Method Article
Generación de clones de células T reguladoras humanas
En este artículo
Resumen
Este protocolo describe la clonación y expansión de células T reguladoras humanas para la generación de Treg humanas viables de ultra alta pureza con desmetilación estable en la región desmetilada específica de Treg (TSDR) y características fenotípicas específicas de Treg.
Resumen
Las células T reguladoras humanas (Treg) son notoriamente difíciles de aislar en alta pureza dados los métodos actuales de enriquecimiento de Treg. Estos métodos se basan en la identificación de Treg a través de varios marcadores de superficie celular dependientes de la activación con diferentes niveles de expresión en diferentes condiciones fisiológicas y patológicas. Por lo tanto, las poblaciones aisladas como "Treg" a menudo contienen un número considerable de células efectoras no Treg (es decir, Teff) que dificultan la caracterización fenotípica y funcional precisa de estas células, su caracterización genómica y proteómica, su enumeración confiable en diferentes estados de salud y enfermedad, así como su aislamiento y expansión con fines terapéuticos. Esto último, en particular, sigue siendo un obstáculo importante, ya que la expansión inadvertida de las células efectoras que se encuentran en compartimentos celulares relevantes para Treg (por ejemplo, células T CD4 + CD25 + ) puede hacer que la inmunoterapia basada en Treg sea ineficaz o incluso perjudicial. Este trabajo presenta un método que evita los problemas asociados con el aislamiento y la expansión de Treg basados en la población y muestra que la generación de clones candidatos a Treg con la posterior selección, cultivo y expansión de solo células monoclonales cuidadosamente examinadas, permite la generación de un producto de células Treg ultrapuras que se puede mantener en cultivo durante muchos meses. permitiendo la investigación posterior de estas células, incluso para posibles aplicaciones terapéuticas.
Introducción
El propósito de este protocolo es permitir la propagación in vitro de Treg humano clonal de ultra alta pureza. El aislamiento de las poblaciones enriquecidas con Treg y la posterior clonación permiten la selección de los fenotipos deseados de Treg y su expansión para un estudio más detallado de la biología de estas células, la exploración de su posible utilidad terapéutica y otras aplicaciones experimentales posteriores.
La clonación de Treg producirá una pureza de Treg significativamente mejor que los enfoques de aislamiento y expansión policlonal. Esto se debe a la exclusión fiable y controlada de células T efectoras con fenotipos similares o diferentes de la población purificada, incluidas las que expresan FOXP3 (FOXP3int, CD45RA,neg, CD25int), no Treg y CD4+, CD25+, FOXP3-Teff1, entre otras. Las líneas celulares clonales obtenidas mediante este enfoque no se enfrentan al problema del crecimiento excesivo con clones no Treg de rápida expansión que hacen que la expansión a muy largo plazo (es decir, varios meses) y el cultivo in vitro de las células sean prácticamente imposibles o al menos extremadamente desafiantes. Las Treg clonales también permiten una investigación exhaustiva de sus características fenotípicas después de la expansión, incluso a través de métodos reconocidos como estándar para la evaluación de las características epigenéticas indicativas deTreg 1,2,3,4 naturales humanas de buena fe (por ejemplo, desmetilación estable en el TSDR).
La expansión de Treg se ha realizado principalmente en forma de expansión de células policlonales tanto con fines investigativos como terapéuticos 5,6,7. Los problemas con la contaminación por Teff son un obstáculo importante para la implementación exitosa de los enfoques de inmunoterapia basados en células Treg. Los intentos previos de expandir/generar Treg monoclonales en la literatura son escasos y no han demostrado el mantenimiento de las características de Treg a largo plazo8.
Este método será de interés para cualquier persona que estudie las propiedades celulares, moleculares y metabólicas de las Treg humanas genuinas . El producto Treg ultrapuro generado mediante el uso de este protocolo en particular se presta a análisis mediante enfoques genómicos. Dadas las tasas de expansión relativamente bajas que caracterizan a las Treg humanas en general, este método puede ser de uso limitado para aquellos que buscan la expansión rápida de un número masivo de células. Sin embargo, dada la pureza extremadamente alta de las Treg generadas con este protocolo, un número menor de Treg puede tener una eficacia similar o incluso mejor que las expansiones más grandes de líneas celulares policlonales que contienen células efectoras que limitan el potencial supresor general del producto generado.
Protocolo
Este protocolo sigue todas las directrices institucionales relativas a la conducta ética de la investigación que implica el uso de muestras humanas. El trabajo con células humanas y otros productos sanguíneos humanos debe realizarse al menos en un entorno con certificación BSL-2 siguiendo las pautas de seguridad BLS-2 como mínimo.
1. Preenriquecimiento de células mononucleares de sangre periférica humana para células CD4 + CD127loCD25hi
PRECAUCIÓN: Utilice una técnica estéril en todo momento. Deseche los objetos punzocortantes inmediatamente en un recipiente adecuado para objetos punzocortantes. Blanquee cualquier cosa que haya entrado en contacto con sangre y/o productos sanguíneos antes de desecharlos. Trabaja en un gabinete de bioseguridad.
- Obtener sangre periférica humana o productos sanguíneos preenriquecidos para leucocitos humanos (es decir, "leucópakos") a partir de extracciones de sangre periférica o leucoféresis. Procese las celdas inmediatamente.
NOTA: Si no se puede evitar el almacenamiento durante la noche, almacene y transporte las celdas a temperatura ambiente (RT). Evite la exposición al frío. - Aislar células mononucleares de sangre periférica (PBMC) mediante centrifugación en gradiente sobre medio de gradiente de densidad como se describió anteriormente9.
- Cuente cuidadosamente las PBMC usando un hemocitómetro o un contador de células. Si es posible, use al menos 300 x 106 PBMC para continuar con el aislamiento de Treg.
- Vuelva a suspender las PBMC en tampón de aislamiento (suero AB humano combinado al 2% [PHS-AB] con EDTA 1,5 mM en solución salina tamponada con fosfato [PBS]) a una concentración de 50 x 106 células/ml y proceda con la clasificación magnética de acuerdo con las instrucciones del fabricante del kit de clasificación utilizado. Por ejemplo, utilice la clasificación por células magnéticas (Tabla de materiales) para el aislamiento negativo de una población de células T CD4+CD127lo , seguida de una clasificación por selección positiva para las células CD25+ .
NOTA: Se puede utilizar una variedad de productos para la purificación magnética de Treg, incluidos los enfoques basados en columnas y sin columnas. Alternativamente, se puede realizar la clasificación de células activadas por fluorescencia (FACS) con compuerta en células T CD4+ CD4+ altas en CD127oCD25. Sin embargo, la esterilidad completa no es posible con el equipo FACS estándar, lo que representa un riesgo significativo de contaminación. Además, no se puede excluir el estrés celular y el daño conferido por el sistema de fluidos, y los láseres de los instrumentos pueden afectar los resultados. - Verifique la pureza de la población enriquecida con Treg resultante mediante tinción para CD4, CD3, CD127 y CD25 (Figura 1). Elija un anticuerpo anti-CD25 humano que reconozca un dominio de unión a CD25 diferente al utilizado en el kit de clasificación, como el especificado en la Tabla de Materiales, para obtener un resultado preciso. Teñir y fijar las células utilizando un protocolo estándar de tinción de superficies, como el descrito en Nowatzky et al.10.
2. Clonación de Treg a partir de una suspensión de células T CD4+ humanas CD4+ altamente enriquecidas con CD127loCD25
- Vuelva a suspender las células enriquecidas con Treg (CD4+CD127loCD25hi) obtenidas en el paso 1.4 en medios de células T ([TCM]; RPMI 1640, 5% PHS-AB, 1% estreptomicina/penicilina, 1% HEPES, 1% aminoácidos no esenciales y 1% glutamina) con 300 UI/mL de interleucina-2 recombinante humana (IL-2) (Tabla de Materiales) con el objetivo de una concentración de ~1−3 x 106 células/mL y recuento. Obtenga al menos tres recuentos de celdas separados y calcule el número promedio de celdas antes de continuar, ya que los recuentos precisos son absolutamente cruciales.
- Prepare una suspensión de células de una sola célula a dos concentraciones: (1) 3 células/mL y (2) 6 células/mL. Cargue cinco placas de 96 pocillos de fondo redondo con 100 μL/pocillo de suspensión 1 y cinco placas con suspensión 2. Tenga mucho cuidado de mantener las células en suspensión al cargar las placas para garantizar una distribución de 0,3 y 0,6 células/pocillo, respectivamente.
NOTA: No aumente la concentración celular a 1 célula/pocillo, ya que esto aumenta el riesgo de obtener líneas celulares oligoclonales y no clones verdaderos. - Prepare las células alimentadoras a partir de PBMC alogénicas humanas recién aisladas obtenidas mediante centrifugación en gradiente de densidad, como se indica en el paso 1.2.
- Prepare al menos 10 x 106 células alimentadoras por placa de clonación para la irradiación resuspendiendo PBMC alogénicas humanas en MTC sin IL-2 en un tubo de polipropileno de 50 mL a una concentración de ~10 x 106 PBMC/mL. Cierre herméticamente el tubo e irradie con 35 Gy en un irradiador gamma o en un dispositivo de irradiación basado en rayos X.
NOTA: La irradiación desencadena la secreción de grandes cantidades de citocinas de los alimentadores que facilitan la proliferación de Teff, pero pueden afectar negativamente la expansión de Treg. A continuación, se eliminarán mediante lavado. - Centrifugar las células a 450 x g y RT durante 5 min después de la irradiación y aspirar el sobrenadante. Lave las células resuspendiéndolas en TCM sin IL-2 utilizando al menos 10 veces el volumen de la célula alimentadora peletizada de medios/PBS.
NOTA: Se recomienda determinar un perfil de expresión del antígeno leucocitario humano (HLA) de las células donantes a clonar. Esto se puede hacer a través de una tinción simple para uno o varios tipos de HLA que son comunes en la población de la que se deriva un donante respectivo (es decir, HLA-A2 o HLA-A24). Las PBMC utilizadas como células alimentadoras no deben expresar este HLA para permitir la reidentificación/aislamiento de las células diana de los cultivos en expansión antes de la apoptosis inducida por irradiación de los alimentadores. - Vuelva a suspender las células alimentadoras irradiadas y lavadas en TCM con 300 UI/mL de IL-2 a una concentración de 1 x 106 células/mL.
- Añada fitohemaglutinina-L (PHA-L) (tabla de materiales) a una concentración de 4 μg/mL (2 veces la concentración requerida en cultivo) y proceda rápidamente al paso 2.8.
- Agregue 100,000 celdas alimentadoras irradiadas en 100 μL de MTC con 4 μg/mL de PHA-L y 300 UI/mL de IL-2 a las celdas enriquecidas con Treg en placas, lo que da como resultado un volumen total de 200 μL y una concentración de PHA-L de 2 μg/mL en cada pocillo. Mezcle bien pipeteando hacia arriba y hacia abajo 5 veces. Limite el tiempo de exposición de las celdas alimentadoras a PHA-L antes de su adición al Treg al mínimo absoluto necesario, y manténgalas en suspensión hasta que estén placadas.
NOTA: Asegure una concentración de PHA-L de 2 μg/mL en el cultivo en el paso inicial de siembra, pero utilice una concentración más baja de 1 μg/mL en la expansión posterior de los clones de Treg. Use 300 UI/mL de IL-2 en todo momento. - Incubar a 37 °C. Cambie el 50% de los medios usando TCM con 300 UI/mL de IL-2 pero sin PHA-L en los días 5-7.
3. Expansión de Treg y mantenimiento de clones en cultivo
- A partir del día 12, verifique los cultivos para detectar la presencia de gránulos de células en proliferación.
NOTA: Habrá gránulos formados por células alimentadoras, pero en el examen microscópico aparecerán como células pequeñas, redondas, moribundas o muertas, mientras que las células T en proliferación serán de mayor tamaño, con contraste brillante y apariencia saludable, a menudo formando grupos de células adyacentes que parecen marrones en el examen macroscópico. - Continúe examinando los cultivos cada 1 o 2 días. Aislar clones tentativos en proliferación transfiriéndolos a pocillos individuales. Coloque cada clon tentativo en una sola placa de 96 pocillos para evitar la contaminación cruzada de cualquier clon tentativo o establecido a través de la transferencia inadvertida de células desde otros pocillos.
- Mantenga las celdas a través del 50% de los cambios de medio cada 2-3 días y divídalas según sea necesario. Monitoree las células de cerca.
NOTA: Retrasar los cambios de medios y la división puede dañar las células y la "división excesiva" puede detener su proliferación y provocar la muerte de la célula. - Reestimule las células con alimentadores alogénicos irradiados como se describe en los pasos 2.3-2.9, pero use concentraciones más bajas de PHA-L (es decir, 1 μg/mL en TCM con 300 UI/mL IL-2). Reestimule cuando el tamaño de las células disminuye y las células se vuelven redondas en lugar de ovaladas alargadas, que suele ser después de 2-3 semanas.
NOTA: Mantenga el cultivo de clonación original durante al menos 6 a 8 semanas. Muchos de los clones "tempranos" que se hacen visibles a las 2 semanas o poco después tienden a no ser verdaderas células Treg, sino células no Treg/Teff que proliferan rápidamente y tienen más probabilidades de fallar en la investigación que las células "tardías", algunas de las cuales tardarán más de 1 mes en aparecer visiblemente en cultivo.
4. Verificación de clones tentativos de Treg
- Comience la investigación de los clones tentativos una vez que hayan proliferado a ~ 1 x 106 células para la monoclonalidad y el estado de metilación de TSDR.
- Opcionalmente, se preseleccionan las expansiones celulares mediante tinción para CD3, CD4, CD127 y CD25 con el fin de identificar las de interés (es decir, CD3 + CD4 + CD127aCD25hi) para una evaluación posterior (Figura 2).
- Establecer la monoclonalidad a través de la identificación de la presencia de una sola cadena Vβ en el producto celular mediante tinción de Vβ utilizando conjuntos de anticuerpos de tinción disponibles comercialmente (Tabla de materiales; Figura 3) siguiendo las instrucciones del fabricante. Asegúrese de adquirir al menos 1 x 106 eventos al ejecutar muestras en un citómetro de flujo para un análisis confiable, de modo que se puedan detectar poblaciones contaminantes menores. Usa un tinte de viabilidad.
- Tener el estado de metilación de TSDR en el locus FOXP3 evaluado por proveedores comerciales o internos11,12. Obtenga al menos 1 x 105 celdas para obtener resultados adecuados.
- Una vez que se hayan confirmado la identidad y la clonalidad de Treg en los pasos 4.3 y 4.4, criopreservar las células o utilizarlas para aplicaciones posteriores.
NOTA: Enfoques de investigación alternativos, pero mucho menos fiables, son la determinación del fenotipo Treg mediante tinciones FACS 1,10 y ensayos de supresión in vitro o in vivo13,14. Evite la dependencia excesiva de los ensayos de supresión de Treg13. Los ensayos se basan típicamente, pero no exclusivamente, en el cocultivo de Treg en números graduados con células T respondedoras (es decir, PBMC o células T purificadas, a veces con depleción de Treg) en presencia de células presentadoras de antígenos de terceros o CD3/CD28 con dilución de colorante que representa la proliferación como lectura. Muchos de estos ensayos tienen severas limitaciones y pueden sobrestimar o subestimar el grado real de supresión mediado por Treg. El estado de metilación de TSDR sigue siendo la medida más definida/fiable del fenotipo o "identidad" de Treg3,15,16. Tenga en cuenta que FOXP3 se encuentra en el cromosoma X y, en las mujeres, un cromosoma X es inactivado por la metilación del ADN, lo que afecta los resultados del análisis de metilación TSDR.
5. Criopreservación de Treg
NOTA: Treg se puede almacenar a largo plazo después de una criopreservación exitosa con DMSO y PHS-AB.
- Determinar el número de crioviales necesarios para criopreservar las células. Esto es igual al volumen final total de la suspensión celular (en mL) que se va a criopreservar, porque se congela 1 mL por vial. Agregue un margen de seguridad del 10% a este volumen para tener en cuenta las pérdidas debidas al pipeteo/tensión superficial.
NOTA: Las células se pueden criopreservar en una amplia gama de concentraciones, normalmente entre 0,1 y 100 x 106 células/mL. - Etiquete los crioviales.
- Generar solución A (SA): mezclar 50% RPMI y 50% PHS-AB o plasma humano. Si se utiliza plasma, centrifugar a 2.000 x g durante 20 min a 4 °C.
NOTA: El volumen de SA debe ser el 75% del volumen final total de la suspensión celular que se va a criopreservar, según lo determinado en el paso 5.1. - Generar solución B (SB): mezclar 60% (v/v) de PBS o RPMI y 40% (v/v) de dimetilsulfóxido (DMSO).
NOTA: El volumen de SB debe ser el 25% del volumen final total de la suspensión celular a criopreservar, según lo determinado en el paso 5.1. - Enfríe ambas soluciones a 4 °C.
- Prepare el medio de congelación mezclando todo SB con partes iguales de SA y manténgalo en hielo.
- Gira Treg desde el paso 4.5 a 450 x g durante 5 min a 4 °C. Aspire y deseche los medios, y vuelva a suspender las células en el SA helado restante y manténgalo en hielo.
- Agregue lentamente el medio de congelación enfriado 1:1 a las células resuspendidas en SA en un tubo grande sobre hielo mientras agita el tubo.
- Alícuota rápida en crioviales a 1 mL/vial. Coloque inmediatamente los crioviales en una caja de armario en RT y transfiéralos a un congelador de -80 °C sin demora. Trasvasar a líquido N2 después de 24 h.
Resultados
La implementación exitosa de este protocolo conducirá a la generación de clones y líneas de células T reguladoras humanas estables.
La preselección/preenriquecimiento de las células CD4+CD127loCD25hi fue un método sencillo para obtener una población inicial que contuviera la mayor parte de las células Treg humanas (Figura 1A-C). No todos los clones mostraron un fenotipo Treg. La preselección de clones mediante la medición de la expresión de CD25hiCD127lo fue un enfoque razonable para identificar clones de interés, y aumentó la eficiencia de la generación de clones objetivo a través de su preselección (Figura 2A, B). La evaluación de la clonalidad pudo lograrse fácilmente mediante la tinción para TCR Vβ, y requirió la demostración de una sola cadena Vβ en el producto celular (Figura 3A, B). Sin embargo, la caracterización de clones mediante citometría de flujo puede llevar a una interpretación errónea de los resultados, debido a la separación imperfecta de las células Teff y Treg, en particular, como se muestra para las tinciones FOXP3, CD25 y CD127 (Figura 4A). El uso combinado de CD45RA y FOXP3/CD25 puede proporcionar mejores pistas, pero la diferenciación de importancia crítica entre FOXP3 intermedio y alto, y/o CD25 en el subconjunto negativo de CD45RA (las célulasnegativas FOXP3int CD45RA no se suprimen) puede ser un desafío, porque los controles de compuerta fluorescentes menos uno (FMO) son de ayuda limitada en este escenario, los controles biológicos (idealmente clones de Treg como en este ejemplo) pueden no estar disponibles inicialmente. y las tinciones de las células PBMC/T nativas "control" pueden ser difíciles de optimizar y/o interpretar10. Si bien las tinciones combinadas de FOXP3 y HELIOS generalmente dieron los resultados más confiables, el uso de HELIOS como marcador Treg sigue siendo algo controvertido, a diferencia del estado de metilación en el TSDR, que es ampliamente aceptado. La Figura 4 muestra una comparación de un clon de Teff y un clon de Treg por citometría de flujo (Figura 4A) y por secuenciación de ARN de una sola célula (Figura 4B) con análisis VD(J), demostrando perfiles fenotípicos y de expresión génica no superpuestos. La diversidad de su repertorio de TCR fue de 1 en ambos productos celulares (es decir, solo una cadena Vβ se expresa a través de una recombinación VD (J) única), lo que proporciona evidencia de monoclonalidad. En la Figura 5, la cinética de un ciclo de proliferación de clones de células Treg se evaluó mediante tinción con Ki67 a lo largo del tiempo, lo que demuestra la lenta proliferación de la mayoría de los clones de Treg genuinos.

Figura 1: Enriquecimiento previo de una población de células que contienen Treg. (A) Células humanas CD3 + CD4 + CD127lo CD25 dentro de PBMC compuertas en linfocitos CD3 + CD4+ solteros vivos. Esta población contenía la mayoría de las células T reguladoras humanas y sirvió como población inicial para el enriquecimiento. (B) Enriquecimiento para células T CD127-CD4+ mediante selección de negativos mediante clasificación magnética. (C) Un mayor enriquecimiento de las célulasCD25 hi (rojo, histograma) de la población CD127-CD4+ (azul, histograma) podría lograrse mediante clasificación magnética (como se muestra aquí) o FACS. El verde representa la expresión de CD25 en la población PBMC antes del enriquecimiento. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cribado de expansiones celulares para Treg de buena fe . La evaluación por citometría de flujo de los niveles de expresión de CD127 y CD25 fue un enfoque sencillo para el cribado inicial, pero requirió la confirmación del estado de metilación en el TSDR dado el alto número de muestras "falsas" (es decir, metiladas). (A) Expansiones celulares obtenidas 14 días después de la clonación: solo 1 (6%) de las expansiones celulares mostraron desmetilación en el TSDR consistente con Treg bona fide . (B) Expansiones celulares detectadas después de 30 días: 2 (33%) de las 6 expansiones fueron consistentes con el estado de Treg por metilaciones. Activado en celdas vivas. Las células son CD4 + CD3 + CD8-. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Verificación de la clonalidad. Se debe verificar la monoclonalidad de las expansiones celulares. (A) Los clones se tiñeron con resultado positivo para una tinción de Vβ; en el caso indicado, Vβ17. (B) Muestra el conjunto completo de datos para 24 especificidades humanas de Vβ. C) Principio del ensayo. Las células se tiñeron con anticuerpos conjugados simples o dobles FITC/PE, cada uno específico para una cadena Vβ del receptor de células T humanas. Cada cuadrante por encima del umbral mostraba tinción para una sola cadena Vβ, pero no para otras. Haga clic aquí para ver una versión más grande de esta figura.
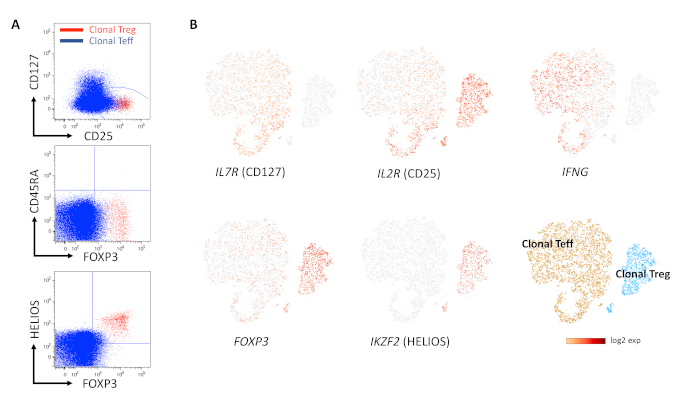
Figura 4: Evaluación fenotípica de clones de Treg después de la expansión a largo plazo. (A) El análisis citométrico de flujo de los clones Treg (rojo) y Teff (azul) en gráficos superpuestos demuestra que la diferenciación entre Treg y Teff puede ser difícil dados los bajos niveles de expresión de FOXP3 y CD25 en Teff humano. (B) La secuenciación de ARN de una sola célula con análisis V(D)J de los mismos productos celulares que en el panel A demuestra la alta expresión diferencial de HELIOS, FOXP3 y CD25 en el clonal Treg frente al Teff clonal, y la ausencia de expresión de IFNg y CD127 después de 51 semanas en cultivo. La diversidad de TCR en cada muestra es 1 (es decir, las expansiones son monoclonales). Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Proliferación de Treg en cultura. Un ciclo de expansión típico en el cultivo estimulado por alimentador dura aproximadamente 2 semanas y luego requiere una reestimulación. Se muestra un gráfico de superposición de la expresión de Ki67 de un clon de Treg, a los 7 (rojo), 11 (azul) y 14 (verde) días. Las células alimentadoras moribundas se excluyeron mediante tinción de viabilidad y activación en HLA-A24 que fue expresada por el Treg, pero no por el donante de células alimentadoras. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe la propagación de células T reguladoras humanas ultrapuras a través del aislamiento, la expansión y la investigación cuidadosa de las células obtenidas en un enfoque de dilución limitante y expansión basado en células alimentadoras a partir de poblaciones iniciales que contienen Treg.
Los pasos críticos en este enfoque son: 1) la elección de una población inicial apropiada. En general, el compartimento CD127loCD25hi de los linfocitos T CD4+ dentro de la PBMC humana contiene una amplia variedad de Treg que se adapta a este propósito10,17. 2) Los recuentos precisos de células son obligatorios para una clonación exitosa, dado el riesgo de sembrar demasiadas células, que posteriormente pueden generar líneas de células oligoclonales, o de sembrar demasiado pocas, lo que reduce la eficiencia de la clonación. Este protocolo utiliza un hemocitómetro estándar para el recuento. Los contadores de celdas automatizados, si los ajustes se optimizan correctamente y se examinan los recuentos, se pueden usar alternativamente. 3) Observación y mantenimiento a largo plazo de placas con células primarias sembradas. Las Treg proliferan lentamente, lo que significa que los clones pueden volverse macroscópicamente visibles en forma de gránulos de células solo después de varias semanas en cultivo. Es importante tener en cuenta que este marco de tiempo difiere significativamente del típico para enfoques de clonación similares aplicados en la generación de Teff de rápida proliferación, como las células T CD8+ citotóxicas u otras. 4) Evaluación crítica de los clones que proliferan lentamente. La lenta tasa de proliferación de Treg a menudo crea problemas que no suelen afrontarse en los enfoques de clonación de células alimentadoras irradiadas, en los que las células alimentadoras suelen morir varios días después de la irradiación en cocultivo con clones o líneas celulares que proliferan rápidamente. Dadas las bajas tasas de expansión de Treg, las células alimentadoras a menudo conservan cierta viabilidad en cultivo durante más de 1 a 2 semanas, a pesar de la irradiación. Esto puede afectar la interpretación de los resultados del análisis del producto celular resultante y engañar al investigador. Por lo tanto, se recomienda clasificar las células alimentadoras que puedan haber conservado cierta viabilidad debido a la expresión de HLA, que debe ser diferente de la de la Treg expandida. Todos los alimentadores mueren en última instancia si se irradian adecuadamente. 5) Hasta la fecha, la investigación de los clones por pirosecuenciación es el método más fiable para establecer la presencia de Treg auténtica en el cultivo. Los ensayos de supresión de Treg y el fenotipado tienen graves limitaciones que no siempre permiten una evaluación fiable. La pirosecuenciación puede subcontratarse a proveedores comerciales o realizarse internamente. Para limitar el tiempo y los costos dedicados a la investigación de las células, es razonable establecer primero la monoclonalidad, seguida de la detección fenotípica (por ejemplo, la expresión de CD127/CD25) eliminando los clones con fenotiposaltos que no son CD127oCD25 (aunque esto puede excluir algunas Treg auténticas) y luego proceder a la pirosecuenciación con los clones seleccionados.
La tabla 1 proporciona una herramienta para la resolución rápida de problemas.
| Problema | Posible explicación y enfoque |
| No se observan clones después de 2 semanas. | Espere y continúe manteniendo la cultura. Las Treg se expanden lentamente y, por lo general, necesitan más tiempo para formar gránulos de células visibles que las Teff. |
| Los clones obtenidos no muestran un fenotipo Treg en el análisis de citometría de flujo. | 1) Los clones son Teff. Cosecha clones que se hacen visibles más tarde: es más probable que sean Treg, dada la lenta proliferación. |
| 2) El panel de tinción no está lo suficientemente optimizado. Refinar el panel o utilizar un panel de tinción Treg optimizado publicado10. | |
| Verificar clones fenotípicamente prometedores a través de la pirosecuenciación en el TSDR. | |
| Las líneas celulares obtenidas no son clonales. | Asegúrese de que las células se cuenten con precisión cuando se siembran y que no se haya permitido que se sedimenten antes de la siembra. Agregue PHA-L inmediatamente antes de la siembra cuando siembra los alimentadores y las Treg primarias juntos, o coloque primero Treg y luego agregue PHA y alimentadores. El PHA provoca la aglomeración de las células y puede tener un impacto negativo en el mantenimiento de una suspensión de una sola célula cuando se siembran células enriquecidas con Treg. |
| Asegúrese de que las células alimentadoras estén muertas en el momento del análisis o que se hayan clasificado en caso de duda (véanse los comentarios sobre la supervivencia prolongada de los alimentadores irradiados cuando se cultivan conjuntamente con células primarias que se expanden lentamente). | |
| Los clones muestran fenotipos de Treg por citometría de flujo y suprimen los ensayos de supresión in vitro por no se desmetilan en el TSDR. | La desmetilación en el TSDR reemplaza a los ensayos de supresión y el análisis de citometría de flujo da como resultado la determinación de la identidad de Treg. Las células efectoras pueden reducir el número de células de la población de células T respondedoras de una manera dependiente de la dosis a través de efectos citotóxicos y de otro tipo. Los resultados de la citometría de flujo pueden ser difíciles de interpretar para los clones cuando no se pueden obtener controles biológicos precisos dados los niveles variables de expresión de FOXP3 y CD25 en Treg y Teff. |
| Los clones de Treg con una proliferación inicial aceptable dejan de expandirse en los ciclos de expansión/estimulación posteriores. | Intenta completar el experimento: algunos clones de Treg dejarán de expandirse. |
| Intente la expansión con diferentes donantes de células alimentadoras alogénicas: algunos funcionan mejor que otros. | |
| Si las células proliferaron previamente bien con un donante de células alimentadoras específico, puede ser útil expandirse utilizando células del mismo donante nuevamente en ciclos de expansión posteriores si es factible. | |
| Las células alimentadoras viables son detectables por citometría de flujo cuando se analiza la línea celular/clon. | Esto puede ocurrir cuando las Treg proliferan lentamente, ya que hay menos competencia, lo que permite que las células alimentadoras irradiadas sobrevivan más de lo habitual. Clasifique los clones en función de la expresión de HLA que está presente en el Treg, pero ausente en las células alimentadoras. Asegúrate de usar un tinte de viabilidad. Todos los alimentadores debidamente irradiados acabarán muriendo. |
Tabla 1: Solución de problemas.
Las posibles modificaciones de este método incluyen: 1) Método de aislamiento de Treg. El uso de FACS es posible, pero está sujeto a las desventajas mencionadas anteriormente. Sin embargo, permite un mejor control inmediato de las propiedades fenotípicas de la población inicial objetivo y puede ser preferible si una población inicial específica de interés no se obtiene fácilmente mediante clasificación magnética. 2) Elegir un subconjunto específico de Treg como población inicial. Por ejemplo, TIGIT/CD226 frente a CD39+ Treg frente a estándar o CD45RA+FOXP3int frente a CD45RA-FOXP3 hi. Se han propuesto varias características fenotípicas para delimitar los subconjuntos de Treg, especialmente susceptibles a la expansión estable y a una alta actividad supresora18,19. 3) Células criopreservadas vs. células alimentadoras frescas. El uso de células alimentadoras descongeladas (criopreservadas, irradiadas o no irradiadas con irradiación posterior) puede ser posible, pero no se recomienda y no se ha evaluado sistemáticamente para este protocolo. 4) Verificación de la clonalidad por PCR vs. citometría de flujo. La secuenciación ofrece una mejor cobertura que la tinción TCR Vβ y puede ser preferible para la determinación de la monoclonalidad20, pero requiere más esfuerzo y tiempo para establecerse que la tinción Vβ. 5) Ensayos de supresión in vivo, como modelos xenogénicos de EICH en ratones NSG. Estos pueden ser preferibles a los ensayos in vitro, pero requieren mucho tiempo, requieren mucha mano de obra y son costosos14. Pueden ser factibles en entornos donde se mantienen rutinariamente colonias de ratones NSG u otros receptores murinos inmunoincompetentes apropiados de células humanas. 6) Generación de clones de Treg antígenos específicos. Esto puede intentarse mediante la aplicación de un enfoque adecuado para el aislamiento de Treg específicos del antígeno, como las tinciones de tetrámeros/polímeros, el aislamiento de células respondedoras en ensayos de estimulación específicos de antígeno (AG) u otra técnica similar, y la posterior aplicación de este protocolo. Sin embargo, la tinción con tetrámeros puede alterar la viabilidad de las células aisladas y es posible que sea necesario sembrar más células.
Las limitaciones de este protocolo incluyen: 1) La proliferación lenta de Treg limita el rendimiento celular. La lenta proliferación de Treg es la principal limitación para su expansión in vitro a largo plazo. Esto se aplica al protocolo que se presenta aquí. 2) Especificidad antígeno desconocida. El protocolo actual no selecciona Treg en función de la especificidad conocida de AG. Si bien la monoclonalidad del producto resultante implica un alto grado de especificidad para el AG, la especificidad no se conoce a priori. La elección de una población inicial con especificidad conocida de AG puede ser un desafío dada la baja frecuencia de precursores de Treg específicos de AG en sangre periférica humana, pero se puede abordar mediante el enriquecimiento previo de Treg previamente expandido en respuesta a los antígenos deseados, la focalización directa mediante enfoques poliméricos de péptidos MHC u otros métodos. 3) El uso de material humano en el proceso de expansión puede limitar las aplicaciones terapéuticas. El uso de células alimentadoras humanas plantea un desafío para las aplicaciones terapéuticas, pero no lo excluye. Todos los reactivos necesarios para llevar a cabo este protocolo están disponibles en las normas de Buenas Prácticas de Fabricación (GMP) (IL-2 y PHA-L). El uso de células presentadoras de antígenos artificiales (APC) y cócteles de citocinas podría ayudar a aliviar la necesidad de células alimentadoras, pero aún no se ha probado. 4) Las células se expanden a largo plazo, in vitro. Esto significa que no hay garantía de que estas células reflejen adecuadamente las Treg fisiológicas dada su cultivo in vitro a largo plazo.
La principal importancia de este enfoque frente a los métodos existentes/alternativos radica en su capacidad para generar un producto de células Treg ultrapuras que mantiene las especificaciones definitorias de Treg durante períodos de tiempo muy largos en cultivo. El enfoque de clonación permite al investigador controlar las propiedades de las células a las que se les permite avanzar en experimentos de expansión, eliminando así la propagación de las células de tipo Teff. La mayoría de los otros métodos se han basado en la expansión policlonal u oligoclonal de Treg, que a menudo conduce a una función supresora comprometida con el tiempo.
Las aplicaciones futuras y las direcciones del método incluyen: 1) Generación de clones de Treg específicos de AG. Esto puede eludir parcialmente las limitaciones relacionadas con la lenta proliferación de Treg de buena fe y reducir la necesidad de grandes cantidades de Treg en aplicaciones clínicas específicas. 2) Aplicaciones en las que se requiere un número bajo de Treg. Esto incluye el análisis fenotípico y funcional de los clones (por ejemplo, secuenciación de ARN). 3) Enfoques de edición genética posteriores. Este método puede combinarse con la modificación de CRISPR-Cas9, por ejemplo, para permitir la evaluación y manipulación de funciones génicas específicas en Treg humanas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este proyecto contó con el apoyo del Instituto Nacional del Ojo de los Institutos Nacionales de Salud bajo el Premio Número K08EY025324 (Nowatzky) y por un Premio Colton Scholar del Centro Judith y Stewart Colton para la Autoinmunidad (Nowatzky).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µm Stericup, 500 mL | Millipore | 5500 | Media storage and preparation |
| 100x Nonessential amino acids | Gibco | 11140-050 | Media component |
| 15 mL conical centrifuge tubes (50/bag, case of 500) | ThermoFisher Scientific | 339650 | |
| 1M HEPES | Gibco | 15630-080 | Media component |
| 25 ml Single Well Pipet Basin | Fischer Scientific | 13-681-508 | |
| 50 mL Conical Centrifuge Tube (25/sleeve) | ThermoFisher Scientific | 339652 | |
| 50x Penicillin Streptomycin Soln | Corning | Corning, 30-001-Cl | Media component |
| CryoTube Vial Int Thread Round Btm Starfoot PP Screw Stopper Sterile PP 1.8 mL | Nalge Nunc | 377267 | |
| DMSO | Corning | 25-950-CQC | |
| EasySep Human CD25 positive selection kit | Stemcell Technologies | 18231 | Alternatives are FACS or MACS column-based sorting |
| EasySep Human CD4+CD127low T cell Pre-Enrichment Kit | Stemcell Technologies | 19231 | Alternatives are FACS or MACS column-based sorting |
| EasySep Human CD4+CD127lowCD25+ Regulatory T Cell Isolation Kit (alternative to item 12) | Stemcell Technologies | 18063 | Alternatives are FACS or MACS column-based sorting |
| Ficoll | GE Healthcare | 17-5442-03 | PBMC purification from peripheral blood of leukapheresis products; density gradient medium |
| Human AB Serum (PHS-AB) | Valley Biomedical Inc | HP1022 | Media component |
| LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Thermo Fischer | L-34962 | Viability dye |
| Phytohemagglutinin-L (PHA-L) | Millipore/Sigma | 11249738001 | T cell stimulation |
| Recombinant IL-2 (e.g., PROLEUKINâ) | Prometheus | T cell stimulation and maintenance/ Media component | |
| RPMI 1640 | Gibco | 21870-076 | Media component |
| Staining antibodies for flowcytometry (Treg phenotyping) | See "Comments" | See "Comments" | Staining antibodies are enlisted in: Nowatzky et al. (2019) PubMed PMID: 30584695; PubMed Central PMCID: PMC6497402. In case EasySep Human CD25 positive selection kit is used, stain with 2A3 or BC96 anti-CD25 antibody, e.g.: Brilliant Violet 421 anti-human CD25 Antibody (Biolegend; 302629) |
| TCR Vβ Repertoire Kit; IOTest Beta Mark | Beckman Coulter | PN IM3497 | Vetting of expansions for monoclonality |
| Tissue Culture Plate, 96 Well, U-Bottom with Low Evaporation Lid | Corning | 353077 |
Referencias
- Miyara, M., et al. Functional delineation and differentiation dynamics of human CD4+ T cells expressing the FoxP3 transcription factor. Immunity. 30 (6), 899-911 (2009).
- Polansky, J. K., et al. DNA methylation controls Foxp3 gene expression. European Journal of Immunology. 38 (6), 1654-1663 (2008).
- Toker, A., et al. Active demethylation of the Foxp3 locus leads to the generation of stable regulatory T cells within the thymus. The Journal of Immunology. 190 (7), 3180-3188 (2013).
- Garg, G., et al. Blimp1 Prevents Methylation of Foxp3 and Loss of Regulatory T Cell Identity at Sites of Inflammation. Cell Reports. 26 (7), 1854-1868 (2019).
- Brunstein, C. G., et al. Infusion of ex vivo expanded T regulatory cells in adults transplanted with umbilical cord blood: safety profile and detection kinetics. Blood. 117 (3), 1061-1070 (2011).
- Hippen, K. L., et al. Massive ex vivo expansion of human natural regulatory T cells (T(regs)) with minimal loss of in vivo functional activity. Science Translational Medicine. 3 (83), 41(2011).
- Bluestone, J. A., et al. Type 1 diabetes immunotherapy using polyclonal regulatory T cells. Science Translational Medicine. 7 (315), 189(2015).
- Dromey, J. A., et al. Generation and expansion of regulatory human CD4(+) T-cell clones specific for pancreatic islet autoantigens. Journal of Autoimmunity. 36 (1), 47-55 (2011).
- Sabado, R. L., et al. Preparation of tumor antigen-loaded mature dendritic cells for immunotherapy. Journal of Visual Experiments. (78), e50085(2013).
- Nowatzky, J., Stagnar, C., Manches, O. OMIP-053: Identification, Classification, and Isolation of Major FoxP3 Expressing Human CD4(+) Treg Subsets. Cytometry A. 95 (3), 264-267 (2019).
- Zhang, Y., et al. Genome-wide DNA methylation analysis identifies hypomethylated genes regulated by FOXP3 in human regulatory T cells. Blood. 122 (16), 2823-2836 (2013).
- Spreafico, R., et al. A sensitive protocol for FOXP3 epigenetic analysis in scarce human samples. European Journal of Immunology. 44 (10), 3141-3143 (2014).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods in Molecular Biology. 707, 21-37 (2011).
- Workman, C. J., et al. In vivo Treg suppression assays. Methods in Molecular Biology. 707, 119-156 (2011).
- Feng, Y., et al. Control of the inheritance of regulatory T cell identity by a cis element in the Foxp3 locus. Cell. 158 (4), 749-763 (2014).
- Toker, A., Huehn, J. To be or not to be a Treg cell: lineage decisions controlled by epigenetic mechanisms. Science Signaling. 4 (158), 4(2011).
- Liu, W., et al. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. Journal of Experimental Medicine. 203 (7), 1701-1711 (2006).
- Fuhrman, C. A., et al. Divergent Phenotypes of Human Regulatory T Cells Expressing the Receptors TIGIT and CD226. The Journal of Immunology. 195 (1), 145-155 (2015).
- Gu, J., et al. Human CD39(hi) regulatory T cells present stronger stability and function under inflammatory conditions. Cellular & Molecular Immunology. 14 (6), 521-528 (2017).
- Genevee, C., et al. An experimentally validated panel of subfamily-specific oligonucleotide primers (V alpha 1-w29/V beta 1-w24) for the study of human T cell receptor variable V gene segment usage by polymerase chain reaction. European Journal of Immunology. 22 (5), 1261-1269 (1992).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados