Method Article
Оценка социального доминирования в мышиных моделях с помощью пробирочного теста
В этой статье
Резюме
Этот протокол описывает поведенческий анализ для оценки социального доминирования у грызунов с помощью трубочного теста. Социальное доминирование остается стабильным с течением времени, и несколько моделей расстройств развития и неврологических расстройств демонстрируют устойчивые аномалии социального доминирования. Таким образом, пробирочный тест служит удобным критерием исхода для механистических исследований или доклинического терапевтического скрининга.
Аннотация
Социальное доминирование изменяется при нейроразвитии и нейродегенеративных заболеваниях и служит полезным критерием исхода в доклинических исследованиях этих расстройств. Трубочный тест — это простой поведенческий анализ для оценки социального доминирования, не требующий дорогостоящего оборудования. В этом тесте две мыши входят в противоположные концы прозрачной пластиковой трубки, и после встречи в середине одна из них (менее доминирующая) должна отступить. Тест в пробирке может использоваться как для самцов, так и для самок мышей и включает в себя несколько параметров, адаптируемых в соответствии с потребностями исследователя. Мышей можно протестировать против нескольких уникальных противников, чтобы получить индекс социального доминирования. Социальное доминирование в пробирке остается стабильным при повторном тестировании и коррелирует с результатами других социальных тестов. Кроме того, тест может быть проведен между соседями по клетке для оценки иерархии социального доминирования в клетке. Пробирочный тест особенно полезен в доклинических терапевтических исследованиях, так как он позволяет проводить продольные испытания до и после экспериментальных вмешательств. Таким образом, он служит удобным критерием исхода для механистических исследований и доклинического терапевтического скрининга.
Введение
Нарушение социального поведения является характерной чертой многих расстройств человека, включая расстройства развития, психические и нейродегенеративные расстройства 1,2. Мышиные модели используются для получения представления о патогенезе этих расстройств и для обеспечения платформы для доклинических испытаний терапевтических средств. Тем не менее, многие тесты на социальное поведение мышей требуют много времени для выполнения, требуют дорогостоящего оборудования и/или программного обеспечения для видеослежения для анализа или имеют субъективные алгоритмы оценки. В отличие от этого, тест на социальное доминирование выполняется быстро и просто и не требует специального оборудования или видеослежения. Анализ имеет бинарный результат «выиграл/проиграл», что упрощает интерпретацию результатов.
Тест на социальное доминирование был разработан Линдзи и его коллегами в попытке оценить социальное доминирование у мышей3. С момента своего развития трубочный тест также был признан способом оценкииерархии социального доминирования в клетке. Фенотипы теста с помощью пробирки коррелируют с другими показателями социального доминирования, такими как парикмахерское искусство, соревнование за вознаграждение и выделение мочи у самцов мышей5. Тем не менее, существуют неоднозначные результаты пробирочного теста и его корреляция с конкуренцией за доступ к пище и воде и агрессией 3,6,7. Важно отметить, что фенотипы пробирочных тестов коррелируют с другими социальными фенотипами, такими как трехкамерная общительность 8,9.
Преимущество теста с пробиркой заключается в том, что его анатомия хорошо определена, что делает его особенно полезным для различных моделей мышей, включая модели расстройств аутистического спектра и других заболеваний, характеризующихся социальным дефицитом, таких как лобно-височная деменция 8,9,10,11,12,13,14,15,16 . Медиальная префронтальная кора (mPFC) является ключевым медиатором тестового поведения мышиной трубки6. Ван и его коллегипоказали, что активность в mPFC управляет социальным доминированием у мышей, а более поздние данные уточнили это понимание, показав, что медиадорсальный таламический вход в прелимбическую и переднюю поясную кору управляет социальным доминированием. В соответствии с ключевой ролью mPFC в социальном доминировании в пробирочном тесте, аномалиях в дендритных стволах, дендритных шипах, глутаматных рецепторах и/или возбудимости нейронов, mPFC был связан с аномалиями пробирочного теста в моделях у грызунов с расстройствами аутистического спектра15,18, лобно-височной деменцией 8,19, хроническим стрессом20 и социальной изоляцией21.
Еще одним ключевым преимуществом пробирочного теста является возможность проверки социального доминирования как до, так и после терапевтического вмешательства, поскольку социальное доминирование мышей в пробирочном тесте стабильно с течением времени, что позволяет проводить повторное тестирование как до, так и после экспериментального вмешательства 6,8,22,23. Одним из примеров этого являются мышиные модели гетерозиготной (Grn+/-) лобно-височной деменции, вызванной мутациями програнулина (GRN), гаплонедостаточной болезнью. У гетерозиготных мышей с програнулином наблюдается дефицит социального доминирования8. Этот дефицит пробирочного теста может быть обращен вспять путем восстановления програнулина с помощью генной терапии AAV-програнулина22 или введения антисортилиновых антител, предназначенных для снижения деградации програнулина23. Эти примеры демонстрируют полезность пробирочного теста при планировании доклинических испытаний для исследований, связанных с деменцией.
Этот протокол предоставляет основные методы проведения пробирочного теста между не-кагематами для оценки различий между экспериментальными группами и между кагематами для оценки иерархий социального доминирования внутри клетки.
протокол
Все экспериментальные процедуры были одобрены Комитетом по институциональному уходу за животными и их использованию Университета Алабамы в Бирмингеме и выполнены в соответствии с Ассоциацией по оценке и аккредитации ухода за лабораторными животными (AAALAC). Гетерозиготных мышей с програнулином генерировали и скрещивали их на фоне C57BL/6J, как описано ранее9. Мыши, использованные для этого исследования, были скрещены на фоне C57BL/6J в течение как минимум 12 поколений. В выборке использовались мыши в возрасте 9–16 месяцев. В этом исследовании использовались как мужчины, так и женщины. Мышей держали в цикле свет/темнота в 12:12 ч с включенным светом в 06:00 ч, и все тестирование проводилось во время световой фазы. Мышам предоставлялся свободный доступ к пище и воде на протяжении всех экспериментов. Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Конструкция сопоставления трубок
- Спланируйте совпадения по трубке перед тестированием. Убедитесь, что нет примечания к генотипу, чтобы экспериментатор не замечал групп (см. дополнительную таблицу 1).
Примечание: Обычно мы тестируем мышей против 3 уникальных противников противоположной экспериментальной группы 8,9,22,23, но некоторые исследования сообщают о тестировании против большего количества противников 10,11,13. - Уравновесьте распределение экспериментальных мышей по левую и правую стороны пробирки, чтобы избежать любых потенциальных искажающих эффектов бокового смещения.
- При тестировании неклеточных соседей сведите к минимуму перемещение клеток, чтобы не подвергать мышей большему стрессу, чем это необходимо. Чтобы свести к минимуму перемещение клетки, максимально перекрывайте матчи между одними и теми же двумя клетками.
- При тестировании соседей по клетке проверяйте каждую мышь из клетки против всех остальных мышей по круговой системе. При повторении теста в течение нескольких дней, сторона пробирки, в которую мышь должна входить (т. е. левая или правая), должна чередоваться изо дня в день.
2. Выбор трубок
ПРИМЕЧАНИЕ: Как правило, испытание трубки проводится с использованием имеющихся в продаже прозрачных пластиковых трубок из ПВХ (см. Таблицу материалов). Важно отметить, что этот протокол оптимизирован для мышей, но может быть применен и к другим моделям грызунов, таким как крысы, полевки и хомяки2.
- Отрежьте трубку из ПВХ до длины 30,5 см. Трубка из ПВХ немного гибкая и часто хранится в рулонах, поэтому перед использованием ее может потребоваться выпрямить. Мягкий нагрев поможет выпрямить изогнутые трубки.
- Внутренний диаметр трубки имеет решающее значение для успеха испытания. Убедитесь, что трубка достаточно большая, чтобы мыши могли по ней двигаться, но не настолько большая, чтобы мыши могли пересекаться друг с другом.
Примечание: Тест не будет работать, если трубка достаточно большая, чтобы мыши могли проходить друг мимо друга, не участвуя в соревновании за социальное доминирование. Ниже приведены приблизительные рекомендации по подходящим размерам трубок у мышей C57BL/6J: (1) внутренний диаметр (ID) 1 дюйм/2,5 см для самцов мышей <6 месяцев, самок мышей <9 месяцев; (2) Внутренний диаметр 1,25 дюйма/3,2 см для самцов мышей в возрасте 6-9 месяцев, самок мышей в возрасте >9 месяцев; и (3) внутренний диаметр 1,5 дюйма/3,5 см для самцов мышей в возрасте >9 месяцев. - По возможности используйте пробирку одинакового размера для всех тестов в группе мышей. Если мыши пересекаются в течение первых нескольких совпадений, запускайте все последующие совпадения со следующей наименьшей трубкой.
3. Место проведения испытаний
- Пробирочный тест проводится на любой плоской, устойчивой поверхности или фильтруемой вытяжке при окружающем освещении.
ПРИМЕЧАНИЕ: Тест обычно проводится в течение дня с 8 утра до 5 вечера. В случаях, когда мыши тестируются в течение нескольких дней, каждая мышь должна быть протестирована в одно и то же время суток для каждого теста (например, с 11 утра до 3 часов дня). Насколько нам известно, эффекты времени суток ранее не изучались. - Проводите тест с пробиркой в тихом месте с минимальными внешними раздражителями. В идеале следователь должен быть единственным человеком в комнате.
4. Привыкание
- Привыкание является важной практикой в поведенческих анализах, которая позволяет мышам ознакомиться с тестовой средой, что может привести к более последовательным инадежным результатам. Для проведения теста в пробирке компьютеризируйте мышей в испытательной комнате перед тестированием. Если тестирование проводится не в помещении для животных, дайте мышам не менее 1 часа привыкнуть к новому помещению перед тестированием.
- (Дополнительный) При желании мышей можно приучить к трубке до начала тестирования. Чтобы привыкнуть к трубке, поместите мышь в трубку без соперника и дайте ей пройти через трубку 2–3 раза, за 2–3 дня до тестирования. Это не стандартная наша практика.
5. Стандартный тест с пробиркой
ПРИМЕЧАНИЕ: (Необязательно) Исследователи, не знакомые с испытанием в пробирке, могут захотеть попрактиковаться в помещении мышей в пробирку с использованием отдельной неэкспериментальной группы мышей. Исследователям часто приходится практиковаться в помещении мышей в пробирку. Опытный исследователь вызовет меньший стресс у мышей, проходящих тест. Более подробная информация о помещении мышей в пробирку приведена в шаге 5.3.
- Поместите все клетки с мышами одного пола для тестирования на тележку. Транспортировка клеток в зону испытаний. Очистите пробирки и зону тестирования 2% хлоргексидином, а затем 70% этанолом. Пробирки легко очищаются с помощью серологической пипетки объемом 50 мл, проталкиваемой через пробирку бумажным полотенцем.
- Поместите две клетки для первого матча на тестовую поверхность. Снимите крышки и поставьте их у каждой клетки.
- Найдите двух мышей, которых нужно проверить. Держите по одной мыши в каждой руке, соответствующей назначенной ей стороне трубки. Найдя первую мышь, аккуратно держите ее за хвост и держите в клетке во время поиска второй.
ПРИМЕЧАНИЕ: Удержание хвоста мыши вблизи центра его длины позволит следователю мягко управлять мышью, не ограничивая ее слишком сильно. Держите мышь так, чтобы все четыре ее лапы оставались на подстилке клетки, чтобы не напрягать мышь без необходимости. - Одновременно удалите обеих мышей из каждой клетки и аккуратно поместите их головой у входа в трубку.
Примечание: Если мыши привыкли или имеют предыдущий опыт испытаний, они обычно входят в пробирку в течение нескольких секунд. Если мыши наивны по отношению к трубке, они могут не решаться войти на первое испытание. При необходимости мышей можно переключить на следующую по величине трубку, чтобы стимулировать вход в трубку. - Держите каждую мышь за хвост, чтобы предотвратить преждевременный контакт мышей. Следите за тем, чтобы мыши не были затянуты в трубку. Однако, как только они начнут входить в трубку, их можно осторожно подтолкнуть, чтобы стимулировать полный вход в трубку.
- Когда обе мыши войдут в трубку, отпустите хвосты и отойдите от трубки (рисунок 1A). Обе мыши должны продвинуться внутрь трубки и встретиться вблизи центра (рисунок 1B).
- Наблюдайте за матчем и записывайте победителя и проигравшего. Мышь считается проигравшей матч, когда две ее лапы выходят из трубки и соприкасаются с испытательной поверхностью (рис. 1C).
ПРИМЕЧАНИЕ: Одна мышь обычно отталкивает другую от трубки, хотя некоторые мыши выполняют невынужденное отступление после контакта с мышью-противником. Изредка обе мыши отступают одновременно, или одна мышь отступает сразу после входа в трубку, не контактируя с мышью-противником. Если произойдет одно из этих событий, поместите обеих мышей обратно в пробирку и снова инициируйте матч. Мыши обычно выполняют более стандартное совпадение со второй попытки. Если ни одна из мышей не отступила в течение 2 минут, прервите матч и запустите его снова в конце сеанса.
- Наблюдайте за матчем и записывайте победителя и проигравшего. Мышь считается проигравшей матч, когда две ее лапы выходят из трубки и соприкасаются с испытательной поверхностью (рис. 1C).
- После окончания матча верните мышей в их домашние клетки. Очистите пробирку и испытательную поверхность 70% этанолом.
- Продолжайте проводить матчи, используя схему, описанную в шаге 1. Каждый раунд начинается сразу после предыдущего. Когда все матчи одного пола будут проведены, верните клетки на стойку/тележку и проверьте мышей противоположного пола, используя ту же процедуру.
- Тщательно очистите тестовую поверхность и пробирки между бегущими самками и самцами мышей. После завершения тестирования очистите пробирки и зону тестирования 2% хлоргексидином.
- Для статистического анализа подсчитайте количество побед для каждой группы и проанализируйте с помощью биномиального теста, чтобы сравнить наблюдаемое распределение с ожидаемым, при этом ожидаемое распределение установлено на уровне 50% побед для каждой группы.
- Рассчитайте процент выигрышей для каждой мыши, разделив количество побед на количество матчей (обычно три матча, если матч не был отменен из-за отсутствующей мыши или других проблем). Сравните процент побед для каждой группы с помощью теста Манна-Уитни.
ПРИМЕЧАНИЕ: При повторении эти совпадения дают сходные результаты при отсутствии дополнительных экспериментальных манипуляций. Например, в предыдущем исследовании было замечено, что 40 из 47 матчей дали один и тот же результат при проведении впоследовательные 8 дней.
- Рассчитайте процент выигрышей для каждой мыши, разделив количество побед на количество матчей (обычно три матча, если матч не был отменен из-за отсутствующей мыши или других проблем). Сравните процент побед для каждой группы с помощью теста Манна-Уитни.
6. Внутриклеточный трубный тест для оценки иерархии социального доминирования
Примечание: Мыши образуют устойчивую иерархию социального доминирования, которая может быть выявлена с помощью кругового тестирования всех мышей в клетке 4,6. Как самцы, так и самки мышей образуют эти иерархии8. Иерархия социального доминирования лучше всего оценивается в клетках, содержащих не менее 5 мышей.
- Планируйте матчи заранее, с уравновешиванием, как описано в шаге 1.
- Проведите тестовые матчи в пробирке, как описано в шаге 5. Проверяйте по одной клетке за раз и проверяйте всех мышей по круговой системе. Очищайте пробирку и место тестирования 70% этанолом между каждой спичкой.
- Проверяйте каждую клетку один раз в день в течение не менее 5 дней, чтобы установить стабильные ранговые порядки каждой мыши.
- Для статистического анализа оцените количество побед на одну мышь. Ранжируйте каждую мышь по количеству побед.
7. Использование пробирочного теста для доклинического терапевтического скрининга
Примечание: Надежность и стабильность фенотипов социального доминирования во многих моделях мышей, а также простота проведения пробирочного теста делают пробирочный тест полезной парадигмой для доклинической проверки терапевтических стратегий. Для этого тест в пробирке может быть проведен с использованием конструкции внутри животного, так как тест может быть проведен последовательно. Также можно сделать конструкцию кроссовера с лекарством, затем контролировать или наоборот. Тест с пробиркой ранее использовался для оценки терапии, повышающей програнулин, у мышей Grn+/− 22,23, что показало, что фенотипы социального доминирования обратимы в этой мышиной модели. Для ясности приведенного ниже обсуждения, мыши будут описываться как «контрольные» (дикого типа, нетрансгенные и т.д.) или «модельные» (нокаутные, трансгенные и т.д.), а экспериментальные вмешательства будут описываться либо как «носители», либо как «лечащиеся» (терапевтические вмешательства). В то время как мыши упоминаются как «контрольные» и «модельные» ниже, идеально использовать однопометников для каждой из этих групп.
- Перед экспериментальным вмешательством проведите предварительный тест, чтобы подтвердить наличие ожидаемого фенотипа социального доминирования у модельных мышей, которые будут использоваться для тестирования. Протестируйте весь пул контрольных и модельных мышей друг с другом и используйте эти данные для распределения мышей по группам лечения, чтобы убедиться, что группы сбалансированы на исходном уровне.
- В зависимости от терапевтического метода может потребоваться различная продолжительность лечения. Например, если препарат представляет собой AAV, дайте мышам восстановиться после операции и дать время для того, чтобы лекарство подействовало. Если лекарственный препарат представляет собой малую молекулу, определите парадигмы лечения до проведения пробирочного теста22.
- Распределите мышей по экспериментальным группам таким образом, чтобы носители и обработанные мыши каждого генотипа имели исходные фенотипы социального доминирования одинаковой степени. Если мыши тестируются несколько раз против нескольких противников, процент выигрыша каждой мыши (описанный в шаге 5.9) может быть использован для создания двух групп со схожими фенотипами.
- Для действительно случайного распределения мышей по группам на основе рекомендаций ARRIVE, используйте протокол блочной рандомизации, основанный на проценте выигрыша каждой мыши8.
- После того, как группы распределены, протестируйте мышей в несколько временных точек во время лечения. Для получения подробной информации о типичных сравнениях см. ПРИМЕЧАНИЕ ниже:
ПРИМЕЧАНИЕ: (1) Мыши-управляющие транспортными средствами с. мышей с моделью носителя (это контрольное сравнение, показывающее, что обработка носителя не заслоняет фенотип модели мыши); (2) Мыши-управляющие транспортными средствами против обработанные модельные мыши (это проверяет гипотезу о том, что обработанные модельные мыши отличаются от нормальных контрольных мышей); (3) Мыши-модели транспортных средств в сравнении с обработанные модельные мыши (это проверяет гипотезу о том, что лечение изменяет фенотип мышиной модели); (4) Мыши-управляющие транспортными средствами против Обработанные контрольные мыши (это контрольное сравнение для определения эффектов лечения у мышей без фенотипа социального доминирования). - Как правило, тестирование проводится в течение двух дней, примерно по 6 матчей в день, со сравнениями (1-4), упомянутыми в шаге 7.4. Чтобы избежать чрезмерного тестирования, проведите сравнения (1) и (2) в день 1, а сравнения (3) и (4) — в день 2. Поскольку контрольные мыши автомобиля тестируются против обеих групп моделей в 1-й день, совпадения каждого сравнения должны быть перемешаны.
- После окончания тестирования верните мышей в домашние клетки. Очистите пробирку и испытательную поверхность 70% этанолом.
Результаты
Тест с пробиркой широко использовался на мышиной модели лобно-височной деменции, вызванной мутациями програнулина, Grn+/− мышей 8,9,22,23,25. Эти мыши демонстрируют низкое социальное доминирование к 9-месячному возрасту (рисунок 2A-D)8. Фенотип низкого социального доминирования старых мышей Grn+/− стабилен при повторном тестировании (рис. 2A)8, что делает его надежным показателем экспериментального результата22,25.
Внутриклеточное тестирование также было проведено на мышах Grn+/− для изучения иерархий социального доминирования между кагематами (рис. 3A-D)8. Важно отметить, что как самцы (рис. 3A,B), так и самки (рис. 3C, D) мышей образуют эти иерархии, а мыши Grn+/− также демонстрируют низкое социальное доминирование среди своих кагематов (рис. 3E). Интересно, что у мышей Grn−/− не было этой аномалии (рисунок 3E).
Низкий фенотип социального доминирования, демонстрируемый у пожилых Grn+/− мышей (рис. 2), делает его привлекательным критерием исхода для терапевтических вмешательств, повышающих програнулин. До инъекции AAV мыши Grn+/− демонстрируют низкий фенотип социального доминирования (рисунок 4A). Grn+/− мыши, которым вводили контрольный вирус, по-прежнему демонстрируют фенотип с низким уровнем доминирования (рис. 4B). Grn+/− мыши, которым вводили вирус для повышения уровня програнулина, больше не имели фенотипа низкого социального доминирования (рис. 4C). При сравнении Grn+/− мышей, которым вводили контрольный AAV, с Grn+/− мышами, которым вводили програнулин-бустящий AAV, Grn+/− мыши, которым вводили контрольный AAV, демонстрировали низкое социальное доминирование (рис. 4D).

Рисунок 1: Схема испытания в пробирке. (А) Экспериментаторы выпускают мышей, как только они вошли в пробирку всеми четырьмя лапами. Трубка должна быть достаточно маленькой, чтобы мышь не могла повернуться или перелезть через другую мышь. (В) Затем обе мыши перемещаются к середине трубки, где они встречаются. (C) Более доминирующая мышь останется в трубке, в то время как менее доминирующая мышь отступит обратно. Мышь считается проигравшей, как только две лапы выходят из трубки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Репрезентативные результаты с использованием трубочного теста для определения фенотипа социального доминирования. Это исследование проводилось на мышиной модели лобно-височной деменции Grn+/− мыши. Мыши были протестированы в течение 3 раундов против 3 новых противников, как описано в шаге 1. Показаны различные способы представления данных. (A) Grn+/− мыши в возрасте старше 9 месяцев имеют низкий фенотип социального доминирования, который стабилен при повторном тестировании (* = биномиальный тест, p < 0,05; точки данных представляют собой процент побед каждого генотипа). (B) Агрегированные данные трех раундов тестирования, показывающие общий процент побед по генотипу (*** = биномиальный тест, p = 0,0004). (C) Нанесите на график количество побед каждой мыши во всех 3 матчах. Grn+/− mice имели меньшее количество побед (**** = тест Манна-Уитни, p < 0,0001). Каждая точка — это мышка. (D) График процентного соотношения мышей в каждом генотипе с заданным процентом победы. Grn+/− мыши с большей вероятностью имели низкий процент побед. (**** = критерий Манна-Уитни, p < 0,0001). 9–16-месячные мыши, n = 58 мышей в группе. Данные адаптированы с разрешения Arrant et al.8. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
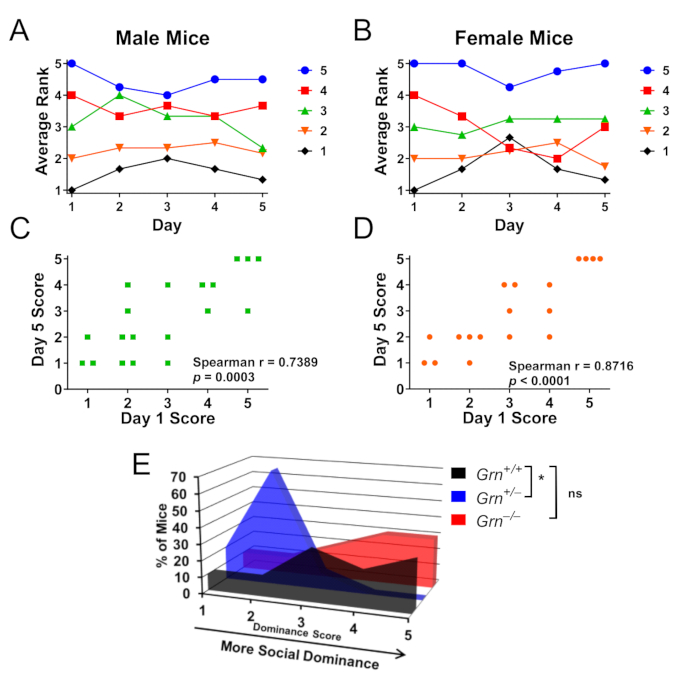
Рисунок 3: Репрезентативные результаты с использованием трубочного теста для определения иерархии социального доминирования в клетке. Клетки самцов или самок мышей (n = 4 клетки на каждый пол по 4–5 мышей в каждой) тестировались по круговой системе в течение 5 дней, чтобы можно было проверить иерархию социального доминирования. (А,Б) Баллы социального доминирования для самцов и самок мышей определялись по количеству побед, где 5 — самая доминирующая мышь, а 1 — наименее доминирующая мышь в каждой клетке. На 5-й день самцы мышей (А) и самки (В) оставались в среднем в пределах одного ранга от своего первоначального балла. Цветовая кодировка указана в рейтинге 1-го дня. (С, Г) Ранг на 5-й день имел очень значимую корреляцию с рангом на 1-й день для обоих полов. (E) Используя эту парадигму внутри клетки для оценки клеток, в которых мыши Grn+/+, Grn+/- и Grn-/− содержались вместе, мыши Grn+/− также продемонстрировали низкое социальное доминирование (критерий Краскела-Уоллиса, p = 0,0063, * = p < 0,05 по апостериорному тесту Данна). Интересно, что у Grn−/− мышей не наблюдалось низкого социального доминирования. Данные адаптированы с разрешения Arrant et al., 20168. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Репрезентативные результаты использования пробирочного теста для оценки доклинической терапевтической эффективности. (A) В исходном тестировании до введения AAV мыши Grn+/− имели низкое социальное доминирование (* = тест Манна-Уитни, p = 0,0157; или * = биномиальный тест, p = 0,0281). Используя блочную рандомизацию, мыши были затем распределены по группам лечения, либо AAV для повышения уровня белка програнулина (AAV-Grn), либо контрольной AAV (AAV-GFP). (B) Grn+/− мыши, которым вводили контрольный AAV-GFP, имели низкий уровень социального доминирования (* = критерий Манна-Уитни, p = 0,0196; или * = биномиальный тест, p = 0,0330). (C) Мыши Grn+/−, которым вводили AAV-Grn, больше не имели низкого социального доминирования. (D) При сравнении мышей Grn+/−, которым вводили AAV-GFP, и мышей, которым вводили AAV-Grn, мыши, которым вводили AAV-Grn, имели более высокое социальное доминирование по сравнению с контрольными мышами, которым вводили AAV-GFP (** = Манн-Уитни, p = 0,0034; или ** = биномиально, p = 0,0062). n = 19-36 мышей в группе. Данные адаптированы с разрешения Arrant et al.22. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительные таблицы 1 и 2: План эксперимента. Пример теста трубки соответствует дизайн-листу. Обратите внимание на распределение каждой экспериментальной группы между левой и правой сторонами пробирки, а также на усилия, направленные на минимизацию перемещения клеток в зону тестирования и за ее пределы. Группа A выделена черным цветом, а группа B указана красным цветом для визуализации этого распределения. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Тест на социальное доминирование с помощью пробирки обеспечивает легко усваиваемый и быстро выполняемый анализ, который исследователи могут счесть полезным либо в качестве основного показателя результата, либо в качестве части батареи поведенческих тестов на мышиных моделях. В этой статье приведены основные протоколы проведения теста в пробирке между незнакомыми людьми или между соседями по клетке.
Исследователи должны знать о нескольких параметрах, которые могут повлиять на поведение теста с пробиркой. Для всех этих параметров целесообразно провести пилотные исследования, чтобы определить их влияние на конкретную модель мыши. Как самцы, так и самки мышей могут выполнять тест через трубку, но мыши каждого пола должны быть проанализированы отдельно, поскольку некоторые модели мышей демонстрируют половые различия в фенотипе социального доминирования26, в то время какдругие не демонстрируют 8,15,27,28. Тест с пробиркой может быть повторен несколько раз на одном и том же животном, как в течение сеанса тестирования (что позволяет рассчитать процент выигрыша для каждой мыши), так и между несколькими сеансами (что позволяет проводить лонгитюдное тестирование для оценки возраста или эффектов вмешательства). Тем не менее, повторение теста может повлиять на фенотипы социального доминирования в некоторых моделях мышей 8,11,26. Наконец, фоновая деформация влияет на поведение при тестировании пробирки, как отмечалось в самойпервой публикации 3 по тестам в пробирках. Вся описанная здесь работа была выполнена на мышах на фоне C57BL/6J, а недавние основополагающие работы по тесту в пробирке также были выполнены на мышах C57BL/6 или C57BL/6J 4,6,17,29. Исследователи, работающие с другими штаммами, могут захотеть подтвердить стабильность и воспроизводимость поведения социального доминирования, прежде чем приступать к новым экспериментам.
Основным критерием результата теста с пробиркой является победа/поражение. Тем не менее, другие группы записывали продолжительность каждого матча и даже подповедение в каждом матче. Поэтому исследователи могут захотеть собрать такую информацию, чтобы увеличить богатство данных, получаемых в результате каждого теста. Ван и его коллеги сообщили, что матчи были короче при спаривании мышей с большими различиями в иерархии внутри клетки, чем при спаривании мышей с близким расположением, показывая, что наиболее доминирующиемыши выигрывают матчи быстро. Чжоу и его коллеги оценили несколько подмоделей поведения в тесте на пробирке: «инициированный толчком», «отталкивающий», «сопротивление» и «отступающий», и обнаружили, что мыши-победители проявляли больше толчков и сопротивления, но меньше отступали, чем проигравшие мыши. Хотя видеозапись матчей не является необходимой, исследователи, заинтересованные в более детальном анализе поведения социального доминирования, могут захотеть записать каждый матч.
Как и в случае со многими поведенческими тестами, тест с пробиркой может быть осложнен другими дефицитами, не связанными с социальным поведением. Двигательные нарушения, вероятно, повлияют на эффективность теста с трубкой, поэтому исследователи могут захотеть провести базовый скрининг моторных фенотипов с помощью таких тестов, как рота-стержень, открытое поле, тест на полюсе и т. д. Обонятельные сигналы являются важным аспектом социального поведения мышей30,31, поэтому исследователи также должны проводить скрининг обонятельных дефицитов, которые могут повлиять на поведение при тестировании на пробирку. Простой способ сделать это — измерить время, которое мыши тратят на изучение мочи незнакомой мыши по сравнениюс водой.
Исследователи, характеризующие социальное поведение в новых моделях мышей, должны рассмотреть возможность использования теста с пробиркой как части батареи социальных тестов. Мышиные модели с отклонениями в тесте с помощью пробирки часто демонстрируют аномальное социальное поведение в других тестах, таких как трехкамерный тест на общительность, тест на резидента-нарушителя и качественная оценка социального взаимодействия 9,10,11,12,13,14,15,20,27,32,33,34 ,35. Социальное доминирование в пробирке коррелирует с социальным доминированием в других задачах, таких как парикмахерская, маркировка мочи и соревнование за теплое место в клетке 17,36,37. Тем не менее, социальное доминирование в других задачах, таких как конкуренция за пищу, воду или доступ к самкам мышей, менее хорошо коррелирует с социальным доминированием с помощью теста 7,38. Используя батарею тестов, исследователи могут получить измерения социального доминирования, агрессии, социального исследования и социального признания в своих мышиных моделях.
Пробирочный тест был использован в качестве основного критерия результата при тестировании доклинических терапевтических подходов 22,23,25 в мышиной модели Grn+/− из-за стабильности фенотипов социального доминирования с течением времени и возможности многократного тестирования мышей. Исследователи, заинтересованные в использовании пробирочного теста для скрининговых вмешательств, должны сначала определить стабильность фенотипов социального доминирования при повторном тестировании на своей мышиной модели. Для этого сначала протестируйте мышей, а затем многократно протестируйте одни и те же совпадения с интервалом в один день, одну неделю или один месяц. Если необходимы более длительные сроки эксперимента, эти повторения могут быть выполнены с еще более длительными интервалами. Соответствие между этими совпадениями может быть статистически определено путем вычисления значения каппа между тестами. Если тест с пробиркой достигает подходящей стабильности в модели мыши, он является идеальным скрининговым анализом благодаря своей простоте и скорости.
Раскрытие информации
Эрик Д. Роберсон работал консультантом в компаниях AGTC и Lilly и получал роялти от Genentech.
Благодарности
Мы благодарим Джеймса Блэка и Мириам Роберсон за помощь в разведении мышей и поддержании колонии, Энтони Филиано и Алисию Холл за помощь в проведении тестовых тестовых тестов в пробирке, а также Роберта Фареза-младшего за предоставление мышей с нокаутом програнулина. Эта работа была поддержана Консорциумом по исследованию ЛВД и Bluefield Project to Cure FTD, Национальным институтом неврологических расстройств и инсульта (R01NS075487, P30NS047466 и F32NS090678) и Национальным институтом старения (P30AG086401, R00AG056597 и K00AG068428). Эксперименты по поведению проводились в Центре оценки поведения животных Университета Алабамы в Бирмингеме.
Материалы
| Name | Company | Catalog Number | Comments |
| Animals diet | Envigo | NIH-31 diet #7917 | Animals chow |
| CHLORHEXIDINE 2% SOLUTION 1GAL | Patterson Veterinary Supply INC | 78924243 | For cleaning tubes and surface |
| Ethanol 70% | Vion Biosciences | VNEE0069CS/4 | For cleaning tubes and surface |
| Large tube for male mice > 9 months old | Home Depot | Store SKU # 1000017942 | 1-7/8 in. O.D. x 1-1/2 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Medium tube for male mice 6–9 months old, female mice > 9 months old | Home Depot | Store SKU # 1000017945 | 1-5/8 in. O.D. x 1-1/4 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Small tube for male mice < 6 months old, female mice < 9 months old | Home Depot | Store SKU # 1000017938 | 1-3/8 in. O.D. x 1 in. I.D. x 24 in. Clear PVC Braided Vinyl Tube |
Ссылки
- Choi, T. Y., Jeong, S., Koo, J. W. Mesocorticolimbic circuit mechanisms of social dominance behavior. Exp Mol Med. 56 (9), 1889-1899 (2024).
- Fulenwider, H. D., Caruso, M. A., Ryabinin, A. E. Manifestations of domination: Assessments of social dominance in rodents. Genes Brain Behav. 21 (3), e12731(2022).
- Lindzey, G., Winston, H., Manosevitz, M. Social dominance in inbred mouse strains. Nature. 191, 474-476 (1961).
- Fan, Z., et al. Using the tube test to measure social hierarchy in mice. Nat Protoc. 14 (3), 819-831 (2019).
- Cum, M., et al. A multiparadigm approach to characterize dominance behaviors in CD1 and c57BL6 male mice. eNeuro. 11 (11), (2024).
- Wang, F., et al. Bidirectional control of social hierarchy by synaptic efficacy in medial prefrontal cortex. Science. 334 (6056), 693-697 (2011).
- Van De Weerd, H. A., Van Den Broek, F. A., Beynen, A. C. Removal of vibrissae in male mice does not influence social dominance. Behav Processes. 27 (3), 205-208 (1992).
- Arrant, A. E., Filiano, A. J., Warmus, B. A., Hall, A. M., Roberson, E. D. Progranulin haploinsufficiency causes biphasic social dominance abnormalities in the tube test. Genes Brain Behav. 15 (6), 588-603 (2016).
- Filiano, A. J., et al. Dissociation of frontotemporal dementia-related deficits and neuroinflammation in progranulin haploinsufficient mice. J. Neurosci. 33 (12), 5352-5361 (2013).
- Shahbazian, M., et al. Mice with truncated mecp2 recapitulate many Rett syndrome features and display hyperacetylation of histone h3. Neuron. 35 (2), 243-254 (2002).
- Spencer, C. M., Alekseyenko, O., Serysheva, E., Yuva-Paylor, L. A., Paylor, R. Altered anxiety-related and social behaviors in the fmr1 knockout mouse model of fragile x syndrome. Genes Brain Behav. 4 (7), 420-430 (2005).
- Irie, F., Badie-Mahdavi, H., Yamaguchi, Y. Autism-like socio-communicative deficits and stereotypies in mice lacking heparan sulfate. Proc Natl Acad Sci U S A. 109 (13), 5052-5056 (2012).
- Veenstra-Vanderweele, J., et al. Autism gene variant causes hyperserotonemia, serotonin receptor hypersensitivity, social impairment and repetitive behavior. Proc Natl Acad Sci U S A. 109 (14), 5469-5474 (2012).
- Jiang-Xie, L. F., et al. Autism-associated gene dlgap2 mutant mice demonstrate exacerbated aggressive behaviors and orbitofrontal cortex deficits. Mol Autism. 5, 32(2014).
- Huang, W. H., et al. Early adolescent rai1 reactivation reverses transcriptional and social interaction deficits in a mouse model of smith-magenis syndrome. Proc Natl Acad Sci U S A. 115 (42), 10744-10749 (2018).
- Rascovsky, K., et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain. 134 (Pt 9), 2456-2477 (2011).
- Zhou, T., et al. History of winning remodels thalamo-PFC circuit to reinforce social dominance. Science. 357 (6347), 162-168 (2017).
- Zhou, X., et al. Prosaposin facilitates sortilin-independent lysosomal trafficking of progranulin. J Cell Biol. 210 (6), 991-1002 (2015).
- Cook, A. K., et al. Dendritic spine head diameter is reduced in the prefrontal cortex of progranulin haploinsufficient mice. Mol Brain. 17 (1), 33(2024).
- Park, M. J., Seo, B. A., Lee, B., Shin, H. S., Kang, M. G. Stress-induced changes in social dominance are scaled by AMPA-type glutamate receptor phosphorylation in the medial prefrontal cortex. Sci Rep. 8 (1), 15008(2018).
- Tada, H., et al. Neonatal isolation augments social dominance by altering actin dynamics in the medial prefrontal cortex. Proc Natl Acad Sci U S A. 113 (45), E7097-E7105 (2016).
- Arrant, A. E., Filiano, A. J., Unger, D. E., Young, A. H., Roberson, E. D. Restoring neuronal progranulin reverses deficits in a mouse model of frontotemporal dementia. Brain. 140 (5), 1447-1465 (2017).
- Kurnellas, M., et al. Latozinemab, a novel progranulin-elevating therapy for frontotemporal dementia. J Transl Med. 21 (1), 387(2023).
- Ueno, H., et al. Effects of repetitive gentle handling of male c57bl/6ncrl mice on comparative behavioural test results. Sci Rep. 10 (1), 3509(2020).
- Arrant, A. E., Nicholson, A. M., Zhou, X., Rademakers, R., Roberson, E. D. Partial tmem106b reduction does not correct abnormalities due to progranulin haploinsufficiency. Mol Neurodegener. 13 (1), 32(2018).
- Chachua, T., et al. Sex-specific behavioral traits in the BRD2 mouse model of juvenile myoclonic epilepsy. Genes Brain Behav. 13 (7), 702-712 (2014).
- Lijam, N., et al. Social interaction and sensorimotor gating abnormalities in mice lacking dvl1. Cell. 90 (5), 895-905 (1997).
- Nishimura, I., Yang, Y., Lu, B. Par-1 kinase plays an initiator role in a temporally ordered phosphorylation process that confers tau toxicity in drosophila. Cell. 116 (5), 671-682 (2004).
- Zhang, C., et al. Dynamics of a disinhibitory prefrontal microcircuit in controlling social competition. Neuron. 110 (3), 516-531.e6 (2022).
- Lin, D. Y., Zhang, S. Z., Block, E., Katz, L. C. Encoding social signals in the mouse main olfactory bulb. Nature. 434 (7032), 470-477 (2005).
- Matsuo, T., et al. Genetic dissection of pheromone processing reveals main olfactory system-mediated social behaviors in mice. Proc Natl Acad Sci U S A. 112 (3), E311-E320 (2015).
- Koh, H. Y., Kim, D., Lee, J., Lee, S., Shin, H. S. Deficits in social behavior and sensorimotor gating in mice lacking phospholipase cbeta1. Genes Brain Behav. 7 (1), 120-128 (2008).
- Long, J. M., Laporte, P., Paylor, R., Wynshaw-Boris, A. Expanded characterization of the social interaction abnormalities in mice lacking dvl1. Genes Brain Behav. 3 (1), 51-62 (2004).
- Moretti, P., Bouwknecht, J. A., Teague, R., Paylor, R., Zoghbi, H. Y. Abnormalities of social interactions and home-cage behavior in a mouse model of Rett syndrome. Hum Mol Genet. 14 (2), 205-220 (2005).
- Nishijima, I., et al. Secretin receptor-deficient mice exhibit impaired synaptic plasticity and social behavior. Hum Mol Genet. 15 (21), 3241-3250 (2006).
- Rodriguiz, R. M., Chu, R., Caron, M. G., Wetsel, W. C. Aberrant responses in social interaction of dopamine transporter knockout mice. Behav Brain Res. 148 (1-2), 185-198 (2004).
- Greenberg, G. D., Howerton, C. L., Trainor, B. C. Fighting in the home cage: Agonistic encounters and effects on neurobiological markers within the social decision-making network of house mice (mus musculus. Neurosci Lett. 566, 151-155 (2014).
- Benton, D., Dalrymple-Alford,, John, C., Brain, P. F. Comparisons of measures of dominance in the laboratory mouse. Anim Behav. 28, 1274-1279 (1980).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены