Method Article
튜브 테스트를 사용한 마우스 모델의 사회적 지배력 평가
요약
이 프로토콜은 튜브 테스트를 사용하여 설치류의 사회적 우세를 평가하기 위한 행동 분석을 설명합니다. 사회적 우위는 시간이 지남에 따라 안정적으로 유지되며, 발달 및 신경 장애의 여러 모델은 강력한 사회적 지배 이상을 나타냅니다. 따라서 튜브 검사는 기계론적 연구 또는 전임상 치료 스크리닝을 위한 편리한 결과 측정 역할을 합니다.
초록
사회적 우위는 신경 발달 및 신경 퇴행성 질환에서 변경되며 이러한 장애에 대한 전임상 연구에서 유용한 결과 측정 역할을 합니다. 튜브 테스트는 고가의 장비가 필요하지 않은 사회적 지배력을 평가하기 위한 간단한 행동 분석법입니다. 이 테스트에서는 두 마리의 생쥐가 투명한 플라스틱 튜브의 반대쪽 끝으로 들어가고 중간에서 만난 후 한 마리(덜 우세한 마우스)가 뒤로 물러나야 합니다. 튜브 테스트는 수컷 및 암컷 마우스 모두에 사용할 수 있으며 연구자의 필요에 맞게 조정 가능한 여러 매개 변수를 포함합니다. 생쥐는 사회적 지배력의 지표를 제공하기 위해 여러 개의 고유한 상대에 대해 테스트될 수 있습니다. 튜브 검사에서 사회적 우위는 반복 검사에서 안정적으로 유지되며 다른 사회적 분석의 성과와 상관관계가 있습니다. 또한, 이 테스트는 케이지 내부의 사회적 지배 계층을 평가하기 위해 케이지 동료 간에 수행될 수 있습니다. 튜브 검사는 실험적 개입 전후에 종단 검사를 가능하게 하기 때문에 전임상 치료 연구에서 특히 유용합니다. 따라서 기계론적 연구 및 전임상 치료 스크리닝을 위한 편리한 결과 측정 역할을 합니다.
서문
사회적 행동의 붕괴는 발달 장애, 정신 장애, 신경 퇴행성 장애를 포함한 많은 인간 장애의 특징이다 1,2. 마우스 모델은 이러한 질환의 발병 기전에 대한 통찰력을 얻고 치료제의 전임상 테스트를 위한 플랫폼을 제공하는 데 사용됩니다. 그러나 생쥐의 사회적 행동에 대한 많은 분석은 수행하는 데 시간이 많이 걸리거나, 분석을 위해 고가의 장비 및/또는 비디오 추적 소프트웨어가 필요하거나, 주관적인 채점 알고리즘을 가지고 있습니다. 대조적으로, 사회적 지배력에 대한 튜브 테스트는 빠르고 간단하게 수행할 수 있으며 특수 장비나 비디오 추적이 필요하지 않습니다. 이 분석은 이분법적인 승/패 결과를 가지고 있어 결과를 쉽게 해석할 수 있습니다.
사회적 우위에 대한 튜브 테스트는 Lindzey와 동료들이 생쥐의 사회적 우세를 평가하기 위한 노력의 일환으로 개발했습니다3. 튜브 테스트는 개발 이후 케이지 내부의 사회적 지배 계층 구조4를 평가하는 방법으로 확립되었습니다. 튜브 검사 표현형은 수컷 마우스의 이발, 보상 경쟁, 소변 만들기와 같은 사회적 지배력의 다른 측정과 상관관계가 있습니다5. 그러나 튜브 테스트의 결과와 음식 및 물 접근성 경쟁 및 공격성과의 상관 관계는 엇갈리고 있습니다 3,6,7. 중요한 것은 튜브 테스트 표현형이 3-챔버 사회성 8,9와 같은 다른 사회적 표현형과 상관관계가 있다는 것입니다.
튜브 검사의 장점은 해부학적 구조가 잘 정의되어 있어 자폐 스펙트럼 장애 및 전두측두엽 치매와 같은 사회적 결핍을 특징으로 하는 기타 질병 모델을 포함한 다양한 마우스 모델에 특히 유용하다는 것입니다 8,9,10,11,12,13,14,15,16 . 내측 전전두엽 피질(mPFC)은 마우스 튜브 검사 행동의 핵심 매개체입니다6. Wang과 동료들은 mPFC의 활동이 생쥐의 사회적 지배를 주도한다는 것을 보여주었으며6 보다 최근의 데이터는 전대뇌 변연계 및 전방 대상피질에 대한 중측 시상 입력이 사회적 지배를 주도한다는 것을 보여줌으로써 이러한 통찰력을 개선했습니다17. 튜브 검사에서 mPFC가 사회적 우세, 수지상 가시, 글루타메이트 수용체 및/또는 신경 흥분성의 이상과 일치하는 mPFC는 자폐 스펙트럼 장애 15,18, 전두측두엽 치매 8,19, 만성 스트레스 20 및 사회적 고립 21의 설치류 모델에서 튜브 검사 이상과 관련이 있습니다.
튜브 검사의 또 다른 주요 장점은 튜브 검사에서 마우스의 사회적 우위가 시간이 지남에 따라 안정적이기 때문에 실험적 개입 전후에 반복적인 검사가 가능하기 때문에 치료 개입 전후에 사회적 우위를 테스트할 수 있다는 것입니다 6,8,22,23. 이에 대한 한 가지 예는 반수부전 질환인 프로그래눌린(GRN) 돌연변이에 의해 유발되는 전두측두엽 치매의 프로그래뉼린 이형접합적(grn+/-) 마우스 모델에서 비롯됩니다. 프로그래뉼린 이형접합 마우스는 사회적 지배력 결핍이 있습니다8. 이러한 튜브 검사 결핍은 AAV-프로그래눌린 유전자 요법22 또는 프로그래눌린 분해를 줄이기 위해 고안된 항 소르틸린 항체 투여로 프로그래눌린을 회복시킴으로써 되돌릴 수 있습니다23. 이러한 사례는 치매 관련 연구를 위한 전임상 시험을 설계하는 데 튜브 검사의 유용성을 보여줍니다.
이 프로토콜은 실험 그룹 간의 차이를 평가하기 위해 케이지메이트가 아닌 사람들 간의 튜브 테스트를 실행하고, 케이지 내 사회적 지배 계층을 평가하기 위해 케이지메이트 간의 튜브 테스트를 실행하는 기본 방법을 제공합니다.
프로토콜
모든 실험 절차는 버밍엄에 있는 앨라배마 대학교의 기관 동물 관리 및 사용 위원회의 승인을 받았으며 실험실 동물 관리 평가 및 인증 협회(AAALAC)에 따라 수행되었습니다. 프로그래눌린 이형접합 마우스를 생성하고, 앞서 설명한 바와 같이 C57BL/6J 배경에 교차시켰다9. 이 연구에 사용된 마우스는 최소 12세대에 걸쳐 C57BL/6J 배경으로 역교배되었습니다. 생후 9-16개월의 마우스가 표본 데이터에 사용되었습니다. 이 연구에서는 수컷과 암컷이 모두 사용되었습니다. 마우스는 06:00시에 조명이 켜진 상태에서 12:12시간의 라이트/다크 사이클을 유지했으며 모든 테스트는 라이트 단계에서 수행되었습니다. 쥐는 모든 실험에서 음식과 물에 대한 자유 의 접근을 받았습니다. 시약과 사용된 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 튜브 테스트 매치 디자인
- 테스트하기 전에 튜브 테스트 일치를 계획하십시오. 실험자가 그룹에 대해 블라인드 상태를 유지하기 위해 유전자형 메모가 없는지 확인하십시오( 보충 표 1 참조).
참고 : 우리는 일반적으로 반대쪽 실험 그룹 8,9,22,23의 3 가지 고유 한 상대에 대해 마우스를 테스트하지만 일부 연구에서는 더 많은 상대 10,11,13에 대해 테스트한다고보고합니다. - 실험용 마우스를 튜브의 왼쪽과 오른쪽에 할당하여 측면 바이어스의 잠재적인 교란 효과를 방지합니다.
- 케이지메이트가 아닌 개체를 테스트할 때는 마우스가 필요 이상으로 스트레스를 받지 않도록 케이지의 움직임을 최소화합니다. 케이지 이동을 최소화하려면 가능한 한 동일한 두 케이지 간에 매치가 겹치도록 합니다.
- 케이지메이트를 테스트할 때는 라운드 로빈 방식으로 케이지의 각 마우스를 다른 모든 마우스와 비교하여 테스트합니다. 여러 날에 걸쳐 테스트를 반복하는 경우 마우스가 입력하도록 할당된 튜브의 측면(즉, 왼쪽 또는 오른쪽)을 매일 번갈아 가며 사용해야 합니다.
2. 튜브 선택
참고: 일반적으로 튜브 테스트는 PVC로 만든 시중에서 판매되는 투명 플라스틱 튜브를 사용하여 수행됩니다( 재료 표 참조). 이 프로토콜은 생쥐에 최적화되어 있지만 쥐, 들쥐 및 햄스터와 같은 다른 설치류 모델에도 적용될 수 있다는 점에 유의하는 것이 중요합니다2.
- PVC 튜브를 30.5cm 길이로 자릅니다. PVC 튜브는 약간 유연하며 종종 롤로 보관되므로 사용하기 전에 곧게 펴야 할 수도 있습니다. 약한 가열은 구부러진 튜브를 곧게 펴는 데 도움이 됩니다.
- 튜브의 내경은 테스트 성공에 매우 중요합니다. 튜브가 마우스가 통과할 수 있을 만큼 충분히 크지만 마우스가 서로 교차할 수 있을 만큼 크지 않은지 확인합니다.
참고: 튜브가 생쥐가 사회적 지배 경쟁에 참여하지 않고 서로를 통과할 수 있을 만큼 충분히 크면 테스트가 작동하지 않습니다. 다음은 C57BL/6J 마우스의 적절한 튜브 크기에 대한 대략적인 지침입니다: (1) 수컷 마우스<6개월, 암컷 마우스<9개월)의 경우 1인치/2.5cm 내경(ID); (2) 생후 6-9개월 수컷 마우스의 경우 1.25인치/3.2cm, >9개월의 암컷 마우스의 경우 ID; (3) 수컷 마우스의 경우 1.5인치/3.5cm(9개월) >9cm ID). - 가능하면 마우스 그룹 내의 모든 테스트에 동일한 크기의 튜브를 사용하십시오. 처음 몇 경기 동안 마우스가 교차하면 다음으로 가장 작은 튜브로 모든 후속 경기를 실행합니다.
3. 테스트 위치
- 주변 조명 아래의 평평하고 안정적인 표면 또는 여과된 후드에서 튜브 테스트를 수행합니다.
참고: 테스트는 일반적으로 오전 8시에서 오후 5시 사이에 수행됩니다. 마우스가 여러 날에 걸쳐 테스트되는 경우, 각 마우스는 각 테스트에 대해 하루 중 동일한 시간(예: 오전 11시에서 오후 3시 사이)에 테스트를 받아야 합니다. 우리가 아는 한, 하루 중 시간 효과는 이전에 연구되지 않았습니다. - 외부 자극을 최소화하고 조용한 장소에서 튜브 테스트를 수행합니다. 이상적으로는 조사관이 회의실에 있는 유일한 사람이어야 합니다.
4. 습관화
- 습관화(habituation)는 생쥐가 테스트 환경에 익숙해질 수 있도록 하는 행동 분석의 중요한 관행이며, 이를 통해 보다 일관되고 신뢰할 수 있는 결과를 얻을 수 있습니다24. 튜브 테스트의 경우 테스트 전에 마우스를 시험장에 적응시킵니다. 동물의 사육실에서 실험을 하지 않는 경우, 실험하기 전에 쥐가 새 방에 적응할 수 있도록 최소 1시간 동안 기다립니다.
- (선택 사항) 원하는 경우, 시험하기 전에 마우스가 튜브에 익숙해질 수 있습니다. 튜브에 익숙해지려면 상대가 없는 튜브에 마우스를 넣고 테스트 2-3일 전에 튜브를 2-3번 통과하도록 합니다. 이것은 우리의 표준 관행이 아닙니다.
5. 표준 튜브 테스트
참고: (선택 사항) 튜브 테스트를 처음 접하는 조사자는 별도의 비실험 마우스 그룹을 사용하여 튜브에 마우스를 배치하는 연습을 할 수 있습니다. 조사관은 종종 튜브에 쥐를 넣는 연습을 해야 합니다. 경험 많은 조사관은 테스트를 받는 쥐에게 스트레스를 덜 유발할 것입니다. 튜브에 마우스를 넣는 방법에 대한 자세한 내용은 5.3단계에 나와 있습니다.
- 테스트할 동성의 마우스가 들어 있는 모든 케이지를 카트에 놓습니다. 케이지를 테스트 영역으로 운반합니다. 튜브와 테스트 영역을 2% 클로르헥시딘과 70% 에탄올로 세척합니다. 튜브는 50mL 혈청학 피펫을 사용하여 종이 타월을 튜브를 통해 밀어 쉽게 세척할 수 있습니다.
- 첫 번째 경기를 위한 두 개의 케이지를 테스트 표면에 놓습니다. 뚜껑을 제거하고 각 케이지 옆에 놓습니다.
- 테스트할 두 마리의 마우스를 찾습니다. 튜브의 할당된 쪽에 해당하는 마우스 한 개를 양손에 잡습니다. 첫 번째 쥐를 찾은 후 꼬리를 부드럽게 잡고 두 번째 쥐를 찾는 동안 우리에 보관하십시오.
알림: 마우스의 꼬리를 길이의 중심 근처에 잡으면 조사자가 마우스를 너무 세게 구속하지 않고 부드럽게 제어할 수 있습니다. 마우스에게 불필요하게 스트레스를 주지 않도록 네 개의 발이 모두 케이지 침구에 남아 있도록 마우스를 잡습니다. - 각 케이지에서 두 쥐를 동시에 제거하고 머리가 튜브 입구에 부드럽게 놓이도록 합니다.
참고: 생쥐가 습관화되었거나 이전 테스트 경험이 있는 경우 일반적으로 몇 초 이내에 튜브에 들어갑니다. 쥐가 튜브에 순진하면 첫 번째 시험에 들어가는 것을 주저할 수 있습니다. 필요한 경우 마우스를 다음으로 큰 튜브로 전환하여 튜브 진입을 유도할 수 있습니다. - 마우스가 조기에 접촉하는 것을 방지하기 위해 각 마우스의 꼬리를 계속 잡으십시오. 마우스가 튜브에 강제로 들어가지 않도록 하십시오. 그러나 일단 튜브에 들어가기 시작하면 튜브에 완전히 들어가도록 부드럽게 살짝 찌를 수 있습니다.
- 두 마우스가 모두 튜브에 들어가면 꼬리를 풀고 튜브에서 물러납니다(그림 1A). 두 마우스 모두 튜브 안으로 들어가 중앙 근처에서 만나야 합니다(그림 1B).
- 경기를 관찰하고 승자와 패자를 기록하십시오. 마우스는 두 개의 발이 튜브에서 나와 테스트 표면에 닿을 때 경기에서 진 것으로 간주됩니다(그림 1C).
참고: 한 마우스는 일반적으로 튜브에서 다른 마우스를 밀어내지만, 일부 마우스는 상대 마우스와 접촉한 후 강제되지 않은 후퇴를 수행합니다. 때때로, 두 마우스가 동시에 후퇴하거나 한 마리의 마우스가 상대 마우스와 접촉하지 않고 튜브에 들어간 직후 후퇴합니다. 이러한 이벤트 중 하나가 발생하면 두 마우스를 모두 튜브에 다시 넣고 일치를 다시 시작합니다. 마우스는 일반적으로 두 번째 시도에서 보다 표준적인 일치를 수행합니다. 두 마우스 모두 2분 이내에 물러나지 않으면 경기를 중단하고 세션이 끝날 때 다시 실행합니다.
- 경기를 관찰하고 승자와 패자를 기록하십시오. 마우스는 두 개의 발이 튜브에서 나와 테스트 표면에 닿을 때 경기에서 진 것으로 간주됩니다(그림 1C).
- 경기가 끝나면 생쥐를 집 우리로 되돌립니다. 튜브와 테스트 표면을 70% 에탄올로 청소합니다.
- 1단계에서 설명한 설계를 사용하여 경기를 계속 실행합니다. 각 라운드는 이전 라운드 직후에 시작됩니다. 한 성별의 모든 경기가 실행되면 케이지를 랙/카트로 되돌리고 동일한 절차를 사용하여 이성의 마우스를 테스트합니다.
- 달리는 암컷 마우스와 수컷 마우스 사이의 테스트 표면과 튜브를 철저히 청소합니다. 테스트가 완료되면 튜브와 테스트 영역을 모두 2% 클로르헥시딘으로 세척합니다.
- 통계 분석의 경우 각 그룹의 승리 횟수를 세고 이항 테스트를 사용하여 관찰된 분포와 기대 분포를 비교하고 각 그룹에 대해 50%의 승리로 설정된 예상 분포를 비교합니다.
- 승리 횟수를 경기 수로 나누어 각 마우스의 승률을 계산합니다(마우스 누락 또는 기타 문제로 인해 경기가 취소되지 않은 한 일반적으로 3경기). Mann-Whitney 검정을 사용하여 각 그룹의 승률을 비교합니다.
참고: 반복되면 이러한 일치는 추가 실험 조작이 없는 경우 유사한 결과를 생성합니다. 예를 들어, 이전 연구에서는 47개의 경기 중 40개가 연속적인8일차에 실행되었을 때 동일한 결과를 생성한다는 것을 관찰했습니다.
- 승리 횟수를 경기 수로 나누어 각 마우스의 승률을 계산합니다(마우스 누락 또는 기타 문제로 인해 경기가 취소되지 않은 한 일반적으로 3경기). Mann-Whitney 검정을 사용하여 각 그룹의 승률을 비교합니다.
6. 사회적 지배 계층 구조를 평가하기 위한 케이지 내 튜브 테스트
참고: 마우스는 안정적인 사회적 지배 계층을 형성하며, 이는 케이지 내의 모든 마우스에 대한 라운드 로빈 튜브 테스트에 의해 밝혀질 수 있습니다 4,6. 수컷 마우스와 암컷 마우스 모두 이러한 계층 구조를 형성합니다8. 사회적 지배 계층은 최소 5마리의 쥐가 있는 우리에서 가장 잘 평가됩니다.
- 1단계에서 설명한 대로 균형을 맞춰 경기를 미리 계획합니다.
- 5단계에 설명된 대로 튜브 테스트 일치를 실행합니다. 한 번에 하나의 케이지를 테스트하고 모든 마우스를 라운드 로빈 방식으로 테스트합니다. 각 성냥 사이에 70% 에탄올로 튜브와 테스트 영역을 청소합니다.
- 각 마우스의 안정적인 순위 순서를 설정하기 위해 최소 5일 동안 하루에 한 번 각 케이지를 테스트합니다.
- 통계 분석을 위해 마우스당 승리 횟수를 평가합니다. 승리 횟수에 따라 각 마우스의 순위를 매깁니다.
7. 전임상 치료 스크리닝을 위한 튜브 테스트 사용
참고: 많은 마우스 모델에서 사회적 지배 표현형의 견고성과 안정성, 그리고 튜브 테스트 수행의 용이성으로 인해 튜브 테스트는 치료 전략의 전임상 테스트에 유용한 패러다임이 되었습니다. 이를 위해 튜브 테스트는 순차적으로 수행할 수 있으므로 동물 내 설계를 사용하여 수행할 수 있습니다. 약물과 크로스 오버 디자인을 수행 한 다음 제어 또는 그 반대의 경우도 가능합니다. 튜브 테스트는 이전에 Grn+/-마우스22,23에서 프로그래눌린 부스팅 요법을 평가하는 데 사용되었으며, 이는 이 마우스 모델에서 사회적 우성 표현형이 가역적임을 보여주었습니다. 아래 논의의 명확성을 위해 마우스는 "대조군"(야생형, 비형질전환 등) 또는 "모델"(녹아웃, 형질전환 등)으로 설명되며, 실험적 개입은 "비히클" 또는 "치료"(치료적 개입)로 설명됩니다. 마우스는 아래에서 "대조군" 및 "모델"이라고 하지만 이러한 각 그룹에 대해 리터메이트를 사용하는 것이 이상적입니다.
- 실험적 개입 전에 사전 테스트를 수행하여 테스트에 사용할 모델 마우스에서 예상되는 사회적 우성 표현형의 존재를 확인합니다. 전체 대조군 풀을 테스트하고 마우스 모델링을 서로 비교하고 이러한 데이터를 사용하여 마우스를치료 그룹에 할당하여 그룹이 기준선에서 균형을 이루는지 확인합니다.
- 치료 방법에 따라 다른 치료 기간이 필요할 수 있습니다. 예를 들어, 약물이 AAV인 경우 마우스가 수술에서 회복하고 약물이 효과를 발휘할 시간을 줍니다. 약물이 소분자인 경우, 튜브 검사 전에 치료 패러다임을 결정한다22.
- 각 유전자형의 비히클 마우스와 처리된 마우스가 비슷한 정도의 기준선 사회적 우성 표현형을 갖도록 마우스를 실험 그룹에 할당합니다. 마우스가 여러 상대를 상대로 여러 번 테스트되는 경우 각 마우스의 승률(5.9단계에서 설명)을 사용하여 유사한 표현형을 가진 두 그룹을 만들 수 있습니다.
- ARRIVE 가이드라인에 따라 마우스를 그룹으로 무작위로 분배하려면 각 마우스의 승률에 따라 블록 무작위 프로토콜8을 사용합니다.
- 그룹을 할당한 후 치료 중 여러 시점에서 마우스를 테스트합니다. 일반적으로 수행되는 비교에 대한 자세한 내용은 아래 참고 사항을 참조하십시오.
참고: (1) 차량 제어 마우스 vs. 차량 모델 마우스(이것은 차량 처리가 마우스 모델의 표현형을 모호하게 하지 않는다는 것을 보여주기 위한 대조군 비교입니다); (2) 차량 제어 마우스 vs. 처리된 모델 마우스(이것은 처리된 모델 마우스가 일반 대조군과 다르다는 가설을 테스트함); (3) 자동차 모델 마우스 vs. 처리된 모델 마우스(이것은 처리가 마우스 모델의 표현형을 변경한다는 가설을 테스트합니다); (4) 차량 제어 마우스 vs. 처리된 대조군 마우스(이것은 사회적 우성 표현형이 없는 마우스에서 처리 효과를 결정하기 위한 대조군 비교입니다). - 일반적으로 테스트는 이틀에 걸쳐 하루에 약 6개의 경기로 수행되며 7.4단계에서 비교(1-4)가 언급됩니다. 과도한 테스트를 방지하려면 1일차에 비교 (1)과 (2)를 실행하고 2일차에 비교 (3)과 (4)를 실행합니다. 차량 제어 마우스는 1일차에 두 모델 그룹에 대해 테스트되기 때문에 각 비교의 일치 항목이 산재되어야 합니다.
- 테스트가 끝나면 쥐를 집 우리로 되돌립니다. 튜브와 테스트 표면을 70% 에탄올로 청소합니다.
결과
튜브 검사는 프로그래눌린 돌연변이로 인한 전두측두엽 치매의 마우스 모델인 Grn+/- 마우스 8,9,22,23,25에 광범위하게 사용되었습니다. 이 마우스는 생후 9개월까지 낮은 사회적 지배력을 보입니다(그림 2A-D)8. 구형 Grn+/− 마우스의 낮은 사회적 우성 표현형은 반복 테스트를 통해 안정적이며(그림 2A)8 강력한 실험 결과 측정22,25입니다.
케이지 내 테스트는 또한 케이지메이트 간의 사회적 지배 계층을 조사하기 위해 Grn+/-마우스에서 수행되었습니다(그림 3A-D)8. 중요한 것은 수컷(그림 3A,B)과 암컷(그림 3C,D) 마우스가 모두 이러한 계층을 형성하며, Grn+/− 마우스도 케이지메이트 사이에서 낮은 사회적 우위를 보인다는 것입니다(그림 3E). 흥미롭게도, Grn−/− 마우스에는 이러한 이상이 없었습니다(그림 3E).
구형 Grn+/- 마우스가 나타내는 낮은 사회적 우성 표현형(그림 2)은 프로그래눌린 강화 치료 개입에 대한 매력적인 결과 측정이 됩니다. AAV 주입 전, Grn+/- 마우스는 낮은 사회적 우성 표현형을 나타냅니다(그림 4A). 대조군 바이러스를 주입한 Grn+/- 마우스는 여전히 낮은 우성 표현형을 보입니다(그림 4B). 프로그래눌린 수치를 높이기 위해 바이러스를 주입한 Grn+/− 마우스는 더 이상 낮은 사회적 우성 표현형을 갖지 않습니다(그림 4C). 대조군 AAV를 주입한 Grn+/- 마우스를 프로그래눌린 부스팅 AAV를 주입한 Grn+/- 마우스를 비교했을 때, 대조군 AAV를 주입한 Grn+/- 마우스는 낮은 사회적 지배력을 보입니다(그림 4D).

그림 1: 튜브 테스트의 개략도. (A) 실험자는 네 발로 튜브에 들어간 마우스를 놓아줍니다. 튜브는 마우스가 돌아서거나 다른 마우스 위로 올라갈 수 없을 만큼 충분히 작아야 합니다. (B) 그런 다음 두 쥐는 튜브의 중앙으로 이동하여 만나게 됩니다. (C) 더 우세한 마우스는 튜브에 남아 있고 덜 우세한 마우스는 뒤로 물러납니다. 마우스는 두 발이 튜브에서 나오면 패자로 계산됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 사회적 우성 표현형을 식별하기 위해 튜브 테스트를 사용한 대표적인 결과. 이 연구는 전두측두엽 치매의 Grn+/- 마우스 모델에 관한 것이었다. 마우스는 1단계에서 설명한 대로 3명의 새로운 상대를 상대로 3라운드를 테스트했습니다. 데이터를 표시하는 다양한 방법이 표시됩니다. (A) 생후 9개월 이상의 Grn+/− 마우스는 반복 테스트에서 안정적인 낮은 사회적 우성 표현형을 가지고 있습니다(* = 이항 테스트, p < 0.05, 데이터 포인트는 각 유전자형의 승률을 나타냄). (B) 유전자형당 전체 승리 비율을 표시하는 세 차례의 테스트에서 집계된 데이터(*** = 이항 테스트, p = 0.0004). (C) 3개의 경기 모두에서 각 마우스의 승리 횟수를 플로팅합니다. Grn+/− 마우스는 승리 횟수가 더 적었습니다(**** = Mann-Whitney 검정, p < 0.0001). 각 점은 마우스입니다. (D) 주어진 승률을 가진 각 유전자형의 생쥐 비율 플롯. Grn+/- 마우스는 승률이 낮을 가능성이 더 높았습니다. (**** = Mann-Whitney 검정, p < 0.0001). 9-16개월 된 마우스, n = 그룹당 58마리의 마우스. 데이터는 Arrant et al.8의 허가를 받아 조정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
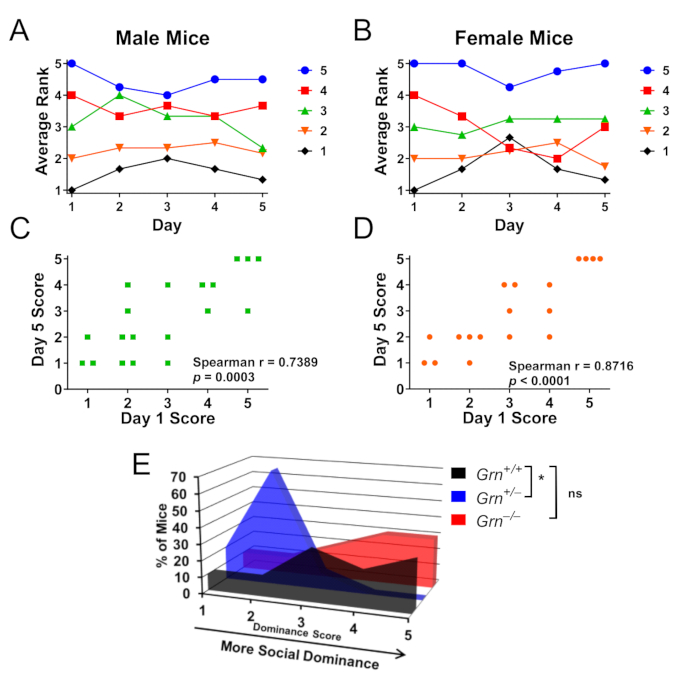
그림 3: 케이지 내 사회적 지배 계층을 결정하기 위해 튜브 테스트를 사용한 대표적인 결과. 수컷 또는 암컷 마우스의 케이지(각각 4-5마리의 마우스로 구성된 성별당 4개의 케이지)를 5일 동안 라운드 로빈 방식으로 테스트하여 사회적 지배 계층을 테스트할 수 있도록 했습니다. (A,B) 수컷과 암컷 마우스의 사회적 우위 점수는 승리 횟수에 따라 결정되었으며, 각 케이지에서 5는 가장 지배적인 마우스이고 1은 가장 덜 지배적인 마우스였습니다. 5일째에 수컷(A) 마우스와 암컷(B) 마우스 모두 평균적으로 초기 점수의 한 등급 이내를 유지했습니다. 색상 코딩은 1일차 순위에 따라 결정됩니다. (C, D) 5일차의 순위는 남녀 모두에서 1일차의 순위와 매우 유의한 상관관계를 보였습니다. (E) Grn+/+, Grn+/− 및 Grn−/− 마우스가 함께 그룹 수용된 케이지를 평가하기 위해 이 케이지 내 패러다임을 사용하여 Grn+/− 마우스도 낮은 사회적 지배력을 보였습니다(Kruskal-Wallis 테스트, p = 0.0063, * = p < Dunn의 사후 테스트에 의해 0.05). 흥미롭게도, 낮은 사회적 지배력은 Grn−/- 마우스에서 관찰되지 않았다. 데이터는 Arrant et al., 20168의 허가를 받아 조정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 전임상 치료 효능을 평가하기 위해 튜브 검사를 사용한 대표적인 결과.(A) AAV 주입 전 기준선 테스트에서 Grn+/- 마우스는 사회적 우위가 낮았습니다(* = Mann-Whitney 테스트, p = 0.0157; 또는 * = 이항 테스트, p = 0.0281). 그런 다음 블록 무작위 배정을 사용하여 생쥐를 프로그래눌린 단백질 수치를 높이기 위한 AAV(AAV-Grn) 또는 대조군 AAV(AAV-GFP)의 치료 그룹에 할당했습니다. (B) 대조군 AAV-GFP를 주입한 Grn+/− 마우스는 사회적 우위가 낮았습니다(* = Mann-Whitney 검정, p = 0.0196; 또는 * = 이항 검정, p = 0.0330). (C) AAV-Grn을 주입한 Grn+/- 마우스는 더 이상 낮은 사회적 지배력을 가지지 않았습니다. (D) AAV-GFP를 주입한 Grn+/− 마우스와 AAV-Grn을 비교했을 때, AAV-Grn을 주입한 마우스는 AAV-GFP를 주입한 대조군 마우스에 비해 사회적 우위가 더 높았습니다(** = Mann-Whitney, p = 0.0034; 또는 ** = 이항, p = 0.0062). n = 그룹당 19-36마리의 마우스. 데이터는 Arrant et al.22의 허가를 받아 조정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1 및 2: 실험 설계. 튜브 테스트 매치 설계 시트의 예. 튜브의 왼쪽과 오른쪽 사이에 각 실험 그룹이 분포되어 있고 테스트 영역 안팎으로 케이지의 움직임을 최소화하려는 노력에 주목하십시오. 그룹 A는 검은색이고 그룹 B는 이 분포를 시각화하기 위해 빨간색으로 나열됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
사회적 우위에 대한 튜브 테스트는 연구자가 1차 결과 측정 또는 마우스 모델에서 일련의 행동 테스트의 일부로 유용할 수 있는 쉽게 채택되고 신속하게 수행되는 분석을 제공합니다. 이 기사는 낯선 사람 사이 또는 케이지메이트 사이에서 튜브 테스트를 수행하기 위한 기본 프로토콜을 제공합니다.
조사관은 튜브 테스트 동작에 영향을 줄 수 있는 몇 가지 매개변수를 알고 있어야 합니다. 이러한 모든 매개변수에 대해 파일럿 연구는 특정 마우스 모델에 대한 영향을 결정하는 것이 좋습니다. 수컷과 암컷 마우스 모두 튜브 테스트를 수행할 수 있지만, 일부 마우스 모델은 사회적 우성 표현형26에서 성별 차이를 보이는 반면 다른 모델은 그렇지 않으므로 각 성별의 마우스는 별도로 분석해야 합니다 8,15,27,28. 튜브 테스트는 테스트 세션 내(각 마우스의 승률 계산 가능)와 여러 세션 사이(연령 또는 중재 효과를 평가하기 위한 종단 테스트 허용) 모두에서 동일한 동물에서 여러 번 반복될 수 있습니다. 그러나 테스트를 반복하면 일부 마우스 모델에서 사회적 우성 표현형에 영향을 미칠 수 있습니다 8,11,26. 마지막으로, 배경 변형은 첫 번째 튜브 테스트 간행물3에서 언급한 바와 같이 튜브 테스트 동작에 영향을 미칩니다. 여기에 설명된 모든 작업은 C57BL/6J 배경의 마우스에서 수행되었으며, 튜브 테스트에 대한 최근의 정액 논문은 C57BL/6 또는 C57BL/6J 마우스 4,6,17,29에서도 수행되었습니다. 다른 균주에서 연구하는 연구자는 새로운 실험을 진행하기 전에 사회적 지배 행동의 안정성과 재현성을 확인하고자 할 수 있습니다.
튜브 테스트의 주요 결과 측정은 승패입니다. 그러나 다른 그룹은 각 경기의 길이와 각 경기 내의 하위 행동을 기록했습니다. 따라서 조사자는 각 테스트에서 얻은 데이터의 풍부함을 높이기 위해 이러한 정보를 수집하기를 원할 수 있습니다. Wang과 동료들은 케이지 내 위계질서에서 큰 차이가 있는 마우스를 짝지을 때 순위가 바짝 붙은 마우스를 짝지을 때보다 일치 항목이 더 짧다고 보고했으며, 이는 가장 우세한 마우스가 빠르게 매치에서 승리한다는 것을 보여주었습니다6. Zhou와 동료들은 튜브 테스트에서 "밀기 시작", "밀쳐내기", "저항" 및 "후퇴"와 같은 몇 가지 하위 행동을 점수화했으며, 이기는 쥐가 지는 쥐보다 더 많은 밀기와 저항에 참여하지만 덜 후퇴한다는 것을 발견했습니다17. 경기의 비디오 녹화가 필요하지는 않지만, 사회적 지배 행동에 대한 보다 자세한 분석에 관심이 있는 연구자는 각 경기를 기록하기를 원할 수 있습니다.
많은 행동 분석과 마찬가지로 튜브 검사는 사회적 행동과 관련이 없는 다른 결함으로 인해 혼동될 수 있습니다. 운동 장애는 튜브 테스트 성능에 영향을 미칠 수 있으므로 조사관은 rota-rod, open field, pole test 등과 같은 테스트를 통해 모터 표현형에 대한 기본 스크리닝을 수행하기를 원할 수 있습니다. 후각 신호는 생쥐의 사회적 행동의 중요한 측면이므로 30,31 연구자는 튜브 검사 행동에 영향을 미칠 수 있는 후각 결핍도 선별해야 합니다. 이를 수행하는 간단한 방법은 생쥐가 낯선 쥐의 소변과 물을 조사하는 데 소비하는 시간을 측정하는 것입니다9.
새로운 마우스 모델에서 사회적 행동을 특성화하는 연구자는 튜브 테스트를 사회적 테스트 배터리의 일부로 사용하는 것을 고려해야 합니다. 튜브 검사 이상이 있는 마우스 모델은 3-챔버 사회성 테스트, 거주자-침입자 테스트 및 사회적 상호 작용의 정성적 점수와 같은 다른 분석에서 종종 비정상적인 사회적 행동을 보입니다 9,10,11,12,13,14,15,20,27,32,33,34 ,35. 튜브 테스트에서의 사회적 우위는 이발, 소변 표시, 케이지 내 따뜻한 장소를 위한 경쟁과 같은 다른 작업에서의 사회적 우위와 상관관계가 있습니다 17,36,37. 그러나 음식, 물 또는 암컷 쥐에 대한 접근과 같은 다른 작업에서의 사회적 우위는 튜브 테스트의 사회적 우위와 상관관계가 낮았다 7,38. 일련의 테스트를 사용하여 연구자는 마우스 모델에서 사회적 지배력, 공격성, 사회적 조사 및 사회적 인식에 대한 측정값을 얻을 수 있습니다.
튜브 검사는 시간이 지남에 따라 사회적 지배 표현형의 안정성과 마우스를 반복적으로 테스트할 수 있는 능력으로 인해 Grn+/-마우스 모델에서 전임상 치료 접근법 22,23,25를 테스트할 때 1차 결과 측정으로 사용되었습니다. 튜브 테스트를 사용하여 중재를 선별하는 데 관심이 있는 연구자는 먼저 마우스 모델에서 반복 테스트를 통해 사회적 지배 표현형의 안정성을 결정해야 합니다. 이렇게 하려면 먼저 마우스를 테스트한 다음 하루, 일주일 또는 한 달 간격으로 동일한 일치 항목을 반복적으로 테스트합니다. 더 긴 실험 일정이 필요한 경우 이러한 반복을 훨씬 더 긴 간격으로 수행할 수 있습니다. 이러한 일치 간의 일치도는 테스트 간의 카파 값을 계산하여 통계적으로 결정될 수 있습니다. 튜브 테스트가 마우스 모델에서 적절한 안정성을 달성하면 단순성과 속도로 인해 이상적인 스크리닝 분석이 됩니다.
공개
Erik D. Roberson은 AGTC 및 Lilly의 컨설턴트로 재직했으며 Genentech로부터 로열티를 받았습니다.
감사의 말
마우스 번식 및 군집 유지 관리에 도움을 준 James Black과 Miriam Roberson, 튜브 테스트 파일럿 분석을 지원해 준 Anthony Filiano와 Alicia Hall, 프로그래눌린 녹아웃 마우스를 제공한 Robert Farese, Jr.에게 감사드립니다. 이 연구는 FTD 연구 컨소시엄 및 FTD 치료를 위한 블루필드 프로젝트, 국립 신경 장애 및 뇌졸중 연구소(R01NS075487, P30NS047466 및 F32NS090678) 및 국립 노화 연구소(P30AG086401, R00AG056597 및 K00AG068428)의 지원을 받았습니다. 행동 실험은 버밍엄에 있는 앨라배마 대학교의 동물 행동 평가 핵심 시설에서 수행되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Animals diet | Envigo | NIH-31 diet #7917 | Animals chow |
| CHLORHEXIDINE 2% SOLUTION 1GAL | Patterson Veterinary Supply INC | 78924243 | For cleaning tubes and surface |
| Ethanol 70% | Vion Biosciences | VNEE0069CS/4 | For cleaning tubes and surface |
| Large tube for male mice > 9 months old | Home Depot | Store SKU # 1000017942 | 1-7/8 in. O.D. x 1-1/2 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Medium tube for male mice 6–9 months old, female mice > 9 months old | Home Depot | Store SKU # 1000017945 | 1-5/8 in. O.D. x 1-1/4 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Small tube for male mice < 6 months old, female mice < 9 months old | Home Depot | Store SKU # 1000017938 | 1-3/8 in. O.D. x 1 in. I.D. x 24 in. Clear PVC Braided Vinyl Tube |
참고문헌
- Choi, T. Y., Jeong, S., Koo, J. W. Mesocorticolimbic circuit mechanisms of social dominance behavior. Exp Mol Med. 56 (9), 1889-1899 (2024).
- Fulenwider, H. D., Caruso, M. A., Ryabinin, A. E. Manifestations of domination: Assessments of social dominance in rodents. Genes Brain Behav. 21 (3), e12731(2022).
- Lindzey, G., Winston, H., Manosevitz, M. Social dominance in inbred mouse strains. Nature. 191, 474-476 (1961).
- Fan, Z., et al. Using the tube test to measure social hierarchy in mice. Nat Protoc. 14 (3), 819-831 (2019).
- Cum, M., et al. A multiparadigm approach to characterize dominance behaviors in CD1 and c57BL6 male mice. eNeuro. 11 (11), (2024).
- Wang, F., et al. Bidirectional control of social hierarchy by synaptic efficacy in medial prefrontal cortex. Science. 334 (6056), 693-697 (2011).
- Van De Weerd, H. A., Van Den Broek, F. A., Beynen, A. C. Removal of vibrissae in male mice does not influence social dominance. Behav Processes. 27 (3), 205-208 (1992).
- Arrant, A. E., Filiano, A. J., Warmus, B. A., Hall, A. M., Roberson, E. D. Progranulin haploinsufficiency causes biphasic social dominance abnormalities in the tube test. Genes Brain Behav. 15 (6), 588-603 (2016).
- Filiano, A. J., et al. Dissociation of frontotemporal dementia-related deficits and neuroinflammation in progranulin haploinsufficient mice. J. Neurosci. 33 (12), 5352-5361 (2013).
- Shahbazian, M., et al. Mice with truncated mecp2 recapitulate many Rett syndrome features and display hyperacetylation of histone h3. Neuron. 35 (2), 243-254 (2002).
- Spencer, C. M., Alekseyenko, O., Serysheva, E., Yuva-Paylor, L. A., Paylor, R. Altered anxiety-related and social behaviors in the fmr1 knockout mouse model of fragile x syndrome. Genes Brain Behav. 4 (7), 420-430 (2005).
- Irie, F., Badie-Mahdavi, H., Yamaguchi, Y. Autism-like socio-communicative deficits and stereotypies in mice lacking heparan sulfate. Proc Natl Acad Sci U S A. 109 (13), 5052-5056 (2012).
- Veenstra-Vanderweele, J., et al. Autism gene variant causes hyperserotonemia, serotonin receptor hypersensitivity, social impairment and repetitive behavior. Proc Natl Acad Sci U S A. 109 (14), 5469-5474 (2012).
- Jiang-Xie, L. F., et al. Autism-associated gene dlgap2 mutant mice demonstrate exacerbated aggressive behaviors and orbitofrontal cortex deficits. Mol Autism. 5, 32(2014).
- Huang, W. H., et al. Early adolescent rai1 reactivation reverses transcriptional and social interaction deficits in a mouse model of smith-magenis syndrome. Proc Natl Acad Sci U S A. 115 (42), 10744-10749 (2018).
- Rascovsky, K., et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain. 134 (Pt 9), 2456-2477 (2011).
- Zhou, T., et al. History of winning remodels thalamo-PFC circuit to reinforce social dominance. Science. 357 (6347), 162-168 (2017).
- Zhou, X., et al. Prosaposin facilitates sortilin-independent lysosomal trafficking of progranulin. J Cell Biol. 210 (6), 991-1002 (2015).
- Cook, A. K., et al. Dendritic spine head diameter is reduced in the prefrontal cortex of progranulin haploinsufficient mice. Mol Brain. 17 (1), 33(2024).
- Park, M. J., Seo, B. A., Lee, B., Shin, H. S., Kang, M. G. Stress-induced changes in social dominance are scaled by AMPA-type glutamate receptor phosphorylation in the medial prefrontal cortex. Sci Rep. 8 (1), 15008(2018).
- Tada, H., et al. Neonatal isolation augments social dominance by altering actin dynamics in the medial prefrontal cortex. Proc Natl Acad Sci U S A. 113 (45), E7097-E7105 (2016).
- Arrant, A. E., Filiano, A. J., Unger, D. E., Young, A. H., Roberson, E. D. Restoring neuronal progranulin reverses deficits in a mouse model of frontotemporal dementia. Brain. 140 (5), 1447-1465 (2017).
- Kurnellas, M., et al. Latozinemab, a novel progranulin-elevating therapy for frontotemporal dementia. J Transl Med. 21 (1), 387(2023).
- Ueno, H., et al. Effects of repetitive gentle handling of male c57bl/6ncrl mice on comparative behavioural test results. Sci Rep. 10 (1), 3509(2020).
- Arrant, A. E., Nicholson, A. M., Zhou, X., Rademakers, R., Roberson, E. D. Partial tmem106b reduction does not correct abnormalities due to progranulin haploinsufficiency. Mol Neurodegener. 13 (1), 32(2018).
- Chachua, T., et al. Sex-specific behavioral traits in the BRD2 mouse model of juvenile myoclonic epilepsy. Genes Brain Behav. 13 (7), 702-712 (2014).
- Lijam, N., et al. Social interaction and sensorimotor gating abnormalities in mice lacking dvl1. Cell. 90 (5), 895-905 (1997).
- Nishimura, I., Yang, Y., Lu, B. Par-1 kinase plays an initiator role in a temporally ordered phosphorylation process that confers tau toxicity in drosophila. Cell. 116 (5), 671-682 (2004).
- Zhang, C., et al. Dynamics of a disinhibitory prefrontal microcircuit in controlling social competition. Neuron. 110 (3), 516-531.e6 (2022).
- Lin, D. Y., Zhang, S. Z., Block, E., Katz, L. C. Encoding social signals in the mouse main olfactory bulb. Nature. 434 (7032), 470-477 (2005).
- Matsuo, T., et al. Genetic dissection of pheromone processing reveals main olfactory system-mediated social behaviors in mice. Proc Natl Acad Sci U S A. 112 (3), E311-E320 (2015).
- Koh, H. Y., Kim, D., Lee, J., Lee, S., Shin, H. S. Deficits in social behavior and sensorimotor gating in mice lacking phospholipase cbeta1. Genes Brain Behav. 7 (1), 120-128 (2008).
- Long, J. M., Laporte, P., Paylor, R., Wynshaw-Boris, A. Expanded characterization of the social interaction abnormalities in mice lacking dvl1. Genes Brain Behav. 3 (1), 51-62 (2004).
- Moretti, P., Bouwknecht, J. A., Teague, R., Paylor, R., Zoghbi, H. Y. Abnormalities of social interactions and home-cage behavior in a mouse model of Rett syndrome. Hum Mol Genet. 14 (2), 205-220 (2005).
- Nishijima, I., et al. Secretin receptor-deficient mice exhibit impaired synaptic plasticity and social behavior. Hum Mol Genet. 15 (21), 3241-3250 (2006).
- Rodriguiz, R. M., Chu, R., Caron, M. G., Wetsel, W. C. Aberrant responses in social interaction of dopamine transporter knockout mice. Behav Brain Res. 148 (1-2), 185-198 (2004).
- Greenberg, G. D., Howerton, C. L., Trainor, B. C. Fighting in the home cage: Agonistic encounters and effects on neurobiological markers within the social decision-making network of house mice (mus musculus. Neurosci Lett. 566, 151-155 (2014).
- Benton, D., Dalrymple-Alford,, John, C., Brain, P. F. Comparisons of measures of dominance in the laboratory mouse. Anim Behav. 28, 1274-1279 (1980).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유