Method Article
Bewertung der sozialen Dominanz in Mausmodellen mit dem Röhrentest
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt einen Verhaltenstest zur Bewertung der sozialen Dominanz bei Nagetieren mit Hilfe des Röhrchentests. Die soziale Dominanz bleibt über die Zeit stabil, und mehrere Modelle von Entwicklungsstörungen und neurologischen Störungen weisen robuste Anomalien der sozialen Dominanz auf. Daher dient der Röhrchentest als geeignetes Ergebnismaß für mechanistische Studien oder präklinische therapeutische Screenings.
Zusammenfassung
Die soziale Dominanz ist bei neurologischen Entwicklungsstörungen und neurodegenerativen Erkrankungen verändert und dient als nützliches Ergebnismaß in präklinischen Studien zu diesen Erkrankungen. Der Röhrchentest ist ein einfacher Verhaltenstest zur Bewertung sozialer Dominanz, der keine teuren Geräte erfordert. In diesem Test dringen zwei Mäuse in entgegengesetzte Enden eines durchsichtigen Plastikröhrchens ein, und nachdem sie sich in der Mitte getroffen haben, muss eine (die weniger dominante) zurückweichen. Der Röhrchentest kann sowohl für männliche als auch für weibliche Mäuse verwendet werden und umfasst mehrere anpassbare Parameter, die an die Bedürfnisse des Untersuchers angepasst werden können. Mäuse können gegen mehrere einzigartige Gegner getestet werden, um einen Index für soziale Dominanz zu erhalten. Die soziale Dominanz im Röhrchentest bleibt bei wiederholten Tests stabil und korreliert mit der Leistung in anderen sozialen Assays. Darüber hinaus kann der Test zwischen Käfiggenossen durchgeführt werden, um die sozialen Dominanzhierarchien innerhalb des Käfigs zu bewerten. Der Röhrchentest ist besonders nützlich in präklinischen therapeutischen Studien, da er Längsschnitttests vor und nach experimentellen Eingriffen ermöglicht. Daher dient es als geeignetes Ergebnismaß für mechanistische Studien und präklinische therapeutische Screenings.
Einleitung
Die Störung des Sozialverhaltens ist ein Merkmal vieler menschlicher Störungen, einschließlich Entwicklungsstörungen, psychiatrischer und neurodegenerativer Störungen 1,2. Mausmodelle werden verwendet, um Einblicke in die Pathogenese dieser Erkrankungen zu gewinnen und eine Plattform für die präklinische Erprobung von Therapeutika bereitzustellen. Viele Assays für das Sozialverhalten von Mäusen sind jedoch zeitaufwändig durchzuführen, erfordern teure Geräte und/oder Video-Tracking-Software zur Analyse oder verfügen über subjektive Bewertungsalgorithmen. Im Gegensatz dazu ist der Röhrentest auf soziale Dominanz schnell und einfach durchzuführen und erfordert keine spezielle Ausrüstung oder Videoverfolgung. Der Assay hat ein binäres Gewinn/Verlierer-Ergebnis, was die Interpretation der Ergebnisse einfach macht.
Der Röhrentest für soziale Dominanz wurde von Lindzey und Kollegen entwickelt, um die soziale Dominanz bei Mäusen zu beurteilen3. Seit seiner Entwicklung hat sich der Röhrentest auch als Mittel zur Bewertung sozialer Dominanzhierarchien innerhalb von Käfigen etabliert4. Die Phänotypen von Röhrchentests korrelieren mit anderen Maßen sozialer Dominanz wie Friseur, Belohnungswettbewerb und Urinproduktion bei männlichen Mäusen5. Es gibt jedoch gemischte Ergebnisse des Röhrchentests und seiner Korrelation mit der Konkurrenz um den Zugang zu Nahrung und Wasser und der Aggression 3,6,7. Wichtig ist, dass die Phänotypen von Röhrchentests mit anderen sozialen Phänotypen wie der Dreikammer-Geselligkeit korrelieren 8,9.
Ein Vorteil des Röhrentests besteht darin, dass seine Anatomie gut definiert ist, was ihn besonders nützlich für verschiedene Mausmodelle macht, einschließlich Modellen von Autismus-Spektrum-Störungen und anderen Krankheiten, die durch soziale Defizite gekennzeichnet sind, wie z. B. frontotemporale Demenz 8,9,10,11,12,13,14,15,16 . Der mediale präfrontale Kortex (mPFC) ist ein wichtiger Mediator des Testverhaltens von Mausröhrchen6. Wang und Kollegen zeigten, dass die Aktivität im mPFC die soziale Dominanz bei Mäusen antreibt6, und neuere Daten haben diese Erkenntnis verfeinert, indem sie zeigten, dass der mediodorsale thalamische Input in den prälimbischen und anterioren cingulären Kortex die soziale Dominanz antreibt17. In Übereinstimmung mit einer Schlüsselrolle des mPFC bei der sozialen Dominanz von Röhrentests, Anomalien in dendritischen Dornen, dendritischen Dornen, Glutamatrezeptoren und/oder neuronaler Erregbarkeit wurde der mPFC mit Anomalien bei Röhrentests in Nagetiermodellen für Autismus-Spektrum-Störungen15,18, frontotemporale Demenz 8,19, chronischen Stress 20 und soziale Isolation 21 in Verbindung gebracht.
Ein weiterer wichtiger Vorteil des Röhrentests ist die Möglichkeit, die soziale Dominanz sowohl vor als auch nach der therapeutischen Intervention zu testen, da die soziale Dominanz der Maus im Röhrentest über die Zeit stabil ist, was wiederholte Tests sowohl vor als auch nach einer experimentellen Intervention ermöglicht 6,8,22,23. Ein Beispiel dafür sind Progranulin-heterozygote (Grn+/−) Mausmodelle der frontotemporalen Demenz, die durch Progranulin (GRN)-Mutationen, eine Haploinsuffizienzkrankheit, verursacht wird. Progranulin-heterozygote Mäuse haben ein soziales Dominanzdefizit8. Dieses Defizit im Röhrchentest kann durch Wiederherstellung von Progranulin entweder mit AAV-Progranulin-Gentherapie22 oder durch Verabreichung von Anti-Sortilin-Antikörpern zur Verringerung des Progranulinabbaus23 rückgängig gemacht werden. Diese Beispiele zeigen die Nützlichkeit des Röhrchentests bei der Gestaltung präklinischer Studien für die Demenzforschung.
Dieses Protokoll bietet grundlegende Methoden für die Durchführung des Röhrchentests zwischen Nicht-Käfigen, um Unterschiede zwischen Versuchsgruppen zu bewerten, und zwischen Käfigen, um soziale Dominanzhierarchien innerhalb des Käfigs zu bewerten.
Protokoll
Alle Versuchsverfahren wurden vom Institutional Animal Care and Use Committee der University of Alabama in Birmingham genehmigt und in Übereinstimmung mit der Association for Assessment and Accreditation of Laboratory Animal Care (AAALAC) durchgeführt. Progranulin-heterozygote Mäuse wurden erzeugt und auf einen C57BL/6J-Hintergrund gekreuzt, wie zuvor beschrieben9. Die für diese Studie verwendeten Mäuse waren über mindestens 12 Generationen auf den C57BL/6J-Hintergrund rückgekreuzt worden. In den Stichprobendaten wurden Mäuse im Alter von 9 bis 16 Monaten verwendet. In dieser Studie wurden sowohl Männer als auch Frauen verwendet. Die Mäuse wurden in einem Hell-Dunkel-Zyklus von 12:12 Uhr gehalten, wobei das Licht um 06:00 Uhr eingeschaltet wurde, und alle Tests wurden während der Lichtphase durchgeführt. Die Mäuse erhielten während aller Experimente ad libitum Zugang zu Nahrung und Wasser. Die Details zu den Reagenzien und den verwendeten Geräten sind in der Materialtabelle aufgeführt.
1. Design des Rohrtest-Match-Designs
- Planen Sie die Röhrchentestspiele vor dem Testen. Stellen Sie sicher, dass es keine Genotyp-Notiz gibt, die den Experimentator für Gruppen blind hält (siehe Ergänzende Tabelle 1).
HINWEIS: Wir testen Mäuse in der Regel gegen 3 einzigartige Gegner der entgegengesetzten Versuchsgruppe 8,9,22,23, aber einige Studien berichten von Tests gegen mehr Gegner 10,11,13. - Ausgleich zur Zuordnung von Versuchsmäusen zur linken und rechten Seite des Röhrchens, um mögliche Störeffekte durch Seitenverzerrung zu vermeiden.
- Minimieren Sie beim Testen von Nicht-Käfigen die Bewegung der Käfige, um zu vermeiden, dass die Mäuse mehr als nötig gestresst werden. Um Käfigbewegungen zu minimieren, überlappen Sie Übereinstimmungen zwischen denselben beiden Käfigen so weit wie möglich.
- Wenn Sie Käfigkameraden testen, testen Sie jede Maus aus einem Käfig gegen jede andere Maus in einer Round-Robin-Methode. Wenn Sie den Test über mehrere Tage wiederholen, sollte die Seite des Röhrchens, in die die Maus eintreten soll (d. h. links oder rechts), von Tag zu Tag gewechselt werden.
2. Auswahl der Schläuche
HINWEIS: In der Regel wird der Röhrchentest mit handelsüblichen durchsichtigen Kunststoffschläuchen aus PVC durchgeführt (siehe Materialtabelle). Es ist wichtig zu beachten, dass dieses Protokoll für Mäuse optimiert ist, aber auch auf andere Nagetiermodelle wie Ratten, Wühlmäuse und Hamster angewendet werdenkann 2.
- Schneiden Sie den PVC-Schlauch auf eine Länge von 30,5 cm zu. PVC-Schläuche sind leicht flexibel und werden oft in Rollen gelagert, so dass sie vor dem Gebrauch möglicherweise gerade gerichtet werden müssen. Leichtes Erhitzen hilft, gebogene Rohre zu begradigen.
- Der Innendurchmesser des Rohres ist entscheidend für den Erfolg des Tests. Stellen Sie sicher, dass die Röhre groß genug ist, damit sich die Mäuse hindurchbewegen können, aber nicht groß genug, damit sich die Mäuse übereinander kreuzen können.
HINWEIS: Der Test funktioniert nicht, wenn die Röhre groß genug ist, dass die Mäuse aneinander vorbeigehen können, ohne sich in einen sozialen Dominanzwettbewerb zu verwickeln. Im Folgenden finden Sie ungefähre Richtlinien für geeignete Röhrchengrößen bei C57BL/6J-Mäusen: (1) 1 Zoll/2,5 cm Innendurchmesser (ID) für männliche Mäuse <6 Monate alt, weibliche Mäuse <9 Monate alt; (2) 1,25 Zoll/3,2 cm ID für männliche Mäuse im Alter von 6-9 Monaten, weibliche Mäuse im Alter von >9 Monaten; und (3) 1,5 Zoll/3,5 cm ID für männliche Mäuse im Alter von >9 Monaten. - Wenn möglich, verwenden Sie für alle Tests innerhalb einer Gruppe von Mäusen ein Röhrchen der gleichen Größe. Wenn sich Mäuse während der ersten Spiele kreuzen, führen Sie alle folgenden Spiele mit dem nächstkleineren Röhrchen durch.
3. Prüfort
- Führen Sie den Röhrentest auf einer flachen, stabilen Oberfläche oder gefilterten Haube unter Umgebungslicht durch.
HINWEIS: Der Test wird in der Regel tagsüber zwischen 8 und 17 Uhr durchgeführt. In Fällen, in denen Mäuse über mehrere Tage getestet werden, sollte jede Maus für jeden Test zur gleichen Tageszeit getestet werden (z. B. zwischen 11 und 15 Uhr). Unseres Wissens nach wurden die Auswirkungen der Tageszeit bisher nicht untersucht. - Führen Sie den Röhrchentest an einem ruhigen Ort mit minimalen äußeren Reizen durch. Im Idealfall sollte der Ermittler die einzige Person im Raum sein.
4. Gewöhnung
- Die Gewöhnung ist eine wichtige Praxis bei Verhaltensassays, die es Mäusen ermöglicht, sich mit der Testumgebung vertraut zu machen, was zu konsistenteren und zuverlässigeren Ergebnissen führen kann24. Für den Röhrchentest gewöhnen Sie die Mäuse vor dem Test an den Testraum. Wenn der Test nicht im Stallraum der Tiere durchgeführt wird, lassen Sie die Mäuse mindestens 1 Stunde Zeit, sich an den neuen Raum zu gewöhnen, bevor Sie testen.
- (Fakultativ) Falls gewünscht, können die Mäuse vor dem Test an das Röhrchen gewöhnt werden. Um sich an die Röhre zu gewöhnen, legen Sie die Maus ohne Gegenspieler in die Röhre und lassen Sie sie 2-3 Mal, 2-3 Tage vor dem Test, durch die Röhre gehen. Das ist nicht unsere übliche Praxis.
5. Standard-Röhrchentest
HINWEIS: (Optional) Untersucher, die neu im Röhrchentest sind, möchten möglicherweise das Einsetzen von Mäusen in das Röhrchen mit einer separaten, nicht experimentellen Gruppe von Mäusen üben. Die Forscher müssen oft üben, Mäuse in die Röhre zu legen. Ein erfahrener Untersucher wird bei den Mäusen, die sich dem Test unterziehen, weniger Stress hervorrufen. Weitere Informationen zum Einsetzen von Mäusen in das Röhrchen finden Sie in Schritt 5.3.
- Alle Käfige mit Mäusen des gleichen Geschlechts, die getestet werden sollen, sind auf einen Wagen zu stellen. Transportieren Sie die Käfige zum Prüfbereich. Reinigen Sie die Röhrchen und den Prüfbereich mit 2 % Chlorhexidin und 70 % Ethanol. Die Röhrchen lassen sich einfach mit einer serologischen 50-ml-Pipette reinigen, indem ein Papiertuch durch das Röhrchen geschoben wird.
- Stellen Sie die beiden Käfige für das erste Spiel auf die Testfläche. Nehmen Sie die Deckel ab und platzieren Sie sie neben jedem Käfig.
- Suchen Sie die beiden Mäuse, die getestet werden sollen. Halten Sie eine Maus in jeder Hand, entsprechend der ihr zugewiesenen Seite der Röhre. Nachdem du die erste Maus gefunden hast, halte vorsichtig ihren Schwanz fest und halte sie im Käfig, während du nach der zweiten suchst.
HINWEIS: Wenn Sie den Schwanz der Maus nahe der Mitte ihrer Länge halten, kann der Untersucher die Maus sanft steuern, ohne sie zu fest zu fesseln. Halten Sie die Maus so, dass alle vier Pfoten auf der Käfigeinstreu bleiben, um die Maus nicht unnötig zu belasten. - Nehmen Sie beide Mäuse gleichzeitig aus jedem Käfig und platzieren Sie sie vorsichtig mit dem Kopf am Eingang des Röhrchens.
HINWEIS: Wenn die Mäuse daran gewöhnt wurden oder bereits Testerfahrung haben, treten sie in der Regel innerhalb weniger Sekunden in die Röhre ein. Wenn die Mäuse der Röhre gegenüber naiv sind, zögern sie möglicherweise, an der ersten Studie teilzunehmen. Bei Bedarf können die Mäuse auf die nächstgrößere Röhre umgeschaltet werden, um den Eintritt in die Röhre zu fördern. - Halten Sie den Schwanz jeder Maus fest, um zu verhindern, dass die Mäuse vorzeitig Kontakt aufnehmen. Achten Sie darauf, dass die Mäuse nicht in das Röhrchen gedrückt werden. Sobald sie jedoch beginnen, in die Röhre einzudringen, können sie sanft angestoßen werden, um den vollständigen Eintritt in die Röhre zu fördern.
- Wenn beide Mäuse in das Röhrchen eingedrungen sind, lassen Sie die Schwänze los und entfernen Sie sich vom Röhrchen (Abbildung 1A). Beide Mäuse sollten in die Röhre vorstoßen und sich in der Nähe der Mitte treffen (Abbildung 1B).
- Beobachten Sie das Spiel und notieren Sie den Gewinner und Verlierer. Eine Maus gilt als das Spiel verloren, wenn zwei ihrer Pfoten die Röhre verlassen und die Testoberfläche berühren (Abbildung 1C).
HINWEIS: In der Regel stößt eine Maus die andere aus der Röhre, obwohl einige Mäuse nach Kontakt mit der gegnerischen Maus einen ungezwungenen Rückzug ausführen. Gelegentlich ziehen sich beide Mäuse gleichzeitig zurück, oder eine Maus zieht sich unmittelbar nach dem Eintritt in die Röhre zurück, ohne die gegnerische Maus zu berühren. Wenn eines dieser Ereignisse eintritt, legen Sie beide Mäuse wieder in das Röhrchen und starten Sie das Spiel erneut. Die Mäuse führen in der Regel beim zweiten Versuch eine standardmäßigere Übereinstimmung durch. Wenn sich keine der Mäuse innerhalb von 2 Minuten zurückgezogen hat, brechen Sie das Spiel ab und führen Sie es am Ende der Sitzung erneut aus.
- Beobachten Sie das Spiel und notieren Sie den Gewinner und Verlierer. Eine Maus gilt als das Spiel verloren, wenn zwei ihrer Pfoten die Röhre verlassen und die Testoberfläche berühren (Abbildung 1C).
- Nachdem das Spiel vorbei ist, bringe die Mäuse in ihre Heimatkäfige zurück. Reinigen Sie das Röhrchen und die Prüffläche mit 70 % Ethanol.
- Fahren Sie mit dem in Schritt 1 beschriebenen Design fort. Jede Runde beginnt unmittelbar nach der vorhergehenden Runde. Wenn alle Spiele eines Geschlechts durchgeführt wurden, stellen Sie die Käfige wieder auf den Gestell / Wagen und testen Sie die Mäuse des anderen Geschlechts mit dem gleichen Verfahren.
- Reinigen Sie die Testoberfläche und die Schläuche zwischen weiblichen und männlichen Mäusen gründlich. Reinigen Sie nach Abschluss des Tests sowohl die Röhrchen als auch den Testbereich mit 2 % Chlorhexidin.
- Zählen Sie für die statistische Analyse die Anzahl der Siege für jede Gruppe, und analysieren Sie sie mithilfe des Binomialtests, um die beobachtete und die erwartete Verteilung zu vergleichen, wobei die erwartete Verteilung auf 50 % der Gewinne für jede Gruppe festgelegt ist.
- Berechnen Sie den Gewinnprozentsatz für jede Maus, indem Sie die Anzahl der Siege durch die Anzahl der Übereinstimmungen dividieren (in der Regel drei Spiele, es sei denn, ein Spiel wurde aufgrund einer fehlenden Maus oder anderer Probleme abgebrochen). Vergleichen Sie den Gewinnprozentsatz für jede Gruppe mit dem Mann-Whitney-Test.
HINWEIS: Wenn diese Übereinstimmungen wiederholt werden, führen sie zu ähnlichen Ergebnissen, wenn keine zusätzlichen experimentellen Manipulationen vorgenommen werden. In einer früheren Studie wurde beispielsweise beobachtet, dass 40 von 47 Spielen das gleiche Ergebnis lieferten, wenn sie an aufeinanderfolgenden Tagen durchgeführt wurden8.
- Berechnen Sie den Gewinnprozentsatz für jede Maus, indem Sie die Anzahl der Siege durch die Anzahl der Übereinstimmungen dividieren (in der Regel drei Spiele, es sei denn, ein Spiel wurde aufgrund einer fehlenden Maus oder anderer Probleme abgebrochen). Vergleichen Sie den Gewinnprozentsatz für jede Gruppe mit dem Mann-Whitney-Test.
6. Inner-Käfig-Röhrentest zur Bewertung sozialer Dominanzhierarchien
HINWEIS: Mäuse bilden stabile soziale Dominanzhierarchien, die durch Ringversuche aller Mäuse in einem Käfig aufgedeckt werdenkönnen 4,6. Sowohl männliche als auch weibliche Mäuse bilden diese Hierarchien8. Soziale Dominanzhierarchien lassen sich am besten in Käfigen mit mindestens 5 Mäusen beurteilen.
- Planen Sie Übereinstimmungen im Voraus, mit Ausgleich, wie in Schritt 1 beschrieben.
- Führen Sie Röhrchentestübereinstimmungen durch, wie in Schritt 5 beschrieben. Testen Sie einen Käfig nach dem anderen und testen Sie alle Mäuse im Round-Robin-Verfahren. Reinigen Sie die Tube und den Testbereich zwischen jedem Spiel mit 70 % Ethanol.
- Testen Sie jeden Käfig mindestens 5 Tage lang einmal täglich, um die stabile Rangfolge jeder Maus zu ermitteln.
- Bewerten Sie für die statistische Analyse die Anzahl der Gewinne pro Maus. Ordnen Sie jede Maus nach der Anzahl der Gewinne.
7. Verwendung des Röhrchentests für das präklinische therapeutische Screening
HINWEIS: Die Robustheit und Stabilität der Phänotypen der sozialen Dominanz in vielen Mausmodellen sowie die einfache Durchführung des Tubentests machen den Tubentest zu einem nützlichen Paradigma für die präklinische Erprobung therapeutischer Strategien. Zu diesem Zweck kann der Röhrchentest mit einem tierinternen Design durchgeführt werden, da der Test seriell durchgeführt werden kann. Es ist auch möglich, ein Cross-Over-Design mit dem Medikament durchzuführen und dann zu kontrollieren oder umgekehrt. Der Röhrentest wurde zuvor zur Bewertung von Progranulin-boostenden Therapien bei Grn+/− Mäusen verwendet22,23, was zeigte, dass die Phänotypen der sozialen Dominanz in diesem Mausmodell reversibel sind. Zur Verdeutlichung der folgenden Diskussion werden Mäuse als "Kontrolle" (Wildtyp, nicht-transgen, etc.) oder "Modell" (Knockout, transgen, etc.) beschrieben, und experimentelle Interventionen werden entweder als "Vehikel" oder "behandelt" (therapeutische Intervention) beschrieben. Während Mäuse im Folgenden als "Kontrolle" und "Modell" bezeichnet werden, ist es ideal, für jede dieser Gruppen Wurfgeschwister zu verwenden.
- Führen Sie vor einer experimentellen Intervention einen Vortest durch, um das Vorhandensein des erwarteten Phänotyps der sozialen Dominanz in den Modellmäusen zu bestätigen, die für den Test verwendet werden sollen. Testen Sie den gesamten Pool von Kontroll- und Modellmäusen gegeneinander und verwenden Sie diese Daten, um Mäuse Behandlungsgruppen zuzuordnen, um sicherzustellen, dass die Gruppen zu Studienbeginn ausgewogen sind.
- Je nach Therapeutikum können unterschiedliche Behandlungsdauern erforderlich sein. Wenn es sich bei dem Medikament beispielsweise um ein AAV handelt, lassen Sie die Mäuse sich von der Operation erholen und haben Sie Zeit, damit das Medikament seine Wirkung entfalten kann. Wenn es sich bei dem Medikament um ein kleines Molekül handelt, bestimmen Sie die Behandlungsparadigmen vor dem Röhrchentest22.
- Ordnen Sie Mäuse Versuchsgruppen zu, so dass Vehikel- und behandelte Mäuse jedes Genotyps zu Beginn Phänotypen der sozialen Dominanz in ähnlichem Ausmaß aufweisen. Wenn Mäuse mehrmals gegen mehrere Gegner getestet werden, kann der Gewinnprozentsatz jeder Maus (beschrieben in Schritt 5.9) verwendet werden, um zwei Gruppen mit ähnlichen Phänotypen zu bilden.
- Für eine wirklich zufällige Verteilung der Mäuse in Gruppen auf der Grundlage der ANARRIVE-Richtlinien verwenden Sie ein Block-Randomisierungsprotokoll, das auf dem Gewinnerprozentsatz jeder Maus basiert8.
- Nachdem die Gruppen eingeteilt wurden, testen Sie die Mäuse zu mehreren Zeitpunkten während der Behandlung. Einzelheiten zu den in der Regel durchgeführten Vergleichen finden Sie in der folgenden Anmerkung:
HINWEIS: (1) Fahrzeugsteuermäuse vs. Fahrzeugmodellmäuse (dies ist ein Kontrollvergleich, um zu zeigen, dass die Fahrzeugbehandlung den Phänotyp des Mausmodells nicht verschleiert); (2) Fahrzeugsteuerungsmäuse vs. behandelte Modellmäuse (dies testet die Hypothese, dass sich die behandelten Modellmäuse von normalen Kontrollen unterscheiden); (3) Fahrzeugmodell-Mäuse vs. behandelte Modellmäuse (dies testet die Hypothese, dass die Behandlung den Phänotyp des Mausmodells verändert); (4) Fahrzeugsteuerungsmäuse vs. Behandelte Kontrollmäuse (dies ist ein Kontrollvergleich, um die Auswirkungen der Behandlung bei Mäusen ohne Phänotyp der sozialen Dominanz zu bestimmen). - In der Regel werden die Tests über zwei Tage mit ca. 6 Übereinstimmungen pro Tag durchgeführt, wobei die Vergleiche (1-4) in Schritt 7.4 erwähnt werden. Um übermäßige Tests zu vermeiden, führen Sie die Vergleiche (1) und (2) an Tag 1 und die Vergleiche (3) und (4) an Tag 2 durch. Da die Fahrzeugkontrollmäuse an Tag 1 gegen beide Modellgruppen getestet werden, müssen die Übereinstimmungen jedes Vergleichs eingestreut werden.
- Nachdem der Test abgeschlossen ist, bringen Sie die Mäuse in ihre Heimkäfige zurück. Reinigen Sie das Röhrchen und die Prüffläche mit 70 % Ethanol.
Ergebnisse
Der Röhrchentest wurde ausgiebig in einem Mausmodell der frontotemporalen Demenz aufgrund von Progranulin-Mutationen eingesetzt, Grn+/- Mäuse 8,9,22,23,25. Diese Mäuse zeigen im Alter von 9 Monaten eine geringe soziale Dominanz (Abbildung 2A-D)8. Der Phänotyp mit geringer sozialer Dominanz älterer Grn+/−-Mäuse ist durch wiederholte Tests stabil (Abbildung 2A)8, was ihn zu einem robusten experimentellen Ergebnismaßmacht 22,25.
Tests innerhalb des Käfigs wurden auch an Grn+/−-Mäusen durchgeführt, um die Hierarchien der sozialen Dominanz zwischen den Käfigen zu untersuchen (Abbildung 3A-D)8. Wichtig ist, dass sowohl männliche (Abbildung 3A,B) als auch weibliche (Abbildung 3C,D) Mäuse diese Hierarchien bilden, und Grn+/−-Mäuse zeigen auch eine geringe soziale Dominanz unter ihren Käfigtieren (Abbildung 3E). Interessanterweise wiesen Grn//-Mäuse diese Anomalie nicht auf (Abbildung 3E).
Der Phänotyp der geringen sozialen Dominanz, den ältere Grn+/− -Mäuse aufweisen (Abbildung 2), macht sie zu einem attraktiven Ergebnismaß für Progranulin-boostende therapeutische Interventionen. Vor der AAV-Injektion zeigen Grn+/- Mäuse einen Phänotyp mit geringer sozialer Dominanz (Abbildung 4A). Grn+/− Mäuse, denen ein Kontrollvirus injiziert wurde, zeigen immer noch einen Phänotyp mit geringer Dominanz (Abbildung 4B). Grn+/− Mäuse, denen ein Virus injiziert wurde, um den Progranulinspiegel zu erhöhen, haben nicht mehr den Phänotyp mit geringer sozialer Dominanz (Abbildung 4C). Beim Vergleich von Grn+/- Mäusen, die mit Kontroll-AAV injiziert wurden, mit Grn+/- Mäusen, die mit Progranulin-verstärkendem AAV injiziert wurden, zeigten Grn+/- Mäuse, denen Kontroll-AAV injiziert wurde, eine geringe soziale Dominanz (Abbildung 4D).

Abbildung 1: Schematische Darstellung des Röhrchentests. (A) Die Experimentatoren lassen die Mäuse frei, sobald sie mit allen vier Pfoten in die Röhre eingedrungen sind. Das Rohr sollte klein genug sein, dass sich eine Maus nicht umdrehen oder über eine andere Maus klettern kann. (B) Beide Mäuse bewegen sich dann in die Mitte der Röhre, wo sie sich treffen. (C) Die dominantere Maus bleibt in der Röhre, während die weniger dominante Maus sich zurückzieht. Die Maus wird als Verlierer gezählt, sobald zwei Pfoten die Röhre verlassen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Repräsentative Ergebnisse mit dem Tubentest zur Identifizierung eines Phänotyps der sozialen Dominanz. Diese Studie wurde im Grn+/- Mausmodell der frontotemporalen Demenz durchgeführt. Die Mäuse wurden 3 Runden gegen 3 neuartige Gegner getestet, wie in Schritt 1 beschrieben. Es werden verschiedene Möglichkeiten zur Darstellung der Daten aufgezeigt. (A) Grn+/− Mäuse im Alter von über 9 Monaten haben einen Phänotyp mit geringer sozialer Dominanz, der bei wiederholten Tests stabil ist (* = Binomialtest, p < 0,05; die Datenpunkte stellen prozentuale Gewinne jedes Genotyps dar). (B) Aggregierte Daten aus den drei Testrunden, die die prozentualen Gesamtgewinne pro Genotyp darstellen (*** = Binomialtest, p = 0,0004). (C) Zeichnen Sie die Anzahl der Gewinne mit jeder Maus in allen 3 Spielen auf. Grn+/− Mäuse hatten eine geringere Anzahl von Siegen (**** = Mann-Whitney-Test, p < 0,0001). Jeder Punkt ist eine Maus. (D) Darstellung des Prozentsatzes der Mäuse in jedem Genotyp mit einem bestimmten Gewinnprozentsatz. Grn+/- Mäuse hatten mit größerer Wahrscheinlichkeit eine niedrige Gewinnquote. (**** = Mann-Whitney-Test, S . < 0,0001). 9–16 Monate alte Mäuse, n = 58 Mäuse pro Gruppe. Die Daten werden mit Genehmigung von Arrant et al.8 angepasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
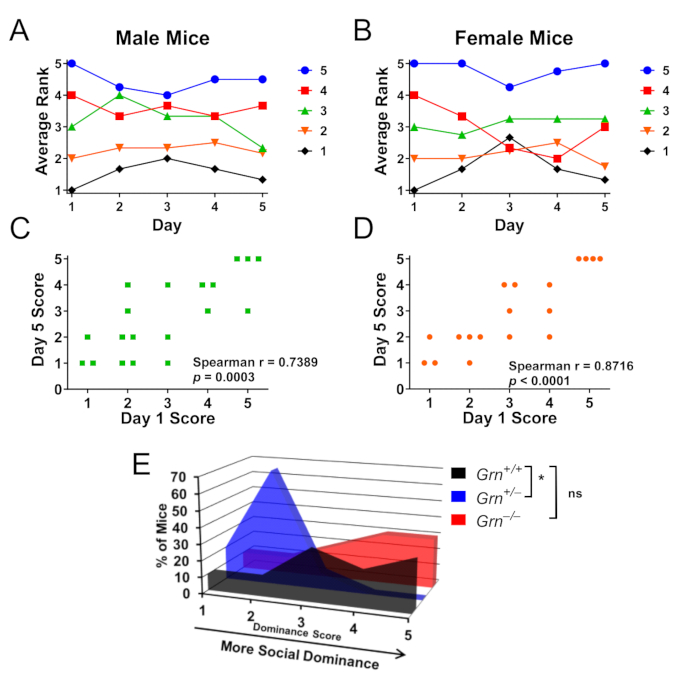
Abbildung 3: Repräsentative Ergebnisse mit dem Röhrchentest zur Bestimmung der sozialen Dominanzhierarchie innerhalb des Käfigs. Käfige mit männlichen oder weiblichen Mäusen (n = 4 Käfige pro Geschlecht zu je 4–5 Mäusen) wurden 5 Tage lang im Ringverfahren getestet, um die soziale Dominanzhierarchie testen zu können. (A,B) Die Werte für die soziale Dominanz von männlichen und weiblichen Mäusen wurden durch die Anzahl der Siege bestimmt, wobei 5 die dominanteste Maus und 1 die am wenigsten dominante Maus in jedem Käfig war. An Tag 5 blieben sowohl männliche (A) als auch weibliche (B) Mäuse im Durchschnitt innerhalb eines Rangs ihrer ursprünglichen Punktzahl. Die Farbcodierung erfolgt nach Tag-1-Rangliste. (C, D) Der Rang an Tag 5 hatte für beide Geschlechter eine hochsignifikante Korrelation mit dem Rang an Tag 1. (E) Unter Verwendung dieses Inner-Käfig-Paradigmas zur Bewertung von Käfigen, in denen Grn+/+, Grn+/− und Grn-//− -Mäuse zusammen gehalten wurden, zeigten Grn+/−-Mäuse auch eine geringe soziale Dominanz (Kruskal-Wallis-Test, p = 0,0063, * = p < 0,05 nach Dunns Post-hoc-Test). Interessanterweise wurde bei Grn-/- Mäusen keine geringe soziale Dominanz beobachtet. Die Daten wurden mit Genehmigung von Arrant et al., 20168 angepasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentative Ergebnisse unter Verwendung des Röhrchentests zur Bewertung der präklinischen therapeutischen Wirksamkeit. (A) In den Ausgangstests vor der AAV-Injektion zeigten Grn+/− Mäuse eine geringe soziale Dominanz (* = Mann-Whitney-Test, p = 0,0157; oder * = Binomialtest, p = 0,0281). Mittels Blockrandomisierung wurden die Mäuse dann entweder in Behandlungsgruppen eingeteilt, entweder in ein AAV zur Erhöhung des Progranulin-Proteinspiegels (AAV-Grn) oder in ein Kontroll-AAV (AAV-GFP). (B) Grn+/− Mäuse, denen die Kontroll-AAV-GFP injiziert wurde, wiesen eine geringe soziale Dominanz auf (* = Mann-Whitney-Test, p = 0,0196; oder * = Binomialtest, p = 0,0330). (C) Grn+/− Mäuse, denen das AAV-Grn injiziert wurde, hatten keine geringe soziale Dominanz mehr. (D) Beim Vergleich von Grn+/−-Mäusen, die mit AAV-GFP injiziert wurden, mit AAV-Grn und AAV-Grn zeigten AAV-Grn-injizierte Mäuse eine höhere soziale Dominanz im Vergleich zu Kontroll-AAV-GFP-injizierten Mäusen (** = Mann-Whitney, p = 0,0034; oder ** = Binomial, p = 0,0062). n = 19-36 Mäuse pro Gruppe. Die Daten wurden mit Genehmigung von Arrant et al.22 angepasst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Tabelle 1 und 2: Versuchsplanung. Ein Beispiel für ein Röhrchentest-Match-Designblatt. Beachten Sie die Verteilung der einzelnen Versuchsgruppen zwischen der linken und der rechten Seite des Röhrchens und den Aufwand, die Bewegung der Käfige in und aus dem Prüfbereich zu minimieren. Gruppe A ist schwarz und Gruppe B ist rot aufgeführt, um diese Verteilung zu visualisieren. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Der Röhrentest für soziale Dominanz bietet einen leicht anwendbaren und schnell durchzuführenden Assay, den Forscher entweder als primäres Ergebnismaß oder als Teil einer Reihe von Verhaltenstests in Mausmodellen nützlich finden können. Dieser Artikel enthält grundlegende Protokolle für die Durchführung des Röhrchentests zwischen Fremden oder zwischen Käfiggenossen.
Die Prüfärzte sollten sich über mehrere Parameter im Klaren sein, die das Verhalten des Röhrchentests beeinflussen können. Für all diese Parameter sind Pilotstudien sinnvoll, um ihre Auswirkungen auf ein bestimmtes Mausmodell zu bestimmen. Sowohl männliche als auch weibliche Mäuse können den Röhrentest durchführen, aber Mäuse jedes Geschlechts sollten separat analysiert werden, da einige Mausmodelle geschlechtsspezifische Unterschiede im Phänotyp der sozialen Dominanzaufweisen 26, während andere dies nicht tun 8,15,27,28. Der Röhrchentest kann mehrmals am selben Tier wiederholt werden, und zwar sowohl innerhalb einer Versuchssitzung (wobei für jede Maus ein Gewinnprozentsatz berechnet werden kann) als auch zwischen mehreren Sitzungen (so dass Längsschnitttests zur Beurteilung des Alters oder der Interventionseffekte möglich sind). Die Wiederholung des Tests kann jedoch die Phänotypen der sozialen Dominanz in einigen Mausmodellen beeinflussen 8,11,26. Schließlich wirkt sich die Hintergrunddehnung auf das Verhalten von Röhrentests aus, wie in der allerersten Veröffentlichung des Röhrentests3 festgestellt wurde. Alle hier beschriebenen Arbeiten wurden an Mäusen auf dem C57BL/6J-Hintergrund durchgeführt, und neuere bahnbrechende Arbeiten zum Röhrchentest wurden auch an C57BL/6- oder C57BL/6J-Mäusendurchgeführt 4,6,17,29. Forscher, die mit anderen Stämmen arbeiten, möchten möglicherweise die Stabilität und Reproduzierbarkeit des sozialen Dominanzverhaltens bestätigen, bevor sie zu neuen Experimenten übergehen.
Das primäre Ergebnismaß des Röhrchentests ist Gewinn/Niederlage. Andere Gruppen haben jedoch die Länge jedes Spiels und sogar Unterverhaltensweisen innerhalb jedes Spiels aufgezeichnet. Die Prüfer können daher solche Informationen sammeln, um die Reichhaltigkeit der bei jedem Test gewonnenen Daten zu erhöhen. Wang und Kollegen berichteten, dass die Übereinstimmungen bei der Paarung von Mäusen mit großen Unterschieden in den Käfighierarchien kürzer waren als bei der Paarung eng beieinander liegender Mäuse, was zeigt, dass die dominantesten Mäuse Spiele schnell gewinnen6. Zhou und Kollegen bewerteten im Röhrchentest mehrere Unterverhaltensweisen: "Push-initiiert", "Push-Back", "Widerstand" und "Rückzug" und fanden heraus, dass Gewinnermäuse mehr Druck und Widerstand leisteten, aber weniger zurückzogen als verlierende Mäuse17. Obwohl eine Videoaufzeichnung von Spielen nicht notwendig ist, möchten Forscher, die an diesen detaillierteren Analysen des sozialen Dominanzverhaltens interessiert sind, möglicherweise jedes Spiel aufzeichnen.
Wie bei vielen Verhaltenstests kann auch der Röhrchentest durch andere Defizite verfälscht werden, die nichts mit dem Sozialverhalten zu tun haben. Eine motorische Beeinträchtigung wirkt sich wahrscheinlich auf die Leistung des Rohrtests aus, daher sollten die Prüfärzte ein grundlegendes Screening auf motorische Phänotypen mit Tests wie dem Rota-Rod, dem Open Field, dem Poltest usw. durchführen. Geruchsreize sind ein wichtiger Aspekt des Sozialverhaltens von Mäusen30,31, daher sollten Forscher auch nach olfaktorischen Defiziten suchen, die sich auf das Verhalten von Röhrchentests auswirken könnten. Eine einfache Möglichkeit, dies zu tun, besteht darin, die Zeit zu messen, die Mäuse damit verbringen, den Urin einer unbekannten Maus im Vergleich zum Wasser zu untersuchen9.
Forscher, die das Sozialverhalten in neuen Mausmodellen charakterisieren, sollten in Betracht ziehen, den Röhrentest als Teil einer Reihe von Sozialtests zu verwenden. Mausmodelle mit Anomalien im Röhrchentest zeigen häufig ein abnormales Sozialverhalten in anderen Assays wie dem Dreikammer-Geselligkeitstest, dem Bewohner-Eindringling-Test und der qualitativen Bewertung der sozialen Interaktion 9,10,11,12,13,14,15,20,27,32,33,34 ,35. Soziale Dominanz im Röhrchentest korreliert mit sozialer Dominanz bei anderen Aufgaben wie Friseur, Urinmarkierung und Wettbewerb um einen warmen Platz in einem Käfig 17,36,37. Die soziale Dominanz bei anderen Aufgaben, wie z.B. der Konkurrenz um Nahrung, Wasser oder den Zugang zu weiblichen Mäusen, korreliert jedoch weniger gut mit der sozialen Dominanz im Röhrentest 7,38. Durch die Verwendung einer Reihe von Tests können Forscher Messungen von sozialer Dominanz, Aggression, sozialer Untersuchung und sozialer Anerkennung in ihren Mausmodellen erhalten.
Der Tubentest wurde aufgrund der Stabilität der Phänotypen der sozialen Dominanz im Laufe der Zeit und der Möglichkeit, Mäuse wiederholt zu testen, als primäres Ergebnismaß bei der Erprobung präklinischer Therapieansätze 22,23,25 im Grn+/−-Mausmodell verwendet. Forscher, die daran interessiert sind, den Tubentest zum Screening von Interventionen zu verwenden, sollten zunächst die Stabilität der Phänotypen der sozialen Dominanz durch wiederholte Tests in ihrem Mausmodell bestimmen. Testen Sie dazu zuerst die Mäuse und dann wiederholt dieselben Übereinstimmungen im Abstand von einem Tag, einer Woche oder einem Monat. Werden längere Versuchszeiten benötigt, können diese Wiederholungen in noch größeren Abständen durchgeführt werden. Die Übereinstimmung zwischen diesen Übereinstimmungen kann statistisch bestimmt werden, indem der Kappa-Wert zwischen den Tests berechnet wird. Wenn der Röhrchentest im Mausmodell eine geeignete Stabilität erreicht, ist er aufgrund seiner Einfachheit und Geschwindigkeit ein idealer Screening-Assay.
Offenlegungen
Erik D. Roberson war als Berater für AGTC und Lilly tätig und erhielt Lizenzgebühren von Genentech.
Danksagungen
Wir danken James Black und Miriam Roberson für ihre Hilfe bei der Mauszucht und der Kolonieerhaltung, Anthony Filiano und Alicia Hall für die Unterstützung bei Röhrchentest-Pilottests und Robert Farese, Jr. für die Bereitstellung von Progranulin-Knockout-Mäusen. Diese Arbeit wurde vom Consortium for FTD Research und dem Bluefield Project to Cure FTD, dem National Institute of Neurological Disorders and Stroke (R01NS075487, P30NS047466 und F32NS090678) und dem National Institute on Aging (P30AG086401, R00AG056597 und K00AG068428) unterstützt. Verhaltensexperimente wurden in der Animal Behavior Assessment Core Facility an der University of Alabama in Birmingham durchgeführt.
Materialien
| Name | Company | Catalog Number | Comments |
| Animals diet | Envigo | NIH-31 diet #7917 | Animals chow |
| CHLORHEXIDINE 2% SOLUTION 1GAL | Patterson Veterinary Supply INC | 78924243 | For cleaning tubes and surface |
| Ethanol 70% | Vion Biosciences | VNEE0069CS/4 | For cleaning tubes and surface |
| Large tube for male mice > 9 months old | Home Depot | Store SKU # 1000017942 | 1-7/8 in. O.D. x 1-1/2 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Medium tube for male mice 6–9 months old, female mice > 9 months old | Home Depot | Store SKU # 1000017945 | 1-5/8 in. O.D. x 1-1/4 in. I.D. x 24 in. Clear PVC Vinyl Tube |
| Small tube for male mice < 6 months old, female mice < 9 months old | Home Depot | Store SKU # 1000017938 | 1-3/8 in. O.D. x 1 in. I.D. x 24 in. Clear PVC Braided Vinyl Tube |
Referenzen
- Choi, T. Y., Jeong, S., Koo, J. W. Mesocorticolimbic circuit mechanisms of social dominance behavior. Exp Mol Med. 56 (9), 1889-1899 (2024).
- Fulenwider, H. D., Caruso, M. A., Ryabinin, A. E. Manifestations of domination: Assessments of social dominance in rodents. Genes Brain Behav. 21 (3), e12731(2022).
- Lindzey, G., Winston, H., Manosevitz, M. Social dominance in inbred mouse strains. Nature. 191, 474-476 (1961).
- Fan, Z., et al. Using the tube test to measure social hierarchy in mice. Nat Protoc. 14 (3), 819-831 (2019).
- Cum, M., et al. A multiparadigm approach to characterize dominance behaviors in CD1 and c57BL6 male mice. eNeuro. 11 (11), (2024).
- Wang, F., et al. Bidirectional control of social hierarchy by synaptic efficacy in medial prefrontal cortex. Science. 334 (6056), 693-697 (2011).
- Van De Weerd, H. A., Van Den Broek, F. A., Beynen, A. C. Removal of vibrissae in male mice does not influence social dominance. Behav Processes. 27 (3), 205-208 (1992).
- Arrant, A. E., Filiano, A. J., Warmus, B. A., Hall, A. M., Roberson, E. D. Progranulin haploinsufficiency causes biphasic social dominance abnormalities in the tube test. Genes Brain Behav. 15 (6), 588-603 (2016).
- Filiano, A. J., et al. Dissociation of frontotemporal dementia-related deficits and neuroinflammation in progranulin haploinsufficient mice. J. Neurosci. 33 (12), 5352-5361 (2013).
- Shahbazian, M., et al. Mice with truncated mecp2 recapitulate many Rett syndrome features and display hyperacetylation of histone h3. Neuron. 35 (2), 243-254 (2002).
- Spencer, C. M., Alekseyenko, O., Serysheva, E., Yuva-Paylor, L. A., Paylor, R. Altered anxiety-related and social behaviors in the fmr1 knockout mouse model of fragile x syndrome. Genes Brain Behav. 4 (7), 420-430 (2005).
- Irie, F., Badie-Mahdavi, H., Yamaguchi, Y. Autism-like socio-communicative deficits and stereotypies in mice lacking heparan sulfate. Proc Natl Acad Sci U S A. 109 (13), 5052-5056 (2012).
- Veenstra-Vanderweele, J., et al. Autism gene variant causes hyperserotonemia, serotonin receptor hypersensitivity, social impairment and repetitive behavior. Proc Natl Acad Sci U S A. 109 (14), 5469-5474 (2012).
- Jiang-Xie, L. F., et al. Autism-associated gene dlgap2 mutant mice demonstrate exacerbated aggressive behaviors and orbitofrontal cortex deficits. Mol Autism. 5, 32(2014).
- Huang, W. H., et al. Early adolescent rai1 reactivation reverses transcriptional and social interaction deficits in a mouse model of smith-magenis syndrome. Proc Natl Acad Sci U S A. 115 (42), 10744-10749 (2018).
- Rascovsky, K., et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain. 134 (Pt 9), 2456-2477 (2011).
- Zhou, T., et al. History of winning remodels thalamo-PFC circuit to reinforce social dominance. Science. 357 (6347), 162-168 (2017).
- Zhou, X., et al. Prosaposin facilitates sortilin-independent lysosomal trafficking of progranulin. J Cell Biol. 210 (6), 991-1002 (2015).
- Cook, A. K., et al. Dendritic spine head diameter is reduced in the prefrontal cortex of progranulin haploinsufficient mice. Mol Brain. 17 (1), 33(2024).
- Park, M. J., Seo, B. A., Lee, B., Shin, H. S., Kang, M. G. Stress-induced changes in social dominance are scaled by AMPA-type glutamate receptor phosphorylation in the medial prefrontal cortex. Sci Rep. 8 (1), 15008(2018).
- Tada, H., et al. Neonatal isolation augments social dominance by altering actin dynamics in the medial prefrontal cortex. Proc Natl Acad Sci U S A. 113 (45), E7097-E7105 (2016).
- Arrant, A. E., Filiano, A. J., Unger, D. E., Young, A. H., Roberson, E. D. Restoring neuronal progranulin reverses deficits in a mouse model of frontotemporal dementia. Brain. 140 (5), 1447-1465 (2017).
- Kurnellas, M., et al. Latozinemab, a novel progranulin-elevating therapy for frontotemporal dementia. J Transl Med. 21 (1), 387(2023).
- Ueno, H., et al. Effects of repetitive gentle handling of male c57bl/6ncrl mice on comparative behavioural test results. Sci Rep. 10 (1), 3509(2020).
- Arrant, A. E., Nicholson, A. M., Zhou, X., Rademakers, R., Roberson, E. D. Partial tmem106b reduction does not correct abnormalities due to progranulin haploinsufficiency. Mol Neurodegener. 13 (1), 32(2018).
- Chachua, T., et al. Sex-specific behavioral traits in the BRD2 mouse model of juvenile myoclonic epilepsy. Genes Brain Behav. 13 (7), 702-712 (2014).
- Lijam, N., et al. Social interaction and sensorimotor gating abnormalities in mice lacking dvl1. Cell. 90 (5), 895-905 (1997).
- Nishimura, I., Yang, Y., Lu, B. Par-1 kinase plays an initiator role in a temporally ordered phosphorylation process that confers tau toxicity in drosophila. Cell. 116 (5), 671-682 (2004).
- Zhang, C., et al. Dynamics of a disinhibitory prefrontal microcircuit in controlling social competition. Neuron. 110 (3), 516-531.e6 (2022).
- Lin, D. Y., Zhang, S. Z., Block, E., Katz, L. C. Encoding social signals in the mouse main olfactory bulb. Nature. 434 (7032), 470-477 (2005).
- Matsuo, T., et al. Genetic dissection of pheromone processing reveals main olfactory system-mediated social behaviors in mice. Proc Natl Acad Sci U S A. 112 (3), E311-E320 (2015).
- Koh, H. Y., Kim, D., Lee, J., Lee, S., Shin, H. S. Deficits in social behavior and sensorimotor gating in mice lacking phospholipase cbeta1. Genes Brain Behav. 7 (1), 120-128 (2008).
- Long, J. M., Laporte, P., Paylor, R., Wynshaw-Boris, A. Expanded characterization of the social interaction abnormalities in mice lacking dvl1. Genes Brain Behav. 3 (1), 51-62 (2004).
- Moretti, P., Bouwknecht, J. A., Teague, R., Paylor, R., Zoghbi, H. Y. Abnormalities of social interactions and home-cage behavior in a mouse model of Rett syndrome. Hum Mol Genet. 14 (2), 205-220 (2005).
- Nishijima, I., et al. Secretin receptor-deficient mice exhibit impaired synaptic plasticity and social behavior. Hum Mol Genet. 15 (21), 3241-3250 (2006).
- Rodriguiz, R. M., Chu, R., Caron, M. G., Wetsel, W. C. Aberrant responses in social interaction of dopamine transporter knockout mice. Behav Brain Res. 148 (1-2), 185-198 (2004).
- Greenberg, G. D., Howerton, C. L., Trainor, B. C. Fighting in the home cage: Agonistic encounters and effects on neurobiological markers within the social decision-making network of house mice (mus musculus. Neurosci Lett. 566, 151-155 (2014).
- Benton, D., Dalrymple-Alford,, John, C., Brain, P. F. Comparisons of measures of dominance in the laboratory mouse. Anim Behav. 28, 1274-1279 (1980).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten