Method Article
Биопсия предстательной железы под контролем когнитивного слияния с использованием мультипараметрической магнитно-резонансной томографии и трансректального ультразвука
В этой статье
Резюме
Биопсия предстательной железы является золотым стандартом диагностики рака предстательной железы. Биопсия предстательной железы под контролем когнитивного слияния, которая сочетает в себе трансректальное ультразвуковое исследование с предварительно измеренными параметрами МРТ, повышает точность биопсии и увеличивает частоту выявления клинически значимого рака предстательной железы.
Аннотация
Традиционная трансректальная биопсия предстательной железы под контролем УЗИ (ТРУЗИ) имеет ограниченную чувствительность и специфичность, особенно для выявления рака предстательной железы на ранних стадиях, из-за отсутствия точного определения поражения. Усовершенствованный метод биопсии предстательной железы под контролем когнитивного слияния был разработан для улучшения нацеливания на поражение путем интеграции трех параметров многопараметрических изображений предстательной железы (mpMRI) в изображения TRUS. Измерение мпМРТ предстательной железы первоначально проводится для получения трех ключевых параметров: угла поворота (α), расстояния от стенки прямой кишки (X) и расстояния от верхушки простаты (Y). Затем эти параметры когнитивно применяются в режиме реального времени при игольчатой биопсии предстательной железы под контролем ТРУЗИ для обнаружения поражений-мишеней. Этот усовершенствованный метод трансперинеальной когнитивной биопсии повышает точность диагностики, улучшает воспроизводимость и снижает зависимость от опыта оператора. Клиническое применение у 423 пациентов показало частоту выявления рака предстательной железы на уровне 73,5%, при этом 62,9% были классифицированы как клинически значимые виды рака. По сравнению с методами с интенсивным использованием оборудования, такими как МРТ-ультразвуковая фьюжн-биопсия, этот подход является экономически эффективным, практичным и хорошо подходит для более широкого клинического внедрения. Кроме того, гибкость метода поддерживает интеграцию с другими методами визуализации, такими как ПЭТ/КТ с 68Ga-PSMA, что еще больше повышает показатели выявления у пациентов с раком предстательной железы высокого риска.
Введение
Рак предстательной железы является серьезной проблемой глобального здравоохранения: по оценкам, в 2022 году во всем мире было зарегистрировано 1 466 680 новых случаев заболевания и 396 792 смерти. Рак предстательной железы является вторым по распространенности онкологическим заболеванием и пятой по значимости причиной смерти от рака среди мужчин1. По прогнозам, к 2040 году число новых случаев рака предстательной железы возрастет до 2,9 миллиона, а смертность, как ожидается, достигнет 700 000человек2. Ранняя диагностика и стандартизированное лечение имеют решающее значение для улучшения показателей выживаемости у пациентов с раком предстательной железы, а биопсия предстательной железы остается золотым стандартом ранней диагностики.
С 1968 года трансректальное ультразвуковое исследование (ТРУЗИ) является важным инструментом для проведения биопсии предстательной железы. Тем не менее, чувствительность и специфичность биопсии предстательной железы под контролем ТРУЗИ ограничены на 65-74% и 40-57% соответственно, особенно при выявлениипоражений на ранних стадиях или небольших объемов4. Чтобы преодолеть эти ограничения, многопараметрическая МРТ (мпМРТ) стала превосходным методом визуализации, обеспечивающим более детальную оценку ткани предстательной железы и улучшенную локализацию клинически значимого рака предстательной железы. По сравнению с традиционной биопсией под контролем ТРУЗИ, мпМРТ может более точно идентифицировать подозрительные поражения в предстательной железе и повысить точность целевых биопсий.
Было разработано несколько методов биопсии предстательной железы под контролем МРТ, использующих расширенные диагностические возможности мпМРТ предстательной железы. Эти методы включают биопсию предстательной железы с целью МРТ, трансректальное ультразвуковое исследование предстательной железы и биопсию предстательной железы под контролем когнитивного слияния 7,8. Целенаправленная биопсия предстательной железы с помощью МРТ выполняется непосредственно внутри МРТ-сканера, что позволяет получать изображения во время биопсии в режиме реального времени. Эта методика обеспечивает отличную локализацию поражения; Однако это дорого и долго из-за длительных требований к визуализации и процедурам. МРТ-трансректальное ультразвуковое исследование фьюжн биопсия предстательной железы сочетает в себе МР-изображения и изображения ТРУЗИ в режиме реального времени с помощью специализированного программного обеспечения, что делает ее сложной и дорогостоящей.
В отличие от этого, биопсия предстательной железы под контролем когнитивного слияния включает в себя запоминание врачами мест поражения по МР-изображениям и мысленную интеграцию этой информации с ТРУЗИ в режиме реального времени во время биопсии. Этот метод не требует дополнительного оборудования, что делает его простым, экономичным и очень подходящим для клинического внедрения. Тем не менее, биопсия предстательной железы под контролем когнитивного слияния в значительной степени зависит от опыта врача, а процесс локализации поражения полностью зависит от памяти и суждения, что приводит к снижению воспроизводимости и ограничивает его более широкое применение. Для решения этих проблем был разработан усовершенствованный метод трансперинеальной когнитивной биопсии путем интеграции трех ключевых параметров изображений mpMR предстательной железы с TRUS. Этот метод обладает высокой воспроизводимостью, прост в исполнении и хорошо подходит для широкого клинического внедрения, предлагая значительную поддержку для точной диагностики рака предстательной железы. В данной статье подробно описывается протокол и клиническая полезность этого стандартизированного подхода, а также подчеркивается его потенциал для улучшения выявления рака предстательной железы в повседневной практике.
протокол
Это исследование с участием людей было проведено в соответствии с принципами, изложенными в Хельсинкской декларации. Письменное информированное согласие было получено от всех участников до их включения в исследование. Критерии включения и исключения были тщательно определены для обеспечения безопасности участников и пригодности процедуры.
1. Отбор пациентов
- Установите следующие критерии включения для отбора пациентов: простатспецифический антиген (ПСА) > 10 нг/мл; наличие подозрительного узла предстательной железы, выявленного при пальцевом ректальном исследовании (DRE), независимо от уровня ПСА; подозрительные поражения, выявленные с помощью трансректального ультразвукового исследования (ТРУЗИ), МРТ или ПСМА ПЭТ/КТ, независимо от уровня ПСА; уровни ПСА в диапазоне от 4 до 10 нг/мл, сопровождающиеся f/tPSA < 0,16, и/или плотностью ПСА (PSAD) > 0,15 нг/мл2, и/или скоростью ПСА (PSAV) > 0,75 нг/мл в год; аномальные результаты других тестов, связанных с простатой, такие как повышенный индекс здоровья предстательной железы (PHI) или положительные результаты на антиген рака предстательной железы 3 (PCA3) в моче.
- Исключить участников из исследования на основании следующих критериев: острая инфекция или лихорадка в течение периода исследования; гипертонический криз; декомпенсированная сердечная недостаточность; тяжелые нарушения свертываемости крови; плохо контролируемые или нестабильные сопутствующие заболевания, такие как гипертония или диабет; тяжелые анальные или ректальные заболевания, включая прогрессирующий внутренний/внешний геморрой или значительную патологию прямой кишки/ануса; выраженное иммуносупрессивное состояние; тяжелые психические расстройства или нежелание или неспособность участников сотрудничать с процедурой.
2. Определение трехмерных координат поражения на мпМРТ
- Тщательно изучите карты Т2-взвешенной визуализации (T2WI, Рисунок 1A), диффузионно-взвешенной визуализации (DWI, Рисунок 1B) и коэффициента кажущейся диффузии (ADC, Рисунок 1C) мультипараметрических МРТ (mpMRI) для выявления поражений предстательной железы.
ПРИМЕЧАНИЕ: Перед биопсией может потребоваться консультация радиолога для подтверждения местоположения поражения. - В качестве вершины используйте точку примерно в 7 мм от передней стенки прямой кишки. Проведите одну линию через среднюю линию тела, которую можно определить по лобковому симфизу или луковичному мочеиспускательному каналу. Проведите еще одну линию через центр поражения. Угол между этими двумя линиями представляет собой угловое смещение, записанное как α (рис. 2A).
ПРИМЕЧАНИЕ: Этот угол α используется для определения того, насколько ультразвуковой датчик повернут для выравнивания с поражением во время биопсии. - Измерьте расстояние от центра поражения до серозальной поверхности прямой кишки на последовательности T2WI и запишите его как X (рисунок 2A).
ПРИМЕЧАНИЕ: Расстояние X используется для определения точки введения иглы во время биопсии и определения места введения биопсийной иглы относительно прямой кишки. - Измерение расстояния от вершины предстательной железы (Y) Создайте плоскость, которая проходит как через центр вершины угла α, так и через центр поражения с помощью DICOM-просмотрщика с MPR (мультипланарной реконструкцией) или другой функцией среза. Измерьте расстояние от очага поражения до верхушки простаты в этой плоскости и запишите его как Y (рисунок 2B).
ПРИМЕЧАНИЕ: Расстояние Y имеет решающее значение для определения глубины проникновения иглы; Она соответствует глубине, на которую должна проникнуть биопсийная игла во время биопсии.
3. Подготовка пациента и визуализация
- Примите пациента в положение для литотомии. Расположите ягодицы точно у центрального края стола для осмотра. Обе ноги симметрично поддерживаются в подставках для ног.
- Втяните мошонку вверх и полностью обнажите область промежности.
- Продезинфицируйте область промежности повидон-йодом (йодофором) и задрапируйте область, оставив место проведения процедуры доступным.
- Подкожно ввести 1% лидокаин для местной анестезии в проекцию самой большой поперечной плоскости простаты на кожу промежности.
- Аккуратно введите биплоскостной трансректальный ультразвуковой зонд (ТРУЗИ) в прямую кишку. Расположите зонд под углом 45° вверх относительно анального отверстия.
ПРИМЕЧАНИЕ: Точка введения анестезии обычно находится на расстоянии 1,5 см от анального отверстия (Рисунок 3). - Введите 1% лидокаин в мышцу, поднимающую плечо, капсулу предстательной железы и верхушку предстательной железы под ультразвуковым контролем в сагиттальной плоскости, чтобы обеспечить адекватную анестезию во время биопсии.
4. ТРУЗИ и когнитивное слияние
- Выровняйте ультразвуковой датчик по средней линии, найдя плоскость на поперечном ультразвуковом изображении, которая точно совпадает с положением поражения на поперечном изображении T2WI на mpMRI. После идентификации держите датчик неподвижно и заморозьте ультразвуковое изображение на этом уровне поперечного сечения.
ПРИМЕЧАНИЕ: Убедитесь, что сагиттальная плоскость ультразвукового датчика выровнена со средней линией тела. В стандартном положении для литотомии сагиттальная плоскость зонда обычно располагается прямо над головой. - Заморозьте изображение и используйте центр датчика в качестве вершины для измерения угла α на ультразвуке. Совместите один край угла α с центральной направляющей линией на поперечном ультразвуковом изображении (рис. 4A).
ПРИМЕЧАНИЕ: Расположение другого края угла α, которое соответствует положению очага поражения на ультразвуковом изображении. - Разморозьте изображение и вращайте зонд до тех пор, пока центральная направляющая линия поперечного ультразвукового изображения не совпадет с положением поражения, определенного на МРТ. Удерживайте щуп неподвижно без дальнейшего вращения после того, как будет достигнут угол поворота на α.
- Расположите ультразвуковой датчик в плоскости поражения, продвигая датчик горизонтально вдоль прямой кишки до тех пор, пока ультразвуковой датчик с линейной решеткой не отобразит изображение предстательной железы, после поворота датчика под правильным α углом.
ПРИМЕЧАНИЕ: Текущее отображаемое изображение соответствует плоскости поражения, определенной по результатам предыдущих измерений МРТ (Рисунок 4B). - Измерьте расстояние от серозальной поверхности прямой кишки до места, соответствующего ранее измеренному значению X на МРТ, подтверждая точку введения биопсийной иглы.
- Измерьте расстояние от верхушки предстательной железы до места, соответствующего ранее измеренному значению Y на МРТ, в направлении, параллельном прямой кишке, обеспечив правильную глубину введения иглы для биопсии (рисунок 4B).
ПРИМЕЧАНИЕ: Эти измерения X и Y подтверждают, что датчик правильно выровнен по поражению на ультразвуковом изображении, что позволяет точно нацеливаться во время биопсии.
5. Прицельная биопсия
- Введите биопсийную иглу вдоль направляющей линии иглы, соответствующей расстоянию от прямой кишки (измеренному как X на ультразвуковом изображении) под ультразвуковым контролем в сагиттальной плоскости с помощью линейного матричного зонда.
- Отрегулируйте глубину иглы в соответствии с ранее измеренным значением Y, которое представляет собой расстояние от верхушки простаты. Выполните 2-3 целевые биопсии в области поражения, как только будет достигнута правильная глубина (Рисунок 4B).
- Повторите вышеуказанные шаги для каждого целевого поражения, если выявлены множественные поражения.
ПРИМЕЧАНИЕ: Крайне важно поддерживать стабильность ультразвукового датчика, а координаты X и Y должны быть точно нанесены для каждого участка биопсии на протяжении всей процедуры. Чтобы обеспечить точность и уменьшить количество движений руки, рекомендуется использовать опорный кронштейн ультразвукового зонда.
6. Систематическая биопсия
- Возьмите по одному биопсийному керну из верхушки, средней линии и основания как в периферической, так и в центральной зонах левой доли простаты.
- Отрегулируйте положение щупа и возьмите по одному керну от вершины, средней линии и основания в обеих зонах; Затем повторите процесс на правой доле простаты.
ПРИМЕЧАНИЕ: Рекомендуется собрать в общей сложности 12 ядер во время систематической биопсии.
7. Завершение
- Аккуратно извлеките зонд TRUS из прямой кишки, чтобы избежать дискомфорта после биопсии.
- Очистите область промежности и прямой кишки стерильными салфетками, чтобы удалить остатки геля или крови.
- Поместите каждое биопсийное ядро в предварительно промаркированные контейнеры с соответствующими консервантами. Пометьте каждый контейнер информацией о пациенте и местом проведения биопсии.
- Транспортируйте помеченные контейнеры с биопсийными стержнями в лабораторию патологии для гистопатологического анализа.
Результаты
В этом случае биопсия предстательной железы под контролем когнитивного слияния точно определила клинически значимое поражение рака предстательной железы. Это поражение было выявлено с помощью МРТ в левой верхушке предстательной железы с максимальным диаметром около 6 мм и оценкой PI-RADS 4, что свидетельствует о высокой вероятности клинически значимого рака предстательной железы.
Патологическим диагнозом данного биопсийного поражения была ацинарная аденокарцинома предстательной железы со следующими подробностями (рис. 5):
Оценка по шкале Глисона: 4 + 4 = 8, при этом 60% основной модели Глисона 4 и 40% второстепенной модели Глисона 3
Группа классов ВОЗ/ISUP: классифицируется как группа 4 степени, что указывает на умеренный риск прогрессирования рака
Опухолевая нагрузка: опухоль занимала 30% ядер биопсии.
Периневральная инвазия: отрицательная (нет признаков вовлечения нерва)
Сосудистая инвазия: отрицательная (нет признаков распространения в кровеносные сосуды)
Другие образцы систематической биопсии предстательной железы были признаны доброкачественными.
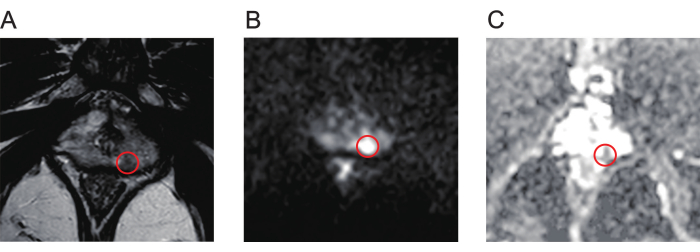
Рисунок 1: Типичные mpMR-изображения поражений рака предстательной железы. (A) Красный круг указывает на поражение с низкой интенсивностью сигнала, как показано на Т2-взвешенной визуализации. (B) Красный круг указывает на поражение с высокой интенсивностью сигнала, как показано на диффузионно-взвешенной визуализации. (C) Красный круг указывает на поражение, показывая низкую интенсивность сигнала на карте коэффициента видимой диффузии. Аббревиатура: mpMR = мультипараметрический магнитный резонанс. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
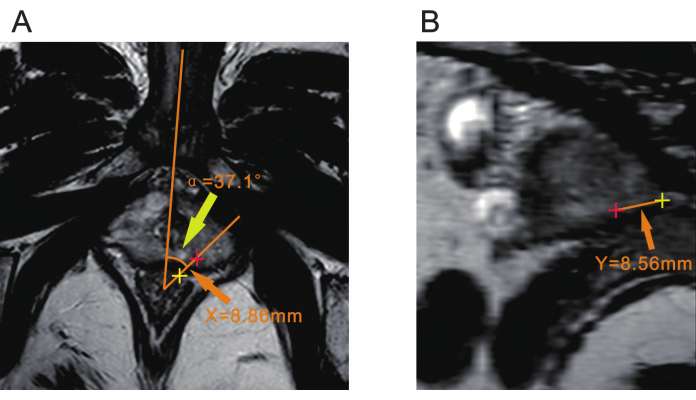
Рисунок 2: Три параметра мпМРТ предстательной железы. (А) Желтая стрелка указывает угол (α) между плоскостью поражения и средней линией тела. Оранжевая стрелка указывает расстояние (X) от центра поражения (красный плюс) до серозальной поверхности прямой кишки (желтый плюс). (B) Оранжевая стрелка указывает расстояние (Y) от центра поражения (красный плюс) до верхушки простаты (желтый плюс). Сокращение: mpMRI = мультипараметрическая магнитно-резонансная томография. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
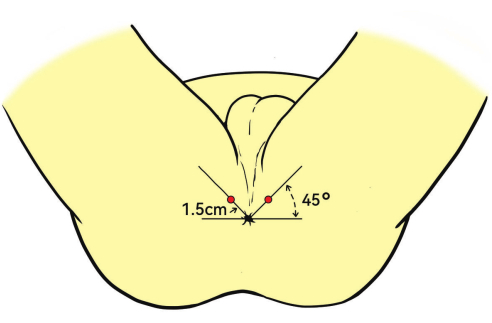
Рисунок 3: Положение пациента и место анестезии. Пациенты размещаются в положении литотомии. Место инъекции, обозначенное красными точками для глубокой инфильтрационной анестезии, находится на расстоянии 1,5 см от анального отверстия под углом 45°. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Три параметра мпМРТ предстательной железы, показанные на УЗИ. (A) Когда ультразвуковое изображение было заморожено, центр зонда использовался в качестве вершины, а центральная направляющая линия использовалась в качестве одного из краев (L1) для измерения угла α, обозначенного оранжевой стрелкой, как показано на mpMRI. После того, как был измерен α угол, обозначенный оранжевой стрелкой, другой край (L2) угла был определен на поперечном ультразвуковом изображении. (B) Значение X на mpMRI, обозначенное оранжевой стрелкой, использовалось в качестве вертикального расстояния для рисования параллельной линии с серозальной поверхностью прямой кишки, а значение Y на mpMRI, обозначенное желтой стрелкой, использовалось в качестве горизонтального расстояния для проведения вертикальной линии от вершины предстательной железы (желтый плюс). Красным плюсом в месте пересечения обозначена область поражения (место биопсии). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
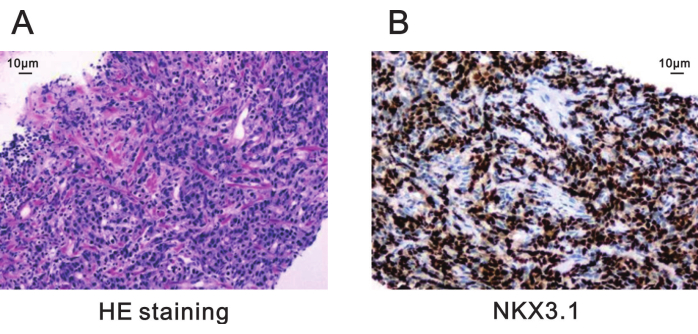
Рисунок 5: Патологическое окрашивание целевого поражения предстательной железы при биопсии. (A) Окрашивание HE, показывающее ацинарную аденокарциному предстательной железы с оценкой по шкале Глисона 4 + 4 = 8 (200x). Масштабная линейка = 10 мкм. (B) Иммуногистохимическое окрашивание для положительной экспрессии NKX3.1 указывает на плохую дифференцировку при раке предстательной железы (200x). Масштабная линейка = 10 мкм. Сокращение: HE = Гематоксилин-эозин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Биопсия под контролем МРТ (МРТ-ГБ) является краеугольным камнем прицельной биопсии предстательной железы и включает в себя таргетную биопсию МРТ (МРТ-ТБ), МРТ-трансректальную ультразвуковую фьюжн-биопсию (FUS-TB) и когнитивную фьюжн-биопсию (COG-TB). МРТ-ТБ обеспечивает высокую точность диагностики за счет МРТ-визуализации в режиме реального времени, при этом общий показатель выявления рака составляет 80%, а клинически значимый показатель выявления рака составляет 55%9. Однако его высокая стоимость и сложность в эксплуатации ограничивают его широкое применение. FUS-TB сочетает в себе точность МРТ с ультразвуковым контролем в режиме реального времени с использованием специализированного программного обеспечения, обеспечивая точную локализацию; Однако это требует дополнительного оборудования и сложных рабочих процессов. В отличие от этого, COG-TB полагается исключительно на способность оператора мысленно интегрировать МРТ и ультразвуковые изображения во время процедуры, что устраняет необходимость в специализированном оборудовании. Этот подход является экономически эффективным, простым в исполнении и обладает значительным потенциалом для широкого клинического применения.
Исследования показали, что диагностическая точность COG-TB в выявлении клинически значимого рака предстательной железы (csPCa) сопоставима с передовыми методами биопсии под контролем МРТ, такими как MRI-TB и FUS-TB 7,10. Эта сопоставимая эффективность подчеркивает, что КОГ-ТБ является жизнеспособной альтернативой, особенно в условиях ограниченного доступа к специализированному оборудованию. Однако, несмотря на свою простоту, COG-TB по-прежнему зависит от опыта оператора. Традиционные методы когнитивного слияния часто полагаются на анатомические ориентиры, такие как кисты, узлы доброкачественной гиперплазии предстательной железы или кальцинаты, для позиционирования поражений 8,11,12,13,14,15. Тем не менее, исследования показывают, что примерно 50% поражений рака предстательной железы не проявляют типичных гипоэхогенных характеристик на ТРУЗИ, при этом у некоторых пациентов отсутствуют четкие анатомические маркеры. Эта вариативность в сочетании с зависимостью оператора от пространственного восприятия ограничивает воспроизводимость и масштабируемость COG-TB.
В этом усовершенствованном методе трансперинеальной когнитивной биопсии локализация поражения параметризуется с использованием трех ключевых метрик изображений mpMR: угол поворота (α), расстояние от серозы прямой кишки (X) и расстояние от верхушки предстательной железы (Y). Используя последовательности T2WI из МРТ-изображений, вершина угла α определяется как ось вращения, а простата сегментируется на плоскости для определения местоположения поражения и измерения значений α, X и Y. Эти параметры затем применяются под контролем ТРУЗ для точного нацеливания на поражение. Применение этих трех параметров аналогично вращению зонда TRUS в прямой кишке. С помощью T2WI простата делится на веерообразные сектора, что позволяет идентифицировать плоскость поражения. Как МРТ, так и ТРУЗИ используют среднюю линию тела в качестве эталона для угла α, который корректирует любые позиционные расхождения между двумя методами визуализации.
Параметры X и Yare имеют решающее значение для определения места и глубины введения иглы. Значение X, измеренное на плоскости T2WI, представляет собой расстояние от центра поражения до серозальной поверхности прямой кишки. Расстояние от центра поражения до основания предстательной железы не измерялось, так как рекомендации ультразвукового скрининга эффективно направляют иглу для биопсии. Серозальная поверхность прямой кишки близка к нулевой отметке на направляющей, что обеспечивает простой и точный ориентир для определения значений X и Y. В отличие от традиционного когнитивного слияния, этот подход не позиционирует поражения на основе внутренних анатомических ориентиров простаты. В большинстве случаев ультразвуковые изображения не нужно замораживать для выполнения этих измерений. Позиционирование поражений по параметрам мпМРТ гарантирует, что этот метод может быть применен к широкому кругу пациентов с высокой воспроизводимостью и короткой кривой обучения, что позволяет начинающим операторам достичь высокой точности после обучения примерно на 10 случаях.
Несмотря на преимущества метода, расхождения между методами МРТ и УЗИ, а также различия в позиционировании пациента и компрессии тканей могут привести к ошибкам. Основные оптимизации включают в себя следующее:
Значение X (расстояние от ректальной серозы): X обычно измеряется с диапазоном погрешности 2-3 мм. Тонкие срезы МРТ-изображений могут повысить разрешение и контрастность, в то время как многократные измерения радиологами могут повысить точность.
Значение Y (расстояние от верхушки предстательной железы): Y зависит от реконструированных плоскостей T2WI, которые могут иметь ограниченное разрешение. Однако, поскольку образец биопсийной иглы имеет длину 2 см, приблизительного определения местоположения поражения часто бывает достаточно. Сканирование тонких срезов и четкая маркировка границ могут уменьшить погрешности измерения.
α Угол (угол поворота): Обеспечение постоянного положения пациента между МРТ и ТРУЗИ, использование средней линии тела в качестве опорного и стабилизация ультразвукового датчика могут свести к минимуму отклонения, связанные с углом.
Этот усовершенствованный метод был недавно применен в когорте из 423 пациентов, средний возраст которых составил 70,8 лет, а среднее значение ПСА составило 59,2 нг/мл. Рак предстательной железы выявлен у 311 пациентов (73,5%), из них у 62,9% был клинически значимый рак. Эти результаты подтверждают надежность и эффективность данного подхода. Биопсия предстательной железы после слияния МРТ и УЗИ может быть выполнена с использованием трансректального или трансперинеального доступа. Pepe et al. проанализировали клинические данные 8500 случаев трансперинеальной биопсии предстательной железы, сообщив о частоте выявления рака предстательной железы в 37,1% и частоте осложнений в 35,9%17. Эти результаты подчеркивают высокий профиль безопасности трансперинеального доступа. Кроме того, трансперинеальный метод обеспечивает более высокую частоту выявления рака и значительно меньший риск инфицирования, чем трансректальный доступ. Основываясь на этих преимуществах, рекомендации Европейской ассоциации урологов (EAU) рекомендуют трансперинеальный путь в качестве предпочтительного подхода к биопсии предстательной железы18.
Этот метод может быть эффективно интегрирован с другими методами визуализации, такими как ПЭТ/КТ 68Ga-PSMA, для улучшения выявления рака предстательной железы высокого риска. Исследования показали, что при стандартизированном значении поглощения (SUVmax) 8, 68Ga-PSMA ПЭТ/КТ достигает 100% диагностической точности при клинически значимом раке предстательной железы (csPCa) у пациентов с ISUP степени ≥319. Целенаправленная биопсия областей с помощью SUVmax ≥ 8 может еще больше повысить скорость обнаружения csPCa. В заключение следует отметить, что этот усовершенствованный метод трансперинеальной когнитивной биопсии устраняет ключевые ограничения традиционного КОГ-ТБ, обеспечивает повышенную воспроизводимость, снижает зависимость от оператора и расширяет его клиническую применимость.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Эта работа была поддержана совместным проектом Комиссии по здравоохранению Чунцина и Бюро по науке и технологиям (2025MSXM046 to JY. D.), Национальным фондом естественных наук Китая (82470420 до J.L.), а также Программой для выдающихся академических лидеров в области медицины Чунцина (YXLJ202406 до J.L.).
Материалы
| Name | Company | Catalog Number | Comments |
| 5% Povidone-Iodine Solution | Chengdu Yong'an Pharmaceutical Co., Ltd. | H51022885 | For disinfection of the surgical area |
| 10% Neutral Buffered Formalin Fixative | Guangzhou Vigrass Biotechnology Co., Ltd. | 24010506 | For fixing biopsy tissue |
| AccuCARE Transperineal Solutions | CIVCO Medical Instruments Co., Inc | 620-119 | For supporting the probe |
| Injection syringe (20 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | For local anesthesia |
| Lidocaine | Hubei Tiansheng Pharmaceutical Co., Ltd. | H42021839 | Diluted with saline to 1% for local anesthesia |
| MRI 3.0T | Philips | Ingenia | For prostate examination |
| RadiAnt DICOM Viewer | Medixant | V2024.1 | For reading prostate MRI, outlining lesions, measuring distances, and angles |
| Single-use Biopsy Needle MC1820 | Bard Peripheral Vascular, Inc. | REHU3231 | For needle biopsy sampling |
| Single-use Sterile Needle 0.7 x 80 TWLB | Zhejiang Kangdeli Medical Devices Co., Ltd. | C20230923 | For local anesthesia |
| Sodium chloride injection | Southwest pharmaceutical Co., LTD | H50021610 | For diluting lidocaine |
| Ultrasound | BK Medical | bk3000-01 | For guiding prostate biopsy |
Ссылки
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- James, N. D., et al. The Lancet Commission on prostate cancer: planning for the surge in cases. Lancet. 403 (10437), 1683-1722 (2024).
- Jansen, H., Gallee, M. P., Schröder, F. H. Analysis of sonographic pattern in prostatic cancer: comparison of longitudinal and transversal transrectal ultrasound with subsequent radical prostatectomy specimens. Eur Urol. 18 (3), 174-178 (1990).
- Heijmink, S. W. T. P. J., et al. A comparison of the diagnostic performance of systematic versus ultrasound-guided biopsies of prostate cancer. Eur Radiol. 16 (4), 927-938 (2006).
- Verma, S., et al. The current state of MR imaging-targeted biopsy techniques for detection of prostate cancer. Radiology. 285 (2), 343-356 (2017).
- Moore, C. M., et al. Image-guided prostate biopsy using magnetic resonance imaging-derived targets: A systematic review. Eur Urol. 63 (1), 125-140 (2013).
- Wegelin, O., et al. The FUTURE trial: A multicenter randomised controlled trial on target biopsy techniques based on magnetic resonance imaging in the diagnosis of prostate cancer in patients with prior negative biopsies. Eur Urol. 75 (4), 582-590 (2019).
- Falagario, U. G., et al. Prostate cancer detection and complications of MRI-targeted prostate biopsy using cognitive registration, software-assisted image fusion or in-bore guidance: a systematic review and meta-analysis of comparative studies. Prostate Cancer Prostatic Dis. , (2024).
- Pokorny, M., et al. MRI-guided in-bore biopsy for prostate cancer: what does the evidence say? A case series of 554 patients and a review of the current literature. World J Urol. 37 (7), 1263-1279 (2019).
- Wegelin, O., et al. Comparing three different techniques for magnetic resonance imaging-targeted prostate biopsies: A systematic review of in-bore versus magnetic resonance imaging-transrectal ultrasound fusion versus cognitive registration. Is there a preferred technique. Eur Urol. 71 (4), 517-531 (2017).
- Puech, P., et al. Multiparametric MRI-targeted TRUS prostate biopsies using visual registration. BioMed Res Int. 2014, 819360 (2014).
- Ito, M., et al. Superior detection of significant prostate cancer by transperineal prostate biopsy using MRI-transrectal ultrasound fusion image guidance over cognitive registration. Int J Clin Oncol. 28 (11), 1545-1553 (2023).
- Oberlin, D. T., et al. Diagnostic value of guided biopsies: Fusion and cognitive-registration magnetic resonance imaging versus conventional ultrasound biopsy of the prostate. Urology. 92, 75-79 (2016).
- Khoo, C. C., et al. A comparison of prostate cancer detection between visual estimation (cognitive registration) and image fusion (software registration) targeted transperineal prostate biopsy. J Urol. 205 (4), 1075-1081 (2021).
- Fleville, S., et al. Diagnostic pathway outcomes for biparametric magnetic resonance imaging-targeted lesions using cognitive registration and freehand transperineal prostate biopsy in biopsy-naïve men (CRAFT single-center study). J Urol. 212 (6), 821-831 (2024).
- Won, S. Y., Cho, N. H., Choi, Y. D., Park, S. Y. Transrectal ultrasound-guided targeted biopsy of transition zone prostate cancer under cognitive registration with prebiopsy MRI and sonographic findings. Clin Radiol. 75 (2), 157.e21-157.e27 (2020).
- Pepe, P., Pennisi, M. Morbidity following transperineal prostate biopsy: Our experience in 8.500 men. Arch Ital Urol Androl. 94 (2), 155-159 (2022).
- Cornford, P., et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG guidelines on prostate cancer-2024 update. Part I: Screening, diagnosis, and local treatment with curative intent. Eur Urol. 86 (2), 148-163 (2024).
- Pepe, P., et al. 68Ga-PSMA PET/CT and prostate cancer diagnosis: Which SUVmax value. In Vivo. 37 (3), 1318-1322 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены