Method Article
ביופסיית ערמונית מונחית היתוך קוגניטיבי באמצעות הדמיית תהודה מגנטית רב-פרמטרית ואולטרסאונד טרנס-רקטלי
* These authors contributed equally
In This Article
Summary
ביופסיה של הערמונית היא שיטת האבחון הסטנדרטית הזהב לסרטן הערמונית. ביופסיית ערמונית מונחית היתוך קוגניטיבי, המשלבת אולטרסאונד טרנס-רקטלי עם פרמטרי MRI שנמדדו מראש, משפרת את דיוק הביופסיה ומשפרת את שיעור הגילוי של סרטן ערמונית משמעותי מבחינה קלינית.
Abstract
לביופסיית ערמונית מסורתית מונחית אולטרסאונד טרנס-רקטלי (TRUS) יש רגישות וסגוליות מוגבלות, במיוחד לגילוי סרטן הערמונית בשלב מוקדם, עקב היעדר מיקוד מדויק של הנגע. פותחה שיטת ביופסיה משופרת של ערמונית מונחית היתוך קוגניטיבי כדי לשפר את מיקוד הנגעים על ידי שילוב שלושה פרמטרים של תמונות MRI רב-פרמטריות של הערמונית (mpMRI) בתמונות TRUS. מדידת mpMRI של הערמונית מבוצעת בתחילה כדי להשיג שלושה פרמטרים מרכזיים: זווית הסיבוב (α), המרחק מדופן פי הטבעת (X) והמרחק מקודקוד הערמונית (Y). פרמטרים אלה מיושמים לאחר מכן באופן קוגניטיבי בביופסיית מחט ערמונית מונחית TRUS בזמן אמת כדי לזהות נגעי מטרה. שיטת ביופסיה משופרת זו של היתוך קוגניטיבי טרנספרינאלי משפרת את דיוק האבחון, משפרת את יכולת השחזור ומפחיתה את ההסתמכות על חווית המפעיל. יישום קליני ב-423 חולים הראה שיעור גילוי של סרטן הערמונית של 73.5%, כאשר 62.9% סווגו כסרטן משמעותי מבחינה קלינית. בהשוואה לשיטות עתירות ציוד כגון ביופסיית היתוך MRI-אולטרסאונד, גישה זו חסכונית, מעשית ומתאימה היטב לאימוץ קליני רחב יותר. בנוסף, הגמישות של השיטה תומכת באינטגרציה עם טכניקות הדמיה אחרות, כגון 68Ga-PSMA PET/CT, מה שמשפר עוד יותר את שיעורי הגילוי עבור חולים עם סרטן הערמונית בסיכון גבוה.
Introduction
סרטן הערמונית הוא דאגה בריאותית עולמית גדולה, עם הערכה של 1,466,680 מקרים חדשים ו-396,792 מקרי מוות שדווחו ברחבי העולם בשנת 2022. סרטן הערמונית הוא הסרטן השני בשכיחותו והגורם החמישי המוביל למוות מסרטן בקרב גברים1. עד שנת 2040, מספר המקרים החדשים של סרטן הערמונית צפוי לעלות ל-2.9 מיליון, כאשר מקרי המוות צפויים להגיע ל-700,000. אבחון מוקדם וטיפול סטנדרטי חיוניים לשיפור שיעורי ההישרדות בחולים עם סרטן הערמונית, וביופסיה של הערמונית נותרה תקן הזהב לאבחון מוקדם.
מאז 1968, אולטרסאונד טרנס-רקטלי (TRUS) הוא כלי חשוב להנחיית ביופסיות ערמונית. עם זאת, הרגישות והספציפיות של ביופסיות ערמונית מונחות TRUS מוגבלות ב-65-74% ו-40-57%3, בהתאמה, במיוחד בזיהוי נגעים בשלב מוקדם או בנפח קטן4. כדי להתגבר על מגבלות אלה, MRI רב-פרמטרי (mpMRI) התגלה כטכניקת הדמיה מעולה, המספקת הערכות מפורטות יותר של רקמת הערמונית ולוקליזציה משופרת של סרטן הערמונית בעל משמעות קלינית. בהשוואה לביופסיה מונחית TRUS מסורתית, mpMRI יכול לזהות בצורה מדויקת יותר נגעים חשודים בתוך הערמונית ולשפר את הדיוק של ביופסיות ממוקדות 5,6.
פותחו מספר טכניקות ביופסיה של הערמונית מונחית MRI, הממנפות את יכולות האבחון המשופרות של mpMRI של הערמונית. טכניקות אלו כוללות ביופסיית ערמונית ממוקדת MRI, ביופסיית ערמונית היתוך אולטרסאונד טרנס-רקטלי MRI וביופסיית ערמונית מונחית היתוך קוגניטיבי 7,8. ביופסיית ערמונית ממוקדת MRI מבוצעת ישירות בתוך סורק ה-MRI, ומאפשרת הנחיית תמונה בזמן אמת במהלך הביופסיה. טכניקה זו מציעה לוקליזציה מצוינת של נגעים; עם זאת, זה יקר וגוזל זמן בשל דרישות ההדמיה והפרוצדורות הממושכות. ביופסיית ערמונית היתוך אולטרסאונד טרנס-רקטלי MRI משלבת תמונות MRI ותמונות TRUS בזמן אמת באמצעות תוכנה מיוחדת, מה שהופך אותה למורכבת ויקרה.
לעומת זאת, ביופסיית ערמונית מונחית היתוך קוגניטיבי מערבת קלינאים המשננים את מיקומי הנגעים מתמונות MR ומשלבים מנטלית מידע זה עם TRUS בזמן אמת במהלך הביופסיה. טכניקה זו אינה דורשת ציוד נוסף, מה שהופך אותה לפשוטה, חסכונית ומתאימה מאוד לאימוץ קליני. עם זאת, ביופסיית ערמונית מונחית היתוך קוגניטיבי תלויה מאוד בניסיון של המטפל, ותהליך לוקליזציה של הנגע מסתמך לחלוטין על זיכרון ושיפוט, מה שמביא להפחתת יכולת השחזור ומגביל את היישום הרחב יותר שלו. כדי להתמודד עם אתגרים אלה, פותחה שיטת ביופסיה משופרת של היתוך קוגניטיבי טרנספרינאלי על ידי שילוב שלושה פרמטרים מרכזיים מתמונות mpMR של הערמונית עם TRUS. שיטה זו ניתנת לשחזור רב, קלה לביצוע ומתאימה היטב ליישום קליני נרחב, ומציעה תמיכה משמעותית לאבחון מדויק של סרטן הערמונית. מאמר זה מפרט את הפרוטוקול והתועלת הקלינית של גישה סטנדרטית זו, ומדגיש את הפוטנציאל שלה לשפר את גילוי סרטן הערמונית בפרקטיקה השגרתית.
Protocol
מחקר זה בהשתתפות משתתפים אנושיים נערך בהתאם לעקרונות שהותוו בהצהרת הלסינקי. הסכמה מדעת בכתב התקבלה מכל המשתתפים לפני הכללתם במחקר. קריטריוני ההכללה וההחרגה הוגדרו בקפידה כדי להבטיח את בטיחות המשתתפים ואת התאמת ההליך.
1. בחירת המטופל
- הגדר את קריטריוני ההכללה הבאים לבחירת המטופל: אנטיגן ספציפי לערמונית (PSA) > 10 ננוגרם/מ"ל; נוכחות של גוש ערמונית חשוד שזוהה על ידי בדיקה רקטלית דיגיטלית (DRE), ללא קשר לרמת ה-PSA; נגעים חשודים שזוהו באמצעות אולטרסאונד טרנס-רקטלי (TRUS), MRI או PSMA PET/CT, ללא קשר לרמת ה-PSA; רמות PSA בין 4 ל-10 ננוגרם/מ"ל בליווי f/tPSA <-0.16, ו/או צפיפות PSA (PSAD) >-0.15 ננוגרם/מ"ל2, ו/או מהירות PSA (PSAV) >-0.75 ננוגרם/מ"ל בשנה; תוצאות חריגות מבדיקות אחרות הקשורות לערמונית, כגון אינדקס בריאות ערמונית מוגבר (PHI) או תוצאות חיוביות של אנטיגן סרטן הערמונית בשתן 3 (PCA3).
- לא לכלול משתתפים במחקר על סמך הקריטריונים הבאים: זיהום חריף או חום במהלך תקופת המחקר; משבר יתר לחץ דם; אי ספיקת לב מפוצה; הפרעות דימום קשות; מחלות נלוות לא מבוקרות או לא יציבות כגון יתר לחץ דם או סוכרת; מצבים אנאליים או רקטליים חמורים, כולל טחורים פנימיים/חיצוניים מתקדמים או פתולוגיה רקטלית/אנאלית משמעותית; מצב דיכוי חיסוני חמור; הפרעות פסיכולוגיות חמורות או משתתפים שאינם מוכנים או אינם מסוגלים לשתף פעולה עם ההליך.
2. קביעת הקואורדינטות התלת מימדיות של הנגע ב-mpMRI
- סקור ביסודיות את מפות ההדמיה המשוקללת T2 (T2WI, איור 1A), הדמיה משוקללת דיפוזיה (DWI, איור 1B) ומקדם דיפוזיה לכאורה (ADC, איור 1C) של סריקות MRI רב-פרמטריות (mpMRI) כדי לזהות את נגעי הערמונית.
הערה: ייתכן שיהיה צורך בהתייעצות עם רדיולוג כדי לאשר את מיקום הנגע לפני הביופסיה. - השתמש בנקודה במרחק של כ-7 מ"מ מדופן פי הטבעת הקדמית כקודקוד. צייר קו אחד דרך קו האמצע של הגוף, אותו ניתן לקבוע על ידי סימפיזה של הערווה או השופכה הבולבוסית. צייר קו נוסף דרך מרכז הנגע. הזווית בין שני הקווים האלה היא התזוזה הזוויתית, שנרשמת כ-α (איור 2A).
הערה: α זווית זו משמשת כדי לקבוע עד כמה מסתובב בדיקת האולטרסאונד כדי ליישר קו עם הנגע במהלך הביופסיה. - מדדו את המרחק ממרכז הנגע למשטח הסרוזלי של פי הטבעת ברצף T2WI ורשמו אותו כ-X (איור 2A).
הערה: מרחק X משמש להנחיית נקודת החדרת המחט במהלך הביופסיה ולקבוע את המיקום שבו מוחדרת מחט הביופסיה ביחס לפי הטבעת. - מדידת המרחק מקודקוד הערמונית (Y) צור מישור העובר הן דרך מרכז קודקוד זווית α והן דרך מרכז הנגע באמצעות מציג DICOM עם MPR (שחזור רב-מישורי) או פונקציית פרוסה אחרת. מדדו את המרחק מהנגע לקודקוד הערמונית במישור זה ורשמו אותו כ-Y (איור 2B).
הערה: המרחק Y הוא קריטי לקביעת עומק חדירת המחט; זה מתאים לעומק שמחט הביופסיה צריכה להגיע אליו במהלך הביופסיה.
3. הכנת מטופל והדמיה
- הנח את המטופל בתנוחת ליטוטומיה. מקם את הישבן בקצה המרכזי המדויק של שולחן הבדיקה. שתי הרגליים נתמכות באופן סימטרי במשענות הרגליים.
- משוך את שק האשכים כלפי מעלה וחשוף את אזור הפרינאום במלואו.
- יש לחטא את אזור הפרינאום עם פובידון-יוד (יודופור) ולעטוף את האזור, ולהשאיר את האתר הפרוצדורלי נגיש.
- הזרקה תת עורית של 1% לידוקאין להרדמה מקומית בהקרנת המישור הרוחבי הגדול ביותר של הערמונית על עור הפרינאום.
- הכנס בעדינות את בדיקת האולטרסאונד הטרנס-רקטלי הדו-כנפי (TRUS) לתוך פי הטבעת. מקם את הגשושית בזווית של 45° כלפי מעלה ביחס לפי הטבעת.
הערה: נקודת החדרת ההרדמה היא בדרך כלל 1.5 ס"מ מפי הטבעת (איור 3). - הזריק 1% לידוקאין לשריר levator ani, קפסולת הערמונית וקודקוד הערמונית באמצעות הנחיית אולטרסאונד במישור הסגיטלי כדי להבטיח הרדמה נאותה במהלך הביופסיה.
4. TRUS ואיחוי קוגניטיבי
- יישר את בדיקת האולטרסאונד עם קו האמצע על ידי איתור מישור בתמונת האולטרסאונד הרוחבית התואם באופן הדוק את מיקום הנגע מהתמונה הרוחבית T2WI ב-mpMRI. לאחר הזיהוי, החזק את הגשושית יציבה והקפיא את תמונת האולטרסאונד ברמת חתך זו.
הערה: ודא שהמישור הסגיטלי של בדיקת האולטרסאונד מיושר עם קו האמצע של הגוף. במיקום הליתוטומיה הסטנדרטי, המישור הסגיטלי של הגשושית ממוקם בדרך כלל ישירות מעל. - הקפיאו את התמונה והשתמשו במרכז הגשושית כקודקוד כדי למדוד את זווית α באולטרסאונד. יישר קצה אחד של זווית α עם הקו המנחה המרכזי בתמונת האולטרסאונד הרוחבית (איור 4A).
הערה: מיקום הקצה השני של זווית α, התואם את מיקום הנגע בתמונת האולטרסאונד. - שחרר את התמונה וסובב את הגשושית עד שהקו המנחה המרכזי של תמונת האולטרסאונד הרוחבית יתיישר עם מיקום הנגע שזוהה ב-MRI. החזק את הגשושית יציבה ללא סיבוב נוסף לאחר השגת הסיבוב לזווית α.
- מקם את בדיקת האולטרסאונד במישור הנגע על ידי קידום הגשושית אופקית לאורך פי הטבעת עד שבדיקת האולטרסאונד של המערך הליניארי תציג את תמונת הערמונית, לאחר סיבוב הגשושית לזווית α הנכונה.
הערה: התמונה הנוכחית המוצגת תואמת את מישור הנגע כפי שנקבע על ידי מדידות ה-MRI הקודמות (איור 4B). - מדוד את המרחק ממשטח הסרוזל הרקטלי למיקום המתאים לערך ה-X שנמדד בעבר ב-MRI, ומאשר את נקודת ההחדרה של מחט הביופסיה.
- מדוד את המרחק מקודקוד הערמונית למיקום המתאים לערך ה-Y שנמדד בעבר ב-MRI בכיוון המקביל לרקטום, תוך הבטחת העומק הנכון להחדרת מחט הביופסיה (איור 4B).
הערה: מדידות X ו-Y אלו מאשרות שהגשושית מיושרת כהלכה עם הנגע בתמונת האולטרסאונד, מה שמאפשר מיקוד מדויק במהלך הביופסיה.
5. ביופסיה ממוקדת
- הכנס את מחט הביופסיה לאורך קו מנחה המחט המתאים למרחק מפי הטבעת (נמדד כ-X בתמונת האולטרסאונד) בהנחיית אולטרסאונד במישור סגיטלי באמצעות בדיקת המערך הליניארי.
- התאם את עומק המחט בהתאם לערך ה-Y שנמדד בעבר, המייצג את המרחק מקודקוד הערמונית. בצע 2-3 ליבות ביופסיה ממוקדות באזור הנגע לאחר הגעה לעומק הנכון (איור 4B).
- חזור על השלבים לעיל עבור כל נגע מטרה אם זוהו נגעים מרובים.
הערה: חיוני לשמור על יציבות בדיקת האולטרסאונד, ויש ליישם את קואורדינטות ה-X וה-Y במדויק עבור כל אתר ביופסיה לאורך כל ההליך. כדי להבטיח דיוק ולהפחית את תנועת הידיים, מומלץ להשתמש בזרוע תמיכה בבדיקת אולטרסאונד לסיוע.
6. ביופסיה שיטתית
- קח ליבת ביופסיה אחת מהקודקוד, קו האמצע והבסיס הן באזור ההיקפי והן באזור המרכזי של האונה השמאלית של הערמונית.
- התאם את מיקום הגשושית וקח ליבה אחת כל אחד מהקודקוד, קו האמצע והבסיס בשני האזורים; לאחר מכן, חזור על התהליך באונה הימנית של הערמונית.
הערה: מומלץ לאסוף בסך הכל 12 ליבות במהלך הביופסיה השיטתית.
7. השלמה
- הסר בעדינות את בדיקת TRUS מפי הטבעת כדי למנוע אי נוחות לאחר ביופסיה.
- נקו את אזורי הפרינאום והחלחולת עם מגבונים סטריליים כדי להסיר שאריות ג'ל או דם.
- הנח כל ליבת ביופסיה במיכלים מסומנים מראש עם חומרים משמרים מתאימים. סמן כל מיכל עם המידע של המטופל ואתר הביופסיה.
- העבר את המיכלים המסומנים עם ליבות ביופסיה למעבדה לפתולוגיה לניתוח היסטופתולוגי.
תוצאות
במקרה זה, ביופסיית הערמונית מונחית היתוך קוגניטיבי זיהתה במדויק נגע סרטן ערמונית משמעותי מבחינה קלינית. נגע זה צוין על ידי MRI בקודקוד השמאלי של הערמונית בקוטר מקסימלי של כ-6 מ"מ וציון PI-RADS של 4, מה שמצביע על סבירות גבוהה לסרטן ערמונית משמעותי מבחינה קלינית.
האבחנה הפתולוגית של נגע ביופסיה זה הייתה אדנוקרצינומה של הערמונית עם הפרטים הבאים (איור 5):
ציון גליסון: 4 + 4 = 8, עם 60% תבנית גליסון מז'ור 4 ו-40% תבנית גליסון מינור 3
קבוצת דרגה של ארגון הבריאות העולמי/ISUP: מסווגת כקבוצת דרגה 4, המצביעה על סיכון בינוני להתקדמות סרטן
עומס הגידול: הגידול תפס 30% מליבות הביופסיה.
פלישה פרינוירולית: שלילית (אין עדות למעורבות עצבית)
פלישה לכלי הדם: שלילי (אין עדות להתפשטות לכלי דם)
ליבות הביופסיה השיטתיות האחרות של הערמונית דווחו כשפירות.
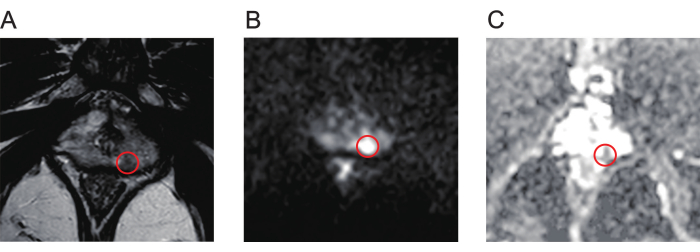
איור 1: תמונות mpMR אופייניות של נגעים בסרטן הערמונית. (A) העיגול האדום מציין את הנגע עם עוצמת אות נמוכה, כפי שמוצג על ידי דימות משוקלל T2. (B) העיגול האדום מציין את הנגע עם עוצמת אות גבוהה, כפי שמוצג על ידי דימות משוקלל דיפוזיה. (C) העיגול האדום מציין את הנגע, ומראה עוצמת אות נמוכה במפת מקדם הדיפוזיה לכאורה. קיצור: mpMR = תהודה מגנטית רב-פרמטרית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
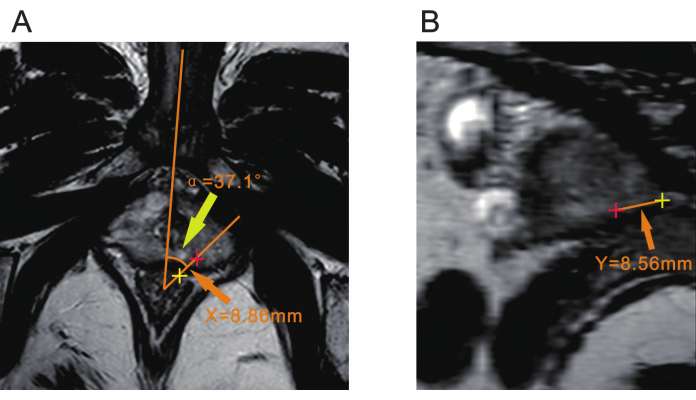
איור 2: שלושה פרמטרים של mpMRI של הערמונית. (A) ראש חץ צהוב מציין את הזווית (α) בין מישור הנגע לקו האמצע של הגוף. ראש החץ הכתום מציין את המרחק (X) ממרכז הנגע (אדום פלוס) למשטח הסרוזל של פי הטבעת (צהוב פלוס). (B) ראש החץ הכתום מציין את המרחק (Y) ממרכז הנגע (פלוס אדום) לקודקוד הערמונית (פלוס צהוב). קיצור: mpMRI = הדמיית תהודה מגנטית רב-פרמטרית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
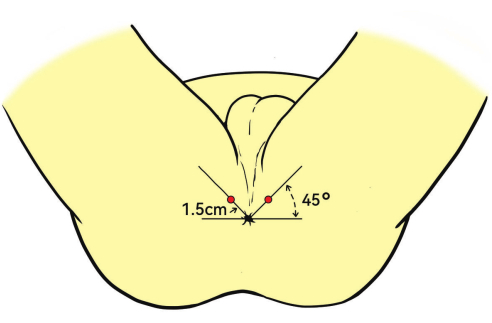
איור 3: מיקום המטופל ואתר ההרדמה. המטופלים ממוקמים בתנוחת ליטוטומיה. אתר ההזרקה המוצג כנקודות האדומות להרדמה עמוקה הוא 1.5 ס"מ מפי הטבעת, בזווית של 45 מעלות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: שלושה פרמטרים של mpMRI של הערמונית מוצגים באולטרסאונד. (A) כשתמונת האולטרסאונד קפואה, מרכז הבדיקה שימש כקודקוד, וקו ההנחיה המרכזי שימש כקצה אחד (L1) כדי למדוד את זווית α שמסומנת על-ידי ראש החץ הכתום, כפי שמוצג ב-mpMRI. לאחר מדידת זווית α המצוינת על ידי ראש החץ הכתום, נקבע הקצה השני (L2) של הזווית בתמונת האולטרסאונד הרוחבית. (B) ערך X ב-mpMRI שמצוין על ידי ראש החץ הכתום שימש כמרחק האנכי לציור קו מקביל עם פני השטח של פי הטבעת, וערך ה-Y ב-mpMRI שמצוין על ידי ראש החץ הצהוב שימש כמרחק אופקי לציור קו אנכי מקודקוד הערמונית (הפלוס הצהוב). הפלוס האדום באתר הצומת מציין את אזור הנגע (אתר הביופסיה). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
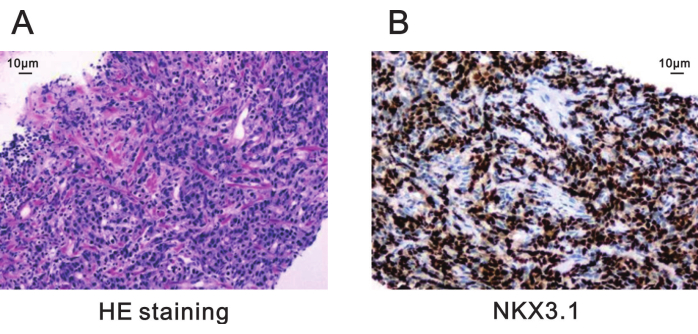
איור 5: צביעה פתולוגית של נגע המטרה של הביופסיה מהערמונית. (A) צביעת HE שמראה אדנוקרצינומה של הערמונית עם ציון גליסון של 4 + 4 = 8 (פי 200). סרגל קנה מידה = 10 מיקרומטר. (B) צביעה אימונוהיסטוכימית לביטוי חיובי של NKX3.1 מצביעה על התמיינות גרועה בסרטן הערמונית (פי 200). סרגל קנה מידה = 10 מיקרומטר. קיצור: HE = המטוקסילין-אאוזין. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
ביופסיה מונחית MRI (MRI-GB) היא אבן פינה של ביופסיה ממוקדת של הערמונית וכוללת ביופסיה ממוקדת MRI (MRI-TB), ביופסיית היתוך אולטרסאונד טרנס-רקטלי (FUS-TB) וביופסיית היתוך קוגניטיבי (COG-TB). MRI-TB משיג דיוק אבחנתי גבוה באמצעות הדמיית MRI בזמן אמת, עם שיעור גילוי סרטן כולל של 80% ושיעור גילוי סרטן משמעותי קלינית של 55%9. עם זאת, עלותו הגבוהה ומורכבותו התפעולית מגבילים את השימוש הנרחב בו. FUS-TB משלב דיוק MRI עם הנחיית אולטרסאונד בזמן אמת באמצעות תוכנה מיוחדת, המציעה לוקליזציה מדויקת; עם זאת, זה דורש ציוד נוסף ותהליכי עבודה מורכבים. לעומת זאת, COG-TB מסתמך אך ורק על יכולתו של המפעיל לשלב מנטלית תמונות MR ואולטרסאונד במהלך ההליך, מה שמבטל את הצורך בציוד מיוחד. גישה זו חסכונית, פשוטה לביצוע וטומנת בחובה פוטנציאל משמעותי ליישום קליני נרחב.
מחקרים הראו כי הדיוק האבחנתי של COG-TB בזיהוי סרטן ערמונית משמעותי מבחינה קלינית (csPCa) דומה לזה של טכניקות ביופסיה מונחות MRI מתקדמות, כגון MRI-TB ו-FUS-TB 7,10. יעילות דומה זו מדגישה את COG-TB כחלופה בת קיימא, במיוחד במסגרות עם גישה מוגבלת לציוד מיוחד. עם זאת, למרות פשטותו, COG-TB נותר תלוי בניסיון של המפעיל. שיטות איחוי קוגניטיביות מסורתיות מסתמכות לרוב על ציוני דרך אנטומיים, כגון ציסטות, גושי היפרפלזיה שפירים של הערמונית, או הסתיידויות, כדי למקם נגעים 8,11,12,13,14,15. עם זאת, מחקרים מצביעים על כך שכ-50% מהנגעים בסרטן הערמונית אינם מציגים מאפיינים היפואקואיים אופייניים ב-TRUS, כאשר לחלק מהחולים חסרים סמנים אנטומיים מובהקים16. שונות זו, יחד עם הסתמכות המפעיל על מודעות מרחבית, מגבילה את יכולת השחזור והמדרגיות של COG-TB.
בשיטת ביופסיה משופרת זו של היתוך קוגניטיבי טרנספרינאלי, לוקליזציה של הנגע מחולקת באמצעות שלושה מדדים מרכזיים של תמונות mpMR: זווית סיבוב (α), מרחק מהסרוזה הרקטלית (X) ומרחק מקודקוד הערמונית (Y). באמצעות רצפי T2WI מתמונות מציאות משולבת, קודקוד זווית α מוגדר כציר הסיבוב, והערמונית מחולקת למישורים כדי לקבוע את מיקום הנגע ולמדוד את ערכי α, X ו-Y. פרמטרים אלה מיושמים לאחר מכן בהנחיית TRUS למיקוד מדויק של הנגע. היישום של שלושת הפרמטרים הללו דומה לסיבוב בדיקת TRUS בפי הטבעת. באמצעות T2WI, הערמונית מחולקת למגזרים בצורת מניפה, המאפשרים זיהוי של מישור הנגע. גם MRI וגם TRUS משתמשים בקו האמצע של הגוף כהתייחסות לזווית α, המתקנת כל פערי מיקום בין שתי שיטות ההדמיה.
הפרמטרים X ו-Yהם חיוניים לקביעת המיקום והעומק של החדרת המחט. ערך ה-X הנמדד במישור T2WI מייצג את המרחק ממרכז הנגע למשטח הסרוזל של פי הטבעת. המרחק ממרכז הנגע לבסיס הערמונית לא נמדד, מכיוון שההנחיה של מסך האולטרסאונד מנחה ביעילות את מחט הביופסיה. משטח הסרוזל הרקטלי קרוב לסמן האפס בקו המנחה, המספק התייחסות קלה ומדויקת לקביעת ערכי X ו-Y. בניגוד לאיחוי קוגניטיבי מסורתי, גישה זו אינה ממקמת נגעים על סמך ציוני הדרך האנטומיים הפנימיים של הערמונית. ברוב המקרים, אין צורך להקפיא את תמונות האולטרסאונד כדי לבצע את המדידות האלה. מיקום נגעים על ידי פרמטרים mpMRI מבטיח שניתן ליישם שיטה זו על מגוון רחב של חולים עם יכולת שחזור גבוהה ועקומת למידה קצרה, מה שמאפשר למפעילים מתחילים להשיג דיוק גבוה לאחר אימון על כ-10 מקרים.
למרות יתרונות השיטה, פערים בין שיטות הדמיית MR ואולטרסאונד, כמו גם שינויים במיקום המטופל ודחיסת רקמות, עלולים לגרום לשגיאות. האופטימיזציות העיקריות כוללות את הדברים הבאים:
ערך X (מרחק מסרוזה פי הטבעת): X נמדד בדרך כלל עם טווח שגיאה של 2-3 מ"מ. תמונות MR בפרוסה דקה יכולות לשפר את הרזולוציה והניגודיות, בעוד שמדידות מרובות על ידי רדיולוגים יכולות לשפר את הדיוק.
ערך Y (מרחק מקודקוד הערמונית): Y מסתמך על מישורי T2WI משוחזרים, שעשויים להיות בעלי רזולוציה מוגבלת. עם זאת, מכיוון שדגימת מחט ביופסיה היא באורך 2 ס"מ, קירוב מיקום הנגע מספיק לעתים קרובות. סריקת פרוסות דקות וסימון גבולות ברור יכולים להפחית שגיאות מדידה.
זווית α (זווית סיבוב): הבטחת מיקום עקבי של המטופל בין MRI ל-TRUS, שימוש בקו האמצע של הגוף כהתייחסות, וייצוב בדיקת האולטרסאונד יכולים למזער סטיות הקשורות לזווית.
שיטה משופרת זו יושמה לאחרונה בקבוצה של 423 חולים, עם גיל ממוצע של 70.8 שנים וערך PSA חציוני של 59.2 ננוגרם/מ"ל. סרטן הערמונית התגלה ב-311 חולים (73.5%), מתוכם 62.9% חלו בסרטן משמעותי מבחינה קלינית. תוצאות אלו מאמתות את האמינות והיעילות של גישה זו. ביופסיה של הערמונית לאחר איחוי MRI-אולטרסאונד יכולה להתבצע בגישה הטרנס-רקטלית או הטרנספרינאלית. פפה ועמיתיו ניתחו נתונים קליניים מ-8,500 מקרים של ביופסיה של ערמונית טרנספרינאלית, ודיווחו על שיעור גילוי סרטן הערמונית של 37.1% ושיעור סיבוכים של 35.9%17. ממצאים אלה מדגישים את פרופיל הבטיחות הגבוה של הגישה הטרנספרינאלית. בנוסף, השיטה הטרנספרינאלית מציעה שיעור גילוי סרטן גבוה יותר וסיכון נמוך משמעותית לזיהום מאשר הגישה הטרנס-רקטלית. בהתבסס על יתרונות אלה, הנחיות האיגוד האירופי לאורולוגיה (EAU) ממליצות על המסלול הטרנספרינאלי כגישה המועדפת לביופסיה של הערמונית18.
ניתן לשלב שיטה זו ביעילות עם שיטות הדמיה אחרות, כגון 68Ga-PSMA PET/CT, כדי לשפר את הזיהוי של סרטן הערמונית בסיכון גבוה. מחקרים הראו כי עם ערך ספיגה מתוקנן (SUVmax) של 8, 68Ga-PSMA PET/CT משיג דיוק אבחנתי של 100% לסרטן ערמונית משמעותי קלינית (csPCa) בחולים עם ISUP בדרגה ≥3,19. ביופסיות ממוקדות של אזורים עם SUVmax ≥ 8 יכולות לשפר עוד יותר את שיעור הזיהוי של csPCa. לסיכום, שיטת ביופסיה משופרת זו של היתוך קוגניטיבי טרנספרינאלי מתייחסת למגבלות העיקריות של COG-TB מסורתי, מציעה יכולת שחזור משופרת, מפחיתה את התלות במפעיל ומרחיבה את היישום הקליני שלה.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
עבודה זו נתמכה על ידי הפרויקט המשותף של ועדת הבריאות של צ'ונגצ'ינג ולשכת המדע והטכנולוגיה (2025MSXM046 עד JY. D.), והקרן הלאומית למדעי הטבע של סין (82470420 ל-J.L.), והתוכנית למנהיג אקדמי רפואי מצטיין של צ'ונגצ'ינג (YXLJ202406 ל-J.L).
Materials
| Name | Company | Catalog Number | Comments |
| 5% Povidone-Iodine Solution | Chengdu Yong'an Pharmaceutical Co., Ltd. | H51022885 | For disinfection of the surgical area |
| 10% Neutral Buffered Formalin Fixative | Guangzhou Vigrass Biotechnology Co., Ltd. | 24010506 | For fixing biopsy tissue |
| AccuCARE Transperineal Solutions | CIVCO Medical Instruments Co., Inc | 620-119 | For supporting the probe |
| Injection syringe (20 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | For local anesthesia |
| Lidocaine | Hubei Tiansheng Pharmaceutical Co., Ltd. | H42021839 | Diluted with saline to 1% for local anesthesia |
| MRI 3.0T | Philips | Ingenia | For prostate examination |
| RadiAnt DICOM Viewer | Medixant | V2024.1 | For reading prostate MRI, outlining lesions, measuring distances, and angles |
| Single-use Biopsy Needle MC1820 | Bard Peripheral Vascular, Inc. | REHU3231 | For needle biopsy sampling |
| Single-use Sterile Needle 0.7 x 80 TWLB | Zhejiang Kangdeli Medical Devices Co., Ltd. | C20230923 | For local anesthesia |
| Sodium chloride injection | Southwest pharmaceutical Co., LTD | H50021610 | For diluting lidocaine |
| Ultrasound | BK Medical | bk3000-01 | For guiding prostate biopsy |
References
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- James, N. D., et al. The Lancet Commission on prostate cancer: planning for the surge in cases. Lancet. 403 (10437), 1683-1722 (2024).
- Jansen, H., Gallee, M. P., Schröder, F. H. Analysis of sonographic pattern in prostatic cancer: comparison of longitudinal and transversal transrectal ultrasound with subsequent radical prostatectomy specimens. Eur Urol. 18 (3), 174-178 (1990).
- Heijmink, S. W. T. P. J., et al. A comparison of the diagnostic performance of systematic versus ultrasound-guided biopsies of prostate cancer. Eur Radiol. 16 (4), 927-938 (2006).
- Verma, S., et al. The current state of MR imaging-targeted biopsy techniques for detection of prostate cancer. Radiology. 285 (2), 343-356 (2017).
- Moore, C. M., et al. Image-guided prostate biopsy using magnetic resonance imaging-derived targets: A systematic review. Eur Urol. 63 (1), 125-140 (2013).
- Wegelin, O., et al. The FUTURE trial: A multicenter randomised controlled trial on target biopsy techniques based on magnetic resonance imaging in the diagnosis of prostate cancer in patients with prior negative biopsies. Eur Urol. 75 (4), 582-590 (2019).
- Falagario, U. G., et al. Prostate cancer detection and complications of MRI-targeted prostate biopsy using cognitive registration, software-assisted image fusion or in-bore guidance: a systematic review and meta-analysis of comparative studies. Prostate Cancer Prostatic Dis. , (2024).
- Pokorny, M., et al. MRI-guided in-bore biopsy for prostate cancer: what does the evidence say? A case series of 554 patients and a review of the current literature. World J Urol. 37 (7), 1263-1279 (2019).
- Wegelin, O., et al. Comparing three different techniques for magnetic resonance imaging-targeted prostate biopsies: A systematic review of in-bore versus magnetic resonance imaging-transrectal ultrasound fusion versus cognitive registration. Is there a preferred technique. Eur Urol. 71 (4), 517-531 (2017).
- Puech, P., et al. Multiparametric MRI-targeted TRUS prostate biopsies using visual registration. BioMed Res Int. 2014, 819360 (2014).
- Ito, M., et al. Superior detection of significant prostate cancer by transperineal prostate biopsy using MRI-transrectal ultrasound fusion image guidance over cognitive registration. Int J Clin Oncol. 28 (11), 1545-1553 (2023).
- Oberlin, D. T., et al. Diagnostic value of guided biopsies: Fusion and cognitive-registration magnetic resonance imaging versus conventional ultrasound biopsy of the prostate. Urology. 92, 75-79 (2016).
- Khoo, C. C., et al. A comparison of prostate cancer detection between visual estimation (cognitive registration) and image fusion (software registration) targeted transperineal prostate biopsy. J Urol. 205 (4), 1075-1081 (2021).
- Fleville, S., et al. Diagnostic pathway outcomes for biparametric magnetic resonance imaging-targeted lesions using cognitive registration and freehand transperineal prostate biopsy in biopsy-naïve men (CRAFT single-center study). J Urol. 212 (6), 821-831 (2024).
- Won, S. Y., Cho, N. H., Choi, Y. D., Park, S. Y. Transrectal ultrasound-guided targeted biopsy of transition zone prostate cancer under cognitive registration with prebiopsy MRI and sonographic findings. Clin Radiol. 75 (2), 157.e21-157.e27 (2020).
- Pepe, P., Pennisi, M. Morbidity following transperineal prostate biopsy: Our experience in 8.500 men. Arch Ital Urol Androl. 94 (2), 155-159 (2022).
- Cornford, P., et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG guidelines on prostate cancer-2024 update. Part I: Screening, diagnosis, and local treatment with curative intent. Eur Urol. 86 (2), 148-163 (2024).
- Pepe, P., et al. 68Ga-PSMA PET/CT and prostate cancer diagnosis: Which SUVmax value. In Vivo. 37 (3), 1318-1322 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved