Method Article
Una biopsia prostatica guidata dalla fusione cognitiva mediante risonanza magnetica multiparametrica ed ecografia transrettale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
La biopsia prostatica è il metodo diagnostico gold standard per il cancro alla prostata. La biopsia prostatica guidata dalla fusione cognitiva, che combina l'ecografia transrettale con parametri di risonanza magnetica premisurati, migliora l'accuratezza della biopsia e aumenta il tasso di rilevamento del cancro alla prostata clinicamente significativo.
Abstract
La biopsia prostatica tradizionale guidata da ecografia transrettale (TRUS) ha una sensibilità e una specificità limitate, in particolare per il rilevamento del cancro alla prostata in stadio iniziale, a causa della mancanza di un targeting preciso della lesione. È stato sviluppato un metodo migliorato di biopsia prostatica guidata dalla fusione cognitiva per migliorare il targeting delle lesioni integrando tre parametri delle immagini RM multiparametriche della prostata (mpMRI) nelle immagini TRUS. La misurazione della mpMRI prostatica viene inizialmente eseguita per ottenere tre parametri chiave: l'angolo di rotazione (α), la distanza dalla parete rettale (X) e la distanza dall'apice della prostata (Y). Questi parametri vengono quindi applicati cognitivamente in una biopsia prostatica con ago guidata da TRUS in tempo reale per rilevare le lesioni bersaglio. Questo metodo di biopsia di fusione cognitiva transperineale migliorato migliora l'accuratezza diagnostica, migliora la riproducibilità e riduce la dipendenza dall'esperienza dell'operatore. L'applicazione clinica in 423 pazienti ha dimostrato un tasso di rilevamento del cancro alla prostata del 73,5%, con il 62,9% classificato come tumori clinicamente significativi. Rispetto ai metodi ad alta intensità di apparecchiature come la biopsia di fusione MRI-ultrasuoni, questo approccio è conveniente, pratico e adatto per un'adozione clinica più ampia. Inoltre, la flessibilità del metodo supporta l'integrazione con altre tecniche di imaging, come la PET/TC 68Ga-PSMA, migliorando ulteriormente i tassi di rilevamento per i pazienti con carcinoma prostatico ad alto rischio.
Introduzione
Il cancro alla prostata è uno dei principali problemi di salute globale, con una stima di 1.466.680 nuovi casi e 396.792 decessi segnalati in tutto il mondo nel 2022. Il cancro alla prostata è il secondo tumore più comune e la quinta causa di morte per cancro tra gli uomini1. Entro il 2040, si prevede che il numero di nuovi casi di cancro alla prostata salirà a 2,9 milioni, con decessi che dovrebbero raggiungere i 700.0002. La diagnosi precoce e il trattamento standardizzato sono fondamentali per migliorare i tassi di sopravvivenza nei pazienti con cancro alla prostata e la biopsia prostatica rimane il gold standard per la diagnosi precoce.
Dal 1968, l'ecografia transrettale (TRUS) è uno strumento importante per guidare le biopsie prostatiche. Tuttavia, la sensibilità e la specificità delle biopsie prostatiche guidate da TRUS sono limitate rispettivamente del 65-74% e del 40-57%3, in particolare nel rilevamento di lesioni in stadio iniziale o di piccolo volume4. Per superare queste limitazioni, la risonanza magnetica multiparametrica (mpMRI) è emersa come una tecnica di imaging superiore, che fornisce valutazioni più dettagliate del tessuto prostatico e una migliore localizzazione del cancro alla prostata clinicamente significativo. Rispetto alla tradizionale biopsia guidata da TRUS, la mpMRI può identificare in modo più accurato le lesioni sospette all'interno della prostata e migliorare la precisione delle biopsie mirate 5,6.
Sono state sviluppate diverse tecniche di biopsia prostatica guidata dalla risonanza magnetica, sfruttando le capacità diagnostiche avanzate della mpMRI prostatica. Queste tecniche includono la biopsia prostatica mirata alla risonanza magnetica, la biopsia prostatica con fusione ecografica transrettale RM e la biopsia prostatica guidata dalla fusione cognitiva 7,8. La biopsia prostatica mirata alla risonanza magnetica viene eseguita direttamente all'interno dello scanner MRI, consentendo la guida delle immagini in tempo reale durante la biopsia. Questa tecnica offre un'eccellente localizzazione delle lesioni; Tuttavia, è costoso e richiede molto tempo a causa dei prolungati requisiti di imaging e procedurali. La biopsia prostatica con fusione ecografica transrettale MRI-MRI combina immagini RM e immagini TRUS in tempo reale tramite software specializzato, rendendola complessa e costosa.
Al contrario, la biopsia prostatica guidata dalla fusione cognitiva coinvolge i medici che memorizzano le posizioni delle lesioni dalle immagini RM e integrano mentalmente queste informazioni con TRUS in tempo reale durante la biopsia. Questa tecnica non richiede apparecchiature aggiuntive, il che la rende semplice, economica e altamente adatta all'adozione clinica. Tuttavia, la biopsia prostatica guidata dalla fusione cognitiva dipende fortemente dall'esperienza del medico e il processo di localizzazione della lesione si basa interamente sulla memoria e sul giudizio, il che si traduce in una ridotta riproducibilità e ne limita l'applicazione più ampia. Per affrontare queste sfide, è stato sviluppato un metodo di biopsia di fusione cognitiva transperineale migliorato integrando tre parametri chiave dalle immagini mpMR della prostata con TRUS. Questo metodo è altamente riproducibile, facile da eseguire e adatto per un'implementazione clinica diffusa, offrendo un supporto significativo per la diagnosi accurata del cancro alla prostata. Questo documento descrive in dettaglio il protocollo e l'utilità clinica di questo approccio standardizzato, evidenziando il suo potenziale per migliorare il rilevamento del cancro alla prostata nella pratica di routine.
Protocollo
Questo studio che ha coinvolto partecipanti umani è stato condotto in conformità con i principi delineati nella Dichiarazione di Helsinki. Il consenso informato scritto è stato ottenuto da tutti i partecipanti prima della loro inclusione nello studio. I criteri di inclusione ed esclusione sono stati attentamente definiti per garantire la sicurezza dei partecipanti e l'idoneità della procedura.
1. Selezione del paziente
- Impostare i seguenti criteri di inclusione per la selezione dei pazienti: antigene prostatico specifico (PSA) > 10 ng/mL; presenza di un nodulo prostatico sospetto rilevato mediante esplorazione rettale digitale (DRE), indipendentemente dal livello di PSA; lesioni sospette identificate tramite ecografia transrettale (TRUS), risonanza magnetica o PSMA PET/CT, indipendentemente dal livello di PSA; livelli di PSA compresi tra 4 e 10 ng/mL accompagnati da f/tPSA < 0,16 e/o densità PSA (PSAD) > 0,15 ng/mL2 e/o velocità PSA (PSAV) > 0,75 ng/ml all'anno; risultati anormali di altri test correlati alla prostata, come l'indice di salute della prostata (PHI) elevato o i risultati positivi dell'antigene 3 del cancro alla prostata urinario (PCA3).
- Escludere i partecipanti dallo studio in base ai seguenti criteri: infezione acuta o febbre durante il periodo di studio; crisi ipertensiva; insufficienza cardiaca scompensata; gravi disturbi emorragici; comorbidità scarsamente controllate o instabili come ipertensione o diabete; gravi condizioni anali o rettali, comprese emorroidi interne/esterne avanzate o patologia rettale/anale significativa; grave stato immunosoppressivo; gravi disturbi psicologici o partecipanti che non vogliono o non sono in grado di collaborare con la procedura.
2. Determinazione delle coordinate tridimensionali della lesione su mpMRI
- Esaminare attentamente le mappe di imaging pesato in T2 (T2WI, Figura 1A), imaging pesato in diffusione (DWI, Figura 1B) e coefficiente di diffusione apparente (ADC, Figura 1C) delle scansioni MRI multiparametriche (mpMRI) per identificare le lesioni della prostata.
NOTA: Potrebbe essere necessaria la consultazione con un radiologo per confermare la posizione della lesione prima della biopsia. - Utilizzare un punto a circa 7 mm dalla parete rettale anteriore come vertice. Traccia una linea attraverso la linea mediana del corpo, che può essere determinata dalla sinfisi pubica o dall'uretra bulbosa. Traccia un'altra linea attraverso il centro della lesione. L'angolo tra queste due linee è lo spostamento angolare, registrato come α (Figura 2A).
NOTA: Questo angolo α viene utilizzato per determinare di quanto la sonda ecografica viene ruotata per allinearsi con la lesione durante la biopsia. - Misurare la distanza dal centro della lesione alla superficie sierosa rettale sulla sequenza T2WI e registrarla come X (Figura 2A).
NOTA: La distanza X viene utilizzata per guidare il punto di inserimento dell'ago durante la biopsia e determinare la posizione in cui viene inserito l'ago per biopsia rispetto al retto. - Misurazione della distanza dall'apice della prostata (Y) Creare un piano che passi attraverso sia il centro del vertice dell'angolo di α che il centro della lesione tramite un visualizzatore DICOM con MPR (ricostruzione multiplanare) o un'altra funzione di fetta. Misurare la distanza dalla lesione all'apice della prostata su questo piano e registrarla come Y (Figura 2B).
NOTA: La distanza Y è fondamentale per determinare la profondità di penetrazione dell'ago; Corrisponde alla profondità che l'ago da biopsia deve raggiungere durante la biopsia.
3. Preparazione e imaging del paziente
- Posizionare il paziente in posizione litotomica. Posizionare i glutei esattamente al centro del lettino da visita. Entrambe le gambe sono supportate simmetricamente nei poggiagambe.
- Ritrarre lo scroto verso l'alto ed esporre completamente la regione perineale.
- Disinfettare l'area perineale con iodio povidone (iodoforo) e drappeggiare l'area, lasciando accessibile il sito procedurale.
- Iniettare per via sottocutanea lidocaina all'1% per l'anestesia locale alla proiezione del piano trasverso più grande della prostata sulla pelle perineale.
- Inserire delicatamente la sonda per ecografia transrettale biplano (TRUS) nel retto. Posizionare la sonda con un angolo di 45° verso l'alto rispetto all'ano.
NOTA: Il punto di inserimento dell'anestesia è in genere a 1,5 cm dall'ano (Figura 3). - Iniettare lidocaina all'1% nel muscolo elevatore dell'ano, nella capsula prostatica e nell'apice della prostata tramite guida ecografica sul piano sagittale per garantire un'adeguata anestesia durante la biopsia.
4. TRUS e fusione cognitiva
- Allineare la sonda ecografica con la linea mediana individuando un piano sull'immagine ecografica trasversale che corrisponda il più possibile alla posizione della lesione dall'immagine trasversale T2WI sulla mpMRI. Una volta identificata, tenere ferma la sonda e congelare l'immagine ecografica a questo livello della sezione trasversale.
NOTA: Assicurarsi che il piano sagittale della sonda ecografica sia allineato con la linea mediana del corpo. Nella posizione litotomica standard, il piano sagittale della sonda è tipicamente posizionato direttamente sopra la testa. - Congelare l'immagine e utilizzare il centro della sonda come vertice per misurare l'angolo di α sugli ultrasuoni. Allineare un bordo dell'angolo di α con la linea guida centrale sull'immagine ecografica trasversale (Figura 4A).
NOTA: La posizione dell'altro bordo dell'angolo di α, che corrisponde alla posizione della lesione sull'immagine ecografica. - Sbloccare l'immagine e ruotare la sonda fino a quando la linea guida centrale dell'immagine ecografica trasversale non si allinea con la posizione della lesione identificata alla risonanza magnetica. Tenere ferma la sonda senza ulteriori rotazioni una volta raggiunta la rotazione all'angolo di α.
- Posizionare la sonda ecografica sul piano della lesione facendola avanzare orizzontalmente lungo il retto fino a quando la sonda ecografica lineare visualizza l'immagine della prostata, dopo aver ruotato la sonda all'angolo α corretto.
NOTA: L'immagine corrente visualizzata corrisponde al piano della lesione come determinato dalle precedenti misurazioni MRI (Figura 4B). - Misurare la distanza dalla superficie sierosa rettale alla posizione corrispondente al valore X precedentemente misurato alla risonanza magnetica, confermando il punto di inserimento dell'ago per biopsia.
- Misurare la distanza dall'apice della prostata alla posizione corrispondente al valore Y precedentemente misurato alla risonanza magnetica nella direzione parallela al retto, garantendo la corretta profondità per l'inserimento dell'ago da biopsia (Figura 4B).
NOTA: Queste misurazioni X e Y confermano che la sonda è correttamente allineata con la lesione sull'immagine ecografica, consentendo un targeting preciso durante la biopsia.
5. Biopsia mirata
- Inserire l'ago per biopsia lungo la linea guida dell'ago corrispondente alla distanza dal retto (misurata come X sull'immagine ecografica) sotto guida ecografica sul piano sagittale utilizzando la sonda array lineare.
- Regolare la profondità dell'ago in base al valore Y precedentemente misurato, che rappresenta la distanza dall'apice della prostata. Eseguire 2-3 nuclei bioptici mirati nell'area della lesione una volta raggiunta la profondità corretta (Figura 4B).
- Ripetere i passaggi precedenti per ciascuna lesione target se vengono identificate più lesioni.
NOTA: È fondamentale mantenere la stabilità della sonda ecografica e le coordinate X e Y devono essere applicate accuratamente per ogni sito di biopsia durante tutta la procedura. Per garantire la precisione e ridurre il movimento della mano, si consiglia di utilizzare un braccio di supporto della sonda ecografica per l'assistenza.
6. Biopsia sistematica
- Prelevare un nucleo bioptico dall'apice, dalla linea mediana e dalla base sia nella zona periferica che in quella centrale del lobo sinistro della prostata.
- Regolare la posizione della sonda e prelevare un nucleo ciascuno dall'apice, dalla linea mediana e dalla base in entrambe le zone; Quindi, ripetere il processo sul lobo destro della prostata.
NOTA: Si consiglia di raccogliere un totale di 12 nuclei durante la biopsia sistematica.
7. Completamento
- Rimuovere delicatamente la sonda TRUS dal retto per evitare qualsiasi disagio dopo la biopsia.
- Pulire le aree perineale e rettale con salviette sterili per rimuovere eventuali residui di gel o sangue.
- Posizionare ogni nucleo bioptico in contenitori pre-etichettati con conservanti appropriati. Contrassegnare ogni contenitore con le informazioni del paziente e il sito della biopsia.
- Trasportare i contenitori etichettati con i nuclei bioptici al laboratorio di patologia per l'analisi istopatologica.
Risultati
In questo caso, la biopsia prostatica guidata dalla fusione cognitiva ha identificato con precisione una lesione del cancro alla prostata clinicamente significativa. Questa lesione è stata indicata dalla risonanza magnetica all'apice sinistro della prostata con un diametro massimo di circa 6 mm e un punteggio PI-RADS di 4, suggerendo un'alta probabilità di cancro alla prostata clinicamente significativo.
La diagnosi patologica di questa lesione bioptica era adenocarcinoma acino prostatico con i seguenti dettagli (Figura 5):
Punteggio di Gleason: 4 + 4 = 8, con il 60% del pattern di Gleason maggiore 4 e il 40% del pattern di Gleason minore 3
Gruppo di grado OMS/ISUP: classificato come gruppo di grado 4, che indica un rischio moderato di progressione del cancro
Carico tumorale: il tumore occupava il 30% dei nuclei bioptici.
Invasione perineurale: negativa (nessuna evidenza di coinvolgimento nervoso)
Invasione vascolare: Negativa (nessuna evidenza di diffusione nei vasi sanguigni)
Gli altri nuclei bioptici sistematici della prostata sono stati segnalati come benigni.
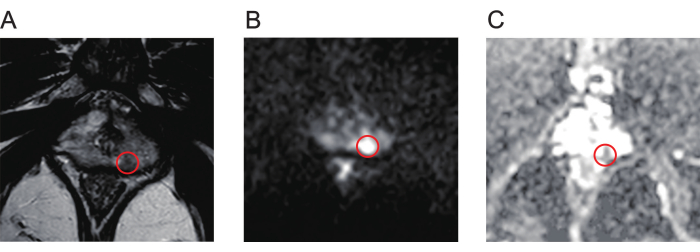
Figura 1: Immagini mpMR tipiche di lesioni del cancro alla prostata. (A) Il cerchio rosso indica la lesione con bassa intensità del segnale, come mostrato dall'imaging pesato in T2. (B) Il cerchio rosso indica la lesione con un'elevata intensità del segnale, come mostrato dall'imaging pesato in diffusione. (C) Il cerchio rosso indica la lesione, mostrando una bassa intensità del segnale sulla mappa del coefficiente di diffusione apparente. Abbreviazione: mpMR = risonanza magnetica multiparametrica. Clicca qui per visualizzare una versione più grande di questa figura.
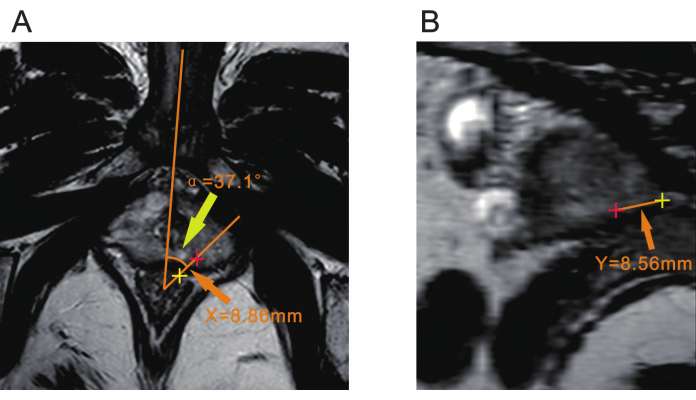
Figura 2: Tre parametri della mpMRI prostatica. (A) La punta della freccia gialla indica l'angolo (α) tra il piano della lesione e la linea mediana del corpo. La punta della freccia arancione indica la distanza (X) dal centro della lesione (più rosso) alla superficie sierosa rettale (più giallo). (B) La punta della freccia arancione indica la distanza (Y) dal centro della lesione (più rosso) all'apice della prostata (più giallo). Abbreviazione: mpMRI = risonanza magnetica multiparametrica. Clicca qui per visualizzare una versione più grande di questa figura.
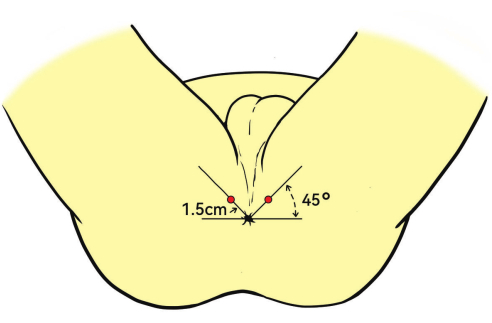
Figura 3: Posizione del paziente e sito di anestesia. I pazienti vengono posti in posizione litotomica. Il sito di iniezione mostrato come i punti rossi per l'anestesia a infiltrazione profonda si trova a 1,5 cm dall'ano, con un angolo di 45°. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Tre parametri della mpMRI prostatica mostrati all'ecografia. (A) Con l'immagine ecografica congelata, il centro della sonda è stato utilizzato come vertice e la linea guida centrale è stata utilizzata come un bordo (L1) per misurare l'angolo di α indicato dalla punta della freccia arancione, come mostrato sulla mpMRI. Una volta misurato l'angolo di α indicato dalla punta della freccia arancione, l'altro bordo (L2) dell'angolo è stato determinato sull'immagine ecografica trasversale. (B) Il valore X sulla mpMRI indicato dalla punta della freccia arancione è stato utilizzato come distanza verticale per tracciare una linea parallela con la superficie sierosa rettale, e il valore Y sulla mpMRI indicato dalla punta della freccia gialla è stato utilizzato come distanza orizzontale per tracciare una linea verticale dall'apice della prostata (il più giallo). Il segno più rosso nel sito di intersezione indica l'area della lesione (sito della biopsia). Clicca qui per visualizzare una versione più grande di questa figura.
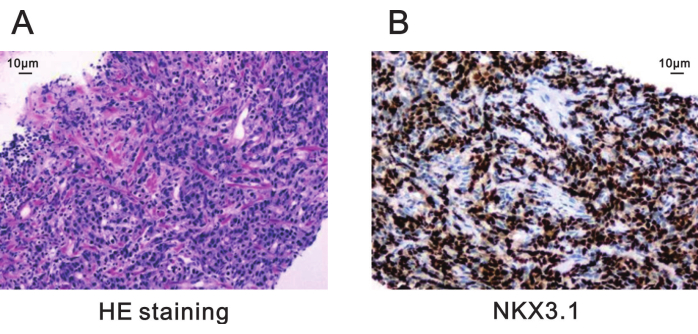
Figura 5: Colorazione patologica della lesione bersaglio della biopsia dalla prostata. (A) Colorazione HE che mostra adenocarcinoma acinarare prostatico con un punteggio di Gleason di 4 + 4 = 8 (200x). Barra della scala = 10 μm. (B) La colorazione immunoistochimica per l'espressione positiva di NKX3.1 indica una scarsa differenziazione nel cancro alla prostata (200x). Barra di scala=10 μm. Abbreviazione: HE = Ematossilina-eosina. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
La biopsia guidata dalla risonanza magnetica (MRI-GB) è una pietra miliare della biopsia prostatica mirata e comprende la biopsia mirata alla risonanza magnetica (MRI-TB), la biopsia di fusione ecografica transrettale MRI (FUS-TB) e la biopsia di fusione cognitiva (COG-TB). La risonanza magnetica-TB raggiunge un'elevata accuratezza diagnostica attraverso l'imaging RM in tempo reale, con un tasso di rilevamento complessivo del cancro dell'80% e un tasso di rilevamento del cancro clinicamente significativo del 55%9. Tuttavia, il suo costo elevato e la complessità operativa ne limitano l'uso diffuso. FUS-TB combina la precisione della risonanza magnetica con la guida ecografica in tempo reale utilizzando un software specializzato, offrendo una localizzazione precisa; Tuttavia, richiede attrezzature aggiuntive e flussi di lavoro complessi. Al contrario, la COG-TB si basa esclusivamente sulla capacità dell'operatore di integrare mentalmente le immagini RM ed ecografiche durante la procedura, eliminando la necessità di apparecchiature specializzate. Questo approccio è conveniente, semplice da eseguire e ha un potenziale significativo per un'applicazione clinica diffusa.
Gli studi hanno dimostrato che l'accuratezza diagnostica della COG-TB nel rilevare il cancro alla prostata clinicamente significativo (csPCa) è paragonabile a quella delle tecniche avanzate di biopsia guidata dalla risonanza magnetica, come la risonanza magnetica-TB e la FUS-TB 7,10. Questa efficacia comparabile sottolinea che la COG-TB è una valida alternativa, soprattutto in ambienti con accesso limitato ad apparecchiature specializzate. Nonostante la sua semplicità, tuttavia, il COG-TB rimane dipendente dall'esperienza dell'operatore. I metodi tradizionali di fusione cognitiva spesso si basano su punti di riferimento anatomici, come cisti, noduli di iperplasia prostatica benigna o calcificazioni, per posizionare le lesioni 8,11,12,13,14,15. Tuttavia, la ricerca indica che circa il 50% delle lesioni del cancro alla prostata non presenta caratteristiche ipoecogene tipiche su TRUS, con alcuni pazienti privi di marcatori anatomici distinti16. Questa variabilità, unita alla dipendenza dell'operatore dalla consapevolezza spaziale, limita la riproducibilità e la scalabilità del COG-TB.
In questo metodo di biopsia di fusione cognitiva transperineale migliorato, la localizzazione della lesione viene parametrizzata utilizzando tre metriche chiave delle immagini mpMR: angolo di rotazione (α), distanza dalla sierosa rettale (X) e distanza dall'apice della prostata (Y). Utilizzando le sequenze T2WI delle immagini RM, il vertice dell'angolo di α è definito come l'asse di rotazione e la prostata è segmentata in piani per determinare la posizione della lesione e misurare i valori α, X e Y. Questi parametri vengono quindi applicati sotto la guida TRUS per un targeting preciso della lesione. L'applicazione di questi tre parametri è simile alla rotazione della sonda TRUS nel retto. Utilizzando T2WI, la prostata viene divisa in settori a forma di ventaglio, consentendo l'identificazione del piano della lesione. Sia la risonanza magnetica che la TRUS utilizzano la linea mediana del corpo come riferimento per l'angolo di α, che corregge eventuali discrepanze di posizione tra le due modalità di imaging.
I parametri X e Y sono fondamentali per determinare la posizione e la profondità di inserimento dell'ago. Il valore X misurato sul piano T2WI rappresenta la distanza dal centro della lesione alla superficie sierosa rettale. La distanza dal centro della lesione alla base della prostata non è stata misurata, poiché le linee guida dello schermo ecografico guidano efficacemente l'ago della biopsia. La superficie sierosa rettale è vicina al marcatore zero sulla linea guida, il che fornisce un riferimento facile e preciso per determinare i valori X e Y. A differenza della fusione cognitiva tradizionale, questo approccio non posiziona le lesioni in base ai punti di riferimento anatomici interni della prostata. Nella maggior parte dei casi, non è necessario congelare le immagini ecografiche per eseguire queste misurazioni. Il posizionamento delle lesioni mediante parametri mpMRI garantisce che questo metodo possa essere applicato a un'ampia gamma di pazienti con un'elevata riproducibilità e una breve curva di apprendimento, consentendo agli operatori alle prime armi di raggiungere un'elevata precisione dopo l'addestramento su circa 10 casi.
Nonostante i vantaggi del metodo, le discrepanze tra le modalità di imaging RM ed ecografico, nonché le variazioni nel posizionamento del paziente e nella compressione dei tessuti, possono introdurre errori. Le ottimizzazioni principali includono quanto segue:
Valore X (distanza dalla sierosa rettale): X viene tipicamente misurato con un intervallo di errore di 2-3 mm. Le immagini RM a fette sottili possono migliorare la risoluzione e il contrasto, mentre le misurazioni multiple da parte dei radiologi possono migliorare l'accuratezza.
Valore Y (distanza dall'apice della prostata): Y si basa su piani T2WI ricostruiti, che possono avere una risoluzione limitata. Tuttavia, poiché un campione di ago da biopsia è lungo 2 cm, è spesso sufficiente approssimare la posizione della lesione. La scansione di fette sottili e una chiara marcatura dei confini possono ridurre gli errori di misurazione.
Angolo di α (angolo di rotazione): garantire un posizionamento coerente del paziente tra la risonanza magnetica e il TRUS, utilizzando la linea mediana del corpo come riferimento e stabilizzando la sonda ecografica può ridurre al minimo le deviazioni legate all'angolo.
Questo metodo migliorato è stato recentemente applicato in una coorte di 423 pazienti, con un'età media di 70,8 anni e un valore mediano di PSA di 59,2 ng/mL. Il cancro alla prostata è stato rilevato in 311 pazienti (73,5%), di cui il 62,9% aveva un cancro clinicamente significativo. Questi risultati convalidano l'affidabilità e l'efficacia di questo approccio. La biopsia prostatica dopo la fusione RM-ecografia può essere eseguita utilizzando l'approccio transrettale o transperineo. Pepe et al. hanno analizzato i dati clinici di 8.500 casi di biopsia prostatica transperineale, riportando un tasso di rilevamento del cancro alla prostata del 37,1% e un tasso di complicanze del 35,9%17. Questi risultati evidenziano l'elevato profilo di sicurezza dell'approccio transperineo. Inoltre, il metodo transperineale offre un tasso di rilevamento del cancro più elevato e un rischio di infezione significativamente inferiore rispetto all'approccio transrettale. Sulla base di questi vantaggi, le linee guida dell'Associazione Europea di Urologia (EAU) raccomandano la via transperineale come approccio preferito per la biopsia prostatica18.
Questo metodo può essere efficacemente integrato con altre modalità di imaging, come la PET/TC 68Ga-PSMA, per migliorare la rilevazione del cancro alla prostata ad alto rischio. Gli studi hanno dimostrato che con un cutoff del valore di captazione standardizzato (SUVmax) di 8,68Ga-PSMA PET/CT raggiunge un'accuratezza diagnostica del 100% per il carcinoma prostatico clinicamente significativo (csPCa) in pazienti con un grado ISUP ≥319. Le biopsie mirate delle regioni con un SUVmax ≥ 8 possono migliorare ulteriormente il tasso di rilevamento di csPCa. In conclusione, questo metodo migliorato di biopsia di fusione cognitiva transperineale affronta i limiti chiave della COG-TB tradizionale, offre una maggiore riproducibilità, riduce la dipendenza dall'operatore e amplia la sua applicabilità clinica.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto dal progetto congiunto della Commissione sanitaria di Chongqing e dell'Ufficio per la scienza e la tecnologia (da 2025MSXM046 a JY. D.), dalla National Natural Science Foundation of China (da 82470420 a J.L.) e dal Program for Outstanding Medical Academic Leader di Chongqing (da YXLJ202406 a J.L.).
Materiali
| Name | Company | Catalog Number | Comments |
| 5% Povidone-Iodine Solution | Chengdu Yong'an Pharmaceutical Co., Ltd. | H51022885 | For disinfection of the surgical area |
| 10% Neutral Buffered Formalin Fixative | Guangzhou Vigrass Biotechnology Co., Ltd. | 24010506 | For fixing biopsy tissue |
| AccuCARE Transperineal Solutions | CIVCO Medical Instruments Co., Inc | 620-119 | For supporting the probe |
| Injection syringe (20 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | For local anesthesia |
| Lidocaine | Hubei Tiansheng Pharmaceutical Co., Ltd. | H42021839 | Diluted with saline to 1% for local anesthesia |
| MRI 3.0T | Philips | Ingenia | For prostate examination |
| RadiAnt DICOM Viewer | Medixant | V2024.1 | For reading prostate MRI, outlining lesions, measuring distances, and angles |
| Single-use Biopsy Needle MC1820 | Bard Peripheral Vascular, Inc. | REHU3231 | For needle biopsy sampling |
| Single-use Sterile Needle 0.7 x 80 TWLB | Zhejiang Kangdeli Medical Devices Co., Ltd. | C20230923 | For local anesthesia |
| Sodium chloride injection | Southwest pharmaceutical Co., LTD | H50021610 | For diluting lidocaine |
| Ultrasound | BK Medical | bk3000-01 | For guiding prostate biopsy |
Riferimenti
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- James, N. D., et al. The Lancet Commission on prostate cancer: planning for the surge in cases. Lancet. 403 (10437), 1683-1722 (2024).
- Jansen, H., Gallee, M. P., Schröder, F. H. Analysis of sonographic pattern in prostatic cancer: comparison of longitudinal and transversal transrectal ultrasound with subsequent radical prostatectomy specimens. Eur Urol. 18 (3), 174-178 (1990).
- Heijmink, S. W. T. P. J., et al. A comparison of the diagnostic performance of systematic versus ultrasound-guided biopsies of prostate cancer. Eur Radiol. 16 (4), 927-938 (2006).
- Verma, S., et al. The current state of MR imaging-targeted biopsy techniques for detection of prostate cancer. Radiology. 285 (2), 343-356 (2017).
- Moore, C. M., et al. Image-guided prostate biopsy using magnetic resonance imaging-derived targets: A systematic review. Eur Urol. 63 (1), 125-140 (2013).
- Wegelin, O., et al. The FUTURE trial: A multicenter randomised controlled trial on target biopsy techniques based on magnetic resonance imaging in the diagnosis of prostate cancer in patients with prior negative biopsies. Eur Urol. 75 (4), 582-590 (2019).
- Falagario, U. G., et al. Prostate cancer detection and complications of MRI-targeted prostate biopsy using cognitive registration, software-assisted image fusion or in-bore guidance: a systematic review and meta-analysis of comparative studies. Prostate Cancer Prostatic Dis. , (2024).
- Pokorny, M., et al. MRI-guided in-bore biopsy for prostate cancer: what does the evidence say? A case series of 554 patients and a review of the current literature. World J Urol. 37 (7), 1263-1279 (2019).
- Wegelin, O., et al. Comparing three different techniques for magnetic resonance imaging-targeted prostate biopsies: A systematic review of in-bore versus magnetic resonance imaging-transrectal ultrasound fusion versus cognitive registration. Is there a preferred technique. Eur Urol. 71 (4), 517-531 (2017).
- Puech, P., et al. Multiparametric MRI-targeted TRUS prostate biopsies using visual registration. BioMed Res Int. 2014, 819360 (2014).
- Ito, M., et al. Superior detection of significant prostate cancer by transperineal prostate biopsy using MRI-transrectal ultrasound fusion image guidance over cognitive registration. Int J Clin Oncol. 28 (11), 1545-1553 (2023).
- Oberlin, D. T., et al. Diagnostic value of guided biopsies: Fusion and cognitive-registration magnetic resonance imaging versus conventional ultrasound biopsy of the prostate. Urology. 92, 75-79 (2016).
- Khoo, C. C., et al. A comparison of prostate cancer detection between visual estimation (cognitive registration) and image fusion (software registration) targeted transperineal prostate biopsy. J Urol. 205 (4), 1075-1081 (2021).
- Fleville, S., et al. Diagnostic pathway outcomes for biparametric magnetic resonance imaging-targeted lesions using cognitive registration and freehand transperineal prostate biopsy in biopsy-naïve men (CRAFT single-center study). J Urol. 212 (6), 821-831 (2024).
- Won, S. Y., Cho, N. H., Choi, Y. D., Park, S. Y. Transrectal ultrasound-guided targeted biopsy of transition zone prostate cancer under cognitive registration with prebiopsy MRI and sonographic findings. Clin Radiol. 75 (2), 157.e21-157.e27 (2020).
- Pepe, P., Pennisi, M. Morbidity following transperineal prostate biopsy: Our experience in 8.500 men. Arch Ital Urol Androl. 94 (2), 155-159 (2022).
- Cornford, P., et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG guidelines on prostate cancer-2024 update. Part I: Screening, diagnosis, and local treatment with curative intent. Eur Urol. 86 (2), 148-163 (2024).
- Pepe, P., et al. 68Ga-PSMA PET/CT and prostate cancer diagnosis: Which SUVmax value. In Vivo. 37 (3), 1318-1322 (2023).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon