Method Article
다파라메트릭 자기공명영상(Multiparametric Magnetic Resonance Imaging and Transrectal Ultrasound)을 이용한 인지 융합 유도 전립선 생검(A Cognitive Fusion-guided Prostate Biopsy Using Multiparametric Magnetic Resonance Imaging and Transrectal Ultrasound)
요약
전립선 생검은 전립선암의 황금 표준 진단 방법입니다. 경직장 초음파와 사전 측정된 MRI 매개변수를 결합한 인지 융합 유도 전립선 생검은 생검의 정확도를 개선하고 임상적으로 유의한 전립선암의 발견률을 향상시킵니다.
초록
기존의 경직장 초음파(TRUS) 유도 전립선 생검은 정확한 병변 표적화가 부족하기 때문에 특히 초기 단계의 전립선암을 감지하는 데 민감도와 특이도가 제한적입니다. mpMRI(prostate multiparametric MRI) 이미지의 세 가지 매개변수를 TRUS 이미지에 통합하여 병변 표적화를 향상시키기 위해 개선된 인지 융합 유도 전립선 생검 방법이 개발되었습니다. 전립선 mpMRI 측정은 초기에 회전 각도(α), 직장 벽으로부터의 거리(X), 전립선 정점으로부터의 거리(Y)의 세 가지 주요 매개변수를 얻기 위해 수행됩니다. 그런 다음 이러한 매개변수는 표적 병변을 감지하기 위해 실시간 TRUS 유도 전립선 바늘 생검에 인지적으로 적용됩니다. 이 개선된 경회음부 인지 융합 생검 방법은 진단 정확도를 높이고 재현성을 개선하며 작업자 경험에 대한 의존도를 줄입니다. 423명의 환자를 대상으로 한 임상적용에서 전립선암 발견률은 73.5%였으며, 이 중 62.9%가 임상적으로 유의한 암으로 분류되었다. MRI-초음파 융합 생검과 같은 장비 집약적인 방법과 비교할 때 이 접근 방식은 비용 효율적이고 실용적이며 광범위한 임상 채택에 적합합니다. 또한 이 방법의 유연성은 68Ga-PSMA PET/CT와 같은 다른 이미징 기술과의 통합을 지원하여 고위험 전립선암 환자의 발견률을 더욱 향상시킵니다.
서문
전립선암은 2022년 전 세계적으로 약 1,466,680명의 새로운 사례와 396,792명의 사망자가 보고된 것으로 추정되는 주요 글로벌 건강 문제입니다. 전립선암은 남성의 암 사망 원인 중 두 번째로 흔한 암이자 다섯 번째로 큰 원인이다1. 2040년까지 새로운 전립선암 환자 수는 290만 명으로 증가하고 사망자는 70만 명에 이를 것으로 예상됩니다2. 조기 진단과 표준화된 치료는 전립선암 환자의 생존율을 높이는 데 매우 중요하며, 전립선 생검은 조기 진단을 위한 황금 표준으로 남아 있습니다.
1968년 이래로 경직장 초음파(TRUS)는 전립선 생검을 안내하는 중요한 도구였습니다. 그러나 TRUS 유도 전립선 생검의 민감도와 특이도는 각각 65-74%와 40-57%3로 제한되며, 특히 초기 단계 또는 소량 병변을 검출할 때 더욱 그렇다4. 이러한 한계를 극복하기 위해 다파라메트릭 MRI(mpMRI)는 전립선 조직에 대한 보다 상세한 평가를 제공하고 임상적으로 유의한 전립선암의 국소화를 개선하는 우수한 이미징 기술로 부상했습니다. mpMRI는 기존의 TRUS 유도 생검과 비교하여 전립선 내 의심스러운 병변을 보다 정확하게 식별하고 표적 생검의 정밀도를 향상시킬 수 있습니다 5,6.
전립선 mpMRI의 향상된 진단 기능을 활용하여 여러 MRI 유도 전립선 생검 기술이 개발되었습니다. 이러한 기법에는 MRI 표적 전립선 생검, MRI-경직장 초음파 융합 전립선 생검, 인지 융합 유도 전립선 생검 7,8이 포함된다. MRI 표적 전립선 생검은 MRI 스캐너 내부에서 직접 수행되어 생검 중 실시간 이미지 안내가 가능합니다. 이 기술은 우수한 병변 국소화를 제공합니다. 그러나 장시간의 이미징 및 절차적 요구 사항으로 인해 비용과 시간이 많이 소요됩니다. MRI-경직장 초음파 융합 전립선 생검은 특수 소프트웨어를 통해 MR 이미지와 실시간 TRUS 이미지를 결합하기 때문에 복잡하고 비용이 많이 듭니다.
이와는 대조적으로, 인지 융합 유도 전립선 생검은 임상의가 MR 영상에서 병변 위치를 기억하고 생검 중에 이 정보를 실시간 TRUS와 정신적으로 통합하는 것을 포함합니다. 이 기술은 추가 장비가 필요하지 않으므로 간단하고 비용 효율적이며 임상 채택에 매우 적합합니다. 그러나 인지 융합 유도 전립선 생검은 임상의의 경험에 크게 의존하며, 병변 국소화 과정은 전적으로 기억과 판단에 의존하기 때문에 재현성이 떨어지고 더 광범위한 적용이 제한됩니다. 이러한 문제를 해결하기 위해 전립선 mpMR 이미지의 세 가지 주요 매개변수를 TRUS와 통합하여 개선된 경회음부 인지 융합 생검 방법이 개발되었습니다. 이 방법은 재현성이 높고 수행하기 쉬우며 광범위한 임상 구현에 적합하여 전립선암의 정확한 진단을 위한 상당한 지원을 제공합니다. 이 논문은 이 표준화된 접근 방식의 프로토콜과 임상적 유용성을 자세히 설명하고 일상적인 진료에서 전립선암 감지를 개선할 수 있는 잠재력을 강조합니다.
프로토콜
인간 참가자를 대상으로 한 이 연구는 헬싱키 선언에 명시된 원칙에 따라 수행되었습니다. 연구에 참여하기 전에 모든 참가자로부터 서면 동의서를 받았습니다. 포함 및 제외 기준은 참가자의 안전과 절차의 적합성을 보장하기 위해 신중하게 정의되었습니다.
1. 환자 선택
- 환자 선택을 위해 다음 포함 기준을 설정합니다: 전립선 특이 항원(PSA) > 10ng/mL; PSA 수치에 관계없이 디지털 직장 검사(DRE)에 의해 감지된 의심스러운 전립선 결절의 존재; PSA 수치에 관계없이 경직장 초음파(TRUS), MRI 또는 PSMA PET/CT를 통해 확인된 의심스러운 병변; f/tPSA < 0.16 및/또는 PSA 밀도(PSAD) > 0.15ng/mL2 및/또는 PSA 속도(PSAV) > 연간 0.75ng/ml를 동반하는 4-10ng/mL 사이의 PSA 수준; 전립선 건강 지수(PHI) 상승 또는 비뇨기 전립선암 항원 3호원(PCA3) 양성 결과와 같은 다른 전립선 관련 검사의 비정상적인 결과.
- 다음 기준에 따라 연구에서 참가자를 제외합니다: 연구 기간 동안의 급성 감염 또는 발열; 고혈압 위기; 비대상성 심부전; 심한 출혈 장애; 고혈압 또는 당뇨병과 같은 잘 조절되지 않거나 불안정한 동반 질환; 진행된 내부/외부 치질 또는 심각한 직장/항문 병리를 포함한 심각한 항문 또는 직장 상태; 심한 면역 억제 상태; 심각한 심리적 장애 또는 참가자가 절차에 협조하기를 원하지 않거나 협조할 수 없는 경우.
2. mpMRI에서 병변의 3차원 좌표 측정
- 전립선 병변을 식별하기 위해 다매개변수 MRI(mpMRI) 스캔의 T2 가중 영상(T2WI, 그림 1A), 확산 가중 영상(DWI, 그림 1B) 및 겉보기 확산 계수(ADC, 그림 1C) 맵을 철저히 검토하십시오.
참고: 생검 전에 병변의 위치를 확인하기 위해 방사선 전문의와의 상담이 필요할 수 있습니다. - 전방 직장 벽에서 약 7mm 떨어진 지점을 꼭짓점으로 사용합니다. 신체의 정중선을 통해 하나의 선을 그리는데, 이는 치골 교감 또는 구근 요도에 의해 결정될 수 있습니다. 병변의 중심을 통해 다른 선을 그립니다. 이 두 선 사이의 각도는 α로 기록된 각도 변위입니다(그림 2A).
참고: 이 각도 α는 생검 중 초음파 프로브가 병변과 정렬되도록 얼마나 회전하는지 결정하는 데 사용됩니다. - T2WI 염기서열에서 병변 중심에서 직장 장막 표면까지의 거리를 측정하고 X로 기록합니다(그림 2A).
참고: 거리 X는 생검 중 바늘 삽입 지점을 안내하고 직장을 기준으로 생검 바늘이 삽입되는 위치를 결정하는 데 사용됩니다. - 전립선 정점으로부터의 거리 측정(Y): MPR(multiplanar reconstruction) 또는 다른 슬라이스 기능이 있는 DICOM 뷰어를 통해 α각의 꼭짓점 중심과 병변 중심을 모두 통과하는 평면을 만듭니다. 이 평면에서 병변에서 전립선 정점까지의 거리를 측정하고 Y로 기록합니다(그림 2B).
참고: 거리 Y는 바늘 관통 깊이를 결정하는 데 중요합니다. 이는 생검 중에 생검 바늘이 도달해야 하는 깊이에 해당합니다.
3. 환자 준비 및 이미징
- 환자를 쇄석술 자세로 눕힙니다. 검사대의 정확한 중앙 가장자리에 엉덩이를 놓습니다. 양쪽 다리는 다리 받침대에서 대칭으로 지지됩니다.
- 음낭을 위쪽으로 집어넣고 회음부를 완전히 노출시킵니다.
- 회음부 부위를 포비돈 요오드(요오드포)로 소독하고 해당 부위를 드레이프하여 시술 부위에 접근할 수 있도록 합니다.
- 회음부 피부에 전립선의 가장 큰 횡단면의 돌출부에 국소 마취를 위해 1% 리도카인을 피하로 주입합니다.
- 복엽 경직장 초음파(TRUS) 프로브를 직장에 부드럽게 삽입합니다. 항문을 기준으로 위쪽 각도로 45° 프로브를 배치합니다.
참고: 마취 삽입 지점은 일반적으로 항문에서 1.5cm 떨어져 있습니다(그림 3). - 생검 중 적절한 마취를 보장하기 위해 시상면의 초음파 유도를 통해 거근, 전립선 캡슐 및 전립선 정점에 1% 리도카인을 주입합니다.
4. TRUS와 인지 융합
- mpMRI의 T2WI 가로 이미지에서 병변의 위치와 밀접하게 일치하는 평면을 가로 초음파 이미지에 배치하여 초음파 프로브를 정중선에 정렬합니다. 일단 식별되면 프로브를 안정적으로 잡고 이 단면 수준에서 초음파 이미지를 고정합니다.
알림: 초음파 프로브의 시상면이 신체의 정중선과 정렬되어 있는지 확인하십시오. 표준 쇄석술 위치에서 프로브의 시상면은 일반적으로 바로 머리 위에 위치합니다. - 이미지를 고정하고 프로브의 중심을 정점으로 사용하여 초음파의 α각을 측정합니다. α각의 한쪽 가장자리를 가로 초음파 이미지의 중앙 안내선에 맞춥니다(그림 4A).
참고: α각의 다른 쪽 가장자리의 위치로, 초음파 이미지에서 병변의 위치에 해당합니다. - 횡방향 초음파 이미지의 중앙 안내선이 MRI에서 확인된 병변의 위치와 정렬될 때까지 이미지의 고정을 해제하고 프로브를 회전합니다. α각으로의 회전이 달성되면 더 이상 회전하지 않고 프로브를 안정적으로 유지하십시오.
- 프로브를 올바른 α 각도로 회전한 후 선형 어레이 초음파 프로브가 전립선 이미지를 표시할 때까지 직장을 따라 프로브를 수평으로 전진시켜 초음파 프로브를 병변 평면에 배치합니다.
참고: 표시된 현재 이미지는 이전 MRI 측정에 의해 결정된 병변의 평면에 해당합니다(그림 4B). - 직장 장막 표면에서 MRI에서 이전에 측정된 X 값에 해당하는 위치까지의 거리를 측정하여 생검 바늘의 삽입 지점을 확인합니다.
- 전립선 정점에서 직장과 평행한 방향으로 MRI에서 이전에 측정한 Y 값에 해당하는 위치까지의 거리를 측정하여 생검 바늘 삽입을 위한 정확한 깊이를 보장합니다(그림 4B).
참고: 이러한 X 및 Y 측정은 프로브가 초음파 이미지의 병변과 올바르게 정렬되어 생검 중에 정확한 표적화가 가능함을 확인합니다.
5. 표적 생검
- 선형 배열 프로브를 사용하여 시상면 초음파 유도 하에 직장으로부터의 거리(초음파 이미지에서 X로 측정)에 해당하는 바늘 안내선을 따라 생검 바늘을 삽입합니다.
- 전립선 정점으로부터의 거리를 나타내는 이전에 측정된 Y 값에 따라 바늘 깊이를 조정합니다. 정확한 깊이에 도달하면 병변 부위에서 2-3개의 표적 생검 코어를 수행합니다(그림 4B).
- 여러 병변이 확인된 경우 각 대상 병변에 대해 위의 단계를 반복합니다.
참고: 초음파 프로브의 안정성을 유지하는 것이 중요하며, 시술 전반에 걸쳐 각 생검 부위에 대해 X, Y 좌표를 정확하게 적용해야 합니다. 정밀도를 보장하고 손의 움직임을 줄이려면 초음파 프로브 지지대를 사용하여 도움을 받는 것이 좋습니다.
6. 체계적인 생검
- 전립선 좌엽의 말초 및 중앙 영역 모두에 있는 정점, 정중선 및 기저부에서 하나의 생검 코어를 채취합니다.
- 프로브 위치를 조정하고 두 영역의 정점, 정중선 및 베이스에서 각각 하나의 코어를 가져옵니다. 그런 다음 전립선의 우엽에 이 과정을 반복합니다.
참고: 체계적인 생검 중에 총 12개의 코어를 수집하는 것이 좋습니다.
7. 완성
- 생검 후 불편함을 피하기 위해 직장에서 TRUS 프로브를 부드럽게 제거합니다.
- 멸균 물티슈로 회음부와 직장 부위를 청소하여 남아 있는 젤이나 혈액을 제거합니다.
- 각 생검 코어를 적절한 방부제가 함유된 사전 라벨링된 용기에 넣습니다. 각 용기에 환자의 정보 및 생검 부위를 표시합니다.
- 조직병리학적 분석을 위해 생검 코어가 있는 라벨이 부착된 용기를 병리학 실험실로 운반합니다.
결과
이 경우, 인지 융합 유도 전립선 생검을 통해 임상적으로 유의한 전립선암 병변을 정확하게 식별했습니다. 이 병변은 전립선 좌측 정점에서 최대 직경이 약 6mm이고 PI-RADS 점수가 4인 MRI로 표시되었으며, 이는 임상적으로 유의한 전립선암의 가능성이 높다는 것을 시사합니다.
이 생검 병변의 병리학적 진단은 다음과 같은 세부 사항을 가진 전립선 아시나르 선암종(prostatic acinar adenocarcinoma)이었습니다(그림 5).
글리슨 점수: 4 + 4 = 8, 60% 메이저 글리슨 패턴 4 및 40% 마이너 글리슨 패턴 3
WHO/ISUP 등급 그룹: 등급 그룹 4로 분류되며, 암 진행 위험이 중간 정도임을 나타냅니다.
종양 부담(Tumor burden): 종양이 생검 코어의 30%를 차지했습니다.
신경 주위 침습: 음성(신경 침범의 증거 없음)
혈관 침습: 음성(혈관으로 퍼졌다는 증거 없음)
전립선의 다른 체계적인 생검 코어는 양성으로 보고되었습니다.
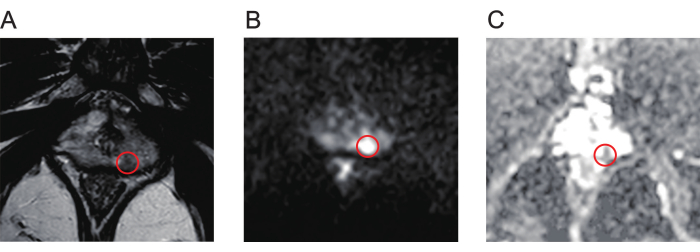
그림 1: 전립선암 병변의 일반적인 mpMR 이미지. (A) 빨간색 원은 T2 가중 영상에서 볼 수 있듯이 신호 강도가 낮은 병변을 나타냅니다. (B) 빨간색 원은 확산 가중 이미징에서 볼 수 있듯이 신호 강도가 높은 병변을 나타냅니다. (C) 빨간색 원은 병변을 나타내며 겉보기 확산 계수 맵에서 낮은 신호 강도를 보여줍니다. 약어 : mpMR = multiparametric magnetic resonance. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
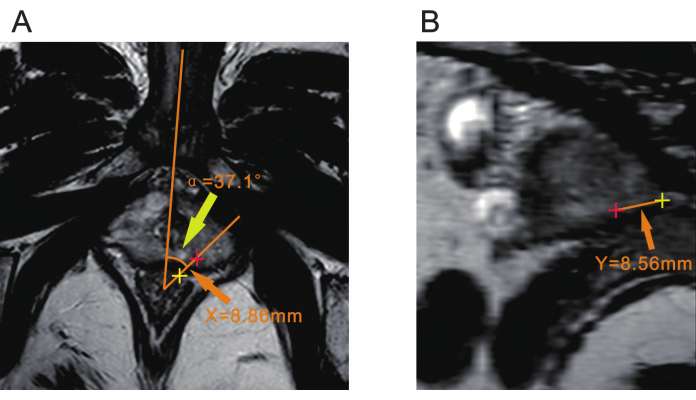
그림 2: 전립선 mpMRI의 세 가지 매개변수. (A) 노란색 화살표는 병변 평면과 신체의 정중선 사이의 각도(α)를 나타냅니다. 주황색 화살촉은 병변 중심(빨간색 플러스)에서 직장 장액 표면(노란색 플러스)까지의 거리(X)를 나타냅니다. (B) 주황색 화살표는 병변 중심(빨간색 플러스)에서 전립선 정점(노란색 플러스)까지의 거리(Y)를 나타냅니다. 약어: mpMRI = multiparametric magnetic resonance imaging. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
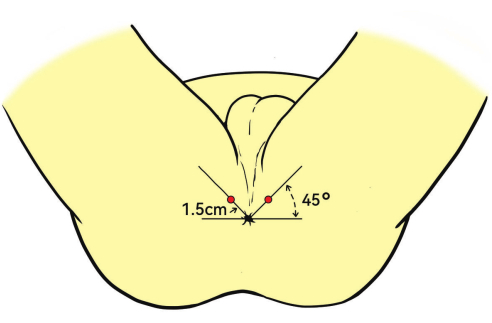
그림 3: 환자 위치 및 마취 부위. 환자는 쇄석술 자세로 배치됩니다. 심부 침투 마취를 위한 빨간 점으로 표시된 주사 부위는 항문에서 1.5cm, 45° 각도로 되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 초음파에서 보여진 전립선 mpMRI의 세 가지 매개변수. (A) 초음파 이미지를 고정한 상태에서 프로브의 중심을 정점으로 사용하고 중앙 안내선을 하나의 가장자리(L1)로 사용하여 mpMRI에 표시된 주황색 화살촉으로 표시된 α 각도를 측정했습니다. 주황색 화살촉으로 표시된 α 각도를 측정한 후 가로 초음파 이미지에서 각도의 다른 가장자리(L2)를 결정했습니다. (B) 주황색 화살촉으로 표시된 mpMRI의 X값은 직장 장액 표면과 평행선을 그리기 위한 수직 거리로 사용되었으며, 노란색 화살촉으로 표시된 mpMRI의 Y 값은 전립선 정점에서 수직선(노란색 플러스)을 그리기 위한 수평 거리로 사용되었습니다. 교차점 부위의 빨간색 플러스는 병변 부위(생검 부위)를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
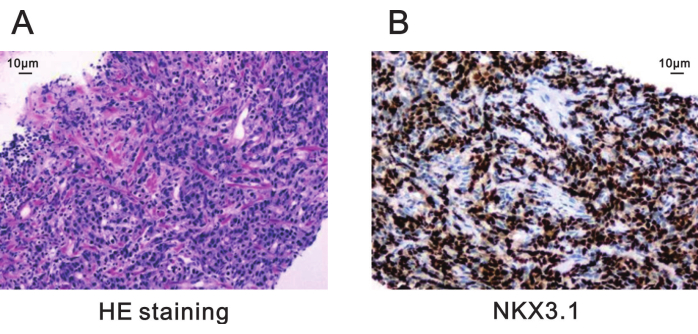
그림 5: 전립선의 생검 표적 병변의 병리학적 염색. (A) Gleason 점수가 4 + 4 = 8 (200x)인 전립선 아시나르 선암종을 보여주는 HE 염색. 스케일 바=10 μm. (B) NKX3.1의 양성 발현을 위한 면역조직화학적 염색은 전립선암에서 분화가 불량함을 나타냅니다(200x). 스케일 바 = 10 μm. 약어 : HE = Hematoxylin-eosin. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
MRI-유도 생검(MRI-GB)은 표적 전립선 생검의 초석이며 MRI 표적 생검(MRI-TB), MRI-경직장 초음파 융합 생검(FUS-TB) 및 인지 융합 생검(COG-TB)을 포함합니다. MRI-TB는 실시간 MR 영상을 통해 전체 암 발견률이 80%이고 임상적으로 유의한 암 발견률이 55%9로 높은 진단 정확도를 달성합니다. 그러나 높은 비용과 운영 복잡성으로 인해 광범위한 사용이 제한됩니다. FUS-TB는 MRI 정밀도와 전문 소프트웨어를 사용하는 실시간 초음파 유도를 결합하여 정확한 위치 파악을 제공합니다. 그러나 추가 장비와 복잡한 워크플로우가 필요합니다. 이와는 대조적으로, COG-TB는 시술 중에 MR과 초음파 이미지를 정신적으로 통합할 수 있는 작업자의 능력에만 전적으로 의존하므로 특수 장비가 필요하지 않습니다. 이 접근 방식은 비용 효율적이고 수행이 간단하며 광범위한 임상 적용에 대한 상당한 잠재력을 가지고 있습니다.
연구에 따르면 임상적으로 유의한 전립선암(csPCa)을 검출하는 데 있어 COG-TB의 진단 정확도는 MRI-TB 및 FUS-TB 7,10과 같은 고급 MRI 유도 생검 기술과 비슷합니다. 이러한 유사 효능은 COG-TB가 특히 특수 장비에 대한 접근이 제한된 환경에서 실행 가능한 대안임을 강조합니다. 그러나 단순함에도 불구하고 COG-TB는 여전히 작업자의 경험에 의존합니다. 전통적인 인지 융합 방법은 종종 낭종, 양성 전립선 비대증 결절 또는 석회화와 같은 해부학적 랜드마크에 의존하여 병변을 배치하는 데 의존합니다 8,11,12,13,14,15. 그러나 연구에 따르면 전립선암 병변의 약 50%는 TRUS에서 전형적인 저반향 특성을 나타내지 않으며, 일부 환자는 뚜렷한 해부학적 표지자가 없다16. 이러한 가변성은 공간 인식에 대한 작업자의 의존도와 결합되어 COG-TB의 재현성과 확장성을 제한합니다.
이 개선된 경회음부 인지 융합 생검 방법에서는 mpMR 이미지의 세 가지 주요 지표인 회전 각도(α), 직장 장막으로부터의 거리(X), 전립선 정점으로부터의 거리(Y)를 사용하여 병변 국소화를 매개변수화합니다. MR 이미지의 T2WI 염기서열을 사용하여 α각의 정점을 회전축으로 정의하고, 전립선을 평면으로 분할하여 병변의 위치를 결정하고 α, X, Y 값을 측정합니다. 그런 다음 이러한 매개변수는 정확한 병변 표적화를 위해 TRUS 지침에 따라 적용됩니다. 이 세 가지 매개변수의 적용은 직장에서 TRUS 프로브를 회전시키는 것과 유사합니다. T2WI를 사용하여 전립선을 부채꼴 모양의 부분으로 나누어 병변의 평면을 식별할 수 있습니다. MRI와 TRUS는 모두 신체의 정중선을 α각의 기준으로 사용하여 두 이미징 양식 간의 위치 불일치를 수정합니다.
매개변수 X와 Y는 바늘 삽입의 위치와 깊이를 결정하는 데 중요합니다. T2WI 평면에서 측정된 X 값은 병변 중심에서 직장 장막 표면까지의 거리를 나타냅니다. 병변 중심에서 전립선 기저부까지의 거리는 측정되지 않았는데, 초음파 검사의 가이드라인이 생검 바늘을 효과적으로 안내하기 때문입니다. 직장 serosal 표면은 지침의 0 마커에 가까우며, 이는 X 및 Y 값을 결정하기 위한 쉽고 정확한 참조를 제공합니다. 전통적인 인지 융합과 달리, 이 접근법은 전립선의 내부 해부학적 경계표에 따라 병변을 배치하지 않습니다. 대부분의 경우 이러한 측정을 수행하기 위해 초음파 이미지를 고정할 필요가 없습니다. mpMRI 매개변수에 의한 병변 포지셔닝은 이 방법을 높은 재현성과 짧은 학습 곡선으로 광범위한 환자에게 적용할 수 있도록 하여 초보 작업자가 약 10개의 사례에 대한 교육 후 높은 정확도를 달성할 수 있도록 합니다.
이 방법의 장점에도 불구하고 MR과 초음파 영상 방식 간의 불일치와 환자 위치 및 조직 압박의 차이로 인해 오류가 발생할 수 있습니다. 주요 최적화는 다음과 같습니다.
X 값(직장 세로사로부터의 거리): X는 일반적으로 2-3mm의 오차 범위로 측정됩니다. 얇은 슬라이스 MR 이미지는 해상도와 대비를 향상시킬 수 있는 반면, 방사선 전문의의 다중 측정은 정확도를 향상시킬 수 있습니다.
Y 값(전립선 정점으로부터의 거리): Y는 해상도가 제한될 수 있는 재구성된 T2WI 평면에 의존합니다. 그러나 생검 바늘 샘플의 길이가 2cm이기 때문에 병변의 위치를 대략적으로 파악하는 것만으로도 충분한 경우가 많습니다. 얇은 슬라이스 스캔과 명확한 경계 표시는 측정 오류를 줄일 수 있습니다.
α 각도(회전 각도): 신체 정중선을 기준으로 사용하여 MRI와 TRUS 사이의 일관된 환자 위치를 보장하고 초음파 프로브를 안정화하면 각도 관련 편차를 최소화할 수 있습니다.
이 개선된 방법은 최근 평균 연령 70.8세, PSA 평균 값 59.2ng/mL의 423명의 환자 코호트에 적용되었습니다. 전립선암은 311명(73.5%)의 환자에서 발견되었으며, 그 중 62.9%는 임상적으로 유의한 암을 가지고 있었다. 이러한 결과는 이 접근 방식의 신뢰성과 효과를 검증합니다. MRI-초음파 융합 후 전립선 생검은 경직장 또는 경회음부 접근법을 사용하여 수행할 수 있습니다. Pepe 등은 8,500건의 경회음부 전립선 생검 사례의 임상 데이터를 분석한 결과, 전립선암 발견률이 37.1%, 합병증 발생률이 35.9%라고 보고했습니다17. 이러한 결과는 경회음부 접근법의 높은 안전성 프로파일을 강조합니다. 또한, 경회음부법은 경직장 접근법보다 암 발견률이 높고 감염 위험이 현저히 낮습니다. 이러한 장점을 바탕으로 유럽비뇨기과학회부(European Association of Urology, EAU)의 가이드라인은 전립선 생검에서 선호되는 접근법으로 경회음부 경로를 권장하고 있다18.
이 방법은 68Ga-PSMA PET/CT와 같은 다른 이미징 방식과 효과적으로 통합되어 고위험 전립선암 검출을 향상시킬 수 있습니다. 연구에 따르면 표준화된 흡수 값(SUVmax) 컷오프가 8, 68Ga-PSMA PET/CT는 ISUP 등급 ≥319 환자에서 임상적으로 유의한 전립선암(csPCa)에 대한 100% 진단 정확도를 달성합니다. SUVmax ≥ 8을 사용한 부위의 표적 생검은 csPCa의 검출률을 더욱 향상시킬 수 있습니다. 결론적으로, 이 개선된 경회음부 인지 융합 생검 방법은 기존 COG-TB의 주요 한계를 해결하고, 재현성을 향상시키고, 작업자 의존도를 줄이고, 임상 적용 가능성을 넓힙니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 연구는 충칭 보건 위원회와 과학기술국의 공동 프로젝트(2025MSXM046 to JY. D.), 중국 국립 자연 과학 재단(82470420 to J.L.), 충칭 우수 의학 학술 지도자 프로그램(YXLJ202406 to J.L.)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 5% Povidone-Iodine Solution | Chengdu Yong'an Pharmaceutical Co., Ltd. | H51022885 | For disinfection of the surgical area |
| 10% Neutral Buffered Formalin Fixative | Guangzhou Vigrass Biotechnology Co., Ltd. | 24010506 | For fixing biopsy tissue |
| AccuCARE Transperineal Solutions | CIVCO Medical Instruments Co., Inc | 620-119 | For supporting the probe |
| Injection syringe (20 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | For local anesthesia |
| Lidocaine | Hubei Tiansheng Pharmaceutical Co., Ltd. | H42021839 | Diluted with saline to 1% for local anesthesia |
| MRI 3.0T | Philips | Ingenia | For prostate examination |
| RadiAnt DICOM Viewer | Medixant | V2024.1 | For reading prostate MRI, outlining lesions, measuring distances, and angles |
| Single-use Biopsy Needle MC1820 | Bard Peripheral Vascular, Inc. | REHU3231 | For needle biopsy sampling |
| Single-use Sterile Needle 0.7 x 80 TWLB | Zhejiang Kangdeli Medical Devices Co., Ltd. | C20230923 | For local anesthesia |
| Sodium chloride injection | Southwest pharmaceutical Co., LTD | H50021610 | For diluting lidocaine |
| Ultrasound | BK Medical | bk3000-01 | For guiding prostate biopsy |
참고문헌
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- James, N. D., et al. The Lancet Commission on prostate cancer: planning for the surge in cases. Lancet. 403 (10437), 1683-1722 (2024).
- Jansen, H., Gallee, M. P., Schröder, F. H. Analysis of sonographic pattern in prostatic cancer: comparison of longitudinal and transversal transrectal ultrasound with subsequent radical prostatectomy specimens. Eur Urol. 18 (3), 174-178 (1990).
- Heijmink, S. W. T. P. J., et al. A comparison of the diagnostic performance of systematic versus ultrasound-guided biopsies of prostate cancer. Eur Radiol. 16 (4), 927-938 (2006).
- Verma, S., et al. The current state of MR imaging-targeted biopsy techniques for detection of prostate cancer. Radiology. 285 (2), 343-356 (2017).
- Moore, C. M., et al. Image-guided prostate biopsy using magnetic resonance imaging-derived targets: A systematic review. Eur Urol. 63 (1), 125-140 (2013).
- Wegelin, O., et al. The FUTURE trial: A multicenter randomised controlled trial on target biopsy techniques based on magnetic resonance imaging in the diagnosis of prostate cancer in patients with prior negative biopsies. Eur Urol. 75 (4), 582-590 (2019).
- Falagario, U. G., et al. Prostate cancer detection and complications of MRI-targeted prostate biopsy using cognitive registration, software-assisted image fusion or in-bore guidance: a systematic review and meta-analysis of comparative studies. Prostate Cancer Prostatic Dis. , (2024).
- Pokorny, M., et al. MRI-guided in-bore biopsy for prostate cancer: what does the evidence say? A case series of 554 patients and a review of the current literature. World J Urol. 37 (7), 1263-1279 (2019).
- Wegelin, O., et al. Comparing three different techniques for magnetic resonance imaging-targeted prostate biopsies: A systematic review of in-bore versus magnetic resonance imaging-transrectal ultrasound fusion versus cognitive registration. Is there a preferred technique. Eur Urol. 71 (4), 517-531 (2017).
- Puech, P., et al. Multiparametric MRI-targeted TRUS prostate biopsies using visual registration. BioMed Res Int. 2014, 819360 (2014).
- Ito, M., et al. Superior detection of significant prostate cancer by transperineal prostate biopsy using MRI-transrectal ultrasound fusion image guidance over cognitive registration. Int J Clin Oncol. 28 (11), 1545-1553 (2023).
- Oberlin, D. T., et al. Diagnostic value of guided biopsies: Fusion and cognitive-registration magnetic resonance imaging versus conventional ultrasound biopsy of the prostate. Urology. 92, 75-79 (2016).
- Khoo, C. C., et al. A comparison of prostate cancer detection between visual estimation (cognitive registration) and image fusion (software registration) targeted transperineal prostate biopsy. J Urol. 205 (4), 1075-1081 (2021).
- Fleville, S., et al. Diagnostic pathway outcomes for biparametric magnetic resonance imaging-targeted lesions using cognitive registration and freehand transperineal prostate biopsy in biopsy-naïve men (CRAFT single-center study). J Urol. 212 (6), 821-831 (2024).
- Won, S. Y., Cho, N. H., Choi, Y. D., Park, S. Y. Transrectal ultrasound-guided targeted biopsy of transition zone prostate cancer under cognitive registration with prebiopsy MRI and sonographic findings. Clin Radiol. 75 (2), 157.e21-157.e27 (2020).
- Pepe, P., Pennisi, M. Morbidity following transperineal prostate biopsy: Our experience in 8.500 men. Arch Ital Urol Androl. 94 (2), 155-159 (2022).
- Cornford, P., et al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG guidelines on prostate cancer-2024 update. Part I: Screening, diagnosis, and local treatment with curative intent. Eur Urol. 86 (2), 148-163 (2024).
- Pepe, P., et al. 68Ga-PSMA PET/CT and prostate cancer diagnosis: Which SUVmax value. In Vivo. 37 (3), 1318-1322 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유