Method Article
Интубация, центральный венозный катетер и установка артериального катетера у свиней для трансляционных исследований в абдоминальной трансплантационной хирургии
В этой статье
Резюме
Для получения наилучших возможных результатов хирурги, проводящие трансляционные исследовательские эксперименты, должны быть опытными в интубации и установке сосудистых капельниц. В этой статье описываются методы, используемые Лабораторией сохранения органов в Торонто для выполнения этих процедур.
Аннотация
Модели трансляционных хирургических исследований на свиньях имеют решающее значение для разработки безопасных доклинических протоколов. Тем не менее, успех экспериментальных операций зависит не только от хирургических навыков исследовательской группы; Периоперационный уход и процедуры лечения, такие как интубация, установка центрального венозного катетера и артериального катетера, необходимы и имеют первостепенное значение для благоприятных результатов эксперимента. Поскольку в исследовательских группах редко работают анестезиологи или любой другой персонал, кроме хирургической бригады, хирургическая бригада, участвующая в трансляционных исследованиях, должна приобрести и/или развить навыки для выполнения периоперационного ухода. Цель данной статьи – показать методы интубации, центрального венозного катетера и установки артериального катетера, которые использовались и совершенствовались в Лаборатории сохранения органов в Торонто в течение последних 10 лет, чтобы использовать их в качестве ориентира для будущих исследователей, присоединившихся либо к этой команде, либо к любой другой лаборатории, выполняющей протоколы трансляционных исследований в области трансплантации свиней и/или брюшной полости.
Введение
Экспериментальные модели свиней часто используются для изучения болезней человека из-за их схожих анатомических и физиологических свойств. Эти модели имеют решающее значение для разработки безопасных доклинических протоколов, но они также подвержены юридическим и этическим ограничениям1. Использование свиней для исследований должно осуществляться в наилучших возможных условиях, чтобы избежать ненужной гибели животных и страданий из-за осложнений анестезии, не связанных с исследовательским проектом.
Предоперационные методы и навыки, такие как интубация, установка центрального венозного катетера и установка артериального катетера, имеют важное значение для достижения успешных и воспроизводимых результатов.
Каждое животное, проходящее общую анестезию для хирургической процедуры, должно быть интубировано для поддержания открытых дыхательных путей, что обеспечивает вспомогательную вентиляцию легких и предотвращает аспирацию бронхо2. Наиболее распространенными положениями для интубации у свиней являются спинное, боковое и грудное лежание 3,4. Лежачее положение на грудине, как правило, легче для персонала, обученного интубации человека3, что и имеет место в данном исследовательском центре.
Хороший сосудистый доступ необходим для введения жидкостей, лекарств и забора образцов во время и после операции. Применение вазопрессоров широко распространено при операциях по трансплантации брюшной полости из-за гемодинамической нестабильности, возникшей в результате ишемии-реперфузионного повреждения. Введение вазопрессоров через периферический катетер может вызвать местное повреждение тканей из-за сосудосуживающего эффекта5. Установка центрального венозного катетера позволяет вводить большое количество жидкости и вазоппрезоров. Мы отдаем предпочтение чрескожной технике с помощью проводника для установки центрального катетера, поскольку она сводит к минимуму повреждение мягких тканей и сосудов6.
Требуется гемодинамическая стабильность животного во время операции, и артериальное давление является параметром, наиболее часто контролируемым дляэтой цели. Артериальная линия позволяет непрерывно измерять артериальное давление, что является более точным, чем традиционное неинвазивноеизмерение8, поскольку неинвазивные методы занижают значения во время гипертонии и завышают их во время гипотензии 7,8. Точное измерение артериального давления во время этих экспериментов имеет основополагающее значение для контроля количества жидкости и вазопрессоров, которые должны быть введены свинье.
Лаборатория по сохранению органов в Торонто использует модели свиней уже более 10 лет и на протяжении многих лет стандартизировала эти процедуры с отличными результатами. Несмотря на то, что в литературе можно найти и другие подходы к тем же процедурам, цель данной статьи состоит в том, чтобы представить методы, разработанные и усовершенствованные на протяжении многих лет в нашем учреждении.
протокол
Все животные, использованные для этого исследования, получили гуманный уход в соответствии с «Принципами ухода за лабораторными животными», сформулированными Национальным обществом медицинских исследований, и «Руководством по уходу за лабораторными животными», опубликованным Национальными институтами здравоохранения, Онтарио, Канада. Все исследования были одобрены Комитетом по уходу за животными Общего научно-исследовательского института Торонто. В данном исследовании использовались 11-12-недельные самцы йоркширских свиней весом 30-40 кг.
1. Интубация
- Держите свиней не менее чем за 5 дней до процедуры, чтобы они могли приспособиться к окружающей среде и снизить общий уровень стресса
- Голодайте на свинье в течение 6 ч до анестезии.
- Обезболивайте свинью с помощью внутримышечной (в/м) инъекции кетамина (20 мг/кг) в качестве диссоциативного анестетика, мидазолама (0,15 мг/кг) для седативного эффекта и атропина (0,04 мг/кг) для уменьшения слюноотделения и бронхиального секрета в помещении содержания.
- Дайте О2 и изофлуран в дозе 5% с помощью маски после того, как свинья заснет не менее чем на 5 минут.
- Переместите свинью в транспортировочную тележку и перенесите в операционную (операционную).
- Поместите свинью в лежачее положение на операционном столе.
- Поместите вентиляционную маску с 2 л/минО2 и 5% изофлураном.
ПРИМЕЧАНИЕ: Убедитесь, что у свиньи есть усилие на вдохе. - Поместите зонд для насыщения крови кислородом на ухо свиньи.
ПРИМЕЧАНИЕ: Зонд также можно разместить на языке, хвосте, прибылом когтене3, губах или паховой складке. - Попросите ассистента разместить электроды электродов электрокардиограммы и манжету для измерения артериального давления.
ПРИМЕЧАНИЕ: Электроды размещаются в правой подмышечной складке, левой подмышечной складке и левой паховой складке. Манжета для измерения артериального давления может быть размещена как на передней, так и на задней ноге. - Проверьте расслабление челюсти после 4-5 минут вентиляции изофлураном в дозе 5%.
ПРИМЕЧАНИЕ: если отмечается резистентность, продолжайте вентиляцию изофлураном еще 3 мин или до тех пор, пока челюсть не расслабится. - Попросите помощника держать нижнюю челюсть вверх, верхнюю челюсть вниз и отвести язык в сторону.
- Вставьте ларингоскоп с прямым лезвием фрезера вниз по средней линии и приподнимите надгортанник.
ПРИМЕЧАНИЕ: Используйте эндотрахеальную трубку, чтобы надавить вниз на мягкое нёбо и позволить надгортаннику выскочить (Рисунок 1). - Визуализируйте голосовые связки и дважды опрыскайте их неаэрозольным спреем с лидокаином (10 мг/дозированная доза) для предотвращения спазмов во время интубации.
- Снимите ларингоскоп и замените кислородную маску на 30 с.
- Снимите кислородную маску, вставьте прямое лезвие Миллера вниз по средней линии и поднимите надгортанник. Вставьте эндотрахеальную трубку диаметром 7,0 мм за пределы голосовых связок.
ПРИМЕЧАНИЕ: При возникновении сопротивления или спазма голосовых связок повторите шаги 1.13 и 1.14. - Удерживая эндотрахеальную трубку на месте, выдвиньте ларингоскоп и стилет.
- Надуйте манжету эндотрахеальной трубки 5-8 куб. см воздуха и подключите ее к датчику капнометрии, чтобы обеспечить правильное размещение трубки.
ПРИМЕЧАНИЕ: Другие методы обеспечения правильной установки включают поиск грудных проводов, конденсацию в эндотрахеальной трубке и прослушивание двусторонних дыхательных шумов. - Включите аппарат искусственной вентиляции легких и настройте на 15-20 вдохов в минуту, изофлуран до 2%-2,5%, дыхательный объем до 10-15 мл/кг массы тела, а пиковое давление на вдохе между 18-20 смH2O 9,10,11.
- Зафиксируйте эндотрахеальную трубку скотчем.
- Нанесите смазку для глаз, чтобы предотвратить сухость и образование язв во время процедуры.
- Обеспечьте надлежащую анестезию, оценив тонус челюсти и соответствующим образом отрегулировав дозу изофлурана. Жесткие мышцы нижней челюсти указывают на легкий уровень анестезии3.
2. Установка центрального венозного катетера
ПРИМЕЧАНИЕ: Выбор катетера зависит от типа используемой модели. Для моделей выживания используется катетер, который может быть туннелирован в конце процедуры. Для моделей терминалов используется более простая модель (см. Таблицу материалов).
- После интубации, когда свинья находится в лежачем положении, продезинфицируйте обе стороны шеи либо раствором йода, либо хлоргексидина.
- Подготовьте катетер, промыв его 5–10 мл физиологического раствора и убедившись, что внутри него нет воздуха. Поместите расширитель через катетер.
- Осмотрите и протестируйте направляющую проволоку, чтобы убедиться в правильности ее характеристик и функции.
ПРИМЕЧАНИЕ: Направляющая проволока должна свободно перемещаться внутри оболочки и не должна иметь дефектов или изломов. Если замечены какие-либо изменения, замените проводник. - Определите следующие три ориентира на шее свиньи: (1) каудальная ветвь нижней челюсти, (2) краниальная манубриум и (3) краниальная точка правого плеча, образованная большим бугорком плечевой кости6 (рис. 2).
- Вставьте иглу искателя, прикрепленную к шприцу объемом 5 мл, в центр треугольника, образованного тремя ориентирами под углом 45° от кожи и направленного в сторону каудальной стороны, при этом слегка оттягивая эмбол шприца.
- Как только яремная вена будет найдена, извлеките шприц из иглы-искателя и стабилизируйте иглу, положив большой палец на ступицу иглы. Убедитесь, что игла искателя закреплена на месте.
ПРИМЕЧАНИЕ: Если есть подозрение, что кровь, вытекающая из иглы, является артериальной, немедленно извлеките иглу и надавите на нее в течение 5 минут. - Введите проводник в иглу искателя и продвигайтесь вперед в наружную яремную вену (техника Сельдингера12). Сопротивление должно быть минимальным или отсутствовать. Снимите иглу искателя и удерживайте направляющий провод на месте.
ПРИМЕЧАНИЕ: Используйте трассу ЭКГ, чтобы убедиться, что проводник не проникает слишком глубоко. Если отмечаются изменения сердечного ритма, слегка удалите проводник. - Вставьте кончик 11-го лезвия в место прокола и сделайте разрез (около 0,5 см) для расширителя и катетера.
- Проведите расширитель и катетер через проводник, чтобы расширить кожу и подкожную клетчатку. Оказавшись на месте, извлеките расширитель из катетера.
- Отсасывайте из просвета катетера, чтобы обеспечить правильный поток, и промойте 5-10 мл физиологического раствора.
- Втяните катетер в кожу с помощью шелкового шва 0 и убедитесь, что катетер надежно закреплен13.
3. Установка артериального катетера
Примечание: Каротидное расположение артериальной линии является предпочтительным, поскольку оно обеспечивает более прямой путь к сердцу, а сосуды шейки больше, чем бедренные сосуды11. Предпочтительно, чтобы артериальная линия располагалась на контралатеральной стороне центрального венозного катетера и под прямым наблюдением; Если такой возможности нет, его можно разместить на той же стороне, что и венозный катетер.
- Сделайте вертикальный разрез в 5-7 см медиально к трахее с помощью ручки для прижигания (рисунок 3).
- Рассеките подкожную клетчатку и плоскость между кожной клетчаткой и мышцами колли11.
- Рассеките лицевую плоскость между трахеей и грудиномастовидной мышцей, чтобы локализовать и открыть влагалище сонной артерии11 (рисунок 4).
- Используйте тупое расслоение, чтобы изолировать общую сонную артерию (рисунок 5).
- Поместите две шелковые завязки 2-0 вокруг сонной артерии для контроля сосудов и перевяжите дистальную артерию (Рисунок 6).
- Поместите под артерию щипцы под прямым углом.
- Попросите ассистента провести проксимальную завязку и ввести кончик ангиокатической иглы в сонную артерию под углом 45°. Как только появится вспышка крови, слегка продвинуте иглу под небольшим углом, а затем продвигайте катетер только в артерию.
- Извлеките иглу, удерживая катетер на месте.
- Прикрепите катетер к артериальному катетеру, аспирируйте и промойте 5-10 мл физиологического раствора, чтобы убедиться в отсутствии сопротивления.
- Наложите повязку вокруг катетера и артерии, чтобы зафиксировать катетер.
4. Послеоперационный уход (модель выживаемости)
- Проложите туннельный катетер венозного катетера и зафиксируйте его на шее свиньи.
- Как только животное станет гемодинамически стабильным и его можно будет отлучать от вазопрессоров, удалите катетер артериальной линии, перевяжите дистальную сторону сонной артерии и проверьте гемостаз. Закройте рану непрерывным швом.
- Переместите свинью в транспортировочную тележку и расположите ее в кормовом положении.
- Выключите изофлуран и наблюдайте за свиньей до тех пор, пока не появятся признаки восстановления после анестезии (движения и дыхание против аппарата искусственной вентиляции легких).
- Выключите аппарат искусственной вентиляции легких, как только будут отмечены эффективные спонтанные дыхания, но поддерживайте подачу O2 на уровне 2 л/мин.
- Выключите подачу O2 через 10-15 минут. Свинья должна быть в состоянии поддерживать сатурацию не менее 94% самостоятельно. Если это не так, снова включите O2 и повторите оценку еще через 5-10 минут.
- Переместите свинью обратно в загон, как только она сохранит насыщение O2 .
ПРИМЕЧАНИЕ: Свинью следует переместить обратно в загон с установленной эндотрахеальной трубкой. - Удалите эндотрахеальную трубку, как только появятся признаки глотания и/или жевания (через 2-4 часа после окончания операции).
- Следите за свиньей в ее загоне и никогда не оставляйте ее одну. После того, как свинья экстубирована и может сохранять стернальное положение, ее можно оставить без присмотра.
Результаты
Мониторинг свиньи во время операции является обязательным, а нормальные параметры, ожидаемые во время операции, показаны в таблице 1 3,14. Приблизительная продолжительность, необходимая для выполнения каждой процедуры, приведена в таблице 2.
Как упоминалось ранее, эта лаборатория выполняет эти процедуры в течение последних 10 лет. За этот период было проведено 595 экспериментов на печени, 277 экспериментов на почках и 100 экспериментов на поджелудочной железе (табл. 3).
За последние 2 года были проведены 100 экспериментов на поджелудочной железе (для 151 свиньи) и приведены в качестве репрезентативных результатов.
У двух животных были затруднены дыхательные пути, для чего опытному ветеринарному технику потребовалось провести интубацию. Остальная часть процедуры прошла без каких-либо других осложнений. Это соответствует 98,7% успешности интубации (Таблица 4).
К сожалению, за этот период было потеряно пять животных в связи с процедурами установки центрального катетера, что составляет 96,7% успеха (Таблица 4). У трех животных наблюдалась аритмия после установки центрального катетера, и в течение нескольких секунд у них развилась асистолия; После этого лекарства не вводились, так как из-за характера экспериментов это считалось теплым временем ишемии ишемии и, возможно, повлияло на конечные результаты. Одному из животных было проведено вскрытие; В правом желудочке были обнаружены множественные сгустки, а также признаки, указывающие на тромбоэмболию легочной артерии. У двух других животных наблюдалась внезапная сердечная смерть без признаков предшествующей аритмии. При вскрытии были отмечены увеличенные сердца и отек плевры.
Установка артериального катетера всегда выполняется в этом учреждении после установки центрального венозного катеттера; Как упоминалось ранее, пять животных были потеряны во время установки центрального венозного катетера, еще до того, как установка артериального катетера началась. Установка артериального катетера была успешной в 146 оставшихся попытках, что соответствует 100% успешности (Таблица 4).

Рисунок 1: Ориентиры воздушных путей. Эндотрахеальная трубка используется для того, чтобы надавить вниз на мягкое нёбо и позволить надгортаннику выскочить. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Установка центрального венозного катетера с использованием техники триангуляции. Три ориентира на шее свиньи: хвостовая ветвь нижней челюсти, краниальный манубриум и краниальная точка правого плеча, образованная большим бугорком плечевой кости. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
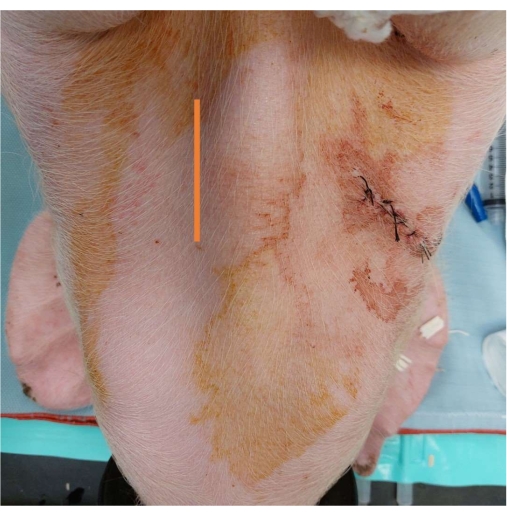
Рисунок 3: Установка артериального катетера. Отметина, показывающая место вертикального разреза на 5-7 см медиально к трахее. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
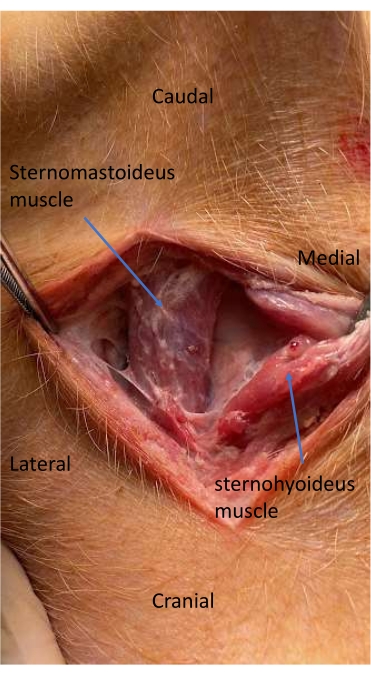
Рисунок 4: Грудиномастовидная и стерноподъязычная мышцы во время диссекции для установки артериальной линии. Лицевая плоскость между трахеей и грудиномастовидной мышцей рассекается для локализации и вскрытия сонной артерии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
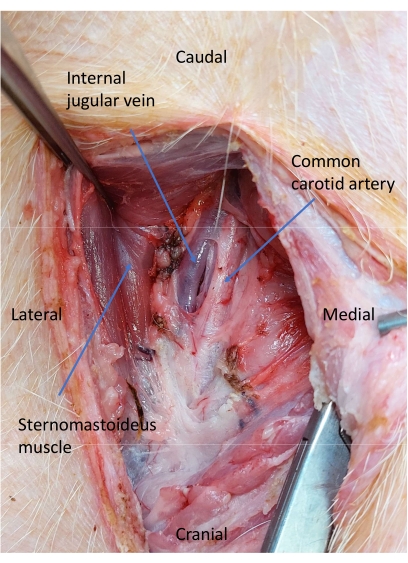
Рисунок 5: Яремная вена и сонная артерия после рассечения сонной артерии. Тупое рассечение проводится для изоляции общей сонной артерии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
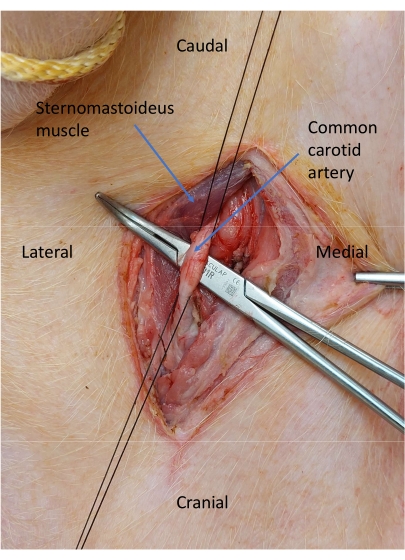
Рисунок 6: Изолированная общая сонная артерия. Два шелковых галстука 2-0 помещаются вокруг сонной артерии для контроля сосудов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Параметр | Нормальный диапазон |
| Температура | 38–39,5 °C |
| Конец CO2 | 40–50 мм рт.ст. |
| Систолическое артериальное давление | 112–139 мм рт.ст. |
| Диастолическое артериальное давление | 72–98 мм рт.ст. |
| Среднее артериальное давление | 86–123 мм рт.ст. |
| Частота сердечных сокращений | 70–100 уд/мин |
| Частота дыхания | 10–20 уд/мин. |
Таблица 1: Нормальные параметры, которые должны поддерживаться во время операции. В таблице указан нормальный диапазон параметров, которые необходимо поддерживать во время операции.
| Процедура | Время (мин) |
| Интубация | 15 ± 5 |
| Центральный венозный катетер | 20 ±10 |
| Артериальная линия | 20 ±10 |
Таблица 2: Продолжительность процедур. В таблице указана приблизительная продолжительность, необходимая для проведения интубации, центральной венозной катетеризации и установки артериального катетера.
| Орган | Количество экспериментов |
| Печень | 595 |
| Почка | 277 |
| Поджелудочная железа | 100 |
Таблица 3: Количество экспериментов на орган. В таблице указано количество экспериментов, проведенных на печени, почках и поджелудочной железе.
| Успешный | Не удалось | Успех (%) | Неудача (%) | |
| Интубации | 149 | 2 | 98.7 | 1.3 |
| Размещение центральной магистрали | 146 | 5 | 96.7 | 3.3 |
| Установка артериального катетера* | 146 | 0 | 100 | 0 |
| *Все установки артериальных капельниц выполняются после установки центрального катетера | ||||
Таблица 4. Процент успеха за одну процедуру. В таблице приведены показатели успешности интубаций, катетеризации центральных вен и установки артериальных капельниц, выполненных у 151 свиньи.
Обсуждение
Каждый исследовательский центр должен создать свои собственные протоколы и рекомендации по моделям трансляционных исследований; Тем не менее, следует придерживаться некоторых основных правил, чтобы гарантировать успешный результат.
Во-первых, свинья должна быть подвергнута физическому осмотру, как только она прибудет в жилищный объект. В общей сложности 5-7 дней кондиционирования необходимо перед процедурой, чтобы снизить уровень стресса и позволить свинье восстановить вес, потерянный во время транспортировки3. Важно отметить, что мы используем свиней, которые поступают с племенной фермы и не выращиваются исключительно в исследовательских целях, и, как ожидается, проблемы со здоровьем могут возникать в течение всего года (сезонные вирусы).
Перед процедурой свинью необходимо натощак на твердую пищу в течение 6-8 ч, однакодо времени операции разрешается пить воду. Также особенно важно помнить, что свиньи подвержены анестезиологическим аритмиям, вызванным анестезией. Постановка ЭКГ во время индукции анестезии и сосудистого доступа помогает их выявить, а при необходимости могут быть назначены антиаритмические препараты3. Это стало важной причиной потери свиней во время наших экспериментов. Сертифицированный ветеринар или опытный ветеринарный техник должен быть доступен на случай, если команда столкнется с проблемой, которую невозможно решить. Ультразвуковое исследование не часто используется в нашей лаборатории из-за ограниченной доступности, поэтому мы оставляем его использование для сложных случаев. Планирование экспериментов с учетом доступности ультразвукового аппарата значительно ограничило бы количество и сроки проведения экспериментов. Тем не менее, если он широко доступен в других исследовательских учреждениях, его использование значительно поощряется.
Опыт хирургической бригады также является ключевым фактором. Весь исследовательский персонал, непосредственно участвующий в хирургической части протоколов в этом исследовательском центре, является обученным хирургом общего профиля, и большинство из них также имеют подготовку в области HPB и/или трансплантационной хирургии. Большинство из них не имеют предыдущего опыта работы с трансляционными моделями свинины. Каждая команда состоит из старшего и младшего научного сотрудника. Старший научный сотрудник имеет опыт работы не менее 1 года в области трансляционных моделей свиней и курирует обучение младшего научного сотрудника основным методам, описанным в этой статье. Младший научный сотрудник обычно становится опытным в течение 4-6 недель.
Вот несколько советов, которые могут быть полезны в случае изменения параметров жизненно важных показателей во время экспериментов. Гипотермия является распространенным осложнением во время операции15; Грелку можно положить на операционный стол, а сверху на свинью можно положить систему согревающего одеяла. Если этих мер недостаточно, можно рассмотреть применение подогретых растворов для внутривенного введения.
Если уровень концевогоCO2 ниже или выше нормы, следует подтвердить правильное размещение эндотрахеальной трубки и надлежащее надувание манжеты. Датчик CO2 следует проверить, чтобы убедиться, что он правильно подключен и работает. Наркозный аппарат следует проверить на наличие утечек, а в случае его истощения заменить шарики углекислого газа. Также важно убедиться, что поток на вдохе, количество вдохов в минуту и пиковое давление на вдохе установлены правильно в соответствии с весом свиньи.
Если датчик пульсоксиметрии не работает в одном из вышеупомянутых мест, сначала следует убедиться, что датчик работает исправно, что аппарат искусственной вентиляции легких включен, что кислород установлен на уровне 2 л/мин и что свинья имеет нормальную окраску. Если все вышеперечисленное в норме, датчик следует переместить в другое из упомянутых мест. Если это не помогает, можно взять анализ газов крови для проверки насыщения кислородом.
В абдоминальной трансплантационной хирургии гипотензия является критическим компонентом постреперфузионного повреждения16. Увеличение скорости внутривенного введения жидкости и использование вазопрессоров (мы используем норадреналин) являются распространенным явлением. Норадреналин обладает как вазопрессорным, так и инотропным действием, поэтому частоту сердечных сокращений необходимо постоянно контролировать. Также важно помнить, что сужение сосудов может нарушить приток крови к недавно пересаженному органу.
Описанные выше процедуры используются для исследований в области абдоминальной трансплантационной хирургии; Тем не менее, мы считаем, что они могут быть адаптированы и использованы для других типов исследований. Модели свиней бесценны для трансляционных исследований, и поэтому исследовательские группы должны обеспечивать гуманное обращение и не допускать боли или страданий животным.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Никакой.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Irrigation, USP | Baxter | JF7124 | Saline |
| Angiocath 16 GA 1.88 , 1.7 x 48 mm | BD | 381157 | |
| Atropine sulfate (8 mg/20 mL - 0.4 mg/mL) | West-Ward | 17733 | 20 mL vial |
| Cook TPN Single Lumen Cathether Set | Cook medical | G08132 | with 10 Fr peel away introducer set |
| Hickman 9.6 F single-lumen CV cathether | Bard | 600560 | |
| Laryngoscope | Heine | ||
| Midazolam (5 mg/mL) | Sandoz | 46237968 | 10 mL vial |
| Miller blade 4 | Heine | 185 mm blade length | |
| Narketan (Ketamine - 100 mg/mL) | Vetoquinal | 8-00223 | 50 mL vial |
| Nasal tracheal tube cuffed 7.0 mm I.D. | Covidien | 86450 | |
| Optixcare eye lube for dogs and cats | Aventix | 5914304 | 20 g |
| Percutaneous Sheath introducer set with integral hemostasis valve/side port for use -7.5 Fr. Catheters | Arrow | SI-09880 | 8.5 Fr, 10 cm, 0.035 inch dia. Spring wire guide |
| Universal Electrosurgical Pad: Split with cord | 3M | 9165 | |
| Valleylab Rocker Switch Pencil Holster | Covidien | E2515H | |
| Xylocaine 10% Spray | AstraZeneca | 73050036 | lidocaine (10 mg/metered dose) |
Ссылки
- Dehoux, J. P., Gianello, P. The importance of large animal models in transplantation. Frontiers in Bioscience: A Journal and Virtual Library. 12, 4864-4880 (2007).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Swindle, M. M. . Swine in the Laboratory Surgery, Anesthesia, Imaging, and Experimental Techniques. , (2015).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Prasanna, N., et al. Safety and efficacy of vasopressor administration through midline catheters. Journal of Critical Care. 61, 1-4 (2021).
- Flournoy, W. S., Mani, S. Percutaneous external jugular vein catheterization in piglets using a triangulation technique. Laboratory Animals. 43 (4), 344-349 (2009).
- Kuck, K., Baker, P. D. Perioperative noninvasive blood pressure monitoring. Anesthesia and Analgesia. 127 (2), 408-411 (2017).
- Pour-Ghaz, I., et al. Accuracy of non-invasive and minimally invasive hemodynamic monitoring: where do we stand. Annals of Translational Medicine. 7 (17), 421 (2019).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments. (101), e52909 (2015).
- Parmentier, C., et al. Normothermic ex vivo pancreas perfusion for the preservation of pancreas allografts before transplantation. Journal of Visualized Experiments. (185), e63905 (2022).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7 (8), 1479-1496 (2012).
- Graham, A. S., Ozment, C., Tegtmeyer, K., Lai, S., Braner, D. A. V. Central venous catheterization. The New England Journal of Medicine. 356 (21), 21 (2009).
- Taylor, R. W., Palagiri, A. V. Central venous catheterization. Critical Care Medicine. 35 (5), 1390-1396 (2007).
- Reed, R., et al. Accuracy of an oscillometric blood pressure monitor in anesthetized pigs. Laboratory Animals. 52 (5), 490-496 (2018).
- Musk, G. C., Costa, R. S., Tuke, J. Body temperature measurements in pigs during general anaesthesia. Laboratory Animals. 50 (2), 119-124 (2016).
- Aggarwal, S., Kang, Y., Freeman, J. A., Fortunato, F. L., Pinsky, M. R. Postreperfusion syndrome: Hypotension after reperfusion of the transplanted liver. Journal of Critical Care. 8 (3), 154-160 (1993).
- Manning, M. W., Kumar, P. A., Maheshwari, K., Arora, H. Post-reperfusion syndrome in liver transplantation-An overview. Journal of Cardiothoracic and Vascular Anesthesia. 34 (2), 501-511 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены