Method Article
Intubation, cathéter veineux central et placement de cathéters artériels chez le porc pour la recherche translationnelle en chirurgie de transplantation abdominale
Dans cet article
Résumé
Pour obtenir les meilleurs résultats possibles, les chirurgiens effectuant des expériences de recherche translationnelle doivent maîtriser l’intubation et le placement des lignes vasculaires. Cet article décrit les techniques utilisées par le Toronto Organ Preservation Laboratory pour effectuer ces procédures.
Résumé
Les modèles de recherche chirurgicale translationnelle chez le porc sont essentiels pour développer des protocoles précliniques sûrs. Cependant, le succès des chirurgies expérimentales ne repose pas uniquement sur les compétences chirurgicales de l’équipe de recherche ; Les procédures de soins et de gestion périopératoires, telles que l’intubation, le cathéter veineux central et le placement du cathéter artériel, sont nécessaires et de la plus haute importance pour des résultats d’expérience favorables. Comme il est rare que les équipes de recherche aient des anesthésiologistes ou tout autre personnel que l’équipe chirurgicale, l’équipe chirurgicale impliquée dans la recherche translationnelle doit acquérir et/ou développer les compétences pour effectuer les soins périopératoires. Le but de cet article est de montrer les techniques d’intubation, de cathéter veineux central et de placement de cathéters artériels utilisées et perfectionnées au Laboratoire de préservation d’organes de Toronto au cours des 10 dernières années, afin de servir de référence pour les futurs chercheurs qui se joindront à cette équipe ou à tout autre laboratoire effectuant des protocoles de recherche translationnelle en transplantation porcine et/ou abdominale.
Introduction
Les modèles expérimentaux de porcs sont souvent utilisés dans l’étude des maladies humaines en raison de leurs propriétés anatomiques et physiologiques similaires. Ces modèles sont cruciaux dans le développement de protocoles précliniques sûrs, mais ils sont également soumis à des restrictions légales et éthiques1. L’utilisation de porcs pour la recherche doit se faire dans les meilleures conditions possibles afin d’éviter des pertes inutiles d’animaux et des souffrances dues à des complications anesthésiques sans rapport avec le projet de recherche.
Les techniques et les compétences préopératoires telles que l’intubation, la mise en place d’un cathéter veineux central et la mise en place d’un cathéter artériel sont essentielles pour obtenir des résultats réussis et reproductibles.
Chaque animal subissant une anesthésie générale pour une intervention chirurgicale doit être intubé pour maintenir une voie respiratoire ouverte, permettant une ventilation assistée et évitant l’aspiration bronchologique2. Les positions d’intubation les plus courantes chez les porcs sont le décubitus dorsal, latéral et sternal 3,4. Le décubitus sternal a tendance à être plus facile pour le personnel formé à l’intubation humaine3, ce qui est le cas dans ce centre de recherche.
Un bon accès vasculaire est essentiel pour l’administration de liquides, de médicaments et de prélèvements pendant et après la chirurgie. L’utilisation de vasopresseurs est fréquente lors des chirurgies de transplantation abdominale en raison de l’instabilité hémodynamique résultant de la lésion d’ischémie-reperfusion. La perfusion de vasopresseurs à travers une ligne périphérique peut provoquer des lésions tissulaires locales en raison des effets vasoconstricteurs5. Le placement d’un cathéter veineux central permet d’infuser de grandes quantités de liquides et de vasoppresors. Nous préférons une technique percutanée assistée par fil-guide pour la mise en place du cathéter central, car elle minimise les dommages aux tissus mous et aux vaisseaux6.
La stabilité hémodynamique de l’animal pendant l’intervention chirurgicale est requise, et la pression artérielle est le paramètre le plus généralement surveillé à cet effet7. Une ligne artérielle permet une mesure continue de la pression artérielle, ce qui est plus précis que la mesure non invasive traditionnelle8, car les techniques non invasives sous-estiment les valeurs pendant l’hypertension et les surestiment pendant l’hypotension 7,8. Une lecture précise de la pression artérielle au cours de ces expériences est fondamentale pour pouvoir contrôler la quantité de liquides et de vasopresseurs qui doivent être administrés au porc.
Le Toronto Organ Preservation Laboratory utilise des modèles porcins depuis plus de 10 ans et a normalisé ces procédures au fil des ans avec d’excellents résultats. Bien que l’on puisse trouver d’autres approches dans la littérature pour les mêmes procédures, l’objectif de cet article est de présenter les techniques développées et perfectionnées au fil des ans dans nos installations.
Protocole
Tous les animaux utilisés pour cette étude ont reçu des soins sans cruauté conformément aux « Principes de soins aux animaux de laboratoire » formulés par la National Society for Medical Research et au « Guide for the Care of Laboratory Animals » publié par les National Institutes of Health, Ontario, Canada. Toutes les études ont été approuvées par le Comité de protection des animaux de l’Institut général de recherche de Toronto. Dans cette étude, des porcs Yorkshire mâles âgés de 11 à 12 semaines pesant de 30 à 40 kg ont été utilisés.
1. L’intubation
- Hébergez les porcs pendant au moins 5 jours avant la procédure pour leur permettre de s’adapter à l’environnement et de réduire les niveaux de stress globaux
- Faites jeûner le porc pendant 6 h avant l’anesthésie.
- Anesthésier le porc à l’aide d’une injection intramusculaire (IM) de kétamine (20 mg/kg) comme anesthésique dissociatif, de midazolam (0,15 mg/kg) pour la sédation et d’atropine (0,04 mg/kg) pour réduire la salivation et les sécrétions bronchiques, dans l’établissement d’hébergement.
- Donnez de l’O2 et de l’isoflurane à 5 % à l’aide d’un masque une fois que le porc s’est endormi pendant au moins 5 minutes.
- Déplacez le porc dans un chariot de transport et transférez-le à la salle d’opération (RO).
- Placez le porc en position couchée sur la table d’opération.
- Placez le masque de ventilation avec 2 L/min O2 et 5 % d’isoflurane.
REMARQUE : Assurez-vous que le porc a un effort inspiratoire. - Positionnez la sonde de saturation en oxygène sur l’oreille des porcs.
REMARQUE : La sonde peut également être placée sur la langue, la queue, l’ergot3, les lèvres ou le pli inguinal. - Demandez à un assistant de placer les électrodes de l’électrocardiogramme et le brassard de tensiomètre.
REMARQUE : Les électrodes sont placées dans le pli axillaire droit, le pli axillaire gauche et le pli inguinal gauche. Le brassard de tensiomètre peut être placé soit dans la patte avant, soit dans la patte arrière. - Vérifiez le relâchement de la mâchoire après 4-5 min de ventilation avec de l’isoflurane à 5 %.
REMARQUE : si une résistance est notée, poursuivre la ventilation avec de l’isoflurane pendant 3 minutes supplémentaires ou jusqu’à ce que la mâchoire soit détendue. - Demandez à l’assistant de tenir la mandibule vers le haut, le maxillaire vers le bas et la langue à l’écart.
- Insérez un laryngoscope avec une lame de fraisage droite le long de la ligne médiane et soulevez l’épiglotte.
REMARQUE : Utilisez une sonde endotrachéale pour enfoncer le palais mou et permettre à l’épiglotte de remonter (Figure 1). - Visualisez les cordes vocales et vaporisez-les deux fois avec un spray non aérosol de lidocaïne (10 mg/dose mesurée) pour prévenir les spasmes pendant l’intubation.
- Retirez le laryngoscope et replacez le masque à oxygène pendant 30 s.
- Retirez le masque à oxygène, insérez la lame droite Miller le long de la ligne médiane et soulevez l’épiglotte. Insérez un tube endotrachéal de 7,0 mm au-delà des cordes vocales.
REMARQUE : S’il y a une résistance ou un spasme des cordes vocales, répétez les étapes 1.13 et 1.14. - Maintenez la sonde endotrachéale en place et faites glisser le laryngoscope et le stylet.
- Gonflez le ballonnet du tube endotrachéal avec 5 à 8 cc d’air et connectez-le à un capteur de capnométrie pour assurer le bon placement du tube.
REMARQUE : D’autres méthodes pour assurer un placement correct comprennent la recherche de pulsions thoraciques, la condensation dans le tube endotrachéal et l’écoute des bruits respiratoires bilatéraux. - Allumez le ventilateur et ajustez à 15-20 respirations par minute, l’isoflurane à 2 %-2,5 %, le volume courant à 10-15 ml/kg de poids corporel et la pression inspiratoire maximale entre 18-20 cmH2O 9,10,11.
- Fixez le tube endotrachéal avec du ruban adhésif.
- Appliquez un lubrifiant pour les yeux pour prévenir la sécheresse et l’ulcération pendant la procédure.
- Assurez-vous d’une anesthésie appropriée en évaluant le tonus de la mâchoire et en ajustant l’isoflurane en conséquence. Les muscles mandibulaires rigides indiquent un niveau léger d’anesthésie3.
2. Placement du cathéter veineux central
REMARQUE : Le choix du cathéter dépend du type de modèle utilisé. Pour les modèles de survie, un cathéter qui peut être creusé à la fin de la procédure est utilisé. Pour les modèles terminaux, un modèle plus simple (voir la table des matériaux) est utilisé.
- Après l’intubation, avec le porc en position couchée, désinfectez les deux côtés du cou avec une solution d’iode ou de chlorhexidine.
- Préparez le cathéter en le rinçant avec 5 à 10 ml de solution saline et assurez-vous qu’il n’y a pas d’air à l’intérieur. Placez le dilatateur dans le cathéter.
- Inspectez et testez le fil-guide pour confirmer les aspects et le fonctionnement corrects.
REMARQUE : Le fil-guide doit se déplacer librement à l’intérieur de la gaine et ne doit présenter aucun défaut ou pli. Si une altération est constatée, remplacez le fil-guide. - Identifiez les trois points de repère suivants sur le cou du porc : (1) la branche caudale de la mandibule, (2) le manubrium crânien et (3) la pointe crânienne de l’épaule droite formée par le grand tubercule de l’humérus6 (figure 2).
- Insérez l’aiguille de recherche attachée à une seringue de 5 ml au centre du triangle formé par les trois points de repère à un angle de 45° par rapport à la peau et dirigée vers le côté caudal, tout en tirant légèrement sur l’embolie de la seringue.
- Une fois la veine jugulaire trouvée, retirez la seringue de l’aiguille de recherche et stabilisez l’aiguille tout en plaçant le pouce sur l’embout de l’aiguille. Assurez-vous que l’aiguille du chercheur est bien en place.
REMARQUE : Si l’on soupçonne que le sang provenant de l’aiguille est artériel, retirez immédiatement l’aiguille et appliquez une pression pendant 5 minutes. - Introduisez le fil-guide dans l’aiguille du chercheur et avancez dans la veine jugulaire externe (technique de Seldinger12). Une résistance minimale, voire nulle, doit être rencontrée. Retirez l’aiguille du chercheur et maintenez le fil-guide en place.
REMARQUE : Utilisez un tracé ECG pour vous assurer que le fil-guide ne pénètre pas trop profondément. Si des altérations du rythme cardiaque sont notées, retirez légèrement le fil-guide. - Insérez l’extrémité d’une lame à 11 lames dans le site de ponction et créez une incision (environ 0,5 cm) pour le dilatateur et le cathéter.
- Faites passer le dilatateur et le cathéter sur le fil-guide pour dilater la peau et le tissu sous-cutané. Une fois en place, retirez le dilatateur du cathéter.
- Aspirez à partir de la lumière du cathéter pour assurer un bon écoulement et rincez avec 5 à 10 ml de solution saline.
- Suturez le cathéter dans la peau avec une suture en soie 0 et assurez-vous que le cathéter est bien fixé13.
3. Placement du cathéter artériel
REMARQUE : Le placement carotidien de la ligne artérielle est préféré car il offre une voie plus directe vers le cœur et les vaisseaux du cou sont plus grands que les vaisseaux fémoraux11. De préférence, le cathéter artériel doit être placé du côté controlatéral du cathéter veineux central et sous vision directe ; Si cela n’est pas possible, il peut être placé du même côté que le cathéter veineux.
- Faites une incision verticale de 5 à 7 cm médialement de la trachée à l’aide d’un stylo cautérisé (Figure 3).
- Disséquer le tissu sous-cutané et le plan entre les muscles faciaux cutanés et les muscles colli11.
- Disséquer le plan facial entre la trachée et le muscle sternomastoïde pour localiser et ouvrir la gaine carotide11 (Figure 4).
- Utilisez la dissection contondante pour isoler l’artère carotide commune (Figure 5).
- Placez deux attaches en soie 2-0 autour de l’artère carotide pour le contrôle vasculaire et attachez l’artère distale (Figure 6).
- Placez la pince à angle droit sous l’artère.
- Demandez à l’assistant de tenir l’attache proximale et d’insérer l’extrémité de l’aiguille d’angiocath dans l’artère carotide à un angle de 45°. Une fois qu’un éclair de sang est visible, avancez légèrement l’aiguille à un angle peu profond, puis avancez le cathéter uniquement dans l’artère.
- Retirez l’aiguille tout en maintenant le cathéter en place.
- Fixez le cathéter à la ligne artérielle, aspirez et rincez avec 5 à 10 ml de solution saline pour vous assurer qu’il n’y a pas de résistance.
- Placez une attache autour du cathéter et de l’artère pour fixer le cathéter.
4. Soins après la chirurgie (modèle de survie)
- Creusez le cathéter veineux et fixez-le au cou du porc.
- Une fois que l’animal est stables sur le plan hémodynamique et qu’il peut être sevré des vasopresseurs, retirez le cathéter de la ligne artérielle, attachez le côté distal de l’artère carotide et vérifiez l’hémostase. Fermez la plaie avec une suture ininterrompue.
- Déplacez le porc vers le chariot de transport et placez-le en position sternale.
- Éteignez l’isoflurane et surveillez le porc jusqu’à ce qu’il y ait des signes de rétablissement de l’anesthésie (mouvements et respiration contre le ventilateur).
- Éteignez le ventilateur une fois que des respirations spontanées efficaces sont notées, mais maintenez l’approvisionnement en O2 à 2 L/min.
- Coupez l’alimentation O2 après 10-15 min. Le porc doit être capable de maintenir une saturation d’au moins 94 % par lui-même. Si ce n’est pas le cas, rallumez l’O2 et réévaluez dans 5 à 10 minutes.
- Ramenez le porc dans son enclos une fois qu’il maintient une saturation en O2 .
REMARQUE : Le porc doit être ramené dans son enclos avec la sonde endotrachéale en place. - Retirez la sonde endotrachéale une fois que des signes d’ingestion et/ou de mastication sont évidents (entre 2 et 4 heures après la fin de la chirurgie).
- Surveillez le porc dans son enclos et ne le laissez jamais seul. Une fois que le porc est extubé et peut maintenir une position sternale, il peut être laissé sans surveillance.
Résultats
La surveillance des porcs pendant l’opération est indispensable, et les paramètres normaux attendus pendant l’opération sont indiqués dans le tableau 1 3,14. La durée approximative nécessaire pour effectuer chaque procédure est indiquée dans le tableau 2.
Comme mentionné précédemment, ce laboratoire effectue ces procédures depuis 10 ans. Au cours de cette période, 595 expériences sur le foie, 277 sur les reins et 100 expériences sur le pancréas ont été réalisées (tableau 3).
Les 100 expériences sur le pancréas (pour 151 porcs) ont été réalisées au cours des 2 dernières années et sont utilisées ici comme résultats représentatifs.
Deux animaux présentaient des voies respiratoires difficiles, pour lesquelles un technicien vétérinaire expérimenté a dû effectuer l’intubation. Le reste de la procédure s’est déroulé sans aucune autre complication. Cela se traduit par un taux de réussite de l’intubation de 98,7 % (tableau 4).
Cinq animaux ont malheureusement été perdus au cours de cette période, en raison des procédures de mise en place du cathéter central, ce qui équivaut à un taux de réussite de 96,7 % (tableau 4). Trois des animaux ont présenté une arythmie après la mise en place d’un cathéter central et ont évolué vers une asystole en quelques secondes ; Aucun médicament n’a été administré par la suite, car en raison de la nature des expériences, cela a été considéré comme une période d’ischémie chaude et a pu affecter les résultats finaux. Une autopsie a été pratiquée sur l’un des animaux ; De multiples caillots ont été découverts dans le ventricule droit, ainsi que des signes évocateurs d’une embolie pulmonaire. Les deux autres animaux présentaient une mort cardiaque subite sans signe d’arythmie antérieure. À l’autopsie, une hypertrophie du cœur et un œdème pleural ont été notés.
La mise en place du cathéter artériel est toujours effectuée, dans cet établissement, après la mise en place du cathéter veineux central ; Comme nous l’avons mentionné précédemment, cinq animaux ont été perdus lors de la mise en place du cathéter veineux central, avant même que la mise en place du cathéter artériel n’ait commencé. La mise en place d’un cathéter artériel a été couronnée de succès dans les 146 tentatives restantes, ce qui se traduit par un taux de réussite de 100 % (tableau 4).

Figure 1 : Points de repère des voies aériennes. Une sonde endotrachéale est utilisée pour enfoncer le palais mou et permettre à l’épiglotte de remonter. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Placement du cathéter veineux central à l’aide de la technique de triangulation. Trois repères sur le cou du porc : la branche caudale de la mandibule, le manubrium crânien et la pointe crânienne de l’épaule droite formée par le gros tubercule de l’humérus. Veuillez cliquer ici pour voir une version agrandie de cette figure.
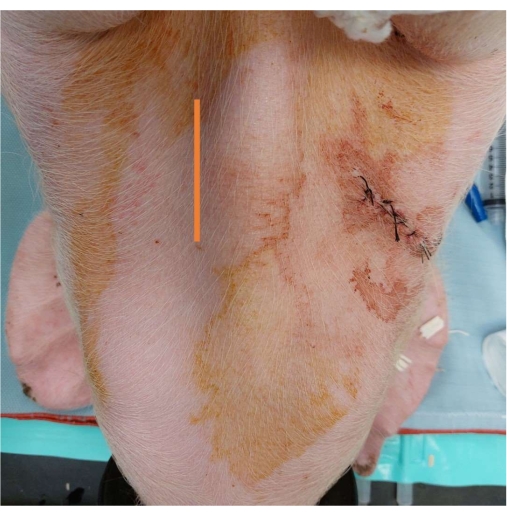
Figure 3 : Placement du cathéter artériel. Une marque montrant le site de l’incision verticale de 5 à 7 cm médiale à la trachée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
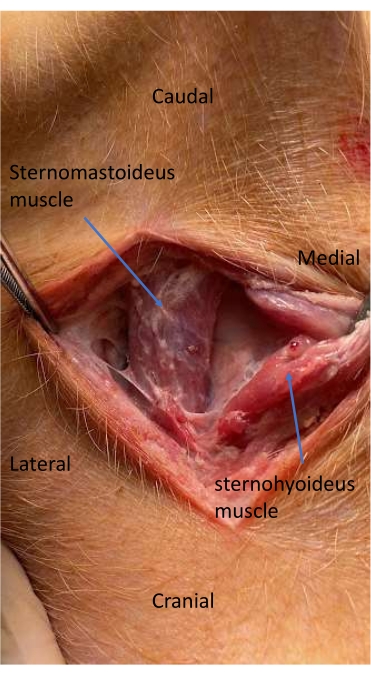
Figure 4 : Muscle sternomastoïde et sterno-yoïde lors de la dissection pour la mise en place d’un cathéter artériel. Le plan facial entre la trachée et le muscle sternomastoïde est disséqué pour localiser et ouvrir la gaine carotidienne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
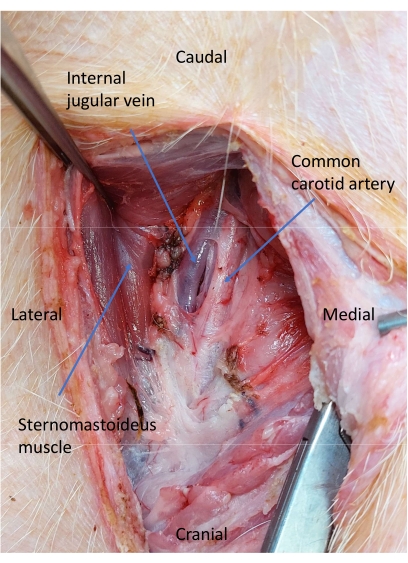
Figure 5 : Veine jugulaire et artère carotide après dissection de la gaine carotide. Une dissection contondante est effectuée pour isoler l’artère carotide commune. Veuillez cliquer ici pour voir une version agrandie de cette figure.
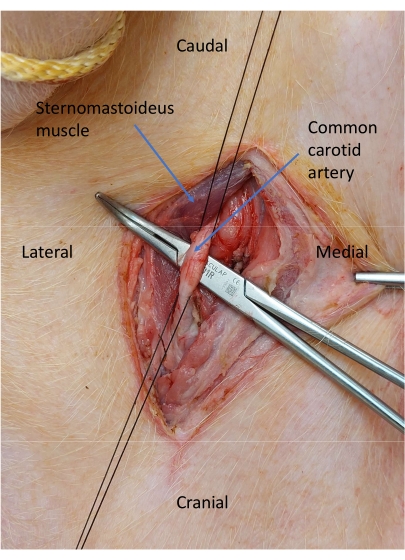
Figure 6 : Artère carotide commune isolée. Deux attaches en soie 2-0 sont placées autour de l’artère carotide pour le contrôle vasculaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Paramètre | Plage normale |
| Température | 38 à 39,5 °C |
| Fin CO2 | 40 à 50 mmHg |
| Pression artérielle systolique | 112 à 139 mmHg |
| Pression artérielle diastolique | 72 à 98 mmHg |
| Pression artérielle moyenne | 86 à 123 mmHg |
| Fréquence cardiaque | 70 à 100 bpm |
| Fréquence respiratoire | 10 à 20 bpm. |
Tableau 1 : Paramètres normaux à maintenir pendant l’opération. Le tableau répertorie la plage normale des paramètres qui doivent être maintenus pendant la chirurgie.
| Procédure | Temps (min) |
| Intubation | 15 ± 5 |
| Cathéter veineux central | 20 ± 10 |
| Ligne artérielle | 20 ± 10 |
Tableau 2 : Durée des procédures. Le tableau répertorie la durée approximative nécessaire pour effectuer l’intubation, le cathétérisme veineux central et la mise en place d’un cathéter artériel.
| Organe | Nombre d’expériences |
| Foie | 595 |
| Rein | 277 |
| Pancréas | 100 |
Tableau 3 : Nombre d’expériences par organe. Le tableau répertorie le nombre d’expériences réalisées sur le foie, les reins et le pancréas.
| Réussi | Échec | Succès ( %) | Échec ( %) | |
| Intubations | 149 | 2 | 98.7 | 1.3 |
| Placement du cathéter central | 146 | 5 | 96.7 | 3.3 |
| Placement du cathéter artériel* | 146 | 0 | 100 | 0 |
| *Tous les placements de cathéters artériels sont effectués après la mise en place d’un cathéter central | ||||
Tableau 4. Taux de réussite par procédure. Le tableau répertorie le taux de réussite des intubations, des cathétérismes veineux centraux et des mises en place de cathéters artériels effectués sur 151 porcs.
Discussion
Chaque centre de recherche doit créer ses propres protocoles et lignes directrices pour les modèles de recherche translationnelle ; Cependant, certaines règles de base sont à suivre pour garantir des résultats réussis.
Tout d’abord, le porc doit être soumis à un examen physique dès son arrivée dans l’établissement d’hébergement. Un total de 5 à 7 jours de conditionnement est nécessaire avant la procédure pour réduire les niveaux de stress et permettre au porc de récupérer le poids perdu pendant le transport3. Il est important de noter que nous utilisons des porcs qui proviennent d’une ferme d’élevage et qui ne sont pas élevés exclusivement à des fins de recherche, et comme prévu, des problèmes de santé peuvent survenir tout au long de l’année (virus saisonniers).
Avant la procédure, le porc doit être à jeun pour recevoir de la nourriture solide pendant 6 à 8 heures, mais l’eau est autorisée jusqu’au moment de l’intervention chirurgicale3. Il est également particulièrement important de se rappeler que les porcs sont sensibles aux arythmies cardiaques induites par l’anesthésie. La mise en place d’un ECG lors de l’induction de l’anesthésie et de l’accès vasculaire permet de les identifier, et des médicaments antiarythmiques peuvent être administrés si nécessaire3. Cela a été une raison importante de la perte de porcs au cours de nos expériences. Un vétérinaire certifié ou un technicien vétérinaire expérimenté doit être disponible au cas où l’équipe rencontrerait un problème qui ne peut être résolu. L’utilisation de l’échographie n’est pas fréquente dans notre laboratoire en raison de sa disponibilité limitée, nous réservons donc son utilisation aux cas difficiles. La planification des expériences en fonction de la disponibilité de l’appareil à ultrasons limiterait considérablement le nombre et le calendrier des expériences. Cependant, s’il est largement disponible dans d’autres installations de recherche, son utilisation est fortement encouragée.
L’expérience de l’équipe chirurgicale est également un facteur clé. Tout le personnel de recherche directement impliqué dans la partie chirurgicale des protocoles, dans ce centre de recherche, est composé de chirurgiens généralistes formés, et la plupart ont également une formation en HPB et/ou en chirurgie de transplantation. La majorité d’entre eux n’ont aucune expérience préalable des modèles porcins translationnels. Chaque équipe est composée d’un boursier senior et d’un boursier junior. Le chercheur principal a au moins 1 an d’expérience dans les modèles translationnels porcins et supervise la formation du chercheur junior aux techniques de base décrites dans cet article. Le boursier junior devient généralement compétent en 4 à 6 semaines.
Voici quelques conseils qui peuvent être utiles en cas de modification des paramètres des signes vitaux pendant les expériences. L’hypothermie est une complication fréquente lors de la chirurgie15 ; Un coussin chauffant peut être placé sur la table d’opération, et un système de couverture chauffante peut également être placé sur le porc. Si ces mesures ne suffisent pas, l’utilisation de solutions IV réchauffées peut être envisagée.
Si le CO2 final est inférieur ou supérieur aux plages normales, le placement correct de la sonde endotrachéale et le gonflage correct du ballonnet doivent être confirmés. Le capteur de CO2 doit être vérifié pour s’assurer qu’il est correctement connecté et qu’il fonctionne. L’appareil d’anesthésie doit être vérifié pour détecter toute fuite et les billes de dioxyde de carbone doivent être remplacées si elles sont épuisées. Il est également important de s’assurer que le débit inspiratoire, les respirations par minute et la pression inspiratoire maximale sont tous correctement réglés en fonction du poids du porc.
Si le capteur d’oxymétrie de pouls ne fonctionne pas à l’un des endroits mentionnés précédemment, il faut d’abord s’assurer que le capteur fonctionne correctement, que le ventilateur est allumé, que l’oxygène est réglé à 2 L/min et que le porc a une coloration normale. Si tout ce qui précède est normal, le capteur doit être déplacé vers un autre des endroits mentionnés. Si cela ne fonctionne pas, une analyse des gaz du sang peut être effectuée pour vérifier la saturation en oxygène.
Dans la chirurgie de transplantation abdominale, l’hypotension est un élément critique des lésions post-reperfusion16. L’augmentation du débit liquidien IV et l’utilisation de vasopresseurs (nous utilisons la noradrénaline) sont courantes. La noradrénaline a à la fois un effet vasopresseur et un effet inotrope, de sorte que la fréquence cardiaque doit être surveillée en permanence. Il est également important de se rappeler que la vasoconstriction peut compromettre le flux sanguin vers l’organe récemment transplanté17.
Les procédures décrites ci-dessus sont utilisées pour la recherche en chirurgie de transplantation abdominale ; Cependant, nous pensons qu’ils peuvent être adaptés et utilisés pour d’autres types de recherche. Les modèles porcins sont inestimables pour la recherche translationnelle et, à ce titre, les équipes de recherche doivent assurer un traitement sans cruauté et ne permettre aucune douleur ou souffrance aux animaux.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Irrigation, USP | Baxter | JF7124 | Saline |
| Angiocath 16 GA 1.88 , 1.7 x 48 mm | BD | 381157 | |
| Atropine sulfate (8 mg/20 mL - 0.4 mg/mL) | West-Ward | 17733 | 20 mL vial |
| Cook TPN Single Lumen Cathether Set | Cook medical | G08132 | with 10 Fr peel away introducer set |
| Hickman 9.6 F single-lumen CV cathether | Bard | 600560 | |
| Laryngoscope | Heine | ||
| Midazolam (5 mg/mL) | Sandoz | 46237968 | 10 mL vial |
| Miller blade 4 | Heine | 185 mm blade length | |
| Narketan (Ketamine - 100 mg/mL) | Vetoquinal | 8-00223 | 50 mL vial |
| Nasal tracheal tube cuffed 7.0 mm I.D. | Covidien | 86450 | |
| Optixcare eye lube for dogs and cats | Aventix | 5914304 | 20 g |
| Percutaneous Sheath introducer set with integral hemostasis valve/side port for use -7.5 Fr. Catheters | Arrow | SI-09880 | 8.5 Fr, 10 cm, 0.035 inch dia. Spring wire guide |
| Universal Electrosurgical Pad: Split with cord | 3M | 9165 | |
| Valleylab Rocker Switch Pencil Holster | Covidien | E2515H | |
| Xylocaine 10% Spray | AstraZeneca | 73050036 | lidocaine (10 mg/metered dose) |
Références
- Dehoux, J. P., Gianello, P. The importance of large animal models in transplantation. Frontiers in Bioscience: A Journal and Virtual Library. 12, 4864-4880 (2007).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Swindle, M. M. . Swine in the Laboratory Surgery, Anesthesia, Imaging, and Experimental Techniques. , (2015).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Prasanna, N., et al. Safety and efficacy of vasopressor administration through midline catheters. Journal of Critical Care. 61, 1-4 (2021).
- Flournoy, W. S., Mani, S. Percutaneous external jugular vein catheterization in piglets using a triangulation technique. Laboratory Animals. 43 (4), 344-349 (2009).
- Kuck, K., Baker, P. D. Perioperative noninvasive blood pressure monitoring. Anesthesia and Analgesia. 127 (2), 408-411 (2017).
- Pour-Ghaz, I., et al. Accuracy of non-invasive and minimally invasive hemodynamic monitoring: where do we stand. Annals of Translational Medicine. 7 (17), 421 (2019).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments. (101), e52909 (2015).
- Parmentier, C., et al. Normothermic ex vivo pancreas perfusion for the preservation of pancreas allografts before transplantation. Journal of Visualized Experiments. (185), e63905 (2022).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7 (8), 1479-1496 (2012).
- Graham, A. S., Ozment, C., Tegtmeyer, K., Lai, S., Braner, D. A. V. Central venous catheterization. The New England Journal of Medicine. 356 (21), 21 (2009).
- Taylor, R. W., Palagiri, A. V. Central venous catheterization. Critical Care Medicine. 35 (5), 1390-1396 (2007).
- Reed, R., et al. Accuracy of an oscillometric blood pressure monitor in anesthetized pigs. Laboratory Animals. 52 (5), 490-496 (2018).
- Musk, G. C., Costa, R. S., Tuke, J. Body temperature measurements in pigs during general anaesthesia. Laboratory Animals. 50 (2), 119-124 (2016).
- Aggarwal, S., Kang, Y., Freeman, J. A., Fortunato, F. L., Pinsky, M. R. Postreperfusion syndrome: Hypotension after reperfusion of the transplanted liver. Journal of Critical Care. 8 (3), 154-160 (1993).
- Manning, M. W., Kumar, P. A., Maheshwari, K., Arora, H. Post-reperfusion syndrome in liver transplantation-An overview. Journal of Cardiothoracic and Vascular Anesthesia. 34 (2), 501-511 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon