Method Article
猪插管、中心静脉导管和动脉导管置入用于腹部移植手术的转化研究
摘要
为了获得最佳结果,进行转化研究实验的外科医生应精通插管和血管管路放置。本文介绍了多伦多器官保存实验室用于执行这些程序的技术。
摘要
猪的转化手术研究模型对于开发安全的临床前方案至关重要。然而,实验性手术的成功不仅仅取决于研究团队的手术技能;围手术期护理和管理程序,如插管、中心静脉导管和动脉导管放置,是必要的,并且对于良好的实验结果至关重要。由于研究团队很少有麻醉师或手术团队以外的任何其他工作人员,因此参与转化研究的手术团队必须获得和/或发展执行围手术期护理的技能。本文的目的是展示多伦多器官保存实验室在过去 10 年中使用和完善的插管、中心静脉导管和动脉导管放置技术,作为未来研究人员加入该团队或任何其他实验室的参考猪和/或腹部移植的转化研究方案。
引言
猪实验模型因其相似的解剖学和生理特性而经常用于研究人类疾病。这些模型对于制定安全的临床前方案至关重要,但它们也受到法律和道德限制1。使用猪进行研究必须在最佳条件下进行,以避免不必要的动物损失和与研究项目无关的麻醉并发症造成的痛苦。
术前技术和技能,如插管、中心静脉导管放置和动脉导管放置,对于获得成功和可重复的结果至关重要。
每只接受全身麻醉以进行外科手术的动物都必须插管以保持气道畅通,从而允许辅助通气并避免支气管误吸2。猪最常见的插管位置是背侧、侧位和胸骨卧位 3,4。对于接受过人体插管3 培训的人员来说,胸骨卧位往往更容易,该研究机构就是这种情况。
良好的血管通路对于手术期间和手术后的液体管理、药物和取样至关重要。由于缺血再灌注损伤导致血流动力学不稳定,血管加压药在腹部移植手术中很常见。由于血管收缩作用,通过外周管路输注血管加压药会导致局部组织损伤5。中心静脉导管放置允许注入大量液体和血管管。我们更喜欢使用导丝辅助经皮技术放置中心静脉导管,因为它可以最大限度地减少对软组织和血管的损伤6。
需要动物在手术过程中的血流动力学稳定性,而血压是为此目的最常监测的参数7。动脉导管允许连续测量血压,这比传统的无创测量更准确8,因为无创技术在高血压期间会低估值,在低血压时高估值 7,8。在这些实验中,准确读数血压对于能够控制必须给猪注射的液体和血管加压药的量至关重要。
多伦多器官保存实验室使用猪模型已有 10 多年,多年来已将这些程序标准化,并取得了出色的结果。尽管在文献中可以找到相同程序的其他方法,但本文的目标是介绍我们设施多年来开发和完善的技术。
研究方案
根据美国国家医学研究学会制定的“实验动物护理原则”和加拿大安大略省国立卫生研究院出版的“实验动物护理指南”,本研究使用的所有动物都接受了人道照顾。所有研究均已获得多伦多综合研究所动物护理委员会的批准。在本研究中,使用了体重 30-40 公斤的 11-12 周龄雄性约克夏猪。
1. 插管
- 手术前将猪饲养至少 5 天,让它们适应环境并降低整体压力水平
- 麻醉前将猪禁食 6 小时。
- 在饲养设施中,肌肉注射 (IM) 氯胺酮 (20 mg/kg) 作为解离麻醉剂,咪达唑仑 (0.15 mg/kg) 用于镇静,阿托品 (0.04 mg/kg) 以减少流涎和支气管分泌物。
- 一旦猪睡着至少 5 分钟,在面罩的帮助下给予 O2 和 5% 的异氟醚。
- 将猪移入运输车并转移到手术室 (OR)。
- 将猪仰卧在 OR 台上。
- 将通气面罩放入 2 L/min O2 和 5% 异氟醚中。
注意:确保猪有吸气努力。 - 将氧饱和度探头放在猪的耳朵上。
注意: 探头也可以放在舌头、尾巴、露爪3、嘴唇或腹股沟褶皱上。 - 请助手放置心电图电极和血压袖带。
注意:电极放置在右腋窝皱襞、左腋窝皱襞和左腹股沟皱襞中。血压袖带可以放置在前腿或后腿。 - 用 5% 的异氟醚通气 4-5 分钟后检查下巴是否松弛。
注意:如果发现阻力,请继续使用异氟醚通气 3 分钟或直到下巴放松。 - 让助手抬起下颌骨,向下压下颌骨,舌头不碍事。
- 将带有直米勒刀片的喉镜沿中线向下插入并提起会厌。
注意:使用气管插管向下推软腭,让会厌弹出(图 1)。 - 观察声带并用利多卡因非气雾剂喷雾剂(10 mg/计量剂量)喷洒声带两次,以防止插管期间痉挛。
- 取下喉镜并更换氧气面罩 30 秒。
- 取下氧气面罩,将 Miller 直刀片插入中线,然后提起会厌。将 7.0 毫米气管插管插入声带之外。
注意:如果声带有阻力或痉挛,请重复步骤 1.13 和 1.14。 - 将气管插管固定到位,然后滑出喉镜和管心针。
- 用 5-8 cc 空气给气管插管套囊充气,并将其连接到二氧化碳传感器,以确保插管的正确放置。
注意:确保正确放置的其他方法包括寻找胸部驱动器、气管插管中的冷凝和听双侧呼吸音。 - 打开呼吸机,调整到每分钟 15-20 次呼吸,异氟醚调整到 2%-2.5%,潮气量调整到 10-15 mL/kg 体重,吸气峰值压力在 18-20 cmH2O 9,10,11 之间。
- 用胶带固定气管插管。
- 涂抹眼部润滑剂以防止手术过程中干燥和溃疡。
- 通过评估下巴张力并相应地调整异氟醚来确保适当的麻醉。僵硬的下颌肌肉表明麻醉程度较低3.
2. 中心静脉导管放置
注意:导管的选择取决于所使用的型号类型。对于生存模型,使用可以在手术结束时插入隧道的导管。对于终端模型,使用更简单的模型(请参阅 材料表)。
- 插管后,将猪置于仰卧位,用碘或洗必泰溶液对颈部两侧进行消毒。
- 用 5 到 10 mL 生理盐水冲洗导管,确保导管内没有空气。将扩张器穿过导管。
- 检查和测试导丝以确认正确的方面和功能。
注意: 导丝必须在护套内自由移动,并且不得有任何缺陷或扭结。如果发现任何更改,请更换导丝。 - 确定猪脖子上的以下三个标志:(1) 下颌骨尾支,(2) 颅柄,以及 (3) 由肱骨大结节形成的右肩颅尖6 (图 2)。
- 将连接到一个 5 mL 注射器的取景针插入由三个标志形成的三角形中心,与皮肤成 45° 角,并指向尾侧,同时稍微向后拉注射器栓子。
- 找到颈静脉后,从取景器针头上取下注射器并稳定针头,同时将拇指放在针座上。确保取景器指针固定到位。
注意:如果怀疑针头流出的血液是动脉血,请立即取出针头并施加压力 5 分钟。 - 将导丝送入取景针并进入颈外静脉(Seldinger 的技术12)。应满足最小阻力或零阻力。取下取景针并将导丝保持在原位。
注意: 使用 ECG 轨迹确保导丝不会太深。如果发现心律改变,请稍微取下导丝。 - 将 11 刀片的尖端插入穿刺部位,并为扩张器和导管创建一个切口(约 0.5 厘米)。
- 将扩张器和导管送入导丝上,以扩张皮肤和皮下组织。就位后,从导管中取出扩张器。
- 从导管腔吸出以确保正常流动并用 5-10 mL 生理盐水冲洗。
- 用 0 丝缝合线将导管缝合到皮肤中,并确保导管牢固13.
3. 动脉导管放置
注意:动脉线的颈动脉放置是首选,因为它提供了更直接的通往心脏的途径,并且颈部血管比股血管大11。最好将动脉线置于中心静脉导管的对侧,并在直视下;如果无法做到这一点,可以将其放置在与静脉导管相同的一侧。
- 使用烧灼笔在气管内侧做一个 5-7 cm 的垂直切口(图 3)。
- 解剖皮下组织和皮肤面部肌和滑道肌之间的平面11.
- 解剖气管和胸骨肌之间的面部平面,以定位并打开颈动脉鞘11 (图4)。
- 使用钝器解剖分离颈总动脉(图5)。
- 在颈动脉周围放置两条 2-0 丝带以进行血管控制,并系好远端的一条(图 6)。
- 将直角镊子放在动脉下方。
- 让助手握住近端系带,将血管导管针尖以 45° 角插入颈动脉。一旦看到一闪而过的血液,就以较浅的角度将针头略微推进,然后将导管仅推进到动脉中。
- 在保持导管就位的同时拔下针头。
- 将导管连接到动脉管上,抽吸,并用 5-10 mL 生理盐水冲洗,以确保没有阻力。
- 在导管和动脉周围系上系带以固定导管。
4. 术后护理(生存模型)
- 将静脉导管隧道化并将其固定在猪的颈部。
- 一旦动物血流动力学稳定并且可以脱离血管加压药,取出动脉导管,系扎颈动脉远端,并验证止血。用不间断的缝合缝合伤口。
- 将猪移动到运输车上,并将其置于胸骨位置。
- 关闭异氟醚并监测猪,直到出现麻醉恢复的迹象(对着呼吸机的运动和呼吸)。
- 一旦注意到有效的自主呼吸,请关闭呼吸机,但将 O2 供应保持在 2 L/min。
- 10-15 分钟后关闭 O2 电源。猪应该能够自行保持至少 94% 的饱和度。如果不是这种情况,请再次打开 O2 并在 5-10 分钟后重新评估。
- 一旦猪保持 O2 饱和度,就将猪移回猪栏。
注意:应将猪移回其围栏,并放置气管插管。 - 一旦吞咽和/或咀嚼的迹象明显(手术结束后 2-4 小时之间),请取出气管插管。
- 监控围栏里的猪,永远不要让它一个人呆着。一旦猪拔管并可以保持胸骨位置,就可以无人看管。
结果
手术期间的猪监测是必不可少的,手术期间预期的正常参数如表 1 3,14 所示。执行每个过程所需的大致持续时间如表 2 所示。
如前所述,该实验室在过去 10 年中一直在执行这些程序。在此期间,进行了 595 次肝脏实验、277 次肾脏实验和 100 次胰腺实验(表3)。
在过去 2 年中进行了 100 次胰腺实验(针对 151 头猪),此处用作代表性结果。
两只动物的气道困难,需要经验丰富的兽医技术人员进行插管。其余的手术在没有任何其他并发症的情况下进行。这意味着插管成功率为 98.7%(表 4)。
不幸的是,在此期间丢失了 5 只动物,与中心静脉导管放置手术有关,相当于 96.7% 的成功率(表 4)。其中 3 只动物在放置中心静脉导管后出现心律失常,并在几秒钟内发展为心脏停搏;之后没有给药,因为由于实验的性质,这被认为是热缺血时间,可能会影响最终结果。对其中一只动物进行了尸检;在右心室发现多个凝块,以及提示肺栓塞的体征。另外两只动物出现心源性猝死,既往无心律失常迹象。尸检时,发现心脏扩大和胸膜水肿。
动脉导管放置始终在该设施中,在中心静脉导管放置后进行;如前所述,在动脉导管放置开始之前,在放置中心静脉管期间丢失了 5 只动物。在剩余的 146 次尝试中,动脉导管放置成功,成功率为 100%(表 4)。

图 1:航空路地标。 使用气管插管向下推软腭并让会厌弹出。 请单击此处查看此图的较大版本。

图 2:使用三角测量技术放置中心静脉导管。 猪脖子上的三个标志:下颌骨尾支、颅柄和由肱骨大结节形成的右肩颅尖。 请单击此处查看此图的较大版本。
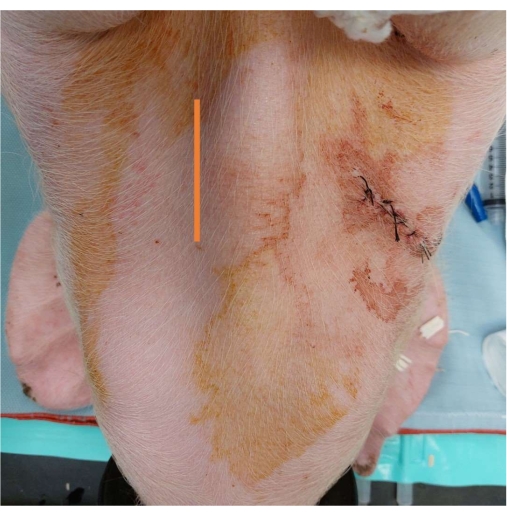
图 3:动脉导管放置。 显示气管内侧 5-7 cm 处垂直切口位置的标记。 请单击此处查看此图的较大版本。
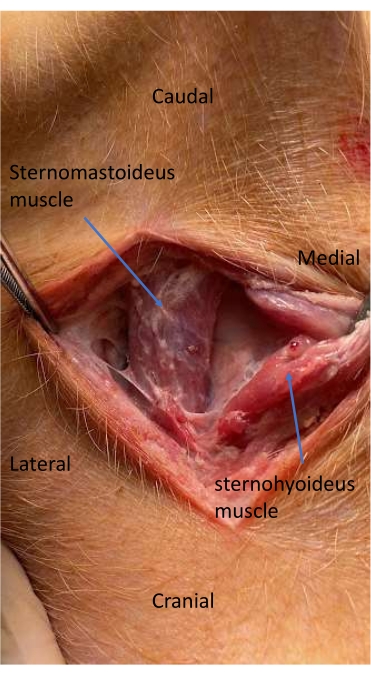
图 4:动脉导管放置解剖过程中的胸骨瘤和胸骨舌骨肌。 解剖气管和胸骨瘤肌之间的面部平面,以定位和打开颈动脉鞘。 请单击此处查看此图的较大版本。
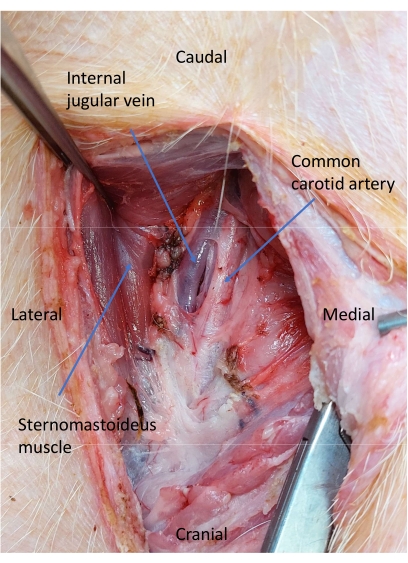
图 5:颈动脉鞘解剖后的颈静脉和颈动脉。 进行钝性清扫以分离颈总动脉。 请单击此处查看此图的较大版本。
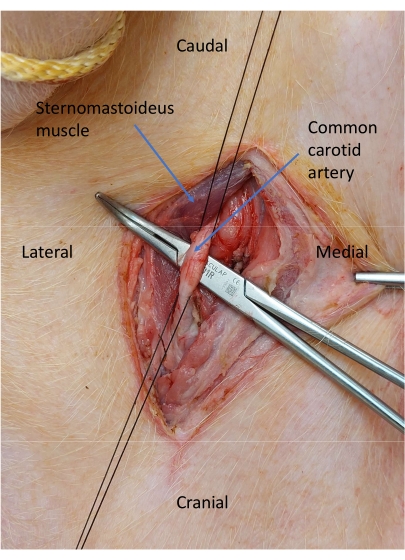
图 6:孤立的颈总动脉。 在颈动脉周围放置两条 2-0 丝带以进行血管控制。 请单击此处查看此图的较大版本。
| 参数 | 正常范围 |
| 温度 | 38–39.5 °C |
| 结束 CO2 | 40–50 毫米汞柱 |
| 收缩压 | 112–139 毫米汞柱 |
| 舒张压 | 72–98 毫米汞柱 |
| 平均动脉血压 | 86–123 毫米汞柱 |
| 心率 | 70–100 次/分 |
| 呼吸频率 | 10-20 次/分。 |
表 1:手术期间要维持的正常参数。 该表列出了手术期间需要保持的参数的正常范围。
| 程序 | 时间 (min) |
| 插管 | 15 ± 5 |
| 中心静脉导管 | 20 ± 10 |
| 动脉线 | 20 ± 10 |
表 2:程序的持续时间。 下表列出了进行插管、中心静脉导管插入术和动脉导管放置所需的大致持续时间。
| 风琴 | 实验次数 |
| 肝 | 595 |
| 肾 | 277 |
| 胰腺 | 100 |
表 3:每个器官的实验数量。 该表列出了在肝脏、肾脏和胰腺上进行的实验数量。
| 成功的 | 未成功 | 成功率 (%) | 失败 (%) | |
| 插管 | 149 | 2 | 98.7 | 1.3 |
| 中心线放置 | 146 | 5 | 96.7 | 3.3 |
| 动脉导管放置* | 146 | 0 | 100 | 0 |
| *所有动脉导管置入均在中心插管置入后进行 | ||||
表 4.每个程序的成功率。 该表列出了对 151 头猪进行的插管、中心静脉导管插入术和动脉导管置入的成功率。
讨论
每个研究中心都必须为转化研究模型制定自己的协议和指南;但是,要保证成功的结果,必须遵循一些基本规则。
首先,猪一到达饲养设施就必须接受体检。手术前总共需要 5-7 天的调理,以降低压力水平并让猪恢复运输过程中失去的体重3。需要注意的是,我们使用的猪来自育种场,并非专门用于研究目的而种植,正如预期的那样,全年可能会出现健康问题(季节性病毒)。
手术前,猪必须禁食固体食物 6-8 小时,但允许喝水直到手术3 时。同样重要的是要记住,猪容易出现麻醉引起的心律失常。在麻醉诱导和血管通路期间放置心电图有助于识别它们,必要时可以给予抗心律失常药物3。这是我们实验中猪损失的一个重要原因。如果团队遇到无法解决的问题,应有经过认证的兽医或经验丰富的兽医技术人员在场。由于可用性有限,我们实验室不经常使用超声,因此我们将其保留用于疑难病例。围绕超声机的可用性来规划实验将大大限制实验的数量和时间。但是,如果在其他研究机构中广泛可用,则会极大地鼓励其使用。
手术团队的经验也是一个关键因素。在该研究机构中,所有直接参与方案手术部分的研究人员都是训练有素的普通外科医生,并且大多数人还接受过 HPB 和/或移植手术的培训。大多数患者以前没有转化猪模型的经验。每个团队由一名高级研究员和一名初级研究员组成。高级研究员在猪转化模型方面至少有 1 年的经验,并监督初级研究员对本文描述的基本技术的培训。初级研究员通常在 4 到 6 周内熟练掌握。
以下是一些提示,在实验期间生命体征参数发生变化时可能会有所帮助。体温过低是手术过程中的常见并发症15;可以在手术台上放置加热垫,也可以在猪的顶部放置加热毯系统。如果这些措施还不够,可以考虑使用加热的静脉注射溶液。
如果末端 CO2 低于或高于正常范围,应确认气管插管的正确放置和袖带的正确充气。应检查 CO2 传感器以确保其正确连接并正常工作。应检查麻醉机是否有任何泄漏,如果用完,请更换二氧化碳珠。确保吸气流量、每分钟呼吸次数和吸气峰值压力都根据猪的体重正确设置也很重要。
如果脉搏血氧仪传感器未在前面提到的位置之一工作,首先应确保传感器正常工作,呼吸机已打开,氧气设置为 2 L/min,并且猪的颜色正常。如果以上所有情况都正常,则应将传感器移动到上述另一个位置。如果这不起作用,可以进行血气分析以验证血氧饱和度。
在腹部移植手术中,低血压是再灌注后损伤的关键组成部分16。增加 IV 液率和使用血管加压药(我们使用去甲肾上腺素)是常见的。去甲肾上腺素同时具有血管加压药和正性肌力作用,因此必须持续监测心率。同样重要的是要记住,血管收缩可能会损害流向最近移植器官的血流17。
上述程序用于腹部移植手术的研究;但是,我们相信它们可以被改编并用于其他类型的研究。猪模型对于转化研究非常宝贵,因此,研究团队必须确保人道的治疗,不允许动物遭受任何痛苦或折磨。
披露声明
作者没有任何可披露的内容。
致谢
没有。
材料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Irrigation, USP | Baxter | JF7124 | Saline |
| Angiocath 16 GA 1.88 , 1.7 x 48 mm | BD | 381157 | |
| Atropine sulfate (8 mg/20 mL - 0.4 mg/mL) | West-Ward | 17733 | 20 mL vial |
| Cook TPN Single Lumen Cathether Set | Cook medical | G08132 | with 10 Fr peel away introducer set |
| Hickman 9.6 F single-lumen CV cathether | Bard | 600560 | |
| Laryngoscope | Heine | ||
| Midazolam (5 mg/mL) | Sandoz | 46237968 | 10 mL vial |
| Miller blade 4 | Heine | 185 mm blade length | |
| Narketan (Ketamine - 100 mg/mL) | Vetoquinal | 8-00223 | 50 mL vial |
| Nasal tracheal tube cuffed 7.0 mm I.D. | Covidien | 86450 | |
| Optixcare eye lube for dogs and cats | Aventix | 5914304 | 20 g |
| Percutaneous Sheath introducer set with integral hemostasis valve/side port for use -7.5 Fr. Catheters | Arrow | SI-09880 | 8.5 Fr, 10 cm, 0.035 inch dia. Spring wire guide |
| Universal Electrosurgical Pad: Split with cord | 3M | 9165 | |
| Valleylab Rocker Switch Pencil Holster | Covidien | E2515H | |
| Xylocaine 10% Spray | AstraZeneca | 73050036 | lidocaine (10 mg/metered dose) |
参考文献
- Dehoux, J. P., Gianello, P. The importance of large animal models in transplantation. Frontiers in Bioscience: A Journal and Virtual Library. 12, 4864-4880 (2007).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Swindle, M. M. . Swine in the Laboratory Surgery, Anesthesia, Imaging, and Experimental Techniques. , (2015).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Prasanna, N., et al. Safety and efficacy of vasopressor administration through midline catheters. Journal of Critical Care. 61, 1-4 (2021).
- Flournoy, W. S., Mani, S. Percutaneous external jugular vein catheterization in piglets using a triangulation technique. Laboratory Animals. 43 (4), 344-349 (2009).
- Kuck, K., Baker, P. D. Perioperative noninvasive blood pressure monitoring. Anesthesia and Analgesia. 127 (2), 408-411 (2017).
- Pour-Ghaz, I., et al. Accuracy of non-invasive and minimally invasive hemodynamic monitoring: where do we stand. Annals of Translational Medicine. 7 (17), 421 (2019).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments. (101), e52909 (2015).
- Parmentier, C., et al. Normothermic ex vivo pancreas perfusion for the preservation of pancreas allografts before transplantation. Journal of Visualized Experiments. (185), e63905 (2022).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7 (8), 1479-1496 (2012).
- Graham, A. S., Ozment, C., Tegtmeyer, K., Lai, S., Braner, D. A. V. Central venous catheterization. The New England Journal of Medicine. 356 (21), 21 (2009).
- Taylor, R. W., Palagiri, A. V. Central venous catheterization. Critical Care Medicine. 35 (5), 1390-1396 (2007).
- Reed, R., et al. Accuracy of an oscillometric blood pressure monitor in anesthetized pigs. Laboratory Animals. 52 (5), 490-496 (2018).
- Musk, G. C., Costa, R. S., Tuke, J. Body temperature measurements in pigs during general anaesthesia. Laboratory Animals. 50 (2), 119-124 (2016).
- Aggarwal, S., Kang, Y., Freeman, J. A., Fortunato, F. L., Pinsky, M. R. Postreperfusion syndrome: Hypotension after reperfusion of the transplanted liver. Journal of Critical Care. 8 (3), 154-160 (1993).
- Manning, M. W., Kumar, P. A., Maheshwari, K., Arora, H. Post-reperfusion syndrome in liver transplantation-An overview. Journal of Cardiothoracic and Vascular Anesthesia. 34 (2), 501-511 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。