Method Article
Intubación, catéter venoso central y colocación de vías arteriales en cerdos para la investigación traslacional en cirugía de trasplante abdominal
En este artículo
Resumen
Para obtener los mejores resultados posibles, los cirujanos que realizan experimentos de investigación traslacional deben ser competentes en la intubación y la colocación de vías vasculares. Este artículo describe las técnicas utilizadas por el Laboratorio de Preservación de Órganos de Toronto para realizar estos procedimientos.
Resumen
Los modelos de investigación quirúrgica traslacional en cerdos son cruciales para el desarrollo de protocolos preclínicos seguros. Sin embargo, el éxito de las cirugías experimentales no depende únicamente de las habilidades quirúrgicas del equipo de investigación; Los procedimientos de cuidado y manejo perioperatorio, como la intubación, la vía venosa central y la colocación de vías arteriales, son necesarios y de suma importancia para obtener resultados favorables del experimento. Como es poco común que los equipos de investigación cuenten con anestesiólogos o cualquier otro personal que no sea el equipo quirúrgico, el equipo quirúrgico involucrado en la investigación traslacional debe adquirir y/o desarrollar las habilidades para realizar la atención perioperatoria. El propósito de este artículo es mostrar las técnicas de intubación, catéter venoso central y colocación de vías arteriales utilizadas y perfeccionadas en el Laboratorio de Preservación de Órganos de Toronto durante los últimos 10 años, para ser utilizadas como referencia para futuros investigadores que se unan a este equipo o a cualquier otro laboratorio que realice protocolos de investigación traslacional en trasplante porcino y/o abdominal.
Introducción
Los modelos experimentales porcinos se utilizan a menudo en el estudio de enfermedades humanas debido a sus propiedades anatómicas y fisiológicas similares. Estos modelos son cruciales en el desarrollo de protocolos preclínicos seguros, pero también están sujetos a restricciones legales y éticas1. El uso de cerdos para la investigación debe realizarse en las mejores condiciones posibles para evitar pérdidas innecesarias de animales y sufrimientos debido a complicaciones anestésicas no relacionadas con el proyecto de investigación.
Las técnicas y habilidades preoperatorias, como la intubación, la colocación de la vía venosa central y la colocación de la vía arterial, son esenciales para lograr resultados exitosos y reproducibles.
Todo animal sometido a anestesia general para un procedimiento quirúrgico debe ser intubado para mantener la vía aérea abierta, permitiendo la ventilación asistida y evitando la broncoaspiración2. Las posiciones más comunes para la intubación en cerdos son decúbito dorsal, lateral y esternal 3,4. La decúbito esternal tiende a ser más fácil para el personal entrenado en intubación humana3, que es el caso de este centro de investigación.
Un buen acceso vascular es esencial para la administración de líquidos, medicamentos y muestras durante y después de la cirugía. El uso de vasopresores es frecuente durante las cirugías de trasplante abdominal debido a la inestabilidad hemodinámica resultante de la lesión por isquemia-reperfusión. La infusión de vasopresores a través de una vía periférica puede causar lesión tisular local debido a los efectos vasoconstrictores5. La colocación de una vía venosa central permite infundir grandes cantidades de líquidos y vasoppresores. Preferimos una técnica percutánea asistida por guía para la colocación de la vía central, ya que minimiza el daño a los tejidos blandos y a los vasos6.
Se requiere la estabilidad hemodinámica del animal durante la cirugía, y la presión arterial es el parámetro más típicamente monitoreado para este propósito7. Una línea arterial permite una medición continua de la presión arterial, que es más precisa que la medición tradicional no invasiva8 ya que las técnicas no invasivas subestiman los valores durante la hipertensión y los sobreestiman durante la hipotensión 7,8. Una lectura precisa de la presión arterial durante estos experimentos es fundamental para poder controlar la cantidad de líquidos y vasopresores que se deben administrar al cerdo.
El Laboratorio de Preservación de Órganos de Toronto ha estado utilizando modelos porcinos durante más de 10 años y ha estandarizado estos procedimientos a lo largo de los años con excelentes resultados. Aunque en la literatura se pueden encontrar otros enfoques para los mismos procedimientos, el objetivo de este trabajo es presentar las técnicas desarrolladas y perfeccionadas a lo largo de los años en nuestras instalaciones.
Protocolo
Todos los animales utilizados para este estudio recibieron cuidado humanitario de acuerdo con los "Principios de Cuidado de Animales de Laboratorio" formulados por la Sociedad Nacional de Investigación Médica y la "Guía para el Cuidado de Animales de Laboratorio" publicada por los Institutos Nacionales de Salud, Ontario, Canadá. Todos los estudios fueron aprobados por el Comité de Cuidado de Animales del Instituto General de Investigación de Toronto. En este estudio, se utilizaron cerdos Yorkshire machos de 11-12 semanas de edad con un peso de 30-40 kg.
1. Intubación
- Aloje a los cerdos durante al menos 5 días antes del procedimiento para permitirles adaptarse al entorno y reducir los niveles generales de estrés.
- Ayuna al cerdo durante 6 h antes de la anestesia.
- Anestesiar al cerdo con una inyección intramuscular (IM) de ketamina (20 mg/kg) como anestésico disociativo, midazolam (0,15 mg/kg) para la sedación y atropina (0,04 mg/kg) para reducir la salivación y las secreciones bronquiales, en el establo.
- DarO2 e isoflurano al 5% con la ayuda de una mascarilla una vez que el cerdo se haya dormido durante al menos 5 min.
- Traslade al cerdo a un carro de transporte y transfiéralo al quirófano.
- Coloque al cerdo en posición supina en la mesa de quirófano.
- Colocar la mascarilla de ventilación con 2 L/min deØ2 y 5% de isoflurano.
NOTA: Asegúrese de que el cerdo tenga esfuerzo inspiratorio. - Coloque la sonda de saturación de oxígeno en la oreja del cerdo.
NOTA: La sonda también se puede colocar en la lengua, la cola, el espolón3, los labios o el pliegue inguinal. - Pídale a un asistente que coloque los electrodos del electrocardiograma y el manguito de presión arterial.
NOTA: Los electrodos se colocan en el pliegue axilar derecho, el pliegue axilar izquierdo y el pliegue inguinal izquierdo. El manguito de presión arterial se puede colocar en la pata delantera o trasera. - Comprobar la relajación de la mandíbula después de 4-5 min de ventilación con isoflurano al 5%.
NOTA: si se nota resistencia, continúe la ventilación con isoflurano durante 3 minutos adicionales o hasta que la mandíbula esté relajada. - Pídale al asistente que sostenga la mandíbula hacia arriba, el maxilar hacia abajo y la lengua para apartarla.
- Inserte un laringoscopio con una hoja de fresado recta a lo largo de la línea media y levante la epiglotis.
NOTA: Utilice un tubo endotraqueal para empujar hacia abajo el paladar blando y permitir que la epiglotis salga (Figura 1). - Visualice las cuerdas vocales y rocíelas dos veces con lidocaína en aerosol (10 mg/dosis medida) para prevenir espasmos durante la intubación.
- Retire el laringoscopio y vuelva a colocar la máscara de oxígeno durante 30 s.
- Retire la máscara de oxígeno, inserte la cuchilla recta Miller por la línea media y levante la epiglotis. Inserte un tubo endotraqueal de 7,0 mm más allá de las cuerdas vocales.
NOTA: Si hay resistencia o espasmo de las cuerdas vocales, repita los pasos 1.13 y 1.14. - Sostenga el tubo endotraqueal en su lugar y deslice hacia afuera el laringoscopio y el estilete.
- Inflar el manguito del tubo endotraqueal con 5-8 cc de aire y conectarlo a un sensor de capnometría para asegurar la correcta colocación del tubo.
NOTA: Otros métodos para asegurar la colocación adecuada incluyen buscar impulsos torácicos, condensación en el tubo endotraqueal y escuchar sonidos respiratorios bilaterales. - Encienda el ventilador y ajústelo a 15-20 respiraciones por minuto, el isoflurano a 2%-2,5%, el volumen corriente a 10-15 mL/kg de peso corporal y la presión inspiratoria máxima entre 18-20 cmH2O 9,10,11.
- Fije el tubo endotraqueal con cinta adhesiva.
- Aplique lubricante para los ojos para prevenir la sequedad y la ulceración durante el procedimiento.
- Asegure una anestesia adecuada evaluando el tono de la mandíbula y ajustando el isoflurano en consecuencia. La rigidez de los músculos mandibulares indica un nivel ligero de anestesia3.
2. Colocación de catéter venoso central
NOTA: La elección del catéter depende del tipo de modelo que se utilice. Para los modelos de supervivencia, se utiliza un catéter que se puede tunelizar al final del procedimiento. Para los modelos de terminales, se utiliza un modelo más simple (consulte la Tabla de materiales).
- Después de la intubación, con el cerdo en posición supina, desinfecte ambos lados del cuello con una solución de yodo o clorhexidina.
- Prepare el catéter enjuagándolo con 5 a 10 mL de solución salina y asegúrese de que no tenga aire en su interior. Coloque el dilatador a través del catéter.
- Inspeccione y pruebe el alambre guía para confirmar los aspectos y el funcionamiento adecuados.
NOTA: La guía debe moverse libremente dentro de la funda y no debe tener defectos ni torceduras. Si se observa alguna alteración, reemplace el alambre guía. - Identifique los siguientes tres puntos de referencia en el cuello del cerdo: (1) la rama caudal de la mandíbula, (2) el manubrio craneal y (3) el punto craneal del hombro derecho formado por el tubérculo mayor del húmero6 (Figura 2).
- Inserte la aguja del buscador unida a una jeringa de 5 ml en el centro del triángulo formado por los tres puntos de referencia en un ángulo de 45° con respecto a la piel y dirigida hacia el lado caudal, mientras tira ligeramente hacia atrás del émbolo de la jeringa.
- Una vez que se encuentre la vena yugular, retire la jeringa de la aguja del buscador y estabilice la aguja mientras coloca el pulgar sobre el centro de la aguja. Asegúrese de que la aguja del buscador esté asegurada en su lugar.
NOTA: Si se sospecha que la sangre que sale de la aguja es arterial, retire la aguja inmediatamente y aplique presión durante 5 minutos. - Introduzca la guía en la aguja del buscador y avance hasta la vena yugular externa (técnica de Seldinger12). Se debe encontrar una resistencia mínima o nula. Retire la aguja del buscador y mantenga la guía en su lugar.
NOTA: Utilice una traza de ECG para asegurarse de que la guía no penetre demasiado profundamente. Si se observan alteraciones en el ritmo cardíaco, retire ligeramente la guía. - Inserte la punta de una cuchilla de 11 hojas en el sitio de punción y cree una incisión (alrededor de 0,5 cm) para el dilatador y el catéter.
- Alimente el dilatador y el catéter sobre la guía para dilatar la piel y el tejido subcutáneo. Una vez en su lugar, retire el dilatador del catéter.
- Aspire desde la luz del catéter para asegurar un flujo adecuado y enjuague con 5-10 mL de solución salina.
- Suturar el catéter en la piel con una sutura de seda 0 y asegurarse de que el catéter esté seguro13.
3. Colocación de vías arteriales
NOTA: Se prefiere la colocación carotídea de la línea arterial, ya que proporciona una ruta más directa al corazón y los vasos del cuello son más grandes que los vasos femorales11. Preferiblemente, la línea arterial debe colocarse en el lado contralateral del catéter venoso central y bajo visión directa; Si esto no es posible, se puede colocar en el mismo lado que el catéter venoso.
- Realizar una incisión vertical de 5-7 cm medial a la tráquea con una pluma de cauterización (Figura 3).
- Diseccionar el tejido subcutáneo y el plano entre los músculos cutáneos y de Colli11.
- Diseccionar el plano facial entre la tráquea y el músculo esternomastoideo para localizar y abrir la vaina carotídea11 (Figura 4).
- Utilice la disección roma para aislar la arteria carótida común (Figura 5).
- Colocar dos bridas de seda 2-0 alrededor de la arteria carótida para el control vascular y atar la distal (Figura 6).
- Coloque las pinzas de ángulo recto debajo de la arteria.
- Pídale al asistente que sostenga la atadura proximal e inserte la punta de la aguja angiocath en la arteria carótida en un ángulo de 45°. Una vez que se vea un destello de sangre, avance la aguja ligeramente en un ángulo poco profundo y luego avance el catéter solo hacia la arteria.
- Retire la aguja mientras mantiene el catéter en su lugar.
- Conecte el catéter a la línea arterial, aspire y enjuague con 5-10 ml de solución salina para asegurarse de que no haya resistencia.
- Coloque un lazo alrededor del catéter y la arteria para asegurar el catéter.
4. Cuidados postoperatorios (modelo de supervivencia)
- Tunelice el catéter de vía venosa y fíjelo al cuello del cerdo.
- Una vez que el animal esté hemodinámicamente estable y pueda ser destetado de los vasopresores, retire el catéter de la línea arterial, ate el lado distal de la arteria carótida y verifique la hemostasia. Cierre la herida con una sutura ininterrumpida.
- Mueva el cerdo al carro de transporte y colóquelo en posición esternal.
- Apague el isoflurano y vigile al cerdo hasta que haya signos de recuperación de la anestesia (movimientos y respiración contra el ventilador).
- Apague el ventilador una vez que se hayan observado respiraciones espontáneas efectivas, pero mantenga el suministro deO2 a 2 L/min.
- Apague el suministro deO2 después de 10-15 minutos. El cerdo debe ser capaz de mantener una saturación de al menos el 94% por sí solo. Si ese no es el caso, vuelva a encender el O2 y vuelva a evaluar en otros 5-10 minutos.
- Mueva el cerdo de regreso a su corral una vez que mantenga la saturación de O2 .
NOTA: El cerdo debe ser trasladado de vuelta a su corral con el tubo endotraqueal en su lugar. - Retirar el tubo endotraqueal una vez que los signos de deglución y/o masticación sean evidentes (entre 2-4 h después del final de la cirugía).
- Vigila al cerdo en su corral y nunca lo dejes solo. Una vez que el cerdo está extubado y puede mantener una posición esternal, se puede dejar desatendido.
Resultados
El seguimiento del cerdo durante la cirugía es indispensable, y los parámetros normales esperados durante la cirugía se muestran en la Tabla 1 3,14. La duración aproximada necesaria para realizar cada procedimiento se muestra en la Tabla 2.
Como se mencionó anteriormente, este laboratorio ha estado realizando estos procedimientos durante los últimos 10 años. Durante este período, se han llevado a cabo 595 experimentos con hígado, 277 experimentos con riñón y 100 experimentos con páncreas (Tabla 3).
Los 100 experimentos de páncreas (para 151 cerdos) se realizaron durante los últimos 2 años y se utilizan aquí como resultados representativos.
Dos animales presentaban una vía aérea difícil, por lo que fue necesario que un técnico veterinario experimentado realizara la intubación. El resto del procedimiento se llevó a cabo sin ninguna otra complicación. Esto se traduce en una tasa de éxito de la intubación del 98,7% (Tabla 4).
Desafortunadamente, se perdieron cinco animales durante este período, relacionados con los procedimientos de colocación de la vía central, lo que equivale a una tasa de éxito del 96,7% (Tabla 4). Tres de los animales presentaron arritmia después de la colocación de la vía central y progresaron a asistolia en cuestión de segundos; No se administraron fármacos después, ya que debido a la naturaleza de los experimentos, se consideró un tiempo de isquemia cálido y puede haber afectado a los resultados finales. Se realizó una autopsia a uno de los animales; Se descubrieron múltiples coágulos en el ventrículo derecho, así como signos sugestivos de una embolia pulmonar. Los otros dos animales presentaron muerte súbita cardíaca sin signos de arritmia previa. Tras la autopsia, se observó corazón agrandado y edema pleural.
La colocación de la vía arterial siempre se realiza, en este centro, después de la colocación de la vía venosa central; Como se mencionó anteriormente, se perdieron cinco animales durante la colocación de la vía venosa central, incluso antes de que comenzara la colocación de la vía arterial. La colocación de vías arteriales fue exitosa en los 146 intentos restantes, lo que se traduce en una tasa de éxito del 100% (Tabla 4).

Figura 1: Puntos de referencia de las vías respiratorias. Se utiliza un tubo endotraqueal para empujar hacia abajo el paladar blando y permitir que la epiglotis salga. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Colocación del catéter venoso central mediante la técnica de triangulación. Tres puntos de referencia en el cuello del cerdo: la rama caudal de la mandíbula, el manubrio craneal y la punta craneal del hombro derecho formada por el tubérculo mayor del húmero. Haga clic aquí para ver una versión más grande de esta figura.
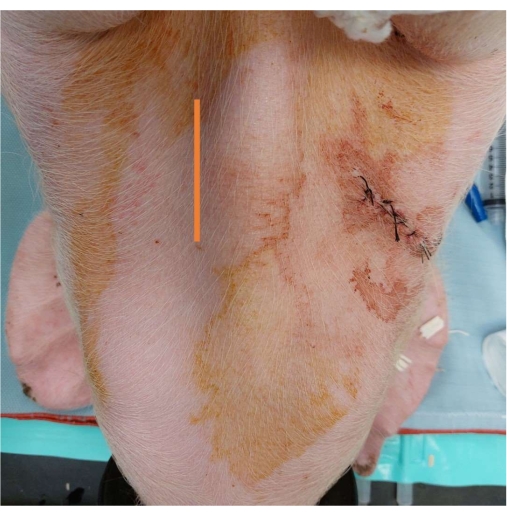
Figura 3: Colocación de la vía arterial. Una marca que muestra el sitio de la incisión vertical de 5-7 cm medial a la tráquea. Haga clic aquí para ver una versión más grande de esta figura.
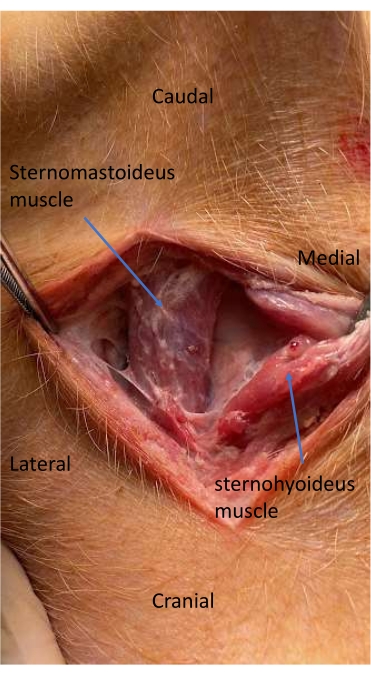
Figura 4: Músculo esternomastoideo y esternohioideo durante la disección para la colocación de vías arteriales. Se diseca el plano facial entre la tráquea y el músculo esternomastoideo para localizar y abrir la vaina carotídea. Haga clic aquí para ver una versión más grande de esta figura.
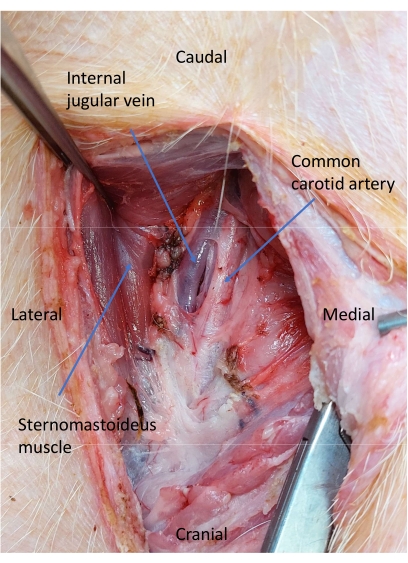
Figura 5: Vena yugular y arteria carótida después de la disección de la vaina carotídea. Se realiza una disección roma para aislar la arteria carótida común. Haga clic aquí para ver una versión más grande de esta figura.
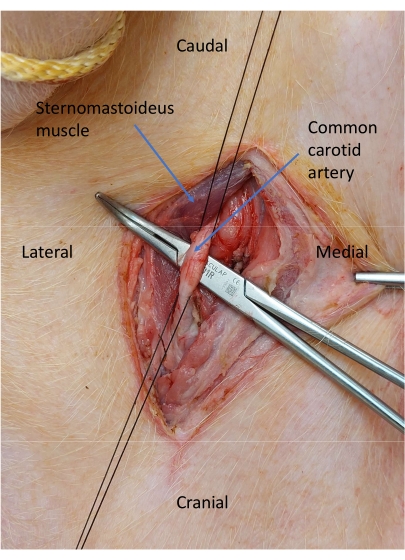
Figura 6: Arteria carótida común aislada. Se colocan dos bridas de seda 2-0 alrededor de la arteria carótida para el control vascular. Haga clic aquí para ver una versión más grande de esta figura.
| Parámetro | Rango normal |
| Temperatura | De 38 a 39,5 °C |
| Fin de CO2 | 40–50 mmHg |
| Presión arterial sistólica | 112–139 mmHg |
| Presión arterial diastólica | 72–98 mmHg |
| Presión arterial media | 86–123 mmHg |
| Polígrafo | De 70 a 100 lpm |
| Frecuencia respiratoria | De 10 a 20 lpm. |
Tabla 1: Parámetros normales que deben mantenerse durante la cirugía. La tabla enumera el rango normal de los parámetros que deben mantenerse durante la cirugía.
| Procedimiento | Tiempo (min) |
| Intubación | 15 ± 5 |
| Catéter venoso central | 20 ± 10 |
| Vía arterial | 20 ± 10 |
Tabla 2: Duración de los procedimientos. La tabla enumera la duración aproximada requerida para realizar la intubación, el cateterismo venoso central y la colocación de vías arteriales.
| Órgano | Número de experimentos |
| Hígado | 595 |
| Riñón | 277 |
| Páncreas | 100 |
Tabla 3: Número de experimentos por órgano. La tabla enumera el número de experimentos realizados en el hígado, el riñón y el páncreas.
| Exitoso | No tuvo éxito | Éxito (%) | Fallo (%) | |
| Intubaciones | 149 | 2 | 98.7 | 1.3 |
| Colocación de la vía central | 146 | 5 | 96.7 | 3.3 |
| Colocación de vías arteriales* | 146 | 0 | 100 | 0 |
| *Todas las colocaciones de vías arteriales se realizan después de la colocación de vías centrales | ||||
Tabla 4. Tasa de éxito por procedimiento. La tabla muestra la tasa de éxito de las intubaciones, cateterismos venosos centrales y colocación de vías arteriales realizadas en 151 cerdos.
Discusión
Cada centro de investigación debe crear sus propios protocolos y directrices para los modelos de investigación traslacional; Sin embargo, se deben seguir algunas reglas básicas para garantizar resultados exitosos.
En primer lugar, el cerdo debe ser sometido a un examen físico tan pronto como llegue a la instalación de alojamiento. Es necesario un total de 5-7 días de acondicionamiento antes del procedimiento para reducir los niveles de estrés y permitir que el cerdo recupere el peso perdido durante el transporte3. Es importante tener en cuenta que utilizamos cerdos que provienen de una granja de cría y no se crían exclusivamente con fines de investigación y, como era de esperar, pueden surgir problemas de salud durante todo el año (virus estacionales).
Antes del procedimiento, el cerdo debe estar en ayunas para alimento sólido durante 6-8 h, sin embargo, se permite el agua hasta el momento de la cirugía3. También es especialmente importante recordar que los cerdos son susceptibles a las arritmias cardíacas inducidas por la anestesia. La colocación de un ECG durante la inducción de la anestesia y el acceso vascular ayuda a identificarlos, pudiendo administrarse fármacos antiarrítmicos si es necesario3. Esta ha sido una razón importante para la pérdida de cerdos durante nuestros experimentos. Un veterinario certificado o un técnico veterinario experimentado debe estar disponible en caso de que el equipo encuentre un problema que no se pueda resolver. El uso de ultrasonidos no es frecuente en nuestro laboratorio debido a la disponibilidad limitada, por lo que reservamos su uso para casos difíciles. La planificación de experimentos en torno a la disponibilidad de la máquina de ultrasonido limitaría significativamente el número y el momento de los experimentos. Sin embargo, si está ampliamente disponible en otros centros de investigación, se fomenta enormemente su uso.
La experiencia del equipo quirúrgico también es un factor clave. Todo el personal investigador directamente implicado en la parte quirúrgica de los protocolos, en este centro de investigación, son cirujanos generales formados, y la mayoría también tiene formación en HPB y/o cirugía de trasplantes. La mayoría no tiene experiencia previa en modelos porcinos traslacionales. Cada equipo está formado por un becario senior y un becario junior. El investigador principal tiene al menos 1 año de experiencia en modelos traslacionales porcinos y supervisa la capacitación del miembro junior en las técnicas básicas descritas en este artículo. El becario junior generalmente se vuelve competente en 4 a 6 semanas.
Aquí hay algunos consejos que pueden ser útiles en caso de que los parámetros de los signos vitales se alteren durante los experimentos. La hipotermia es una complicación frecuente durante la cirugía15; Se puede colocar una almohadilla térmica en la mesa de cirugía y también se puede colocar un sistema de manta térmica encima del cerdo. Si estas medidas no son suficientes, se puede considerar el uso de soluciones intravenosas calentadas.
Si el CO2 final está por debajo o por encima de los rangos normales, se debe confirmar la colocación correcta del tubo endotraqueal y el inflado adecuado del manguito. Se debe revisar el sensor de CO2 para asegurarse de que esté conectado y funcione correctamente. La máquina de anestesia debe ser revisada en busca de fugas, y las perlas de dióxido de carbono deben ser reemplazadas si se agotan. También es importante asegurarse de que el flujo inspiratorio, las respiraciones por minuto y la presión inspiratoria máxima se ajusten correctamente de acuerdo con el peso del cerdo.
Si el sensor de oximetría de pulso no funciona en uno de los lugares mencionados anteriormente, primero se debe asegurarse de que el sensor funcione correctamente, que el ventilador esté encendido, que el oxígeno esté ajustado a 2 L/min y que el cerdo tenga una coloración normal. Si todo lo anterior es normal, el sensor debe trasladarse a otra de las ubicaciones mencionadas. Si esto no funciona, se puede tomar un análisis de gases en sangre para verificar la saturación de oxígeno.
En la cirugía de trasplante abdominal, la hipotensión es un componente crítico de la lesión post-reperfusión16. El aumento de la tasa de líquidos por vía intravenosa y el uso de vasopresores (usamos norepinefrina) son comunes. La norepinefrina tiene un efecto vasopresor e inotrópico, por lo que la frecuencia cardíaca debe controlarse constantemente. También es importante recordar que la vasoconstricción puede comprometer el flujo sanguíneo al órgano recién trasplantado17.
Los procedimientos descritos anteriormente se utilizan para la investigación en cirugía de trasplante abdominal; sin embargo, creemos que pueden ser adaptados y utilizados para otros tipos de investigación. Los modelos porcinos son invaluables para la investigación traslacional y, como tal, los equipos de investigación deben garantizar un trato humanitario y no permitir ningún dolor o sufrimiento a los animales.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Irrigation, USP | Baxter | JF7124 | Saline |
| Angiocath 16 GA 1.88 , 1.7 x 48 mm | BD | 381157 | |
| Atropine sulfate (8 mg/20 mL - 0.4 mg/mL) | West-Ward | 17733 | 20 mL vial |
| Cook TPN Single Lumen Cathether Set | Cook medical | G08132 | with 10 Fr peel away introducer set |
| Hickman 9.6 F single-lumen CV cathether | Bard | 600560 | |
| Laryngoscope | Heine | ||
| Midazolam (5 mg/mL) | Sandoz | 46237968 | 10 mL vial |
| Miller blade 4 | Heine | 185 mm blade length | |
| Narketan (Ketamine - 100 mg/mL) | Vetoquinal | 8-00223 | 50 mL vial |
| Nasal tracheal tube cuffed 7.0 mm I.D. | Covidien | 86450 | |
| Optixcare eye lube for dogs and cats | Aventix | 5914304 | 20 g |
| Percutaneous Sheath introducer set with integral hemostasis valve/side port for use -7.5 Fr. Catheters | Arrow | SI-09880 | 8.5 Fr, 10 cm, 0.035 inch dia. Spring wire guide |
| Universal Electrosurgical Pad: Split with cord | 3M | 9165 | |
| Valleylab Rocker Switch Pencil Holster | Covidien | E2515H | |
| Xylocaine 10% Spray | AstraZeneca | 73050036 | lidocaine (10 mg/metered dose) |
Referencias
- Dehoux, J. P., Gianello, P. The importance of large animal models in transplantation. Frontiers in Bioscience: A Journal and Virtual Library. 12, 4864-4880 (2007).
- Ettrup, K. S., et al. Basic surgical techniques in the Göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. Journal of Visualized Experiments. (52), e2652 (2011).
- Swindle, M. M. . Swine in the Laboratory Surgery, Anesthesia, Imaging, and Experimental Techniques. , (2015).
- Chum, H., Pacharinsak, C. Endotracheal intubation in swine. Lab Animal. 41 (11), 309-311 (2012).
- Prasanna, N., et al. Safety and efficacy of vasopressor administration through midline catheters. Journal of Critical Care. 61, 1-4 (2021).
- Flournoy, W. S., Mani, S. Percutaneous external jugular vein catheterization in piglets using a triangulation technique. Laboratory Animals. 43 (4), 344-349 (2009).
- Kuck, K., Baker, P. D. Perioperative noninvasive blood pressure monitoring. Anesthesia and Analgesia. 127 (2), 408-411 (2017).
- Pour-Ghaz, I., et al. Accuracy of non-invasive and minimally invasive hemodynamic monitoring: where do we stand. Annals of Translational Medicine. 7 (17), 421 (2019).
- Kaths, J. M., et al. Normothermic ex vivo kidney perfusion for the preservation of kidney grafts prior to transplantation. Journal of Visualized Experiments. (101), e52909 (2015).
- Parmentier, C., et al. Normothermic ex vivo pancreas perfusion for the preservation of pancreas allografts before transplantation. Journal of Visualized Experiments. (185), e63905 (2022).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7 (8), 1479-1496 (2012).
- Graham, A. S., Ozment, C., Tegtmeyer, K., Lai, S., Braner, D. A. V. Central venous catheterization. The New England Journal of Medicine. 356 (21), 21 (2009).
- Taylor, R. W., Palagiri, A. V. Central venous catheterization. Critical Care Medicine. 35 (5), 1390-1396 (2007).
- Reed, R., et al. Accuracy of an oscillometric blood pressure monitor in anesthetized pigs. Laboratory Animals. 52 (5), 490-496 (2018).
- Musk, G. C., Costa, R. S., Tuke, J. Body temperature measurements in pigs during general anaesthesia. Laboratory Animals. 50 (2), 119-124 (2016).
- Aggarwal, S., Kang, Y., Freeman, J. A., Fortunato, F. L., Pinsky, M. R. Postreperfusion syndrome: Hypotension after reperfusion of the transplanted liver. Journal of Critical Care. 8 (3), 154-160 (1993).
- Manning, M. W., Kumar, P. A., Maheshwari, K., Arora, H. Post-reperfusion syndrome in liver transplantation-An overview. Journal of Cardiothoracic and Vascular Anesthesia. 34 (2), 501-511 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados