Method Article
Количественный анализ вязкоупругих свойств эритроцитов с помощью оптического пинцета и расфокусирующей микроскопии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь описан интегрированный протокол, основанный на оптическом пинцете и расфокусирующей микроскопии для измерения реологических свойств клеток. Данный протокол имеет широкое применение при изучении вязкоупругих свойств эритроцитов при вариабельных физиопатологических условиях.
Аннотация
Вязкоупругие свойства эритроцитов исследованы с помощью ряда методов. Однако сообщаемые экспериментальные данные варьируются. Это связано не только с нормальной изменчивостью клеток, но и с различиями в методах и моделях клеточного ответа. Здесь используется интегрированный протокол с использованием оптического пинцета и расфокусирующей микроскопии для получения реологических характеристик эритроцитов в диапазоне частот от 1 Гц до 35 Гц. В то время как оптический пинцет используется для измерения эритроцитарно-комплексной эластичной постоянной, расфокусирующая микроскопия способна получить профиль высоты, объем и форм-фактор клетки, параметр, который позволяет преобразовать сложную упругую константу в сложный модуль сдвига. Кроме того, применяя модель мягкой стекловидной реологии, можно получить показатель масштабирования для обоих модулей. Разработанная методика позволяет исследовать механическое поведение эритроцитов, характеризуя их вязкоупругие параметры, полученные в четко определенных экспериментальных условиях, при ряде физиологических и патологических состояний.
Введение
Зрелые эритроциты (эритроциты), также известные как эритроциты, способны расширяться более чем в два раза по размеру при прохождении через самые узкие капилляры человеческого тела1. Такая способность объясняется их уникальной способностью деформироваться при воздействии внешних нагрузок.
В последние годы различные исследования охарактеризовали эту особенность на поверхностях эритроцитов 2,3. Область физики, описывающая упругие и вязкие реакции материалов из-за внешних нагрузок, называется реологией. Как правило, при приложении внешней силы результирующая деформация зависит от свойств материала и может быть разделена на упругие деформации, которые накапливают энергию, или вязкие деформации, которые рассеивают энергию4. Все клетки, включая эритроциты, проявляют вязкоупругое поведение; Другими словами, энергия как накапливается, так и рассеивается. Таким образом, вязкоупругий отклик ячейки можно охарактеризовать ее комплексным модулем сдвига G*(ω) = G'(ω) + iG"(ω), где G' (ω) - модуль накопления, связанный с упругим поведением, а G" (ω) - модуль потерь, связанный с его вязкостью4. Кроме того, для описания клеточных реакций использовались феноменологические модели, одна из наиболее часто используемых называется мягкой стеклянной реологической моделью5, характеризующейся степенной зависимостью модуля комплексного сдвига от частоты нагрузки.
Для характеристики вязкоупругих свойств эритроцитов были использованы одноячеистые методы путем приложения силы и измерения смещения в зависимости от приложенной нагрузки 2,3. Однако для комплексного модуля сдвига в литературе можно найти мало результатов. При использовании динамического рассеяния света значения модулей хранения и потерь эритроцитов варьировались от 0,01 до 1 Па в диапазоне частот от 1 до 100Гц 6. С помощью опто-магнитной скручивающей цитометрии был получен кажущийся сложный модуль упругости7, и для целей сравнения был заявлен мультипликативный коэффициент, который, возможно, прояснит расхождения.
Совсем недавно была создана новая методология, основанная на оптическом пинцете (ОТ) вместе с расфокусирующей микроскопией (ДМ), как интегрированный инструмент для количественного картирования хранения и потери модулей сдвига эритроцитов человека при нагрузках, зависящих от времени 8,9. Кроме того, была использована модель мягкой стекловидной реологии для подгонки результатов и получения степенного коэффициента, характеризующего эритроциты 8,9.
В целом, разработанная методика8,9, протокол для которой подробно описан ниже, проясняет предыдущие расхождения с использованием измеренных значений для форм-фактора Ff, который связывает силы и деформации с напряжениями и деформациями на поверхности эритроцитов и может быть использован в качестве нового метода диагностики, способного количественно определять вязкоупругие параметры и мягкие стекловидные свойства эритроцитов, полученных от лиц с разной кровью Патологий. Такая характеристика с использованием протокола, описанного ниже, может открыть новые возможности для понимания поведения эритроцитов с механобиологической точки зрения.
протокол
Образцы человеческой крови были предоставлены взрослыми мужчинами и женщинами-добровольцами в соответствии с протоколами, утвержденными Комитетом по этике исследований Федерального университета Рио-де-Жанейро (протокол 2.889.952) и зарегистрированными на платформе Бразилии под номером CAAE 88140418.5.0000.5699. Всем добровольцам была выдана письменная форма согласия. Пациенты с гемоглобинопатией и/или принимающие контролируемые лекарства были исключены. Весь процесс следовал руководящим принципам, утвержденным этическим комитетом института.
1. Подготовка держателей образцов
- Приобретите два покровных стекла (24 мм x 60 мм и 24 мм x 32 мм; толщина = 0,13-0,17 мм) и одно резиновое кольцо (диаметр = 10 мм; толщина = 2 мм) для каждого держателя образца.
- Налейте силиконовую смазку на поверхность резинового кольца таким образом, чтобы покрыть весь периметр.
- Поместите резиновое кольцо на покровное стекло так, чтобы смазочная сторона была обращена к защитному столику. Подождите 5 минут для правильного прикрепления, после чего держатели образцов будут готовы к приему клеточной культуры.
ПРИМЕЧАНИЕ: Кроме того, можно использовать как коммерческую, так и домашнюю посуду со стеклянным дном, как описаноранее 10.
2. Клеточная культура
ПРИМЕЧАНИЕ: Следующие шаги описывают, как получить здоровые эритроциты из крови человека. Важно, чтобы образцы были свежеприготовленными перед каждым экспериментом.
- Разбавьте 20 мкл крови в 250 мкл 1x фосфатного буферного физиологического раствора (PBS), содержащего 137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na 2 HPO 4, 1,8 мМ KH2PO4, 10 мМ глюкозы и дополните 1 мг / мл бычьего сывороточного альбумина (BSA).
- После центрифугирования при 200 x g в течение 2 мин при комнатной температуре аспирируйте надосадочную жидкость с помощью пипетки и ресуспендируйте гранулу клетки в 1 мл 1x раствора PBS / BSA. Промойте ячейки 2 раза в буфере.
- Рассчитайте плотность клеток с помощью гемоцитометра и засейте от 50 000 до 100 000 клеток в держатель образца, подготовленный на этапе 1. Подождите 10-15 минут для прикрепления неспецифической клетки к покровному стеклу; Время ожидания не влияет на клетки.
- Добавьте к образцу 0,2 мкл 10% раствора полистирольной сферы v/v (радиус = 1,52 ± 0,02 мкм) для дальнейших экспериментов OT. Подтвердите правильное смешивание, посмотрев на образцы под микроскопом.
- После посева ячеек просто поместите второе покровное стекло над резиновым кольцом (добавлять смазку для крепления не нужно), закройте установку и завершите пробоподготовку. Образцы готовы к микроскопическому анализу и манипуляциям.
3. Настройка микроскопа с оптическим пинцетом
ПРИМЕЧАНИЕ: OT - это инструменты, которые используют сильно сфокусированный лазерный луч для захвата микроскопических объектов и измерения сил в пиконетном диапазоне и смещений в нанометровом масштабе. Используемый лазер OT (длина волны 1064 нм) должен быть правильно выровнен, как описаноранее 10.
- Вкратце, используя, по крайней мере, два зеркала, разделенные расстоянием в несколько сантиметров (по крайней мере, 10-20 см), направьте линейно поляризованный лазерный луч к заднему входу инвертированного микроскопа. Точно выровняйте лазерный луч для попадания в микроскоп по прямой линии (рис. 1).
- Затем отразите лазерный луч с помощью дихроичного зеркала, установленного в микроскопе, чтобы двигаться параллельно оси линзы объектива и войти в линзу около центра ее заднего входа. Это сфокусирует лазер для создания оптической ловушки (рис. 1).
- Затем, чтобы измерить силы с помощью OT, откалибруйте систему, чтобы получить жесткость ловушки (κOT). Более подробное описание процедуры калибровки ОТ см.в разделе 10. Как только κ OT найден, система OT готова к реологическим экспериментам.
4. Настройка DM
ПРИМЕЧАНИЕ: DM - это метод оптической микроскопии на основе светлого поля, который позволяет прозрачным объектам становиться видимыми, если микроскоп слегка расфокусирован11,12. Такая методика была применена для получения эритроцитов формы13. Тот же микроскоп, который используется для системы OT, может быть использован для DM для получения профиля высоты с помощью 3D-реконструкций.
- Отрегулируйте систему освещения микроскопа, выполнив подсветкуKöhler 14 , и, для лучшего разрешения, полностью откройте конденсатор-диафрагму для проведения экспериментов.
- Используйте пьезоэлектрическую систему позиционирования для смещения образца во всех координатах с нанометровой точностью по оси z. Выполните автокалибровку пьезоэлектрической системы по всем осям. После того, как все процедуры выполнены, система микроскопа готова к экспериментам с СД.
5. Реологический эксперимент и анализ на основе ОТ
ПРИМЕЧАНИЕ: Реологический эксперимент состоит из наблюдения за реакцией клетки на небольшие колебания различной частоты.
- Экспериментирование
- Используя систему OT, захватите сферу с помощью лазера OT, а затем прикрепите ее к эритроциту, прижав сферу к поверхности ячейки рядом с верхней поверхностью и близко к краю ячейки. Используйте микроскоп для этого шага. Затем захватите другую сферу и повторите ту же процедуру прикрепления, но теперь прикрепите ее к покровному стеклу, близко к ячейке. Сфера, прикрепленная к покровному стеклу, представляет собой эталонный валик (рис. 2), который необходим для отслеживания пьезосмещения и сравнения со сферой эритроцитов.
- Перед началом измерения убедитесь, что выбранная ячейка хорошо прикреплена к покровному стеклу и что эритроциты и эталонные сферы прилипли к поверхности эритроцитов и покровному стекла соответственно. Визуально идентифицируйте неприлипшие клетки, поскольку они будут двигаться с течением времени, несмотря на высокий уровень адгезии (около 80-90%).
- Добавьте синусоидальную функцию амплитуды ξ 0 = 0,500 ± 0,001 мкм и изменяющиеся частоты 1 Гц, 7 Гц, 14 Гц, 21 Гц, 28 Гц и 35 Гц с соответствующими угловыми частотами, ω, 6,3 рад/с, 169 рад/с, 88 рад/с, 132 рад/с, 176 рад/с и 220 рад/с, в программное обеспечение пьезоэлектрического каскада, С помощью пьезоэлектрического программного обеспечения, как было продемонстрировано ранее 8,9.
- Используя пьезоэлектрический столик, нажмите кнопку пуска, чтобы разрешить пьезоэлектрическое смещение и удержать сферу эритроцитов в ловушке, подвергнуть образец циклу движений с использованием ранее установленной синусоидальной функции. Используйте камеру, способную создавать изображения со скоростью 790 кадров в секунду или выше, чтобы записать движение образца. Схема эксперимента показана на рисунке 2.
- В то время как образец подвергается синусоидальным движениям, активируйте OT, чтобы захватить сферу, прикрепленную к поверхности эритроцитов. Независимо от температуры, выбранной для проведения экспериментов, комнатной температуры, 37 ° C или другой температуры, внимательно следите за температурой, чтобы избежать колебаний во время измерений. Инфракрасный (1064 нм) лазер, используемый для создания ОТ, почти не вызывает повреждений или нагрева ячеек.
- Анализ
- Проанализируйте изображения, полученные во время синусоидальных движений, используя ImageJ, чтобы найти положение центра масс каждой из сфер с течением времени.
ПРИМЕЧАНИЕ: Эти данные позволяют строить графики, способные показать разность фаз и амплитуд между обеими сферами. Такая информация имеет решающее значение для получения вязкоупругого отклика эритроцитов. - Чтобы получить центр масс для каждой из сфер, откройте программное обеспечение ImageJ. Импортируйте весь фильм, полученный во время синусоидальных движений.
- На вкладке « Изображение » нажмите « Настроить», а затем выберите «Порог». Откроется окно порога. Выберите Ч/Б. Это сделает фон белым, а сферы черными.
- Отрегулируйте порог с помощью обеих полос прокрутки под гистограммой, чтобы обе сферы отображались с максимальным количеством пикселей.
- Выберите эталонную сферу, щелкнув « Файл» > «Прямоугольник». Нарисуйте прямоугольник, чтобы выделить сферу. После выбора опорной сферы в одном изображении убедитесь, что прямоугольник также правильно выделяет ту же сферу на всех других изображениях фильма.
- Затем на вкладке «Анализ» нажмите «Установить измерения» и выберите параметр «Центр масс».
- Щелкните еще раз на вкладке « Анализ » и выберите «Анализировать частицы». Откроется новое окно. Определите размер и цикличность (в зависимости от радиуса сферы). Установите следующие флажки: «Показать результаты» и « Очистить результаты». Наконец, нажмите « ОК », чтобы обработать все изображения.
- Появится новое окно, содержащее таблицу с координатами xy для центра масс. Сохраните эти значения координат в виде файла .txt. Повторите процедуру для другой сферы, прикрепленной к поверхности эритроцитов.
- Чтобы получить амплитуду и разность фаз для обеих сфер, откройте программное обеспечение для анализа. Импортируйте .txt файлы, полученные ранее.
- Создайте новую таблицу с тремя столбцами. В первом столбце (c0) добавьте количество кадров, во втором столбце (c1) добавьте координаты x для сферы отсчета, а в третьем столбце (c2) координаты x для сферы, прикрепленной к поверхности RBC.
ПРИМЕЧАНИЕ: В этом примере, поскольку синусоидальные движения выполнялись только по оси x, необходимо использовать координаты x только для обеих сфер. - Далее соотнесите кадры со временем. Нажмите на Windows > ввода формулы. Откроется новое окно под названием «Запись формулы». В этом окне можно настроить восемь различных уравнений, каждое из которых находится в определенной тональности (от F1 до F8).
- Нажмите клавишу F1 и введите следующую формулу:
c 3 = c0 / (частота кадров в секунду камеры)
Нажмите « Выполнить». Это создаст новый столбец на некоторое время в таблице (столбец 4). - Вычтите значение координаты x каждого кадра на соответствующее среднее значение. Для этого обозначьте любые два ключа в записи формулы и введите следующие уравнения для каждого ключа:
c 4 = (c 1 - среднее (c 1)) и c 5 = (c 2 - среднее (c2))
Нажмите кнопку «Выполнить». Результаты будут отображаться в столбцах 5 и 6 для справочных сфер и сфер эритроцитов соответственно. - Преобразуйте значения центра масс из пикселей в микрометры. Для этого используйте другой ключ в записи формулы и введите следующее уравнение:
c 4 = c 4 / число преобразования
Повторите тот же процесс для столбца 5.
ПРИМЕЧАНИЕ: Преобразование производится с помощью микрометровой шкалы/линейки и получения его изображения с помощью той же установки микроскопа, которая использовалась для измерений (включая ту же линзу объектива). Эта процедура может быть выполнена во время калибровки микроскопа. Таким образом, получается соотношение пиксель/микрометр. - Сгенерируйте график с центрами масс обеих сфер по оси y и временем по оси x. Для этого нажмите « Галерея» > «Линейный» и «Скаттер». Откроется новое окно. Выберите столбец времени для оси X и на оси Y выберите столбцы центра масс в микрометрах как для эталонной сферы, так и для сферы эритроцитов.
- На графике выберите только данные, относящиеся к первой угловой частоте (6,3 рад/с). Используйте инструменты, показанные на рисунке 3.
- Определите уравнение, которое корректирует кривую данных для эталонной сферы. Для этого нажмите « Кривая подгонки» > «Общие» и «Подгонка1», выберите поле данных, связанных с положением опорной сферы, а затем нажмите « Определить». Откроется новое окно для определения уравнения. Положение ξ(t) эталонной сферы описывается следующим образом:
ξ(t) = ξ0cos(ωt)
где ξ — синусоидальное движение образца, ω — угловая частота, а t — время в s. Перенеся это уравнение в программное обеспечение для анализа, оно будет выглядеть следующим образом: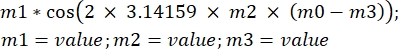 , где m1 — ξ, m2 — f, m0 — время t, m3 — фаза косинусной функции для t = 0.
, где m1 — ξ, m2 — f, m0 — время t, m3 — фаза косинусной функции для t = 0. - Оцените значения для m1, m2 и m3 с графика. После определения уравнения нажмите «ОК». Данные будут подогнаны на основе уравнения, и на графике появится кривая вместе с маленьким квадратом со значениями m1, m2 и m3.
- Определите уравнение, которое корректирует кривую данных для сферы эритроцитов. Для этого нажмите « Подгонка кривой» > «Общие » и определите уравнение, которое будет корректировать кривую для данных. Положение ρ(t) сферы эритроцитов определяется выражением:
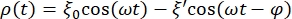
где ξ' — противофазовая амплитуда, а φ — противофазный угол. Перенеся эту формулу в программное обеспечение для анализа, она будет выглядеть следующим образом: , где m1, m2 и m3 — значения, полученные при подгонке кривой эталонной сферы. m4 — ξ', а m5 — φ.
, где m1, m2 и m3 — значения, полученные при подгонке кривой эталонной сферы. m4 — ξ', а m5 — φ. - Оцените значения для m4 и m5 с графика. После определения формулы нажмите «ОК». Данные будут подогнаны на основе уравнения, и на графике появится кривая вместе с маленьким квадратом со значениями m4 и m5.
- Затем создайте новую таблицу, чтобы добавить данные, полученные в результате подгонки кривой в соответствующие столбцы. Определите пять различных столбцов для следующих параметров: угловая частота, амплитуда (опорная сфера), начальное время, амплитуда (сфера эритроцитов) и противофазный угол. Выполните ту же процедуру для всех остальных частот.
- Используйте следующие уравнения, чтобы найти константы хранения (K') и потерь (K"):

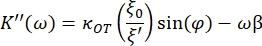
где κ OT — упругая постоянная OT, а β — коэффициент лобового сопротивления Стокса. Перенеся уравнения в программное обеспечение для анализа, это будет выглядеть следующим образом: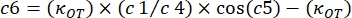 и
и
 , где β и κOT должны быть заменены значениями, найденными в системе.
, где β и κOT должны быть заменены значениями, найденными в системе. - Нанесите результаты на график, используя ось x для K" и ось y для K' (рис. 4).
- Проанализируйте изображения, полученные во время синусоидальных движений, используя ImageJ, чтобы найти положение центра масс каждой из сфер с течением времени.
6. Эксперимент и анализ DM для получения общего форм-фактора ячейки
- Видеосъемка
- Переместите пьезоэлектрический каскад в направлении xy с помощью программного обеспечения для поиска изолированной ячейки, прикрепленной к покровному стеклу. Улавливаем и прикрепляем к поверхности эритроцитов полистирольный шар известного диаметра. Используя пьезоэлектрический столик, слегка переместите захваченный шарик, также прикрепленный к поверхности эритроцитов, чтобы деформировать ячейку, а затем прикрепите шарик к покровному стеклу.
ПРИМЕЧАНИЕ: Также можно использовать ту же ячейку из измерений ОТ. - Измените положение оси Z, чтобы найти сфокусированное изображение, где плоскость фокусировки находится в середине выбранной ячейки. На этом изображении представлен меньший контраст с уровнем серого в центре ячейки, равным уровню серого за пределами ячейки (фон).
- Когда положение фиксировано, используйте программное обеспечение камеры для создания фильма всей ячейки примерно с 5000 изображений с 8-битным и 256 x 256 пикселями с частотой кадров 25 кадров в секунду. Затем переместите положение по оси Z на 2 мкм вниз или вверх, чтобы получить расфокусированное изображение для выбранной ячейки. Повторите параметры, чтобы создать фильм для этой ситуации.
- Наконец, не изменяя положение оси Z, найдите область без ячеек, чтобы повторить ту же процедуру и создать видеоролик фона изображения.
- Переместите пьезоэлектрический каскад в направлении xy с помощью программного обеспечения для поиска изолированной ячейки, прикрепленной к покровному стеклу. Улавливаем и прикрепляем к поверхности эритроцитов полистирольный шар известного диаметра. Используя пьезоэлектрический столик, слегка переместите захваченный шарик, также прикрепленный к поверхности эритроцитов, чтобы деформировать ячейку, а затем прикрепите шарик к покровному стеклу.
- Получение контрастного изображения
- Преобразуйте каждый из трех фильмов в три средних изображения. Используя ImageJ, выберите один из фильмов, нажмите « Стеки изображений» >> «Проект Z » и выберите параметр « Средняя интенсивность ». Повторите эту процедуру для других фильмов, чтобы получить соответствующие изображения.
- Измените все полученные изображения с 8-битных на 32-битные с плавающей запятой. Используя ImageJ, нажмите на Image > Type > 32-бит. Затем нажмите «Анализ» > «Установить измерения» и выберите параметр « Среднее значение серого ». Наконец, снова нажмите « Анализировать» > «Измерить».
- Затем нажмите « Обработать > калькулятор изображений » и разделите сфокусированное изображение на фоновое изображение. На этот результат умножьте среднее значение уровня серого сфокусированного изображения. Получите среднее значение, нажав на Process > Math > Multiply.
- Чтобы получить среднее значение, выберите сфокусированное изображение, а затем нажмите « Проанализировать > измерить». Для репрезентативного изображения среднее значение уровня серого составляет 69 199. Повторите описанные выше процедуры для расфокусированного изображения. В этом случае среднее значение серого уровня составляет 69 231. На рисунке 5 показаны сфокусированные и расфокусированные изображения до и после процедуры.
- Изображения могут терять визуальный контраст во время операций. Чтобы лучше визуализировать изображения, нажмите « Изображение» > «Отрегулировать» > «Яркость/контрастность» и выберите параметр « Авто ».
- Далее, чтобы найти контрастность изображения, используйте следующее соотношение:
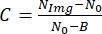 , где N Img — уровень серого ячейки, N0 — уровень серого вне ячейки и постоянный параметр, соответствующий уровню серого для нулевой интенсивности света, зависящего от камеры.
, где N Img — уровень серого ячейки, N0 — уровень серого вне ячейки и постоянный параметр, соответствующий уровню серого для нулевой интенсивности света, зависящего от камеры. - Чтобы найти значение B, используйте измеритель мощности для измерения интенсивности света. Для каждого значения интенсивности света должно быть записано видео; Таким образом, разные значения интенсивности могут быть связаны с разными уровнями серого. Наконец, получите линейную подгонку и соотнесите B с нулевой интенсивностью света15.
- Найдите значение N0, нажмите на значок Polygon Selection и нарисуйте многоугольник, как показано на рисунке 6. Затем перейдите на вкладку «Анализ» и выберите «Измерить», чтобы найти средний уровень серого для выбранной области. Каждое изображение сформировано набором пикселей, и каждый пиксель имеет определенный уровень серого. Набор всех уровней серого из-за всех пикселей, составляющих изображение, соответствует NImg.
- Используйте уравнение контраста для определения N Img - No и выполните его, выбрав «Процесс» > «Математика» > «Вычитание». Разделите полученный результат на N0 - B. Наконец, найдите контраст для сфокусированного (C 0) и расфокусированного изображения (C1).
- Получение высотного профиля
- Для того чтобы получить высотный профиль, воспользуйтесь уже описанным способом13. Короче говоря, используйте преобразование Хартли (FHT) для получения толщины эритроцитов. В ImageJ нажмите «Обработать» > « БПФ» > «Параметры БПФ», а затем выберите «FHT».
- Вычтите изображения C0 и C1 в ImageJ с помощью Process > Math > Вычтите , чтобы получить изображение для следующей процедуры, C = C0 - C1.
- Для изображения C нажмите «Обработать» > « БПФ» > «Параметры БПФ», а затем выберите «FHT », чтобы выполнить преобразование изображения по Хартли. Затем разделите на пространственную частоту q2 с помощью специального плагина DivideQ2. Нажмите на плагин > DivideQ2.
ПРИМЕЧАНИЕ: Файл DivideQ2.class должен быть скопирован в каталог плагинов, где установлен ImageJ. Плагин предоставляется в виде файла .class (Supplementary File 1), который будет включен в папку плагина ImageJ. - Затем выполните обратное преобразование FHT с помощью Process > БПФ > БПФ, чтобы получить изображение с уровнем серого, пропорциональным высоте ячейки.
- Наконец, нажмите « Обработать» > «Математика» > «Умножить », чтобы перемножить полученное изображение, используя следующую константу:
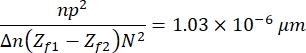
который определяется на основе характеристик изображений, образца и экспериментальной установки13. Здесь n = 1,51 — показатель преломления масла, p = 0,0721 мкм — соотношение между микрометрами и пикселями изображений, Δ n = 0,058 — разница между показателями преломления эритроцитов и водной среды, расстояние между фокусирующими и расфокусирующими изображениями (Z f1 - Z f2) = 2мкм и размер изображений, N 2 = 256 pxl2. - Используйте полученное изображение для получения профиля высоты (рисунок 7). Полученное изображение используется в ImageJ для наблюдения за различными профилями высоты. Это зависит от того, где в ячейке размещена желтая вертикальная линия, например, на рисунке 7 получается профиль высоты, ограниченный вертикальной линией, обратите это внимание, нажав Ctrl + K.
- Коэффициент формы
- Найдя изображение, содержащее профиль высоты эритроцитов, используйте расфокусированный контраст 2 мкм, чтобы создать набор из двух изображений в ImageJ. Нажмите « Изображения > стопки», а затем выберите опцию «Изображения для стека». Чтобы найти форм-фактор, используйте настраиваемый макрос ImageJ для анализа стека. Настроенный макрос ImageJ доступен для загрузки в виде дополнительного файла 2.
ПРИМЕЧАНИЕ: Программа использует расфокусировку изображения для определения краев ячейки. Затем он определяет периметр, используя изображение, содержащее профиль высоты, для каждого горизонтального положения. Помимо ребер, он определяет периметр, а также обратный периметр. Сумма обратных значений периметра, умноженная на толщину пикселя, соответствует обратному форм-фактору. - Вставьте соотношение пиксель/микрометр в программу. Получите это значение из эксперимента по калибровке объектива микроскопа. В используемом примере значение составляет 13,87 пикселя/мкм.
- Выберите горизонтальную начальную позицию, чтобы поместить желтую линию на первое изображение стопки. Начните линию перед началом ячейки и проведите ее за вертикальными границами ячейки. В этом примере желтая линия имеет длину 153 пикселя, а начальная позиция находится между i = 70, y1 = 80 и i = 70 и y2 = 195. Затем переместите желтую линию по горизонтали, пока конечная позиция не будет f = 245, y1 = 80 и f = 245, а y2 = 195.
- Наконец, чтобы найти края ячейки, периметр и обратную сторону периметра, выберите вкладку «Макрос » и нажмите « Запустить макрос». Макрос выдаст таблицу с положением ребер, периметром и обратным периметром, а также изображение анализируемой ячейки. Проверьте, совпадают ли края этого изображения с краями рисунка 7, в противном случае повторите процедуру.
- Используйте сумму обратного периметра, чтобы найти форм-фактор8.
- Найдя изображение, содержащее профиль высоты эритроцитов, используйте расфокусированный контраст 2 мкм, чтобы создать набор из двух изображений в ImageJ. Нажмите « Изображения > стопки», а затем выберите опцию «Изображения для стека». Чтобы найти форм-фактор, используйте настраиваемый макрос ImageJ для анализа стека. Настроенный макрос ImageJ доступен для загрузки в виде дополнительного файла 2.
7. Модель реологии мягкого стекла и экспериментальный анализ
- Организация экспериментальных данных в виде таблицы
- Создайте новую таблицу в аналитическом программном обеспечении, щелкнув вкладку « Файл ». Определите 10 различных столбцов (от c0 до c9) для следующих параметров: используемые угловые частоты (рад/с): c0; Значения K' (пН/мкм), полученные для каждой угловой частоты: c1; ErrK': c2; K" (пН/мкм), полученные для каждой угловой частоты: c3; ErrK": c4; Значения G'(Pa), полученные для каждой угловой частоты: c5; ErrG': c6; G" (Па) значения, полученные для каждой угловой частоты: c7; ErrG": c8 и Ff с соответствующей погрешностью: c9 (рис. 8). Используйте следующую формулу для заполнения следующих столбцов:
c5 = (3 x c1) / (8 x 1,28 x 0,087)
c6 = (3 / (8 x 0,087 x 1,28)) x sqrt (c2^2 + (c1 x 0,01 / 1,28)^2 + (c1 x 0,008 / 0,087) ^ 2)
c7 = (3 x c3) / (8 x 1,28 x 0,087)
c8 = (3 / (8 x 0,087 x c4)) x sqrt (c4^2 + (c3 x 0,01 / 1,28)^2 + (c3 x 0,008 / 0,087)^2)
- Создайте новую таблицу в аналитическом программном обеспечении, щелкнув вкладку « Файл ». Определите 10 различных столбцов (от c0 до c9) для следующих параметров: используемые угловые частоты (рад/с): c0; Значения K' (пН/мкм), полученные для каждой угловой частоты: c1; ErrK': c2; K" (пН/мкм), полученные для каждой угловой частоты: c3; ErrK": c4; Значения G'(Pa), полученные для каждой угловой частоты: c5; ErrG': c6; G" (Па) значения, полученные для каждой угловой частоты: c7; ErrG": c8 и Ff с соответствующей погрешностью: c9 (рис. 8). Используйте следующую формулу для заполнения следующих столбцов:
- Построение кривой G' (ω) в сравнении с G" (ω)
- Чтобы построить кривую G' (ω) против G" (ω) в аналитическом программном обеспечении, используйте данные из предыдущей таблицы. Нажмите «Галерея» > «Линейный» и выберите формат точечной диаграммы.
- Откроется новое окно. Выберите столбец G» в качестве оси X и столбец G' в качестве оси Y. Наконец, нажмите кнопку « График », чтобы получить график.
- Чтобы добавить полосы ошибок на график, щелкните окно « График », а затем нажмите « График» > «Полосы ошибок». Откроется новое окно. Во-первых, отметьте опцию Y Err . Откроется еще одно окно под названием «Настройки панели ошибок ».
- Нажмите « % от значения», выберите « Столбец данных», а затем щелкните столбец «ErrG». Наконец, нажмите « ОК» > «График», появятся полосы ошибок для значений y. Повторите ту же процедуру для значений оси x, выбрав квадрат X Err и правильный столбец для ErrG». Окончательный график будет похож на тот, что показан на рисунке 9.
- Подгонка параметров к модели реологии мягкого стекла
ПРИМЕЧАНИЕ: Анализ данных разделен на две части: 1) кривая, совпадающая с графиком G' (ω) и G" (ω) для получения параметров Γ и Gm; 2) подгонка кривой G' (ω) и G" (ω) в зависимости от частоты ω, чтобы получить показатель степенного закона α.- Кривая, подгоняющая график G' (ω) к G" (ω) для получения параметров Γ и Gm.
- Перейдите на вкладку Curve Fit, выберите Fit1. Откроется новое окно. Выберите квадрат и нажмите кнопку «Определить». Появится окно под названием «Общее определение соответствия кривой». Введите следующее уравнение:
м1 + м0/м2
где m1 = 61,576; m2 = 1, с допустимой погрешностью 1 х 10-5. Здесь m0 представляет G ", m1 представляет Gm , а m2 представляет Γ.
ПРИМЕЧАНИЕ: Для m1 и m2 необходимо оценить их соответствующие значения во время определения соответствия кривой. Приведенные выше оценки были основаны на показанном примере эксперимента. В экспериментах оценивайте числа в соответствии со значениями, наблюдаемыми на графике. - Нажмите на кнопку OK в обоих окнах, и появится примерка, как показано на рисунке 10 - черная кривая. Проверьте правильность значений m1 и m2, перечисленных в таблице соответствия кривой, которая появилась вместе с графиком.
- Перейдите на вкладку Curve Fit, выберите Fit1. Откроется новое окно. Выберите квадрат и нажмите кнопку «Определить». Появится окно под названием «Общее определение соответствия кривой». Введите следующее уравнение:
- Подгонка кривой G ' и G" в зависимости от угловой частоты ω
- Затем создайте два других графика, а именно: G' как функция ω и G' как функция ω. Размещайте полосы погрешности только на оси Y, как было показано ранее.
- Повторите процедуру подгонки кривой, но теперь в разделе «Выбор подгонки кривой» выберите параметр «G», а затем в разделе «Общая подгонка > определение кривой» напишите следующее уравнение:
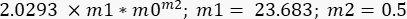
В этом случае m1 оценивалось как значение G" (ω) = 23,683 Па, когда ω = 6,3 рад/с; m2 был оценен как 0,5 (помните, что m2 является показателем степени α и варьируется от 0 до 1). Вставьте значение Γ = 2,0293 в соответствии с результатом m2 на рисунке 10. - Отметьте опцию Данные о весе. После всех этих процедур нажмите на ОК, и появится кривая, аналогичная той, что изображена на рисунке 11 - появится синяя кривая. Появятся значения α, α = 0,63 ± 0,02 и G 0, G 0 = (3,7 ± 0,3)Па. Используйте эти значения, чтобы подогнать следующую кривую, G' (ω).
- Нажмите на следующую кривую, повторите процедуру подгонки кривой, но теперь в общем определении кривой подгонки напишите следующее уравнение:

В данном случае м3 – это всего лишь оценочное значение α для подтверждения ранее полученного значения. Используйте значения для G 0 = 3,703 и G' (ω) = 23,683 Па, когда ω = 6,3 рад/с. - Снова добавьте 1 x 10-5 как допустимую ошибку и отметьте опцию Weight Data. После всех этих процедур нажмите на ОК, и появится кривая, аналогичная той, что изображена на рисунке 11 - появится зеленая кривая.
- Кривая, подгоняющая график G' (ω) к G" (ω) для получения параметров Γ и Gm.
Результаты
На рисунке 1 представлена схема системы ОТ, используемой для реологических измерений. На рисунке 2 показаны схемы микрореологического эксперимента с обеими сферами, а также показан репрезентативный эритроцит. На рисунке 3 показана типичная кривая для амплитуд обеих сфер в зависимости от времени, когда синусоидальные движения производятся пьезоэлектрическим каскадом. В то время как сфера отсчета (рис. 3 - красная кривая) колеблется вслед за движением ступени, сфера эритроцитов (рис. 3 - синяя кривая) колеблется с другой амплитудой и фазой. Измеряя эти параметры, можно определить комплексную упругую константу K* (ω) для различных эритроцитов в образце. На рисунке 4 показан типичный график для упругой константы хранения K' (ω) в зависимости от упругой константы потерь K" (ω). Наблюдаемая линейная зависимость показывает, что поверхность эритроцитов можно считать мягким стеклообразным материалом. Далее, чтобы получить общий форм-фактор ячейки, Ff, необходима процедура DM, и на рисунке 5, рисунке 6 и рисунке 7 приведены некоторые из необходимых шагов для этой цели. Затем, чтобы преобразовать силы и деформации в напряжения и деформации, необходимо превратить K* (ω) в G* (ω).
Комплексная упругая константа эритроцитов определяется как K* (ω) = K' (ω) + iK" (ω). Кроме того, K* (ω) связан с модулем сдвига комплекса эритроцитов G* (ω) = G' (ω) + iG" (ω). G' (ω) и G" (ω) являются модулями хранения и потерь при сдвиге эритроцитов соответственно. Соотношение между K* (ω) и G* (ω) определяется выражением:
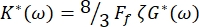
где F f — форм-фактор, зависящий от геометрии эритроцитов, как упоминалось ранее, а ζ — толщина мембраны эритроцитов, ранее определенная как ζ = (0,087 ± 0,009) мкм 8,15.
Кроме того, модули сдвига потерь хранения G' (ω) и G" (ω) связаны, соответственно, с упругими константами хранения K' (ω) и потерь K" (ω) через уравнения 8,9
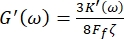 и
и 
Для нахождения стандартных ошибок для G' (ω) и G" (ω), Err G' и Err G", соответственно, используют уравнения распространения неопределенностей с результатами K' (ω) и K " (ω), согласно следующим уравнениям 8,9:
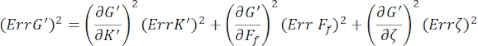
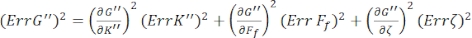 .
.
Согласно теории мягкой стекловидной реологии, эритроциты ведут себя как вязкоупругие материалы, такие как эмульсии, пасты и суспензии 8,9, а их модули хранения и потерь подчиняются следующим уравнениям:
Таким образом, где G m — модуль сдвига клеточной мембраны, G 0 — модуль хранения низкочастотных данных, Γ — отношение , α — степенной показатель реологической модели мягкого стеклообразия, а ω 0 = 1 рад/с 8,9
, α — степенной показатель реологической модели мягкого стеклообразия, а ω 0 = 1 рад/с 8,9 .
.
Использовались значения, найденные для Ff, а также ζ толщины поверхности эритроцитов (оцененные в 87 ± 8 нм 8,9,15). Результаты показаны на рисунках 8, 9 и 10. Опять же, линейная зависимость между G' и G" согласуется с гипотезой о том, что поверхности эритроцитов могут быть смоделированы как мягкие стеклообразные материалы. Также из линейного подгонки этого графика можно получить значение G m, а путем введения этого значения в подгонку кривой мягкой стекловидной реологии G" определяются значения G0 и α (рисунок 11 - синяя кривая). Кроме того, после использования полученного результата для G 0 и добавления его к подгонке кривой мягкой стекловидной реологии G', получается то же значение для экспоненты в пределах полос погрешности (рис. 11 - зеленая кривая).

Рисунок 1: Схематическое изображение ОТ-микроскопа. Вся система построена на антивибрационном столе. Лазер выравнивается с использованием, по крайней мере, двух разных дихроичных зеркал (белых) и направляется к заднему входу линзы объектива микроскопа с помощью другого дихроичного зеркала (светло-голубого). Также необходимы пьезоэлектрический столик и цифровая научная камера, подключенная к компьютеру. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Схема микрореологического эксперимента. Эталонная сфера (темно-серая) прикреплена к покровному стеклу, а сфера эритроцитов (синяя) прикреплена к поверхности эритроцитов (красная) и захвачена OT (обозначается персиковыми треугольниками при включенном лазере). ρ – равновесное положение сферы эритроцитов в ловушке; ξ — синусоидальное движение образца, x — деформация клетки. Схематическое изображение было создано в Biorender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
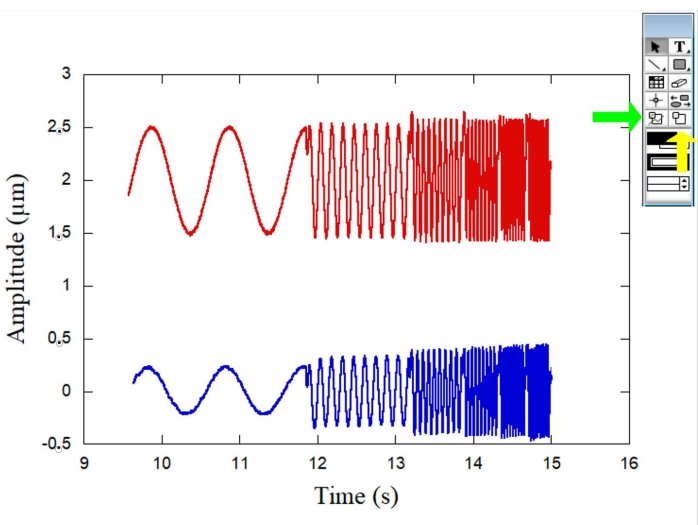
Рисунок 3: График, иллюстрирующий амплитуды (мкм) обеих сфер во времени (с), когда синусоидальные движения производятся пьезоэлектрическим каскадом. Сфера отсчета (красная кривая) колеблется вслед за движением ступени, в то время как сфера эритроцитов (синяя кривая) колеблется с другой амплитудой и фазой. Зеленая стрелка справа указывает на инструмент выделения данных, а желтая стрелка указывает на инструмент масштабирования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Результаты микрореологии эритроцитов. Сохраняйте упругую константу как функцию упругой константы потерь для разных эритроцитов в образце (n = 10 разных ячеек из трех разных образцов). Точки данных представляют собой средние значения как K ' (ось y), так и K" (ось x) с соответствующими полосами погрешности (стандартная ошибка среднего), полученными для каждой угловой частоты, используемой в экспериментальной установке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
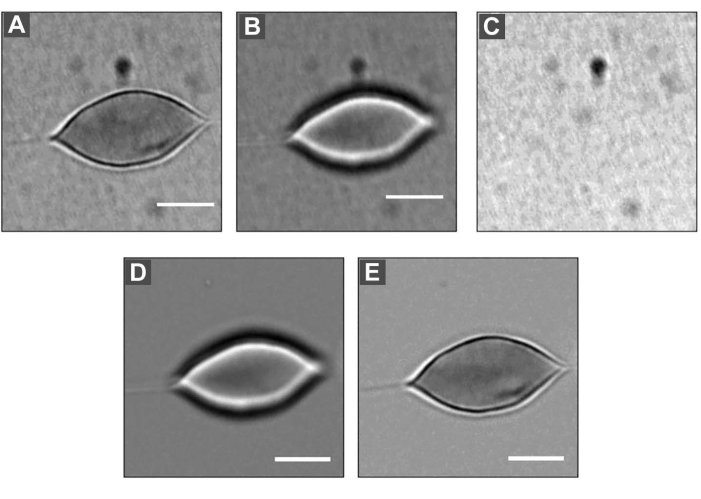
Рисунок 5: DM, нанесенный на эритроциты . (A) Расфокусированное изображение, размер = 2 мкм. (B) Изображение в фокусе. (C) Фоновое изображение. Разделив каждое изображение (A) и (B) на фоновое изображение (C), а затем умножив на среднее значение серого каждого изображения, можно получить изображения (D) и (E). Масштабная линейка: 5 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
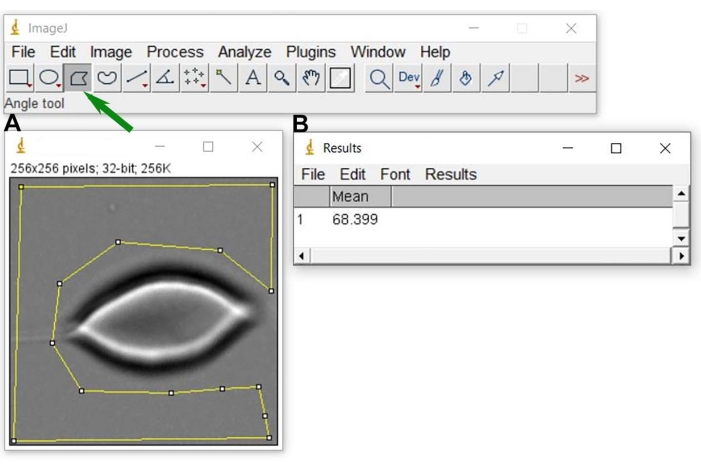
Рисунок 6: Уровень серого фона N0. После открытия репрезентативного изображения в ImageJ (A) выберите область (желтую геометрическую фигуру вокруг ячейки эритроцитов), используемую для получения среднего значения уровня серого фона и результата (B). Чтобы выполнить выделение желтым цветом в A, используйте инструмент выделения многоугольников на изображении J (обозначен зеленой стрелкой). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
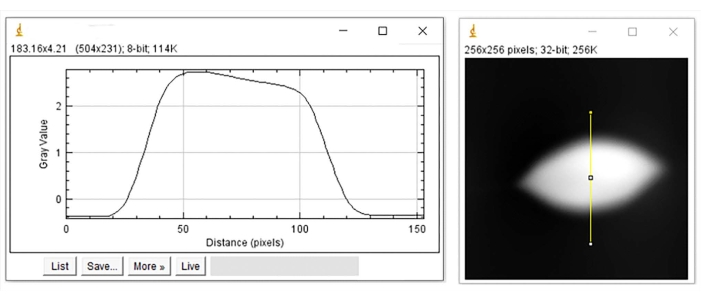
Рисунок 7: Профиль высоты деформированного эритроцита. Высота профиля (слева) представлена вдоль вертикальной желтой линии изображения (справа). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
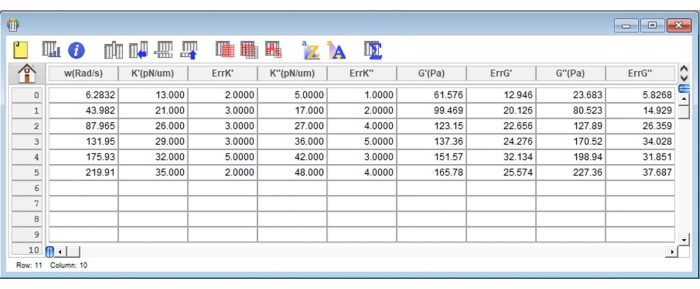
Рисунок 8: Репрезентативный скриншот типичной таблицы результатов в аналитическом программном обеспечении. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 9: Вязкоупругие параметры эритроцитов. Сохраните модуль сдвига как функцию модуля сдвига потерь для разных эритроцитов в образце (n = 10 разных ячеек из трех разных образцов). Точки данных представляют собой средние значения как G ' (ось y), так и G" (ось x) с соответствующими полосами погрешности (стандартная ошибка среднего), полученными для каждой угловой частоты, используемой в экспериментах. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
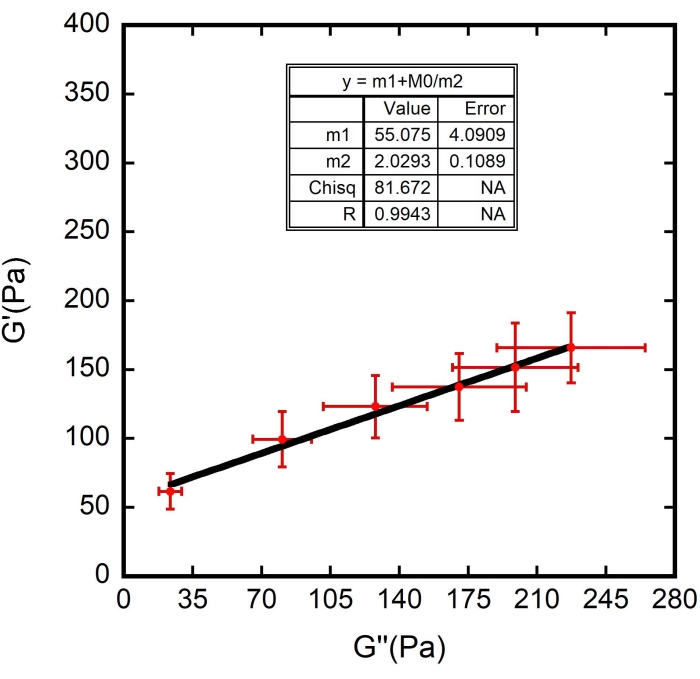
Рисунок 10: Подгонка кривой G ' (Па) в зависимости от G" (Па). Линейная черная линия — это кривая, подходящая для точек данных. N = 10 различных ячеек из трех разных образцов. Полосы погрешности представляют собой стандартную погрешность среднего. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
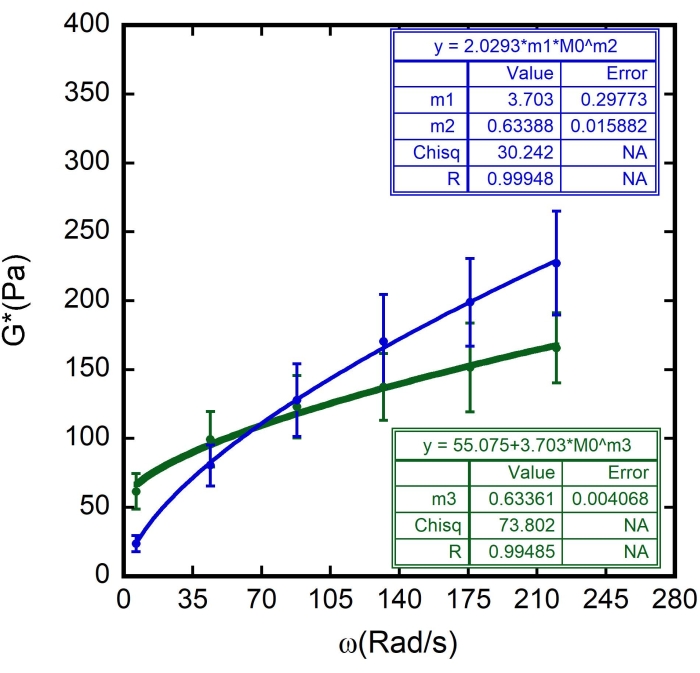
Рисунок 11: Адаптация модели реологии мягкого стекла к результатам. Комплексный модуль сдвига (G*) как функция угловой частоты ω для различных эритроцитов в образце. Зеленые круги на графике представляют средние значения G', а синие круги представляют средние значения G', построенные с соответствующими полосами погрешностей. Непрерывные зеленые и синие линии представляют собой кривые фитинги для модели мягкой стекловидной реологии. На графике указаны параметры m 1, m 2 и m3. В то время как m 1 равно G0, m 2 и m3 являются экспонентой, α. N = 10 различных ячеек из трех разных выборок. Полосы погрешности представляют собой стандартную погрешность среднего. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный файл 1: Плагин ImageJ DivideQ2.class. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: ImageJ настроил макрос для получения форм-фактора. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В этом протоколе представлен интегрированный метод на основе оптического пинцета и расфокусирующей микроскопии для количественного картирования вязкоупругих свойств эритроцитов. Определены результаты по модулям хранения и сдвига потерь, а также показатель масштабирования, характеризующий мягкую стекловидную реологию эритроцитов. Применение этого протокола для различных экспериментальных условий, таких как физиологическая ситуация8 или на каждой стадии внутриэритроцитарного цикла P. falciparum 9, уже проводилось.
Ссылки в литературе указывают на расхождения в реологии эритроцитов, частично связанные с изменениями в морфологии клеток, которые должным образом не были учтены при измерениях 6,7. Используя динамическое рассеяние света, значения модулей хранения и потерь эритроцитов были зарегистрированы в диапазоне от 0,01 до 1 Па в диапазоне частот от 1 до 100 Гц6. В другом исследовании, проведенном с помощью оптической магнитно-скручивающей цитометрии, был определен кажущийся комплексный модуль упругости7, но он отклонялся от значений динамического рассеяния света; Таким образом, для сравнения был использован мультипликативный коэффициент 84. В соответствии с процедурами, описанными в настоящем протоколе, эти различия были выяснены8 путем характеристики форм-фактора эритроцитов с использованием метода неинвазивной расфокусирующей микроскопии11,12,13. Сложный модуль сдвига, характеризующий поверхности ячеек, может быть получен только в том случае, если геометрия считается16,17, а это не всегда выполнялось должным образом.
Интегрированная методика, представленная в данном протоколе, позволяет выполнять оба метода (измерение ОТ и измерение СД) для одной и той же отдельной ячейки, один за другим. Это также позволяет выполнять измерения OT для разных клеток в популяции, а затем выполнять измерения DM для других клеток в той же клеточной популяции. Последний вариант, вероятно, привнесет большую вариабельность в оба результата, но ошибки могут быть распространены соответствующим образом, таким образом, что результаты будут коррелировать общую морфологию эритроцитов с общими вязкоупругими свойствами эритроцитов в данной популяции клеток, соответствующих конкретному экспериментальному условию.
Основным ограничением для выполнения этого протокола является внутренняя сложность выполнения самого метода, поскольку он представляет собой интеграцию оптического пинцета и расфокусирующей микроскопии; Таким образом, наличие инструментов для выполнения всех описанных шагов может быть проблемой. Однако, если у кого-то есть доступ к установке OT, гораздо более целесообразно в конечном итоге адаптировать установку для проведения экспериментов. Именно здесь вписывается настоящий протокол, не только детализирующий каждый шаг для выполнения измерений и анализа, но и помогающий людям идентифицировать и внедрять эти системы OT вместо того, чтобы создавать настройку с нуля.
Кроме того, прикрепление эритроцитов к покровным стеклам становится ограничивающим фактором, поскольку они являются неадгезивными клетками, и такие шаги могут вызвать трудности в измерениях, поскольку некоторые эритроциты могут быть отделены. Таким образом, важно выбрать хорошо прилипший эритроцит. Один из способов проверить, был ли выбор удачным, может произойти во время подготовки образца к измерению. После того, как сфера эритроцитов, захваченная ОТ, будет перенесена на поверхность ячейки, слегка переместите образец, чтобы убедиться, что ячейка надежно зафиксирована и не изменила положение вслед за шариком, захваченным ОТ. Если это так, найдите другую ячейку в образце. Будущие улучшения, такие как использование двухлучевого OT для одновременного улавливания эритроцитов и одновременного выполнения реологических измерений, также могут быть сделаны.
Кроме того, возможность извлечения количественной вязкоупругой информации эритроцитов на основе отдельных ячеек позволяет использовать различные приложения, которые только начинают изучаться 8,9. Таким образом, представленный способ может быть распространен на характеристику механического поведения эритроцитов при других физиопатологических состояниях, таких как железодефицитная анемия и диабет, или при генетических заболеваниях крови, таких как, например, серповидноклеточная анемия и талассемия. Такой интегрированный инструмент может послужить основой для разработки новых методов диагностики, способных коррелировать изменения вязкоупругих свойств эритроцитов с изменениями кровотока у лиц с различной патологией.
Раскрытие информации
Авторы не имеют финансовых интересов в продуктах, описанных в этой рукописи, и им больше нечего раскрывать.
Благодарности
Авторы выражают благодарность всем сотрудникам передового микроскопического центра CENABIO за очень важную помощь. Эта работа была поддержана бразильскими агентствами Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - Financial Code 001, Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ) и Instituto Nacional de Ciência e Tecnologia de Fluidos Complexos (INCT-FCx) совместно с Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP). Б.. был поддержан грантом JCNE от FAPERJ.
Материалы
| Name | Company | Catalog Number | Comments |
| 35mm culture dishes | Corning | 430165 | |
| Bovine serum albumin | Sigma-Aldrich | A9418 | |
| Coverslips | Knittel Glass | VD12460Y1A.01 and VD12432Y1A.01 | |
| Glass-bottom dishes | MatTek Life Sciences | P35G-0-10-C | |
| Glucose | Sigma-Aldrich | G7021 | |
| ImageJ | NIH | https://imagej.nih.gov/ij/ | |
| Immersion oil | Nikon | MXA22165 | |
| Inverted microscope | Nikon | Eclipse TE300 | |
| KaleidaGraph | Synergy Software | https://www.synergy.com/ | |
| KCl | Sigma-Aldrich | P5405 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Microscope camera | Hamamatsu | C11440-10C | |
| Na2HPO4 | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S5886 | |
| Neubauer chamber | Sigma-Aldrich | BR717805-1EA | |
| Objective lens | Nikon | PLAN APO 100X 1.4 NA DIC H; PLAN APO 60x 1.4 NA DIC H and Plan APO 10x XXNA PH2 | |
| Optical table | Thorlabs | T1020CK | |
| OT laser | IPG Photonics | YLR-5-1064-LP | |
| Polystyrene microspheres | Polysciences | 17134-15 | |
| rubber ring | Forever Seals | NBR O-Ring | |
| Silicone grease | Dow Corning | Z273554 | |
| Stage positioning | PI | P-545.3R8S | |
| Pipette | Gilson | P1000 |
Ссылки
- Fowler, V. M. The human erythrocyte plasma membrane: a Rosetta Stone for decoding membrane-cytoskeleton structure. Current Topics in Membranes. 72, 39-88 (2013).
- Tomaiuolo, G. Biomechanical properties of red blood cells in health and disease towards microfluidics. Biomicrofluidics. 8 (5), 051501 (2014).
- Depond, M., Henry, B., Buffet, P., Ndour, P. A. Methods to investigate the deformability of RBC during malaria. Frontiers in Physiology. 10, 1613 (2019).
- Boal, D. . Mechanics of the Cell. 2 edn. , (2012).
- Balland, M., et al. Power laws in microrheology experiments on living cells: Comparative analysis and modeling. Physical Review E. 74 (2), 021911 (2006).
- Amin, M. S., et al. Microrheology of red blood cell membranes using dynamic scattering microscopy. Optics Express. 15 (25), 17001-17009 (2007).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. American Journal of Physiology Cell Physiology. 293 (2), 597-605 (2007).
- Gomez, F., et al. Effect of cell geometry in the evaluation of erythrocyte viscoelastic properties. Physical Review E. 101 (6-1), 062403 (2020).
- Gomez, F., et al. Plasmodium falciparum maturation across the intra-erythrocytic cycle shifts the soft glassy viscoelastic properties of red blood cells from a liquid-like towards a solid-like behavior. Experimental Cell Research. 397 (2), 112370 (2020).
- Pompeu, P., et al. Protocol to measure the membrane tension and bending modulus of cells using optical tweezers and scanning electron microscopy. STAR Protocols. 2 (1), 100283 (2021).
- Agero, U., Mesquita, L. G., Neves, B. R., Gazzinelli, R. T., Mesquita, O. N. Defocusing microscopy. Microscopy Research and Technique. 65 (3), 159-165 (2004).
- Agero, U., Monken, C. H., Ropert, C., Gazzinelli, R. T., Mesquita, O. N. Cell surface fluctuations studied with defocusing microscopy. Physical Review E. 67 (5), 051904 (2003).
- Roma, P. M. S., Siman, L., Amaral, F. T., Agero, U., Mesquita, O. N. Total three-dimensional imaging of phase objects using defocusing microscopy: Application to red blood cells. Applied Physics Letters. 104 (25), 251107 (2014).
- Köhler, A. New method of illumination for photomicrographical purposes. Journal of the Royal Microscopical Society. 14, 261-262 (1894).
- Nans, A., Mohandas, N., Stokes, D. L. Native ultrastructure of the red cell cytoskeleton by cryo-electron tomography. Biophysical Journal. 101 (10), 2341-2350 (2011).
- Ayala, Y. A., et al. Rheological properties of cells measured by optical tweezers. BMC Biophysics. 9, 5 (2016).
- Ayala, Y. A., et al. Effects of cytoskeletal drugs on actin cortex elasticity. Experimental Cell Research. 351 (2), 173-181 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены