Method Article
Analisi quantitativa delle proprietà viscoelastiche dei globuli rossi mediante pinzetta ottica e microscopia di defocalizzazione
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui viene descritto un protocollo integrato basato su pinzette ottiche e microscopia di defocalizzazione per misurare le proprietà reologiche delle cellule. Questo protocollo ha ampia applicabilità nello studio delle proprietà viscoelastiche degli eritrociti in condizioni fisio-patologiche variabili.
Abstract
Le proprietà viscoelastiche degli eritrociti sono state studiate con una serie di tecniche. Tuttavia, i dati sperimentali riportati variano. Ciò non è solo attribuito alla normale variabilità delle cellule, ma anche alle differenze nei metodi e nei modelli di risposta cellulare. Qui, un protocollo integrato che utilizza pinzette ottiche e microscopia di defocalizzazione viene impiegato per ottenere le caratteristiche reologiche dei globuli rossi nella gamma di frequenza da 1 Hz a 35 Hz. Mentre le pinzette ottiche sono utilizzate per misurare la costante elastica del complesso eritrocitario, la microscopia di defocalizzazione è in grado di ottenere il profilo di altezza della cella, il volume e il suo fattore di forma un parametro che consente la conversione della costante elastica complessa in modulo di taglio complesso. Inoltre, applicando un modello di reologia vetrosa morbida, è possibile ottenere l'esponente di scala per entrambi i moduli. La metodologia sviluppata permette di esplorare il comportamento meccanico dei globuli rossi, caratterizzandone i parametri viscoelastici, ottenuti in condizioni sperimentali ben definite, per diverse condizioni fisiologiche e patologiche.
Introduzione
I globuli rossi maturi (RBC), noti anche come eritrociti, sono in grado di estendersi più del doppio delle loro dimensioni quando passano attraverso i capillari più stretti del corpo umano1. Tale capacità è attribuita alla loro capacità unica di deformarsi quando sottoposta a carichi esterni.
Negli ultimi anni, diversi studi hanno caratterizzato questa caratteristica nelle superfici RBC 2,3. L'area della fisica che descrive le risposte elastiche e viscose dei materiali dovute a carichi esterni è chiamata reologia. In generale, quando viene applicata una forza esterna, la deformazione risultante dipende dalle proprietà del materiale e può essere suddivisa in deformazioni elastiche, che immagazzinano energia, o deformazioni viscose, che dissipano energia4. Tutte le cellule, compresi i globuli rossi, mostrano un comportamento viscoelastico; In altre parole, l'energia viene immagazzinata e dissipata. La risposta viscoelastica di una cellula può quindi essere caratterizzata dal suo modulo di taglio complesso G*(ω) = G'(ω) + iG"(ω), dove G' (ω) è il modulo di accumulo, correlato al comportamento elastico, e G" (ω) è il modulo di perdita, correlato alla sua viscosità4. Inoltre, sono stati utilizzati modelli fenomenologici per descrivere le risposte cellulari, uno dei più utilizzati è chiamato il modello 5 di reologia vetrosa morbida, caratterizzato da una dipendenza dalla legge di potenza del modulo di taglio complesso con la frequenza di carico.
Sono stati impiegati metodi basati su singole cellule per caratterizzare le proprietà viscoelastiche dei globuli rossi, applicando forza e misurando lo spostamento in funzione del carico imposto 2,3. Tuttavia, per il complesso modulo di taglio, pochi risultati possono essere trovati in letteratura. Utilizzando la diffusione dinamica della luce, sono stati riportati valori per i moduli di stoccaggio e perdita di RBC variabili da 0,01-1 Pa, nella gamma di frequenza 1-100 Hz6. Utilizzando la citometria a torsione magnetica ottica, è stato ottenuto un modulo elastico complesso apparente7 e, a scopo di confronto, è stato affermato un fattore moltiplicativo per chiarire eventualmente le discrepanze.
Più recentemente, è stata stabilita una nuova metodologia basata su pinzette ottiche (OT) insieme alla microscopia di defocalizzazione (DM), come strumento integrato per mappare quantitativamente l'immagazzinamento e la perdita dei moduli di taglio degli eritrociti umani su carichi dipendenti dal tempo 8,9. Inoltre, è stato utilizzato un modello reologico vetroso morbido per adattarsi ai risultati e ottenere un coefficiente di legge di potenza che caratterizza i globuli rossi 8,9.
Nel complesso, la metodologia sviluppata8,9, il cui protocollo è descritto in dettaglio di seguito, chiarisce le precedenti discrepanze utilizzando i valori misurati per il fattore di forma, Ff, che mette in relazione forze e deformazioni con sollecitazioni e deformazioni nella superficie dei globuli rossi e può essere utilizzato come nuovo metodo diagnostico in grado di determinare quantitativamente i parametri viscoelastici e le caratteristiche vetrose morbide dei globuli rossi ottenuti da individui con sangue diverso Patologie. Tale caratterizzazione, utilizzando il protocollo descritto di seguito, può aprire nuove possibilità per comprendere il comportamento dei globuli rossi da una prospettiva meccanobiologica.
Protocollo
I campioni di sangue umano sono stati forniti da volontari adulti uomini e donne secondo i protocolli approvati dal Comitato Etico di Ricerca dell'Università Federale di Rio de Janeiro (Protocollo 2.889.952) e registrati nella piattaforma brasiliana con il numero CAAE 88140418.5.0000.5699. Una forma scritta di consenso è stata rilasciata e raccolta da tutti i volontari. Sono stati esclusi quelli con emoglobinopatia e/o assunzione di farmaci controllati. L'intero processo ha seguito le linee guida approvate dal comitato etico dell'istituto.
1. Preparazione dei portacampioni
- Acquistare due coprivetrini (24 mm x 60 mm e 24 mm x 32 mm; spessore = 0,13-0,17 mm) e un anello di gomma (diametro = 10 mm; spessore = 2 mm) per ciascun portacampioni.
- Versare grasso siliconico sulla superficie dell'anello di gomma in modo da coprire l'intero perimetro.
- Posizionare l'anello di gomma sul coperchio con il lato grasso rivolto verso il coperchio. Attendere 5 minuti per il corretto fissaggio, i portacampioni sono quindi pronti a ricevere la coltura cellulare.
NOTA: Inoltre, è possibile utilizzare anche piatti con fondo di vetro commerciali o fatti in casa, come descritto in precedenza10.
2. Coltura cellulare
NOTA: I passaggi seguenti descrivono come ottenere globuli rossi sani dal sangue umano. È importante che i campioni siano preparati al momento prima di ogni esperimento.
- Diluire 20 μL di sangue in 250 μL di soluzione salina tampone fosfato (PBS) contenente 137 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mM KH2PO4, 10 mM glucosio e integrato con 1 mg/mldi albumina sierica bovina (BSA).
- Dopo centrifugazione a 200 x g per 2 minuti a temperatura ambiente, aspirare il surnatante con una pipetta e risospendere il pellet cellulare in 1 ml di 1x soluzione PBS/BSA. Lavare le celle 2 volte nel buffer.
- Calcolare la densità cellulare utilizzando un emocitometro e seminare da 50.000 a 100.000 cellule nel portacampioni preparato nella fase 1. Attendere 10-15 minuti per il fissaggio non specifico della cella al coprifoglio; Il tempo di attesa non influisce sulle celle.
- Aggiungere al campione 0,2 μL di una soluzione di sfere di polistirene al 10% v/v (raggio = 1,52 ± 0,02 μm) per ulteriori esperimenti OT. Confermare la corretta miscelazione osservando i campioni al microscopio.
- Dopo la semina delle celle, basta posizionare il secondo coprivetrino sopra l'anello di gomma (non è necessario aggiungere grasso per il fissaggio), chiudere la configurazione e terminare la preparazione del campione. I campioni sono pronti per l'analisi e la manipolazione al microscopio.
3. Configurazione del microscopio a pinzetta ottica
NOTA: OT sono strumenti che utilizzano un raggio laser altamente focalizzato per intrappolare oggetti microscopici e misurare le forze nella gamma di piconewton e gli spostamenti su scala nanometrica. Il laser OT utilizzato (lunghezza d'onda 1064 nm) deve essere opportunamente allineato, come descritto in precedenza10.
- In breve, utilizzando almeno due specchi separati da una distanza di pochi centimetri (almeno 10-20 cm), dirigere un raggio laser polarizzato linearmente verso l'ingresso posteriore di un microscopio invertito. Allineare con precisione il raggio laser per entrare nel microscopio in linea retta (Figura 1).
- Quindi, riflettere il raggio laser utilizzando uno specchio dicroico, installato nel microscopio, per procedere parallelamente all'asse della lente dell'obiettivo ed entrare nella lente vicino al centro del suo ingresso posteriore. Questo focalizzerà il laser per creare la trappola ottica (Figura 1).
- Successivamente, per misurare le forze con OT, calibrare il sistema per ottenere la rigidità della trappola (κOT). Vedere10 per una descrizione più dettagliata della procedura di calibrazione OT. Una volta trovato κ OT, il sistema OT è pronto per gli esperimenti di reologia.
4. Configurazione DM
NOTA: DM è una tecnica di microscopia ottica basata su campo chiaro che consente agli oggetti trasparenti di diventare visibili se il microscopio è leggermente sfocato11,12. Tale tecnica è stata applicata per ottenere la forma RBC13. Lo stesso microscopio impiegato per il sistema OT può essere utilizzato per il DM, per ottenere un profilo di altezza attraverso ricostruzioni 3D.
- Regolare il sistema di illuminazione del microscopio eseguendo l'illuminazione Köhler14 e, per una migliore risoluzione, aprire completamente il condensatore-diaframma per eseguire gli esperimenti.
- Utilizzare un sistema di posizionamento piezoelettrico per spostare il campione in tutte le coordinate, con precisione nanometrica sull'asse z. Eseguire l'autocalibrazione del sistema piezoelettrico su tutti gli assi. Una volta eseguite tutte le procedure, il sistema di microscopio è pronto per gli esperimenti DM.
5. Esperimento e analisi reologica basata su OT
NOTA: L'esperimento di reologia consiste nell'osservare le risposte della cellula a piccole oscillazioni di frequenze variabili.
- Sperimentazione
- Utilizzando il sistema OT, intrappolare la sfera con il laser OT e quindi collegarla a un RBC premendo la sfera contro la superficie della cella vicino alla superficie superiore e vicino al bordo della cella. Utilizzare il microscopio per questo passaggio. Quindi, intrappolare un'altra sfera e ripetere la stessa procedura di attacco, ma ora attaccarla al coprifoglio, vicino alla cella. La sfera attaccata al coprislip è il tallone di riferimento (Figura 2), che è necessario per seguire lo spostamento piezoelettrico e per confrontarlo con la sfera RBC.
- Assicurarsi che la cella scelta sia ben fissata al coprivetrino e che i globuli rossi e le sfere di riferimento abbiano aderito rispettivamente alla superficie dei globuli rossi e al coprifoglio, prima di iniziare la misurazione. Identificare visivamente le cellule non aderenti mentre si muoveranno nel tempo, nonostante l'alto tasso di adesione (circa l'80% -90%).
- Aggiungere una funzione sinusoidale di ampiezza, ξ 0 = 0,500 ± 0,001 μm e frequenze variabili di 1 Hz, 7 Hz, 14 Hz, 21 Hz, 28 Hz e 35 Hz, con rispettive frequenze angolari, ω, di 6,3 rad/s, 169 rad/s, 88 rad/s, 132 rad/s, 176 rad/s e 220 rad/s, al software dello stadio piezoelettrico, utilizzando il software piezoelettrico, come precedentemente dimostrato 8,9.
- Utilizzando lo stadio piezoelettrico, premere il pulsante di avvio per consentire lo spostamento piezoelettrico e mantenere la sfera RBC nella trappola, sottoporre il campione ad un ciclo di movimenti utilizzando la funzione sinusoidale precedentemente impostata. Utilizzare una fotocamera in grado di produrre immagini a 790 fotogrammi/s o superiore per registrare il movimento del campione. Uno schema dell'esperimento è mostrato nella Figura 2.
- Mentre il campione è sottoposto a movimenti sinusoidali, attivare l'OT per intrappolare la sfera attaccata alla superficie RBC. Indipendentemente dalla temperatura scelta per eseguire gli esperimenti, temperatura ambiente, 37 °C o un'altra temperatura, monitorare attentamente la temperatura per evitare variazioni durante le misurazioni. Il laser a infrarossi (1064 nm) utilizzato per creare l'OT non provoca quasi nessun danno o riscaldamento delle celle.
- Analisi
- Analizza le immagini ottenute durante i movimenti sinusoidali utilizzando ImageJ per trovare la posizione del centro di massa di ciascuna delle sfere nel tempo.
NOTA: Questi dati consentono di generare grafici in grado di mostrare le differenze di fase e ampiezza tra le due sfere. Tali informazioni sono cruciali per ottenere la risposta viscoelastica dei globuli rossi. - Per ottenere il centro di massa per ciascuna delle sfere, aprire il software ImageJ. Importa l'intero filmato ottenuto durante i movimenti sinusoidali.
- Nella scheda Immagine , fare clic su Regola, quindi selezionare Soglia. Si aprirà la finestra di soglia. Seleziona B/N. Questo renderà lo sfondo bianco e le sfere nere.
- Regola la soglia con entrambe le barre di scorrimento sotto l'istogramma in modo che entrambe le sfere vengano visualizzate con la quantità massima di pixel.
- Selezionare la sfera di riferimento facendo clic su File > Rettangolo. Disegna un rettangolo per selezionare la sfera. Dopo aver selezionato la sfera di riferimento in un'immagine, assicuratevi che il rettangolo selezioni correttamente la stessa sfera anche in tutte le altre immagini del filmato.
- Quindi, nella scheda Analizza , fare clic su Imposta misure e selezionare l'opzione Centro di massa .
- Fare nuovamente clic sulla scheda Analizza e selezionare Analizza particelle. Si aprirà una nuova finestra. Definire le dimensioni e la circolarità (a seconda del raggio della sfera). Selezionare le caselle seguenti Visualizza risultati e Cancella risultati. Infine, fai clic su OK per elaborare tutte le immagini.
- Apparirà una nuova finestra contenente una tabella con le coordinate xy per il centro della massa. Salvare questi valori di coordinate come file .txt. Ripetete la procedura per l'altra sfera, attaccata alla superficie RBC.
- Per ottenere l'ampiezza e le differenze di fase per entrambe le sfere, aprire il software di analisi. Importare i file .txt ottenuti in precedenza.
- Creare una nuova tabella con tre colonne. Nella prima colonna (c0) aggiungere il numero di fotogrammi, nella seconda colonna (c1) aggiungere le coordinate x per la sfera di riferimento e nella terza colonna (c2), le coordinate x per la sfera attaccata alla superficie RBC.
NOTA: in questo esempio, poiché i movimenti sinusoidali sono stati eseguiti solo sull'asse x, è necessario utilizzare solo le coordinate x per entrambe le sfere. - Quindi, correlare i fotogrammi con il tempo. Fare clic su Windows > voce Formula. Si aprirà una nuova finestra chiamata voce della formula. In questa finestra è possibile impostare otto diverse equazioni, ognuna delle quali in una chiave specifica (da F1 a F8).
- Selezionare F1, digitare la formula seguente:
C 3 = C0 / (FPS fotocamera)
Fare clic su Esegui. In questo modo verrà creata una nuova colonna per un periodo di tempo nella tabella (colonna 4). - Sottrarre il valore delle coordinate x di ciascun fotogramma in base al rispettivo valore medio. A tale scopo, designare due chiavi qualsiasi sulla voce della formula e digitare le equazioni seguenti per ogni chiave:
c 4 = (c 1 - media(c 1)) e c 5 = (c 2 - media(c2))
Fare clic sul pulsante Esegui . I risultati verranno visualizzati nelle colonne 5 e 6 rispettivamente per le sfere di riferimento e RBC. - Convertite i valori del centro di massa da pixel a micrometri. Per questo, utilizzare un'altra chiave sulla voce della formula e digitare l'equazione seguente:
c 4 = c 4 / numero di conversione
Ripetere lo stesso processo per la colonna 5.
NOTA: La conversione viene acquisita utilizzando una scala/righello micrometrico e ottenendo la sua immagine con la stessa configurazione del microscopio utilizzata per le misurazioni (inclusa la stessa lente dell'obiettivo). Questa procedura può essere eseguita durante la calibrazione del microscopio. Si ottiene così una relazione pixel/micrometro. - Generate un grafico con i centri di massa di entrambe le sfere sull'asse y e il tempo sull'asse x. Per questo, fai clic su Galleria > lineare e dispersione. Si aprirà una nuova finestra. Selezionate la colonna temporale per l'asse x e nell'asse y selezionate le colonne del centro di massa in micrometri sia per le sfere di riferimento che per quelle RBC.
- Nel grafico, selezionare solo i dati relativi alla prima frequenza angolare (6,3 rad/s). Utilizzare gli strumenti indicati nella Figura 3.
- Definite l'equazione che regola la curva dei dati per la sfera di riferimento. Per questo, fare clic su Curve Fit > Generale e Fit1, selezionare la casella di dati relativi alla posizione della sfera di riferimento, quindi fare clic su Definisci. Si aprirà una nuova finestra per definire l'equazione. La posizione ξ(t) della sfera di riferimento è descritta da:
ξ(t) = ξ0cos(ωt)
dove ξ è il movimento sinusoidale del campione, ω è la frequenza angolare e t è il tempo in s. Trasponendo questa equazione al software di analisi, apparirà come segue: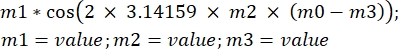 , dove m1 è ξ, m2 è f, m0 è il tempo t e m3 è la fase della funzione coseno per t = 0.
, dove m1 è ξ, m2 è f, m0 è il tempo t e m3 è la fase della funzione coseno per t = 0. - Stimare i valori per m1, m2 e m3 dal plot. Dopo aver definito l'equazione, fare clic su OK. I dati verranno adattati in base all'equazione e una curva insieme a un piccolo quadrato apparirà nel grafico con i valori di m1, m2 e m3.
- Definire l'equazione che regola la curva dei dati per la sfera RBC. Per questo, fai clic su Adattamento curva > Generale e definisci l'equazione che regolerà la curva per i dati. La posizione ρ(t) della sfera RBC è data da:
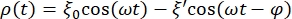
dove ξ' è l'ampiezza fuori fase, e φ è l'angolo fuori fase. Trasponendo questa formula al software di analisi, apparirà come segue: , dove m1, m2 e m3 sono i valori ottenuti nell'adattamento della curva della sfera di riferimento. m4 è ξ' e m5 è φ.
, dove m1, m2 e m3 sono i valori ottenuti nell'adattamento della curva della sfera di riferimento. m4 è ξ' e m5 è φ. - Stimare i valori per m4 e m5 dal grafico. Dopo aver definito la formula, fare clic su OK. I dati verranno adattati in base all'equazione e una curva insieme a un piccolo quadrato apparirà nel grafico con i valori di m4 e m5.
- Quindi, create una nuova tabella per aggiungere i dati ottenuti dal raccordo della curva nelle rispettive colonne. Definite cinque colonne diverse per i seguenti parametri: frequenza angolare, ampiezza (sfera di riferimento), tempo iniziale, ampiezza (sfera RBC) e angolo fuori fase. Eseguire la stessa procedura per tutte le altre frequenze.
- Utilizzare le seguenti equazioni per trovare le costanti di stoccaggio (K') e di perdita (K"):

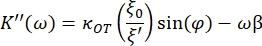
dove κ OT è la costante elastica OT e β è il coefficiente di resistenza di Stokes. Trasponendo le equazioni al software di analisi, apparirà come segue: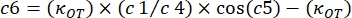 e
e
 , dove β e κOT devono essere sostituiti dai valori trovati nel sistema.
, dove β e κOT devono essere sostituiti dai valori trovati nel sistema. - Tracciare i risultati su un grafico, utilizzando l'asse x per K" e l'asse y per K' (Figura 4).
- Analizza le immagini ottenute durante i movimenti sinusoidali utilizzando ImageJ per trovare la posizione del centro di massa di ciascuna delle sfere nel tempo.
6. Esperimento e analisi DM per ottenere il fattore di forma cellulare complessivo
- Acquisizione video
- Spostare lo stadio piezoelettrico nella direzione xy utilizzando il software per cercare una cella isolata attaccata al coprifoglio. Intrappolare e attaccare una sfera di polistirene di diametro noto alla superficie dei globuli rossi. Utilizzando lo stadio piezoelettrico, spostare leggermente il tallone intrappolato, anch'esso attaccato alla superficie RBC, in modo da deformare la cella, quindi attaccare il tallone al coprifoglio.
NOTA: È anche possibile utilizzare la stessa cella delle misurazioni OT. - Modificate la posizione dell'asse z per trovare l'immagine a fuoco, dove il piano di messa a fuoco si trova al centro della cella scelta. Questa immagine presenta il contrasto minore con il livello di grigio al centro della cella uguale al livello di grigio all'esterno della cella (sfondo).
- Quando la posizione è fissa, utilizzare il software della fotocamera per creare un filmato dell'intera cella con circa 5.000 immagini a 8 bit e 256 pixel x 256 pixel, a un frame rate di 25 fps. Quindi, spostare la posizione dell'asse z di 2 μm verso il basso o verso l'alto per ottenere un'immagine sfocata per la cella scelta. Ripetete i parametri per creare un filmato per questa situazione.
- Infine, senza modificare la posizione dell'asse z, cercate una regione senza celle per ripetere la stessa procedura e create un filmato dello sfondo dell'immagine.
- Spostare lo stadio piezoelettrico nella direzione xy utilizzando il software per cercare una cella isolata attaccata al coprifoglio. Intrappolare e attaccare una sfera di polistirene di diametro noto alla superficie dei globuli rossi. Utilizzando lo stadio piezoelettrico, spostare leggermente il tallone intrappolato, anch'esso attaccato alla superficie RBC, in modo da deformare la cella, quindi attaccare il tallone al coprifoglio.
- Acquisizione di immagini a contrasto
- Converti ciascuno dei tre filmati in tre immagini medie. Utilizzando ImageJ, selezionare uno dei filmati, fare clic su Image > Stacks > Z Project e scegliere l'opzione Intensità media . Ripeti questa procedura affinché gli altri filmati ottengano le rispettive immagini.
- Cambia tutte le immagini ottenute da 8 bit a virgola mobile a 32 bit. Utilizzando ImageJ, fare clic su Image > digitare > 32 bit. Quindi, fai clic su Analizza > Imposta misurazioni e scegli l'opzione Valore grigio medio . Infine, fai nuovamente clic su Analizza > misura.
- Quindi, fai clic su Process > Image Calculator e dividi l'immagine focalizzata per l'immagine di sfondo. Per ottenere questo risultato, moltiplicare il valore medio del livello di grigio dell'immagine messa a fuoco. Ottenere il valore medio facendo clic su Elabora > Matematica > Moltiplica.
- Per ottenere il valore medio, scegliere l'immagine messa a fuoco, quindi fare clic su Analizza > misura. Per l'immagine rappresentativa, il valore medio del livello di grigio è 69.199. Ripetere le procedure precedenti per l'immagine sfocata. In questo caso, il valore medio del livello di grigio è 69.231. La Figura 5 mostra le immagini a fuoco e sfocate prima e dopo la procedura.
- Le immagini possono perdere il contrasto visivo durante le operazioni. Per visualizzare meglio le immagini, fare clic su Immagine > Regola > luminosità / contrasto e selezionare l'opzione Auto .
- Quindi, per trovare il contrasto dell'immagine, utilizzare la seguente relazione:
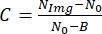 , dove N Img è il livello di grigio della cella, N0 è il livello di grigio esterno alla cella ed è un parametro costante corrispondente al livello di grigio per l'intensità della luce zero che dipende dalla fotocamera.
, dove N Img è il livello di grigio della cella, N0 è il livello di grigio esterno alla cella ed è un parametro costante corrispondente al livello di grigio per l'intensità della luce zero che dipende dalla fotocamera. - Per trovare il valore B, utilizzare un misuratore di potenza per misurare l'intensità della luce. Per ogni valore di intensità luminosa, deve essere registrato un video; Pertanto, diversi valori di intensità possono essere correlati a diversi livelli di grigio. Infine, ottenere un adattamento lineare e mettere in relazione B con l'intensità luminosa zero15.
- Trova il valore di N0, fai clic sull'icona Selezione poligono e disegna un poligono come quello in Figura 6. Quindi, fare clic sulla scheda Analizza e selezionare Misura per trovare il livello di grigio medio per l'area selezionata. Ogni immagine è formata da un insieme di pixel e ogni pixel ha un certo livello di grigio. L'insieme di tutti i livelli di grigio dovuti a tutti i pixel che compongono l'immagine corrisponde a NImg.
- Utilizzare l'equazione di contrasto per determinare N Img - No ed eseguire questa operazione selezionando Elabora > Matematica > Sottrai. Dividere il risultato per N0 - B. Infine, trova il contrasto per l'immagine focalizzata (C 0) e sfocata (C1).
- Ottenere il profilo di altezza
- Per ottenere il profilo di altezza, utilizzare il metodo13 già descritto. In breve, utilizzare la trasformata di Hartley (FHT) per ottenere lo spessore RBC. In ImageJ, fare clic su Elabora > FFT > Opzioni FFT, quindi scegliere FHT.
- Sottrarre le immagini C0 e C1 in ImageJ utilizzando Process > Math > Subtract per ottenere l'immagine per la procedura seguente, C = C0 - C1.
- Per l'immagine C, fare clic su Elabora > FFT > Opzioni FFT, quindi scegliere FHT per eseguire la trasformazione di Hartley dell'immagine. Quindi, dividi per la frequenza spaziale q2 usando il plugin personalizzato DivideQ2. Clicca su Plugin > DivideQ2.
Nota : il file DivideQ2.class deve essere copiato nella directory dei plugin in cui è installato ImageJ. Il plugin viene fornito come file .class (Supplementary File 1) da includere nella cartella plugin di ImageJ. - Quindi, eseguire la trasformazione inversa FHT utilizzando Process > FFT > FFT per ottenere un'immagine con un livello di grigio proporzionale all'altezza della cella.
- Infine, fai clic su Elabora > Matematica > moltiplica per moltiplicare l'immagine risultante usando la seguente costante:
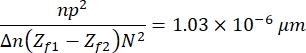
che viene definito in base alle caratteristiche delle immagini, del campione e dell'impostazione sperimentale13. Qui, n = 1,51 è l'indice di rifrazione dell'olio, p = 0,0721 μm è la relazione tra micrometri e pixel delle immagini, Δ n = 0,058 è la differenza tra l'RBC e gli indici di rifrazione del mezzo acquoso, la distanza tra le immagini di messa a fuoco e sfocatura (Z f1 - Zf2) = 2μm e la dimensione delle immagini, N 2 = 256 pxl2. - Utilizzare l'immagine risultante per ottenere il profilo di altezza (Figura 7). L'immagine risultante viene utilizzata in ImageJ per osservare diversi profili di altezza. Dipende da dove nella cella è posizionata la linea verticale gialla, ad esempio, nella Figura 7 si ottiene un profilo di altezza limitato dalla linea verticale, osservarlo premendo Ctrl + K.
- Fattore di forma
- Dopo aver trovato l'immagine che contiene il profilo di altezza RBC, utilizzare il contrasto sfocato di 2 μm per creare un set di due immagini in ImageJ. Fare clic su Image > Stacks, quindi selezionare l'opzione Immagini da impilare. Per trovare il fattore di forma, utilizzare una macro personalizzata ImageJ per analizzare lo stack. La macro personalizzata ImageJ è disponibile per il download come file supplementare 2.
Nota : il programma utilizza l'immagine di sfocatura per determinare i bordi della cella. Determina quindi il perimetro, utilizzando l'immagine che contiene il profilo di altezza, per ogni posizione orizzontale. Oltre ai bordi, determina il perimetro e l'inverso del perimetro. La somma dei valori perimetrali inversi, moltiplicati per lo spessore dei pixel, corrisponde all'inverso del fattore di forma. - Inserire la relazione pixel/micrometro nel programma. Ottenere questo valore dall'esperimento di calibrazione dell'obiettivo del microscopio. Nell'esempio utilizzato, il valore è 13,87 pixel/μm.
- Scegliere la posizione iniziale orizzontale per inserire la linea gialla nella prima immagine della pila. Iniziare la linea prima dell'inizio della cella e disegnarla oltre i limiti verticali della cella. Nell'esempio, la linea gialla ha 153 pixel di lunghezza e la posizione iniziale è compresa tra i = 70, y1 = 80 e i = 70 e y2 = 195. Quindi, spostare la linea gialla orizzontalmente fino a quando la posizione finale è f = 245, y1 = 80 e f = 245 e y2 = 195.
- Infine, per trovare i bordi delle celle, il perimetro e l'inverso del perimetro, selezionare la scheda Macro e fare clic su Esegui macro. La macro fornirà una tabella con la posizione dei bordi, il perimetro e l'inverso del perimetro e un'immagine della cella analizzata. Verificare se i bordi di questa immagine sono simili ai bordi della Figura 7, altrimenti ripetere la procedura.
- Utilizzare la somma dell'inversa del perimetro per trovare il fattore di forma8.
- Dopo aver trovato l'immagine che contiene il profilo di altezza RBC, utilizzare il contrasto sfocato di 2 μm per creare un set di due immagini in ImageJ. Fare clic su Image > Stacks, quindi selezionare l'opzione Immagini da impilare. Per trovare il fattore di forma, utilizzare una macro personalizzata ImageJ per analizzare lo stack. La macro personalizzata ImageJ è disponibile per il download come file supplementare 2.
7. Modello di reologia vetrosa morbida e analisi sperimentale
- Organizzazione dei dati sperimentali in una tabella
- Creare una nuova tabella nel software di analisi facendo clic sulla scheda File . Determinare 10 colonne diverse (da c0 a c9) per i seguenti parametri: frequenze angolari utilizzate (rad/s): c0; Valori K' (pN/μm) ottenuti per ogni frequenza angolare: c1; ErrK': c2; Valori di K" (pN/μm) ottenuti per ogni frequenza angolare: c3; ErrK": c4; Valori G'(Pa) ottenuti per ogni frequenza angolare: c5; ErrG': c6; G" (Pa) valori ottenuti per ogni frequenza angolare: c7; ErrG": c8 e Ff con il rispettivo errore: c9 (Figura 8). Utilizzare la formula seguente per popolare le colonne seguenti:
c5 = (3 x c1) / (8 x 1,28 x 0,087)
c6 = (3 / (8 x 0,087 x 1,28)) x sqrt (c2^2 + (c1 x 0,01 / 1,28)^2 + (c1 x 0,008 / 0,087) ^ 2)
c7 = (3 x c3) / (8 x 1,28 x 0,087)
c8 = (3 / (8 x 0,087 x c4)) x sqrt (c4^2 + (c3 x 0,01 / 1,28)^2 + (c3 x 0,008 / 0,087)^2)
- Creare una nuova tabella nel software di analisi facendo clic sulla scheda File . Determinare 10 colonne diverse (da c0 a c9) per i seguenti parametri: frequenze angolari utilizzate (rad/s): c0; Valori K' (pN/μm) ottenuti per ogni frequenza angolare: c1; ErrK': c2; Valori di K" (pN/μm) ottenuti per ogni frequenza angolare: c3; ErrK": c4; Valori G'(Pa) ottenuti per ogni frequenza angolare: c5; ErrG': c6; G" (Pa) valori ottenuti per ogni frequenza angolare: c7; ErrG": c8 e Ff con il rispettivo errore: c9 (Figura 8). Utilizzare la formula seguente per popolare le colonne seguenti:
- Tracciare la curva G' (ω) contro G" (ω)
- Per generare la curva G' (ω) rispetto a G" (ω) nel software di analisi, utilizzare i dati della tabella precedente. Fate clic su Galleria > Lineare (Linear) e scegliete il formato Grafico a dispersione.
- Si aprirà una nuova finestra. Selezionare la colonna G " come asse x e la colonna G' come asse y. Infine, fare clic sul pulsante Plot per ottenere il grafico.
- Per aggiungere le barre di errore nel plottaggio, fare clic sulla finestra Plot , quindi fare clic su Barre di errore > di stampa. Si aprirà una nuova finestra. Innanzitutto, contrassegna l'opzione Y Err . Si aprirà un'altra finestra, chiamata Impostazioni barra di errore .
- Fare clic su % di valore, selezionare Data Column, quindi fare clic sulla colonna ErrG'. Infine, fai clic su OK > Plot, appariranno le barre di errore per i valori y. Ripetere la stessa procedura per i valori dell'asse x selezionando ora il quadrato X Err e la colonna corretta per ErrG". Il grafico finale sarà simile a quello mostrato nella Figura 9.
- Adattamento dei parametri al modello di reologia vetrosa morbida
NOTA: L'analisi dei dati è divisa in due parti: 1) curva che si adatta al diagramma G' (ω) rispetto a G" (ω) per ottenere i parametri Γ e Gm; 2) curva che raccorda G' (ω) e G" (ω) in funzione della frequenza ω, per ottenere l'esponente della legge di potenza α.- Curva che adatta il grafico G' (ω) rispetto a G" (ω) per ottenere i parametri Γ e Gm.
- Fate clic sulla scheda Adattamento curva (Curve Fit), selezionate Adatta 1. Si aprirà una nuova finestra. Selezionare il quadrato e fare clic sul pulsante Definisci. Apparirà una finestra chiamata definizione generale di adattamento della curva. Digitare l'equazione seguente:
m1 + m0/m2
dove m1 = 61,576; m2 = 1, con errore ammissibile di 1 x 10-5. Qui m0 rappresenta G ", m1 rappresenta Gm e m2 rappresenta Γ.
NOTA: Per m1 e m2 è necessario stimare i rispettivi valori durante la definizione dell'adattamento della curva. Le stime di cui sopra erano basate sull'esperimento di esempio mostrato. Negli esperimenti, stimare i numeri in base ai valori osservati nel grafico. - Fare clic sul pulsante OK in entrambe le finestre e verrà visualizzato il raccordo, come mostrato nella Figura 10 : una curva nera. Controllare i valori corretti per m1 e m2, elencati nella tabella di adattamento della curva visualizzata con il grafico.
- Fate clic sulla scheda Adattamento curva (Curve Fit), selezionate Adatta 1. Si aprirà una nuova finestra. Selezionare il quadrato e fare clic sul pulsante Definisci. Apparirà una finestra chiamata definizione generale di adattamento della curva. Digitare l'equazione seguente:
- Curve fitting G ' e G" in funzione della frequenza angolare ω
- Quindi, creare altri due grafici, vale a dire, G' come funzione di ω e G' come funzione di ω. Posizionare le barre di errore solo sull'asse y, come illustrato in precedenza.
- Ripetete la procedura di adattamento della curva, ma ora selezionate l'opzione "G" in Selezioni adattamento curva (General Fit Definition), quindi in Adattamento generale > definizione curva (General Fit Definition) scrivete la seguente equazione:
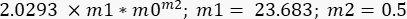
In questo caso, m1 è stato stimato come il valore di G" (ω) = 23,683 Pa, quando ω = 6,3 rad/s; m2 è stato stimato essere 0,5 (ricordiamo che m2 è l'esponente α e varia tra 0 e 1). Inserire il valore per Γ = 2,0293, in base al risultato di m2 nella Figura 10. - Contrassegnare l'opzione Dati peso. Dopo tutte queste procedure, fare clic su OK e verrà visualizzato un adattamento della curva simile a quello nella Figura 11: verrà visualizzata una curva blu. Appariranno i valori per α, α = 0,63 ± 0,02 e G 0, G 0 = (3,7 ± 0,3)Pa. Utilizzare questi valori per adattare la curva successiva, G' (ω).
- Fate clic sulla curva successiva, ripetete la procedura di adattamento della curva, ma ora nella Definizione generale della curva di adattamento (General Fit Curve Definition), scrivete la seguente equazione:

In questo caso, m3 è solo un valore stimato di α per confermare il valore ottenuto in precedenza. Utilizzare i valori per G 0 = 3,703 e G' (ω) = 23,683 Pa quando ω = 6,3 rad/s. - Ancora una volta, aggiungi 1 x 10-5 come errore consentito e contrassegna l'opzione Dati di peso. Dopo tutte queste procedure, fare clic su OK e verrà visualizzato un adattamento della curva simile a quello nella Figura 11 : verrà visualizzata una curva verde.
- Curva che adatta il grafico G' (ω) rispetto a G" (ω) per ottenere i parametri Γ e Gm.
Risultati
La figura 1 rappresenta gli schemi del sistema OT utilizzato per le misure reologiche. La Figura 2 mostra gli schemi dell'esperimento di microreologia con entrambe le sfere e viene mostrato anche un RBC rappresentativo. La figura 3 mostra una curva tipica per le ampiezze di entrambe le sfere in funzione del tempo quando i movimenti sinusoidali sono prodotti dallo stadio piezoelettrico. Mentre la sfera di riferimento (Figura 3 - curva rossa) oscilla seguendo il movimento dello stage, la sfera RBC (Figura 3 - una curva blu) oscilla con un'ampiezza e una fase diverse. Misurando questi parametri, è possibile determinare la complessa costante elastica K* (ω) per diversi globuli rossi nel campione. La figura 4 mostra un tipico grafico per la costante elastica di stoccaggio K' (ω) in funzione della costante elastica di perdita K" (ω). La dipendenza lineare osservata dimostra che la superficie dei globuli rossi può essere considerata un materiale vetroso morbido. Successivamente, per ottenere il fattore di forma cellulare complessivo, Ff, è necessaria una procedura DM e la Figura 5, la Figura 6 e la Figura 7 includono alcuni dei passaggi richiesti per lo scopo. Quindi, per convertire forze e deformazioni in tensioni e deformazioni, è necessario trasformare K* (ω) in G* (ω).
La costante elastica complessa dei globuli rossi è definita come K* (ω) = K' (ω) + iK" (ω). Inoltre, K* (ω) è correlato al modulo di taglio del complesso RBC G* (ω) = G' (ω) + iG" (ω). G' (ω) e G" (ω) sono rispettivamente il modulo di stoccaggio e perdita di taglio dei globuli rossi. La relazione tra K* (ω) e G* (ω) è data da:
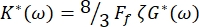
dove Ff è un fattore di forma che dipende dalla geometria RBC, come accennato in precedenza, e ζ è lo spessore della membrana RBC, precedentemente determinato come ζ = (0,087 ± 0,009)μm 8,15.
Inoltre, i moduli di taglio di perdita G' (ω) e G" (ω) di stoccaggio sono correlati, rispettivamente, alle costanti elastiche di accumulo K' (ω) e perdita K" (ω) attraverso le equazioni 8,9
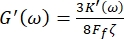 e
e 
Per trovare gli errori standard per G' (ω) e G" (ω), Err G' ed Err G", rispettivamente, usare la propagazione delle equazioni di incertezze con i risultati di K' (ω) e K " (ω), secondo le seguenti equazioni 8,9:
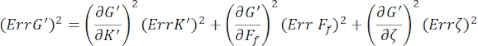
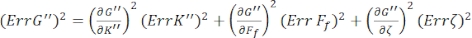 .
.
Secondo la teoria della reologia vetrosa morbida, i globuli rossi si comportano come materiali viscoelastici come emulsioni, paste e fanghi 8,9 e i loro moduli di stoccaggio e perdita obbediscono alle seguenti equazioni:
Quindi, , dove G m è il modulo di taglio della membrana cellulare, G 0 è il modulo di stoccaggio a bassa frequenza, Γ è il rapporto  , α è l'esponente della legge di potenza del modello di reologia vetrosa morbida e ω0 = 1 rad/s 8,9.
, α è l'esponente della legge di potenza del modello di reologia vetrosa morbida e ω0 = 1 rad/s 8,9.
Sono stati utilizzati i valori trovati per Ff e anche lo spessore superficiale dei globuli rossi ζ (stimati a 87 ± 8 nm 8,9,15). I risultati sono illustrati nelle Figure 8, 9 e 10. Ancora una volta, la dipendenza lineare tra G' e G" è in linea con l'ipotesi che le superfici RBC possano essere modellate come materiali vetrosi morbidi. Inoltre, dall'adattamento lineare di questo grafico, è possibile ottenere il valore di G m e, introducendo questo valore nella curva reologica vetrosa morbida di G", vengono determinati i valori di G0 e α (Figura 11 - una curva blu). Inoltre, dopo aver utilizzato il risultato ottenuto per G 0 e averlo aggiunto alla curva reologica vetrosa morbida di G', viene derivato lo stesso valore per l'esponente, all'interno di barre di errore (Figura 11 - una curva verde).

Figura 1: Rappresentazione schematica del microscopio OT. L'intero sistema è costruito su un tavolo antivibrante. Il laser viene allineato utilizzando almeno due diversi specchi dicroici (bianchi) e diretto verso l'ingresso posteriore della lente dell'obiettivo del microscopio utilizzando un altro specchio dicroico (azzurro). Sono necessari anche un palco piezoelettrico e una fotocamera scientifica digitale collegata a un computer. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Schemi dell'esperimento di microreologia. La sfera di riferimento (grigio scuro) è attaccata al coprislip e la sfera RBC (blu) è attaccata alla superficie eritrocitaria (rosso) e intrappolata dall'OT (indicato da triangoli di pesca quando il laser è acceso). ρ è la posizione di equilibrio della sfera RBC nella trappola; ξ è il movimento sinusoidale del campione e x è la deformazione cellulare. L'immagine schematica è stata creata in Biorender. Fare clic qui per visualizzare una versione ingrandita di questa figura.
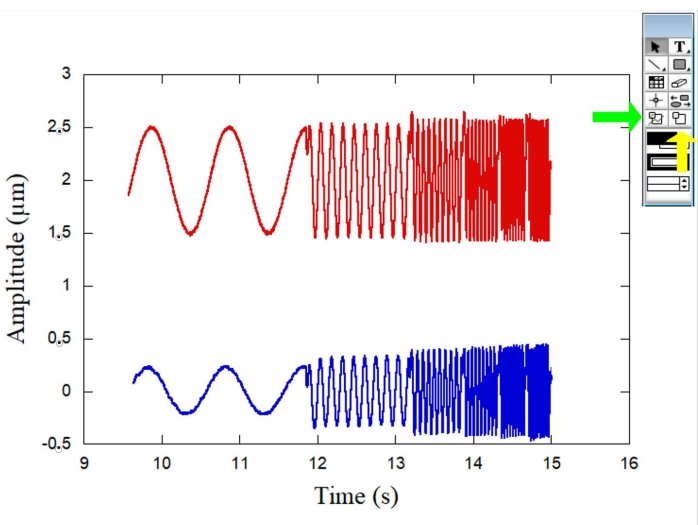
Figura 3: Grafico che illustra le ampiezze (μm) di entrambe le sfere nel tempo (s) quando i movimenti sinusoidali sono prodotti dallo stadio piezoelettrico. La sfera di riferimento (curva rossa) oscilla seguendo il movimento dello stage, mentre la sfera RBC (curva blu) oscilla con ampiezza e fase diverse. La freccia verde a destra indica lo strumento di selezione dei dati mentre la freccia gialla indica lo strumento di selezione dello zoom. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Risultati della microreologia dei globuli rossi. Memorizzare la costante elastica in funzione della costante elastica di perdita per diversi RBC nel campione (n = 10 celle diverse da tre campioni diversi). I punti dati rappresentano i valori medi di K' (asse y) e K" (asse x) con le rispettive barre di errore (errore standard della media), ottenuti per ciascuna frequenza angolare utilizzata nella configurazione sperimentale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
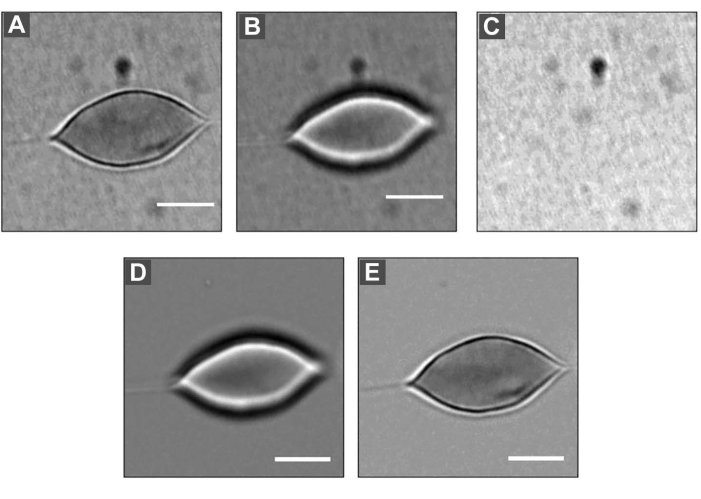
Figura 5: DM applicato a un RBC . (A) Immagine sfocata, dimensione = 2 μm. (B) Immagine a fuoco. (C) Immagine di sfondo. Dividendo ogni immagine (A) e (B) per l'immagine di sfondo (C), e quindi moltiplicando per il valore medio di grigio di ogni immagine, è possibile ottenere immagini (D) ed (E). Barra scala: 5 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
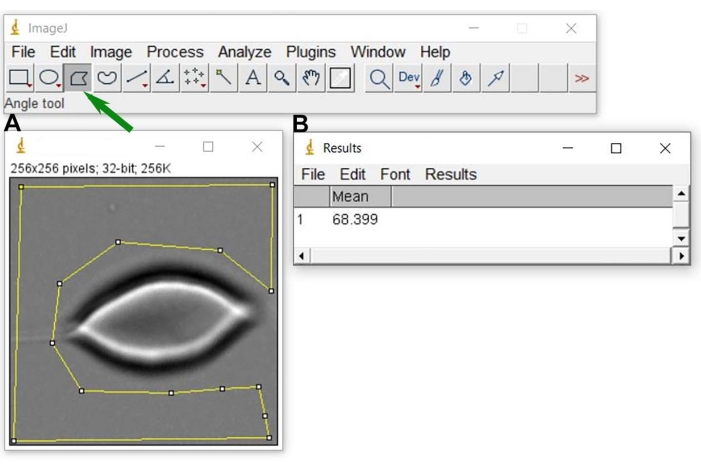
Figura 6: Sfondo grigio livello N0. Dopo aver aperto l'immagine rappresentativa in ImageJ (A), selezionare un'area (figura geometrica gialla attorno alla cella RBC) utilizzata per ottenere il valore medio del livello di grigio di sfondo e il risultato (B). Per eseguire la selezione gialla in A, utilizzare lo strumento di selezione poligono dell'immagine J (indicato con una freccia verde). Fare clic qui per visualizzare una versione ingrandita di questa figura.
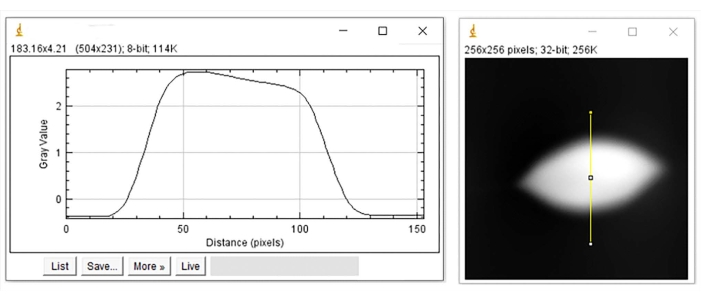
Figura 7: Profilo di altezza per il RBC deformato. Profilo dell'altezza (a sinistra) rappresentato lungo la linea gialla verticale dell'immagine (a destra). Fare clic qui per visualizzare una versione ingrandita di questa figura.
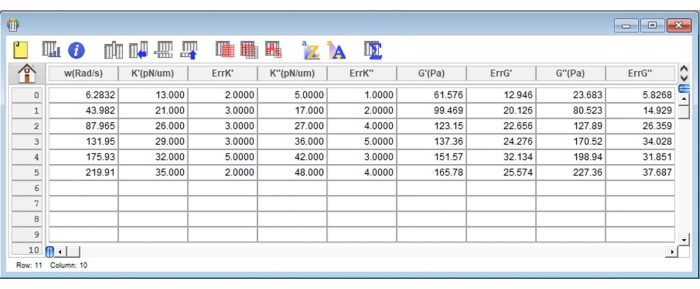
Figura 8: Screenshot rappresentativo di una tipica tabella di risultati nel software di analisi. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 9: Parametri viscoelastici dei globuli rossi. Conservare il modulo di taglio in funzione del modulo di taglio di perdita per diversi globuli rossi nel campione (n = 10 celle diverse da tre campioni diversi). I punti dati rappresentano i valori medi di entrambi G' (asse y) e G" (asse x), con le rispettive barre di errore (errore standard della media), ottenuti per ogni frequenza angolare utilizzata negli esperimenti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
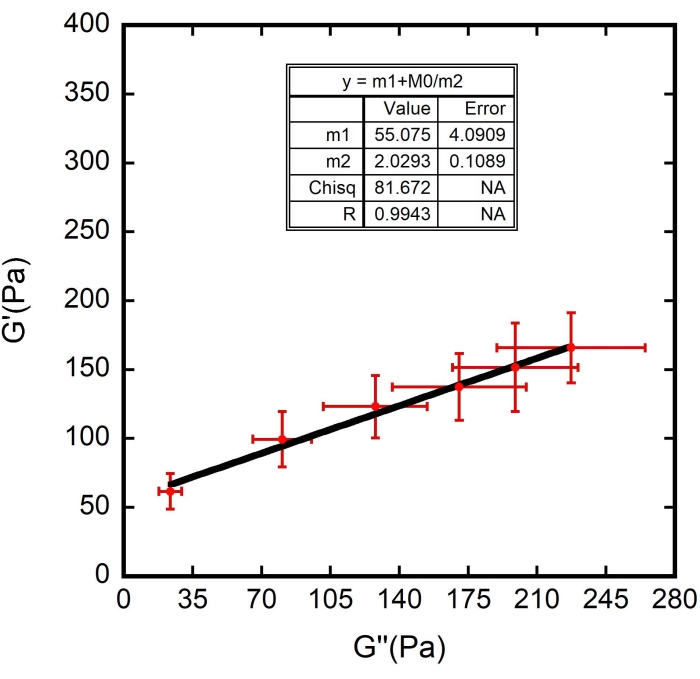
Figura 10: Adattamento della curva di G ' (Pa) in funzione di G" (Pa). La linea nera lineare è la curva adatta ai punti dati. N = 10 cellule diverse da tre diversi campioni. Le barre di errore rappresentano l'errore standard della media. Fare clic qui per visualizzare una versione ingrandita di questa figura.
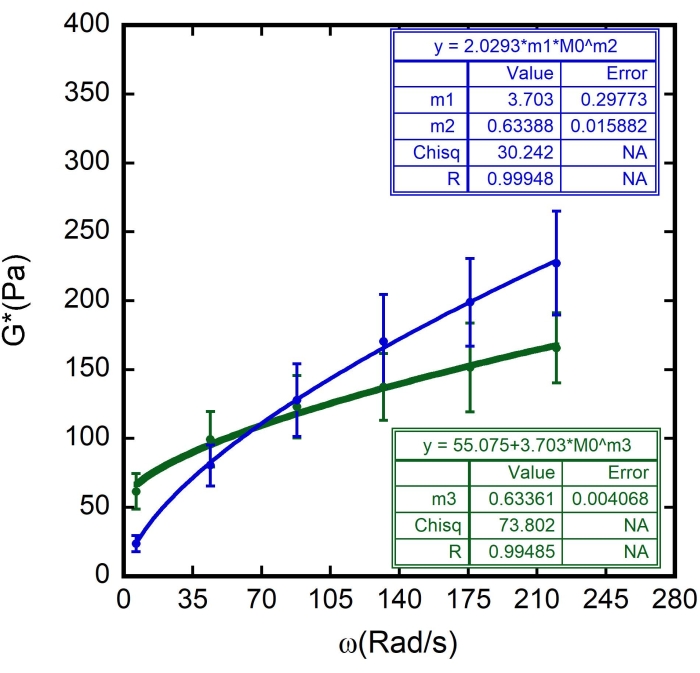
Figura 11: Adattamento del modello di reologia vetrosa morbida ai risultati. Il modulo di taglio complesso (G*) in funzione della frequenza angolare ω per diversi globuli rossi nel campione. I cerchi verdi nel grafico rappresentano i valori medi di G', mentre i cerchi blu rappresentano i valori medi di G", tracciati con le rispettive barre di errore. Le linee continue verdi e blu rappresentano i raccordi curvi per il modello reologico vetroso morbido. I parametri m 1, m 2 e m3 sono indicati nel grafico. Mentre m 1 è G0, m 2 e m3 sono l'esponente, α. N = 10 celle diverse da tre diversi campioni. Le barre di errore rappresentano l'errore standard della media. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Scheda supplementare 1: ImageJ plugin DivideQ2.class. Clicca qui per scaricare questo file.
Scheda supplementare 2: ImageJ macro personalizzata per ottenere il fattore di forma. Clicca qui per scaricare questo file.
Discussione
In questo protocollo, viene presentato un metodo integrato basato su pinzette ottiche e microscopia di defocalizzazione per mappare quantitativamente le proprietà viscoelastiche dei globuli rossi. Vengono determinati i risultati per i moduli di taglio di stoccaggio e perdita, insieme all'esponente di scala che caratterizza la reologia vetrosa morbida dei globuli rossi. L'applicazione di questo protocollo per diverse condizioni sperimentali, come nella situazione fisiologica8 o lungo ogni stadiodel ciclo intraeritrocitico 9 di P. falciparum è già stata effettuata.
I riferimenti in letteratura indicano discrepanze nella reologia dei globuli rossi, parzialmente attribuite a cambiamenti nella morfologia cellulare non adeguatamente presi in considerazione durante le misurazioni 6,7. Utilizzando la diffusione dinamica della luce, sono stati riportati valori per i moduli di stoccaggio e perdita RBC compresi tra 0,01-1 Pa, nella gamma di frequenza 1-100 Hz6. In un altro studio, utilizzando la citometria a torsione magnetica ottica, l'apparente modulo elastico complesso è stato determinato7, ma divergeva dai valori di diffusione dinamica della luce; Pertanto, un fattore moltiplicativo di 84 è stato utilizzato a fini comparativi. Seguendo le procedure descritte nel presente protocollo, queste differenze sono state chiarite8 caratterizzando il fattore di forma RBC utilizzando una tecnica di microscopia defocalizzante non invasiva11,12,13. Il modulo di taglio complesso, che caratterizza le superfici cellulari, può essere ottenuto solo se la geometria è considerata16,17 e questo non è stato sempre eseguito correttamente.
La metodologia integrata presentata in questo protocollo consente di eseguire entrambi i metodi (misura OT e misura DM) per la stessa singola cella, uno dopo l'altro. Consente inoltre di eseguire misurazioni OT per diverse cellule in una popolazione e quindi eseguire misurazioni DM per altre cellule nella stessa popolazione cellulare. L'ultima opzione introdurrà probabilmente una maggiore variabilità per entrambi i risultati, ma gli errori possono essere propagati di conseguenza, in modo tale che i risultati correleranno la morfologia complessiva dei globuli rossi con le proprietà viscoelastiche complessive dei globuli rossi in una data popolazione di cellule corrispondenti a una particolare condizione sperimentale.
Il limite principale per l'esecuzione di questo protocollo è la difficoltà intrinseca nell'eseguire il metodo stesso poiché si tratta di un'integrazione di pinzette ottiche e microscopia di defocalizzazione; Pertanto, la disponibilità di strumenti per eseguire tutti i passaggi descritti può essere una sfida. Tuttavia, se si ha accesso a una struttura OT, è molto più fattibile eventualmente adattare la struttura per eseguire gli esperimenti. È qui che si inserisce il presente protocollo, non solo dettagliando ogni fase per eseguire le misurazioni e l'analisi, ma anche aiutando le persone a identificare e adottare questi sistemi OT invece di creare una configurazione da zero.
Inoltre, l'attaccamento dei globuli rossi ai coprivetrini diventa un fattore limitante poiché sono cellule non aderenti e tali passaggi possono introdurre difficoltà nelle misurazioni, poiché alcuni globuli rossi possono essere staccati. Pertanto, è importante scegliere un RBC ben aderito. Un modo per verificare se la scelta è andata a buon fine può verificarsi al momento della preparazione del campione per la misurazione. Dopo aver posizionato la sfera RBC intrappolata OT sulla superficie della cella, spostare leggermente il campione per assicurarsi che la cella sia saldamente fissata e non abbia cambiato posizione dopo il tallone intrappolato OT. In tal caso, cercare un'altra cella nell'esempio. Possono essere fatti anche miglioramenti futuri come l'uso di OT a doppio raggio per intrappolare simultaneamente l'RBC ed eseguire le misurazioni reologiche allo stesso tempo.
Oltre a ciò, la possibilità di estrarre informazioni viscoelastiche quantitative basate su singole cellule di globuli rossi consente una varietà di applicazioni che stanno appena iniziando a essere esplorate 8,9. Pertanto, il metodo presentato può essere esteso alla caratterizzazione del comportamento meccanico dei globuli rossi in altre condizioni fisio-patologiche come l'anemia da carenza di ferro e il diabete o nelle malattie genetiche del sangue come l'anemia falciforme e la talassemia, per esempio. Tale strumento integrato può fornire la base per lo sviluppo di nuovi metodi diagnostici in grado di correlare i cambiamenti nelle proprietà viscoelastiche dei globuli rossi con le modifiche nel flusso sanguigno di individui con diverse patologie.
Divulgazioni
Gli autori non hanno interessi finanziari nei prodotti descritti in questo manoscritto e non hanno nient'altro da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare tutti i membri della struttura di microscopia avanzata CENABIO per l'importante aiuto. Questo lavoro è stato sostenuto dalle agenzie brasiliane Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - Financial Code 001, Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ) e Instituto Nacional de Ciência e Tecnologia de Fluidos Complexos (INCT-FCx) insieme a Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP). B.P. è stato sostenuto da una sovvenzione JCNE di FAPERJ.
Materiali
| Name | Company | Catalog Number | Comments |
| 35mm culture dishes | Corning | 430165 | |
| Bovine serum albumin | Sigma-Aldrich | A9418 | |
| Coverslips | Knittel Glass | VD12460Y1A.01 and VD12432Y1A.01 | |
| Glass-bottom dishes | MatTek Life Sciences | P35G-0-10-C | |
| Glucose | Sigma-Aldrich | G7021 | |
| ImageJ | NIH | https://imagej.nih.gov/ij/ | |
| Immersion oil | Nikon | MXA22165 | |
| Inverted microscope | Nikon | Eclipse TE300 | |
| KaleidaGraph | Synergy Software | https://www.synergy.com/ | |
| KCl | Sigma-Aldrich | P5405 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Microscope camera | Hamamatsu | C11440-10C | |
| Na2HPO4 | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S5886 | |
| Neubauer chamber | Sigma-Aldrich | BR717805-1EA | |
| Objective lens | Nikon | PLAN APO 100X 1.4 NA DIC H; PLAN APO 60x 1.4 NA DIC H and Plan APO 10x XXNA PH2 | |
| Optical table | Thorlabs | T1020CK | |
| OT laser | IPG Photonics | YLR-5-1064-LP | |
| Polystyrene microspheres | Polysciences | 17134-15 | |
| rubber ring | Forever Seals | NBR O-Ring | |
| Silicone grease | Dow Corning | Z273554 | |
| Stage positioning | PI | P-545.3R8S | |
| Pipette | Gilson | P1000 |
Riferimenti
- Fowler, V. M. The human erythrocyte plasma membrane: a Rosetta Stone for decoding membrane-cytoskeleton structure. Current Topics in Membranes. 72, 39-88 (2013).
- Tomaiuolo, G. Biomechanical properties of red blood cells in health and disease towards microfluidics. Biomicrofluidics. 8 (5), 051501 (2014).
- Depond, M., Henry, B., Buffet, P., Ndour, P. A. Methods to investigate the deformability of RBC during malaria. Frontiers in Physiology. 10, 1613 (2019).
- Boal, D. . Mechanics of the Cell. 2 edn. , (2012).
- Balland, M., et al. Power laws in microrheology experiments on living cells: Comparative analysis and modeling. Physical Review E. 74 (2), 021911 (2006).
- Amin, M. S., et al. Microrheology of red blood cell membranes using dynamic scattering microscopy. Optics Express. 15 (25), 17001-17009 (2007).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. American Journal of Physiology Cell Physiology. 293 (2), 597-605 (2007).
- Gomez, F., et al. Effect of cell geometry in the evaluation of erythrocyte viscoelastic properties. Physical Review E. 101 (6-1), 062403 (2020).
- Gomez, F., et al. Plasmodium falciparum maturation across the intra-erythrocytic cycle shifts the soft glassy viscoelastic properties of red blood cells from a liquid-like towards a solid-like behavior. Experimental Cell Research. 397 (2), 112370 (2020).
- Pompeu, P., et al. Protocol to measure the membrane tension and bending modulus of cells using optical tweezers and scanning electron microscopy. STAR Protocols. 2 (1), 100283 (2021).
- Agero, U., Mesquita, L. G., Neves, B. R., Gazzinelli, R. T., Mesquita, O. N. Defocusing microscopy. Microscopy Research and Technique. 65 (3), 159-165 (2004).
- Agero, U., Monken, C. H., Ropert, C., Gazzinelli, R. T., Mesquita, O. N. Cell surface fluctuations studied with defocusing microscopy. Physical Review E. 67 (5), 051904 (2003).
- Roma, P. M. S., Siman, L., Amaral, F. T., Agero, U., Mesquita, O. N. Total three-dimensional imaging of phase objects using defocusing microscopy: Application to red blood cells. Applied Physics Letters. 104 (25), 251107 (2014).
- Köhler, A. New method of illumination for photomicrographical purposes. Journal of the Royal Microscopical Society. 14, 261-262 (1894).
- Nans, A., Mohandas, N., Stokes, D. L. Native ultrastructure of the red cell cytoskeleton by cryo-electron tomography. Biophysical Journal. 101 (10), 2341-2350 (2011).
- Ayala, Y. A., et al. Rheological properties of cells measured by optical tweezers. BMC Biophysics. 9, 5 (2016).
- Ayala, Y. A., et al. Effects of cytoskeletal drugs on actin cortex elasticity. Experimental Cell Research. 351 (2), 173-181 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon