Method Article
Análisis cuantitativo de las propiedades viscoelásticas de los glóbulos rojos mediante pinzas ópticas y microscopía desenfocada
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, se describe un protocolo integrado basado en pinzas ópticas y microscopía desenfocada para medir las propiedades reológicas de las células. Este protocolo tiene una amplia aplicabilidad en el estudio de las propiedades viscoelásticas de los eritrocitos en condiciones fisiopatológicas variables.
Resumen
Las propiedades viscoelásticas de los eritrocitos han sido investigadas por una variedad de técnicas. Sin embargo, los datos experimentales reportados varían. Esto no solo se atribuye a la variabilidad normal de las células, sino también a las diferencias en los métodos y modelos de respuesta celular. Aquí, se emplea un protocolo integrado que utiliza pinzas ópticas y microscopía de desenfoque para obtener las características reológicas de los glóbulos rojos en el rango de frecuencia de 1 Hz a 35 Hz. Mientras que las pinzas ópticas se utilizan para medir la constante elástica del complejo eritrocitario, la microscopía de desenfoque es capaz de obtener el perfil de altura de la célula, el volumen y su factor de forma, un parámetro que permite la conversión de la constante elástica compleja en módulo de corte complejo. Además, aplicando un modelo de reología vítrea suave, se puede obtener el exponente de escala para ambos módulos. La metodología desarrollada permite explorar el comportamiento mecánico de los glóbulos rojos, caracterizando sus parámetros viscoelásticos, obtenidos bajo condiciones experimentales bien definidas, para varias condiciones fisiológicas y patológicas.
Introducción
Los glóbulos rojos maduros (RBC), también conocidos como eritrocitos, pueden extenderse más del doble de su tamaño cuando pasan a través de los capilares más estrechos del cuerpo humano1. Tal capacidad se atribuye a su capacidad única de deformarse cuando se somete a cargas externas.
En los últimos años, diferentes estudios han caracterizado esta característica en superficies de glóbulos rojos 2,3. El área de la física que describe las respuestas elásticas y viscosas de los materiales debido a las cargas externas se llama reología. En general, cuando se aplica una fuerza externa, la deformación resultante depende de las propiedades del material y se puede dividir en deformaciones elásticas, que almacenan energía, o deformaciones viscosas, que disipan la energía4. Todas las células, incluidos los glóbulos rojos, exhiben un comportamiento viscoelástico; En otras palabras, la energía se almacena y se disipa. La respuesta viscoelástica de una célula puede caracterizarse por su módulo de cizallamiento complejo G*(ω) = G'(ω) + iG"(ω), donde G' (ω) es el módulo de almacenamiento, relacionado con el comportamiento elástico, y G" (ω) es el módulo de pérdida, relacionado con su viscosidad4. Además, se han utilizado modelos fenomenológicos para describir las respuestas celulares, uno de los más utilizados se denomina modelo5 de reología vítrea blanda, caracterizado por una dependencia de la ley de potencia del módulo de cizallamiento complejo con la frecuencia de carga.
Se han empleado métodos basados en una sola célula para caracterizar las propiedades viscoelásticas de los glóbulos rojos, aplicando fuerza y midiendo el desplazamiento en función de la carga impuesta 2,3. Sin embargo, para el módulo de cizallamiento complejo, se pueden encontrar pocos resultados en la literatura. Utilizando la dispersión dinámica de la luz, se informaron valores para el almacenamiento de RBC y los módulos de pérdida que variaron de 0.01-1 Pa, en el rango de frecuencia de 1-100 Hz6. Mediante el uso de citometría óptica de torsión magnética, se obtuvo un módulo elástico complejo aparente7, y para fines de comparación, se afirmó un factor multiplicativo para posiblemente aclarar las discrepancias.
Más recientemente, se estableció una nueva metodología basada en pinzas ópticas (OT) junto con microscopía desenfocada (DM), como herramienta integrada para mapear cuantitativamente el almacenamiento y la pérdida de módulos de cizallamiento de eritrocitos humanos sobre cargas dependientes del tiempo 8,9. Además, se utilizó un modelo de reología vítrea suave para ajustar los resultados y obtener un coeficiente de ley de potencia que caracteriza a los glóbulos rojos 8,9.
En general, la metodología desarrollada8,9, cuyo protocolo se describe en detalle a continuación, aclara las discrepancias anteriores utilizando los valores medidos para el factor de forma, Ff, que relaciona las fuerzas y deformaciones con tensiones y deformaciones en la superficie de los glóbulos rojos y puede utilizarse como un nuevo método de diagnóstico capaz de determinar cuantitativamente los parámetros viscoelásticos y las características vítreas blandas de los glóbulos rojos obtenidos de individuos con sangre diferente. Patologías. Dicha caracterización, utilizando el protocolo que se describe a continuación, puede abrir nuevas posibilidades para comprender el comportamiento de los glóbulos rojos desde una perspectiva mecanobiológica.
Protocolo
Las muestras de sangre humana fueron proporcionadas por hombres y mujeres adultos voluntarios de acuerdo con los protocolos aprobados por el Comité de Ética en Investigación de la Universidad Federal de Río de Janeiro (Protocolo 2.889.952) y registrados en la Plataforma Brasil con el número CAAE 88140418.5.0000.5699. Se emitió una forma escrita de consentimiento y se recogió de todos los voluntarios. Se excluyeron aquellos con hemoglobinopatía y/o que tomaban medicación controlada. Todo el proceso siguió las directrices aprobadas por el comité de ética del instituto.
1. Preparación de los portamuestras
- Adquiera dos cubreobjetos (24 mm x 60 mm y 24 mm x 32 mm; espesor = 0,13-0,17 mm) y un anillo de goma (diámetro = 10 mm; espesor = 2 mm) para cada portamuestras.
- Vierta grasa de silicona sobre la superficie del anillo de goma de una manera que cubra todo el perímetro.
- Coloque el anillo de goma en el cubreobjetos con el lado de la grasa orientado hacia el cubreobjetos. Espere 5 minutos para la fijación adecuada, los portamuestras están listos para recibir el cultivo celular.
NOTA: Además, también se pueden usar platos comerciales o caseros con fondo de vidrio, como se describió anteriormente10.
2. Cultivo celular
NOTA: Los pasos a continuación describen cómo obtener glóbulos rojos sanos de la sangre humana. Es importante que las muestras estén recién preparadas antes de cada experimento.
- Diluir 20 μL de sangre en 250 μL de 1x solución salina tampón fosfato (PBS) que contiene 137 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mM KH2PO4, 10 mM de glucosa, ysuplementado con 1 mg/ml de albúmina sérica bovina (BSA).
- Después de la centrifugación a 200 x g durante 2 min a temperatura ambiente, aspirar el sobrenadante con una pipeta y resuspender el pellet celular en 1 ml de 1 solución PBS/BSA. Lave las celdas 2 veces en el tampón.
- Calcular la densidad celular utilizando un hemocitómetro y sembrar de 50.000 a 100.000 células en el portamuestras preparado en el paso 1. Espere 10-15 minutos para la fijación de células no específicas al cubreobjetos; El tiempo de espera no afecta a las células.
- Añadir a la muestra 0,2 μL de una solución de esfera de poliestireno al 10% v/v (radio = 1,52 ± 0,02 μm) para otros experimentos de OT. Confirme la mezcla adecuada mirando las muestras bajo el microscopio.
- Después de la siembra de células, simplemente coloque el segundo cubreobjetos sobre el anillo de goma (no es necesario agregar grasa para la fijación), cierre la configuración y termine la preparación de la muestra. Las muestras están listas para el análisis y la manipulación por microscopía.
3. Configuración del microscopio de pinzas ópticas
NOTA: OT son herramientas que utilizan un rayo láser altamente enfocado para atrapar objetos microscópicos y para medir fuerzas en el rango de piconewton y desplazamientos en la escala nanométrica. El láser OT utilizado (longitud de onda de 1064 nm) debe estar correctamente alineado, como se describió anteriormente10.
- Brevemente, usando al menos dos espejos separados por una distancia de unos pocos centímetros (10-20 cm como mínimo), dirija un rayo láser polarizado linealmente hacia la entrada posterior de un microscopio invertido. Alinee con precisión el rayo láser para que ingrese al microscopio en línea recta (Figura 1).
- Luego, refleje el rayo láser usando un espejo dicroico, instalado en el microscopio, para proceder paralelo al eje de la lente del objetivo y entrar en la lente cerca del centro de su entrada posterior. Esto enfocará el láser para crear la trampa óptica (Figura 1).
- A continuación, para medir fuerzas con OT, calibre el sistema para obtener la rigidez de la trampa (κOT). Consulte10 para obtener una descripción más detallada del procedimiento de calibración OT. Una vez que se encuentra κ OT, el sistema OT está listo para los experimentos de reología.
4. Configuración de DM
NOTA: La DM es una técnica de microscopía óptica basada en campo claro que permite que los objetos transparentes se vuelvan visibles si el microscopio está ligeramente desenfocado11,12. Tal técnica ha sido aplicada para obtener la forma RBC13. El mismo microscopio empleado para el sistema OT se puede utilizar para DM, para obtener un perfil de altura a través de reconstrucciones 3D.
- Ajuste el sistema de iluminación del microscopio realizando la iluminación Köhler14 y, para una mejor resolución, abra completamente el condensador-diafragma para realizar los experimentos.
- Utilice un sistema de posicionamiento piezoeléctrico para desplazar la muestra en todas las coordenadas, con precisión nanométrica en el eje z. Realizar la autocalibración del sistema piezoeléctrico en todos los ejes. Una vez que se realizan todos los procedimientos, el sistema de microscopio está listo para los experimentos de DM.
5. Experimento y análisis de reología basado en OT
NOTA: El experimento de reología consiste en observar las respuestas de la célula a pequeñas oscilaciones de frecuencias variables.
- Experimentación
- Usando el sistema OT, atrape la esfera con el láser OT y luego conéctela a un RBC presionando la esfera contra la superficie celular cerca de la superficie superior y cerca del borde de la celda. Utilice el microscopio para este paso. Luego, atrape otra esfera y repita el mismo procedimiento de fijación pero ahora conéctela al cubreobjetos, cerca de la celda. La esfera unida al cubreobjetos es la cuenta de referencia (Figura 2), que es necesaria para seguir el desplazamiento piezoeléctrico y comparar con la esfera RBC.
- Asegúrese de que la celda elegida esté bien fijada al cubreobjetos y que el RBC y las esferas de referencia se hayan adherido a la superficie del RBC y al cubreobjetos, respectivamente, antes de comenzar la medición. Identifique visualmente las células no adheridas ya que se moverán con el tiempo, a pesar de la alta tasa de adhesión (alrededor del 80%-90%).
- Añadir una función sinusoidal de amplitud, ξ 0 = 0,500 ± 0,001 μm y frecuencias variables de 1 Hz, 7 Hz, 14 Hz, 21 Hz, 28 Hz y 35 Hz, con frecuencias angulares respectivas, ω, de 6,3 rad/s, 169 rad/s, 88 rad/s, 132 rad/s, 176 rad/s y 220 rad/s, al software de la etapa piezoeléctrica, utilizando el software piezoeléctrico, como se demostró anteriormente 8,9.
- Usando la etapa piezoeléctrica, presione el botón de inicio para permitir el desplazamiento piezoeléctrico y mantener la esfera RBC en la trampa, someta la muestra a un ciclo de movimientos utilizando la función sinusoidal previamente establecida. Utilice una cámara capaz de producir imágenes a 790 fotogramas/s o más para grabar el movimiento de la muestra. Un esquema del experimento se muestra en la Figura 2.
- Mientras la muestra se somete a movimientos sinusoidales, active el OT para atrapar la esfera unida a la superficie RBC. Independientemente de la temperatura elegida para llevar a cabo los experimentos, temperatura ambiente, 37 ° C, u otra temperatura, controle cuidadosamente la temperatura para evitar variaciones durante las mediciones. El láser infrarrojo (1064 nm) utilizado para crear el OT casi no causa daño o calentamiento de las células.
- Análisis
- Analiza las imágenes obtenidas durante los movimientos sinusoidales utilizando ImageJ para encontrar la posición del centro de masa de cada una de las esferas a lo largo del tiempo.
NOTA: Estos datos permiten generar gráficos capaces de mostrar las diferencias de fase y amplitud entre ambas esferas. Dicha información es crucial para obtener la respuesta viscoelástica de los glóbulos rojos. - Para obtener el centro de masa para cada una de las esferas, abra el software ImageJ. Importa toda la película obtenida durante los movimientos sinusoidales.
- En la pestaña Imagen , haga clic en Ajustar y luego seleccione Umbral. Se abrirá la ventana de umbral. Seleccione B&W. Esto hará que el fondo sea blanco y las esferas negras.
- Ajuste el umbral con ambas barras de desplazamiento debajo del histograma para que ambas esferas aparezcan con la cantidad máxima de píxeles.
- Seleccione la esfera de referencia haciendo clic en Archivo > Rectángulo. Dibuja un rectángulo para seleccionar la esfera. Después de seleccionar la esfera de referencia en una imagen, asegúrese de que el rectángulo también seleccione correctamente la misma esfera en todas las demás imágenes de la película.
- Luego, en la pestaña Analizar , haga clic en Establecer medidas y seleccione la opción Centro de masa .
- Haga clic de nuevo en la ficha Analizar y seleccione Analizar partículas. Se abrirá una nueva ventana. Definir el tamaño y la circularidad (dependiendo del radio de la esfera). Marque las siguientes casillas Mostrar resultados y Borrar resultados. Finalmente, haga clic en Aceptar para procesar todas las imágenes.
- Aparecerá una nueva ventana que contiene una tabla con coordenadas xy para el centro de la masa. Guarde estos valores de coordenadas como un archivo .txt. Repita el procedimiento para la otra esfera, unida a la superficie RBC.
- Para obtener la amplitud y las diferencias de fase para ambas esferas, abra el software de análisis. Importe los archivos .txt obtenidos anteriormente.
- Cree una nueva tabla con tres columnas. En la primera columna (c0) agregue el número de marcos, en la segunda columna (c1) agregue las coordenadas x para la esfera de referencia, y en la tercera columna (c2), las coordenadas x para la esfera unida a la superficie RBC.
NOTA: En este ejemplo, como los movimientos sinusoidales se realizaron solo en el eje x, solo es necesario usar las coordenadas x para ambas esferas. - A continuación, correlacione los fotogramas con el tiempo. Haga clic en Windows > Formula Entry. Se abrirá una nueva ventana llamada entrada de fórmula. En esta ventana, es posible configurar ocho ecuaciones diferentes, cada una de ellas en una clave específica (de F1 a F8).
- Seleccione F1, escriba la fórmula siguiente:
c 3 = c0 / (fps de cámara)
Haga clic en Ejecutar. Esto creará una nueva columna para un tiempo en la tabla (columna 4). - Resta el valor de la coordenada x de cada fotograma por su respectivo valor medio. Para ello, designe dos claves cualesquiera en la entrada de la fórmula y escriba las siguientes ecuaciones para cada clave:
c 4 = (c 1 - media(c 1)) y c 5 = (c 2 - media(c2))
Haga clic en el botón Ejecutar . Los resultados aparecerán en las columnas 5 y 6 para las esferas de referencia y RBC, respectivamente. - Convierta el centro de los valores de masa de píxeles a micrómetros. Para ello, use otra clave en la entrada de la fórmula y escriba la siguiente ecuación:
c 4 = c 4 / número de conversión
Repita el mismo proceso para la columna 5.
NOTA: La conversión se adquiere utilizando una escala / regla micrométrica y obteniendo su imagen con la misma configuración de microscopio utilizada para las mediciones (incluida la misma lente objetivo). Este procedimiento se puede realizar durante la calibración del microscopio. Se obtiene así una relación píxel/micrómetro. - Genera un gráfico con los centros de masa de ambas esferas en el eje y y el tiempo en el eje x. Para esto, haga clic en Galería > Lineal y Dispersión. Se abrirá una nueva ventana. Seleccione la columna de tiempo para el eje x y en el eje y seleccione las columnas del centro de masa en micrómetros para las esferas de referencia y RBC.
- En el gráfico, seleccione solo los datos relacionados con la primera frecuencia angular (6.3 rad/s). Utilice las herramientas indicadas en la figura 3.
- Defina la ecuación que ajusta la curva de datos para la esfera de referencia. Para ello, haga clic en Ajuste de curva > General y Ajustar1, seleccione la casilla de datos relacionados con la posición de la esfera de referencia y luego haga clic en Definir. Se abrirá una nueva ventana para definir la ecuación. La posición ξ(t) de la esfera de referencia se describe mediante:
ξ(t) = ξ0cos(ωt)
donde ξ es el movimiento sinusoidal de la muestra, ω es la frecuencia angular y t es el tiempo en s. Transponiendo esta ecuación al software de análisis, se verá de la siguiente manera: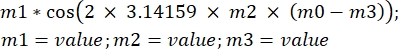 , donde m1 es ξ, m2 es f, m0 es el tiempo t y m3 es la fase de la función coseno para t = 0.
, donde m1 es ξ, m2 es f, m0 es el tiempo t y m3 es la fase de la función coseno para t = 0. - Estime los valores para m1, m2 y m3 de la parcela. Después de definir la ecuación, haga clic en Aceptar. Los datos se ajustarán en función de la ecuación y aparecerá una curva junto con un cuadrado pequeño en el gráfico con los valores de m1, m2 y m3.
- Defina la ecuación que ajusta la curva de datos para la esfera RBC. Para ello, haga clic en Ajuste de curva > General y defina la ecuación que ajustará la curva para los datos. La posición ρ(t) de la esfera RBC viene dada por:
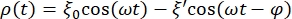
donde ξ' es la amplitud fuera de fase, y φ es el ángulo fuera de fase. Transponiendo esta fórmula al software de análisis, se verá de la siguiente manera: , donde m1, m2 y m3 son los valores obtenidos en el ajuste de curva de la esfera de referencia. m4 es ξ' y m5 es φ.
, donde m1, m2 y m3 son los valores obtenidos en el ajuste de curva de la esfera de referencia. m4 es ξ' y m5 es φ. - Estimar los valores para m4 y m5 de la parcela. Después de definir la fórmula, haga clic en Aceptar. Los datos se ajustarán en función de la ecuación, y aparecerá una curva junto con un pequeño cuadrado en el gráfico con los valores de m4 y m5.
- A continuación, cree una nueva tabla para agregar los datos obtenidos del ajuste de curva en sus respectivas columnas. Defina cinco columnas diferentes para los siguientes parámetros: frecuencia angular, amplitud (esfera de referencia), tiempo inicial, amplitud (esfera RBC) y ángulo fuera de fase. Realice el mismo procedimiento para todas las demás frecuencias.
- Utilice las siguientes ecuaciones para encontrar las constantes de almacenamiento (K') y pérdida (K"):

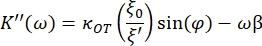
donde κ OT es la constante elástica OT y β es el coeficiente de arrastre de Stokes. Transponiendo las ecuaciones al software de análisis, se verá de la siguiente manera: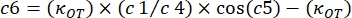 y
y
 , donde β y κOT deben reemplazarse por los valores encontrados en el sistema.
, donde β y κOT deben reemplazarse por los valores encontrados en el sistema. - Trazar los resultados en un gráfico, usando el eje x para K " y el eje y para K' (Figura 4).
- Analiza las imágenes obtenidas durante los movimientos sinusoidales utilizando ImageJ para encontrar la posición del centro de masa de cada una de las esferas a lo largo del tiempo.
6. Experimento y análisis de DM para obtener el factor de forma celular global
- Adquisición de vídeo
- Mueva la etapa piezoeléctrica en la dirección xy utilizando el software para buscar una celda aislada unida al cubreobjetos. Atrape y fije una esfera de poliestireno de diámetro conocido a la superficie RBC. Usando la etapa piezoeléctrica, mueva ligeramente la cuenta atrapada, también unida a la superficie RBC, para deformar la celda, y luego conecte la cuenta al cubreobjetos.
NOTA: También es posible utilizar la misma celda de las mediciones OT. - Cambie la posición del eje z para encontrar la imagen enfocada, donde el plano de enfoque está en el centro de la celda elegida. Esta imagen presenta el contraste más pequeño con el nivel de gris en el centro de la celda igual al nivel de gris fuera de la celda (fondo).
- Cuando la posición sea fija, utilice el software de la cámara para crear una película de toda la celda con aproximadamente 5.000 imágenes a 8 bits y 256 píxeles x 256 píxeles, a una velocidad de fotogramas de 25 fps. A continuación, mueva la posición del eje z 2 μm hacia abajo o hacia arriba para obtener una imagen desenfocada para la celda elegida. Repita los parámetros para crear una película para esta situación.
- Finalmente, sin cambiar la posición del eje z, busque una región sin celdas para repetir el mismo procedimiento y crear una película del fondo de la imagen.
- Mueva la etapa piezoeléctrica en la dirección xy utilizando el software para buscar una celda aislada unida al cubreobjetos. Atrape y fije una esfera de poliestireno de diámetro conocido a la superficie RBC. Usando la etapa piezoeléctrica, mueva ligeramente la cuenta atrapada, también unida a la superficie RBC, para deformar la celda, y luego conecte la cuenta al cubreobjetos.
- Adquisición de imágenes de contraste
- Convierte cada una de las tres películas en tres imágenes promedio. Con ImageJ, seleccione una de las películas, haga clic en Image > Stacks > Z Project y elija la opción Average Intensity (Intensidad media ). Repita este procedimiento para que las otras películas obtengan sus respectivas imágenes.
- Cambie todas las imágenes obtenidas de 8 bits a 32 bits de punto flotante. Usando ImageJ, haga clic en Imagen > Escriba > 32 bits. Luego, haga clic en Analizar > establecer medidas y elija la opción Valor gris medio . Finalmente, haga clic nuevamente en Analizar > medir.
- A continuación, haga clic en Procesar > Calculadora de imágenes y divida la imagen enfocada por la imagen de fondo. Para obtener este resultado, multiplique el valor promedio del nivel de gris de la imagen enfocada. Obtenga el valor promedio haciendo clic en Proceso > Matemáticas > Multiplicar.
- Para obtener el valor promedio, elija la imagen enfocada y luego haga clic en Analizar > medir. Para la imagen representativa, el valor promedio del nivel de gris es 69,199. Repita los procedimientos anteriores para la imagen desenfocada. En este caso, el valor promedio del nivel de gris es 69,231. La figura 5 muestra las imágenes enfocadas y desenfocadas antes y después del procedimiento.
- Las imágenes pueden perder contraste visual durante las operaciones. Para visualizar mejor las imágenes, haga clic en Imagen > Ajustar > brillo / contraste y seleccione la opción Auto .
- A continuación, para encontrar el contraste de la imagen, utilice la siguiente relación:
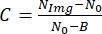 , donde N Img es el nivel de gris de la celda, N0 es el nivel de gris fuera de la celda, y es un parámetro constante correspondiente al nivel de gris para la intensidad de luz cero que depende de la cámara.
, donde N Img es el nivel de gris de la celda, N0 es el nivel de gris fuera de la celda, y es un parámetro constante correspondiente al nivel de gris para la intensidad de luz cero que depende de la cámara. - Para encontrar el valor B, use un medidor de potencia para medir la intensidad de la luz. Para cada valor de intensidad de luz, se debe grabar un video; Por lo tanto, diferentes valores de intensidad pueden estar relacionados con diferentes niveles de gris. Finalmente, obtén un ajuste lineal y relaciona B con la intensidad de luz cero15.
- Busque el valor de N0, haga clic en el icono Selección de polígonos y dibuje un polígono como el de la Figura 6. Luego, haga clic en la pestaña Analizar y seleccione Medir para encontrar el nivel de gris promedio para el área seleccionada. Cada imagen está formada por un conjunto de píxeles y cada píxel tiene un cierto nivel de gris. El conjunto de todos los niveles de gris debido a todos los píxeles que componen la imagen corresponde a NImg.
- Utilice la ecuación de contraste para determinar N Img - No y ejecute esto seleccionando Proceso > Matemáticas > Restar. Divide el resultado entre N0 - B. Finalmente, encuentre el contraste para la imagen enfocada (C 0) y desenfocada (C1).
- Obtención del perfil de altura
- Para obtener el perfil de altura, utilice el método13 ya descrito. En resumen, utilice la transformada de Hartley (FHT) para obtener el grosor RBC. En ImageJ, haga clic en Procesar > FFT > Opciones FFT y, a continuación, elija FHT.
- Resta las imágenes C0 y C1 en ImageJ usando Process > Math > Resta para obtener la imagen para el siguiente procedimiento, C= C0 - C1.
- Para la imagen C, haga clic en Procesar > Opciones FFT > FFT y, a continuación, elija FHT para realizar la transformación Hartley de la imagen. Luego, divida por la frecuencia espacial q2 usando el complemento personalizado DivideQ2. Haga clic en Plugin > DivideQ2.
NOTA: El archivo DivideQ2.class debe copiarse en el directorio de plugins donde está instalado ImageJ. El plugin se proporciona como un archivo .class (Archivo complementario 1) que se incluirá en la carpeta del plugin de ImageJ. - A continuación, realice la transformación inversa FHT utilizando Process > FFT > FFT para obtener una imagen con un nivel de gris proporcional a la altura de la celda.
- Finalmente, haga clic en Proceso > Matemáticas > Multiplicar para multiplicar la imagen resultante usando la siguiente constante:
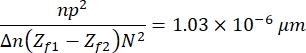
que se define en función de las características de las imágenes, la muestra y la configuración experimental13. Aquí, n = 1.51 es el índice de refracción del aceite, p = 0.0721 μm es la relación entre micrómetros y píxeles de las imágenes, Δ n = 0.058 es la diferencia entre los índices de refracción de RBC y medio acuoso, la distancia entre las imágenes de enfoque y desenfoque (Z f1 - Z f2) = 2μm, y el tamaño de las imágenes, N 2 = 256 pxl2. - Utilice la imagen resultante para obtener el perfil de altura (Figura 7). La imagen resultante se utiliza en ImageJ para observar diferentes perfiles de altura. Depende de en qué parte de la celda se coloque la línea vertical amarilla, por ejemplo, en la Figura 7 se obtiene un perfil de altura limitado por la línea vertical, observe esto presionando Ctrl + K.
- Factor de forma
- Después de encontrar la imagen que contiene el perfil de altura RBC, utilice el contraste desenfocado de 2 μm para crear un conjunto de dos imágenes en ImageJ. Haga clic en Imágenes > Pilas y, a continuación, seleccione la opción Imágenes para apilar. Para encontrar el factor de forma, utilice una macro personalizada de ImageJ para analizar la pila. La macro personalizada de ImageJ está disponible para su descarga como archivo complementario 2.
NOTA: El programa utiliza la imagen de desenfoque para determinar los bordes de la celda. A continuación, determina el perímetro, utilizando la imagen que contiene el perfil de altura, para cada posición horizontal. Además de los bordes, determina el perímetro, así como el inverso del perímetro. La suma de los valores del perímetro inverso, multiplicado por el grosor de píxeles, corresponde al inverso del factor de forma. - Inserte la relación píxel/micrómetro en el programa. Obtenga este valor del experimento de calibración objetiva del microscopio. En el ejemplo utilizado, el valor es 13,87 píxeles/μm.
- Elija la posición inicial horizontal para poner la línea amarilla en la primera imagen de la pila. Comience la línea antes del comienzo de la celda y tráigala más allá de los límites verticales de la celda. En el ejemplo, la línea amarilla tiene 153 píxeles de longitud y la posición inicial está entre i = 70, y1 = 80 e i = 70, y y2 = 195. Luego, mueva la línea amarilla horizontalmente hasta que la posición final sea f = 245, y1 = 80 y f = 245, y y2 = 195.
- Finalmente, para encontrar los bordes de la celda, el perímetro y la inversa del perímetro, seleccione la pestaña Macro y haga clic en Ejecutar macro. La macro entregará una tabla con la posición de los bordes, el perímetro y la inversa del perímetro, y una imagen de la celda analizada. Compruebe si los bordes de esta imagen son similares a los bordes de la figura 7, de lo contrario, repita el procedimiento.
- Utilice la suma del inverso del perímetro para encontrar el factor de forma8.
- Después de encontrar la imagen que contiene el perfil de altura RBC, utilice el contraste desenfocado de 2 μm para crear un conjunto de dos imágenes en ImageJ. Haga clic en Imágenes > Pilas y, a continuación, seleccione la opción Imágenes para apilar. Para encontrar el factor de forma, utilice una macro personalizada de ImageJ para analizar la pila. La macro personalizada de ImageJ está disponible para su descarga como archivo complementario 2.
7. Modelo de reología vítrea blanda y análisis experimental
- Organización de los datos experimentales en una tabla
- Cree una nueva tabla en el software de análisis haciendo clic en la pestaña Archivo . Determine 10 columnas diferentes (de c0 a c9) para los siguientes parámetros: frecuencias angulares utilizadas (rad/s): c0; K' (pN/μm) valores obtenidos para cada frecuencia angular: c1; ErrK': c2; K" (pN/μm) valores obtenidos para cada frecuencia angular: c3; ErrK": c4; Valores G'(Pa) obtenidos para cada frecuencia angular: c5; ErrG': c6; G" (Pa) valores obtenidos para cada frecuencia angular: c7; ErrG": c8 y Ff con su respectivo error: c9 (Figura 8). Utilice la fórmula siguiente para rellenar las columnas siguientes:
c5 = (3 x c1) / (8 x 1,28 x 0,087)
c6 = (3 / (8 x 0.087 x 1.28)) x sqrt (c2^2 + (c1 x 0.01 / 1.28)^2 + (c1 x 0.008 / 0.087) ^ 2)
c7 = (3 x c3) / (8 x 1,28 x 0,087)
c8 = (3 / (8 x 0.087 x c4)) x sqrt (c4^2 + (c3 x 0.01 / 1.28)^2 + (c3 x 0.008 / 0.087)^2)
- Cree una nueva tabla en el software de análisis haciendo clic en la pestaña Archivo . Determine 10 columnas diferentes (de c0 a c9) para los siguientes parámetros: frecuencias angulares utilizadas (rad/s): c0; K' (pN/μm) valores obtenidos para cada frecuencia angular: c1; ErrK': c2; K" (pN/μm) valores obtenidos para cada frecuencia angular: c3; ErrK": c4; Valores G'(Pa) obtenidos para cada frecuencia angular: c5; ErrG': c6; G" (Pa) valores obtenidos para cada frecuencia angular: c7; ErrG": c8 y Ff con su respectivo error: c9 (Figura 8). Utilice la fórmula siguiente para rellenar las columnas siguientes:
- Trazando la curva G' (ω) versus G" (ω)
- Para generar la curva G' (ω) versus G" (ω) en el software de análisis, utilice los datos de la tabla anterior. Haga clic en Galería > Lineal y elija el formato Diagrama de dispersión.
- Se abrirá una nueva ventana. Seleccione la columna G " como eje x y la columna G' como eje y. Finalmente, haga clic en el botón Trazar para obtener el gráfico.
- Para agregar las barras de error en el gráfico, haga clic en la ventana Trazado y, a continuación, haga clic en Trazar > barras de error. Se abrirá una nueva ventana. Primero, marque la opción Y Err . Se abrirá otra ventana, llamada Configuración de la barra de errores .
- Haga clic en % de valor, seleccione Columna de datos y, a continuación, haga clic en la columna ErrG'. Finalmente, haga clic en Aceptar > Trazar, aparecerán las barras de error para los valores y. Repita el mismo procedimiento para los valores del eje x seleccionando ahora el cuadrado X Err y la columna correcta para el ErrG". La gráfica final será similar a la que se muestra en la Figura 9.
- Ajuste de los parámetros al modelo de reología vítrea suave
NOTA: El análisis de los datos se divide en dos partes: 1) curva que ajusta la gráfica G' (ω) versus G" (ω) para obtener los parámetros Γ y Gm; 2) ajuste de curva G' (ω) y G" (ω) en función de la frecuencia ω, para obtener el exponente de la ley de potencia α.- Curva que ajusta la gráfica G' (ω) versus G" (ω) para obtener los parámetros Γ y Gm.
- Haga clic en la pestaña Ajuste de curva , seleccione Ajustar1. Se abrirá una nueva ventana. Seleccione el cuadrado y haga clic en el botón Definir . Aparecerá una ventana llamada definición general de ajuste de curva. Escriba la siguiente ecuación:
m1 + m0/m2
donde m1 = 61,576; m2 = 1, con error admisible de 1 x 10-5. Aquí m0 representa G", m1 representa G m y m2 representa Γ.
NOTA: Para m1 y m2 es necesario estimar sus respectivos valores durante la definición del ajuste de la curva. Las estimaciones anteriores se basaron en el experimento de ejemplo mostrado. En los experimentos, estime los números de acuerdo con los valores observados en la gráfica. - Haga clic en el botón Aceptar en ambas ventanas y aparecerá el accesorio, como se muestra en la Figura 10 : una curva negra. Compruebe los valores correctos para m1 y m2, que aparecen en la tabla de ajuste de curvas que apareció con el gráfico.
- Haga clic en la pestaña Ajuste de curva , seleccione Ajustar1. Se abrirá una nueva ventana. Seleccione el cuadrado y haga clic en el botón Definir . Aparecerá una ventana llamada definición general de ajuste de curva. Escriba la siguiente ecuación:
- Ajuste de curva G ' y G" en función de la frecuencia angular ω
- A continuación, cree otras dos gráficas, a saber, G' en función de ω y G' en función de ω. Coloque las barras de error solo en el eje y, como se demostró anteriormente.
- Repita el procedimiento de ajuste de curva, pero ahora en Selecciones de ajuste de curva, seleccione la opción G" y, a continuación, en Ajuste general > definición de curva, escriba la siguiente ecuación:
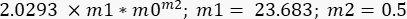
En este caso, m1 se estimó como el valor de G" (ω) = 23,683 Pa, cuando ω = 6,3 rad/s; m2 se estimó en 0,5 (recuerde que m2 es el exponente α y varía entre 0 y 1). Inserte el valor para Γ = 2.0293, de acuerdo con el resultado de m2 en la Figura 10. - Marque la opción Datos de peso. Después de todos estos procedimientos, haga clic en Aceptar y aparecerá una curva similar a la de la Figura 11: aparecerá una curva azul. Aparecerán los valores para α , α = 0,63 ± 0,02 y G 0, G 0 = (3,7 ± 0,3)Pa. Utilice estos valores para ajustarse a la siguiente curva, G' (ω).
- Haga clic en la siguiente curva, repita el procedimiento de ajuste de curva, pero ahora en la definición de curva de ajuste general, escriba la siguiente ecuación:

En este caso, m3 es solo un valor estimado de α para confirmar el valor obtenido previamente. Utilice los valores para G 0 = 3,703 y G' (ω) = 23,683 Pa cuando ω = 6,3 rad/s. - Nuevamente, agregue 1 x 10-5 como error permitido y marque la opción Datos de peso. Después de todos estos procedimientos, haga clic en Aceptar y aparecerá una curva similar a la de la Figura 11 : aparecerá una curva verde.
- Curva que ajusta la gráfica G' (ω) versus G" (ω) para obtener los parámetros Γ y Gm.
Resultados
La Figura 1 representa los esquemas del sistema OT utilizado para las mediciones reológicas. La figura 2 muestra los esquemas del experimento de microrreología con ambas esferas y también se muestra un RBC representativo. La Figura 3 muestra una curva típica para las amplitudes de ambas esferas en función del tiempo cuando los movimientos sinusoidales son producidos por la etapa piezoeléctrica. Mientras que la esfera de referencia (Figura 3 - curva roja) oscila siguiendo el movimiento de la etapa, la esfera RBC (Figura 3 - una curva azul) oscila con una amplitud y fase diferentes. Al medir estos parámetros, es posible determinar la constante elástica compleja K* (ω) para diferentes glóbulos rojos en la muestra. La figura 4 muestra una gráfica típica para la constante elástica de almacenamiento K' (ω) en función de la constante elástica de pérdida K" (ω). La dependencia lineal observada demuestra que la superficie RBC puede considerarse un material vítreo blando. A continuación, para obtener el factor de forma celular general, Ff, es necesario un procedimiento de DM y la Figura 5, la Figura 6 y la Figura 7 incluyen algunos de los pasos requeridos para el propósito. Luego, para convertir las fuerzas y deformaciones en tensiones y detensiones, es necesario convertir K* (ω) en G* (ω).
La constante elástica compleja de glóbulos rojos se define como K* (ω) = K' (ω) + iK" (ω). Además, K* (ω) está relacionado con el módulo de corte del complejo RBC G* (ω) = G' (ω) + iG" (ω). G' (ω) y G" (ω) son los módulos de almacenamiento y pérdida de cizallamiento de glóbulos rojos, respectivamente. La relación entre K* (ω) y G* (ω) viene dada por:
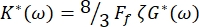
donde Ff es un factor de forma que depende de la geometría RBC, como se mencionó anteriormente, y ζ es el espesor de la membrana RBC, previamente determinado como ζ = (0.087 ± 0.009)μm 8,15.
Además, los módulos de corte de pérdida de almacenamiento G' (ω) y G" (ω) están relacionados, respectivamente, con las constantes elásticas de almacenamiento K' (ω) y pérdida K" (ω) a través de las ecuaciones 8,9
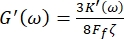 y
y 
Para encontrar los errores estándar para G' (ω) y G" (ω), Err G' y Err G", respectivamente, use las ecuaciones de propagación de incertidumbres con los resultados de K' (ω) y K" (ω), de acuerdo con las siguientes ecuaciones 8,9:
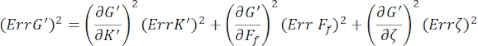
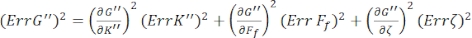 .
.
De acuerdo con la teoría de la reología vítrea blanda, los glóbulos rojos se comportan como materiales viscoelásticos como emulsiones, pastas y lodos 8,9 y sus módulos de almacenamiento y pérdida obedecen a las siguientes ecuaciones:
Así, , donde G m es el módulo de corte de la membrana celular, G 0 es el módulo de almacenamiento de baja frecuencia, Γ es la relación  , α es el exponente de la ley de potencia del modelo de reología vítrea blanda, y ω0 = 1 rad/s 8,9.
, α es el exponente de la ley de potencia del modelo de reología vítrea blanda, y ω0 = 1 rad/s 8,9. 
Se utilizaron los valores encontrados para F f y también el espesor superficial de la ζ de RBC (estimado en 87 ± 8 nm 8,9,15). Los resultados se muestran en la Figura 8, Figura 9 y Figura 10. Una vez más, la dependencia lineal entre G' y G" está en línea con la hipótesis de que las superficies RBC se pueden modelar como materiales vidriosos blandos. Además, a partir del ajuste lineal de esta gráfica, se puede obtener el valor de G m, y al introducir este valor en el ajuste de la curva de reología vítrea suave de G", se determinan los valores de G0 y α (Figura 11 - una curva azul). Además, después de usar el resultado obtenido para G 0 y agregarlo al ajuste de la curva de reología vítrea suave de G', se deriva el mismo valor para el exponente, dentro de las barras de error (Figura 11 - una curva verde).

Figura 1: Representación esquemática del microscopio OT. Todo el sistema está construido sobre una mesa antivibración. El láser se alinea utilizando al menos dos espejos dicroicos diferentes (blanco) y se dirige a la entrada posterior de la lente del objetivo del microscopio utilizando otro espejo dicroico (azul claro). También es necesario un escenario piezoeléctrico y una cámara científica digital conectada a una computadora. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Esquemas del experimento de microrreología. La esfera de referencia (gris oscuro) está unida al cubreobjetos y la esfera RBC (azul) está unida a la superficie del eritrocitos (rojo) y atrapada por el OT (indicado por triángulos de melocotón cuando el láser está encendido). ρ es la posición de equilibrio de la esfera RBC en la trampa; ξ es el movimiento sinusoidal de la muestra y x es la deformación celular. La imagen esquemática fue creada en Biorender. Haga clic aquí para ver una versión más grande de esta figura.
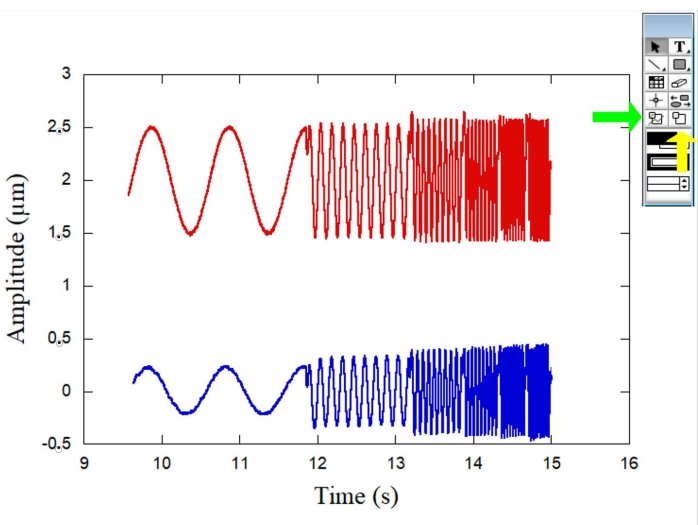
Figura 3: Gráfico que ilustra las amplitudes (μm) de ambas esferas a lo largo del tiempo (s) cuando los movimientos sinusoidales son producidos por la etapa piezoeléctrica. La esfera de referencia (curva roja) oscila siguiendo el movimiento de la etapa, mientras que la esfera RBC (curva azul) oscila con una amplitud y fase diferentes. La flecha verde de la derecha indica la herramienta de selección de datos, mientras que la flecha amarilla indica la herramienta de selección de zoom. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Resultados de microrreología de glóbulos rojos. Almacenar constante elástica en función de la constante elástica de pérdida para diferentes glóbulos rojos en la muestra (n = 10 celdas diferentes de tres muestras diferentes). Los puntos de datos representan los valores medios de K ' (eje y) y K" (eje x) con sus respectivas barras de error (error estándar de media), obtenidos para cada frecuencia angular utilizada en la configuración experimental. Haga clic aquí para ver una versión más grande de esta figura.
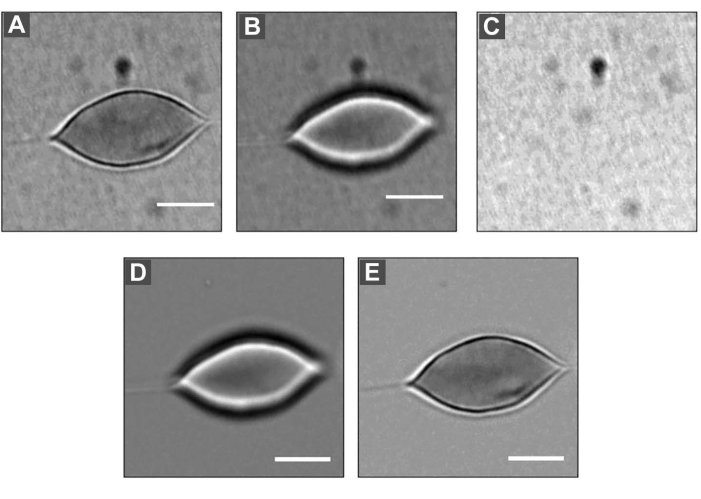
Figura 5: DM aplicado a un RBC . (A) Imagen desenfocada, tamaño = 2 μm. (B) Imagen enfocada. (C) Imagen de fondo. Dividiendo cada imagen (A) y (B) por la imagen de fondo (C), y luego multiplicando por el valor gris promedio de cada imagen, es posible obtener imágenes (D) y (E). Barra de escala: 5 μm. Haga clic aquí para ver una versión más grande de esta figura.
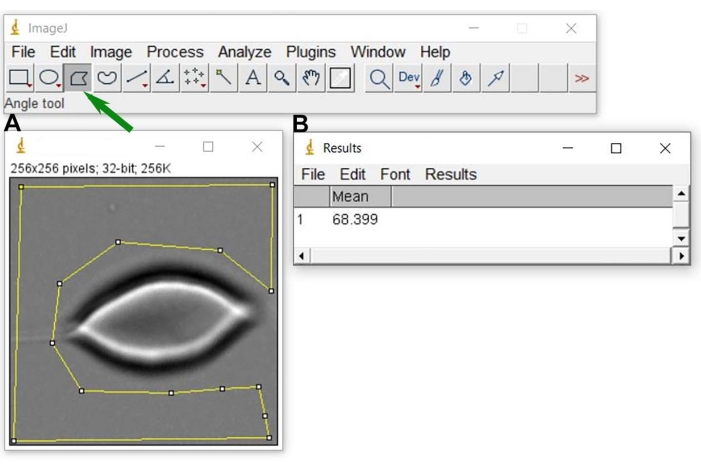
Figura 6: Fondo gris nivel N0. Después de abrir la imagen representativa en ImageJ (A), seleccione una región (figura geométrica amarilla alrededor de la celda RBC) utilizada para obtener el valor medio del nivel de gris de fondo y el resultado (B). Para realizar la selección amarilla en A, utilice la herramienta de selección de polígonos de la imagen J (indicada con una flecha verde). Haga clic aquí para ver una versión más grande de esta figura.
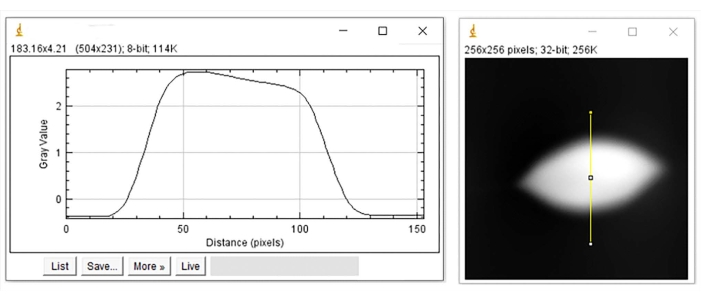
Figura 7: Perfil de altura para el RBC deformado. Perfil de altura (izquierda) representado a lo largo de la línea amarilla vertical de la imagen (derecha). Haga clic aquí para ver una versión más grande de esta figura.
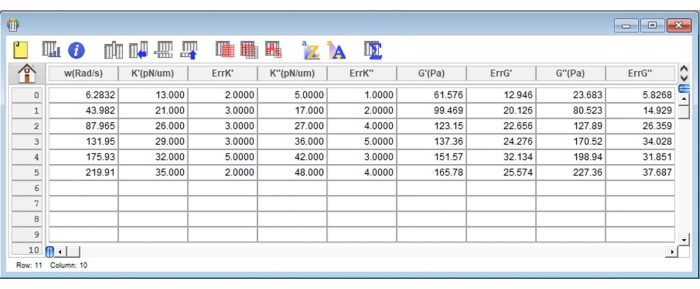
Figura 8: Captura de pantalla representativa de una tabla típica de resultados en el software de análisis. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Parámetros viscoelásticos de RBC. Almacenar el módulo de cizallamiento en función del módulo de corte de pérdida para diferentes glóbulos rojos en la muestra (n = 10 celdas diferentes de tres muestras diferentes). Los puntos de datos representan los valores medios de G' (eje y) y G" (eje x), con sus respectivas barras de error (error estándar de media), obtenidos para cada frecuencia angular utilizada en los experimentos. Haga clic aquí para ver una versión más grande de esta figura.
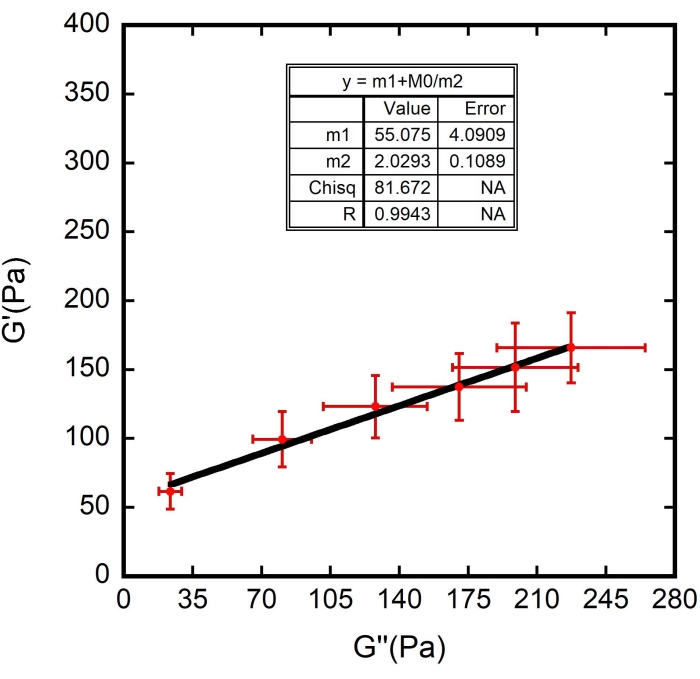
Figura 10: Ajuste de la curva de G ' (Pa) en función de G" (Pa). La línea negra lineal es la curva ajustada a los puntos de datos. N = 10 células diferentes de tres muestras diferentes. Las barras de error representan el error estándar de media. Haga clic aquí para ver una versión más grande de esta figura.
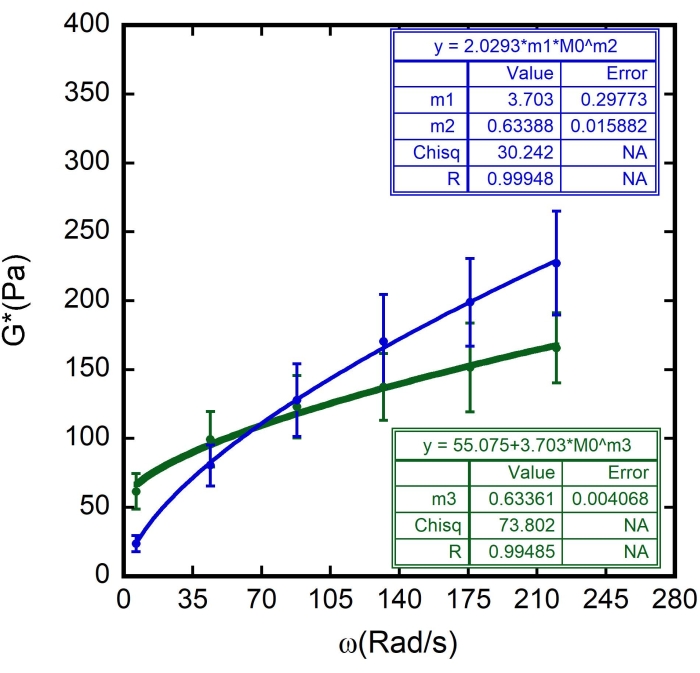
Figura 11: Ajuste del modelo de reología vítrea suave a los resultados. El módulo de corte complejo (G*) en función de la frecuencia angular ω para diferentes glóbulos rojos en la muestra. Los círculos verdes en la gráfica representan los valores medios de G', mientras que los círculos azules representan los valores medios de G", trazados con sus respectivas barras de error. Las líneas continuas verdes y azules representan los accesorios de curva para el modelo de reología vítrea suave. Los parámetros m 1, m 2 y m3 se indican en la gráfica. Mientras que m 1 es G0, m 2 y m3 son el exponente, α. N = 10 celdas diferentes de tres muestras diferentes. Las barras de error representan el error estándar de media. Haga clic aquí para ver una versión más grande de esta figura.
Expediente complementario 1: ImageJ plugin DivideQ2.class. Haga clic aquí para descargar este archivo.
Expediente complementario 2: ImageJ personalizó la macro para obtener el factor de forma. Haga clic aquí para descargar este archivo.
Discusión
En este protocolo, se presenta un método integrado basado en pinzas ópticas y microscopía de desenfoque para mapear cuantitativamente las propiedades viscoelásticas de los glóbulos rojos. Se determinan los resultados para los módulos de almacenamiento y pérdida de cizallamiento, junto con el exponente de escala que caracteriza la reología vítrea suave de los glóbulos rojos. Ya se ha llevado a cabo la aplicación de este protocolo para diferentes condiciones experimentales, como en la situación fisiológica8 o a lo largo de cada etapa del ciclo intraeritrocítico9 de P. falciparum.
Las referencias en la literatura apuntan a discrepancias en la reología de los glóbulos rojos, parcialmente atribuidas a cambios en la morfología celular no tomados en cuenta adecuadamente durante las mediciones 6,7. Utilizando la dispersión dinámica de la luz, se informaron valores para los módulos de almacenamiento y pérdida de glóbulos rojos que oscilaron entre 0,01-1 Pa, en el rango de frecuencia de 1-100 Hz6. En otro estudio, utilizando citometría óptica magnética de torsión, se determinó el módulo elástico complejo aparente7, pero divergió de los valores dinámicos de dispersión de la luz; Por lo tanto, se utilizó un factor multiplicativo de 84 para fines comparativos. Siguiendo los procedimientos descritos en el presente protocolo, estas diferencias fueron aclaradas8 mediante la caracterización del factor de forma RBC utilizando una técnica de microscopía desenfocada no invasiva11,12,13. El módulo de cizallamiento complejo, que caracteriza las superficies celulares, sólo puede obtenerse si la geometría se considera16,17 y esto no siempre se realizó correctamente.
La metodología integrada presentada en este protocolo permite realizar ambos métodos (medición OT y medición DM) para la misma celda única, uno tras otro. También permite realizar mediciones de OT para diferentes células en una población, y luego realizar mediciones de DM para otras células en la misma población celular. La última opción probablemente introducirá más variabilidad en ambos resultados, pero los errores se pueden propagar en consecuencia, de tal manera que los resultados correlacionarán la morfología general de los glóbulos rojos con las propiedades viscoelásticas generales de los glóbulos rojos en una población dada de células correspondientes a una condición experimental particular.
La principal limitación para ejecutar este protocolo es la dificultad intrínseca para realizar el método en sí, ya que es una integración de pinzas ópticas y microscopía de desenfoque; Por lo tanto, la disponibilidad de instrumentos para realizar todos los pasos descritos puede ser un desafío. Sin embargo, si uno tiene acceso a una instalación de OT, es mucho más factible adaptar eventualmente la instalación para realizar los experimentos. Ahí es donde encaja el protocolo actual, no solo detallando cada paso para realizar las mediciones y el análisis, sino también ayudando a las personas a identificar y adoptar estos sistemas OT en lugar de crear una configuración desde cero.
Además, la fijación de glóbulos rojos a los cubreobjetos se convierte en un factor limitante, ya que son células no adherentes y tales pasos pueden introducir dificultades en las mediciones, ya que algunos glóbulos rojos pueden separarse. Por lo tanto, es importante elegir un RBC bien adherido. Una forma de verificar si la elección fue exitosa puede ocurrir en el momento de preparar la muestra para la medición. Después de colocar la esfera RBC atrapada en OT en la superficie de la célula, mueva ligeramente la muestra para asegurarse de que la celda esté firmemente fijada y no haya cambiado de posición después de la cuenta atrapada en OT. Si es así, busque otra celda en la muestra. También se pueden realizar mejoras futuras, como el uso de OT de doble haz para atrapar simultáneamente el RBC y realizar las mediciones reológicas al mismo tiempo.
Aparte de eso, la posibilidad de extraer información viscoelástica cuantitativa basada en células individuales de glóbulos rojos permite una variedad de aplicaciones que apenas están comenzando a explorarse 8,9. Por lo tanto, el método presentado puede extenderse a la caracterización del comportamiento mecánico de los glóbulos rojos en otras condiciones fisiopatológicas como la anemia por deficiencia de hierro y la diabetes o en enfermedades genéticas de la sangre como la enfermedad de células falciformes y la talasemia, por ejemplo. Tal herramienta integrada puede proporcionar la base para el desarrollo de nuevos métodos de diagnóstico capaces de correlacionar los cambios en las propiedades viscoelásticas de los glóbulos rojos con modificaciones en el flujo sanguíneo de individuos con diferentes patologías.
Divulgaciones
Los autores no tienen intereses financieros en los productos descritos en este manuscrito y no tienen nada más que revelar.
Agradecimientos
Los autores desean agradecer a todos los miembros de la instalación de microscopía avanzada CENABIO por su importante ayuda. Este trabajo fue apoyado por las agencias brasileñas Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - Código Financiero 001, Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ) e Instituto Nacional de Ciência e Tecnologia de Fluidos Complexos (INCT-FCx) junto con Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP). B.P. fue apoyado por una subvención JCNE de FAPERJ.
Materiales
| Name | Company | Catalog Number | Comments |
| 35mm culture dishes | Corning | 430165 | |
| Bovine serum albumin | Sigma-Aldrich | A9418 | |
| Coverslips | Knittel Glass | VD12460Y1A.01 and VD12432Y1A.01 | |
| Glass-bottom dishes | MatTek Life Sciences | P35G-0-10-C | |
| Glucose | Sigma-Aldrich | G7021 | |
| ImageJ | NIH | https://imagej.nih.gov/ij/ | |
| Immersion oil | Nikon | MXA22165 | |
| Inverted microscope | Nikon | Eclipse TE300 | |
| KaleidaGraph | Synergy Software | https://www.synergy.com/ | |
| KCl | Sigma-Aldrich | P5405 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Microscope camera | Hamamatsu | C11440-10C | |
| Na2HPO4 | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S5886 | |
| Neubauer chamber | Sigma-Aldrich | BR717805-1EA | |
| Objective lens | Nikon | PLAN APO 100X 1.4 NA DIC H; PLAN APO 60x 1.4 NA DIC H and Plan APO 10x XXNA PH2 | |
| Optical table | Thorlabs | T1020CK | |
| OT laser | IPG Photonics | YLR-5-1064-LP | |
| Polystyrene microspheres | Polysciences | 17134-15 | |
| rubber ring | Forever Seals | NBR O-Ring | |
| Silicone grease | Dow Corning | Z273554 | |
| Stage positioning | PI | P-545.3R8S | |
| Pipette | Gilson | P1000 |
Referencias
- Fowler, V. M. The human erythrocyte plasma membrane: a Rosetta Stone for decoding membrane-cytoskeleton structure. Current Topics in Membranes. 72, 39-88 (2013).
- Tomaiuolo, G. Biomechanical properties of red blood cells in health and disease towards microfluidics. Biomicrofluidics. 8 (5), 051501 (2014).
- Depond, M., Henry, B., Buffet, P., Ndour, P. A. Methods to investigate the deformability of RBC during malaria. Frontiers in Physiology. 10, 1613 (2019).
- Boal, D. . Mechanics of the Cell. 2 edn. , (2012).
- Balland, M., et al. Power laws in microrheology experiments on living cells: Comparative analysis and modeling. Physical Review E. 74 (2), 021911 (2006).
- Amin, M. S., et al. Microrheology of red blood cell membranes using dynamic scattering microscopy. Optics Express. 15 (25), 17001-17009 (2007).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. American Journal of Physiology Cell Physiology. 293 (2), 597-605 (2007).
- Gomez, F., et al. Effect of cell geometry in the evaluation of erythrocyte viscoelastic properties. Physical Review E. 101 (6-1), 062403 (2020).
- Gomez, F., et al. Plasmodium falciparum maturation across the intra-erythrocytic cycle shifts the soft glassy viscoelastic properties of red blood cells from a liquid-like towards a solid-like behavior. Experimental Cell Research. 397 (2), 112370 (2020).
- Pompeu, P., et al. Protocol to measure the membrane tension and bending modulus of cells using optical tweezers and scanning electron microscopy. STAR Protocols. 2 (1), 100283 (2021).
- Agero, U., Mesquita, L. G., Neves, B. R., Gazzinelli, R. T., Mesquita, O. N. Defocusing microscopy. Microscopy Research and Technique. 65 (3), 159-165 (2004).
- Agero, U., Monken, C. H., Ropert, C., Gazzinelli, R. T., Mesquita, O. N. Cell surface fluctuations studied with defocusing microscopy. Physical Review E. 67 (5), 051904 (2003).
- Roma, P. M. S., Siman, L., Amaral, F. T., Agero, U., Mesquita, O. N. Total three-dimensional imaging of phase objects using defocusing microscopy: Application to red blood cells. Applied Physics Letters. 104 (25), 251107 (2014).
- Köhler, A. New method of illumination for photomicrographical purposes. Journal of the Royal Microscopical Society. 14, 261-262 (1894).
- Nans, A., Mohandas, N., Stokes, D. L. Native ultrastructure of the red cell cytoskeleton by cryo-electron tomography. Biophysical Journal. 101 (10), 2341-2350 (2011).
- Ayala, Y. A., et al. Rheological properties of cells measured by optical tweezers. BMC Biophysics. 9, 5 (2016).
- Ayala, Y. A., et al. Effects of cytoskeletal drugs on actin cortex elasticity. Experimental Cell Research. 351 (2), 173-181 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados