Method Article
Quantitative Analyse der viskoelastischen Eigenschaften roter Blutkörperchen mittels optischer Pinzette und Defokussierungsmikroskopie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier wird ein integriertes Protokoll beschrieben, das auf einer optischen Pinzette und Defokussierungsmikroskopie basiert, um die rheologischen Eigenschaften von Zellen zu messen. Dieses Protokoll ist breit anwendbar bei der Untersuchung der viskoelastischen Eigenschaften von Erythrozyten unter variablen physiopathologischen Bedingungen.
Zusammenfassung
Die viskoelastischen Eigenschaften von Erythrozyten wurden mit einer Reihe von Techniken untersucht. Die berichteten experimentellen Daten variieren jedoch. Dies wird nicht nur auf die normale Variabilität der Zellen zurückgeführt, sondern auch auf die Unterschiede in den Methoden und Modellen der Zellantwort. Hier wird ein integriertes Protokoll mit optischer Pinzette und Defokussierungsmikroskopie verwendet, um die rheologischen Eigenschaften roter Blutkörperchen im Frequenzbereich von 1 Hz bis 35 Hz zu erhalten. Während optische Pinzetten verwendet werden, um die elastische Konstante des Erythrozytenkomplexes zu messen, ist die Defokussierungsmikroskopie in der Lage, das Zellhöhenprofil, das Volumen und den Formfaktor zu ermitteln, einen Parameter, der die Umwandlung der komplexen elastischen Konstante in einen komplexen Schermodul ermöglicht. Darüber hinaus kann durch Anwendung eines Weichglas-Rheologiemodells der Skalierungsexponent für beide Module erhalten werden. Die entwickelte Methodik ermöglicht es, das mechanische Verhalten roter Blutkörperchen zu untersuchen und ihre viskoelastischen Parameter zu charakterisieren, die unter genau definierten experimentellen Bedingungen für verschiedene physiologische und pathologische Bedingungen ermittelt wurden.
Einleitung
Reife rote Blutkörperchen (RBCs), auch Erythrozyten genannt, sind in der Lage, sich mehr als doppelt so groß auszudehnen, wenn sie die engsten Kapillaren des menschlichen Körpers passieren1. Diese Fähigkeit wird auf ihre einzigartige Fähigkeit zurückgeführt, sich bei äußeren Belastungen zu verformen.
In den letzten Jahren haben verschiedene Studien dieses Merkmal in Erythrozytenoberflächencharakterisiert 2,3. Das Gebiet der Physik, das die elastischen und viskosen Reaktionen von Materialien aufgrund äußerer Belastungen beschreibt, wird als Rheologie bezeichnet. Wenn eine äußere Kraft ausgeübt wird, hängt die resultierende Verformung im Allgemeinen von den Eigenschaften des Materials ab und kann in elastische Verformungen, die Energie speichern, oder viskose Verformungen, die Energie abführen, unterteilt werden4. Alle Zellen, einschließlich der Erythrozyten, zeigen ein viskoelastisches Verhalten; Mit anderen Worten: Energie wird sowohl gespeichert als auch abgeführt. Die viskoelastische Reaktion einer Zelle kann somit durch ihren komplexen Schermodul G*(ω) = G'(ω) + iG"(ω) charakterisiert werden, wobei G' (ω) der Speichermodul ist, bezogen auf das elastische Verhalten, und G" (ω) der Verlustmodul, bezogen auf ihre Viskosität4. Darüber hinaus wurden phänomenologische Modelle verwendet, um Zellantworten zu beschreiben, eines der am häufigsten verwendeten ist das weiche Glasrheologiemodell5, das durch eine Potenzgesetzabhängigkeit des komplexen Schermoduls mit der Lastfrequenz gekennzeichnet ist.
Einzelzellbasierte Methoden wurden verwendet, um die viskoelastischen Eigenschaften von Erythrozyten zu charakterisieren, indem Kraft aufgebracht und die Verschiebung in Abhängigkeit von der Nutzlast gemessen wurde 2,3. Für den komplexen Schubmodul finden sich in der Literatur jedoch nur wenige Ergebnisse. Mit Hilfe der dynamischen Lichtstreuung wurden Werte für die Erythrozytenspeicherung und die Verlustmodule im Frequenzbereich von 1-100 Hz6 berichtet, die zwischen 0,01 und 1 Pa lagen. Mit Hilfe der optischen magnetischen Verdrillungszytometrie wurde ein scheinbarer komplexer Elastizitätsmodul7 erhalten, und zu Vergleichszwecken wurde ein multiplikativer Faktor beansprucht, um die Diskrepanzen möglicherweise zu klären.
In jüngerer Zeit wurde eine neue Methodik entwickelt, die auf einer optischen Pinzette (OT) zusammen mit der Defokussierungsmikroskopie (DM) als integriertes Werkzeug zur quantitativen Kartierung der Speicherung und des Verlusts von Schermodulen menschlicher Erythrozyten über zeitabhängige Belastungen basiert 8,9. Darüber hinaus wurde ein weiches, glasartiges Rheologiemodell verwendet, um die Ergebnisse anzupassen und einen Potenzgesetzkoeffizienten zu erhalten, der die Erythrozyten charakterisiert 8,9.
Insgesamt klärt die entwickelte Methodik8,9, deren Protokoll im Folgenden ausführlich beschrieben wird, bisherige Diskrepanzen durch die Verwendung der Messwerte für den Formfaktor Ff, der Kräfte und Verformungen mit Spannungen und Dehnungen in der Erythrozytenoberfläche in Beziehung setzt und als neuartiges diagnostisches Verfahren verwendet werden kann, das in der Lage ist, die viskoelastischen Parameter und weichglasigen Merkmale von Erythrozyten quantitativ zu bestimmen, die von Personen mit unterschiedlichem Blut erhalten wurden Pathologien. Eine solche Charakterisierung unter Verwendung des unten beschriebenen Protokolls könnte neue Möglichkeiten eröffnen, das Verhalten von Erythrozyten aus mechanobiologischer Sicht zu verstehen.
Protokoll
Menschliche Blutproben wurden von erwachsenen Männern und Frauen gemäß den von der Forschungsethikkommission der Bundesuniversität von Rio de Janeiro genehmigten Protokollen (Protokoll 2.889.952) zur Verfügung gestellt und auf der brasilianischen Plattform unter der CAAE-Nummer 88140418.5.0000.5699 registriert. Allen Freiwilligen wurde eine schriftliche Einverständniserklärung erteilt und von ihnen eingeholt. Personen mit einer Hämoglobinopathie und/oder der Einnahme kontrollierter Medikamente wurden ausgeschlossen. Der gesamte Prozess folgte den Richtlinien, die von der Ethikkommission des Instituts genehmigt wurden.
1. Vorbereitung der Probenhalter
- Besorgen Sie sich zwei Deckgläser (24 mm x 60 mm und 24 mm x 32 mm; Dicke = 0,13-0,17 mm) und einen Gummiring (Durchmesser = 10 mm; Dicke = 2 mm) für jeden Probenhalter.
- Gießen Sie Silikonfett so über die Oberfläche des Gummirings, dass es den gesamten Umfang abdeckt.
- Legen Sie den Gummiring mit der Fettseite zum Deckglas auf das Deckglas. Warten Sie 5 Minuten auf die ordnungsgemäße Befestigung, dann sind die Probenhalter bereit, die Zellkultur zu erhalten.
HINWEIS: Darüber hinaus können auch handelsübliche oder selbstgemachte Glasbodenschalen verwendet werden, wie zuvor beschrieben10.
2. Zellkultur
HINWEIS: Die folgenden Schritte beschreiben, wie Sie gesunde Erythrozyten aus menschlichem Blut gewinnen. Wichtig ist, dass die Proben vor jedem Experiment frisch aufbereitet werden.
- 20 μl Blut werden in 250 μl 1x Phosphatpuffer-Kochsalzlösung (PBS) mit 137 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mMKH2PO4, 10 mM Glukose verdünnt und mit 1 mg/ml Rinderserumalbumin (BSA) ergänzt.
- Nach der Zentrifugation bei 200 x g für 2 min bei Raumtemperatur wird der Überstand mit einer Pipette abgesaugt und das Zellpellet in 1 ml 1x PBS/BSA-Lösung resuspendiert. Waschen Sie die Zellen 2x im Puffer.
- Berechnen Sie die Zelldichte mit einem Hämozytometer und säen Sie 50.000 bis 100.000 Zellen in den in Schritt 1 vorbereiteten Probenhalter. Warten Sie 10-15 Minuten, bis die unspezifische Zelle am Deckglas befestigt ist. Die Wartezeit wirkt sich nicht auf die Zellen aus.
- Für weitere OT-Experimente werden der Probe 0,2 μl einer 10%igen v/v-Polystyrolkugellösung (Radius = 1,52 ± 0,02 μm) zugegeben. Vergewissern Sie sich vom richtigen Mischen, indem Sie die Proben unter dem Mikroskop betrachten.
- Legen Sie nach der Aussaat der Zellen einfach das zweite Deckglas über den Gummiring (es ist nicht erforderlich, Fett für die Befestigung hinzuzufügen), schließen Sie die Einrichtung und beenden Sie die Probenvorbereitung. Die Proben sind bereit für die mikroskopische Analyse und Manipulation.
3. Einrichtung des optischen Pinzettenmikroskops
HINWEIS: OT sind Werkzeuge, die einen hochfokussierten Laserstrahl verwenden, um mikroskopisch kleine Objekte einzufangen und Kräfte im Piconewton-Bereich und Verschiebungen im Nanometerbereich zu messen. Der verwendete OT-Laser (Wellenlänge 1064 nm) muss, wie zuvor beschrieben10, richtig ausgerichtet sein.
- Kurz gesagt, mit mindestens zwei Spiegeln, die durch einen Abstand von einigen Zentimetern (mindestens 10-20 cm) voneinander getrennt sind, richten Sie einen linear polarisierten Laserstrahl auf den Hintereingang eines inversen Mikroskops. Richten Sie den Laserstrahl präzise so aus, dass er in einer geraden Linie in das Mikroskop eintritt (Abbildung 1).
- Reflektieren Sie dann den Laserstrahl mit einem dichroitischen Spiegel, der im Mikroskop installiert ist, um parallel zur Achse der Objektivlinse vorzugehen und in die Linse in der Nähe der Mitte ihres Hintereingangs einzutreten. Dadurch wird der Laser fokussiert, um die optische Falle zu erzeugen (Abbildung 1).
- Um als Nächstes Kräfte mit OT zu messen, kalibrieren Sie das System, um die Trap-Steifigkeit (κOT) zu erhalten. Siehe10 für eine detailliertere Beschreibung des OT-Kalibrierungsverfahrens. Sobald κ OT gefunden ist, ist das OT-System bereit für die Rheologie-Experimente.
4. DM einrichten
HINWEIS: DM ist eine hellfeldbasierte optische Mikroskopietechnik, die es ermöglicht, transparente Objekte sichtbar zu machen, wenn das Mikroskop leicht unscharf ist11,12. Eine solche Technik wurde angewendet, um die Erythrozytenform13 zu erhalten. Das gleiche Mikroskop, das für das OT-System verwendet wird, kann auch für DM verwendet werden, um durch 3D-Rekonstruktionen ein Höhenprofil zu erhalten.
- Stellen Sie das Beleuchtungssystem des Mikroskops mit der Köhler-Beleuchtung14 ein und öffnen Sie für eine bessere Auflösung die Kondensorblende vollständig, um die Experimente durchzuführen.
- Verwenden Sie ein piezoelektrisches Positionierungssystem, um die Probe in allen Koordinaten mit nanometrischer Präzision in der z-Achse zu verschieben. Führen Sie die Autokalibrierung des piezoelektrischen Systems in allen Achsen durch. Sind alle Prozeduren durchgeführt, ist das Mikroskopsystem bereit für DM-Experimente.
5. OT-basiertes Rheologieexperiment und -analyse
HINWEIS: Das Rheologie-Experiment besteht darin, die Reaktionen der Zelle auf kleine Schwingungen unterschiedlicher Frequenzen zu beobachten.
- Experimentieren
- Mit dem OT-System fangen Sie die Kugel mit dem OT-Laser ein und befestigen sie dann an einem RBC, indem Sie die Kugel nahe der Oberseite und nahe am Zellrand gegen die Zelloberfläche drücken. Verwenden Sie für diesen Schritt das Mikroskop. Fangen Sie dann eine andere Kugel ein und wiederholen Sie den gleichen Anbringungsvorgang, aber befestigen Sie sie nun am Deckglas in der Nähe der Zelle. Die am Deckglas befestigte Kugel ist die Referenzraupe (Abbildung 2), die notwendig ist, um die Piezoverschiebung zu verfolgen und mit der RBC-Kugel zu vergleichen.
- Stellen Sie sicher, dass die gewählte Zelle gut auf dem Deckglas befestigt ist und dass die Erythrozyten- und Referenzkugeln auf der Erythrozytenoberfläche bzw. dem Deckglas haften, bevor Sie mit der Messung beginnen. Identifizieren Sie die nicht verklebten Zellen visuell, da sie sich trotz der hohen Adhäsionsrate (ca. 80%-90%) im Laufe der Zeit bewegen.
- Fügen Sie der piezoelektrischen Tischsoftware eine sinusförmige Funktion der Amplitude ξ 0 = 0,500 ± 0,001 μm und variierende Frequenzen von 1 Hz, 7 Hz, 14 Hz, 21 Hz, 28 Hz und 35 Hz mit den entsprechenden Winkelfrequenzen ω von 6,3 rad/s, 169 rad/s, 88 rad/s, 132 rad/s, 176 rad/s und 220 rad/s hinzu. Verwendung der piezoelektrischen Software, wie zuvor gezeigt 8,9.
- Drücken Sie mit dem piezoelektrischen Tisch die Starttaste, um die piezoelektrische Verschiebung zuzulassen und die RBC-Kugel in der Falle zu halten, und unterziehen Sie die Probe einem Bewegungszyklus mit der zuvor eingestellten Sinusfunktion. Verwenden Sie eine Kamera, die Bilder mit einer Geschwindigkeit von 790 Bildern/s oder höher erzeugen kann, um die Bewegung der Probe aufzuzeichnen. Eine schematische Darstellung des Experiments ist in Abbildung 2 dargestellt.
- Während die Probe sinusförmigen Bewegungen ausgesetzt ist, aktivieren Sie den OT, um die an der RBC-Oberfläche befestigte Kugel einzufangen. Unabhängig von der für die Durchführung der Experimente gewählten Temperatur ist die Raumtemperatur von 37 °C oder eine andere Temperatur sorgfältig zu überwachen, um Schwankungen während der Messungen zu vermeiden. Der Infrarotlaser (1064 nm), der zur Erzeugung der OT verwendet wird, verursacht fast keine Beschädigung oder Erwärmung der Zellen.
- Analyse
- Analysieren Sie die Bilder, die während der sinusförmigen Bewegungen mit ImageJ aufgenommen wurden, um die Position des Massenschwerpunkts jeder der Kugeln im Zeitverlauf zu ermitteln.
HINWEIS: Diese Daten ermöglichen die Erstellung von Diagrammen, die Phasen- und Amplitudenunterschiede zwischen beiden Kugeln darstellen können. Diese Informationen sind entscheidend für die viskoelastische Reaktion von Erythrozyten. - Um den Massenschwerpunkt für jede der Kugeln zu erhalten, öffnen Sie die ImageJ-Software. Importieren Sie den gesamten Film, der während der sinusförmigen Bewegungen erhalten wurde.
- Klicken Sie auf der Registerkarte Bild auf Anpassen und wählen Sie dann Schwellenwert aus. Das Schwellenwertfenster wird geöffnet. Wählen Sie S/W. Dadurch wird der Hintergrund weiß und die Kugeln schwarz.
- Passen Sie den Schwellenwert mit beiden Bildlaufleisten unter dem Histogramm so an, dass beide Kugeln mit der maximalen Anzahl von Pixeln angezeigt werden.
- Wählen Sie die Referenzkugel aus, indem Sie auf Datei > Rechteck klicken. Zeichnen Sie ein Rechteck, um die Kugel auszuwählen. Nachdem Sie die Referenzkugel in einem Bild ausgewählt haben, stellen Sie sicher, dass das Rechteck dieselbe Kugel auch in allen anderen Bildern des Films korrekt auswählt.
- Klicken Sie dann auf der Registerkarte " Analysieren " auf " Messungen festlegen " und wählen Sie die Option "Massenmittelpunkt ".
- Klicken Sie erneut auf die Registerkarte " Analysieren" und wählen Sie "Partikel analysieren". Es öffnet sich ein neues Fenster. Definieren Sie die Größe und Zirkularität (abhängig vom Kugelradius). Aktivieren Sie die folgenden Kontrollkästchen: Ergebnisse anzeigen und Ergebnisse löschen. Klicken Sie abschließend auf OK , um alle Bilder zu verarbeiten.
- Es erscheint ein neues Fenster mit einer Tabelle mit XY-Koordinaten für den Massenmittelpunkt. Speichern Sie diese Koordinatenwerte als .txt Datei. Wiederholen Sie den Vorgang für die andere Kugel, die an der RBC-Oberfläche befestigt ist.
- Um die Amplitude und die Phasenunterschiede für beide Kugeln zu erhalten, öffnen Sie die Analysesoftware. Importieren Sie die .txt zuvor erhaltenen Dateien.
- Erstellen Sie eine neue Tabelle mit drei Spalten. Addieren Sie in der ersten Spalte (c0) die Anzahl der Frames, in der zweiten Spalte (c1) die x-Koordinaten für die Referenzkugel und in der dritten Spalte (c2) die x-Koordinaten für die Kugel, die an die RBC-Oberfläche angehängt ist.
HINWEIS: Da in diesem Beispiel die sinusförmigen Bewegungen nur in der x-Achse ausgeführt wurden, müssen nur die x-Koordinaten für beide Kugeln verwendet werden. - Korrelieren Sie als Nächstes die Frames mit der Zeit. Klicken Sie auf Windows > Formeleingabe. Es öffnet sich ein neues Fenster mit dem Namen Formeleintrag. In diesem Fenster ist es möglich, acht verschiedene Gleichungen einzurichten, jede davon in einer bestimmten Tonart (von F1 bis F8).
- Wählen Sie F1 aus, und geben Sie die folgende Formel ein:
c 3 = c0 / (Kamera fps)
Klicken Sie auf Ausführen. Dadurch wird eine neue Spalte für eine bestimmte Zeit in der Tabelle erstellt (Spalte 4). - Subtrahieren Sie den x-Koordinatenwert jedes Frames von seinem jeweiligen Mittelwert. Legen Sie dazu zwei beliebige Schlüssel in der Formeleingabe fest und geben Sie für jeden Schlüssel die folgenden Gleichungen ein:
c 4 = (c 1 - Mittelwert (c 1)) und c 5 = (c 2 - Mittelwert (c2))
Klicken Sie auf die Schaltfläche Ausführen . Die Ergebnisse werden in den Spalten 5 und 6 für Referenz- bzw. RBC-Kugeln angezeigt. - Konvertieren Sie die Massenmittelpunktwerte von Pixeln in Mikrometer. Verwenden Sie dazu eine andere Taste auf dem Formeleintrag und geben Sie die folgende Gleichung ein:
c 4 = c 4 / Umrechnungszahl
Wiederholen Sie den gleichen Vorgang für Spalte 5.
HINWEIS: Die Konvertierung erfolgt mit einer Mikrometer-Skala/Lineal und der Aufnahme des Bildes mit demselben Mikroskop-Setup, das für die Messungen verwendet wird (einschließlich derselben Objektivlinse). Dieses Verfahren kann während der Mikroskopkalibrierung durchgeführt werden. Auf diese Weise erhält man ein Pixel/Mikrometer-Verhältnis. - Erzeugen Sie ein Diagramm mit den Massenschwerpunkten beider Kugeln auf der y-Achse und der Zeit auf der x-Achse. Klicken Sie dazu auf Galerie > Linear und Scatter. Es öffnet sich ein neues Fenster. Wählen Sie die Zeitspalte für die x-Achse und auf der y-Achse die Spalten des Massenschwerpunkts in Mikrometern für Referenz- und RBC-Kugeln aus.
- Wählen Sie im Diagramm nur die Daten aus, die sich auf die erste Kreisfrequenz (6,3 rad/s) beziehen. Verwenden Sie die in Abbildung 3 angegebenen Werkzeuge.
- Definieren Sie die Gleichung, mit der die Datenkurve für die Referenzkugel angepasst wird. Klicken Sie dazu auf Curve Fit > General und Fit1, wählen Sie das Kästchen mit den Daten aus, die sich auf die Position der Referenzkugel beziehen, und klicken Sie dann auf Definieren. Es öffnet sich ein neues Fenster, in dem Sie die Gleichung definieren können. Die Position ξ(t) der Referenzkugel wird beschrieben durch:
ξ(t) = ξ0cos(ωt)
wobei ξ die sinusförmige Bewegung der Probe, ω die Kreisfrequenz und t die Zeit in s ist. Wenn Sie diese Gleichung auf die Analysesoftware übertragen, sieht sie wie folgt aus: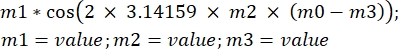 , wobei m1 ξ, m2 f, m0 die Zeit t und m3 die Phase der Kosinusfunktion für t = 0 ist.
, wobei m1 ξ, m2 f, m0 die Zeit t und m3 die Phase der Kosinusfunktion für t = 0 ist. - Schätzen Sie die Werte für m1, m2 und m3 aus dem Diagramm. Nachdem Sie die Gleichung definiert haben, klicken Sie auf OK. Die Daten werden basierend auf der Gleichung angepasst, und im Diagramm wird eine Kurve zusammen mit einem kleinen Quadrat mit den Werten von m1, m2 und m3 angezeigt.
- Definieren Sie die Gleichung, mit der die Datenkurve für die RBC-Kugel angepasst wird. Klicken Sie dazu auf Curve Fit > General und definieren Sie die Gleichung, mit der die Kurve für die Daten angepasst wird. Die Position ρ(t) der RBC-Kugel ist gegeben durch:
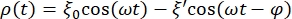
wobei ξ' die Phasenverschiebungsamplitude und φ der Phasenverschiebungswinkel ist. Wenn Sie diese Formel in die Analysesoftware übertragen, sieht sie wie folgt aus: , wobei m1, m2 und m3 die Werte sind, die in der Kurvenanpassung der Referenzkugel erhalten werden. m4 ist ξ' und m5 ist φ.
, wobei m1, m2 und m3 die Werte sind, die in der Kurvenanpassung der Referenzkugel erhalten werden. m4 ist ξ' und m5 ist φ. - Schätzen Sie die Werte für m4 und m5 aus dem Diagramm. Nachdem Sie die Formel definiert haben, klicken Sie auf OK. Die Daten werden basierend auf der Gleichung angepasst, und im Diagramm wird eine Kurve zusammen mit einem kleinen Quadrat mit den Werten von m4 und m5 angezeigt.
- Erstellen Sie als Nächstes eine neue Tabelle, um die aus der Kurvenanpassung erhaltenen Daten in den entsprechenden Spalten hinzuzufügen. Definieren Sie fünf verschiedene Spalten für die folgenden Parameter: Drehfrequenz, Amplitude (Referenzkugel), Anfangszeit, Amplitude (RBC-Kugel) und Phasenaußenwinkel. Führen Sie die gleiche Prozedur für alle anderen Frequenzen durch.
- Verwenden Sie die folgenden Gleichungen, um die Speicher- (K') und Verlustkonstanten (K") zu ermitteln:

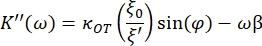
wobei κOT die elastische OT-Konstante und β der Stokes-Luftwiderstandsbeiwert ist. Wenn Sie die Gleichungen in die Analysesoftware übertragen, sieht es wie folgt aus: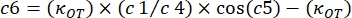 und
und
 , wobei β und κOT durch die im System gefundenen Werte ersetzt werden müssen.
, wobei β und κOT durch die im System gefundenen Werte ersetzt werden müssen. - Stellen Sie die Ergebnisse in einem Diagramm dar, wobei Sie die x-Achse für K " und die y-Achse für K' verwenden (Abbildung 4).
- Analysieren Sie die Bilder, die während der sinusförmigen Bewegungen mit ImageJ aufgenommen wurden, um die Position des Massenschwerpunkts jeder der Kugeln im Zeitverlauf zu ermitteln.
6. DM-Experiment und Analyse zur Ermittlung des gesamten Zellformfaktors
- Video-Akquisition
- Bewegen Sie den piezoelektrischen Tisch mit der Software in xy-Richtung, um nach einer isolierten Zelle zu suchen, die am Deckglas befestigt ist. Fangen Sie eine Styroporkugel mit bekanntem Durchmesser ein und befestigen Sie sie an der Erythrozytenoberfläche. Bewegen Sie mit dem piezoelektrischen Tisch die eingeschlossene Perle, die ebenfalls an der RBC-Oberfläche befestigt ist, leicht, um die Zelle zu verformen, und befestigen Sie dann die Perle am Deckglas.
HINWEIS: Es ist auch möglich, dieselbe Zelle aus den OT-Messungen zu verwenden. - Ändern Sie die Position der Z-Achse, um das fokussierte Bild zu finden, bei dem sich die Fokusebene in der Mitte der ausgewählten Zelle befindet. Dieses Bild zeigt den kleineren Kontrast mit dem Grauwert in der Mitte der Zelle, der dem Grauwert außerhalb der Zelle (Hintergrund) entspricht.
- Wenn die Position festgelegt ist, erstellen Sie mit der Kamerasoftware einen Film der gesamten Zelle mit etwa 5.000 Bildern bei 8 Bit und 256 Pixel x 256 Pixel bei einer Bildrate von 25 fps. Verschieben Sie dann die Position der z-Achse um 2 μm nach unten oder oben, um ein unscharfes Bild für die ausgewählte Zelle zu erhalten. Wiederholen Sie die Parameter, um einen Film für diese Situation zu erstellen.
- Suchen Sie schließlich, ohne die Position der Z-Achse zu ändern, nach einem Bereich ohne Zellen, um den gleichen Vorgang zu wiederholen und einen Film des Bildhintergrunds zu erstellen.
- Bewegen Sie den piezoelektrischen Tisch mit der Software in xy-Richtung, um nach einer isolierten Zelle zu suchen, die am Deckglas befestigt ist. Fangen Sie eine Styroporkugel mit bekanntem Durchmesser ein und befestigen Sie sie an der Erythrozytenoberfläche. Bewegen Sie mit dem piezoelektrischen Tisch die eingeschlossene Perle, die ebenfalls an der RBC-Oberfläche befestigt ist, leicht, um die Zelle zu verformen, und befestigen Sie dann die Perle am Deckglas.
- Kontrastbildaufnahme
- Konvertieren Sie jeden der drei Filme in drei durchschnittliche Bilder. Wählen Sie mit ImageJ einen der Filme aus, klicken Sie auf Bild > Stapel > Z-Projekt und wählen Sie die Option Durchschnittliche Intensität . Wiederholen Sie diesen Vorgang für die anderen Filme, um die entsprechenden Bilder zu erhalten.
- Ändern Sie alle erhaltenen Bilder von 8-Bit auf Gleitkomma-32-Bit. Klicken Sie mit ImageJ auf Image > Type > 32-Bit. Klicken Sie dann auf Analysieren > Messungen festlegen und wählen Sie die Option Mittlerer Grauwert . Klicken Sie abschließend erneut auf Analyze > Measure.
- Klicken Sie anschließend auf Process > Image Calculator und teilen Sie das fokussierte Bild durch das Hintergrundbild. Multiplizieren Sie dazu den Mittelwert des Grauwerts des fokussierten Bildes. Ermitteln Sie den Durchschnittswert, indem Sie auf Prozess > Rechnen > Multiplizieren klicken.
- Um den Durchschnittswert zu erhalten, wählen Sie das fokussierte Bild aus und klicken Sie dann auf Analysieren > Messen. Für das repräsentative Bild liegt der Mittelwert des Grauwerts bei 69.199. Wiederholen Sie die obigen Schritte für das unscharfe Bild. In diesem Fall liegt der Durchschnittswert des Grauwerts bei 69.231. Abbildung 5 zeigt die fokussierten und defokussierten Bilder vor und nach dem Eingriff.
- Bilder können während des Betriebs an visuellem Kontrast verlieren. Um die Bilder besser zu visualisieren, klicken Sie auf Bild > Helligkeit/Kontrast anpassen > und wählen Sie die Option Auto .
- Um als Nächstes den Bildkontrast zu ermitteln, verwenden Sie die folgende Beziehung:
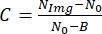 , wobei N Img der Grauwert der Zelle ist, N0 der Grauwert außerhalb der Zelle ist und ein konstanter Parameter ist, der dem Grauwert für die Lichtintensität Null entspricht, der von der Kamera abhängt.
, wobei N Img der Grauwert der Zelle ist, N0 der Grauwert außerhalb der Zelle ist und ein konstanter Parameter ist, der dem Grauwert für die Lichtintensität Null entspricht, der von der Kamera abhängt. - Um den Wert B zu ermitteln, verwenden Sie einen Leistungsmesser, um die Lichtintensität zu messen. Für jeden Wert der Lichtintensität muss ein Video aufgezeichnet werden; So können unterschiedliche Intensitätswerte mit unterschiedlichen Graustufen in Verbindung gebracht werden. Zum Schluss erhalten Sie eine lineare Anpassung und setzen B mit der Lichtintensität15 Null in Beziehung.
- Suchen Sie den Wert von N0, klicken Sie auf das Symbol Polygonauswahl und zeichnen Sie ein Polygon wie das in Abbildung 6. Klicken Sie dann auf die Registerkarte Analysieren und wählen Sie Messen , um den mittleren Grauwert für den ausgewählten Bereich zu ermitteln. Jedes Bild besteht aus einer Reihe von Pixeln und jedes Pixel hat einen bestimmten Grauwert. Die Menge aller Graustufen aufgrund aller Pixel, aus denen das Bild besteht, entspricht NImg.
- Verwenden Sie die Kontrastgleichung, um N Img - No zu bestimmen, und führen Sie diese aus, indem Sie Prozess > Mathematik > Subtrahieren auswählen. Teilen Sie das Ergebnis durch N0 - B. Finden Sie schließlich den Kontrast für das fokussierte (C 0) und defokussierte Bild (C1).
- Abrufen des Höhenprofils
- Um das Höhenprofil zu erhalten, verwenden Sie die bereits beschriebene Methode13. Kurz gesagt, verwenden Sie die Hartley-Transformation (FHT), um die Erythrozytendicke zu erhalten. Klicken Sie in ImageJ auf Process > FFT > FFT Options (FFT-Optionen verarbeiten) und wählen Sie dann FHT aus.
- Subtrahieren Sie die Bilder C0 und C1 in ImageJ mit Process > Math > Subtrahieren , um das Bild für die folgende Prozedur zu erhalten: C= C0 - C1.
- Klicken Sie für Bild C auf > FFT-> FFT-Optionen verarbeiten und wählen Sie dann FHT , um die Hartley-Transformation des Bildes durchzuführen. Teilen Sie dann durch die Ortsfrequenz q2 mit dem speziell angefertigten Plugin DivideQ2. Klicken Sie auf Plugin > DivideQ2.
HINWEIS: Die Datei DivideQ2.class muss in das Plugins-Verzeichnis kopiert werden, in dem ImageJ installiert ist. Das Plugin wird als .class Datei (Supplementary File 1) bereitgestellt, die in den Plugin-Ordner von ImageJ aufgenommen wird. - Führen Sie dann die inverse Transformation FHT mit Prozess > FFT > FFT durch, um ein Bild mit einem Grauwert zu erhalten, der proportional zur Höhe der Zelle ist.
- Klicken Sie abschließend auf Process > Math > Multiplizieren , um das resultierende Bild mit der folgenden Konstante zu multiplizieren:
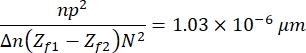
die sich aus den Eigenschaften der Bilder, der Probe und des Versuchsaufbaus13 ergibt. Dabei ist n = 1,51 der Ölbrechungsindex, p = 0,0721 μm das Verhältnis zwischen Mikrometern und Pixeln der Bilder, Δ n = 0,058 ist die Differenz zwischen dem Erythrozyten- und dem wässrigen Medium Brechungsindex, der Abstand zwischen den fokussierenden und defokussierenden Bildern (Z f1 - Z f2) = 2μm und die Größe der Bilder, N2 = 256 pxl2. - Verwenden Sie das resultierende Bild, um das Höhenprofil zu erhalten (Abbildung 7). Das resultierende Bild wird in ImageJ verwendet, um verschiedene Höhenprofile zu beobachten. Es hängt davon ab, wo in der Zelle die gelbe vertikale Linie platziert ist, z. B. wird in Abbildung 7 ein durch die vertikale Linie begrenztes Höhenprofil erhalten, beobachten Sie dies durch Drücken von Strg + K.
- Formfaktor
- Nachdem Sie das Bild gefunden haben, das das RBC-Höhenprofil enthält, verwenden Sie den defokussierten Kontrast von 2 μm, um einen Satz von zwei Bildern in ImageJ zu erstellen. Klicken Sie auf Bild > Stapel und wählen Sie dann die Option Bilder zum Stapeln. Um den Formfaktor zu finden, verwenden Sie ein benutzerdefiniertes ImageJ-Makro, um den Stapel zu analysieren. Das angepasste ImageJ-Makro steht als Supplementary File 2 zum Download zur Verfügung.
HINWEIS: Das Programm verwendet das Unschärfebild, um die Zellenränder zu bestimmen. Anschließend wird der Umfang anhand des Bildes, das das Höhenprofil enthält, für jede horizontale Position bestimmt. Zusätzlich zu den Kanten bestimmt es den Umfang sowie die Umkehrung des Umfangs. Die Summe der inversen Umfangswerte, multipliziert mit der Pixeldicke, entspricht der Umkehrung des Formfaktors. - Fügen Sie das Pixel/Mikrometer-Verhältnis in das Programm ein. Ermitteln Sie diesen Wert aus dem Mikroskop-Objektiv-Kalibrierungsexperiment. Im verwendeten Beispiel liegt der Wert bei 13,87 Pixel/μm.
- Wählen Sie die horizontale Startposition, um die gelbe Linie in das erste Bild des Stapels einzufügen. Beginnen Sie die Linie vor dem Anfang der Zelle und zeichnen Sie sie über die vertikalen Grenzen der Zelle hinaus. Im Beispiel hat die gelbe Linie eine Länge von 153 Pixeln und die Anfangsposition liegt zwischen i = 70, y1 = 80 und i = 70 und y2 = 195. Verschieben Sie dann die gelbe Linie horizontal, bis die endgültige Position f = 245, y1 = 80 und f = 245 und y2 = 195 ist.
- Um schließlich die Zellenränder, den Umfang und die Umkehrung des Umfangs zu finden, wählen Sie die Registerkarte Makro und klicken Sie auf Makro ausführen. Das Makro liefert eine Tabelle mit der Position der Kanten, dem Umfang und der Umkehrung des Umfangs sowie ein Bild der analysierten Zelle. Überprüfen Sie, ob die Kanten dieses Bildes den Kanten in Abbildung 7 ähneln, andernfalls wiederholen Sie den Vorgang.
- Verwenden Sie die Summe der Umkehrung des Umfangs, um den Formfaktor8 zu ermitteln.
- Nachdem Sie das Bild gefunden haben, das das RBC-Höhenprofil enthält, verwenden Sie den defokussierten Kontrast von 2 μm, um einen Satz von zwei Bildern in ImageJ zu erstellen. Klicken Sie auf Bild > Stapel und wählen Sie dann die Option Bilder zum Stapeln. Um den Formfaktor zu finden, verwenden Sie ein benutzerdefiniertes ImageJ-Makro, um den Stapel zu analysieren. Das angepasste ImageJ-Makro steht als Supplementary File 2 zum Download zur Verfügung.
7. Weichglas-Rheologiemodell und experimentelle Analyse
- Organisieren der experimentellen Daten in einer Tabelle
- Erstellen Sie eine neue Tabelle in der Analysesoftware, indem Sie auf die Registerkarte Datei klicken. Bestimmen Sie 10 verschiedene Spalten (von c0 bis c9) für die folgenden Parameter: verwendete Winkelfrequenzen (rad/s): c0; K' (pN/μm) Werte für jede Kreisfrequenz: c1; ErrK': c2; K" (pN/μm) Werte für jede Kreisfrequenz: c3; ErrK": c4; G'(Pa)-Werte für jede Kreisfrequenz: c5; ErrG': c6; G" (Pa)-Werte für jede Kreisfrequenz: c7; ErrG": c8 und Ff mit seinem jeweiligen Fehler: c9 (Abbildung 8). Verwenden Sie die folgende Formel, um die folgenden Spalten auszufüllen:
c5 = (3 x c1) / (8 x 1,28 x 0,087)
c6 = (3 / (8 x 0,087 x 1,28)) x sqrt (c2^2 + (c1 x 0,01 / 1,28)^2 + (c1 x 0,008 / 0,087) ^ 2)
c7 = (3 x c3) / (8 x 1,28 x 0,087)
c8 = (3 / (8 x 0,087 x c4)) x sqrt (c4^2 + (c3 x 0,01 / 1,28)^2 + (c3 x 0,008 / 0,087)^2)
- Erstellen Sie eine neue Tabelle in der Analysesoftware, indem Sie auf die Registerkarte Datei klicken. Bestimmen Sie 10 verschiedene Spalten (von c0 bis c9) für die folgenden Parameter: verwendete Winkelfrequenzen (rad/s): c0; K' (pN/μm) Werte für jede Kreisfrequenz: c1; ErrK': c2; K" (pN/μm) Werte für jede Kreisfrequenz: c3; ErrK": c4; G'(Pa)-Werte für jede Kreisfrequenz: c5; ErrG': c6; G" (Pa)-Werte für jede Kreisfrequenz: c7; ErrG": c8 und Ff mit seinem jeweiligen Fehler: c9 (Abbildung 8). Verwenden Sie die folgende Formel, um die folgenden Spalten auszufüllen:
- Plotkurve G' (ω) versus G" (ω)
- Um die Kurve G' (ω) versus G" (ω) in der Analysesoftware zu erzeugen, verwenden Sie die Daten aus der vorherigen Tabelle. Klicken Sie auf Galerie > Linear und wählen Sie das Streudiagrammformat.
- Es öffnet sich ein neues Fenster. Wählen Sie die Spalte " G" als x-Achse und die Spalte " G" als y-Achse aus. Klicken Sie abschließend auf die Schaltfläche Zeichnen , um das Diagramm zu erhalten.
- Um die Fehlerbalken in die Zeichnung einzufügen, klicken Sie auf das Fenster Zeichnung und dann auf > Fehlerbalken zeichnen. Es öffnet sich ein neues Fenster. Markieren Sie zunächst die Option Y Err . Ein weiteres Fenster mit dem Namen Fehlerleisteneinstellungen wird geöffnet.
- Klicken Sie auf % des Werts, wählen Sie Datenspalte und klicken Sie dann auf die Spalte ErrG'. Klicken Sie abschließend auf OK > Plot, die Fehlerbalken für die y-Werte werden angezeigt. Wiederholen Sie den gleichen Vorgang für die Werte der x-Achse, indem Sie nun das Quadrat X Err und die richtige Spalte für das ErrG auswählen. Das endgültige Diagramm ähnelt dem in Abbildung 9 gezeigten.
- Anpassung der Parameter an das Modell der weichglasigen Rheologie
HINWEIS: Die Datenanalyse ist in zwei Teile unterteilt: 1) Kurve, die an das Diagramm G' (ω) im Vergleich zu G" (ω) angepasst wird, um die Parameter Γ und Gm zu erhalten; 2) Kurvenanpassung G' (ω) und G" (ω) als Funktion der Frequenz ω, um den Potenzgesetz-Exponenten α zu erhalten.- Kurve, die das Diagramm G' (ω) im Vergleich zu G" (ω) anpasst, um die Parameter Γ und G m zu erhalten.
- Klicken Sie auf die Registerkarte Kurvenanpassung und wählen Sie Anpassen1 aus. Es öffnet sich ein neues Fenster. Wählen Sie das Quadrat aus und klicken Sie auf die Schaltfläche Definieren . Ein Fenster mit dem Namen Allgemeine Kurvenanpassungsdefinition wird angezeigt. Geben Sie die folgende Gleichung ein:
m1 + m0/m2
wobei m1 = 61,576; m2 = 1, mit einem zulässigen Fehler von 1 x 10-5. Hier steht m0 für G", m1 für G, m und m2 für Γ.
ANMERKUNG: Für m1 und m2 ist es notwendig, ihre jeweiligen Werte während der Definition der Kurvenanpassung zu schätzen. Die obigen Schätzungen basieren auf dem gezeigten Beispielexperiment. Schätzen Sie in den Experimenten die Zahlen anhand der im Diagramm beobachteten Werte. - Klicken Sie in beiden Fenstern auf die Schaltfläche OK und die Armatur wird angezeigt, wie in Abbildung 10 dargestellt - eine schwarze Kurve. Überprüfen Sie die korrekten Werte für m1 und m2, die in der Kurvenanpassungstabelle aufgeführt sind, die mit dem Diagramm angezeigt wird.
- Klicken Sie auf die Registerkarte Kurvenanpassung und wählen Sie Anpassen1 aus. Es öffnet sich ein neues Fenster. Wählen Sie das Quadrat aus und klicken Sie auf die Schaltfläche Definieren . Ein Fenster mit dem Namen Allgemeine Kurvenanpassungsdefinition wird angezeigt. Geben Sie die folgende Gleichung ein:
- Kurvenanpassung G ' und G" in Abhängigkeit von der Kreisfrequenz ω
- Erstellen Sie als Nächstes zwei weitere Diagramme, nämlich G' als Funktion von ω und G' als Funktion von ω. Platzieren Sie die Fehlerbalken nur auf der y-Achse, wie zuvor gezeigt.
- Wiederholen Sie den Kurvenanpassungsvorgang, aber wählen Sie jetzt in der Kurvenanpassungsauswahl die Option "G" aus, und schreiben Sie dann unter Allgemeine Anpassung > Kurvendefinition die folgende Gleichung:
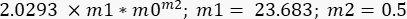
In diesem Fall wurde m1 als Wert von G" (ω) = 23,683 Pa geschätzt, wenn ω = 6,3 rad/s; m2 wurde auf 0,5 geschätzt (denken Sie daran, dass m2 der Exponent α ist und zwischen 0 und 1 variiert). Geben Sie den Wert für Γ = 2,0293 gemäß dem Ergebnis von m2 in Abbildung 10 ein. - Markieren Sie die Option Gewichtsdaten. Klicken Sie nach all diesen Verfahren auf OK, und eine Kurvenanpassung ähnlich der in Abbildung 11 - eine blaue Kurve wird angezeigt. Die Werte für α, α = 0,63 ± 0,02 und G 0, G 0 = (3,7 ± 0,3)Pa werden angezeigt. Verwenden Sie diese Werte, um die nächste Kurve G' (ω) anzupassen.
- Klicken Sie auf die nächste Kurve, wiederholen Sie die Kurvenanpassung, aber schreiben Sie nun in der allgemeinen Kurvendefinition die folgende Gleichung:

In diesem Fall ist m3 nur ein geschätzter Wert von α, um den zuvor erhaltenen Wert zu bestätigen. Verwenden Sie die Werte für G 0 = 3,703 und G' (ω) = 23,683 Pa, wenn ω = 6,3 rad/s ist. - Fügen Sie erneut 1 x 10-5 als zulässigen Fehler hinzu und markieren Sie die Option Gewichtsdaten. Klicken Sie nach all diesen Verfahren auf OK und eine Kurvenanpassung ähnlich der in Abbildung 11 - eine grüne Kurve wird angezeigt.
- Kurve, die das Diagramm G' (ω) im Vergleich zu G" (ω) anpasst, um die Parameter Γ und G m zu erhalten.
Ergebnisse
Abbildung 1 zeigt die schematische Darstellung des OT-Systems, das für die Rheologiemessungen verwendet wird. Abbildung 2 zeigt die schematische Darstellung des Mikrorheologie-Experiments mit beiden Kugeln und ein repräsentatives RBC. Abbildung 3 zeigt eine typische Kurve für die Amplituden beider Kugeln in Abhängigkeit von der Zeit, wenn die sinusförmigen Bewegungen von der piezoelektrischen Stufe erzeugt werden. Während die Referenzkugel (Abbildung 3 - rote Kurve) der Tischbewegung folgt, schwingt die RBC-Kugel (Abbildung 3 - blaue Kurve) mit einer anderen Amplitude und Phase. Durch die Messung dieser Parameter ist es möglich, die komplexe elastische Konstante K* (ω) für verschiedene Erythrozyten in der Probe zu bestimmen. Abbildung 4 zeigt ein typisches Diagramm für die speicherelastische Konstante K' (ω) als Funktion der verlustelastischen Konstante K" (ω). Die beobachtete lineare Abhängigkeit zeigt, dass die Erythrozytenoberfläche als weiches, glasartiges Material betrachtet werden kann. Als Nächstes ist ein DM-Verfahren erforderlich, um den gesamten Zellformfaktor Ff zu erhalten, und Abbildung 5, Abbildung 6 und Abbildung 7 enthalten einige der für diesen Zweck erforderlichen Schritte. Um dann Kräfte und Verformungen in Spannungen und Dehnungen umzuwandeln, ist es notwendig, K* (ω) in G* (ω) umzuwandeln.
Die komplexe elastische Konstante der Erythrozyten ist definiert als K* (ω) = K' (ω) + iK" (ω). Darüber hinaus ist K* (ω) mit dem Schubmodul des RBC-Komplexes G* (ω) = G' (ω) + iG" (ω) verbunden. G' (ω) und G" (ω) sind die RBC-Scherspeicher- bzw. Verlustmoduli. Die Beziehung zwischen K* (ω) und G* (ω) ist gegeben durch:
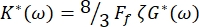
wobei Ff ein Formfaktor ist, der, wie bereits erwähnt, von der RBC-Geometrie abhängt, und ζ die RBC-Membrandicke ist, die zuvor als ζ = (0,087 ± 0,009)μm 8,15 bestimmt wurde.
Darüber hinaus sind die Verlustschubmodule der Speicher G' (ω) und G" (ω) durch die Gleichungen 8,9 mit den elastischen Konstanten K' (ω) und Verlust K" (ω) in Beziehung gesetzt
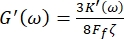 und
und 
Um die Standardfehler für G' (ω) und G" (ω), Err G' bzw. Err G" zu finden, verwenden Sie die Propagationsgleichungen der Unsicherheiten mit den Ergebnissen von K' (ω) und K " (ω) gemäß den folgenden Gleichungen8,9:
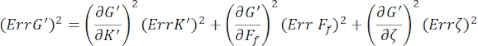
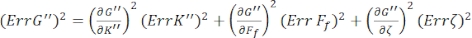 .
.
Nach der Theorie der weichen Glasrheologie verhalten sich die Erythrozyten wie viskoelastische Materialien wie Emulsionen, Pasten und Schlämme 8,9 und ihre Speicher- und Verlustmodule gehorchen den folgenden Gleichungen:
 Somit ist , wobei G m der Schermodul der Zellmembran, G 0 der niederfrequente Speichermodul Γ das Verhältnis
Somit ist , wobei G m der Schermodul der Zellmembran, G 0 der niederfrequente Speichermodul Γ das Verhältnis  α der Potenzgesetz-Exponent des weichen Glasrheologiemodells und ω0 = 1 rad/s 8,9 ist.
α der Potenzgesetz-Exponent des weichen Glasrheologiemodells und ω0 = 1 rad/s 8,9 ist.
Es wurden die gefundenen Werte für Ff und auch die Erythrozyten ζ verwendet (geschätzt auf 87 ± 8 nm 8,9,15). Die Ergebnisse sind in Abbildung 8, Abbildung 9 und Abbildung 10 dargestellt. Auch hier steht die lineare Abhängigkeit zwischen G' und G" im Einklang mit der Hypothese, dass Erythrozytenoberflächen als weiche, glasartige Materialien modelliert werden können. Außerdem kann aus der linearen Anpassung dieses Diagramms der Wert von G m erhalten werden, und durch Einführung dieses Wertes in die weiche glasartige Rheologiekurvenanpassung von G" werden die Werte von G0 und α bestimmt (Abbildung 11 - eine blaue Kurve). Darüber hinaus wird nach Verwendung des erhaltenen Ergebnisses für G 0 und Addition zur Anpassung der weichen Glasrheologiekurve von G' derselbe Wert für den Exponenten innerhalb von Fehlerbalken abgeleitet (Abbildung 11 - eine grüne Kurve).

Abbildung 1: Schematische Darstellung des OT-Mikroskops. Das gesamte System ist auf einem Anti-Vibrations-Tisch aufgebaut. Der Laser wird mit mindestens zwei verschiedenen dichroitischen Spiegeln (weiß) ausgerichtet und mit einem weiteren dichroitischen Spiegel (hellblau) auf den hinteren Eingang der Mikroskopobjektivlinse gerichtet. Ein piezoelektrischer Tisch und eine digitale wissenschaftliche Kamera, die an einen Computer angeschlossen ist, sind ebenfalls erforderlich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Schematische Darstellung des Mikrorheologie-Experiments. Die Referenzkugel (dunkelgrau) ist auf dem Deckglas befestigt und die RBC-Kugel (blau) ist auf der Erythrozytenoberfläche (rot) befestigt und wird vom OT gefangen (gekennzeichnet durch pfirsichfarbene Dreiecke, wenn der Laser eingeschaltet ist). ρ ist die Gleichgewichtslage der RBC-Kugel in der Falle; ξ ist die sinusförmige Bewegung der Probe und x ist die Zellverformung. Das schematische Bild wurde in Biorender erstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
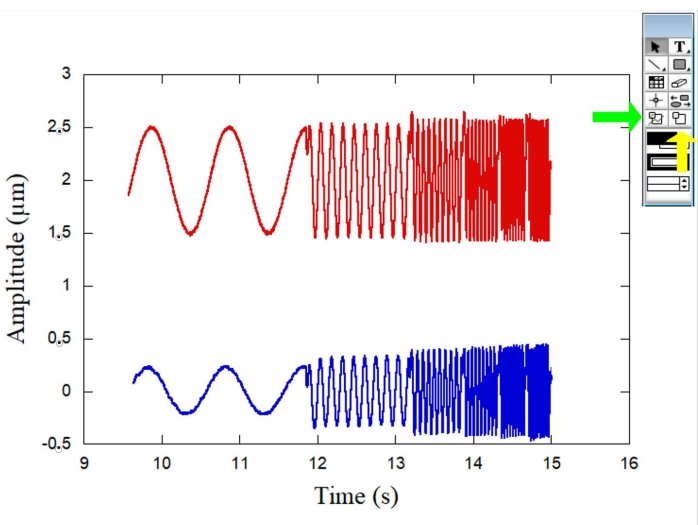
Abbildung 3: Diagramm, das die Amplituden (μm) beider Kugeln über die Zeit (s) veranschaulicht, wenn sinusförmige Bewegungen von der piezoelektrischen Stufe erzeugt werden. Die Referenzkugel (rote Kurve) oszilliert mit der Bühnenbewegung, während die RBC-Kugel (blaue Kurve) mit einer anderen Amplitude und Phase schwingt. Der grüne Pfeil auf der rechten Seite zeigt das Datenauswahlwerkzeug an, während der gelbe Pfeil das Zoomauswahlwerkzeug anzeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Ergebnisse der Erythrozyten-Mikrorheologie. Speichern Sie die elastische Konstante als Funktion der verlustelastischen Konstante für verschiedene Erythrozyten in der Probe (n = 10 verschiedene Zellen aus drei verschiedenen Proben). Die Datenpunkte stellen die Mittelwerte von K ' (y-Achse) und K" (x-Achse) mit ihren jeweiligen Fehlerbalken (Standardfehler des Mittelwerts) dar, die für jede im Versuchsaufbau verwendete Kreisfrequenz erhalten werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
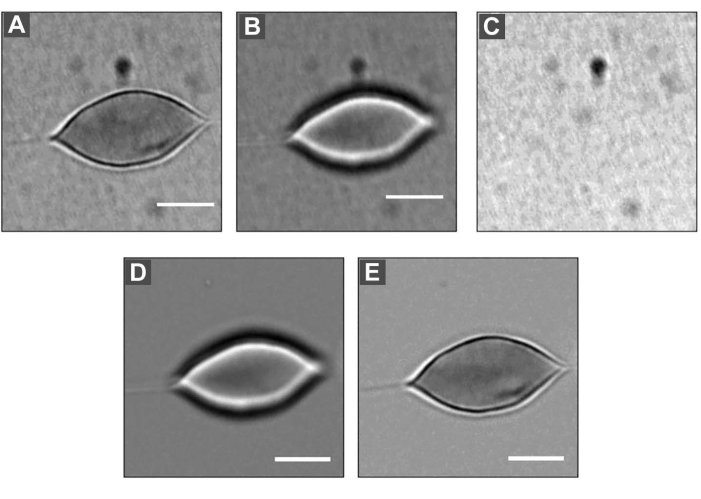
Abbildung 5: DM auf einen Erythrozyten angewendet . (A) Unscharfes Bild, Größe = 2 μm. (B) Bild im Fokus. (C) Hintergrundbild. Wenn man jedes Bild (A) und (B) durch das Hintergrundbild (C) dividiert und dann mit dem durchschnittlichen Grauwert jedes Bildes multipliziert, erhält man die Bilder (D) und (E). Maßstabsbalken: 5 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
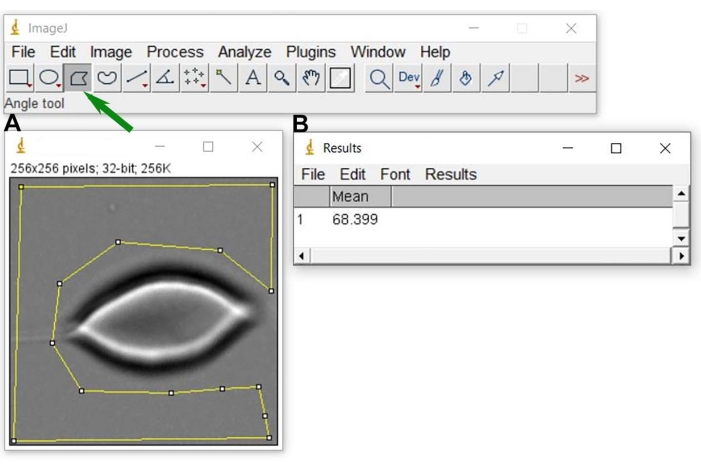
Abbildung 6: Hintergrundgraustufe N0. Nachdem Sie das repräsentative Bild in ImageJ (A) geöffnet haben, wählen Sie einen Bereich (gelbe geometrische Figur um die RBC-Zelle) aus, der verwendet wird, um den Mittelwert des Hintergrundgrauwerts und das Ergebnis (B) zu erhalten. Um die gelbe Auswahl in A durchzuführen, verwenden Sie das Polygonauswahlwerkzeug von Bild J (gekennzeichnet durch einen grünen Pfeil). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
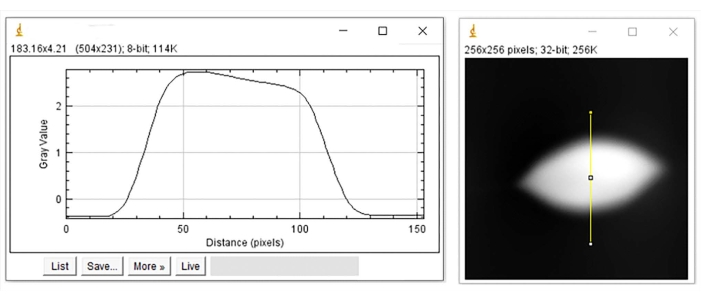
Abbildung 7: Höhenprofil für die verformte RBC. Höhenprofil (links) entlang der vertikalen gelben Linie des Bildes (rechts). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
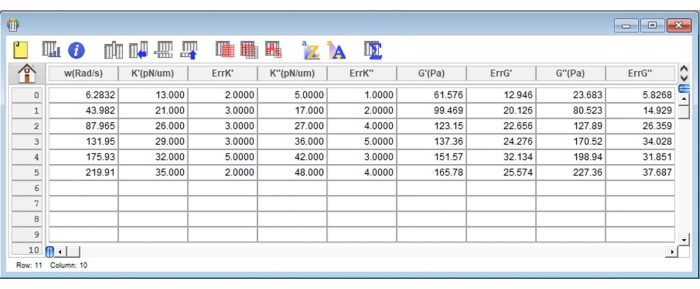
Abbildung 8: Repräsentativer Screenshot einer typischen Ergebnistabelle in der Analysesoftware. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 9: Viskoelastische Parameter der Erythrozyten. Speichern Sie den Schermodul als Funktion des Verlustschubmoduls für verschiedene Erythrozyten in der Probe (n = 10 verschiedene Zellen aus drei verschiedenen Proben). Die Datenpunkte repräsentieren die Mittelwerte sowohl von G ' (y-Achse) als auch von G" (x-Achse) mit ihren jeweiligen Fehlerbalken (Standardfehler des Mittelwerts), die für jede in den Experimenten verwendete Kreisfrequenz erhalten werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
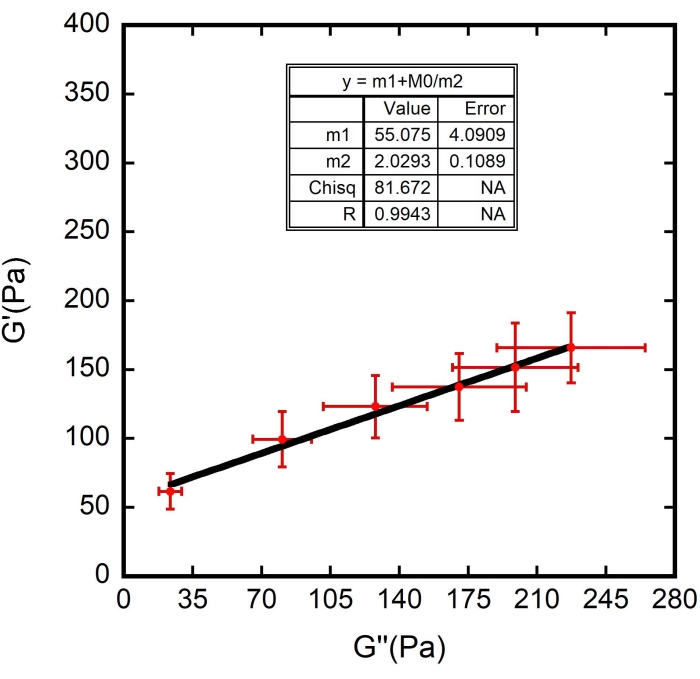
Abbildung 10: Kurvenanpassung von G ' (Pa) als Funktion von G" (Pa). Die lineare schwarze Linie ist die Kurvenanpassung für die Datenpunkte. N = 10 verschiedene Zellen aus drei verschiedenen Proben. Fehlerbalken stellen den Standardfehler des Mittelwerts dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
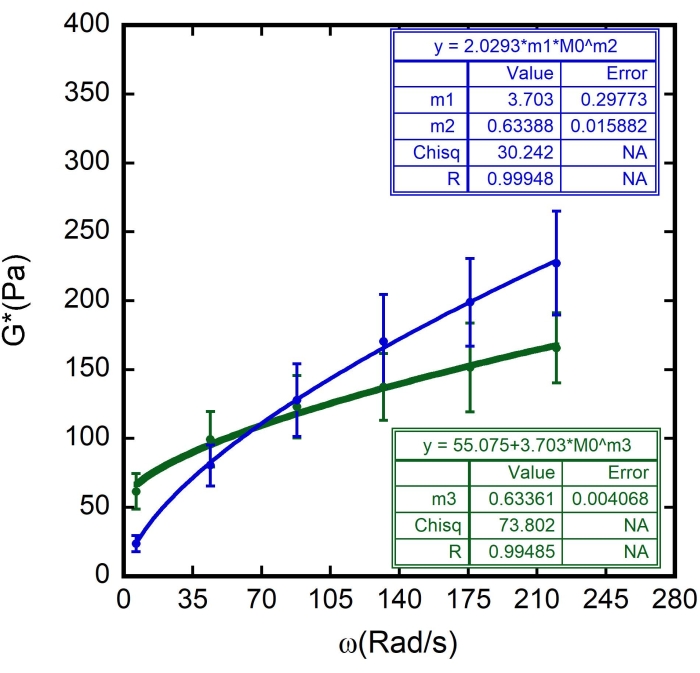
Abbildung 11: Anpassung des Rheologiemodells für weiches Glas an die Ergebnisse. Der komplexe Schermodul (G*) als Funktion der Kreisfrequenz ω für verschiedene Erythrozyten in der Probe. Die grünen Kreise im Diagramm stellen die Mittelwerte von G' dar, während die blauen Kreise die Mittelwerte von G" darstellen, die mit ihren jeweiligen Fehlerbalken aufgetragen werden. Die durchgehenden grünen und blauen Linien stellen die Kurvenanpassungen für das weichglasige Rheologiemodell dar. Die Parameter m 1, m2 und m3 sind im Diagramm angegeben. Während m 1 G0 ist, sind m 2 und m3 der Exponent, α. N = 10 verschiedene Zellen aus drei verschiedenen Proben. Fehlerbalken stellen den Standardfehler des Mittelwerts dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzendes Dossier 1: ImageJ-Plugin DivideQ2.class. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzendes Dossier 2: ImageJ hat das Makro angepasst, um den Formfaktor zu erhalten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In diesem Protokoll wird eine integrierte Methode vorgestellt, die auf einer optischen Pinzette und Defokussierungsmikroskopie basiert, um die viskoelastischen Eigenschaften von Erythrozyten quantitativ abzubilden. Die Ergebnisse für die Speicher- und Verlustschermodule sowie der Skalierungsexponent, der die weiche Glasrheologie von Erythrozyten charakterisiert, werden bestimmt. Die Anwendung dieses Protokolls für verschiedene experimentelle Bedingungen, wie z.B. in physiologischer Situation8 oder entlang jedes Stadiums des intraerythrozytären Zyklus9 von P. falciparum, wurde bereits durchgeführt.
Verweise in der Literatur weisen auf Diskrepanzen in der Rheologie der Erythrozyten hin, die teilweise auf Veränderungen in der Zellmorphologie zurückzuführen sind, die bei den Messungen nicht richtig berücksichtigt wurden 6,7. Mittels dynamischer Lichtstreuung wurden Werte für die RBC-Speicher- und Verlustmodule im Bereich von 0,01-1 Pa im Frequenzbereich von 1-100 Hz6 angegeben. In einer anderen Studie wurde mittels optischer magnetischer Verdrillungszytometrie der scheinbare komplexe Elastizitätsmodulbestimmt 7, wich jedoch von den Werten der dynamischen Lichtstreuung ab; Daher wurde zu Vergleichszwecken ein multiplikativer Faktor von 84 verwendet. In Anlehnung an die im vorliegenden Protokoll beschriebenen Verfahren wurden diese Unterschiede8 durch Charakterisierung des Erythrozyten-Formfaktors unter Verwendung einer nichtinvasiven Defokussierungsmikroskopietechnik11,12,13 verdeutlicht. Der komplexe Schubmodul, der Zelloberflächen charakterisiert, kann nur erhalten werden, wenn die Geometrie16,17 berücksichtigt wird, und dies wurde nicht immer richtig durchgeführt.
Die integrierte Methodik, die in diesem Protokoll vorgestellt wird, ermöglicht es, beide Methoden (OT-Messung und TM-Messung) für dieselbe einzelne Zelle nacheinander durchzuführen. Es ermöglicht auch, OT-Messungen für verschiedene Zellen in einer Population durchzuführen und dann DM-Messungen für andere Zellen in derselben Zellpopulation durchzuführen. Die letzte Option wird wahrscheinlich zu einer größeren Variabilität beider Ergebnisse führen, aber die Fehler können entsprechend propagiert werden, so dass die Ergebnisse die gesamte Morphologie der Erythrozyten mit den gesamten viskoelastischen Eigenschaften der Erythrozyten in einer bestimmten Population von Zellen korrelieren, die einer bestimmten experimentellen Bedingung entsprechen.
Die Haupteinschränkung bei der Ausführung dieses Protokolls ist die intrinsische Schwierigkeit bei der Durchführung der Methode selbst, da es sich um eine Integration von optischer Pinzette und Defokussierungsmikroskopie handelt. Daher kann die Verfügbarkeit von Instrumenten zur Durchführung aller beschriebenen Schritte eine Herausforderung darstellen. Wenn man jedoch Zugang zu einer OT-Einrichtung hat, ist es viel praktikabler, die Einrichtung schließlich für die Durchführung der Experimente anzupassen. Hier setzt das vorliegende Protokoll an, das nicht nur jeden Schritt zur Durchführung der Messungen und Analysen detailliert beschreibt, sondern auch den Menschen hilft, diese OT-Systeme zu identifizieren und zu übernehmen, anstatt ein Setup von Grund auf neu zu erstellen.
Auch die Befestigung von Erythrozyten an Deckgläsern wird zu einem limitierenden Faktor, da es sich um nicht haftende Zellen handelt und solche Schritte zu Schwierigkeiten bei der Messung führen können, da sich einige Erythrozyten ablösen können. Daher ist es wichtig, eine gut haftende Erythrozyte zu wählen. Eine Möglichkeit, um zu überprüfen, ob die Wahl erfolgreich war, kann zum Zeitpunkt der Vorbereitung der Probe für die Messung erfolgen. Nachdem Sie die OT-gefangene Erythrozytenkugel auf der Zelloberfläche positioniert haben, bewegen Sie die Probe leicht, um sicherzustellen, dass die Zelle fest fixiert ist und ihre Position nach der OT-eingeschlossenen Perle nicht geändert hat. Wenn dies der Fall ist, suchen Sie nach einer anderen Zelle in der Stichprobe. Zukünftige Verbesserungen, wie z. B. die Verwendung von Zweistrahl-OT, um gleichzeitig die Erythrozyten einzufangen und die Rheologiemessungen durchzuführen, können ebenfalls durchgeführt werden.
Darüber hinaus ermöglicht die Möglichkeit, einzelzellbasierte quantitative viskoelastische Informationen von Erythrozyten zu extrahieren, eine Vielzahl von Anwendungen, die gerade erst erforscht werden 8,9. Somit kann die vorgestellte Methode auf die Charakterisierung des mechanischen Verhaltens von Erythrozyten unter anderen physiopathologischen Bedingungen wie Eisenmangelanämie und Diabetes oder bei genetischen Bluterkrankungen wie z.B. Sichelzellanämie und Thalassämie ausgeweitet werden. Ein solches integriertes Werkzeug könnte die Grundlage für die Entwicklung neuartiger diagnostischer Methoden bilden, die in der Lage sind, die Veränderungen der viskoelastischen Eigenschaften der Erythrozyten mit Veränderungen im Blutfluss von Personen mit unterschiedlichen Pathologien zu korrelieren.
Offenlegungen
Die Autoren haben keine finanziellen Interessen an den in diesem Manuskript beschriebenen Produkten und haben auch sonst nichts offenzulegen.
Danksagungen
Die Autoren bedanken sich bei allen Mitgliedern der CENABIO Advanced Microscopy Facility für ihre wichtige Hilfe. Diese Arbeit wurde von den brasilianischen Agenturen Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) - Financial Code 001, Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ) und Instituto Nacional de Ciência e Tecnologia de Fluidos Complexos (INCT-FCx) zusammen mit der Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) unterstützt. B.P. wurde durch ein JCNE-Stipendium von FAPERJ unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 35mm culture dishes | Corning | 430165 | |
| Bovine serum albumin | Sigma-Aldrich | A9418 | |
| Coverslips | Knittel Glass | VD12460Y1A.01 and VD12432Y1A.01 | |
| Glass-bottom dishes | MatTek Life Sciences | P35G-0-10-C | |
| Glucose | Sigma-Aldrich | G7021 | |
| ImageJ | NIH | https://imagej.nih.gov/ij/ | |
| Immersion oil | Nikon | MXA22165 | |
| Inverted microscope | Nikon | Eclipse TE300 | |
| KaleidaGraph | Synergy Software | https://www.synergy.com/ | |
| KCl | Sigma-Aldrich | P5405 | |
| KH2PO4 | Sigma-Aldrich | P5655 | |
| Microscope camera | Hamamatsu | C11440-10C | |
| Na2HPO4 | Sigma-Aldrich | S5136 | |
| NaCl | Sigma-Aldrich | S5886 | |
| Neubauer chamber | Sigma-Aldrich | BR717805-1EA | |
| Objective lens | Nikon | PLAN APO 100X 1.4 NA DIC H; PLAN APO 60x 1.4 NA DIC H and Plan APO 10x XXNA PH2 | |
| Optical table | Thorlabs | T1020CK | |
| OT laser | IPG Photonics | YLR-5-1064-LP | |
| Polystyrene microspheres | Polysciences | 17134-15 | |
| rubber ring | Forever Seals | NBR O-Ring | |
| Silicone grease | Dow Corning | Z273554 | |
| Stage positioning | PI | P-545.3R8S | |
| Pipette | Gilson | P1000 |
Referenzen
- Fowler, V. M. The human erythrocyte plasma membrane: a Rosetta Stone for decoding membrane-cytoskeleton structure. Current Topics in Membranes. 72, 39-88 (2013).
- Tomaiuolo, G. Biomechanical properties of red blood cells in health and disease towards microfluidics. Biomicrofluidics. 8 (5), 051501 (2014).
- Depond, M., Henry, B., Buffet, P., Ndour, P. A. Methods to investigate the deformability of RBC during malaria. Frontiers in Physiology. 10, 1613 (2019).
- Boal, D. . Mechanics of the Cell. 2 edn. , (2012).
- Balland, M., et al. Power laws in microrheology experiments on living cells: Comparative analysis and modeling. Physical Review E. 74 (2), 021911 (2006).
- Amin, M. S., et al. Microrheology of red blood cell membranes using dynamic scattering microscopy. Optics Express. 15 (25), 17001-17009 (2007).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. American Journal of Physiology Cell Physiology. 293 (2), 597-605 (2007).
- Gomez, F., et al. Effect of cell geometry in the evaluation of erythrocyte viscoelastic properties. Physical Review E. 101 (6-1), 062403 (2020).
- Gomez, F., et al. Plasmodium falciparum maturation across the intra-erythrocytic cycle shifts the soft glassy viscoelastic properties of red blood cells from a liquid-like towards a solid-like behavior. Experimental Cell Research. 397 (2), 112370 (2020).
- Pompeu, P., et al. Protocol to measure the membrane tension and bending modulus of cells using optical tweezers and scanning electron microscopy. STAR Protocols. 2 (1), 100283 (2021).
- Agero, U., Mesquita, L. G., Neves, B. R., Gazzinelli, R. T., Mesquita, O. N. Defocusing microscopy. Microscopy Research and Technique. 65 (3), 159-165 (2004).
- Agero, U., Monken, C. H., Ropert, C., Gazzinelli, R. T., Mesquita, O. N. Cell surface fluctuations studied with defocusing microscopy. Physical Review E. 67 (5), 051904 (2003).
- Roma, P. M. S., Siman, L., Amaral, F. T., Agero, U., Mesquita, O. N. Total three-dimensional imaging of phase objects using defocusing microscopy: Application to red blood cells. Applied Physics Letters. 104 (25), 251107 (2014).
- Köhler, A. New method of illumination for photomicrographical purposes. Journal of the Royal Microscopical Society. 14, 261-262 (1894).
- Nans, A., Mohandas, N., Stokes, D. L. Native ultrastructure of the red cell cytoskeleton by cryo-electron tomography. Biophysical Journal. 101 (10), 2341-2350 (2011).
- Ayala, Y. A., et al. Rheological properties of cells measured by optical tweezers. BMC Biophysics. 9, 5 (2016).
- Ayala, Y. A., et al. Effects of cytoskeletal drugs on actin cortex elasticity. Experimental Cell Research. 351 (2), 173-181 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten