Method Article
Регистрация внутрикавернозного давления на модели крысы с повреждением кавернозного нерва
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает разработку стабильной модели радикальной простатэктомии с двусторонним повреждением кавернозного нерва, связанной с эректильной дисфункцией и измерением внутрикавернозного давления.
Аннотация
Модель двустороннего повреждения кавернозного нерва (КН) крысы широко использовалась для моделирования клинического повреждения кавернозного нерва, связанного с эректильной дисфункцией (ЭД), для оценки эффекта клинических терапевтических методов. Тем не менее, методы построения модели травмы КН несовершенны и разнообразны в области исследований ОНП. Именно травма ЦН является наиболее часто используемым методом в последние годы. Целью данного исследования является подробное описание процедуры построения модели двусторонней травмы ЦНС крысы и измерения регистрации внутрикавернозного давления (ВЧД), что позволяет получить надежную и воспроизводимую модель травмы крысы. В данной работе успешно разработан метод травмы ЦН при раздавливании гемостата с использованием иглы шприца в качестве жесткой опоры и гемостата с резиновой втулкой. Кроме того, этот метод позволяет сделать вывод о том, что напряжение 1,0 В, частота 20 Гц и ширина импульса 5 мс являются оптимизированными параметрами стимуляции для регистрации ВЧД в модели двусторонней травмы ЦН.
Введение
ЭД является одним из распространенных заболеваний у взрослых мужчин. По оценкам, к 2025 году число пациентов с ЭД в мире достигнет 322 миллионов1. Одно многоцентровое обширное выборочное обследование в Китае показывает, что доля ЭД, вызванной операциями на органах малого таза или травмами, составляет около 8%2. Несмотря на постоянное совершенствование хирургических техник и хирургических инструментов, заболеваемость ЭД все еще остается высокой. Считается, что развитие и прогрессирование ЭД после нервосберегающей радикальной простатэктомии (РП) способствует повреждению кавернозного нерва, приводящему к атрофии гладкой мускулатуры кавернозного тела, апоптозу эндотелиальных клеток и патологическому ремоделированию 3,4.
Для изучения механизма гемодинамики и гистопатологических изменений повреждения ЦН, связанного с ЭД, было разработано и оценено несколько различных типов животных моделей повреждения ЦН, включая грызунов, собак, кошек и обезьян 5,6,7. Основываясь на преимуществах в затратах и воспроизводимости, двусторонняя модель травмы ЦНС на крысе стала наиболее распространенной моделью для оценки ЭД после радикальной хирургии таза8. Тем не менее, в многочисленных литературных работах сообщалось о различных формах повреждения нервов, принципиальные различия которых заключаются в подходах к повреждению нервов (раздавливание, замораживание, пересечение и иссечение)9,10,11. Кроме того, разнообразие подходов к повреждению нервов может привести к несогласованности параметров регистрации внутрикавернозного давления (ВЧД) в модели крысы, что определяет точность и оценку ВЧД8. Тем не менее, стандартизированного метода индуцирования повреждения нерва и регистрации ВЧД модели пока не существует.
Таким образом, данное исследование направлено на построение более надежной и воспроизводимой модели двусторонней травмы крысы при ЦН. Этот метод дает подробное описание процедуры построения модели и измерения ВЧД, что может быть полезно для изучения механизмов ЭД и разработки эффективных методов лечения в будущем.
протокол
В этом исследовании использовались пятнадцать взрослых самцов крыс породы Спрэг-Доули (в возрасте 3 месяцев) весом от 300 до 350 г. Все процедуры на животных проводились в соответствии с Рекомендациями NIH по уходу и использованию лабораторных животных и с одобрения Комитета по уходу за животными и их использованию в пятой аффилированной больнице Университета Сунь Ятсена. Животные были размещены в комфортабельном помещении с контролируемой температурой и освещением.
1. Материалы подготовки к хирургической процедуре
- Подготовьте следующие инструменты: скальпель, тканевые ножницы, нитевые ножницы, изгибающие щипцы, тканевые щипцы, микрохирургические щипцы, кровоостанавливающие щипцы от комаров Хартмана, стерильные хирургические листы, держатель микроигл, крысиные абдоминальные ретракторы, а также систему сбора и обработки биологических сигналов (см. Таблицу материалов).
- Перед операцией простерилизовать все хирургические инструменты. Используйте спиртовые салфетки (70% этанол) для очистки области операции.
ПРИМЕЧАНИЕ: Хирургические инструменты должны быть стерилизованы путем погружения спиртом в течение ночи.
- Перед операцией простерилизовать все хирургические инструменты. Используйте спиртовые салфетки (70% этанол) для очистки области операции.
- Подготовьте систему регистрации давления
- Подсоедините шприц объемом 10 мл, содержащий гепариновый физиологический раствор, и иглу для подкожных инъекций 25 G к 3-ходовому запорному крану с трубкой (длиной 20 см). Промойте стерилизованную трубку стерильным гепариновым раствором (200 Ед/мл).
ПРИМЕЧАНИЕ: Заполнение пробирки гепариновым физиологическим раствором позволяет избежать попадания пузырьков воздуха в систему.
- Подсоедините шприц объемом 10 мл, содержащий гепариновый физиологический раствор, и иглу для подкожных инъекций 25 G к 3-ходовому запорному крану с трубкой (длиной 20 см). Промойте стерилизованную трубку стерильным гепариновым раствором (200 Ед/мл).
- Поднимите иглу 25 G на 20 см (как раз на длину трубки) над рабочей площадкой животного. Затем проверьте точность измерения системы регистрации давления с помощью промывки или постукивания.
2. Подготовка животного
- Обезболивание крыс путем внутрибрюшинного введения пентобарбитала натрия (60 мг/кг) (см. Таблицу материалов).
Примечание: Для подтверждения достаточной глубины анестезии была проведена оценка ритма спонтанного дыхания и рефлексов крысы путем защемления задней лапы. - Наносите мазь на двусторонние глаза, чтобы избежать сухости роговицы.
- После подтверждения правильной анестезии побрейте нижнюю половину живота, шею и промежность с помощью электробритвы. Положите крысу в лежачем положении на грелку (37 °C). Надевайте медицинские перчатки для поддержания стерильных условий во время хирургических процедур.
3. Изоляция ЦНС и процедура травмирования
- С помощью скальпеля сделайте 4-сантиметровый разрез через кожу по нижней, средней линии живота. Чтобы полностью обнажить мочевой пузырь и простату, используйте тканевые ножницы и тканевые щипцы, чтобы сделать надлежащий разрез через подкожную фасцию, мышечную ткань и брюшину.
- Используйте абдоминальный ретрактор крысы для увеличения карты операционного поля. Используйте впитывающие ватные палочки, чтобы отделить простату от прилегающих тканей, таких как связки.
ПРИМЕЧАНИЕ: Большой тазовый ганглий (МПГ) и КН могут быть обнаружены в одной из двух дорсолатеральных областей предстательной железы. - С помощью угловых микроножниц надрежьте фасцию, расположенную над CN на 1-6 мм дистальнее MPG. Затем наложите шов 9-0 под ЦН с помощью микрохирургических щипцов.
- Поместите иглу шприца (25 G) под ЦН, на 5 мм дистальнее МПГ. Затем поставьте гемостат в светлую структуру сэндвича «наконечник гемостата-игла шприца-нерв-наконечник гемостата» (рисунок 1 и рисунок 2).
ПРИМЕЧАНИЕ: Игла шприца должна быть отшлифована. - Нанесите гемостат с полным закрытием кончика на расстоянии 5 мм от ганглия на 1 мин, затем извлеките гемостат и иглу шприца (рис. 2).
- Слегка приподнимите нерв с помощью шва 9-0 и поместите крючки биполярного электрода (см. Таблицу материалов) вокруг CN на 2-4 мм дистальнее MPG (Рисунок 3).
ПРИМЕЧАНИЕ: Две пары MPG и CN работали одинаково.
4. Катетеризация кавернозного тела и стимуляция КН для измерения ВЧД
- Промойте трубку стерильным гепариновым физиологическим раствором (200 Ед/мл) перед введением его в кавернозное тело.
- Удерживайте иглу 25 G и держите направление вставки параллельно ходу кавернозного тела (Рисунок 3).
ПРИМЕЧАНИЕ: Белочная оболочка должна быть растянута для облегчения введения. - Введите иглу 25 G на 6 мм в кавернозное тело (рисунок 3). Промойте трубку и слегка надавите на кавернозное тело, чтобы оценить чувствительность датчика (Рисунок 4). Чтобы предотвратить случайное падение, зафиксируйте трубу на рабочем столе скотчем.
- Для стимуляции КН используют следующие параметры: напряжение 1,0 В, частота 20 Гц, длительность импульса 5 мс. Применяйте 1 минуту стимуляции с 5 минутами отдыха между следующей стимуляцией.
ПРИМЕЧАНИЕ: Поверните 3-позиционный запорный кран в сторону канала датчика давления при начале измерения.
5. Послеоперационный уход
- Положите крыс на подогретую подушку (37 °C) и внимательно следите за ними для восстановления после анестезии.
- Для послеоперационного контроля боли дайте нестероидные противовоспалительные препараты (такие как карпрофен, 0,5 мг/кг, подкожное введение) (см. Таблицу материалов), когда крысы полностью выздоровеют.
- Переместите крыс в асептическую клетку и наблюдайте за ними в течение 2 дней, чтобы оценить состояние питания послеоперационной раны, психическое состояние и инфекцию.
Результаты
В ходе хирургической процедуры была получена типичная кривая ответа ВЧД с использованием этого протокола с рекомендуемыми настройками стимуляции. Кривая реакции ВЧД мгновенно повышается при стимуляции нерва и снижается при прекращении стимуляции (Рисунок 5). Перед измерением ВЧД важно исследовать интракавернозную линию давления, что влияет на оценку повышенных значений ВЧД (рис. 4).
Как показано на рисунке 6, нет существенной разницы между пиковым ВЧД и плато ВЧД при напряжении выше 1,0 В у нормальных крыс (без повреждения кавернозного нерва). Однако пик ВЧД и плато ВЧД увеличиваются с увеличением напряжения стимуляции выше 1,0 В после повреждения кавернозного нерва (рис. 7). Измерение ВЧД оценивали перед операцией, через 0, 7 и 28 дней после раздавливания CN. Наблюдалась значительная разница в ВЧД между 0 днями и 7 или 28 днями после операции, но статистическая разница между 7 и 28 днями отсутствовала (рис. 8). Это указывает на то, что модель травмы крысы с ЦН, следующая современному методу, является надежной.
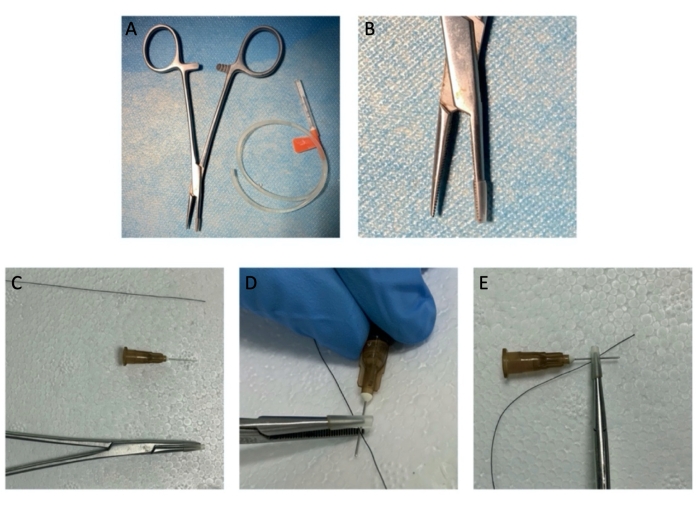
Рисунок 1: Инструменты кровоостанавливающего средства для раздавливания травмы. (А, Б) Кровоостанавливающие средства с резиновой втулкой. (К-Е) Показана моделирующая структура типа «наконечник гемостата-игла-нерв-наконечник гемостата». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Процедура повреждения кавернозных нервов. (А) Анатомическое строение МПГ и КН (отмечено красной линией). (B) Поместите иглу шприца под определенным углом (красная стрелка). (В) Для нанесения травмы на КН был наложен гемостат. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
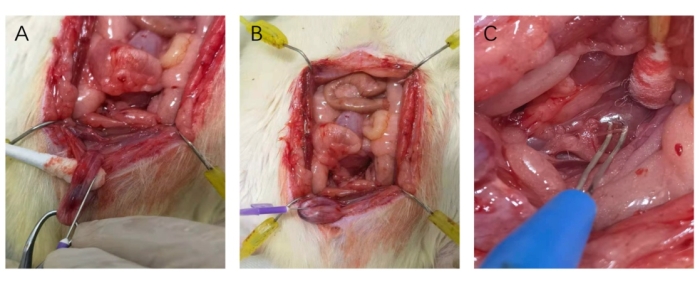
Рисунок 3: Катетеризация кавернозного тела и зацепление нерва. (А) Игла 25 G была параллельна ходу кавернозного тела при катетеризации. (В) Введение иглы 25 G в кавернозное тело. (В) Размещение нерва на крючках биполярного электрода. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Исследование внутрикавернозной линии давления. Кривая чувствительного отклика позволяет предположить, что игла 23 G находится в правильном положении интракавернозной. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
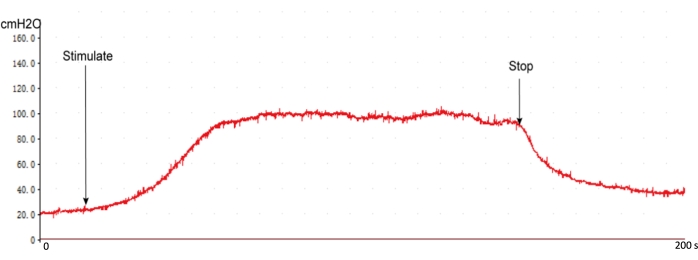
Рисунок 5: Типичная кривая реакции ВЧД нормальных крыс. При начале стимуляции ЧС ВЧД быстро поднимается и выходит на плато. ВЧД снижался до исходного уровня без стимуляции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Влияние стимуляции градиентом напряжения на ВЧД без повреждения кавернозного нерва. При увеличении напряжения стимуляции выше 1,0 В пиковое ВЧД и плато ВЧД не увеличиваются. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
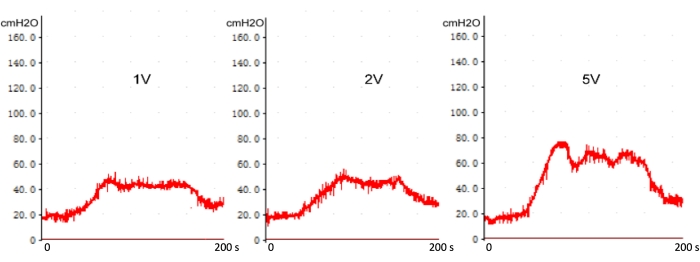
Рисунок 7: Стимуляция градиента напряжения на ВЧД с повреждением кавернозного нерва в реальном времени. С увеличением напряжения стимуляции выше 1 В пиковое ВЧД и плато ВЧД увеличиваются. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
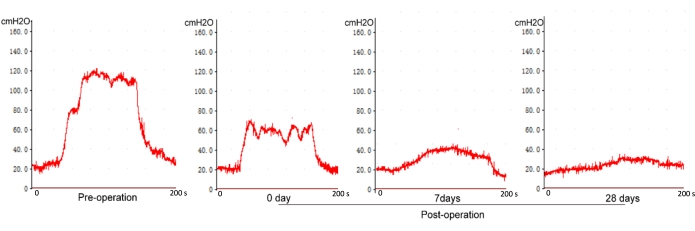
Рисунок 8: Измерение ВЧД в разное послеоперационное время. Снижение ВЧД поддерживает более низкий уровень ВЧД до 28 дней. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
ЭД является тяжелым осложнением операции на органах малого таза или травмы. Несмотря на проведение нервосберегающей операции, частота возникновения ЭД при радикальной простатэктомии (РП) составляет примерно 14-90%. Из-за проблемной регенерации травмы КН клинический лечебный эффект менее чем удовлетворительный. Таким образом, стабильная животная модель травмы ЦНС для изучения методов лечения ЭД имеет важное значение. Quinlan et al. впервые сообщили о модели травмы крысы CN для изучения RP-ассоциированной ЭД13. В нескольких исследованиях были разработаны модели травмированных крыс CN на основе модели Квинлана, включая пересечение, иссечение, раздавливание и замораживание CN 8,14,15,16,17. Каждый тип травмы может быть выполнен в одностороннем или двустороннем порядке для конкретного дизайна эксперимента.
Несмотря на наименее тяжелую степень травмы, при раздавливающем типе может быть зарезервирована эпилемма ЧН. Двусторонняя травма ЦНС является лучшей аналогией нервосберегающей РП18,19. Тем не менее, существуют некоторые проблемы с методами раздавливания ЦН, о которых сообщалось в настоящем исследовании. Отсутствие достаточной степени травматизма и множественные травмы ограничивают применение модели. Одноточечная модель травмы с адекватной степенью имеет беспрецедентное преимущество в фундаментальных исследованиях. Таким образом, мы разработали более стабильную модель двусторонней травмы ЦНС крысы с РП, связанной с РП.
КН подвержен нейротмезису из-за своего небольшого размера. В этом исследовании впервые был предложен навык работы для обеспечения адекватной степени травмы и предотвращения пересечения нерва с использованием иглы шприца в качестве жесткой опоры и гемостата с резиновой втулкой. Тем не менее, различные силы сжатия и время будут определять степень травмы, которая влияет на вероятность успешного построения модели. Настоящее исследование показало, что применение гемостата с полным закрытием кончика на расстоянии 5 мм от ганглия в течение 1 минуты может быть наиболее подходящим режимом работы.
Для оценки стабильности и надежности модели восстановление эректильной функции оценивалось через 0, 7 и 28 дней после раздавливания ЦН. Было обнаружено, что наблюдалась значительная разница в ВЧД между 0 днями и 7 или 28 днями; однако существенной разницы между значениями ПМС за 7 дней и 28 дней не наблюдалось. Это указывает на то, что эректильная функция постепенно снижается и, по-видимому, поддерживает более низкий уровень ВЧД до 28 дней. Это говорит о том, что модель двусторонней травмы ЦН крысы подходит для эксперимента продолжительностью в один месяц.
Напряжение стимуляции CN в исследованиях не имеет общего согласия, которое колеблется от 1,0 до 12 В. Во-первых, влияние стимуляции градиентом напряжения на ICP было изучено на нормальных крысах. При повышении напряжения стимуляции выше 1,0 В пиковое ВЧД и плато ВЧД не повышаются. Наш результат согласуется с работой Хокса, М. и др.20. Это явление говорит о том, что ток, проводимый через нерв, выше порогового значения и достаточен для запуска рефлекса, что приводит к полной физиологической реакции. После травмы ЧН была мгновенно стимулирована градиентным напряжением, и был зарегистрирован ВЧД. По сравнению с напряжением 1,0 В, пиковое напряжение ВЧД и плато ВЧД увеличиваются с увеличением напряжения стимуляции выше 1 В. Использование более высокого напряжения стимуляции может привести к «ложноположительной» кривой отклика ВЧД. В общем случае рекомендуется использовать напряжение 1,0 В, частоту 20 Гц и ширину импульса 5 мс в качестве параметров стимуляции для регистрации ВЧД в модели двусторонней травмы ЦН.
Как и в случае с другими животными моделями, двусторонняя модель травмы крысы с ЦН, полученная с помощью текущего метода, также имеет некоторые ограничения по сравнению с клиническими пациентами. Модель крысы с лучшей регенеративной способностью периферической нервной системы может влиять на оценку регенерации и восстановления нервов. В отличие от этого, он обеспечивает приемлемый метод исследования в данном исследовании. В связи с этим необходимо создание более стабильной двусторонней модели ЭД при травме ЦН, способствующей трансформации достижений в клиническом лечении.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Работа выполнена при поддержке Национального фонда естественных наук Китая (грант No 82071636).
Материалы
| Name | Company | Catalog Number | Comments |
| 25 G needle | BD Bioscience | 367391 | |
| Abdominal retractor | RWD Life Science | R22009-01 | |
| Animal operating pad | Provided by Guangdong Provincial Key Laboratory of Biomedical Imaging | NA | |
| Bending forceps | RWD Life Science | F12011-10 | |
| Biological signal acquisition and processing system | Techman Software | BL-420S | |
| Bipolar electrode | Techman Software | AC0047 | |
| Carprofen | Sigma-Aldrich | MFCD00079028 | |
| HARTMAN mosquito hemostatic forceps | RWD Life Science | F22002-10 | |
| Heparin | Shanghai Aladdin Biochemical Technology | 2608411 | |
| Micro needle holder | RWD Life Science | F31047-12 | |
| Microsurgery forceps | RWD Life Science | F11001-11 | |
| Scalpel | RWD Life Science | S32003-12 | |
| Sodium pentobarbital | Guangdong Provincial Key Laboratory of Biomedical Imaging | NA | |
| Sprague–Dawley rat | Guangdong Medical Laboratory Animal Center | GDMLAC-035 | |
| Thread scissors | RWD Life Science | S15001-11 | |
| Tissue forceps | RWD Life Science | F13019-12 | |
| Tissue scissors | RWD Life Science | S13029-14 |
Ссылки
- Ayta, I. A., McKinlay, J. B., Krane, R. J. The likely worldwide increase in erectile dysfunction between 1995 and 2025 and some possible policy consequences. BJU International. 84 (1), 50-56 (1999).
- Li, D., et al. Multicenter pathophysiologic investigation of erectile dysfunction in clinic outpatients in China. Urology. 79 (3), 601-606 (2012).
- Montorsi, F., et al. Recovery of spontaneous erectile function after nerve-sparing radical retropubic prostatectomy with and without early intracavernous injections of alprostadil: results of a prospective, randomized trial. The Journal of Urology. 158 (4), 1408-1410 (1997).
- Mulhall, J. P., Graydon, R. J. The hemodynamics of erectile dysfunction following nerve-sparing radical retropubic prostatectomy. International Journal of Impotence Research. 8 (2), 91-94 (1996).
- Lue, T. F., Takamura, T., Schmidt, R. A., Palubinskas, A. J., Tanagho, E. A. Hemodynamics of erection in the monkey. Journal of Urology. 130 (6), 1237-1241 (1983).
- Lue, T. F., Takamura, T., Umraiya, M., Schmidt, R. A., Tanagho, E. A. Hemodynamics of canine corpora cavernosa during erection. Urology. 24 (4), 347-352 (1984).
- Semans, J. H., Langworthy, O. R. Observations on the neurophysiology of sexual function in the male cat. The Journal of Urology. 40 (6), 836-846 (1938).
- Canguven, O., Burnett, A. Cavernous nerve injury using rodent animal models. TheJournal of Sexual Medicine. 5 (8), 1776-1785 (2008).
- Sezen, S. F., Hoke, A., Burnett, A. L., Snyder, S. H. Immunophilin ligand FK506 is neuroprotective for penile innervation. Nature Medicine. 7 (10), 1073-1074 (2001).
- Leungwattanakij, S., et al. Cavernous neurotomy causes hypoxia and fibrosis in rat corpus cavernosum. Journal of Andrology. 24 (2), 239-245 (2003).
- Burnett, A. L., Becker, R. E. Immunophilin ligands promote penile neurogenesis and erection recovery after cavernous nerve injury. Journal of Urology. 171 (1), 495-500 (2004).
- Mulhall, J. P. Defining and reporting erectile function outcomes after radical prostatectomy: challenges and misconceptions. Journal of Urology. 181 (2), 462-471 (2009).
- Quinlan, D. M., Nelson, R. J., Partin, A. W., Mostwin, J. L., Walsh, P. C. The rat as a model for the study of penile erection. Journal of Urology. 141 (3), 656-661 (1989).
- Burnett, A. L., Lowenstein, C. J., Bredt, D. S., Chang, T. S., Snyder, S. H. Nitric oxide: a physiologic mediator of penile erection. Science. 257 (5068), 401-403 (1992).
- Carrier, S., et al. Regeneration of nitric oxide synthase-containing nerves after cavernous nerve neurotomy in the rat. Journal of Urology. 153 (5), 1722-1727 (1995).
- El-Sakka, A. I., et al. Effect of cavernous nerve freezing on protein and gene expression of nitric oxide synthase in the rat penis and pelvic ganglia. Journal of Urology. 160 (6), 2245-2252 (1998).
- Mullerad, M., Donohue, J. F., Li, P. S., Scardino, P. T., Mulhall, J. P. Functional sequelae of cavernous nerve injury in the rat: is there model dependency. TheJournal of Sexual Medicine. 3 (1), 77-83 (2006).
- Hayashi, N., et al. The effect of FK1706 on erectile function following bilateral cavernous nerve crush injury in a rat model. Journal of Urology. 176 (2), 824-829 (2006).
- Hsieh, P. S., et al. The effect of vascular endothelial growth factor and brain-derived neurotrophic factor on cavernosal nerve regeneration in a nerve-crush rat model. BJU International. 92 (4), 470-475 (2003).
- Hox, M., Mann-Gow, T., Lund, L., Zvara, P. Cavernous Nerve Stimulation and Recording of Intracavernous Pressure in a Rat. Journal of Visualized Experiments. (134), e56807 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены