Method Article
Intrakavernöse Druckaufzeichnung in einem Rattenmodell mit Verletzung des Nervus cavernosus
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Entwicklung eines stabilen bilateralen Modells für Rattenverletzungen des Nervus cavernosus, das mit radikaler Prostatektomie in Verbindung mit erektiler Dysfunktion und intrakavernöser Druckmessung einhergeht.
Zusammenfassung
Das Modell der bilateralen Verletzung des Nervus cavernosus (CN) bei der Ratte wurde ausgiebig verwendet, um klinische Verletzungen des Nervus cavernosus im Zusammenhang mit erektiler Dysfunktion (ED) zu simulieren und die Wirkung klinischer therapeutischer Methoden zu bewerten. Die Methoden zur Erstellung von CN-Verletzungsmodellen sind jedoch fehlerhaft und variieren im Bereich der ED-Forschung. Es ist die CN-Quetschverletzung, die in den letzten Jahren die am häufigsten verwendete Methode ist. Ziel dieser Studie ist es, eine detaillierte Beschreibung des Verfahrens der Konstruktion eines bilateralen CN-Verletzungsmodells für Ratten und der Messung der intrakavernösen Druckaufzeichnung (ICP) zu liefern, um ein zuverlässiges und reproduzierbares Modell für CN-Verletzungen an Ratten bereitzustellen. In dieser Arbeit wurde erfolgreich die CN-Verletzungsmethode der Hämostatenquetschverletzung entwickelt, bei der eine Spritzennadel als harte Unterstützung und ein Hämostat mit einer Gummimanschette verwendet werden. Außerdem kommt diese Methode zu dem Schluss, dass eine Spannung von 1,0 V, eine Frequenz von 20 Hz und eine Pulsbreite von 5 ms die optimierten Stimulationsparameter für die ICP-Aufzeichnung in einem bilateralen CN-Verletzungs-Rattenmodell sind.
Einleitung
ED ist eine der häufigsten Erkrankungen bei erwachsenen Männern. Es wird geschätzt, dass die Zahl der ED-Patienten weltweit bis 2025 322 Millionen erreichen wird1. Eine multizentrische umfangreiche Stichprobenerhebung in China zeigt, dass der Anteil der durch Beckenoperationen oder Traumata verursachten ED bei etwa 8 %2 liegt. Trotz der kontinuierlichen Verbesserung der Operationstechniken und chirurgischen Instrumente ist die Inzidenz von ED nach wie vor hoch. Es wurde davon ausgegangen, dass die Entwicklung und das Fortschreiten der ED nach nervenschonender radikaler Prostatektomie (RP) zu einer Schädigung des Nervus cavernosus beiträgt, die zu einer Atrophie des Corpus cavernosum, der glatten Muskulatur, der Apoptose der Endothelzellen und einem pathologischen Umbau führt 3,4.
Zur Untersuchung des Mechanismus der hämodynamischen und histopathologischen Veränderungen der ZN-Schädigung im Zusammenhang mit ED wurden verschiedene Tiermodelle für ZN-Verletzungen entwickelt und bewertet, darunter Nagetiere, Hunde, Katzen und Affen 5,6,7. Aufgrund der Vorteile in Bezug auf Aufwand und Reproduzierbarkeit hat sich das bilaterale Modell der KN-Verletzungsratte zum gebräuchlichsten Modell für die Beurteilung der ED nach radikalen Beckenoperationenentwickelt 8. In der zahlreichen Literatur wurden jedoch verschiedene Formen von Nervenverletzungen beschrieben, deren Hauptunterschiede die Ansätze der Nervenverletzung (Quetschen, Einfrieren, Durchtrennen und Exzision) sind9,10,11. Darüber hinaus könnte die Vielfalt der Ansätze zur Nervenverletzung zu einer Inkonsistenz der Parameter für die Aufzeichnung des intrakavernösen Drucks (ICP) im Rattenmodell führen, was die Genauigkeit und Bewertung von ICP8 bestimmt. Dennoch gibt es noch keine standardisierte Methode zur Induktion von Nervenverletzungen und zur Aufzeichnung des ICP des Modells.
Daher zielt diese Studie darauf ab, ein zuverlässigeres und reproduzierbareres bilaterales Modell für CN-Verletzungen von Ratten zu erstellen. Diese Methode bietet eine detaillierte Beschreibung des Verfahrens der Modellkonstruktion und der ICP-Messung, die für die Untersuchung der Mechanismen der ED und die Entwicklung wirksamer Behandlungen in der Zukunft von Vorteil sein könnte.
Protokoll
In dieser Studie wurden fünfzehn erwachsene männliche Sprague-Dawley-Ratten (3 Monate alt) mit einem Gewicht zwischen 300 und 350 g verwendet. Alle Tiereingriffe wurden gemäß den NIH-Richtlinien für die Pflege und Verwendung von Labortieren und mit Genehmigung des Institutional Animal Care and Use Committee des fünften angeschlossenen Krankenhauses der Sun Yat-Sen University durchgeführt. Die Tiere wurden in einer komfortablen Anlage mit kontrollierter Temperatur und Licht untergebracht.
1. Materialien zur Vorbereitung auf chirurgische Eingriffe
- Bereiten Sie die folgenden Instrumente vor: Skalpell, Gewebeschere, Fadenschere, Biegezange, Gewebezange, mikrochirurgische Zange, hämostatische Hartman-Mückenzange, sterile chirurgische Laken, einen Mikronadelhalter, Abdominalretraktoren für Ratten und ein biologisches Signalerfassungs- und -verarbeitungssystem (siehe Materialtabelle).
- Sterilisieren Sie alle chirurgischen Instrumente vor der Operation. Verwenden Sie alkoholische Tücher (70 % Ethanol), um den Operationsbereich zu reinigen.
HINWEIS: Die chirurgischen Instrumente sollten über Nacht durch Eintauchen in Alkohol sterilisiert werden.
- Sterilisieren Sie alle chirurgischen Instrumente vor der Operation. Verwenden Sie alkoholische Tücher (70 % Ethanol), um den Operationsbereich zu reinigen.
- Vorbereiten des Druckaufzeichnungssystems
- Verbinden Sie eine 10-ml-Spritze mit Heparinkochsalzlösung und einer subkutanen 25-G-Nadel mit einem Schlauch (20 cm Länge) mit einem 3-Wege-Absperrhahn. Spülen Sie das sterilisierte Röhrchen mit steriler Heparin-Kochsalzlösung (200 U/ml).
HINWEIS: Durch das Befüllen der Tube mit Heparin-Kochsalzlösung wird das Einbringen von Luftblasen in das System vermieden.
- Verbinden Sie eine 10-ml-Spritze mit Heparinkochsalzlösung und einer subkutanen 25-G-Nadel mit einem Schlauch (20 cm Länge) mit einem 3-Wege-Absperrhahn. Spülen Sie das sterilisierte Röhrchen mit steriler Heparin-Kochsalzlösung (200 U/ml).
- Heben Sie die 25 G Nadel 20 cm (nur die Schlauchlänge) über das Tier-OP-Pad. Prüfen Sie anschließend die Messgenauigkeit des Druckaufzeichnungssystems durch Spülen oder Klopfen.
2. Vorbereitung des Tieres
- Betäuben Sie Ratten durch intraperitoneale Natrium-Pentobarbital-Injektion (60 mg/kg) (siehe Materialtabelle).
HINWEIS: Um eine ausreichende Anästhesietiefe zu bestätigen, wurde eine Bewertung des spontanen Atemrhythmus und der Reflexe einer Ratte durch Einklemmen der Hinterpfote durchgeführt. - Tragen Sie Salbe auf beide Augen auf, um Hornhauttrockenheit zu vermeiden.
- Nachdem Sie eine ordnungsgemäße Betäubung bestätigt haben, rasieren Sie die untere Hälfte des Bauches, des Halses und des Perineums mit einem Elektrorasierer. Legen Sie die Ratte in Rückenlage auf ein Heizkissen (37 °C). Tragen Sie medizinische Handschuhe, um bei chirurgischen Eingriffen sterile Bedingungen zu gewährleisten.
3. Verfahren zur Isolierung und Verletzung der KN
- Verwenden Sie ein Skalpell, um einen 4 cm langen Schnitt durch die Haut an der unteren, mittleren Bauchlinie zu machen. Um die Blase und die Prostata vollständig freizulegen, verwenden Sie eine Gewebeschere und eine Gewebezange, um einen Schnitt durch die subkutane Faszie, das Muskelgewebe und das Bauchfell zu machen.
- Verwenden Sie einen Bauchretraktor für Ratten, um die operative Feldkarte zu vergrößern. Verwenden Sie saugfähige Wattestäbchen, um die Prostata von den angrenzenden Geweben, wie z. B. den Bändern, zu trennen.
HINWEIS: Das große Beckenganglion (MPG) und das CN können in einem von zwei dorsolateralen Bereichen der Prostata gefunden werden. - Verwenden Sie eine abgewinkelte Mikroschere, um die Faszie über CN 1-6 mm distal von MPG zu schneiden. Schieben Sie dann eine Naht 9-0 mit Hilfe einer mikrochirurgischen Pinzette unter die CN.
- Platzieren Sie eine Spritzennadel (25 G) unter dem CN, 5 mm distal zum MPG. Stellen Sie dann das Blutstillungsmittel in das Licht der Sandwichstruktur "Hämostatenspitze-Spritze-Nadel-Nerven-Hämostat-Spitze" (Abbildung 1 und Abbildung 2).
HINWEIS: Die Spritzennadel muss flach geschliffen werden. - Tragen Sie das Blutstillbad mit vollem Spitzenverschluss in einem Abstand von 5 mm vom Ganglion für 1 Minute auf und ziehen Sie dann das Blutstillbad und die Spritzennadel zurück (Abbildung 2).
- Heben Sie den Nerv mit einer 9-0-Naht leicht an und platzieren Sie die Haken der bipolaren Elektrode (siehe Materialtabelle) um den CN 2-4 mm distal von MPG (Abbildung 3).
HINWEIS: Zwei Paare von MPG und CN wurden auf die gleiche Weise betrieben.
4. Katheterisierung des Corpus cavernosum und Stimulation des KN für die ICP-Messung
- Spülen Sie das Röhrchen mit steriler Heparinkochsalzlösung (200 U/ml), bevor Sie es in den Schwellkörper einführen.
- Halten Sie die 25 G Nadel fest und halten Sie die Einstichrichtung parallel zum Verlauf des Corpus cavernosum (Abbildung 3).
HINWEIS: Die Tunica albuginea sollte gedehnt werden, um das Einführen zu erleichtern. - Schieben Sie die 25 G Nadel 6 mm in den Schwellkörper (Abbildung 3). Spülen Sie das Rohr und drücken Sie leicht auf den Schwellkörper, um die Empfindlichkeit des Schallkopfs zu beurteilen (Abbildung 4). Um ein versehentliches Herunterfallen zu verhindern, fixieren Sie das Rohr mit Klebeband auf dem Arbeitstisch.
- Für die CN-Stimulation sind folgende Parameter zu verwenden: Spannung bei 1,0 V, Frequenz bei 20 Hz, Pulsbreite bei 5 ms. Wenden Sie 1 Minute Stimulation mit 5 Minuten Pause zwischen der folgenden Stimulation an.
HINWEIS: Drehen Sie den 3-Wege-Absperrhahn beim Starten der Messung auf den Druckmessumformerkanal.
5. Postoperative Pflege
- Legen Sie die Ratten auf eine erwärmte Unterlage (37 °C) und überwachen Sie sie sorgfältig auf die Wiederherstellung der Narkose.
- Zur postoperativen Schmerzkontrolle sind nichtsteroidale Antirheumatika (wie Carprofen, 0,5 mg/kg, subkutane Injektion) (siehe Materialtabelle) zu verabreichen, wenn sich die Ratten vollständig erholt haben.
- Bringen Sie die Ratten in den aseptischen Käfig und überwachen Sie sie 2 Tage, um den Ernährungszustand, den psychischen Zustand und die Infektion der Schnittwunde zu beurteilen.
Ergebnisse
Der chirurgische Eingriff erzeugte eine typische ICP-Reaktionskurve unter Verwendung dieses Protokolls mit den empfohlenen Stimulationseinstellungen. Die ICP-Reaktionskurve steigt sofort an, wenn der Nerv stimuliert wird, und sinkt, wenn die Stimulation zurückgezogen wird (Abbildung 5). Vor der Messung des ICP ist es wichtig, die intrakavernöse Druckleitung zu untersuchen, was sich auf die Bewertung erhöhter ICP-Werte auswirkt (Abbildung 4).
Wie in Abbildung 6 dargestellt, gibt es keinen signifikanten Unterschied zwischen dem ICP-Spitzenwert und dem ICP-Plateau, wenn die Spannung bei normalen Ratten über 1,0 V liegt (ohne Verletzung des Nervus cavernosus). Der ICP-Spitzenwert und das ICP-Plateau nehmen jedoch mit zunehmender Stimulationsspannung über 1,0 V nach einer Verletzung des Nervus cavernosus zu (Abbildung 7). Die ICP-Messung wurde vor der Operation, 0, 7 und 28 Tage nach der CN-Zerkleinerung bewertet. Es gab einen signifikanten Unterschied der ICP zwischen 0 Tagen und 7 bzw. 28 Tagen nach der Operation, aber keinen statistischen Unterschied zwischen 7 Tagen und 28 Tagen (Abbildung 8). Dies deutet darauf hin, dass das Modell der CN-Verletzungsratte nach der aktuellen Methode zuverlässig ist.
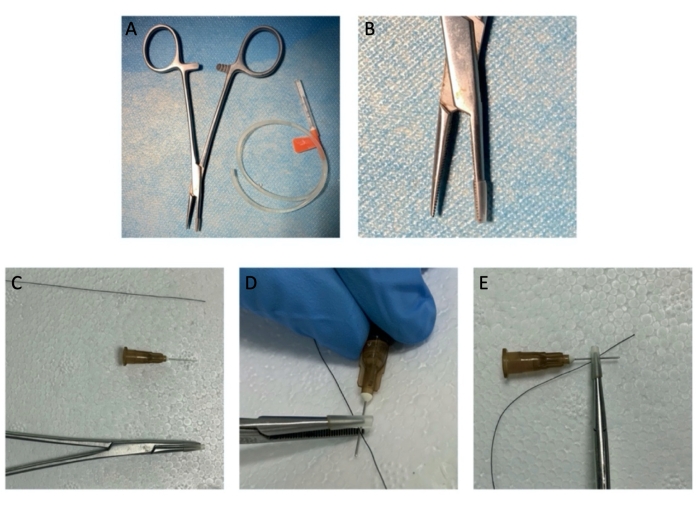
Abbildung 1: Die Instrumente der Hämostatenquetschverletzung. (A, B) Der Hämostat mit einer Gummimanschette. (C-E) Dargestellt wird der simulative Aufbau von "Hämostatenspitze-Spritzennadel-Nerv-Hämostatspitze". Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Der Ablauf der Verletzung der Nervus cavernosus. (A) Die anatomische Struktur des MPG und des CN (markiert durch eine rote Linie). (B) Platzieren einer Spritzennadel unter dem CN in einem bestimmten Winkel (roter Pfeil). (C) Ein Blutstiller wurde auf CN angewendet, um eine Verletzung zu verursachen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
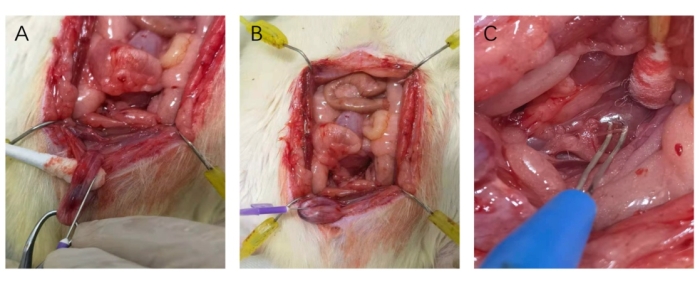
Abbildung 3: Katheterisierung des Corpus cavernosum und Haken des Nervs. (A) Die 25-G-Nadel war beim Katheterisieren parallel zum Verlauf des Corpus cavernosum. (B) Schieben Sie die 25-G-Nadel in den Schwellkörper. (C) Platzieren des Nervs an den Haken der bipolaren Elektrode. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Untersuchung der intrakavernösen Druckleitung. Die empfindliche Reaktionskurve deutet darauf hin, dass sich die 23-G-Nadel in der korrekten Position von intracavernös befindet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
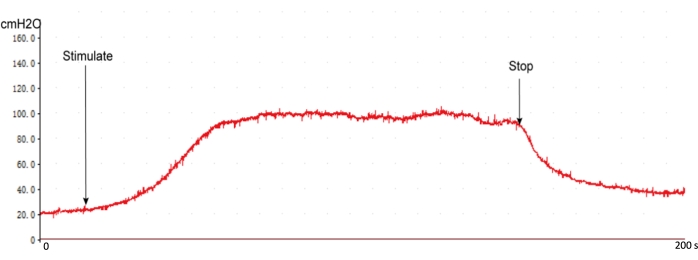
Abbildung 5: Die typische ICP-Reaktionskurve normaler Ratten. Wenn die Stimulation des CN beginnt, steigt der ICP schnell an und tritt in ein Plateau ein. Der ICP sank ohne Stimulation auf den Ausgangswert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Die Wirkung der Spannungsgradientenstimulation auf den ICP ohne Verletzung des Nervus cavernosus. Mit zunehmender Stimulationsspannung über 1,0 V nehmen der Spitzen-ICP und das ICP-Plateau nicht zu. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
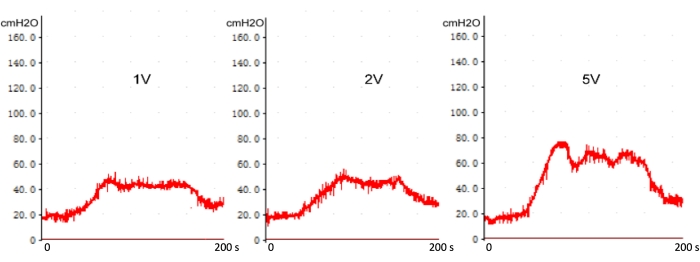
Abbildung 7: Die Stimulation des Spannungsgradienten auf dem ICP mit Echtzeit-Verletzung des Nervus cavernosus. Mit zunehmender Stimulationsspannung über 1 V nehmen der Spitzen-ICP und das Plateau des ICP zu. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
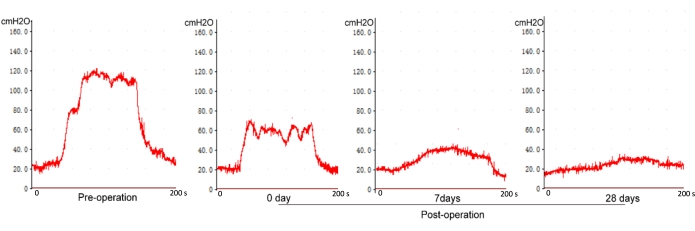
Abbildung 8: Die Messung des ICP zu verschiedenen Zeitpunkten nach der Operation. Eine ICP-Abnahme hält einen niedrigeren ICP-Spiegel bis zu 28 Tage aufrecht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
ED ist eine schwere Komplikation einer Beckenoperation oder eines Traumas. Trotz einer nervenschonenden Operation liegt die Inzidenzrate der ED bei der radikalen Prostatektomie (RP) bei etwa 14-90 %12. Aufgrund der problematischen Regeneration der Verletzung des CN ist die klinisch heilende Wirkung nicht zufriedenstellend. Daher ist ein stabiles Tiermodell für ZNS-Verletzungen für die Erforschung von Behandlungen von ED unerlässlich. Quinlan et al. berichteten zuerst über das CN-Verletzungs-Rattenmodell für die Studie der RP-assoziierten ED13. Mehrere Studien entwickelten Modelle für CN-Verletzungen an Ratten auf der Grundlage des Quinlan-Modells, einschließlich Durchtrennung, Exzision, Zerkleinerung und Einfrieren derCN 8,14,15,16,17. Jede Art von Verletzung kann einseitig oder bilateral für ein bestimmtes Versuchsdesign durchgeführt werden.
Trotz des geringsten Verletzungsgrades kann der Quetschtyp das Perilemma epineurium des ZNA erhalten. Die bilaterale CN-Quetschverletzung ist die beste Analogie zur nervenschonenden RP 18,19. Dennoch gibt es einige Probleme mit den Methoden der CN-Quetschverletzung, über die in der aktuellen Studie berichtet wurde. Das Fehlen eines ausreichenden Verletzungsgrades und mehrere Verletzungen schränken die Anwendung des Modells ein. Ein Single-Point-Injury-Modell mit adäquatem Grad hat in der Grundlagenforschung einen beispiellosen Vorteil. Aus diesem Grund hatten wir ein stabileres bilaterales Modell für CN-Verletzungsratten der RP-assoziierten ED entwickelt.
CN ist aufgrund seiner schlanken Größe anfällig für Neurotmesis. In dieser Studie wurde zunächst eine Operationsfertigkeit vorgeschlagen, um einen angemessenen Verletzungsgrad sicherzustellen und eine Nervendurchtrennung zu vermeiden, wobei eine Spritzennadel als starre Unterstützung und ein Blutstiller mit einer Gummimanschette verwendet wurden. Dennoch würden unterschiedliche Kompressionskräfte und -zeiten den Grad der Verletzung bestimmen, der die Erfolgsquote des Modellbaus beeinflusst. Die aktuelle Studie ergab, dass die Anwendung eines Blutstillers mit vollem Spitzenverschluss in 5 mm Abstand vom Ganglion für 1 Minute die am besten geeignete Betriebsart sein könnte.
Um die Stabilität und Zuverlässigkeit des Modells zu bewerten, wurde die Wiederherstellung der erektilen Funktion nach 0, 7 und 28 Tagen nach dem CN-Crush bewertet. Es wurde festgestellt, dass es einen signifikanten Unterschied des ICP zwischen 0 Tagen und 7 oder 28 Tagen gab; Es gab jedoch keinen signifikanten Unterschied zwischen den ICP-Werten der 7 Tage und der 28 Tage. Es deutet darauf hin, dass die erektile Funktion allmählich degeneriert und ein niedrigerer ICP-Spiegel bis zu 28 Tage aufrechterhalten wird. Dies deutet darauf hin, dass das bilaterale CN-Quetschverletzungs-Rattenmodell für ein einmonatiges Versuchsdesign geeignet ist.
Die CN-Stimulationsspannung in Studien hat keine allgemeine Übereinstimmung, sie variiert zwischen 1,0 und 12 V. Zunächst wurde die Wirkung der Spannungsgradientenstimulation auf den ICP an normalen Ratten untersucht. Mit zunehmender Stimulationsspannung über 1,0 V steigen der Spitzen-ICP und das Plateau des ICP nicht an. Unser Ergebnis stimmt mit der Arbeit von Hox, M. et al.20 überein. Dieses Phänomen deutet darauf hin, dass der über den Nerv geleitete Strom über der Schwelle liegt und ausreicht, um den Reflex auszulösen, was zu einer vollständigen physiologischen Reaktion führt. Nach der Verletzung wurde CN sofort durch Gradientenspannung stimuliert und ICP aufgezeichnet. Im Vergleich zu 1,0 V nehmen der Spitzen-ICP und das Plateau des ICP mit zunehmender Stimulationsspannung über 1 V zu. Die Verwendung einer höheren Stimulationsspannung kann zu einer "falsch positiven" ICP-Antwortkurve führen. Im Allgemeinen wird empfohlen, eine Spannung von 1,0 V, eine Frequenz von 20 Hz und eine Pulsbreite von 5 ms als Stimulationsparameter für die ICP-Aufzeichnung in einem bilateralen CN-Verletzungs-Rattenmodell zu verwenden.
Wie bei anderen Tiermodellen weist auch das bilaterale Modell der CN-Verletzungsratte nach der aktuellen Methode einige Einschränkungen im Vergleich zu klinischen Patienten auf. Das Rattenmodell mit der besseren Regenerationsfähigkeit des peripheren Nervensystems könnte die Bewertung der Nervenregeneration und -regeneration beeinflussen. Im Gegensatz dazu stellt es in der aktuellen Studie eine akzeptable Forschungsmethode dar. Daher ist es notwendig, ein stabileres bilaterales Modell der KN-Verletzungsratte für ED zu etablieren, das zur Transformation der Erfolge in der klinischen Behandlung beiträgt.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (Grant NO. 82071636) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 25 G needle | BD Bioscience | 367391 | |
| Abdominal retractor | RWD Life Science | R22009-01 | |
| Animal operating pad | Provided by Guangdong Provincial Key Laboratory of Biomedical Imaging | NA | |
| Bending forceps | RWD Life Science | F12011-10 | |
| Biological signal acquisition and processing system | Techman Software | BL-420S | |
| Bipolar electrode | Techman Software | AC0047 | |
| Carprofen | Sigma-Aldrich | MFCD00079028 | |
| HARTMAN mosquito hemostatic forceps | RWD Life Science | F22002-10 | |
| Heparin | Shanghai Aladdin Biochemical Technology | 2608411 | |
| Micro needle holder | RWD Life Science | F31047-12 | |
| Microsurgery forceps | RWD Life Science | F11001-11 | |
| Scalpel | RWD Life Science | S32003-12 | |
| Sodium pentobarbital | Guangdong Provincial Key Laboratory of Biomedical Imaging | NA | |
| Sprague–Dawley rat | Guangdong Medical Laboratory Animal Center | GDMLAC-035 | |
| Thread scissors | RWD Life Science | S15001-11 | |
| Tissue forceps | RWD Life Science | F13019-12 | |
| Tissue scissors | RWD Life Science | S13029-14 |
Referenzen
- Ayta, I. A., McKinlay, J. B., Krane, R. J. The likely worldwide increase in erectile dysfunction between 1995 and 2025 and some possible policy consequences. BJU International. 84 (1), 50-56 (1999).
- Li, D., et al. Multicenter pathophysiologic investigation of erectile dysfunction in clinic outpatients in China. Urology. 79 (3), 601-606 (2012).
- Montorsi, F., et al. Recovery of spontaneous erectile function after nerve-sparing radical retropubic prostatectomy with and without early intracavernous injections of alprostadil: results of a prospective, randomized trial. The Journal of Urology. 158 (4), 1408-1410 (1997).
- Mulhall, J. P., Graydon, R. J. The hemodynamics of erectile dysfunction following nerve-sparing radical retropubic prostatectomy. International Journal of Impotence Research. 8 (2), 91-94 (1996).
- Lue, T. F., Takamura, T., Schmidt, R. A., Palubinskas, A. J., Tanagho, E. A. Hemodynamics of erection in the monkey. Journal of Urology. 130 (6), 1237-1241 (1983).
- Lue, T. F., Takamura, T., Umraiya, M., Schmidt, R. A., Tanagho, E. A. Hemodynamics of canine corpora cavernosa during erection. Urology. 24 (4), 347-352 (1984).
- Semans, J. H., Langworthy, O. R. Observations on the neurophysiology of sexual function in the male cat. The Journal of Urology. 40 (6), 836-846 (1938).
- Canguven, O., Burnett, A. Cavernous nerve injury using rodent animal models. TheJournal of Sexual Medicine. 5 (8), 1776-1785 (2008).
- Sezen, S. F., Hoke, A., Burnett, A. L., Snyder, S. H. Immunophilin ligand FK506 is neuroprotective for penile innervation. Nature Medicine. 7 (10), 1073-1074 (2001).
- Leungwattanakij, S., et al. Cavernous neurotomy causes hypoxia and fibrosis in rat corpus cavernosum. Journal of Andrology. 24 (2), 239-245 (2003).
- Burnett, A. L., Becker, R. E. Immunophilin ligands promote penile neurogenesis and erection recovery after cavernous nerve injury. Journal of Urology. 171 (1), 495-500 (2004).
- Mulhall, J. P. Defining and reporting erectile function outcomes after radical prostatectomy: challenges and misconceptions. Journal of Urology. 181 (2), 462-471 (2009).
- Quinlan, D. M., Nelson, R. J., Partin, A. W., Mostwin, J. L., Walsh, P. C. The rat as a model for the study of penile erection. Journal of Urology. 141 (3), 656-661 (1989).
- Burnett, A. L., Lowenstein, C. J., Bredt, D. S., Chang, T. S., Snyder, S. H. Nitric oxide: a physiologic mediator of penile erection. Science. 257 (5068), 401-403 (1992).
- Carrier, S., et al. Regeneration of nitric oxide synthase-containing nerves after cavernous nerve neurotomy in the rat. Journal of Urology. 153 (5), 1722-1727 (1995).
- El-Sakka, A. I., et al. Effect of cavernous nerve freezing on protein and gene expression of nitric oxide synthase in the rat penis and pelvic ganglia. Journal of Urology. 160 (6), 2245-2252 (1998).
- Mullerad, M., Donohue, J. F., Li, P. S., Scardino, P. T., Mulhall, J. P. Functional sequelae of cavernous nerve injury in the rat: is there model dependency. TheJournal of Sexual Medicine. 3 (1), 77-83 (2006).
- Hayashi, N., et al. The effect of FK1706 on erectile function following bilateral cavernous nerve crush injury in a rat model. Journal of Urology. 176 (2), 824-829 (2006).
- Hsieh, P. S., et al. The effect of vascular endothelial growth factor and brain-derived neurotrophic factor on cavernosal nerve regeneration in a nerve-crush rat model. BJU International. 92 (4), 470-475 (2003).
- Hox, M., Mann-Gow, T., Lund, L., Zvara, P. Cavernous Nerve Stimulation and Recording of Intracavernous Pressure in a Rat. Journal of Visualized Experiments. (134), e56807 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten