Method Article
Imagens rápidas de alta resolução de montagem total de vasculatura de pequenos animais para estudos quantitativos
Neste Artigo
Resumo
Este protocolo apresenta um método rápido para imagens vasculares tridimensionais quantitativas de montagem total usando microscopia de fluorescência de folha de luz. A eficácia do método é demonstrada usando o sistema de artérias do arco faríngeo do modelo de embrião de galinha, com forças hemodinâmicas quantificadas via fluidodinâmica computacional.
Resumo
Em modelos de pequenos animais de desenvolvimento cardiovascular e doenças, simulações computacionais específicas do fluxo sanguíneo permitem avaliações quantitativas de métricas hemodinâmicas que são difíceis de medir experimentalmente. Simulações computacionais de dinâmica de fluidos lançam luz sobre os papéis críticos da mecânica na função cardiovascular e na progressão da doença. A aquisição de imagens volumétricas de alta qualidade dos vasos de interesse é fundamental para a precisão e reprodutibilidade dos resultados de medição morfológica e quantificação de fluxo. Este estudo propõe um método rápido, econômico e acessível para imagens de alta resolução de montagem total da vasculatura de pequenos animais usando microscopia de fluorescência de folha de luz. O protocolo modificado de preparação de amostra de folha de luz iDISCO+ (imagem tridimensional habilitada para imunomarcação de órgãos limpos com solvente) envolve (1) marcação da vasculatura com um agente fluorescente, (2) preservação da amostra e (3) tornar a amostra transparente. Ao contrário do iDISCO + clássico, que usa coloração imuno-histoquímica, os autores rotulam o endotélio vascular com poli-L-lisina marcada com FITC, um corante fluorescente não específico acessível que é altamente resistente ao foto-branqueamento, em um processo denominado "endo-pintura". A rotulagem rápida reduz o tempo de preparação da amostra de aproximadamente quatro semanas para menos de 3 dias. Além disso, o uso de cinamato de etila (ECi) de solvente minimamente perigoso como agente de compensação e solução de imagem torna as amostras mais seguras de manusear e compatíveis com uma ampla gama de instalações de imagem. O protocolo proposto é aplicado para obter pilhas de imagens de microscopia de fluorescência de folha de luz altamente resolvidas do sistema cardiovascular em embriões de galinha variando do dia 3 (HH18) ao dia 8 (HH34). Este estudo demonstra ainda a adequação deste método para quantificação vascular por meio de reconstrução 3D e modelagem hemodinâmica computacional de um embrião de pintinho dia 5 (HH 26).
Introdução
A imagem volumétrica é necessária para estudos precisos da fisiologia e doenças cardiovasculares. A imagem quantitativa produz pilhas de imagens de alta resolução com dimensões volumétricas intactas. As amostras devem ser preservadas para manter sua morfologia in vivo e volume de lúmen, bem como imagens em uma capacidade uniforme de alta resolução. A partir de pilhas de imagens de alta resolução, o usuário pode gerar renderizações vasculares tridimensionais de alta fidelidade que permitem uma exibição completa das formas, estrutura e conectividade dos vasos1.
As estruturas cardiovasculares possuem características anatômicas tridimensionais complexas que não podem ser capturadas com precisão ao examiná-las através de uma lente bidimensional e desarticulada. A imagem morfológica de campo amplo do estereoscópio e os cortes histológicos são inadequados para capturar variações tridimensionais complexas 1,2,3. As imagens de micro e nanotomografia computadorizada são o padrão-ouro para imagens volumétricas quantitativas de pequenos animais 1,4, mas não são amplamente acessíveis ou adotadas entre a comunidade biológica. Inovações recentes na limpeza de tecidos e microscopia de órgãos inteiros/pequenos animais permitiram aplicações quantitativas de técnicas de limpeza de montagem total e marcação vascular 5,6,7. A limpeza de tecidos funciona para homogeneizar o espalhamento de luz em amostras de tecido, reduzindo assim os atrasos na propagação da luz através do meio, diminuindo a chance de dispersão ou absorção de luz. A alta transparência requer um processamento rigoroso de tecidos que pode afetar a antigenicidade ou o brilho da marcação do sinal de fluorescência8. A microscopia de folha de luz emergiu como uma ferramenta de imagem rápida e poderosa amplamente adotada pelos biólogos9, oferecendo um ganho de velocidade de várias ordens de magnitude em relação aos microscópios de varredura e a capacidade de obter imagens de amostras com mais de 1 cm de tamanho. Por meio da microscopia de fluorescência de folha de luz (LSFM), um laser ilumina uma seção transversal da amostra com maior velocidade e profundidade em comparação com a microscopia confocal; Por esse motivo, o método requer alta transparência da amostra.
Aqui, os autores adaptam os métodos recentes de limpeza iDISCO+, combinando-os com a endo-pintura10 no modelo animal de embrião de galinha para mostrar a eficácia do método do desenvolvimento cardiovascular inicial ao tardio. O iDISCO (imagem tridimensional habilitada para imunomarcação de órgãos limpos com solvente) é um método de limpeza baseado em solvente orgânico, que, ao contrário dos métodos baseados em limpeza aquosa, não está sujeito a artefatos de imagem causados pela evaporação do solvente. O iDISCO difere do iDISCO+ porque a etapa de desidratação do tetrahidrofurano do primeiro (iDISCO) é substituída por uma desidratação mais suave do metanol seguida por uma etapa de extração lipídica (iDISCO+). As vantagens do método de limpeza iDISCO+ incluem imunomarcação de grandes amostras e embriões adultos, baixo encolhimento do tecido e alta transparência 8,11. É importante ressaltar que o iDISCO+ permite a geração de pilhas de imagens de alta resolução, expandindo as técnicas tradicionais de imunomarcação biológica para obter informações sobre grandes amostras de órgãos ou um embrião inteiro, em vez de se limitar à amostragem de pequenas regiões que carecem de informações sobre toda a organização do nível do tecido, como na histologia tradicional9. As desvantagens do iDISCO+ incluem o fato de que as proteínas fluorescentes geneticamente codificadas não são preservadas11. O método de marcação de tecidos de endopintura foi introduzido pela primeira vez como uma triagem de alto rendimento para defeitos cardiovasculares usando corações de embriões de galinha HH31-HH36 que foram perfundidos com 0,5 mg / ml de FITC-poli-L-lisina no ápice do ventrículo esquerdo. O corante foi deixado se ligar por 4 min antes da fixação e armazenamento10.
O presente estudo descobriu que a mesma concentração de FITC-poli-L-lisina poderia ser usada para uma gama mais ampla de embriões (HH18 - HH34), mas encontrou o tempo de fixação ideal para variar (de 5 a 10 min) para garantir vasos bem marcados. Os usuários da atual técnica endo-DISCO podem querer ajustar a concentração do corante (diminuindo em 0,1 mg / mL de cada vez) caso a solução se mostre muito viscosa para rotular todos os vasos desejados, mas são encorajados a primeiro ajustar o tempo de fixação e otimizar a contração muscular do ventrículo esquerdo antes de ajustar a concentração do corante. Os autores tentaram a endopintura com uma concentração de 0,1 mg / mL e descobriram que, embora o corante se espalhasse mais facilmente através de pequenos vasos, ele era mais facilmente lavado após a perfusão de PFA. Os autores mostram que as pilhas de imagens de alta resolução geradas por meio da presente técnica são de qualidade suficiente para modelagem hemodinâmica computacional. Os caminhos do fluxo sanguíneo e as forças hemodinâmicas correspondentes, incluindo as distribuições de pressão e tensão de cisalhamento da parede, ocorrem em padrões localizados complexos que só podem ser resolvidos por meio de simulações computacionais de fluxo 1,12. Essas forças biomecânicas afetam o comportamento dos tecidos cardiovasculares adjacentes e desencadeiam adaptação, crescimento e remodelação vascular13. A compreensão dos valores da força hemodinâmica local lança luz crítica sobre os reguladores mecanicistas da função cardiovascular e do início ou progressão da doença2.
Protocolo
O Escritório de Bem-Estar de Animais de Laboratório interpreta a política do Serviço de Saúde Pública como aplicável ao modelo de pintinho como um "animal vertebrado" somente após a eclosão. Esses embriões também estão isentos da jurisdição do Comitê Institucional de Cuidados e Uso de Animais (IACUC). As perguntas frequentes relevantes do National Institutes of Health podem ser acessadas em: http://grants.nih.gov/grants/olaw/faqs.htm#ApplicabilityofthePHSPolicy.
1. Coleta, rotulagem e fixação de embriões
- Fashion puxou hastes capilares de vidro de 0,75 de diâmetro interno em microagulhas cortadas usando uma microforja 1,12.
NOTA: O tamanho da ponta necessária depende da idade/vazão do animal desejada. A microagulha pode alternativamente ser cortada usando pinças de microdissecção ou tesouras com precisão bastante reduzida. - Aqueça a solução de Tyrode a aproximadamente 38 ° C.
- Dissolva o sólido de poli-L-lisina FITC na solução de Tyrode para preparar uma solução estoque de 0,5 mg / mL.
NOTA: Esta concentração é otimizada para rotular artérias de embriões de galinha. A concentração ideal para outros tipos de tecido pode variar. A solução-mãe extra deve ser conservada a -20 °C. - Dissecar o embrião aviário (variando de HH18 (dia 3) a HH34 (dia 8) para o presente estudo cardíaco de pintinhos) da gema de ovo cortando ao redor do embrião com uma tesoura de ponta curva e usando uma pipeta de transferência ou uma espátula para transferir o embrião para uma placa de Petri de 35 mm cheia de solução de Tyrode quente.
- Remova cuidadosamente as membranas coriônicas e alantóides que envolvem o embrião e a membrana do pericárdio ao redor do coração com uma pinça de ponta fina, fazendo pequenas incisões (~ 0,1 mm) nas membranas e puxando-as para longe do embrião.
- Transfira o embrião para uma placa de Petri nova e limpa, cheia de solução quente de Tyrode para manter o coração batendo.
- Encha uma seringa de plástico de 5 ml com a solução de Tyrode quente. Apare a extremidade larga de uma ponta de pipeta de plástico de 0-20 μL e encaixe-a na ponta plana da seringa. A seringa foi agora estendida para o diâmetro fino da ponta da pipeta.
- Construa uma "linha de injeção" conectando um segmento de tubo de silicone de diâmetro interno de 0,03 polegada ao aparelho de seringa de ponta de pipeta recém-preso (etapa 1.7). Conecte uma microagulha capilar de vidro na extremidade oposta do tubo.
- Monte a microagulha no suporte de microinjeção conectado a um micromanipulador. Purgue o tubo de silicone e a microagulha de bolhas de ar.
- Usando o micromanipulador, insira a agulha no ápice do coração e perfunda o embrião 1,12 injetando lentamente a solução de Tyrode no coração. Continue perfundindo o embrião até que ele esteja praticamente limpo de sangue.
- Use o micromanipulador para puxar a agulha e a linha de injeção de volta de seu local de inserção e oriente a agulha para que não seja perturbada durante a preparação da próxima linha de injeção. Remova o tubo de silicone da agulha e da seringa.
NOTA: Alguns usuários podem achar ideal manter a agulha presa ao coração, caso em que o usuário deve remover o tubo de silicone entre a agulha e a seringa, mantendo a agulha no lugar. - Realize endo-pintura para marcar o endotélio vascular com fluorescência verde.
- Usando uma micropipeta, carregue 20-40 μL de solução estoque de poli-L-lisina FITC no tubo de silicone, com cuidado para não criar bolhas de ar antes da barreira de líquido FITC.
- Recoloque a seringa cheia com a solução de Tyrode e use o micromanipulador para injetar lentamente no ápice do coração, reinserindo a agulha se necessário. Remova a agulha após a difusão da poli-L-lisina FITC e antes que qualquer bolha de ar entre no coração.
- Deixe a poli-L-lisina FITC descansar no embrião por 5-10 min.
NOTA: (verificação de qualidade opcional) Para verificar a fluorescência, tire uma foto com um estéreo fluorescente ou macroscópio. A imagem pode ser usada para ajudar a determinar um fator de desidratação após a conclusão da limpeza do embrião.
- Encha uma seringa de 5 mL com paraformaldeído (PFA) a 4% e conecte-a ao tubo de injeção de silicone para uma terceira etapa de injeção.
- Perfundir o embrião 1,12 com 4% de PFA até que todas as estruturas cardiovasculares estejam em plena capacidade de volume e o tecido comece a ficar mais opaco.
- Carregue suavemente o embrião em um frasco de 2-5 mL cheio de PFA a 4% suficiente para cobrir a amostra. Tome cuidado para não deformar excessivamente o embrião.
NOTA: Escolha um frasco grande o suficiente para a amostra de interesse para evitar esmagar ou deformar a amostra. - Incubar o embrião durante a noite a 4 °C com um agitador.
2. Desidratação e limpeza de embriões
- Pipetar cuidadosamente o PFA a 4%.
NOTA: A partir deste ponto, evite o contato direto com o embrião para evitar danos ou deformações nos tecidos. - Para lavar o embrião, incube-o em solução tampão fosfato fresco (PBS) em temperatura ambiente por 30 min, agitando suavemente. Repita mais duas vezes para um total de 3 lavagens.
- Comece a desidratar o embrião em uma capela de exaustão. Pipete cuidadosamente o PBS e incube o embrião em uma série graduada de 5 incubações de metanol à temperatura ambiente por 1 h cada: concentração de 20%, 40%, 60%, 80% e 100% de metanol.
- Deixe o embrião em metanol 100% fresco em temperatura ambiente durante a noite.
NOTA: (Ponto de parada opcional). Os embriões podem ser armazenados a -20 °C em metanol 100% para uso posterior por até 6 meses. - Na hotte, inicie o procedimento de remoção de lípidos. Incubar o embrião em um DCM 2:1 (volume a volume): solução de metanol em temperatura ambiente por 3 h, agitando suavemente.
CUIDADO: O DCM é tóxico e deve ser manuseado na capela. Tome precauções extras ao trabalhar com DCM. Luvas duplas podem ajudar a fornecer uma barreira extra. - Retire o cinamato de etila (ECi) a 4 °C e deixe-o em temperatura ambiente para descongelar.
- Lave os embriões em DCM 100% fresco em temperatura ambiente por 15 min, agitando. Repita a lavagem 100% DCM para obter um total de 2 lavagens.
- Pipetar o DCM e incubar o embrião em 100% ECi. Deixe o embrião em ECi até que ele desapareça em aproximadamente 1 h. Agite suavemente o tubo, se necessário.
- (Etapa de verificação opcional) Examine a qualidade da limpeza e coloração do vaso com um estéreo fluorescente ou macroscópio. Tire uma foto do embrião para determinar o fator de escala de desidratação específico do estágio/idade.
- Conservar o embrião eliminado a 4 °C durante um período máximo de 6 meses até estar pronto para a imagem, mantendo o embrião protegido da luz.
3. Aquisição de dados
- Para obter imagens de embriões, use um microscópio fluorescente de folha de luz. Fixe a cabeça de um embrião opticamente limpo em um capilar de vidro usando gel de supercola.
- Monte o capilar de vidro no suporte da amostra, encha a câmara de imagem com ECi e abaixe o embrião na câmara de imagem.
- Ajuste os parâmetros e execute a imagem.
4. Aplicação quantitativa: reconstrução 3D e modelagem fluidodinâmica computacional
NOTA: Nestas etapas, as pilhas de imagens de alta resolução geradas por folhas de luz são carregadas no software de código aberto SimVascular14 para reconstrução anatômica 3D e modelagem dinâmica de fluidos computacional. Existem tutoriais detalhados no site do SimVascular (consulte Tabela de Materiais). A reconstrução consiste em criar linhas de caminho nos vasos de interesse, criar segmentações 2D ao longo das linhas de caminho e combinar segmentações elevadas em um modelo sólido 3D. A modelagem computacional consiste em preparar uma geometria em malha, definir condições de contorno e executar simulações.
- Crie um novo SVProject em Arquivo e carregue uma pilha de imagens de folha de luz de alta resolução clicando com o botão direito do mouse em Imagens e, em seguida, clicando em adicionar/substituir imagem.
- Siga as etapas do tutorial do software para reconstruir anatomias vasculares in silico.
- Crie uma linha de caminho clicando com o botão direito do mouse em Caminhos e selecionando criar caminho. Coloque marcadores de caminho ao longo de um recipiente de interesse. Repita para cada recipiente de interesse.
- Para cada linha de caminho criada, trace as seções transversais do vaso 2D clicando com o botão direito do mouse em Segmentações e selecionando Criar grupo de contorno. Selecione o caminho da embarcação e clique duas vezes no nome da embarcação em Segmentação para iniciar a segmentação manual.
- Depois que todas as embarcações tiverem sido segmentadas, crie um modelo clicando com o botão direito do mouse em Modelos e selecionando criar modelo. Selecione o tipo PolyData , insira um nome de modelo, clique em Criar modelo sólido e selecione todas as segmentações que devem fazer parte do modelo.
- Combine a geometria executando o gerador de malha Tetgen embutido no SimVascular SVMesher. Defina um tamanho máximo de aresta e execute a geração de malha de superfície e volume.
NOTA: Escolha um tamanho de malha que possa resolver detalhes geométricos finos e variabilidades hemodinâmicas localizadas no vaso. Comece com o botão Estimar um tamanho de malha global . Um estudo de convergência de malha pode ser necessário ao finalizar as simulações. - Configure uma simulação computacional de fluxo sanguíneo usando o Solucionador SimVascular. Crie arquivos de simulação clicando com o botão direito do mouse em Simulações e selecionando Criar trabalho de simulação. Ajuste os parâmetros básicos e selecione BCs de entrada e saída para condições de contorno específicas.
- Ajuste os parâmetros do Solver, navegue até a guia Criar arquivos e executar simulação, selecione o arquivo de malha e clique em Criar arquivos de dados para simulação.
- Inicie a simulação usando uma estação de trabalho de computação de alto desempenho ou supercomputador.
Resultados
O protocolo de imagem de alta resolução de montagem completa rápida apresentado aqui (Figura 1, Tabela 1) produz lúmens de vasos claramente delineados, conforme mostrado na Figura 2, Figura 3 e Figura 4, onde o endotélio da vasculatura do embrião de pintinho é fluorescente GFP e, portanto, delineado em verde nos estágios embrionários, desde o desenvolvimento inicial até o maduro do coração (Figura 4). É importante encontrar a combinação certa de concentração de poli-L-lisina, tempo de fixação do corante e uso de contrações ventriculares (quando aplicável) se a vasculatura da amostra não aparecer claramente rotulada (veja a Figura 2 para saber como os embriões devem ficar sob um estereoscópio fluorescente ou macroscópio antes da imagem LSFM.) Manter um coração batendo através da solução quente de Tyrode e a dissecção rápida do embrião longe do saco vitelino auxilia na difusão da solução por toda a amostra / modelo de pequeno animal. A viscosidade da poli-L-lisina pode ser controlada através da concentração da solução estoque. Uma solução menos viscosa pode ajudar na penetrância de fluorescência em toda a amostra, embora a robustez da marcação deva ser verificada após a perfusão de PFA. O usuário pode querer compensar uma concentração mais baixa de solução estoque de poli-L-lisina aumentando o volume injetado e permitindo um maior tempo de incubação antes de fixar o embrião com PFA.
A Figura 5 demonstra a adequação do método apresentado para reconstrução anatômica 3D e modelagem computacional. Os valores de tensão de cisalhamento da parede estão de acordo com os estudos anteriores dos autores baseados em reconstruções de nanotomografia computadorizada1.

Figura 1: Configuração de marcação e fixação de embriões (superior) e configuração de aquisição de dados de microscopia de folha de luz (inferior). Clique aqui para ver uma versão maior desta figura.

Figura 2: Embriões antes e depois dos procedimentos de limpeza. Embriões iluminados representativos de campo claro e canal GFP para amostras que passaram pelas etapas 1 (antes da limpeza) e 2 (após a limpeza) do protocolo, conforme visto com um macroscópio fluorescente. Observe como todo o embrião brilha no canal GFP antes de clarear, particularmente no coração para o qual as membranas externas foram removidas. Toda a vasculatura desejada é claramente rotulada no embrião eliminado por GFP. Barras de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
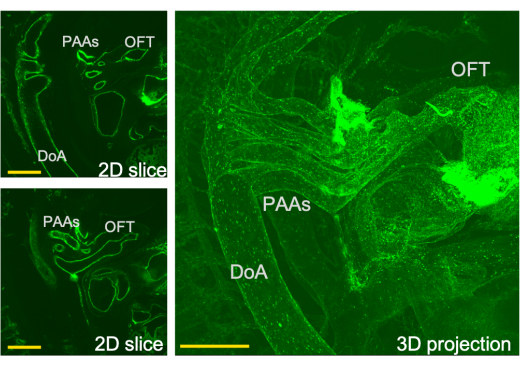
Figura 3: Visão tridimensional do sistema de fluxo cardíaco e cortes correspondentes através desta visão obtida pelo LSFM. PAA- artéria do arco faríngeo, OFT-via de saída, aorta DoA-dorsal. Barras de escala = 0,5 mm. Clique aqui para ver uma versão maior desta figura.
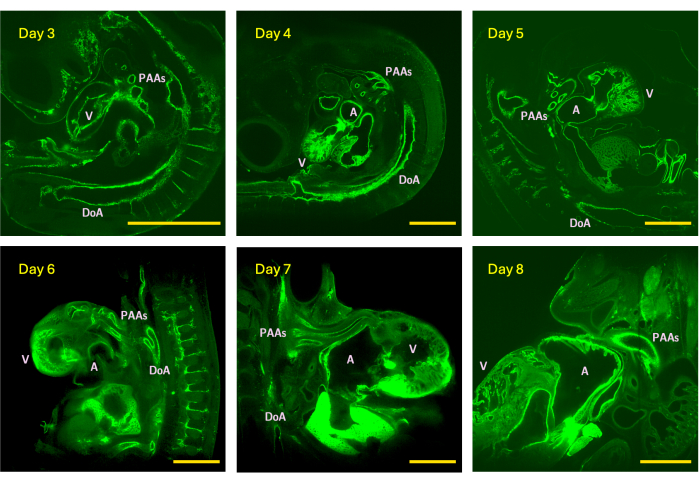
Figura 4: Exemplo de fatias z de pilhas de imagens LSFM adquiridas do dia 3 (estágio HH18), 4 (HH24), 5 (HH26), 6 (HH29), 7 (HH31) e 8 (HH34) embriões de pintinho. O tamanho da imagem representa o campo de visão máximo (sem ladrilhos) do osciloscópio equipado com uma objetiva de detecção de 5x. V - ventrículo; A - átrio; DoA - aorta dorsal; PAAs - artérias do arco faríngeo. Barras de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Reconstruções anatômicas representativas in silico do arco aórtico do dia 5 (estágio HH26) e principais resultados da simulação hemodinâmica. Esquerda: Um modelo de anatomia vascular reconstruído mostrando a via de saída (OFT), artérias do arco faríngeo (PAAs) e aorta dorsal (DoA). Médio: O fluxo sanguíneo agiliza no pico da sístole obtida usando simulação de fluxo sanguíneo. As linhas aerodinâmicas vermelhas atendem principalmente às regiões cranianas, enquanto as azuis atendem às regiões caudais. Direita: Pico de distribuição de tensão de cisalhamento da parede sistólica (WSS) sobre a parede do vaso obtida usando simulação de fluxo sanguíneo Clique aqui para ver uma versão maior desta figura.
| Dias | Passos | Hora | Temperatura |
| Dia 1 | Colheita de embriões | 5-10 min/embrião | RT (bancada) |
| FITC Endo-pintura | 10-30 min/embrião | RT (bancada) | |
| Correção de perfusão PFA | Perfusão: 5-15 min/embrião | Perfusão: RT (bancada) Incubação: 4 °C | |
| Incubação: O/N | |||
| Dia 2 | Lavagem PBS | 90 minutos | RT (bancada) |
| Desidratação | 5 h + O/N | RT (exaustor) | |
| Dia 3 | Remoção de lipídios | 3,5 h | RT (exaustor) |
| Clareira | ≥1 h | RT (bancada) |
Tabela 1: Visão geral da preparação da amostra para imagens quantitativas rápidas de folha de luz.
Discussão
A capacidade de estudar biologia em 3D é fundamental para uma compreensão precisa da complexidade morfológica, estrutura de órgãos internos e conexões vasculares. Imagens vasculares 3D precisas e confiáveis também são fundamentais para simulações hemodinâmicas computacionais específicas do assunto, que geralmente são o único meio confiável de quantificar os principais parâmetros hemodinâmicos, como tensão de cisalhamento da parede e distribuição de pressão. Aqui, os autores apresentam um método de preparação de amostra rápido e acessível para imagens vasculares 3D de alta resolução em pequenos animais usando LSFM. O método produz de forma confiável pilhas de imagens de alta resolução de embriões de pintinhos HH18 (dia 3) a HH34 (dia 8), que representam um período crítico do desenvolvimento cardíaco. De HH24 (dia 4) a HH34 (dia 8), o tamanho total do embrião aumenta de ~ 30-550 mm3, um aumento médio de crescimento de 2 vezes por período de 24 horas, com o tamanho do miocárdio cardíaco aumentando de ~ 1 mm3 (dia 4) para ~ 17 mm3 (dia 8) 15. Devido ao rápido crescimento embrionário e cardiovascular, as imagens para o estudo atual foram obtidas com uma resolução no plano que variou de 0,61 μm em HH18 (dia 3) a 2,28 μm em HH34 (dia 8) com uma faixa de passo z de 1,92-2,4 μm quando se concentra no sistema de artérias do arco faríngeo e de 1,22 μm (HH18) a 2,53 μm (HH34) com uma faixa de passo z de 1,94-3,5 μm ao capturar todo o embrião (Figura 4). As pilhas de imagens de alta resolução geradas são adequadas para reconstrução anatômica vascular in silico e simulações hemodinâmicas específicas do sujeito, conforme demonstrado por meio de modelos HH26 (dia 5), que foram fotografados em uma resolução no plano de 1,30 μm e tamanho de passo z de 1,92 μm16. Tal como acontece com outras técnicas de montagem total, o método proposto pode ser usado em modelos animais, particularmente ao realizar imagens de órgãos inteiros 5,6,7. A técnica iDISCO+ foi aplicada a corações de camundongos recém-nascidos e adultos5.
A principal vantagem do método proposto reside no uso de poli-L-lisina marcada com FITC para marcação fluorescente e ECi para limpeza. A poli-L-lisina é carregada positivamente sob pH fisiológico, por isso se liga de forma não específica ao endotélio vascular enquanto é perfundida através da amostra. O processo prende o FITC de forma rápida e confiável às paredes dos vasos, rotulando-os com uma fluorescência brilhante e estável que é altamente resistente ao fotobranqueamento. Tradicionalmente, a imagem microscópica volumétrica de montagem completa, incluindo LSFM, requer que as amostras sejam marcadas com coloração imuno-histoquímica. Esse procedimento exige o uso de anticorpos caros e estende o tempo de preparo da amostra para até 4 semanas 1,8,9. Os embriões precoces não expressam marcadores vasculares tradicionais, como elastina ou células musculares lisas vasculares, e são, portanto, mais difíceis de atingir com anticorpos específicos. Além disso, as amostras limpas são frequentemente fotografadas enquanto submersas na solução de limpeza. O procedimento clássico de limpeza iDISCO+ requer o composto perigoso éter dibenzílico, que muitas vezes não é permitido em instalações de imagem8. O ECi é um composto minimamente perigoso que é seguro de manusear fora do ambiente de laboratório e tem menos probabilidade de danificar o equipamento óptico. Se desejado, a técnica proposta pode ser combinada ou multiplexada com imunocoloração, desde que as propriedades de emissão espectral escolhidas permitam experimentos de co-expressão. A multiplexação pode aumentar o tempo de rotulagem e preparação da amostra.
O protocolo proposto tem algumas limitações. O procedimento é aplicável apenas a embriões sacrificados e tecidos excisados, excluindo a possibilidade de estudos longitudinais. A endopintura de poli-L-lisina FITC, embora rápida e econômica, requer um alto nível de destreza e precisão. Além disso, como o corante não penetra facilmente no tecido, ele apenas rotula as paredes dos vasos que pode alcançar, apresentando desafios para o estudo de pequenas redes capilares. Tais desafios podem ser gerenciados mantendo o coração batendo ao administrar a poli-L-lisina e ajustando a viscosidade/concentração da solução injetada. A inespecificidade do corante dificulta a distinção entre os tipos de vasos1. O excesso de poli-L-lisina FITC que vaza da vasculatura durante o processo de injeção também pode se ligar a tecidos não vasculares, como pele e membrana superficiais, o que pode interferir na folha de luz iluminante durante a imagem e reduzir a qualidade da imagem. O usuário deve estar atento ao injetar a poli-L-lisina para evitar vazamentos. O protocolo atual é validado extensivamente usando embriões de galinha em estágio inicial para imagens das principais artérias sistêmicas. A concentração, o volume e o tempo de fixação da injeção de poli-L-lisina FITC podem precisar ser otimizados para diferentes casos de uso.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado por um Prêmio de Desenvolvimento de Carreira da American Heart Association, Prêmio de Carreira do Burroughs Wellcome Fund na Interface Científica, Fundo de Pesquisa de Ventrículo Único de Empreendimentos Adicionais e Núcleo de Microscopia da Escola de Medicina da UCSD (Grant P30 NS047101). Os autores agradecem ao Dr. Bobby Thompson por sua introdução à endopintura, ao Núcleo de Microscopia da Escola de Medicina da UCSD e a Robert Porter (UCSD) pelo suporte experimental.
Materiais
| Name | Company | Catalog Number | Comments |
| #5 forceps | Fine Science Tools | 11252-30 | |
| #55-forceps | Fine Science Tools | 11295-51 | |
| 0.03 inch inner diameter silicone tubing | VWR | 32829-182 | |
| 20 μL pipette tips | VWR | 76322-134 | |
| 35 mm Petri dish | VWR | 10799-192 | |
| 5 mL plastic syringe | VWR | BD 309646 | |
| Dichloromethane (DCM) | Sigma-Aldrich | 270997 | Refer to MSDS. Stored in side cabinet under fume hood |
| Ethyl cinnamate (ECi) | Sigma-Aldrich | 112372 | Stored at 4 °C |
| Fine Curved scissors | Fine Science Tools | 14061-09 | |
| FITC-poly-L-lysine | Sigma-Aldrich | P3069 | Store at -20 °C (powder, stock solution), 4ºC (working solution) |
| Fluoresent microscope | EVIDENT SCIENTIFIC | MVX10 | |
| Glass capillary tubes (0.75 mm ID) | Sutter Instrument | FG-GB100-75-10 | |
| Lightsheet microscope | Zeiss | Z.1 system | |
| Methanol | Sigma-Aldrich | M1775 | Refer to MSDS. Stored in flammable cabinet under fume hood |
| Microforge | Narishige International USA, Inc. | MF2 | |
| Micromanipulator | World Percision Instrrument | M3301R | |
| Paraformaldehyde (PFA) 4% | Thermo Scientific | J19943.K2 | Refer to MSDS. Stored at -20 °C (powder), 4 °C (4% working solution) |
| Phosphate buffered saline (PBS) | Cytiva | SH30256.01 | Stored on benchtop |
| SimVascular | open source software www.simvascular.org | ||
| Tyrode’s Solution | Made in-house |
Referências
- Lindsey, S. E., Butcher, J. T., Vignon-Clementel, I. E. Cohort-based multiscale analysis of hemodynamic-driven growth and remodeling of the embryonic pharyngeal arch arteries. Development. 145 (20), dev162578(2018).
- Lindsey, S. E., Vignon-Clementel, I. E., Butcher, J. T. Assessing early cardiac outflow tract adaptive responses through combined experimental-computational manipulations. Ann Biomed Eng. 49 (12), 3227-3242 (2021).
- Salman, H. E., et al. Effect of left atrial ligation-driven altered inflow hemodynamics on embryonic heart development: Clues for prenatal progression of hypoplastic left heart syndrome. Biomech Model Mechanobiol. 20 (2), 733-750 (2021).
- Henning, A. L., Jiang, M. X., Yalcin, H. C., Butcher, J. T. Quantitative three-dimensional imaging of live avian embryonic morphogenesis via micro-computed tomography. Dev Dyn. 240 (8), 1949-1957 (2011).
- Anbazhakan, S., et al. Blood flow modeling reveals improved collateral artery performance during the regenerative period in mammalian hearts. Nat Cardiovasc Res. 1 (8), 775-790 (2022).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nat Methods. 13 (10), 859-867 (2016).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2016).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), dev199369(2021).
- Rios Coronado, P. E., Red-Horse, K. Enhancing cardiovascular research with whole-organ imaging. Curr Opin Hematol. 28 (3), 214-220 (2021).
- Miller, C. E., et al. Confocal imaging of the embryonic heart: How deep. Microsc Microanal. 11 (3), 216-223 (2005).
- Renier, N., et al. Mapping of brain activity by automated volume analysis of immediate early genes. Cell. 165 (7), 1789-1802 (2016).
- Lindsey, S. E., et al. Growth and hemodynamics after early embryonic aortic arch occlusion. Biomech Model Mechanobiol. 14 (4), 735-751 (2015).
- Humphrey, J. D. Constrained mixture models of soft tissue growth and remodeling-twenty years after. J Elast. 145 (1), 49-75 (2021).
- Updegrove, A., et al. SimVascular: An open-source pipeline for cardiovascular simulation. Ann Biomed Eng. 45 (3), 525-541 (2017).
- Kim, J. S., Min, J., Recknagel, A. K., Riccio, M., Butcher, J. T. Quantitative three-dimensional analysis of embryonic chick morphogenesis via microcomputed tomography. Anat Rec. 294 (1), 1-10 (2011).
- Zhang, D., Lindsey, S. Evaluation of high-resolution image accuracy for small animal vascular flow quantitation. Bull Am Phys Soc. , https://meetings.aps.org/Meeting/DFD24/Session/X03.8 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados