Method Article
정량적 연구를 위한 소동물 혈관 구조의 신속한 전체 마운트 고해상도 이미징
요약
이 프로토콜은 광시트 형광 현미경을 사용하여 정량적 전체 마운트 3차원 혈관 이미징을 위한 신속한 방법을 소개합니다. 이 방법의 효능은 전산 유체 역학을 통해 정량화된 혈역학적 힘과 함께 병아리 배아 모델의 인두 궁 동맥 시스템을 사용하여 입증되었습니다.
초록
심혈관 발달 및 질병에 대한 소동물 모델에서 혈류에 대한 피험자별 컴퓨터 시뮬레이션을 통해 실험적으로 측정하기 어려운 혈류역학적 메트릭의 정량적 평가를 가능하게 합니다. 전산 유체 역학 시뮬레이션은 심혈관 기능 및 질병 진행에서 역학의 중요한 역할을 조명합니다. 관심 vessel의 고품질 volumetric 이미지를 획득하는 것은 형태학적 측정 및 유동 정량 결과의 정확성과 재현성의 핵심입니다. 이 연구는 광시트 형광 현미경을 사용하여 소동물 혈관 구조의 전체 마운트 고해상도 이미징을 위한 빠르고 비용 효율적이며 접근 가능한 방법을 제안합니다. 수정된 iDISCO+(immunolabeling-enabled three-dimensional imaging of solvent-cleared organs) 광시트 시료 전처리 프로토콜에는 (1) 형광물질로 혈관 구조를 라벨링하고, (2) 시료를 보존하고, (3) 시료를 투명하게 만드는 작업이 포함됩니다. 면역조직화학적 염색을 사용하는 기존의 iDISCO+와 달리, 저자는 "엔도페인팅(endo-painting)"이라는 과정을 통해 광표백에 대한 내성이 뛰어난 저렴한 비특이적 형광 염료인 FITC가 부착된 폴리-L-라이신(poly-L-lysine)으로 혈관 내피를 라벨링합니다. 신속한 라벨링으로 시료 전처리 시간을 약 4주에서 3일 미만으로 단축할 수 있습니다. 또한 최소 위험 용매인 에틸 신나메이트(ECi)를 투명화 에이전트 및 이미징 솔루션으로 사용하면 샘플을 더 안전하게 취급할 수 있으며 광범위한 이미징 시설을 준수할 수 있습니다. 제안된 프로토콜은 3일(HH18)부터 8일(HH34)까지의 병아리 배아에서 심혈관계의 고분해능 광시트 형광 현미경 이미지 스택을 얻기 위해 적용됩니다. 이 연구는 5일(HH 26) 병아리 배아의 3D 재구성 및 컴퓨터 혈류역학 모델링을 통해 혈관 정량화에 대한 이 방법의 적합성을 추가로 입증합니다.
서문
체적 영상은 심혈관 생리학 및 질환에 대한 정확한 연구를 위해 필요합니다. 정량적 이미징은 온전한 체적 치수를 가진 고해상도 이미지 스택을 생성합니다. 샘플은 생체 내 형태와 루멘 부피를 유지하기 위해 보존되어야 할 뿐만 아니라 균일한 고해상도 용량으로 이미지화되어야 합니다. 고해상도 이미징 스택에서 사용자는 혈관 모양, 구조 및 연결성을 완벽하게 표시할 수 있는 고충실도의 3차원 혈관 렌더링을 생성할 수 있습니다1.
심혈관 구조는 2차원의 분리된 렌즈를 통해 검사할 때 정확하게 포착할 수 없는 복잡한 3차원 해부학적 특징을 가지고 있습니다. 입체경, 광시야, 형태학적 이미징 및 조직학적 단면은 복잡한 3차원 변화를 포착하는 데 부적절합니다 1,2,3. 마이크로 및 나노 컴퓨터 단층 촬영 영상은 정량적 소동물 체적 영상 1,4의 황금 표준이지만, 생물학계에서 널리 접근하거나 채택되지 않습니다. 최근 조직 투명화 및 전체 장기/소동물 현미경 검사의 혁신으로 전체 마운트 투명화 및 혈관 라벨링 기술의 정량적 응용이 가능해졌습니다 5,6,7. Tissue-clearing은 조직 샘플에서 빛의 산란을 균질화하는 작용을 하여 빛의 산란 또는 흡수 가능성을 낮춤으로써 매체를 통한 광 전파의 지연을 줄입니다. 투명도가 높기 위해서는 엄격한 조직 처리가 필요하며, 이는 형광 신호 표지의 항원성 또는 밝기에 영향을 미칠 수 있습니다8. 광시트 현미경 검사는생물학자들9에 의해 널리 채택된 빠르고 강력한 이미징 도구로 부상했으며, 스캐닝 현미경보다 몇 배나 빠른 속도와 1cm 이상의 샘플을 이미지화할 수 있는 기능을 제공합니다. 광시트 형광 현미경(LSFM)을 통해 레이저는 컨포칼 현미경 검사에 비해 더 빠른 속도와 깊이로 샘플 단면을 비춥니다. 이러한 이유로 이 방법에는 높은 시료 투명도가 필요합니다.
여기에서 저자는 최근의 iDISCO+ 투명화 방법을 병아리 배아 동물 모델의 엔도 페인팅10과 결합하여 심혈관 발달 초기부터 후기까지 이 방법의 효능을 보여줍니다. iDISCO(immunolabeling-enabled three-dimensional imaging of solvent-cleared organs)는 유기 용매 기반 투명화 방법으로, 수성 투명화 기반 방법과 달리 용매 증발로 인한 이미징 아티팩트의 영향을 받지 않습니다. iDISCO는 전자(iDISCO)의 테트라하이드로푸란 탈수 단계가 더 가벼운 메탄올 탈수 후 지질 추출 단계(iDISCO+)로 대체된다는 점에서 iDISCO+와 다릅니다. iDISCO+ 투명화 방법의 장점으로는 대형 성체 샘플 및 배아의 면역 표지, 낮은 조직 수축 및높은 투명도 8,11 등이 있습니다. 중요한 점은, iDISCO+는 고해상도 이미지 스택을 생성할 수 있으며, 전통적인 생물학 면역 라벨링 기술을 확장하여 전통적인 조직학에서와 같이 전체 조직 수준 조직에 대한 정보가 부족한 작은 영역의 샘플링에 국한되지 않고 큰 장기 샘플 또는 전체 배아에 대한 정보를 얻을 수 있다는 것입니다9. iDISCO+의 단점은 유전적으로 암호화된 형광 단백질이 보존되지 않는다는 사실입니다11. 엔도 페인팅의 조직 라벨링 방법은 좌심실 정점에서 0.5mg/ml의 FITC-poly-L-lysine을 관류한 HH31-HH36 병아리 배아 심장을 사용하여 심혈관 결손에 대한 고처리량 스크리닝으로 처음 도입되었습니다. 염료는 고정 및 보관 전에 4 분 동안 결합하도록 허용10.
본 연구는 동일한 FITC-폴리-L-라이신 농도가 더 넓은 범위의 배아(HH18 - HH34)에 사용될 수 있음을 발견했지만, 밝게 표지된 혈관을 보장하기 위해 이상적인 고정 시간이 다양하다는 것을 발견했습니다(5-10분). 본 endo-DISCO 기술의 사용자는 용액의 점성이 너무 높아 원하는 모든 혈관에 라벨을 붙일 수 없는 경우 염료 농도를 조정(한 번에 0.1mg/mL씩 감소)할 수 있지만, 염료 농도를 조정하기 전에 먼저 고정 시간을 조정하고 좌심실의 근육 수축을 최적화하는 것이 좋습니다. 저자는 0.1mg/mL의 농도로 엔도 페인팅을 시도한 결과 염료가 작은 혈관을 통해 더 쉽게 퍼지는 반면 PFA 관류 시 더 쉽게 씻겨 나간다는 것을 발견했습니다. 저자는 본 기술을 통해 생성된 고해상도 이미징 스택이 컴퓨터 혈류역학 모델링에 충분한 품질임을 보여줍니다. 압력 및 벽 전단 응력 분포를 포함한 혈류 경로 및 해당 혈역학적 힘은 계산 흐름 시뮬레이션을 통해서만 해결할 수 있는 복잡한 국소 패턴으로 발생합니다 1,12. 이러한 생체역학적 힘은 인접한 심혈관 조직의 행동에 영향을 미치고 혈관 적응, 성장 및 리모델링을 유발합니다13. 국소 혈류역학적 힘 값을 이해하면 심혈관 기능 및 질병 시작 또는 진행의 기계론적 조절자에 대한 중요한 시각을 얻을 수 있습니다2.
프로토콜
실험실 동물 복지국(Office of Laboratory Animal Welfare)은 공중 보건 서비스 정책이 부화 후에만 병아리 모델에 "척추 동물"로 적용되는 것으로 해석합니다. 이러한 배아는 기관 동물 관리 및 사용 위원회(IACUC) 관할권에서 유사하게 면제됩니다. 관련 국립보건원(National Institutes of Health)에서 자주 묻는 질문은 http://grants.nih.gov/grants/olaw/faqs.htm#ApplicabilityofthePHSPolicy 에서 확인할 수 있습니다.
1. 배아 채취, 라벨링 및 고정
- 패션은 0.75 내경의 유리 모세관 막대를 마이크로 포지 1,12를 사용하여 절단 마이크로 니들로 당겼습니다.
참고: 필요한 팁의 크기는 원하는 동물의 나이/유속에 따라 다릅니다. 마이크로니들은 현저절부 집게 또는 가위를 사용하여 정밀도가 크게 떨어질 수도 있습니다. - Tyrode의 용액을 약 38°C로 데웁니다.
- TIRODE의 용액에 FITC 폴리-L-라이신 고체를 용해시켜 0.5mg/mL 원액을 준비합니다.
참고: 이 농도는 병아리 배아 동맥을 라벨링하는 데 최적화되어 있습니다. 다른 조직 유형에 대한 최적 농도는 다를 수 있습니다. 추가 원액은 -20 °C에서 보관해야 합니다. - 구부러진 팁 가위로 배아 주위를 자르고 전사 피펫 또는 주걱을 사용하여 배아를 따뜻한 Tyrode의 용액으로 채워진 35mm 페트리 접시에 옮겨 달걀 노른자에서 조류 배아(본 병아리 심장 연구의 경우 HH18(3일차)에서 HH34(8일차)까지)를 해부합니다.
- 배아를 감싸고 있는 융모막막과 심장 주위의 심낭막을 가는 집게로 조심스럽게 제거하고, 막을 작게(~0.1mm) 절개하여 배아에서 떼어냅니다.
- 심장 박동을 유지하기 위해 따뜻한 Tyrode의 용액으로 채워진 새롭고 깨끗한 페트리 접시에 배아를 이식합니다.
- 5mL 플라스틱 주사기에 따뜻한 Tyrode 용액을 채웁니다. 0-20 μL 플라스틱 피펫 팁의 넓은 끝을 잘라내어 주사기의 평평한 팁에 부착합니다. 이제 주사기가 미세한 피펫 팁 직경까지 확장되었습니다.
- 0.03인치 내경 실리콘 튜브 세그먼트를 새로 고정된 피펫 팁 주사기 장치에 부착하여 "주입 라인"을 구성합니다(1.7단계). 유리 모세관 마이크로니들을 튜브의 반대쪽 끝에 부착합니다.
- 마이크로매니퓰레이터에 부착된 마이크로인젝션 홀더에 마이크로니들을 장착합니다. 기포의 실리콘 튜브와 마이크로니들을 퍼지합니다.
- 마이크로매니퓰레이터를 사용하여 바늘을 심장 정점에 삽입하고 Tyrode의 용액을 심장에 천천히 주입하여 배아 1,12를 관류합니다. 피가 거의 제거될 때까지 배아를 계속 관류하십시오.
- 마이크로 매니퓰레이터를 사용하여 바늘과 주입 라인을 삽입 부위에서 뒤로 당기고 다음 주입 라인을 준비하는 동안 방해받지 않도록 바늘의 방향을 잡습니다. 바늘과 주사기에서 실리콘 튜브를 제거합니다.
참고: 일부 사용자는 바늘을 심장에 부착한 상태로 유지하는 것이 가장 좋다고 생각할 수 있으며, 이 경우 사용자는 바늘을 제자리에 유지하면서 바늘과 주사기 사이의 실리콘 튜브를 제거해야 합니다. - 엔도 페인팅(endo-painting)을 수행하여 혈관 내피를 녹색 형광으로 표시합니다.
- 마이크로피펫을 사용하여 20-40μL의 FITC 폴리-L-라이신 원액을 실리콘 튜브에 로드하고 FITC 액체 장벽 앞에 기포가 생성되지 않도록 주의합니다.
- 티로드의 용액이 채워진 주사기를 다시 부착하고 마이크로 매니퓰레이터를 사용하여 심장 정점에 천천히 주입하고 필요한 경우 바늘을 다시 삽입합니다. FITC 폴리-L-라이신이 확산된 후 기포가 심장으로 들어가기 전에 바늘을 제거합니다.
- FITC 폴리-L-라이신을 5-10분 동안 배아에 그대로 둡니다.
참고: (선택적 품질 검사) 형광을 확인하려면 형광 스테레오 또는 매크로스코프로 사진을 찍습니다. 이 그림은 배아 제거가 완료된 후 탈수 인자를 결정하는 데 도움이 될 수 있습니다.
- 5mL 주사기에 4% 파라포름알데히드(PFA)를 채우고 실리콘 주입 튜브에 부착하여 세 번째 주입 단계를 수행합니다.
- 모든 심혈관 구조가 최대 부피 용량이 되고 조직이 더 불투명해지기 시작할 때까지 배아 1,12를 4% PFA로 관류합니다.
- 샘플을 덮을 수 있을 만큼 충분한 4% PFA로 채워진 2-5mL 바이알에 배아를 부드럽게 로드합니다. 배아가 과도하게 변형되지 않도록 주의하십시오.
참고: s에 충분히 큰 바이알을 선택하십시오.amps가 부서지거나 변형되는 것을 방지하기 위해 관심 샘플. - 쉐이커로 4 °C에서 밤새 배아를 배양합니다.
2. 배아 탈수 및 제거
- 4% PFA를 조심스럽게 피펫으로 빼냅니다.
참고: 이 시점부터는 조직 손상이나 변형을 방지하기 위해 배아와의 직접적인 접촉을 피하십시오. - 배아를 세척하려면 실온에서 30분 동안 부드럽게 흔들면서 신선한 인산염 완충 용액(PBS)에 배아를 배양합니다. 두 번 더 반복하여 총 3회 세탁합니다.
- 흄 후드에서 배아를 탈수하기 시작합니다. PBS를 조심스럽게 피펫으로 빼내고 실온에서 각각 1시간(20%, 40%, 60%, 80%, 100%) 메탄올 농도의 5가지 메탄올 배양을 단계적으로 배양합니다.
- 배아를 신선한 100% 메탄올에 넣어 실온에서 하룻밤 동안 그대로 두십시오.
참고: (선택적 정지 지점). 배아는 -20°C에서 100% 메탄올에 저장하여 나중에 최대 6개월 동안 사용할 수 있습니다. - 흄 후드에서 지질 제거 절차를 시작합니다. 배아를 2:1(부피 대 부피) DCM: 메탄올 용액을 실온에서 3시간 동안 부드럽게 흔들어 배양을 배양합니다.
주의 : DCM은 독성이 있으므로 연기 후드에서 처리해야 합니다. DCM으로 작업할 때는 각별히 주의하십시오. 이중 장갑은 추가 장벽을 제공하는 데 도움이 될 수 있습니다. - 에틸 신나메이트(ECi)를 4°C에서 꺼내 실온에서 해동합니다.
- 배아를 신선한 100% DCM으로 실온에서 15분 동안 흔들어 세척합니다. 100% DCM 세척을 반복하여 총 2회 세척합니다.
- DCM을 피펫으로 추출하고 100% ECi에서 배아를 배양합니다. 약 1시간 후에 제거될 때까지 배아를 ECi에 그대로 둡니다. 필요한 경우 튜브를 부드럽게 흔듭니다.
- (선택적 확인 단계) 투명화 및 혈관 염색의 품질을 형광 스테레오 또는 매크로스코프로 검사합니다. 배아의 사진을 찍어 단계/연령별 탈수 스케일링 인자를 결정합니다.
- 투명해진 배아를 이미지화할 준비가 될 때까지 최대 6개월 동안 4°C에서 보관하여 배아를 빛으로부터 보호합니다.
3. 데이터 수집
- 배아를 이미지화하려면 광시트 형광 현미경을 사용하십시오. 광학적으로 투명한 배아의 머리를 초강력 접착제 젤을 사용하여 유리 모세관에 부착합니다.
- 유리 모세관을 시료 홀더에 장착하고, 이미징 챔버를 ECi로 채우고, 이미징 챔버에서 배아를 내립니다.
- 매개변수를 조정하고 이미징을 수행합니다.
4. 양적 적용: 3D 재구성 및 전산 유체 역학 모델링
참고: 이 단계에서는 3D 해부학적 재구성 및 전산 유체 역학 모델링을 위해 라이트 시트에서 생성된 고해상도 이미지 스택이 오픈 소스 소프트웨어 SimVascular14 에 로드됩니다. 자세한 튜토리얼은 SimVascular 웹 사이트에 있습니다( 재료 표 참조). 재구성은 관심 있는 선박에 유적선을 작성하고, 유적선을 따라 2D 분할을 작성하고, 로프트 분할을 3D 솔리드 모델로 결합하는 것으로 구성됩니다. 계산 모델링은 메쉬된 형상을 준비하고, 경계 조건을 정의하고, 시뮬레이션을 실행하는 것으로 구성됩니다.
- 파일 아래에 새 SVProject를 만들고 이미지를 마우스 오른쪽 버튼으로 클릭한 다음 이미지 추가/바꾸기를 클릭하여 고해상도 광시트 이미징 스택을 업로드합니다.
- 소프트웨어 튜토리얼 단계에 따라 인실리코(in silico)로 혈관 해부학적 구조를 재구성하십시오.
- Paths를 마우스 오른쪽 버튼으로 클릭하고 경로 만들기를 선택하여 유적선을 만듭니다. 관심 있는 선박을 따라 경로 표식기를 배치합니다. 관심 있는 각 용기에 대해 반복합니다.
- 생성된 각 유적선에 대해 Segmentations를 마우스 오른쪽 버튼으로 클릭하고 Create Contour Group을 선택하여 2D 선박 횡단면을 추적합니다. 선박 경로를 선택하고 Segmentation(세분화)에서 선박 이름을 두 번 클릭하여 수동 세분화를 시작합니다.
- 모든 선박이 분할되면 Models 를 마우스 오른쪽 버튼으로 클릭한 다음 create model을 선택하여 모델을 생성합니다. PolyData 유형을 선택하고, 모델 이름을 입력하고, 솔리드 모델 생성을 클릭하고, 모델의 일부가 되어야 하는 모든 세그먼트를 선택합니다.
- SimVascular SVMesher에 내장된 Tetgen 메셔를 실행하여 지오메트리를 메시합니다. 최대 가장자리 크기를 정의하고 표면 및 볼륨 메싱을 모두 수행합니다.
참고: 혈관의 미세한 기하학적 세부 사항과 국부적인 혈역학적 변동성을 해결할 수 있는 메쉬 크기를 선택하십시오. Estimate a global mesh size(전역 메시 크기 추정 ) 버튼부터 시작합니다. 시뮬레이션을 마무리할 때 메쉬 수렴 스터디가 필요할 수 있습니다. - SimVascular Solver를 사용하여 컴퓨터 혈류 시뮬레이션을 설정합니다. Simulations 를 마우스 오른쪽 버튼으로 클릭하고 Create Simulation Job을 선택하여 시뮬레이션 파일을 만듭니다. 기본 매개변수를 조정하고 특정 경계 조건에 대한 입구 및 출구 BC를 선택합니다.
- 솔버 매개변수를 조정하고, 파일 생성 및 시뮬레이션 실행 탭으로 이동하고, 메시 파일을 선택하고, 시뮬레이션을 위한 데이터 파일 생성을 클릭합니다.
- 고성능 컴퓨팅 워크스테이션 또는 슈퍼컴퓨터를 사용하여 시뮬레이션을 시작합니다.
결과
여기에 제시된 신속한 전체 장착형 고해상도 이미징 프로토콜(그림 1, 표 1)은 그림 2, 그림 3 및 그림 4와 같이 명확하게 윤곽이 그려진 혈관 내피를 생성하며, 여기서 병아리 배아 혈관 내피는 GFP 형광이므로 심장 발달 초기부터 성숙한 심장 발달까지 배아 단계에 걸쳐 녹색으로 윤곽이 그려져 있습니다(그림 4). 샘플 혈관 구조가 명확하게 라벨링되지 않은 경우 poly-L-lysine 농도, 염료 고정 시간 및 심실 수축 사용(해당되는 경우)의 올바른 조합을 찾는 것이 중요합니다(LSFM 이미징 전에 배아가 형광 입체경 또는 거시경 아래에서 어떻게 보여야 하는지에 대해서는 그림 2 참조). 따뜻한 Tyrode의 용액을 통해 박동하는 심장을 유지하고 난황 자루에서 배아를 빠르게 해부하면 샘플/소동물 모델 전체에 용액을 확산시키는 데 도움이 됩니다. poly-L-lysine의 점도는 원액의 농도를 통해 제어될 수 있습니다. 점성이 낮은 용액은 시료 전체에 형광 침투를 도울 수 있지만, PFA 관류 후 라벨링의 견고성을 확인해야 합니다. 사용자는 주입된 부피를 늘리고 배아를 PFA로 고정하기 전에 배양 시간을 늘려 더 낮은 농도의 poly-L-lysine 스톡 용액을 보상하기를 원할 수 있습니다.
그림 5 는 3D 해부학적 재구성 및 계산 모델링에 대해 제시된 방법의 적합성을 보여줍니다. 벽 전단 응력 값은 나노 컴퓨터 단층 촬영 재구성1을 기반으로 한 저자의 이전 연구와 일치합니다.

그림 1: 배아 라벨링 및 고정 설정(위) 및 광시트 현미경 데이터 수집 설정(아래). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 세척 절차 전후의 배아. 대표적인 명시야 및 GFP 채널은 형광 매크로스코프로 볼 수 있는 프로토콜의 1단계(투명화 전) 및 2단계(투명화 후)를 거친 샘플에 대한 배아를 조명했습니다. 전체 배아가 투명해지기 전에 GFP 채널에서 어떻게 빛나는지, 특히 외부 막이 제거된 심장에서 어떻게 빛나는지 주목하십시오. 원하는 모든 혈관 구조는 GFP 제거 배아에 명확하게 표시되어 있습니다. 스케일 바 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
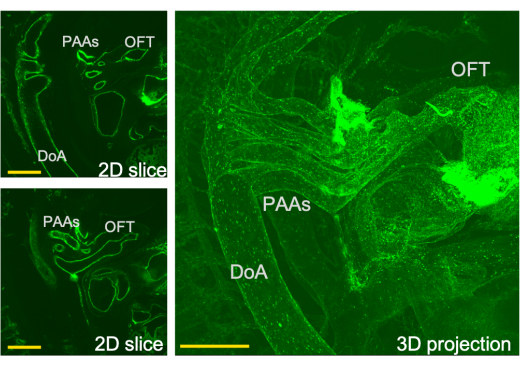
그림 3: 심장 유출 시스템의 3차원 보기와 LSFM에서 얻은 이 보기를 통한 해당 슬라이스. PAA- 인두 궁 동맥, OFT- 유출로, DoA- 등쪽 대동맥. 스케일 바 = 0.5mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
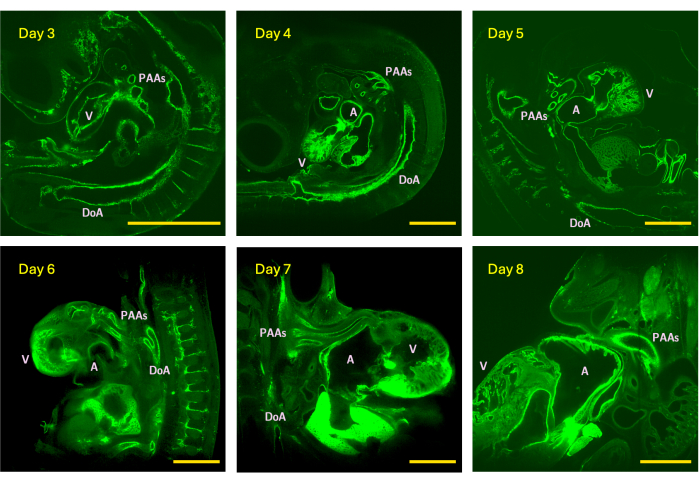
그림 4: 3일차(HH18기), 4(HH24), 5(HH26), 6(HH29), 7(HH31) 및 8(HH34) 병아리 배아에서 획득한 LSFM 이미지 스택의 z-슬라이스 예. 이미지 크기는 5x 감지 대물렌즈가 장착된 스코프의 최대(타일링 없음) 시야를 나타냅니다. V - 심실; A - 아트리움; DoA - 등쪽 대동맥; PAA - 인두궁동맥. 스케일 바 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 5일차(HH26기) 대동맥궁 및 주요 혈류역학적 시뮬레이션 결과의 대표적인 인실 리코 해부학적 재구성. 왼쪽: 유출로(OFT), 인두궁동맥(PAA) 및 배측 대동맥(DoA)을 보여주는 재구성된 혈관 해부학 모델. 중간: 혈류 시뮬레이션을 사용하여 얻은 최대 수축기에서 혈류 유선. 빨간색 유선은 주로 두개골 부위에 서비스를 제공하고 파란색은 꼬리 부위에 서비스를 제공합니다. 오른쪽: 혈류 시뮬레이션을 사용하여 얻은 혈관 벽에 대한 최대 수축기 벽 전단 응력(WSS) 분포 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 일 | 단계 | 시간 | 온도 |
| 1일차 | 배아 수확 | 5-10분/배아 | RT(벤치탑) |
| FITC 엔도 페인트 | 10-30분/배아 | RT(벤치탑) | |
| PFA 관류 수정 | 관류: 5-15분/배아 | 관류 : RT (벤치 탑) 배양 : 4 ° C | |
| 배양: O/N | |||
| 2일차 | PBS 워시 | 90 분 | RT(벤치탑) |
| 탈수 | 5시간 + O/N | RT(흄후드) | |
| 3일차 | 지질 제거 | 3.5시간 | RT(흄후드) |
| 지우기 | ≥1시간 | RT(벤치탑) |
표 1: 신속한 정량적 광시트 이미징을 위한 시료 준비 개요.
토론
생물학을 3D로 연구할 수 있는 능력은 형태학적 복잡성, 내부 장기 구조 및 혈관 연결을 정확하게 이해하는 데 매우 중요합니다. 정확하고 신뢰할 수 있는 3D 혈관 이미지는 또한 피험자별 컴퓨터 혈류역학 시뮬레이션의 핵심이며, 이는 종종 벽 전단 응력 및 압력 분포와 같은 주요 혈역학적 매개변수를 정량화하는 유일하고 신뢰할 수 있는 수단입니다. 여기에서 저자는 LSFM을 사용하여 작은 동물의 고해상도 3D 혈관 이미징을 위한 빠르고 접근 가능한 샘플 준비 방법을 소개합니다. 이 방법은 심장 발달의 중요한 시기를 나타내는 HH18(3일차)에서 HH34(8일차) 병아리 배아의 고해상도 이미지 스택을 안정적으로 생성합니다. HH24(4일차)에서 HH34(8일차)까지 총 배아 크기는 ~30-550mm3에서 24시간 주기당 평균 성장이 2배 증가하며, 심장 심근 크기는 ~1mm3(4일차)에서 ~17mm3(8일차)로 증가합니다15. 빠른 배아 및 심혈관 성장으로 인해, 본 연구를 위한 이미지는 인두궁동맥계에 초점을 맞출 때 1.92-2.4μm의 z-스텝 범위로, 1.22μm(HH18)에서 2.53μm(HH34)까지 다양한 평면 해상도로 획득되었으며, 인두궁동맥계에 초점을 맞출 때 1.94-3.5μm의 z-스텝 범위로 1.94-3.5μm였습니다(그림 4). 생성된 고해상도 이미지 스택은 1.30μm의 평면 해상도와 1.92μm의 z-step 크기로 이미지화된 HH26(5일차) 모델을 통해 입증된 인실리코 혈관 해부학적 재구성 및 피험자별 혈류역학 시뮬레이션에 적합합니다16. 다른 전체-마운트 기법과 마찬가지로, 제안된 방법은 특히 전체-장기 이미징을 수행할 때 동물 모델 전반에 걸쳐 사용될 수 있다 5,6,7. iDISCO+ 기술은 신생아 및 성체 쥐 심장에 적용되었습니다5.
제안된 방법의 주요 장점은 형광 표지를 위해 FITC가 표지된 폴리-L-라이신을 사용하고 투명화를 위해 ECi를 사용한다는 것입니다. 폴리-L-라이신은 생리학적 pH에서 양전하를 띠기 때문에 시료를 통해 관류되는 동안 혈관 내피에 비특이적으로 결합합니다. 이 공정은 FITC를 용기 벽에 빠르고 안정적으로 부착하여 광표백에 대한 내성이 높은 밝고 안정적인 형광으로 라벨링합니다. 전통적으로 LSFM을 포함한 전체 장착 부피 측정 현미경 이미징은 샘플에 면역조직화학 염색을 라벨링해야 합니다. 이 절차는 고가의 항체를 사용해야 하며 시료 전처리 시간을 최대 4주까지 연장합니다 1,8,9. 초기 배아는 엘라스틴 또는 혈관 평활근 세포와 같은 전통적인 혈관 마커를 발현하지 않기 때문에 특정 항체로 표적화하기가 더 어렵습니다. 또한, 투명화된 표본은 종종 투명화 용액에 잠겨 있는 동안 이미지화됩니다. 기존의 iDISCO+ 세척 절차에는 위험한 화합물인 디벤질 에테르가 필요한데, 이는 이미징 시설에서 허용되지 않는 경우가 많습니다8. ECi는 실험실 환경 밖에서 안전하게 취급할 수 있고 광학 장비를 손상시킬 가능성이 적은 최소 위험 화합물입니다. 원하는 경우, 제안된 기술은 선택된 스펙트럼 방출 특성이 동시 발현 실험을 허용하는 경우 면역염색과 결합 또는 다중화될 수 있습니다. 복합화는 시료 라벨링 및 준비 시간을 증가시킬 수 있습니다.
제안된 프로토콜에는 몇 가지 제한 사항이 있습니다. 이 절차는 희생된 배아와 절제된 조직에만 적용되므로 종단 연구의 가능성은 배제됩니다. FITC 폴리-L-라이신 엔도 페인팅은 빠르고 경제적이지만 높은 수준의 민첩성과 정밀도를 필요로 합니다. 또한 염료는 조직을 쉽게 통과하지 못하기 때문에 염료가 도달할 수 있는 혈관 벽에만 라벨을 붙이기 때문에 작은 모세관 네트워크를 연구하는 데 어려움을 겪습니다. 이러한 문제는 폴리-L-라이신을 투여할 때 심장 박동을 유지하고 주입된 용액의 점도/농도를 조정하여 관리할 수 있습니다. 염료의 비특이성으로 인해 용기 유형1을 구별하기가 어렵습니다. 주입 과정에서 혈관 구조 밖으로 누출되는 과도한 FITC 폴리-L-라이신은 표재성 피부 및 막과 같은 비혈관 조직에도 결합할 수 있으며, 이는 이미징 중 조명 시트를 방해하고 이미징 품질을 저하시킬 수 있습니다. 사용자는 폴리-L-라이신을 주입할 때 누출을 방지하기 위해 주의해야 합니다. 현재 프로토콜은 주요 전신 동맥을 이미징하기 위해 초기 단계의 병아리 배아를 사용하여 광범위하게 검증되었습니다. FITC 폴리-L-라이신 주입의 농도, 부피 및 고정 시간은 다양한 사용 사례에 맞게 더욱 최적화해야 할 수 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 미국심장협회(American Heart Association) 경력개발상(American Heart Association Career Development Award), Scientific Interface의 Burroughs Wellcome Fund Career Award, Additional Ventures Single Ventricle Research Fund 및 UCSD School of Medicine Microscopy Core(보조금 P30 NS047101)의 지원을 받았습니다. 저자는 엔도 페인팅을 소개한 Bobby Thompson 박사, UCSD School of Medicine Microscopy Core, 실험적 지원을 제공한 Robert Porter(UCSD)에게 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| #5 forceps | Fine Science Tools | 11252-30 | |
| #55-forceps | Fine Science Tools | 11295-51 | |
| 0.03 inch inner diameter silicone tubing | VWR | 32829-182 | |
| 20 μL pipette tips | VWR | 76322-134 | |
| 35 mm Petri dish | VWR | 10799-192 | |
| 5 mL plastic syringe | VWR | BD 309646 | |
| Dichloromethane (DCM) | Sigma-Aldrich | 270997 | Refer to MSDS. Stored in side cabinet under fume hood |
| Ethyl cinnamate (ECi) | Sigma-Aldrich | 112372 | Stored at 4 °C |
| Fine Curved scissors | Fine Science Tools | 14061-09 | |
| FITC-poly-L-lysine | Sigma-Aldrich | P3069 | Store at -20 °C (powder, stock solution), 4ºC (working solution) |
| Fluoresent microscope | EVIDENT SCIENTIFIC | MVX10 | |
| Glass capillary tubes (0.75 mm ID) | Sutter Instrument | FG-GB100-75-10 | |
| Lightsheet microscope | Zeiss | Z.1 system | |
| Methanol | Sigma-Aldrich | M1775 | Refer to MSDS. Stored in flammable cabinet under fume hood |
| Microforge | Narishige International USA, Inc. | MF2 | |
| Micromanipulator | World Percision Instrrument | M3301R | |
| Paraformaldehyde (PFA) 4% | Thermo Scientific | J19943.K2 | Refer to MSDS. Stored at -20 °C (powder), 4 °C (4% working solution) |
| Phosphate buffered saline (PBS) | Cytiva | SH30256.01 | Stored on benchtop |
| SimVascular | open source software www.simvascular.org | ||
| Tyrode’s Solution | Made in-house |
참고문헌
- Lindsey, S. E., Butcher, J. T., Vignon-Clementel, I. E. Cohort-based multiscale analysis of hemodynamic-driven growth and remodeling of the embryonic pharyngeal arch arteries. Development. 145 (20), dev162578 (2018).
- Lindsey, S. E., Vignon-Clementel, I. E., Butcher, J. T. Assessing early cardiac outflow tract adaptive responses through combined experimental-computational manipulations. Ann Biomed Eng. 49 (12), 3227-3242 (2021).
- Salman, H. E., et al. Effect of left atrial ligation-driven altered inflow hemodynamics on embryonic heart development: Clues for prenatal progression of hypoplastic left heart syndrome. Biomech Model Mechanobiol. 20 (2), 733-750 (2021).
- Henning, A. L., Jiang, M. X., Yalcin, H. C., Butcher, J. T. Quantitative three-dimensional imaging of live avian embryonic morphogenesis via micro-computed tomography. Dev Dyn. 240 (8), 1949-1957 (2011).
- Anbazhakan, S., et al. Blood flow modeling reveals improved collateral artery performance during the regenerative period in mammalian hearts. Nat Cardiovasc Res. 1 (8), 775-790 (2022).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nat Methods. 13 (10), 859-867 (2016).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2016).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), dev199369 (2021).
- Rios Coronado, P. E., Red-Horse, K. Enhancing cardiovascular research with whole-organ imaging. Curr Opin Hematol. 28 (3), 214-220 (2021).
- Miller, C. E., et al. Confocal imaging of the embryonic heart: How deep. Microsc Microanal. 11 (3), 216-223 (2005).
- Renier, N., et al. Mapping of brain activity by automated volume analysis of immediate early genes. Cell. 165 (7), 1789-1802 (2016).
- Lindsey, S. E., et al. Growth and hemodynamics after early embryonic aortic arch occlusion. Biomech Model Mechanobiol. 14 (4), 735-751 (2015).
- Humphrey, J. D. Constrained mixture models of soft tissue growth and remodeling-twenty years after. J Elast. 145 (1), 49-75 (2021).
- Updegrove, A., et al. SimVascular: An open-source pipeline for cardiovascular simulation. Ann Biomed Eng. 45 (3), 525-541 (2017).
- Kim, J. S., Min, J., Recknagel, A. K., Riccio, M., Butcher, J. T. Quantitative three-dimensional analysis of embryonic chick morphogenesis via microcomputed tomography. Anat Rec. 294 (1), 1-10 (2011).
- Zhang, D., Lindsey, S. Evaluation of high-resolution image accuracy for small animal vascular flow quantitation. Bull Am Phys Soc. , (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유