Method Article
Obtención rápida de imágenes de alta resolución de la vasculatura de animales pequeños para estudios cuantitativos
En este artículo
Resumen
Este protocolo introduce un método rápido para la obtención de imágenes vasculares tridimensionales cuantitativas de montaje completo mediante microscopía de fluorescencia de lámina de luz. La eficacia del método se demuestra utilizando el sistema de arterias de arco faríngeo del modelo de embrión de pollo, con fuerzas hemodinámicas cuantificadas mediante dinámica de fluidos computacional.
Resumen
En modelos de desarrollo y enfermedades cardiovasculares de animales pequeños, las simulaciones computacionales del flujo sanguíneo específicas del sujeto permiten evaluaciones cuantitativas de métricas hemodinámicas que son difíciles de medir experimentalmente. Las simulaciones computacionales de dinámica de fluidos arrojan luz sobre el papel fundamental de la mecánica en la función cardiovascular y la progresión de la enfermedad. La adquisición de imágenes volumétricas de alta calidad de los recipientes de interés es fundamental para la precisión y la reproducibilidad de los resultados de la medición morfológica y la cuantificación del flujo. Este estudio propone un método rápido, rentable y accesible para obtener imágenes de alta resolución de la vasculatura de animales pequeños utilizando microscopía de fluorescencia de lámina de luz. El protocolo modificado de preparación de muestras de hoja ligera iDISCO+ (imágenes tridimensionales habilitadas para inmunoetiquetado de órganos aclarados con solvente) implica (1) etiquetar la vasculatura con un agente fluorescente, (2) preservar la muestra y (3) hacer que la muestra sea transparente. A diferencia del iDISCO+ clásico, que utiliza la tinción inmunohistoquímica, los autores etiquetan el endotelio vascular con poli-L-lisina marcada con FITC, un colorante fluorescente no específico asequible que es altamente resistente al fotoblanqueo, en un proceso denominado "endopintura". El etiquetado rápido reduce el tiempo de preparación de la muestra de aproximadamente cuatro semanas a menos de 3 días. Además, el uso de un disolvente mínimamente peligroso de cinamato de etilo (ECi) como agente de limpieza y solución de imagen hace que las muestras sean más seguras de manipular y cumplan con una gama más amplia de instalaciones de imagen. El protocolo propuesto se aplica para obtener pilas de imágenes de microscopía de fluorescencia de lámina de luz de alta resolución del sistema cardiovascular en embriones de pollo que van desde el día 3 (HH18) hasta el día 8 (HH34). Este estudio demuestra aún más la idoneidad de este método para la cuantificación vascular a través de la reconstrucción 3D y el modelado hemodinámico computacional de un embrión de pollo de día 5 (HH 26).
Introducción
Las imágenes volumétricas son necesarias para estudios precisos de la fisiología y las enfermedades cardiovasculares. Las imágenes cuantitativas producen pilas de imágenes de alta resolución con dimensiones volumétricas intactas. Las muestras deben conservarse para mantener su morfología in vivo y su volumen de lúmenes, así como obtener imágenes en una capacidad uniforme de alta resolución. A partir de pilas de imágenes de alta resolución, el usuario puede generar representaciones vasculares tridimensionales de alta fidelidad que permiten una visualización completa de las formas, la estructura yla conectividad de los vasos.
Las estructuras cardiovasculares poseen características anatómicas tridimensionales complejas que no se pueden capturar con precisión cuando se examinan a través de una lente bidimensional e inconexa. Las imágenes morfológicas estereoscópicas de campo amplio y las secciones histológicas son inadecuadas para capturar variaciones tridimensionales complejas 1,2,3. Las imágenes de micro y nano tomografía computarizada son el estándar de oro para las imágenes volumétricas cuantitativas de animales pequeños 1,4, pero no son ampliamente accesibles ni adoptadas entre la comunidad biológica. Las innovaciones recientes en la limpieza de tejidos y la microscopía de órganos enteros/animales pequeños han permitido aplicaciones cuantitativas de las técnicas de aclaramiento de todo el montaje y marcaje vascular 5,6,7. La limpieza de tejidos funciona para homogeneizar la dispersión de la luz en las muestras de tejido, reduciendo así los retrasos en la propagación de la luz a través del medio al disminuir la posibilidad de dispersión o absorción de la luz. La alta transparencia requiere un procesamiento estricto de los tejidos que puede afectar a la antigenicidad o al brillo del marcaje de la señal de fluorescencia8. La microscopía de lámina de luz se ha convertido en una herramienta de imagen rápida y potente ampliamente adoptada por los biólogos9, ya que ofrece una ganancia de velocidad de varios órdenes de magnitud sobre los microscopios de barrido y la capacidad de obtener imágenes de muestras de más de 1 cm de tamaño. A través de la microscopía de fluorescencia de lámina de luz (LSFM), un láser ilumina una sección transversal de la muestra con mayor velocidad y profundidad en comparación con la microscopía confocal; Por esta razón, el método requiere una alta transparencia de la muestra.
Aquí, los autores adaptan los métodos recientes de limpieza iDISCO+, combinándolos con endo-painting10 en el modelo animal de embrión de pollo para mostrar la eficacia del método desde el desarrollo cardiovascular temprano hasta tardío. iDISCO (immunolabeling-enabled three-dimensional imaging of solvent-cleared objects) es un método de limpieza a base de solvente orgánico que, a diferencia de los métodos acuosos basados en clearing, no está sujeto a artefactos de imagen causados por la evaporación del solvente. iDISCO se diferencia de iDISCO+ en que la etapa de deshidratación por tetrahidrofurano del anterior (iDISCO) se sustituye por una deshidratación de metanol más suave seguida de una etapa de extracción de lípidos (iDISCO+). Las ventajas del método de aclarado iDISCO+ incluyen el inmunomarcaje de muestras adultas y embriones grandes, la baja contracción del tejido y la alta transparencia 8,11. Es importante destacar que iDISCO+ permite la generación de pilas de imágenes de alta resolución, ampliando las técnicas tradicionales de inmunomarcaje biológico para obtener información sobre grandes muestras de órganos o un embrión completo, en lugar de limitarse al muestreo de pequeñas regiones que carecen de información sobre toda la organización a nivel de tejido, como con la histología tradicional9. Las desventajas de iDISCO+ incluyen el hecho de que las proteínas fluorescentes codificadas genéticamente no se conservan11. El método de marcaje de tejidos de la endo-pintura se introdujo por primera vez como un cribado de alto rendimiento para defectos cardiovasculares utilizando corazones de embriones de pollo HH31-HH36 que se perfundieron con 0,5 mg/ml de FITC-poli-L-lisina en el ápice ventricular izquierdo. Se dejó que el tinte se uniera durante 4 minutos antes de la fijación y almacenamiento10.
El presente estudio encontró que la misma concentración de FITC-poli-L-lisina podría usarse para una gama más amplia de embriones (HH18 - HH34), pero encontró que el tiempo de fijación ideal varía (de 5 a 10 minutos) para garantizar vasos marcados brillantes. Los usuarios de la actual técnica endo-DISCO pueden querer ajustar la concentración de colorante (disminuyendo en 0,1 mg/ml a la vez) si la solución resulta demasiado viscosa para etiquetar todos los vasos deseados, pero se les recomienda ajustar primero el tiempo de fijación y optimizar la contracción muscular del ventrículo izquierdo antes de ajustar la concentración de colorante. Los autores intentaron la endopintura con una concentración de 0,1 mg/mL y descubrieron que, si bien el tinte se propagaba más fácilmente a través de los vasos pequeños, se lavaba más fácilmente con la perfusión de PFA. Los autores muestran que las pilas de imágenes de alta resolución generadas a través de la presente técnica son de suficiente calidad para el modelado hemodinámico computacional. Las trayectorias del flujo sanguíneo y las fuerzas hemodinámicas correspondientes, incluidas las distribuciones de presión y esfuerzo cortante en la pared, ocurren en patrones localizados complejos que solo pueden resolverse mediante simulaciones de flujo computacional 1,12. Estas fuerzas biomecánicas afectan el comportamiento de los tejidos cardiovasculares adyacentes y desencadenan la adaptación, el crecimiento y la remodelación vascular13. La comprensión de los valores de la fuerza hemodinámica local arroja luz crítica sobre los reguladores mecanicistas de la función cardiovascular y el inicio o progresión de la enfermedad2.
Protocolo
La Oficina de Bienestar de Animales de Laboratorio interpreta que la política del Servicio de Salud Pública se aplica al modelo de polluelo como un "animal vertebrado" solo después de la eclosión. Estos embriones están igualmente exentos de la jurisdicción del Comité Institucional de Cuidado y Uso de Animales (IACUC). Las preguntas frecuentes relevantes de los Institutos Nacionales de Salud se pueden consultar en: http://grants.nih.gov/grants/olaw/faqs.htm#ApplicabilityofthePHSPolicy.
1. Recolección, etiquetado y fijación de embriones
- La moda tiró de varillas capilares de vidrio de 0,75 de diámetro interior en microagujas cortadas utilizando una microforja 1,12.
NOTA: El tamaño de la punta requerida depende de la edad del animal / caudal deseado. Alternativamente, la microaguja se puede cortar con pinzas de microdisección o tijeras con una precisión muy reducida. - Caliente la solución de Tyrode a aproximadamente 38 ° C.
- Disuelva el sólido de poli-L-lisina FITC en la solución de Tyrode para preparar una solución madre de 0,5 mg/mL.
NOTA: Esta concentración está optimizada para el etiquetado de arterias de embriones de pollo. La concentración óptima para otros tipos de tejidos puede variar. La solución madre adicional debe almacenarse a -20 °C. - Diseccionar el embrión aviar (desde HH18 (día 3) hasta HH34 (día 8) para el presente estudio cardíaco de pollos) de la yema de huevo cortando alrededor del embrión con tijeras de punta curva y usando una pipeta de transferencia o una espátula para transferir el embrión a una placa de Petri de 35 mm llena de solución tibia de Tyrode.
- Retire cuidadosamente las membranas coriónicas y alantoideas que envuelven el embrión y la membrana del pericardio alrededor del corazón con pinzas de punta fina haciendo pequeñas incisiones (~0,1 mm) en las membranas y alejándolas del embrión.
- Transfiera el embrión a una placa de Petri nueva y limpia llena de solución tibia de Tyrode para mantener el corazón latiendo.
- Llene una jeringa de plástico de 5 ml con solución tibia de Tyrode. Recorte el extremo ancho de una punta de pipeta de plástico de 0-20 μL y conéctela a la punta plana de la jeringa. La jeringa ahora se ha extendido hasta el diámetro fino de la punta de la pipeta.
- Construya una "línea de inyección" conectando un segmento de tubo de silicona de 0,03 pulgadas de diámetro interior al aparato de jeringa con punta de pipeta recién asegurado (paso 1.7). Conecte una microaguja capilar de vidrio al extremo opuesto del tubo.
- Monte la microaguja en el soporte de microinyección conectado a un micromanipulador. Purgue el tubo de silicona y la microaguja de las burbujas de aire.
- Con el micromanipulador, inserte la aguja en el ápice del corazón y perfunda el embrión 1,12 inyectando lentamente la solución de Tyrode en el corazón. Continúe perfundiendo el embrión hasta que esté en gran parte libre de sangre.
- Utilice el micromanipulador para tirar de la aguja y la línea de inyección hacia atrás de su sitio de inserción y oriente la aguja de manera que no se altere durante la preparación de la siguiente línea de inyección. Retire el tubo de silicona de la aguja y la jeringa.
NOTA: Algunos usuarios pueden considerar óptimo mantener la aguja unida al corazón, en cuyo caso el usuario debe quitar el tubo de silicona entre la aguja y la jeringa, mientras mantiene la aguja en su lugar. - Realizar endo-pintura para marcar el endotelio vascular con fluorescencia verde.
- Con una micropipeta, cargue 20-40 μL de solución madre de poli-L-lisina FITC en el tubo de silicona, con cuidado de no crear burbujas de aire por delante de la barrera líquida FITC.
- Vuelva a colocar la jeringa llena con la solución de Tyrode y use el micromanipulador para inyectar lentamente en el ápice del corazón, volviendo a insertar la aguja si es necesario. Retire la aguja después de que se haya difundido la poli-L-lisina FITC y antes de que entren burbujas de aire en el corazón.
- Deje reposar la poli-L-lisina FITC en el embrión durante 5-10 minutos.
NOTA: (control de calidad opcional) Para verificar la fluorescencia, tome una fotografía con un estéreo fluorescente o un macroscopio. La imagen se puede utilizar para ayudar a determinar un factor de deshidratación después de que se completa la limpieza del embrión.
- Llene una jeringa de 5 ml con paraformaldehído (PFA) al 4% y conéctela al tubo de inyección de silicona para un tercer paso de inyección.
- Perfundir el embrión 1,12 con PFA al 4% hasta que todas las estructuras cardiovasculares estén a plena capacidad de volumen y el tejido comience a volverse más opaco.
- Cargue suavemente el embrión en un vial de 2-5 ml lleno de suficiente PFA al 4% para cubrir la muestra. Tenga cuidado de no deformar el embrión en exceso.
NOTA: Elija un vial lo suficientemente grande para la muestra de interés para evitar aplastar o deformar la muestra. - Incubar el embrión durante la noche a 4 °C con un agitador.
2. Deshidratación y desinfección embrionaria
- Pipetee con cuidado el PFA al 4%.
NOTA: A partir de este punto, evite el contacto directo con el embrión para evitar daños o deformaciones en los tejidos. - Para lavar el embrión, incube el embrión en una solución tampón de fosfato (PBS) fresca a temperatura ambiente durante 30 minutos mientras agita suavemente. Repita dos veces más para un total de 3 lavados.
- Comienza a deshidratar el embrión en una campana extractora. Pipetear cuidadosamente el PBS e incubar el embrión en una serie graduada de 5 incubaciones de metanol a temperatura ambiente durante 1 h cada una: concentración de metanol del 20%, 40%, 60%, 80% y 100%.
- Deje el embrión en metanol fresco al 100% a temperatura ambiente durante la noche.
NOTA: (Punto de parada opcional). Los embriones pueden almacenarse a -20 °C en metanol al 100% para su uso posterior durante un máximo de 6 meses. - En la campana extractora, comience el procedimiento de eliminación de lípidos. Incubar el embrión en una solución de metanol DCM 2:1 (volumen a volumen) a temperatura ambiente durante 3 h, agitando suavemente.
PRECAUCIÓN: El DCM es tóxico y debe manipularse en la campana extractora. Tome precauciones adicionales cuando trabaje con DCM. Los guantes dobles pueden ayudar a proporcionar una barrera adicional. - Saca el cinamato de etilo (ECi) a 4 °C y déjalo a temperatura ambiente para que se descongele.
- Lavar los embriones en DCM fresco 100% a temperatura ambiente durante 15 min, agitando. Repita el lavado 100% DCM para lograr un total de 2 lavados.
- Pipetear DCM e incubar el embrión en ECi al 100%. Dejar el embrión en ECi hasta que se aclare en aproximadamente 1 h. Agite suavemente el tubo si es necesario.
- (Paso de verificación opcional) Examine la calidad del aclarado y la tinción de los vasos con un estereoscopio fluorescente o un macroscopio. Tome una fotografía del embrión para determinar el factor de deshidratación específico de la etapa / edad.
- Almacene el embrión aclarado a 4 °C durante un máximo de 6 meses hasta que esté listo para la obtención de imágenes, manteniendo el embrión protegido de la luz.
3. Adquisición de datos
- Para obtener imágenes de los embriones, use un microscopio fluorescente de lámina de luz. Fije la cabeza de un embrión ópticamente aclarado a un capilar de vidrio con gel de superpegamento.
- Monte el capilar de vidrio en el portamuestras, llene la cámara de imágenes con ECi y baje el embrión en la cámara de imágenes.
- Ajuste los parámetros y realice la obtención de imágenes.
4. Aplicación cuantitativa: reconstrucción 3D y modelado computacional de dinámica de fluidos
NOTA: En estos pasos, las pilas de imágenes de alta resolución generadas por láminas de luz se cargan en el software de código abierto SimVascular14 para la reconstrucción anatómica en 3D y el modelado dinámico de fluidos computacional. Existen tutoriales detallados en el sitio web de SimVascular (consulte la Tabla de materiales). La reconstrucción consiste en crear trayectorias en los vasos de interés, crear segmentaciones 2D a lo largo de las trayectorias y combinar segmentaciones voladas en un modelo sólido 3D. El modelado computacional consiste en preparar una geometría de malla, definir las condiciones de contorno y ejecutar simulaciones.
- Cree un nuevo SVProject en Archivo y cargue una pila de imágenes de hojas de luz de alta resolución haciendo clic con el botón derecho en Imágenes y, a continuación, haciendo clic en Agregar/reemplazar imagen.
- Siga los pasos del tutorial del software para reconstruir anatomías vasculares in silico.
- Para crear una línea de ruta, haga clic con el botón derecho en Rutas y seleccione crear ruta. Coloque marcadores de camino a lo largo de una embarcación de interés. Repita el procedimiento para cada embarcación de interés.
- Para cada línea de ruta creada, trace las secciones transversales de los recipientes en 2D haciendo clic con el botón derecho en Segmentaciones y seleccionando Crear grupo de curvas de nivel. Seleccione la ruta de la embarcación y haga doble clic en el nombre de la embarcación en Segmentación para comenzar la segmentación manual.
- Una vez que se hayan segmentado todas las embarcaciones, cree un modelo haciendo clic con el botón derecho en Modelos y luego seleccionando crear modelo. Seleccione el tipo de PolyData , introduzca un nombre de modelo, haga clic en Crear modelo sólido y seleccione todas las segmentaciones que deben formar parte del modelo.
- Engrane la geometría ejecutando el mezclador Tetgen integrado en SimVascular SVMesher. Defina un tamaño máximo de borde y realice el mallado de superficie y volumen.
NOTA: Elija un tamaño de malla que pueda resolver detalles geométricos finos y variabilidades hemodinámicas localizadas en el vaso. Comience con el botón Estimar un tamaño de malla global . Puede ser necesario un estudio de convergencia de malla al finalizar las simulaciones. - Configure una simulación computacional del flujo sanguíneo con SimVascular Solver. Cree archivos de simulación haciendo clic con el botón derecho en Simulaciones y seleccionando Crear trabajo de simulación. Ajuste los parámetros básicos y seleccione los BC de entrada y salida para condiciones de contorno específicas.
- Ajuste los parámetros del Solver, vaya a la pestaña Crear archivos y Ejecutar simulación, seleccione el archivo de malla, haga clic en Crear archivos de datos para simulación.
- Inicie la simulación utilizando una estación de trabajo o supercomputadora de computación de alto rendimiento.
Resultados
El protocolo rápido de imágenes de alta resolución de montaje completo que se presenta aquí (Figura 1, Tabla 1) produce lúmenes vasculares claramente delineados como se muestra en la Figura 2, Figura 3 y Figura 4, donde el endotelio de la vasculatura del embrión de pollo es fluorescente GFP y, por lo tanto, delineado en verde a través de las etapas embrionarias desde el desarrollo cardíaco temprano hasta el maduro (Figura 4). Es importante encontrar la combinación correcta de concentración de poli-L-lisina, tiempo de fijación del tinte y uso de contracciones ventriculares (cuando corresponda) si la vasculatura de la muestra no aparece claramente etiquetada (consulte la Figura 2 para ver cómo deben verse los embriones bajo un estereoscopio o macroscopio fluorescente antes de la toma de imágenes de LSFM). Mantener un corazón latiendo a través de la solución tibia de Tyrode y la disección rápida del embrión lejos del saco vitelino ayuda a la difusión de la solución en toda la muestra/modelo animal pequeño. La viscosidad de la poli-L-lisina se puede controlar a través de la concentración de la solución madre. Una solución menos viscosa puede ayudar en la penetrancia de fluorescencia en toda la muestra, aunque la solidez del marcaje debe verificarse después de la perfusión de PFA. Es posible que el usuario desee compensar una menor concentración de solución madre de poli-L-lisina aumentando el volumen inyectado y permitiendo un mayor tiempo de incubación antes de fijar el embrión con PFA.
La Figura 5 demuestra la idoneidad del método presentado para la reconstrucción anatómica 3D y el modelado computacional. Los valores del esfuerzo cortante de pared están en línea con los estudios previos de los autores basados en reconstrucciones de tomografía nanocomputarizada1.

Figura 1: Configuración de etiquetado y fijación de embriones (arriba) y configuración de adquisición de datos de microscopía de lámina ligera (abajo). Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Embriones antes y después de los procedimientos de limpieza. Embriones representativos de campo claro e iluminados por canal GFP para muestras que se han sometido a los pasos 1 (antes de la aclaración) y 2 (después de la aclaración) del protocolo tal como se ve con un macroscopio fluorescente. Obsérvese cómo todo el embrión brilla en el canal GFP antes de aclararse, especialmente en el corazón, al que se le han extirpado las membranas exteriores. Toda la vasculatura deseada está claramente etiquetada en el embrión aclarado con GFP. Barras de escala = 1 mm. Haga clic aquí para ver una versión más grande de esta figura.
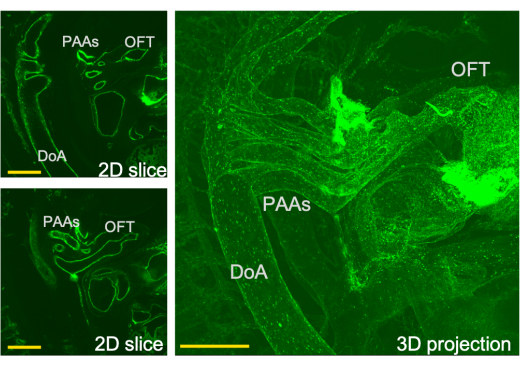
Figura 3: Vista tridimensional del sistema de flujo de salida cardíaco y los cortes correspondientes a través de esta vista obtenida por LSFM. PAA- arteria de arco faríngeo, tracto de salida OFT, DoA-aorta dorsal. Barras de escala = 0,5 mm. Haga clic aquí para ver una versión más grande de esta figura.
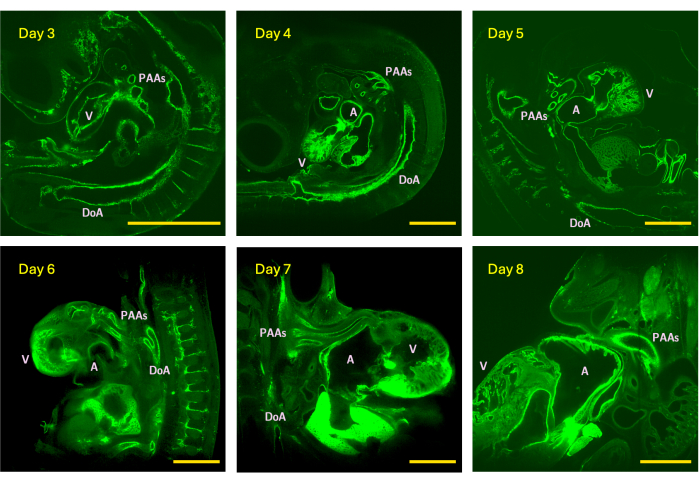
Figura 4: Ejemplos de cortes z de pilas de imágenes LSFM adquiridas del día 3 (etapa HH18), 4 (HH24), 5 (HH26), 6 (HH29), 7 (HH31) y 8 (HH34) embriones de pollo. El tamaño de la imagen representa el campo de visión máximo (sin mosaicos) del visor equipado con un objetivo de detección 5x. V - ventrículo; A - atrio; DoA - aorta dorsal; AAP - arterias del arco faríngeo. Barras de escala = 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Reconstrucciones anatómicas in silico representativas del arco aórtico del día 5 (estadio HH26) y resultados clave de la simulación hemodinámica. Izquierda: Un modelo de anatomía vascular reconstruido que muestra el tracto de salida (OFT), las arterias del arco faríngeo (AAP) y la aorta dorsal (DoA). Medio: Líneas de corriente del flujo sanguíneo en la sístole máxima obtenida mediante simulación de flujo sanguíneo. Las líneas rojas sirven en gran medida a las regiones craneales, mientras que las azules sirven a las regiones caudales. Derecha: Distribución del esfuerzo de cizallamiento de la pared sistólica (WSS) máxima sobre la pared del vaso obtenida mediante simulación del flujo sanguíneo Haga clic aquí para ver una versión más grande de esta figura.
| Días | Pasos | Hora | Temperatura |
| Día 1 | Recolección de embriones | 5-10 min/embrión | RT (de sobremesa) |
| FITC Endo-pintura | 10-30 min/embrión | RT (de sobremesa) | |
| Solución de perfusión de PFA | Perfusión: 5-15 min/embrión | Perfusión: RT (sobremesa) Incubación: 4 °C | |
| Incubación: O/N | |||
| Día 2 | Lavado de PBS | 90 minutos | RT (de sobremesa) |
| Deshidratación | 5 h + O/N | RT (campana extractora) | |
| Día 3 | Eliminación de lípidos | 3.5 h | RT (campana extractora) |
| Claro | ≥1 h | RT (de sobremesa) |
Tabla 1: Resumen de la preparación de muestras para la obtención rápida de imágenes cuantitativas de láminas de luz.
Discusión
La capacidad de estudiar biología en 3D es fundamental para una comprensión precisa de la complejidad morfológica, la estructura de los órganos internos y las conexiones vasculares. Las imágenes vasculares 3D precisas y fiables también son fundamentales para las simulaciones hemodinámicas computacionales específicas del sujeto, que a menudo son el único medio fiable para cuantificar parámetros hemodinámicos clave, como el esfuerzo cortante de la pared y la distribución de la presión. Aquí, los autores presentan un método de preparación de muestras rápido y accesible para imágenes vasculares 3D de alta resolución en animales pequeños utilizando LSFM. El método produce de forma fiable pilas de imágenes de alta resolución de embriones de pollo HH18 (día 3) a HH34 (día 8), que representan un período crítico del desarrollo cardíaco. De HH24 (día 4) a HH34 (día 8), el tamaño total del embrión aumenta de ~30-550mm3, un aumento de crecimiento promedio de 2 veces por período de 24 h, con un aumento del tamaño del corazón y miocardio de ~1mm3 (día 4) a ~17mm3 (día 8)15. Debido al rápido crecimiento embrionario y cardiovascular, las imágenes para el presente estudio se obtuvieron con una resolución en el plano que varió de 0,61 μm en HH18 (día 3) a 2,28 μm en HH34 (día 8) con un rango de pasos z de 1,92-2,4 μm cuando se enfoca en el sistema de arterias del arco faríngeo y de 1,22 μm (HH18) a 2,53 μm (HH34) con un rango de pasos z de 1,94-3,5 μm cuando se captura todo el embrión (Figura 4). Las pilas de imágenes de alta resolución generadas son adecuadas para la reconstrucción anatómica vascular in silico y las simulaciones hemodinámicas específicas del sujeto, como se demostró a través de los modelos HH26 (día 5), de los que se obtuvieron imágenes con una resolución en el plano de 1,30 μm y un tamaño de paso z de 1,92 μm16. Al igual que con otras técnicas de montaje completo, el método propuesto puede utilizarse en modelos animales, particularmente cuando se realizan imágenes de órganos completos 5,6,7. La técnica iDISCO+ se ha aplicado en corazones de ratón neonatos y adultos5.
La principal ventaja del método propuesto radica en el uso de poli-L-lisina marcada con FITC para el marcaje fluorescente y ECi para el aclarado. La poli-L-lisina está cargada positivamente bajo el pH fisiológico, por lo que se une de forma no específica al endotelio vascular mientras se perfunde a través de la muestra. El proceso adhiere FITC de forma rápida y fiable a las paredes de los vasos, marcándolas con una fluorescencia brillante y estable que es muy resistente al fotoblanqueo. Tradicionalmente, las imágenes microscópicas volumétricas de montaje completo, incluida la LSFM, requieren que las muestras se etiqueten con tinción inmunohistoquímica. Este procedimiento exige el uso de anticuerpos costosos y prolonga el tiempo de preparación de la muestra hasta 4 semanas 1,8,9. Los embriones tempranos no expresan marcadores vasculares tradicionales como la elastina o las células del músculo liso vascular y, por lo tanto, son más difíciles de atacar con anticuerpos específicos. Además, las muestras aclaradas a menudo se obtienen imágenes mientras se sumergen en la solución de limpieza. El procedimiento clásico de limpieza iDISCO+ requiere el peligroso compuesto éter de dibencilo, que a menudo no está permitido en las instalaciones de diagnóstico por imágenes8. ECi es un compuesto mínimamente peligroso que es seguro manipular fuera de los entornos de laboratorio y es menos probable que dañe los equipos ópticos. Si se desea, la técnica propuesta puede combinarse o multiplexarse con inmunotinción, siempre que las propiedades de emisión espectral elegidas permitan experimentos de coexpresión. La multiplexación puede aumentar el etiquetado de la muestra y el tiempo de preparación.
El protocolo propuesto tiene algunas limitaciones. El procedimiento solo es aplicable a embriones sacrificados y tejido extirpado, lo que excluye la posibilidad de estudios longitudinales. La endopintura de poli-L-lisina FITC, aunque rápida y económica, requiere un alto nivel de destreza y precisión. Además, como el tinte no penetra fácilmente a través del tejido, solo etiquetará las paredes de los vasos que pueda alcanzar, lo que presenta desafíos para el estudio de redes capilares pequeñas. Tales desafíos se pueden manejar manteniendo el corazón latiendo al administrar la poli-L-lisina y ajustando la viscosidad/concentración de la solución inyectada. La falta de especificidad del colorante dificulta la distinción entre los tipos de vasos1. El exceso de poli-L-lisina FITC que se escapa de la vasculatura durante el proceso de inyección también puede unirse a tejidos no vasculares, como la piel y la membrana superficiales, lo que puede interferir con la lámina de luz iluminadora durante la obtención de imágenes y reducir la calidad de la imagen. El usuario debe estar atento al inyectar la poli-L-lisina para evitar fugas. El protocolo actual está ampliamente validado utilizando embriones de pollo en etapa temprana para obtener imágenes de las arterias sistémicas principales. Es posible que la concentración, el volumen y el tiempo de fijación de la inyección de poli-L-lisina FITC deban optimizarse aún más para diferentes casos de uso.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue respaldado por un Premio de Desarrollo Profesional de la Asociación Americana del Corazón, el Premio de Carrera del Fondo Burroughs Wellcome en la Interfaz Científica, el Fondo de Investigación de Ventrículo Único de Additional Ventures y el Núcleo de Microscopía de la Facultad de Medicina de la UCSD (Subvención P30 NS047101). Los autores agradecen al Dr. Bobby Thompson por su introducción a la endo-pintura, al Centro de Microscopía de la Facultad de Medicina de la UCSD y a Robert Porter (UCSD) por su apoyo experimental.
Materiales
| Name | Company | Catalog Number | Comments |
| #5 forceps | Fine Science Tools | 11252-30 | |
| #55-forceps | Fine Science Tools | 11295-51 | |
| 0.03 inch inner diameter silicone tubing | VWR | 32829-182 | |
| 20 μL pipette tips | VWR | 76322-134 | |
| 35 mm Petri dish | VWR | 10799-192 | |
| 5 mL plastic syringe | VWR | BD 309646 | |
| Dichloromethane (DCM) | Sigma-Aldrich | 270997 | Refer to MSDS. Stored in side cabinet under fume hood |
| Ethyl cinnamate (ECi) | Sigma-Aldrich | 112372 | Stored at 4 °C |
| Fine Curved scissors | Fine Science Tools | 14061-09 | |
| FITC-poly-L-lysine | Sigma-Aldrich | P3069 | Store at -20 °C (powder, stock solution), 4ºC (working solution) |
| Fluoresent microscope | EVIDENT SCIENTIFIC | MVX10 | |
| Glass capillary tubes (0.75 mm ID) | Sutter Instrument | FG-GB100-75-10 | |
| Lightsheet microscope | Zeiss | Z.1 system | |
| Methanol | Sigma-Aldrich | M1775 | Refer to MSDS. Stored in flammable cabinet under fume hood |
| Microforge | Narishige International USA, Inc. | MF2 | |
| Micromanipulator | World Percision Instrrument | M3301R | |
| Paraformaldehyde (PFA) 4% | Thermo Scientific | J19943.K2 | Refer to MSDS. Stored at -20 °C (powder), 4 °C (4% working solution) |
| Phosphate buffered saline (PBS) | Cytiva | SH30256.01 | Stored on benchtop |
| SimVascular | open source software www.simvascular.org | ||
| Tyrode’s Solution | Made in-house |
Referencias
- Lindsey, S. E., Butcher, J. T., Vignon-Clementel, I. E. Cohort-based multiscale analysis of hemodynamic-driven growth and remodeling of the embryonic pharyngeal arch arteries. Development. 145 (20), dev162578(2018).
- Lindsey, S. E., Vignon-Clementel, I. E., Butcher, J. T. Assessing early cardiac outflow tract adaptive responses through combined experimental-computational manipulations. Ann Biomed Eng. 49 (12), 3227-3242 (2021).
- Salman, H. E., et al. Effect of left atrial ligation-driven altered inflow hemodynamics on embryonic heart development: Clues for prenatal progression of hypoplastic left heart syndrome. Biomech Model Mechanobiol. 20 (2), 733-750 (2021).
- Henning, A. L., Jiang, M. X., Yalcin, H. C., Butcher, J. T. Quantitative three-dimensional imaging of live avian embryonic morphogenesis via micro-computed tomography. Dev Dyn. 240 (8), 1949-1957 (2011).
- Anbazhakan, S., et al. Blood flow modeling reveals improved collateral artery performance during the regenerative period in mammalian hearts. Nat Cardiovasc Res. 1 (8), 775-790 (2022).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nat Methods. 13 (10), 859-867 (2016).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2016).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), dev199369(2021).
- Rios Coronado, P. E., Red-Horse, K. Enhancing cardiovascular research with whole-organ imaging. Curr Opin Hematol. 28 (3), 214-220 (2021).
- Miller, C. E., et al. Confocal imaging of the embryonic heart: How deep. Microsc Microanal. 11 (3), 216-223 (2005).
- Renier, N., et al. Mapping of brain activity by automated volume analysis of immediate early genes. Cell. 165 (7), 1789-1802 (2016).
- Lindsey, S. E., et al. Growth and hemodynamics after early embryonic aortic arch occlusion. Biomech Model Mechanobiol. 14 (4), 735-751 (2015).
- Humphrey, J. D. Constrained mixture models of soft tissue growth and remodeling-twenty years after. J Elast. 145 (1), 49-75 (2021).
- Updegrove, A., et al. SimVascular: An open-source pipeline for cardiovascular simulation. Ann Biomed Eng. 45 (3), 525-541 (2017).
- Kim, J. S., Min, J., Recknagel, A. K., Riccio, M., Butcher, J. T. Quantitative three-dimensional analysis of embryonic chick morphogenesis via microcomputed tomography. Anat Rec. 294 (1), 1-10 (2011).
- Zhang, D., Lindsey, S. Evaluation of high-resolution image accuracy for small animal vascular flow quantitation. Bull Am Phys Soc. , https://meetings.aps.org/Meeting/DFD24/Session/X03.8 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados