Method Article
Crioseccionamento direto de cabeças de Drosophila para coloração e imunocoloração aprimoradas de fluorescência cerebral
Neste Artigo
Resumo
Este estudo apresenta um protocolo simplificado para processamento de tecidos envolvendo decapitação, fixação, criosecção, coloração de fluorescência, imunocoloração e imagem, que pode ser estendido para imagens confocais e multifotônicas. O método mantém uma eficácia comparável a dissecções complexas, ignorando a necessidade de habilidades motoras avançadas. A análise quantitativa de imagens fornece amplo potencial investigativo.
Resumo
A imunocoloração dos cérebros de Drosophila melanogaster é essencial para explorar os mecanismos por trás de comportamentos complexos, circuitos neurais e padrões de expressão de proteínas. Os métodos tradicionais geralmente envolvem desafios como realizar dissecção complexa, manter a integridade do tecido e visualizar padrões de expressão específicos durante imagens de alta resolução. Apresentamos um protocolo otimizado que combina criossecção com coloração de fluorescência e imunocoloração. Este método melhora a preservação do tecido e a clareza do sinal e reduz a necessidade de dissecção trabalhosa para imagens cerebrais de Drosophila. O método envolve dissecção rápida, fixação ideal, crioproteção e criossecção, seguida de coloração fluorescente e imunocoloração. O protocolo reduz significativamente os danos aos tecidos, aumenta a penetração de anticorpos e produz imagens nítidas e bem definidas. Demonstramos a eficácia dessa abordagem visualizando populações neurais específicas e proteínas sinápticas com alta fidelidade. Este método versátil permite a análise de vários marcadores de proteína no cérebro adulto em vários planos z e pode ser adaptado para outros tecidos e organismos modelo. O protocolo fornece uma ferramenta confiável e eficiente para pesquisadores que conduzem imuno-histoquímica de alta qualidade em estudos de neurobiologia de Drosophila. A visualização detalhada desse método facilita a análise abrangente da neuroanatomia, patologia e localização de proteínas, tornando-o particularmente valioso para a pesquisa em neurociência.
Introdução
Comportamentos complexos que vão desde interações sociais1, percepção e processamento sensorial2, aprendizagem3 até movimento4 são impulsionados pelo cérebro. Os distúrbios neurológicos também são cada vez mais comuns e devem aumentar com o tempo 5,6. É fundamental estudar como o cérebro funciona tanto na saúde quanto na doença. O dogma central da biologia molecular sugere que uma das funções mais importantes das unidades biológicas são as proteínas7, e tanto quanto e onde elas são expressas são essenciais para entender como o cérebro funciona.
Drosophila melanogaster, comumente conhecida como mosca da fruta, é um modelo altamente valioso para estudar a função cerebral sob envelhecimento e condições fisiopatológicas8. A disponibilidade de ferramentas genéticas avançadas em Drosophila permite que os pesquisadores explorem a função de quase qualquer proteína9, com bibliotecas genéticas abrangentes para quase todos os genes prontamente acessíveis10. Juntamente com sua curta vida útil e alta taxa reprodutiva, essas características tornam a Drosophila um modelo excepcional para a pesquisa do cérebro11. Isso levou a conquistas significativas, incluindo o desenvolvimento de um mapa cerebral completo da mosca12, e até contribuiu para um Prêmio Nobel por elucidar os mecanismos neuronais dos ritmos circadianos e relógios moleculares 13,14,15. Como resultado, a Drosophila continua sendo um sistema poderoso e versátil, impulsionando nossa compreensão da função cerebral e fornecendo insights sem precedentes sobre os processos neurológicos.
A imuno-histoquímica e a imunofluorescência são ferramentas fundamentais para estudar a expressão de proteínas in situ. Em contraste com técnicas como Western Blot, que permite apenas análises semiquantitativas e normalmente é conduzida em tecido a granel16, ou técnicas complicadas e caras como espectrometria de massa para medir o nível de proteína17, a imuno-histoquímica é relativamente direta e permite tanto a quantificação da expressão da proteína quanto a medição da localização de uma proteína dentro de um tecido ou célula. É importante ressaltar que a imuno-histoquímica fluorescente também pode ser multiplexada para medir várias proteínas para identificar tipos específicos de células e tecidos ou responder a várias perguntas no mesmo tecido. Além disso, a fixação do tecido pode permitir comparações entre diferentes condições experimentais, genótipos, idades e pontos de tempo circadianos. No entanto, a imuno-histoquímica fluorescente pode ser desafiadora e muitos fatores podem influenciar a qualidade da imagem. Este protocolo otimizado de criosseccionamento e imunocoloração para cérebros de Drosophila visa aprimorar a imagem de alta resolução, melhorando a preservação do tecido, a penetração de anticorpos e a visualização de populações neurais e marcadores de proteínas. Desenvolvido para enfrentar os desafios dos métodos tradicionais, como dissecção complexa, danos teciduais e resolução de imagem limitada associada a montagens de cérebro inteiro18. Este protocolo combina criossecção com coloração de fluorescência para garantir integridade estrutural e imagens nítidas em vários planos z. Em comparação com as preparações de montagem inteira, esse método minimiza a distorção, facilita a difusão mais profunda de anticorpos e fornece análises neuroanatômicas e de localização de proteínas claras18. Sua versatilidade permite a adaptação para outros tecidos e organismos modelo, oferecendo uma ferramenta confiável e eficiente para pesquisas em neurociência 19,20. Ele pode ser adaptado para observar quase qualquer proteína e aplicado para estudar qualquer condição, doença ou modelo.
Protocolo
1. Preparação do equipamento
- Certifique-se de que o criostato esteja ligado e ajustado para -20 °C. Ligue o aquecedor de lâminas ou uma pequena incubadora, certificando-se de que esteja ajustado para 37 °C.
NOTA: Nesta fase, as lâminas rotuladas podem ser colocadas no aquecedor ou incubadora e deixadas indefinidamente até o seccionamento.
2. Preparação de soluções
- Prepare 50 mL de solução salina tamponada com fosfato 1x (PBS), pH 7,4, a partir de 10x estoque de PBS. Prepare uma solução de paraformaldeído a 4% em PBS com um volume final de 10 mL.
- Prepare uma solução de limpeza de etanol a 70% em água em um borrifador. Prepare uma solução de bloqueio (albumina de soro bovino (BSA) a 3% em solução salina tamponada com Tris de estoque 20x). Preparar uma solução primária de anticorpos (a diluição depende da experiência). Aqui, uma diluição de 1:250 de anticorpo de camundongo ApoE em 3% BSA em TBS é usada.
- Preparar uma solução de anticorpos secundários (a diluição depende da experiência). Aqui, é usada uma diluição de 1:500 de Alexa Flour 750 A21037 Goat Anti-Mouse Secondary em 3% BSA em TBS.
- Prepare a solução de coloração fluorescente (a diluição depende do experimento). Aqui, uma solução de 5 μg / mL de Vermelho do Nilo em PBS é preparada.
NOTA: Todas as soluções, principalmente as fluorescentes, devem ser refrigeradas e armazenadas em um recipiente refrigerado escuro. Eles também devem ser levados à temperatura ambiente imediatamente antes do uso.
3. Coleta de tecido
- Depois de obter moscas em frascos envelhecidos, abra a válvula na esteira de CO2 e despeje as moscas na esteira rapidamente para evitar a fuga. Espere que as moscas fiquem quase inconscientes, interrompendo a maior parte do movimento. A posição voa sob o microscópio SZ61 movendo o tapete sob a lente objetiva. Ajuste a ampliação e o foco de forma que as moscas sejam claramente visíveis e confortáveis para decapitar.
NOTA: As moscas usadas para este exemplo são ELAV/+ e ELAV>ApoE4 - Insira uma tesoura de mola entre o tórax e a cabeça, aperte com firmeza e decapite 5 a 10 cabeças de mosca por grupo experimental. Devolva as moscas não utilizadas ao frasco de envelhecimento.
NOTA: Se houver preocupação com a penetração do fixador, uma pequena incisão pode ser realizada na parte posterior da cabeça para permitir maior penetração do agente fixador na etapa 4.1. - Usando um pincel, coloque suavemente as cabeças em tubos rotulados de 1,5 mL no gelo até que os grupos ELAV/+ e ELAV>ApoE4 tenham sido coletados.
4. Fixação de tecido total
- Remova os tubos do gelo e pipete 100 μL de paraformaldeído a 4% em solução de PBS em cada tubo, garantindo que todos os cabeçotes estejam submersos na solução. Se as cabeças estiverem aderidas às paredes do tubo e evitando o contato com a solução, use uma escova para empurrá-las suavemente para baixo ou bata levemente contra uma superfície horizontal para garantir o contato apropriado.
- Coloque em um agitador orbital usando uma configuração média por 15 min. Após 15 min, descarte a solução de Paraformaldeído e substitua-a por 1x PBS por 10 min, garantindo que todas as cabeças estejam submersas na solução.
- Descartando a solução anterior a cada vez, lave o lenço com PBS 2x por 10 min cada, totalizando 3 lavagens.
- Após a lavagem final, transfira os cabeçotes para uma solução de sacarose a 10% em PBS, garantindo que os cabeçotes estejam submersos dentro do tubo. Deixe-os durante a noite para obter a saturação ideal.
NOTA: Se for desejada uma imagem no mesmo dia, a infusão de sacarose pode ser reduzida; no entanto, os efeitos crioprotetores também serão reduzidos proporcionalmente.
5. Preparação do molde
- Preencha um molde rotulado aproximadamente 50% com composto de Temperatura de Corte Ótima (OCT), permitindo que ele se espalhe para todos os 4 cantos do molde.
- Usando um pincel, coloque cuidadosamente as cabeças na superfície da OCT dentro do molde. Ao colocar vários grupos experimentais no mesmo molde, certifique-se de que esses grupos estejam separados dentro do molde para evitar confusão.
NOTA: É importante evitar a diluição do composto OCT por contaminação com a solução de sacarose anterior através da escova. Além disso, a colocação profunda na OCT usando o pincel pode criar muitas bolhas ao redor das cabeças. Evite esses erros para evitar problemas de seccionamento mais tarde. - Usando a ponta da pinça, empurre lentamente cada cabeça para a parte inferior do molde com os olhos voltados para o fundo. Essa orientação é selecionada para um corte no plano coronal.
- Evite perfurar ou esmagar as cabeças contra o fundo do molde durante este processo. Alinhe todas as cabeças nas dimensões X, Y e Z para que cada seção contenha todos os assuntos simultaneamente. Garanta uma submersão lenta para reduzir a formação de bolhas de ar.
- Uma vez que todas as cabeças estejam alinhadas corretamente, coloque cuidadosamente os moldes diretamente em -20 °C para congelar.
NOTA: Se o alinhamento das cabeças estiver significativamente errado durante o seccionamento, considere o uso de gelo seco ou nitrogênio líquido para o congelamento inicial do molde. - Quando o molde estiver quase todo congelado, encha o restante com OCT e deixe-o congelar antes de armazenar a longo prazo a - 80 °C.
6. Crioseccionamento de moldes
NOTA: Geralmente, é aconselhável preparar e cortar um molde em branco antes de cortar os moldes experimentais do grupo. Isso permite garantir a funcionalidade adequada da roda, lâmina e vidro anti-rolamento imediatamente antes de seccionar o tecido.
- Prenda a broca do mandril ao molde aplicando uma quantidade generosa de OCT no molde e colocando a broca por cima, pressionando-a plana. Deixe congelar completamente no criostato, geralmente dentro de 5 min.
- Solte a broca e o bloco OCT do molde e coloque-o no mandril, garantindo que o molde permaneça devidamente orientado de cima para baixo. Aperte a chave do mandril até que a broca esteja segura.
- Alinhe o bloco com a lâmina usando os botões de ajuste e os controles de profundidade do mandril.
- Defina a largura da seção para 20 μm. Corte cada fatia usando movimentos lentos, mas consistentes, permitindo que o vidro anti-rolo capture cada fatia. Capture seções usando os slides aquecidos tocando o slide na borda mais próxima da seção e permitindo que a seção suba no slide. Até oito seções podem ser ajustadas em uma corrediça de tamanho padrão (25 mm x 75 mm x 1 mm) quando espaçadas adequadamente.
NOTA: Há uma questão de escolha a ser feita ao escolher quais seções coletar. Como resultado da orientação de incorporação, as seções anteriores serão da anterior e as seções posteriores serão das porções posteriores da cabeça. Como tal, se o interesse estiver em uma área específica mais do que em outra, a seleção de seção pode ser ajustada de acordo. Alternativamente, todas as seções podem ser coletadas em várias lâminas até que não haja mais tecido. - Deixe as lâminas secarem em temperatura ambiente por pelo menos 30 min, mas não mais do que 1 h.
7. Coloração e IHQ
NOTA: Para este protocolo, o método detalhará a IHC usando um anticorpo primário não conjugado. Anticorpos conjugados com fluorocromo ou outras colorações de fluorescência que podem ser realizadas em um único estágio devem ser usados junto com o anticorpo secundário se ambos forem usados juntos.
- Imediatamente após o período de secagem, remova o OCT nas bordas da lâmina usando uma lâmina de barbear, deixando espaço para uma borda hidrofóbica. Desenhe uma borda hidrofóbica em cada slide usando o marcador. Deixe secar por 5 min.
- Lave todas as lâminas 3 vezes por 5 min cada com PBS pipetando suavemente em cima da lâmina, evitando pipetar diretamente em cima do tecido quando possível.
NOTA: A pipeta de 1000 μL é mais útil aqui. Uma lâmina de tamanho padrão com tecido deve ser completamente coberta com 750μL de qualquer solução. Racks e baldes de slides também podem ser usados. - Após a lavagem das lâminas, pipetar BSA a 3% em solução de bloqueio TBS nas lâminas. Deixe incubar por 30 minutos.
- Rejeitar a solução de bloqueio e pipetar a solução de anticorpos primários para as lâminas. Neste caso, uma diluição de 1:250 de SC-13521 ApoE em 3% BSA em TBS. Deixe o anticorpo incubar durante a noite a 4 °C ou por 1 h à temperatura ambiente. Use lenços umedecidos ou toalhas de papel para evitar que a solução seque durante a noite.
- Descarte o anticorpo primário e, usando a pipeta, lave 3 vezes por 5 minutos cada com PBS.
- Adicione a solução de anticorpos secundários. Neste caso, uma diluição de 1:500 de AF 750 Goat Anti-Mouse, além de uma concentração de 5 μg/mL de Vermelho do Nilo, tudo em 3% de BSA em TBS. Deixe incubar por 1 hora em temperatura ambiente.
NOTA: Incubamos simultaneamente uma coloração fluorescente e um anticorpo secundário no mesmo tampão, 3% de BSA em TBS. Isso é preferível, desde que não haja conflitos conhecidos entre os dois reagentes. Se houver conflitos, incube separadamente e faça mais 3 lavagens entre as incubações. - Lave as lâminas 3 vezes com PBS por 5 min cada. Após a lavagem final, deixe uma pequena quantidade de PBS na lâmina.
8. Montagem e preparação para imagem
- Usando uma pipeta de 1000 μL, adicione 3-5 gotas de meio de montagem endurecido contendo DAPI (0,9 μg/ml), uniformemente ao longo da lâmina, evitando queda direta no tecido.
- Coloque a lamínula na lâmina, evitando a formação de bolhas de ar.
NOTA: O uso de pinças pode ajudar nisso, permitindo que a lamínula deslize perto da superfície da lâmina antes de finalmente ser solta. - Manuseie as lâminas recém-montadas com cuidado e guarde-as planas até que estejam completamente secas. Sele as lâminas usando esmalte se houver previsão de armazenamento a longo prazo.
- Capture imagens o mais rápido possível para evitar o decaimento fluorescente.
9. Aquisição de imagem
NOTA: Para captura de imagem, o uso do software Olympus Cell Sense Dimensions será detalhado.
- Antes de fazer a imagem, inspecione as lâminas e limpe-as com etanol a 70% em solução aquosa. Se as lâminas forem fotografadas imediatamente após a montagem, tome cuidado extra ao limpar para evitar perturbar a lamínula. Deixe as superfícies da lâmina e da lamínula secarem por 5 minutos antes de fazer a imagem.
- Selecione cada canal desejado para captura, neste caso, os canais para DAPI, Nile Red e AF 750.
- Selecione a ampliação desejada conforme descrito abaixo. A escolha da ampliação depende do experimento; Aqui, use ampliação de 10x.
NOTA: Todas as ampliações são utilizáveis, incluindo lentes à base de óleo. Se desejar, aplique óleo de imersão na superfície da lâmina. - Para cada canal, calibre os tempos de exposição adequados com base nos assuntos fluorescentes mais brilhantes em um experimento. Evite a superexposição enquanto gera uma imagem o mais brilhante possível.
NOTA: Em geral, os dois principais determinantes da má captura do processo são a superexposição, resultando na perda de definição, e muito sinal de fundo, que é difícil de separar do sinal verdadeiro. Além disso, as exposições devem ser definidas independentemente para cada ampliação exclusiva usada. - Selecione a pasta a ser salva e nomeie as imagens mescladas no menu. Após a captura, todas as imagens estarão localizadas nesta pasta e terão o nome definido aqui.
- Capture imagens focando primeiro em um assunto no canal que permite o melhor ponto focal e, em seguida, comece a coletar. Mantenha o procedimento de focar em cada assunto no mesmo canal para consistência em todo o experimento.
- Capture todos os grupos experimentais usados para comparações posteriores no mesmo dia para evitar o decaimento fluorescente entre os grupos comparados.
- Selecione a ampliação desejada conforme descrito abaixo. A escolha da ampliação depende do experimento; Aqui, use ampliação de 10x.
10. Quantificação
NOTA: A quantificação pode ser realizada usando uma variedade de softwares. Aqui, o uso do Olympus CellSense Dimensions é referenciado.
- Após a coleta, revise as imagens. Remova seções que possuem imperfeições ou artefatos de seção da pasta de quantificação. Selecione imagens que reflitam o objetivo da quantificação. Exemplos de imperfeições são bolhas, seções rasgadas, tecido sobreposto e poeira ou detritos.
- Para selecionar as imagens apropriadas, certifique-se de que todas as imagens com tecido cerebral sejam usadas para quantificação para refletir a expressão geral em todo o cérebro. Como alternativa, use imagens que reflitam apenas o prosencéfalo, o mescentro ou o posterior para fornecer informações sobre as diferenças de expressão nessas áreas.
- Nos menus de contagem e medição, determine os parâmetros de interesse e seus limites para a quantificação das imagens.
- Para quantificação da expressão ApoE por comparação de valor de intensidade média, selecione valores de limite de modo que todos os pixels desse canal sejam considerados (0-infinito). Além disso, contorne as regiões de interesse usando as ferramentas de desenho disponíveis.
- Execute a contagem e a medição em lote para todos os arquivos ou individualmente em cada imagem.
- Para processamento em lote, registre as configurações e a execução da quantificação e selecione a pasta para executar a quantificação. O processamento em lote pode ser acessado por meio da guia do gerenciador de macros e acelera muito o fluxo de trabalho.
- Exporte a tabela de dados para uma planilha para plotagem. Para fazer isso, use o menu de contagem e medição de resultados ao abrir ou exportar para uma tabela automaticamente ao executar em um lote. Essas tabelas de dados conterão todos os parâmetros selecionados escolhidos na etapa 10.2.
- Para análise estatística e plotagem, plote os dados usando uma planilha diretamente ou por meio de outro software. A familiaridade com o software escolhido é fundamental para gerar uma representação precisa dos resultados experimentais. Aqui, os valores absolutos de intensidade da expressão de ApoE no cérebro do mutante foram normalizados para o controle e, em seguida, plotados usando o GraphPad Prism.
Resultados
O método descrito acima permite a imagem de fluorescência de cérebros de moscas adultas de forma confiável e sem dissecção tediosa. Ilustrado de forma simples na Figura 1, o método é simples e pode ser executado rapidamente se todas as amostras, equipamentos e materiais estiverem prontamente disponíveis. Alternativamente, usando armazenamento de -80 °C durante o estágio de molde OCT, as amostras podem ser mantidas para uso muitas semanas depois. Os pesquisadores não precisam ser treinados por muito tempo para aprender as técnicas simples de dissecação e incorporação, tornando esse método bastante acessível.
Exemplos de microscopia de fluorescência realizada usando este método podem ser vistos na Figura 2A-D. A expressão da marca de anticorpo (ApoE) e da coloração fluorescente (Vermelho do Nilo) é bem definida. Além disso, a alta integridade do tecido cerebral também pode ser vista. As imagens podem ser esclarecidas usando recursos comuns de software de processamento de imagem, como deconvolução, que também é mostrada no painel Figura 2A'-D'. A deconvolução é útil para melhorar a nitidez e o contraste e reduzir o ruído.
Com relação à quantificação de imagens, todas as imagens podem ser quantificadas para parâmetros padrão, como contagem de objetos, área média do objeto, intensidade e fração de área. As limitações da quantificação realmente dependem do software escolhido, mas geralmente os parâmetros listados acima permitem uma investigação adequada e estão disponíveis na maioria das aplicações. A Figura 3 demonstra um histograma gerado a partir de valores médios de intensidade nas regiões cerebrais de várias imagens. Isso serve para visualizar a intensidade cerebral média de um determinado genótipo. Neste caso, ELAV/+ e ELAV>ApoE4.
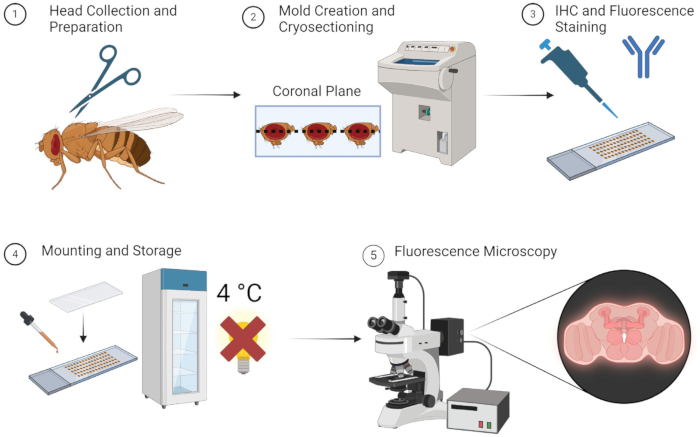
Figura 1: Fluxo de trabalho para seccionamento e imagem do cérebro de Drosophila. 1. As cabeças de Drosophila são coletadas por decapitação usando tesouras finas. 2. Após a fixação, as cabeças coletadas são incorporadas com OCT em um molde e criosseccionadas para obter seções cerebrais finas. 3. As seções cerebrais são submetidas a coloração imuno-histoquímica (IHQ) com anticorpos primários ou coloração fluorescente. 4. Após a coloração, as seções são montadas com uma lamínula e armazenadas a 4 °C no escuro para manter a integridade da fluorescência. 5. As seções cerebrais são visualizadas usando microscopia de fluorescência para estudar as proteínas ou estruturas celulares alvo. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imuno-histoquímica e coloração de fluorescência de cabeças criosseccionadas. (A-D) Imagens representativas de cabeças de moscas fêmeas de 7 semanas coradas para expressão de ApoE, lipídios (vermelho do Nilo) e DAPI. Essas imagens demonstram a expressão da ApoE4 humana (Elav>ApoE4), enquanto as moscas de controle Elav/+ não possuem essa expressão de ApoE. Coloração lipídica com Vermelho do Nilo (Elav>ApoE4 e Elav/+). A integridade do tecido cerebral usando este método também é evidenciada aqui. (A'-D') Estes representam o A, B, C e D após a deconvolução. Clique aqui para ver uma versão maior desta figura.

Figura 3: Quantificação relativa da ApoE. Mostraram os resultados da quantificação da expressão da proteína ApoE em cérebros de Drosophila de 7 semanas de idade. Os valores absolutos de intensidade foram coletados para os indivíduos mutantes Elav/+ e Elav>ApoE4 e, em seguida, normalizados para Elav/+. A significância estatística entre Elav>ApoE4 e Elav/+ é aparente. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, apresentamos um protocolo para imagens fluorescentes precisas de cabeças de Drosophila criosseccionadas. Esta é uma abordagem direta que tem vários pontos positivos importantes. Ou seja, os métodos são simples o suficiente para que qualquer pessoa com treinamento básico de segurança laboratorial possa concluir, eles são adaptáveis para medir a expressão de qualquer proteína para a qual existam anticorpos de alta qualidade e permitem a medição precisa de quanto uma proteína de interesse é expressa e onde essa expressão ocorre em toda a cabeça. Se a qualidade do tecido e da imagem for alta o suficiente, isso poderia permitir o mapeamento 3D da expressão em toda a cabeça da Drosophila .
Em contraste com as abordagens tecnicamente desafiadoras para isolar o cérebro para imagens combinadas com microscopia confocal, este protocolo permite imagens em toda a cabeça da Drosophila, não apenas no cérebro. Isso é especialmente importante, dado que o sistema visual da mosca é um modelo importante da função neuronal21, mas algumas dessas estruturas podem ser perdidas durante o isolamento do cérebro. Ele também fornece tecidos de controle em secção, por exemplo, os músculos da tromba, para determinar se a expressão da proteína de interesse é específica para certos tipos de células ou tipos de tecidos22. Isso permite a comparação direta entre os tecidos, em vez de usar seções separadas que podem ser afetadas por pequenas diferenças nas condições. Outro ponto forte deste protocolo e do uso de Drosophila como sistema modelo é que as cabeças das moscas são muito pequenas19,20, portanto, imagens fluorescentes de conteúdo relativamente alto podem ser feitas. Conseguimos colocar mais de 50 cabeças em um único bloco. Com 8 seções que podem ser colocadas em um slide de tamanho padrão da indústria, 1 slide pode conter 8 seções exclusivas por mosca para um total de 400 seções exclusivas. É importante ressaltar que todas as seções são submetidas às mesmas condições experimentais e pontos de tempo para alcançar grande integridade na comparação entre os grupos. Além disso, este protocolo requer apenas o uso de um microscópio fluorescente padrão em vez de um microscópio confocal, o que pode ser proibitivo para laboratórios ou instituições que carecem de alto apoio financeiro e permitem o acesso a essas imagens de forma mais ampla.
Uma limitação importante desse protocolo, que é inerente à imunocoloração, é a importância do uso de anticorpos de alta qualidade e controles apropriados ao otimizar os anticorpos. É fundamental verificar se os anticorpos são seletivos e sensíveis à proteína de interesse, pois muitas vezes há coloração fora do alvo que pode levar a desafios para determinar se o sinal fluorescente é real. Para fazer isso, teste os anticorpos primários e secundários. Felizmente, é simples fazer isso por causa das ferramentas genéticas facilmente disponíveis em Drosophila. Para verificar a qualidade do anticorpo primário, recomendamos completar o protocolo com moscas do tipo selvagem e moscas experimentais ao lado de moscas de controle positivo que superexpressam a proteína de interesse e moscas de controle negativo que têm o gene nocauteado ou derrubado. Esses grupos de controle estabelecerão a faixa de níveis de expressão e fluorescência esperada, servindo como pontos de referência para avaliar onde as moscas experimentais se enquadram nesse espectro. É fundamental testar várias diluições do anticorpo primário, pois muito pouco levará a uma coloração de baixa qualidade que não leva à fluorescência acima do fundo onde a proteína está presente, enquanto muito anticorpo levará a uma coloração fora do alvo onde a proteína está ausente. Esta abordagem de diluição múltipla deve incluir um grupo sem anticorpo primário, que verificará a qualidade do anticorpo secundário, uma vez que só haverá fluorescência neste grupo se houver fluorescência de fundo e forneça um grupo de controlo negativo adicional que mostre os limites da deteção por fluorescência pelo anticorpo secundário. Se necessário, use diferentes condições de incubação, ou seja, tempo ou temperatura, para maximizar a relação sinal-ruído em suas imagens finais. Reiteramos que anticorpos de alta qualidade, juntamente com tecidos de alta qualidade, são essenciais para imagens imunofluorescentes de alta qualidade.
Ao todo, a imagem imunofluorescente é uma ferramenta poderosa para estudar a biologia de forma mais ampla e a neurociência mais especificamente. Isso, combinado com as poderosas ferramentas genéticas disponíveis na Drosophila, tem o potencial de descobrir conhecimentos importantes sobre como as proteínas afetam a saúde e a doença. O cérebro da mosca tem sido comprovadamente importante para descobrir como o cérebro humano funciona e continuará a fazê-lo. Devido à adaptabilidade do protocolo, descrevemos aqui, o papel de quase qualquer proteína (ou lipídio) na cabeça pode ser estudado no contexto de qualquer doença ou condição, limitado apenas pela qualidade dos anticorpos. Assim, a imagem imunofluorescente provavelmente será crítica para pesquisas futuras sobre como o cérebro funciona e terá um impacto significativo na saúde humana e no desenvolvimento terapêutico.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Agradecemos aos membros do laboratório Melkani por sua ajuda com feedback valioso para o desenvolvimento do protocolo. Os estoques de moscas, Elav-Gal4 (BL # 458) e UAS-ApoE4 (BL # 76607) foram obtidos do Bloomington Drosophila Stock Center (Bloomington, IN, EUA). Este trabalho foi apoiado por bolsas do National Institutes of Health (NIH) AG065992 e RF1NS133378 ao GCM. Este trabalho também é apoiado pelos fundos UAB Startup 3123226 e 3123227 para a GCM
Materiais
| Name | Company | Catalog Number | Comments |
| 1000 uL Pipette | Eppendorf | 3123000063 | |
| 1000 uL Pipette Tips | Olympus Plastics | 23-165R | |
| 10X Phosphate Buffered Saline (PBS) | Fisher | J62036.K7 | ph=7.4 |
| 200 Proof Ethanol | Decon Laboratories | 64-17-5 | |
| 20X Tris Buffered Saline | Thermo Scientific | J60877.K2 | pH=7.4 |
| AF750 Goat Anti-Mouse Secondary Antibody | Alexa Fluor | A21037 | |
| Anti-Roll Glass | IMEB | AR-14047742497 | |
| ApoE Mouse Primary Antibody | Santa Cruz | SC13521 | |
| Bovine Serum Albumin | Fisher | 9048-46-8 | |
| Centrifuge Tubes 1.5 mL | Fisher | 05-408-129 | |
| Charged Slides | Globe Scientific | 1415-15 | |
| Cryosectioning Molds | Fisher | 2363553 | |
| Cryostat | Leica | CM 3050 S | |
| Cryostat Blades | C.L. Sturkey | DT554N50 | |
| Distilled Water | |||
| Dry Ice | ??? | ??? | |
| Fine Forceps | Fine Science Tools | 11254-20 | |
| Fly Pad | Tritech Research | MINJ-DROS-FP | |
| Hardening mounting Media with Dapi | Vectashield | H-1800 | |
| Kimwipes | Kimtech | 34120 | |
| Microscope | Olympus | SZ61 | |
| Nile Red | Sigma | N3013 | |
| Optimal Cutting Temperature Compound | Fisher | 4585 | |
| Orbital Shaker | OHAUS | SHLD0415DG | |
| Paraformaldehyde 20% | Electron Microscopy Sciences | 15713 | |
| Razor Blades | Gravey | #40475 | |
| Spring Scissors | Fine Science Tools | 15000-10 | |
| Sucrose | Fisher | S5-500 |
Referências
- Fabbri-Destro, M., Rizzolatti, G. Mirror neurons and mirror systems in monkeys and humans. Physiology. 23, 171-179 (2008).
- Faust, T. E., Gunner, G., Schafer, D. P. Mechanisms governing activity-dependent synaptic pruning in the developing mammalian CNS. Nat Rev Neurosci. 22, 657-673 (2021).
- Roozendaal, B., McEwen, B. S., Chattarji, S. Stress, memory and the amygdala. Nat Rev Neurosci. 10, 423-433 (2009).
- Arber, S., Costa, R. M. Networking brainstem and basal ganglia circuits for movement. Nat Rev Neurosci. 23, 342-360 (2022).
- GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 7, e105-e125 (2022).
- Huang, Y., Li, Y., Pan, H., Han, L. Global, regional, and national burden of neurological disorders in 204 countries and territories worldwide. J Glob Health. 13, 04160 (2023).
- Crick, F. Central dogma of molecular biology. Nature. 227, 561-563 (1970).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9, 235-244 (2016).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the Fly: A primer on the Drosophila model system. Genetics. 201, 815-842 (2015).
- Larkin, A., et al. FlyBase: updates to the Drosophila melanogaster knowledge base. Nucleic Acids Res. 49, D899-D907 (2021).
- Jeibmann, A., Paulus, W. Drosophila melanogaster as a model organism of brain diseases. Int J Mol Sci. 10, 407-440 (2009).
- Winding, M., et al. The connectome of an insect brain. Science. 379, eadd9330 (2023).
- Bargiello, T. A., Jackson, F. R., Young, M. W. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature. 312, 752-754 (1984).
- Zehring, W. A., et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell. 39, 369-376 (1984).
- Huang, R. C. The discoveries of molecular mechanisms for the circadian rhythm: The 2017 Nobel Prize in Physiology or Medicine. Biomed J. 41, 5-8 (2018).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 4, 429-434 (2012).
- Ong, S. E., Foster, L. J., Mann, M. Mass spectrometric-based approaches in quantitative proteomics. Methods. 29, 124-130 (2003).
- Behnke, J. A., Ye, C., Moberg, K. H., Zheng, J. Q. A protocol to detect neurodegeneration in Drosophila melanogaster whole-brain mounts using advanced microscopy. STAR Protoc. 2, 100689 (2021).
- Moraes, R. C. M., et al. Apolipoprotein E induces lipid accumulation through Dgat2 that is prevented with time-restricted feeding in Drosophila. Genes. 15 (11), 1376 (2024).
- Roth, J. R., et al. Rapamycin reduces neuronal mutant huntingtin aggregation and ameliorates locomotor performance in Drosophila. Front Aging Neurosci. 15, 1223911 (2023).
- Currier, T. A., Pang, M. M., Clandinin, T. R. Visual processing in the fly, from photoreceptors to behavior. Genetics. 224, (2023).
- McKellar, C. E., Siwanowicz, I., Dickson, B. J., Simpson, J. H. Controlling motor neurons of every muscle for fly proboscis reaching. Elife. 9, (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados