Method Article
향상된 뇌 형광 염색 및 면역 염색을 위한 초파리 머리의 직접 동결 절편
요약
이 연구는 참수, 고정, 동결 절제, 형광 염색, 면역 염색 및 이미징을 포함하는 조직 처리를 위한 단순화된 프로토콜을 제시하며, 이는 공초점 및 다광자 이미징으로 확장될 수 있습니다. 이 방법은 복잡한 해부에 필적하는 효능을 유지하며 고급 운동 기술의 필요성을 우회합니다. 정량적 이미지 분석은 광범위한 조사 잠재력을 제공합니다.
초록
초파리 멜라노가스터 뇌의 면역 염색은 복잡한 행동, 신경 회로 및 단백질 발현 패턴의 메커니즘을 탐구하는 데 필수적입니다. 전통적인 방법은 종종 복잡한 해부 수행, 조직 무결성 유지, 고해상도 이미징 중 특정 발현 패턴 시각화와 같은 문제를 수반합니다. 당사는 동결 절편과 형광 염색 및 면역 염색을 결합한 최적화된 프로토콜을 제시합니다. 이 방법은 조직 보존 및 신호 선명도를 개선하고 초파리 뇌 이미징을 위한 힘든 해부의 필요성을 줄여줍니다. 이 방법은 신속한 해부, 최적의 고정, 동결 보호 및 동결 절편을 수반한 후 형광 염색 및 면역 염색을 수반합니다. 이 프로토콜은 조직 손상을 크게 줄이고 항체 침투를 강화하며 선명하고 잘 정의된 이미지를 생성합니다. 우리는 특정 신경 집단과 시냅스 단백질을 높은 충실도로 시각화하여 이 접근 방식의 효과를 입증합니다. 이 다재다능한 방법을 사용하면 여러 z-평면에 걸쳐 성인 뇌의 다양한 단백질 마커를 분석할 수 있으며 다른 조직 및 모델 유기체에 적용할 수 있습니다. 이 프로토콜은 초파리 신경생물학 연구에서 고품질 면역조직화학을 수행하는 연구자에게 신뢰할 수 있고 효율적인 도구를 제공합니다. 이 방법의 상세한 시각화는 신경 해부학, 병리학 및 단백질 국소화에 대한 포괄적인 분석을 용이하게 하여 신경 과학 연구에 특히 유용합니다.
서문
사회적 상호작용1, 감각 지각 및 처리2, 학습3, 움직임4에 이르는 복잡한 행동은 뇌에 의해 주도된다. 신경 장애도 점점 더 흔해지고 있으며 시간이 지남에 따라 증가할 것으로 예측됩니다 5,6. 뇌가 건강과 질병 모두에서 어떻게 작용하는지 연구하는 것은 매우 중요합니다. 분자생물학의 중심 교리에 따르면, 생물학적 단위의 가장 중요한 기능 중 하나는 단백질7이며, 단백질이 얼마나 많이 발현되는지, 그리고 어디서 발현되는지는 뇌가 어떻게 작동하는지를 이해하는 데 매우 중요하다.
흔히 초파리(fruit fly)로 알려진 초파리(Drosophila melanogaster)는 노화 및 병태생리학적 조건에서 뇌 기능을 연구하는 데 매우 유용한 모델이다8. 초파리에서 고급 유전 도구를 사용할 수 있게 됨에 따라 연구자들은 거의모든 단백질의 기능을 탐구할 수 있으며9 거의 모든 유전자에 대한 포괄적인 유전자 라이브러리를 쉽게 접근할 수 있습니다10. 짧은 수명과 높은 번식률과 함께 이러한 특징은 초파리를 뇌 연구를 위한 탁월한 모델로 만듭니다11. 이는 파리12의 완전한 뇌 지도를 개발하는 등 중요한 업적을 남겼으며, 일주기 리듬과 분자 시계 13,14,15의 신경 메커니즘을 규명한 공로로 노벨상을 수상하기도 했습니다. 그 결과, 초파리는 강력하고 다재다능한 시스템으로 남아 뇌 기능에 대한 이해를 촉진하고 신경학적 과정에 대한 전례 없는 통찰력을 제공합니다.
면역조직화학(Immunohistochemistry)과 면역형광법(immunofluorescence)은 단백질 in situ 를 연구하기 위한 기초 도구입니다.반정량적 분석만 가능하고 일반적으로 벌크 조직16에서 수행되는 웨스턴 블롯(Western Blott)과 같은 기술 또는 단백질 수준17을 측정하기 위한 질량 분석법과 같은 복잡하고 비용이 많이 드는 기술과 대조적으로, 면역조직화학은 비교적 간단하며 단백질 발현의 정량화와 조직 또는 세포 내 단백질의 국소화를 모두 측정할 수 있습니다. 중요한 것은 형광 면역조직화학을 다중화하여 여러 단백질을 측정하여 특정 세포 유형과 조직을 식별하거나 동일한 조직에서 여러 질문에 답할 수도 있다는 것입니다. 또한 조직 고정을 통해 다양한 실험 조건, 유전자형, 연령 및 일주기 시점을 비교할 수 있습니다. 그러나 형광 면역조직화학은 까다로울 수 있으며 많은 요인이 이미지 품질에 영향을 미칠 수 있습니다. 초파리 뇌를 위한 이 최적화된 동결 절제 및 면역 염색 프로토콜은 조직 보존, 항체 침투, 신경 집단 및 단백질 마커의 시각화를 개선하여 고해상도 이미징을 향상시키는 것을 목표로 합니다. 복잡한 해부, 조직 손상 및 전뇌 마운트와 관련된 제한된 이미징 해상도와 같은 기존 방법의 문제를 해결하기 위해 개발되었습니다18. 이 프로토콜은 동결 절편과 형광 염색을 결합하여 여러 z-평면에서 구조적 무결성과 선명한 이미징을 보장합니다. 전체 마운트 제제와 비교하여 이 방법은 뒤틀림을 최소화하고 더 깊은 항체 확산을 촉진하며 명확한 신경 해부학적 및 단백질 국소화 분석을 제공합니다18. 그 다양성은 다른 조직 및 모델 유기체에 대한 적응을 가능하게 하여 신경과학 연구를 위한 신뢰할 수 있고 효율적인 도구를 제공합니다19,20. 거의 모든 단백질을 관찰하도록 조정할 수 있으며 모든 상태, 질병 또는 모델을 연구하는 데 적용할 수 있습니다.
프로토콜
1. 장비 준비
- 저온 유지 장치의 전원이 켜져 있고 -20 °C로 설정되어 있는지 확인하십시오. 슬라이드 워머 또는 소형 인큐베이터의 전원을 켜고 37°C로 설정되어 있는지 확인합니다.
참고: 이 단계에서 라벨이 부착된 슬라이드는 워머 또는 인큐베이터에 놓고 절단될 때까지 무기한 방치할 수 있습니다.
2. 용액 준비
- 10x PBS 스톡에서 pH 7.4의 1x 인산염 완충 식염수(PBS) 50mL를 준비합니다. PBS에서 4% 파라포름알데히드 용액을 최종 부피 10mL로 준비합니다.
- 스프레이 병에 70% 에탄올의 물을 섞은 세척액을 준비합니다. 차단 용액(20x 스톡의 Tris-buffered Saline 중 3% 소 혈청 알부민(BSA))을 준비합니다. 1차 항체 용액을 준비합니다(희석은 실험에 따라 다름). 여기에서는 TBS에서 3% BSA에 ApoE 마우스 항체를 1:250 희석하여 사용합니다.
- 2차 항체 용액을 준비합니다(희석은 실험에 따라 다름). 여기에서는 TBS에서 3% BSA에 Alexa Flour 750 A21037 Goat Anti-Mouse Secondary를 1:500 희석하여 사용합니다.
- 형광 염색 용액을 준비합니다(희석은 실험에 따라 다름). 여기서, PBS의 나일 레드의 5 μg/mL 용액이 준비됩니다.
알림: 모든 용액, 특히 형광등은 냉장 보관해야 하며 어두운 냉장 용기에 보관해야 합니다. 또한 사용 직전에 실온으로 가져와야 합니다.
3. 조직의 채취
- 노화된 바이알에 파리를 넣은 후 CO2 매트의 밸브를 열고 파리를 매트에 재빨리 버려 탈출하지 않도록 합니다. 파리가 대부분 의식을 잃고 대부분의 움직임을 멈출 때까지 기다립니다. 대물 렌즈 아래의 매트를 이동하여 SZ61 현미경 아래로 이동합니다. 파리가 명확하게 보이고 편안하게 참수할 수 있도록 배율과 초점을 조정합니다.
참고: 이 예제에 사용된 파리는 ELAV/+ 및 ELAV>ApoE4입니다. - 흉부와 머리 사이에 스프링 가위를 삽입하고 단단히 짜서 실험군당 5-10개의 파리 머리를 참수합니다. 사용하지 않은 파리는 노화된 바이알에 다시 넣습니다.
참고: 고정제의 침투에 대한 우려가 있는 경우 4.1단계에서 고정제의 침투를 증가시킬 수 있도록 머리 뒤쪽을 약간 절개할 수 있습니다. - 브러시를 사용하여 ELAV/+ 및 ELAV>ApoE4 그룹이 수집될 때까지 얼음 위에 표시된 1.5mL 튜브에 헤드를 부드럽게 넣습니다.
4. 전체적인 조직의 정착
- 얼음에서 튜브를 제거하고 PBS 용액에 100μL의 4% 파라포름알데히드를 피펫으로 넣어 모든 헤드가 용액에 잠기도록 합니다. 헤드가 튜브 벽에 부착되어 용액과의 접촉을 피하는 경우 브러시를 사용하여 부드럽게 아래로 밀거나 수평면을 가볍게 두드려 적절한 접촉을 확인하십시오.
- 중간 설정을 사용하여 오비탈 셰이커에 15분 동안 놓습니다. 15분 후 파라포름알데히드 용액을 버리고 10분 동안 1x PBS로 교체하여 모든 헤드가 용액에 잠기도록 합니다.
- 매번 이전 용액을 버리고 PBS로 조직을 2회 각각 10분씩 총 3회 세척합니다.
- 최종 세척 후 헤드를 PBS 용액의 10% 자당으로 옮겨 헤드가 튜브 내에 잠기도록 합니다. 최적의 채도를 위해 밤새 그대로 두십시오.
참고: 당일 이미징을 원하는 경우 자당 주입을 줄일 수 있습니다. 그러나 동결 보호 효과도 비례적으로 감소합니다.
5. 금형 준비
- 라벨이 부착된 금형에 최적 절삭 온도(OCT) 화합물을 약 50% 채워 금형의 4개 모서리 전체로 퍼질 수 있도록 합니다.
- 브러시를 사용하여 금형 내의 OCT 표면에 헤드를 조심스럽게 놓습니다. 여러 실험 그룹을 동일한 금형에 배치할 때 혼동을 방지하기 위해 이러한 그룹이 금형 내에서 분리되어 있는지 확인하십시오.
알림: 브러시를 통한 이전 자당 용액과의 오염으로 인해 OCT 화합물이 희석되는 것을 방지하는 것이 중요합니다. 또한 브러시를 사용하여 OCT 깊숙이 배치하면 머리 주위에 많은 거품이 생길 수 있습니다. 나중에 단면 문제를 방지하기 위해 이러한 실수를 피하십시오. - 집게 끝을 사용하여 눈이 바닥을 향하도록 각 머리를 금형 바닥으로 천천히 밀어 넣습니다. 이 방향은 코로나 평면을 통과하는 절단에 대해 선택됩니다.
- 이 과정에서 금형 바닥에 헤드에 구멍을 내거나 부수지 마십시오. X, Y 및 Z 치수의 모든 헤드를 정렬하여 각 섹션에 모든 주제가 동시에 포함되도록 합니다. 기포 형성을 줄이기 위해 천천히 잠수하십시오.
- 모든 헤드가 제대로 정렬되면 금형을 -20°C에 직접 조심스럽게 배치하여 동결합니다.
알림: 절단 중에 헤드 정렬이 크게 벗어난 것으로 확인되면 금형의 초기 급속 동결을 위해 드라이 아이스 또는 액체 질소를 사용하는 것이 좋습니다. - 금형이 대부분 얼면 나머지 부분을 OCT로 채우고 동결시킨 후 -80 °C에서 장기간 보관합니다.
6. 금형의 냉동 절편
참고: 일반적으로 실험 그룹 주형을 절단하기 전에 빈 주형을 준비하고 절단하는 것이 좋습니다. 이를 통해 조직을 절단하기 직전에 휠, 블레이드 및 안티롤 유리의 적절한 기능을 보장할 수 있습니다.
- 금형에 OCT를 넉넉히 바르고 비트를 위에 놓고 평평하게 눌러 척 비트를 금형에 부착합니다. 이것을 저온 유지 장치에서 일반적으로 5분 이내에 완전히 얼리도록 합니다.
- 금형에서 비트와 OCT 블록을 분리하고 척에 넣어 금형이 위에서 아래로 올바른 방향을 유지하도록 합니다. 비트가 고정될 때까지 척 키를 조입니다.
- 조정 손잡이와 척 깊이 컨트롤을 사용하여 블록을 블레이드에 맞춥니다.
- 단면 폭을 20μm로 설정합니다. 느리지만 일관된 동작으로 각 슬라이스를 자르면 안티롤 유리가 각 슬라이스를 캡처할 수 있습니다. 예열된 슬라이드를 사용하여 슬라이드를 섹션의 더 가까운 가장자리로 터치하고 섹션이 슬라이드 위로 올라갈 수 있도록 하여 섹션을 캡처합니다. 적절한 간격을 두면 표준 크기 슬라이드(25mm x 75mm x 1mm)에 최대 8개의 섹션을 맞출 수 있습니다.
참고: 수집할 섹션을 선택할 때 선택해야 할 사항이 있습니다. 임베딩 방향의 결과로, 이전 섹션은 앞쪽에서, 나중 섹션은 머리의 뒤쪽 부분에서 오게 됩니다. 따라서 한 특정 영역이 다른 영역보다 더 관심이 있는 경우 그에 따라 섹션 선택을 조정할 수 있습니다. 또는 조직이 남지 않을 때까지 모든 절편을 여러 슬라이드에 수집할 수 있습니다. - 슬라이드를 실온에서 최소 30분에서 1시간 이상 건조시키지 마십시오.
7. 염색 및 IHC
참고: 이 프로토콜의 경우 이 방법은 접합되지 않은 1차 항체를 사용하여 IHC를 자세히 설명합니다. 형광색소 접합 항체 또는 단일 단계에서 수행할 수 있는 기타 형광 염색은 둘 다 함께 사용하는 경우 2차 항체와 함께 사용해야 합니다.
- 건조 기간 직후 면도날을 사용하여 슬라이드 가장자리의 OCT를 제거하고 소수성 테두리를 위한 공간을 남겨둡니다. 마커를 사용하여 각 슬라이드에 소수성 테두리를 그립니다. 5분 동안 건조시킵니다.
- 모든 슬라이드를 PBS로 각각 5분씩 3회 세척하여 슬라이드 위에서 부드럽게 피펫팅하고 가능한 경우 티슈 위에 직접 피펫팅하는 것을 피하십시오.
참고: 1000 μL 피펫이 여기에서 가장 유용합니다. 조직이 있는 표준 크기의 슬라이드는 750μL의 용액으로 완전히 덮어야 합니다. 슬라이드 랙과 버킷도 사용할 수 있습니다. - 슬라이드를 세척한 후 TBS 차단 용액에 3% BSA를 슬라이드에 피펫으로 분사합니다. 30분 동안 배양합니다.
- 차단 용액을 버리고 1차 항체 용액을 슬라이드에 피펫팅합니다. 이 경우, TBS에서 3% BSA에 SC-13521 ApoE를 1:250 희석합니다. 항체가 4°C에서 하룻밤 동안 또는 실온에서 1시간 동안 배양되도록 합니다. 물티슈나 종이 타월을 사용하여 용액이 밤새 마르지 않도록 합니다.
- 1차 항체를 버리고 피펫을 이용하여 PBS로 5분씩 3회 세척합니다.
- 2차 항체 용액을 추가합니다. 이 경우, TBS의 3% BSA에 5μg/mL 농도의 나일 레드와 함께 AF 750 Goat Anti-Mouse를 1:500 희석합니다. 실온에서 1시간 동안 배양합니다.
참고: 우리는 형광 염색제와 2차 항체를 동일한 완충액인 TBS의 3% BSA에 동시에 배양합니다. 이는 두 시약 사이에 알려진 충돌이 없는 한 선호됩니다. 충돌이 있는 경우 별도로 배양하고 배양 사이에 추가로 3회 세척을 수행합니다. - PBS로 슬라이드를 각각 5분씩 3회 세척합니다. 최종 세척 후 슬라이드에 소량의 PBS를 남겨 두십시오.
8. 이미징을 위한 장착 및 준비
- 1000μL 피펫을 사용하여 DAPI(0.9μg/ml)가 포함된 경화 장착 매체 3-5방울을 조직에 직접 떨어지지 않도록 슬라이드 전체에 고르게 추가합니다.
- 기포 형성을 피하면서 슬라이드에 커버슬립을 놓습니다.
알림: 집게를 사용하면 커버슬립이 최종적으로 해제되기 전에 슬라이드 표면 가까이로 미끄러지도록 하여 이를 도울 수 있습니다. - 새로 장착된 슬라이드는 조심스럽게 다루고 완전히 마를 때까지 평평하게 보관하십시오. 장기 보관이 예상되는 경우 매니큐어를 사용하여 슬라이드를 밀봉하십시오.
- 형광 감쇠를 방지하기 위해 가능한 한 빨리 이미지를 캡처하십시오.
9. 이미지 획득
참고: 이미지 캡처의 경우 Olympus Cell Sense Dimensions 소프트웨어의 사용에 대해 자세히 설명합니다.
- 이미징하기 전에 슬라이드를 검사하고 수용액에 70% 에탄올을 사용하여 닦습니다. 장착 직후 슬라이드를 이미지화하는 경우 커버슬립을 방해하지 않도록 청소할 때 각별히 주의하십시오. 이미징하기 전에 슬라이드와 커버슬립의 표면을 5분 동안 건조시킵니다.
- 캡처를 위해 원하는 각 채널(이 경우 DAPI, Nile Red 및 AF 750용 채널)을 선택합니다.
- 아래 설명된 대로 원하는 배율을 선택합니다. 배율 선택은 실험에 따라 다릅니다. 여기서는 10배 확대를 사용합니다.
참고: 유성 렌즈를 포함한 모든 배율을 사용할 수 있습니다. 원하는 경우 슬라이드 표면에 이멀젼 오일을 바릅니다. - 각 채널에 대해 실험에서 가장 밝은 형광 피사체를 기준으로 적절한 노출 시간을 보정합니다. 가능한 한 밝은 이미지를 생성하면서 과다 노출을 피하십시오.
참고: 일반적으로 프로세스 캡처 불량의 두 가지 주요 결정 요인은 과다 노출로 인한 정의의 손실과 실제 신호와 분리하기 어려운 너무 많은 백그라운드 신호입니다. 또한 사용된 각 고유 배율에 대해 노출을 독립적으로 설정해야 합니다. - 저장할 폴더를 선택하고 메뉴 내에서 병합된 이미지의 이름을 지정합니다. 캡처 후 모든 이미지는 이 폴더에 있으며 여기에 정의된 이름을 갖습니다.
- 먼저 최상의 초점을 허용하는 채널의 피사체에 초점을 맞춰 이미지를 캡처한 다음 수집을 시작합니다. 실험 전반에 걸쳐 일관성을 유지하기 위해 동일한 채널에서 각 피험자에 초점을 맞추는 절차를 유지합니다.
- 비교 그룹 간의 형광 감소를 방지하기 위해 같은 날 이후 비교에 사용된 모든 실험 그룹을 캡처합니다.
- 아래 설명된 대로 원하는 배율을 선택합니다. 배율 선택은 실험에 따라 다릅니다. 여기서는 10배 확대를 사용합니다.
10. 정량화
참고: 정량화는 다양한 소프트웨어를 사용하여 수행할 수 있습니다. 여기서는 Olympus CellSense Dimensions의 사용을 참조합니다.
- 컬렉션에 따라 이미지를 검토합니다. 결함 또는 단면 아티팩트가 있는 단면을 quantification 폴더에서 제거합니다. 정량화의 목표를 반영하는 이미지를 선택합니다. 결함의 예로는 기포, 찢어진 부분, 겹치는 조직, 먼지 또는 파편이 있습니다.
- 적절한 이미지를 선택하려면 뇌 조직을 특징으로 하는 모든 이미지가 뇌 전체의 전반적인 발현을 반영하기 위한 정량화에 사용되어야 합니다. 또는 앞뇌, 뇌 중간 또는 뒷뇌를 반영하는 이미지만 사용하여 이러한 영역의 표현 차이에 대한 통찰력을 얻을 수 있습니다.
- Count 및 Measure 메뉴 내에서 관심 있는 매개변수와 이미지 정량화를 위한 경계를 결정합니다.
- 평균 강도 값 비교를 통한 ApoE 표현의 정량화를 위해 해당 채널의 모든 픽셀이 고려되도록 임계값을 선택합니다(0-무한대). 또한 사용 가능한 그리기 도구를 사용하여 관심 영역을 간략하게 설명합니다.
- 카운트를 실행하고 모든 파일에 대해 배치로 또는 각 이미지에 대해 개별적으로 측정합니다.
- 일괄 처리의 경우 정량화의 설정 및 실행을 기록한 다음 정량화를 수행할 폴더를 선택합니다. 일괄 처리는 매크로 관리자 탭을 통해 액세스할 수 있으며 워크플로우를 크게 가속화합니다.
- 플로팅을 위해 데이터 테이블을 스프레드시트로 내보냅니다. 이렇게 하려면 Count and Measure results 메뉴를 사용하여 배치를 수행할 때 자동으로 테이블을 열거나 테이블로 내보냅니다. 이러한 데이터 테이블에는 10.2단계에서 선택한 모든 매개변수가 포함됩니다.
- 통계 분석 및 플로팅을 위해 스프레드시트를 직접 사용하거나 다른 소프트웨어를 통해 데이터를 플롯합니다. 선택한 소프트웨어에 대한 친숙도는 실험 결과를 정확하게 표현하는 데 중요합니다. 여기서, 돌연변이의 뇌에서 ApoE 발현의 절대 강도 값을 대조군으로 정규화한 다음 GraphPad Prism을 사용하여 표시했습니다.
결과
위에서 설명한 방법을 사용하면 성체 파리 뇌의 형광 이미징을 지루한 해부 없이 안정적으로 수행할 수 있습니다. 그림 1에서 간단히 볼 수 있듯이 이 방법은 간단하며 모든 시편, 장비 및 재료를 쉽게 구할 수 있는 경우 신속하게 수행할 수 있습니다. 또는 OCT 금형 단계에서 -80°C 보관을 사용하면 몇 주 후에 사용할 수 있도록 시편을 보관할 수 있습니다. 연구자들은 간단한 해부 및 임베딩 기술을 배우기 위해 오랜 시간 훈련을 받을 필요가 없으므로 이 방법을 쉽게 이용할 수 있습니다.
이 방법을 사용하여 수행된 형광 현미경 검사의 예는 그림 2A-D에서 볼 수 있습니다. 항체 태그(ApoE)와 형광 염색(Nile Red)의 발현은 잘 정의되어 있습니다. 또한 뇌 조직의 높은 무결성도 볼 수 있습니다. 디콘볼루션(deconvolution)과 같은 일반적인 이미지 처리 소프트웨어 기능을 사용하여 이미지를 더욱 선명하게 할 수 있으며, 이는 패널 그림 2A'-D'에도 나와 있습니다. 디콘볼루션은 선명도와 대비를 개선하고 노이즈를 줄이는 데 유용합니다.
이미지의 정량화와 관련하여 모든 이미지는 물체 수, 평균 물체 면적, 강도 및 면적 분율과 같은 표준 매개변수에 대해 정량화할 수 있습니다. 정량화의 한계는 실제로 선택한 소프트웨어에 따라 다르지만 일반적으로 위에 나열된 매개변수는 적절한 조사를 허용하고 대부분의 응용 프로그램에서 사용할 수 있습니다. 그림 3 은 여러 이미지의 뇌 영역 내의 평균 강도 값에서 생성된 히스토그램을 보여줍니다. 이것은 주어진 유전자형의 평균 뇌 강도를 시각화하는 역할을 합니다. 이 경우 ELAV/+ 및 ELAV>ApoE4.
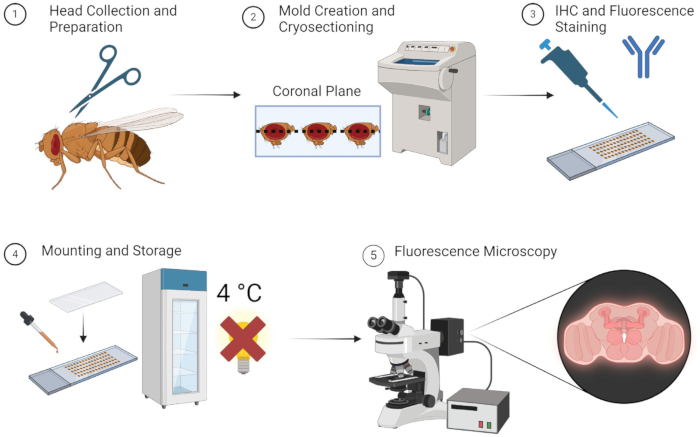
그림 1: Drosophila 뇌 절편 및 이미징을 위한 워크플로우. 1. 초파리 머리는 가는 가위를 사용하여 참수하여 수집합니다. 2. 고정 후, 수집된 헤드는 금형에 OCT를 삽입하고 동결 절편을 하여 얇은 뇌 절편을 얻습니다. 3. 뇌 절편은 1차 항체 또는 형광 염색으로 면역조직화학(IHC) 염색을 받습니다. 4. 얼룩이 지기 후에, 단면도는 덮개 미끄러짐으로 거치되고 형광 완전성을 유지하기 위하여 암흑 속에 4개의 °C에 저장됩니다. 5. 표적 단백질 또는 세포 구조를 연구하기 위해 형광 현미경을 사용하여 뇌 부분을 시각화합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 동결 해부 헤드의 면역조직화학 및 형광 염색. (A-D) ApoE 발현을 위해 염색된 7주 된 암컷 파리 머리, 지질(Nile Red) 및 DAPI의 대표 이미지. 이 이미지는 인간 ApoE4(Elav>ApoE4)의 발현을 보여주며, 대조군 파리인 Elav/+에는 이 ApoE 발현이 없습니다. 나일 레드(Elav>ApoE4 및 Elav/+)를 사용한 지질 염색. 이 방법을 사용한 뇌 조직의 무결성은 여기에서도 입증되었습니다. (A'-D') 이는 디콘볼루션 이후의 A, B, C 및 D를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: ApoE의 상대적 정량화. 7주 된 초파리 뇌에서 ApoE 단백질 발현에 대한 정량화 결과를 보여줍니다. Elav/+ 및 Elav>ApoE4 돌연변이 피험자 모두에 대해 강도의 절대값을 수집한 다음 Elav/+로 정규화했습니다. Elav>ApoE4와 Elav/+ 사이의 통계적 유의성은 분명합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서는 동결 절제된 초파리 머리의 정밀한 형광 이미징을 위한 프로토콜을 제시합니다. 이것은 몇 가지 중요한 장점이 있는 간단한 접근 방식입니다. 즉, 이 방법은 기본적인 실험실 안전 교육을 받은 사람이라면 누구나 이수할 수 있을 만큼 간단하고, 고품질 항체가 존재하는 모든 단백질의 발현을 측정할 수 있으며, 관심 단백질이 얼마나 많이 발현되는지와 머리 전체에서 해당 발현이 발생하는 위치를 정확하게 측정할 수 있습니다. 조직과 이미지 품질이 충분히 높으면 전체 초파리 머리에 걸쳐 발현을 3D 매핑할 수 있습니다.
컨포칼 현미경 검사와 결합된 이미징을 위해 뇌를 분리하는 기술적으로 어려운 접근 방식과 달리, 이 프로토콜은 뇌뿐만 아니라 초파리 머리 전체에 걸쳐 이미징을 가능하게 합니다. 이것은 파리 시각 시스템이 뉴런 기능의 중요한 모델이라는 점을 감안할 때특히 중요합니다 21 이러한 구조 중 일부는 뇌가 격리되는 동안 손실될 수 있습니다. 또한, 관심있는 단백질의 발현이 특정 세포 유형 또는 조직 유형에 특이적인지 여부를 결정하기 위해 예를 들어, 주둥이의 근육과 같은 단면 제어 조직을 제공한다22. 이를 통해 조건의 약간의 차이에 의해 영향을 받을 수 있는 별도의 섹션을 사용하는 대신 조직을 직접 비교할 수 있습니다. 이 프로토콜과 초파리를 모델 시스템으로 사용하는 또 다른 강점은 플라이 헤드가 매우 작기 때문에19,20 상대적으로 높은 함량의 형광 이미징을 수행할 수 있다는 것입니다. 우리는 한 블록에 50개 이상의 머리를 넣을 수 있었습니다. 업계 표준 크기의 슬라이드에 8개의 섹션을 배치할 수 있는 경우 1개의 슬라이드에는 플라이당 8개의 고유한 섹션이 포함되어 총 400개의 고유한 섹션이 포함될 수 있습니다. 중요한 것은 모든 섹션이 그룹 간에 비교할 때 뛰어난 무결성을 달성하기 위해 동일한 실험 조건과 시간 지점을 적용받는다는 것입니다. 또한 이 프로토콜은 컨포칼 현미경이 아닌 표준 형광 현미경만 사용하면 되므로 높은 재정 지원이 부족하고 이 이미징에 보다 광범위하게 액세스할 수 있는 실험실 또는 기관에는 비용이 많이 들 수 있습니다.
면역염색에 내재된 이 프로토콜의 주요 제한 사항 중 하나는 항체를 최적화할 때 고품질 항체와 적절한 대조군을 사용하는 것이 중요하다는 것입니다. 항체가 선택적이고 관심 단백질에 민감한지 확인하는 것이 중요한데, 형광 신호가 진짜인지 판단하는 데 어려움을 초래할 수 있는 off-target 염색이 있는 경우가 많기 때문입니다. 이를 위해서는 1차 항체와 2차 항체를 모두 검사해야 합니다. 다행히도, 초파리에서 쉽게 구할 수 있는 유전 도구 때문에 이 작업을 수행하는 것은 간단합니다. 1차 항체의 품질을 검증하기 위해 야생형 파리 및 실험용 파리와 관심 단백질을 과발현하는 양성 대조군 파리 및 유전자가 knock out 또는 knock down된 음성 대조군 파리와 함께 프로토콜을 완료하는 것이 좋습니다. 이러한 대조군은 발현 수준과 예상 형광의 범위를 설정하여 실험용 파리가 해당 스펙트럼 내에서 어디에 속하는지 평가하기 위한 기준점 역할을 합니다. 1차 항체의 여러 희석액을 검사하는 것이 중요한데, 너무 적으면 단백질이 존재하는 배경 위에서 형광이 발생하지 않는 낮은 품질의 염색이 발생하고, 항체가 너무 많으면 단백질이 없는 곳에서 off-target 염색이 발생하기 때문입니다. 이 다중 희석 접근법에는 1차 항체가 없는 그룹이 포함되어야 하며, 배경 형광이 있는 경우에만 이 그룹에 형광이 있고 2차 항체에 의한 형광 검출의 한계를 보여주는 추가 음성 대조군을 제공하기 때문에 2차 항체의 품질을 검증할 수 있습니다. 필요한 경우 다양한 배양 조건(예: 시간 또는 온도)을 사용하여 최종 이미지에서 신호 대 잡음비를 최대화합니다. 우리는 고품질 조직과 함께 고품질 항체가 고품질 면역 형광 이미징에 중요하다는 점을 다시 한 번 강조합니다.
전체적으로 면역형광 이미징은 생물학을 보다 광범위하게 연구하고 신경 과학을 보다 구체적으로 연구할 수 있는 강력한 도구입니다. 이는 초파리 에서 사용할 수 있는 강력한 유전 도구와 결합되어 단백질이 건강과 질병에 미치는 영향에 대한 중요한 지식을 밝힐 수 있는 잠재력을 가지고 있습니다. 파리의 뇌는 인간의 뇌가 어떻게 기능하는지를 발견하는 데 명백히 중요했으며, 앞으로도 계속 그렇게 할 것이다. 여기에서 설명하는 프로토콜의 적응성 때문에 머리에 있는 거의 모든 단백질(또는 지질)의 역할은 모든 질병 또는 상태의 맥락에서 연구할 수 있으며 항체의 품질에 의해서만 제한됩니다. 따라서 면역형광 영상은 뇌가 어떻게 작동하는지에 대한 향후 연구에 매우 중요할 것이며 인간의 건강과 치료 개발에 상당한 영향을 미칠 것입니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
프로토콜 개발에 귀중한 피드백을 제공하는 데 도움을 주신 Melkani 연구실 구성원들에게 감사드립니다. 플라이 스톡인 Elav-Gal4 (BL#458) 및 UAS-ApoE4 (BL#76607)는 Bloomington Drosophila Stock Center (Bloomington, IN, USA)에서 획득하였다. 이 작업은 미국 국립보건원(NIH)의 보조금 AG065992 및 G.C.M에 대한 RF1NS133378의 지원을 받았습니다. 이 작업은 UAB Startup Funds 3123226 및 G.C.M의 3123227에서도 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 1000 uL Pipette | Eppendorf | 3123000063 | |
| 1000 uL Pipette Tips | Olympus Plastics | 23-165R | |
| 10X Phosphate Buffered Saline (PBS) | Fisher | J62036.K7 | ph=7.4 |
| 200 Proof Ethanol | Decon Laboratories | 64-17-5 | |
| 20X Tris Buffered Saline | Thermo Scientific | J60877.K2 | pH=7.4 |
| AF750 Goat Anti-Mouse Secondary Antibody | Alexa Fluor | A21037 | |
| Anti-Roll Glass | IMEB | AR-14047742497 | |
| ApoE Mouse Primary Antibody | Santa Cruz | SC13521 | |
| Bovine Serum Albumin | Fisher | 9048-46-8 | |
| Centrifuge Tubes 1.5 mL | Fisher | 05-408-129 | |
| Charged Slides | Globe Scientific | 1415-15 | |
| Cryosectioning Molds | Fisher | 2363553 | |
| Cryostat | Leica | CM 3050 S | |
| Cryostat Blades | C.L. Sturkey | DT554N50 | |
| Distilled Water | |||
| Dry Ice | ??? | ??? | |
| Fine Forceps | Fine Science Tools | 11254-20 | |
| Fly Pad | Tritech Research | MINJ-DROS-FP | |
| Hardening mounting Media with Dapi | Vectashield | H-1800 | |
| Kimwipes | Kimtech | 34120 | |
| Microscope | Olympus | SZ61 | |
| Nile Red | Sigma | N3013 | |
| Optimal Cutting Temperature Compound | Fisher | 4585 | |
| Orbital Shaker | OHAUS | SHLD0415DG | |
| Paraformaldehyde 20% | Electron Microscopy Sciences | 15713 | |
| Razor Blades | Gravey | #40475 | |
| Spring Scissors | Fine Science Tools | 15000-10 | |
| Sucrose | Fisher | S5-500 |
참고문헌
- Fabbri-Destro, M., Rizzolatti, G. Mirror neurons and mirror systems in monkeys and humans. Physiology. 23, 171-179 (2008).
- Faust, T. E., Gunner, G., Schafer, D. P. Mechanisms governing activity-dependent synaptic pruning in the developing mammalian CNS. Nat Rev Neurosci. 22, 657-673 (2021).
- Roozendaal, B., McEwen, B. S., Chattarji, S. Stress, memory and the amygdala. Nat Rev Neurosci. 10, 423-433 (2009).
- Arber, S., Costa, R. M. Networking brainstem and basal ganglia circuits for movement. Nat Rev Neurosci. 23, 342-360 (2022).
- GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 7, e105-e125 (2022).
- Huang, Y., Li, Y., Pan, H., Han, L. Global, regional, and national burden of neurological disorders in 204 countries and territories worldwide. J Glob Health. 13, 04160 (2023).
- Crick, F. Central dogma of molecular biology. Nature. 227, 561-563 (1970).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9, 235-244 (2016).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the Fly: A primer on the Drosophila model system. Genetics. 201, 815-842 (2015).
- Larkin, A., et al. FlyBase: updates to the Drosophila melanogaster knowledge base. Nucleic Acids Res. 49, D899-D907 (2021).
- Jeibmann, A., Paulus, W. Drosophila melanogaster as a model organism of brain diseases. Int J Mol Sci. 10, 407-440 (2009).
- Winding, M., et al. The connectome of an insect brain. Science. 379, eadd9330 (2023).
- Bargiello, T. A., Jackson, F. R., Young, M. W. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature. 312, 752-754 (1984).
- Zehring, W. A., et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell. 39, 369-376 (1984).
- Huang, R. C. The discoveries of molecular mechanisms for the circadian rhythm: The 2017 Nobel Prize in Physiology or Medicine. Biomed J. 41, 5-8 (2018).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 4, 429-434 (2012).
- Ong, S. E., Foster, L. J., Mann, M. Mass spectrometric-based approaches in quantitative proteomics. Methods. 29, 124-130 (2003).
- Behnke, J. A., Ye, C., Moberg, K. H., Zheng, J. Q. A protocol to detect neurodegeneration in Drosophila melanogaster whole-brain mounts using advanced microscopy. STAR Protoc. 2, 100689 (2021).
- Moraes, R. C. M., et al. Apolipoprotein E induces lipid accumulation through Dgat2 that is prevented with time-restricted feeding in Drosophila. Genes. 15 (11), 1376 (2024).
- Roth, J. R., et al. Rapamycin reduces neuronal mutant huntingtin aggregation and ameliorates locomotor performance in Drosophila. Front Aging Neurosci. 15, 1223911 (2023).
- Currier, T. A., Pang, M. M., Clandinin, T. R. Visual processing in the fly, from photoreceptors to behavior. Genetics. 224, (2023).
- McKellar, C. E., Siwanowicz, I., Dickson, B. J., Simpson, J. H. Controlling motor neurons of every muscle for fly proboscis reaching. Elife. 9, (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유