Method Article
Cryosectionnement direct des têtes de drosophile pour une coloration par fluorescence cérébrale et une immunocoloration améliorées
Dans cet article
Résumé
Cette étude présente un protocole simplifié pour le traitement des tissus impliquant la décapitation, la fixation, la cryosection, la coloration par fluorescence, l’immunocoloration et l’imagerie, qui peut être étendu à l’imagerie confocale et multiphotonique. La méthode maintient une efficacité comparable à celle des dissections complexes, en contournant le besoin de motricité avancée. L’analyse quantitative d’images offre un vaste potentiel d’investigation.
Résumé
L’immunomarquage du cerveau de Drosophila melanogaster est essentiel pour explorer les mécanismes à l’origine de comportements complexes, de circuits neuronaux et de modèles d’expression protéique. Les méthodes traditionnelles comportent souvent des défis tels que la réalisation de dissections complexes, le maintien de l’intégrité des tissus et la visualisation de modèles d’expression spécifiques pendant l’imagerie haute résolution. Nous présentons un protocole optimisé qui combine la cryosectionnement avec la coloration par fluorescence et l’immunomarquage. Cette méthode améliore la préservation des tissus et la clarté du signal et réduit le besoin de dissection laborieuse pour l’imagerie cérébrale de la drosophile. La méthode implique une dissection rapide, une fixation optimale, une cryoprotection et une cryosection, suivies d’une coloration fluorescente et d’une immunocoloration. Le protocole réduit considérablement les lésions tissulaires, améliore la pénétration des anticorps et produit des images nettes et bien définies. Nous démontrons l’efficacité de cette approche en visualisant des populations neuronales spécifiques et des protéines synaptiques avec une grande fidélité. Cette méthode polyvalente permet d’analyser divers marqueurs protéiques dans le cerveau adulte sur plusieurs plans z et peut être adaptée à d’autres tissus et organismes modèles. Le protocole fournit un outil fiable et efficace pour les chercheurs qui mènent des études d’immunohistochimie de haute qualité dans les études de neurobiologie de la drosophile. La visualisation détaillée de cette méthode facilite l’analyse complète de la neuroanatomie, de la pathologie et de la localisation des protéines, ce qui la rend particulièrement précieuse pour la recherche en neurosciences.
Introduction
Les comportements complexes allant des interactions sociales1, de la perception et du traitement sensoriels2, de l’apprentissage3 au mouvement4 sont pilotés par le cerveau. Les troubles neurologiques sont également de plus en plus fréquents et devraient augmenter avec le temps 5,6. Il est essentiel d’étudier le fonctionnement du cerveau dans la santé et la maladie. Le dogme central de la biologie moléculaire suggère que l’une des fonctions les plus importantes des unités biologiques est la protéine7, et que la quantité et l’endroit où elles sont exprimées sont essentiels pour comprendre le fonctionnement du cerveau.
Drosophila melanogaster, communément appelée mouche des fruits, est un modèle très précieux pour l’étude de la fonction cérébrale dans des conditions de vieillissement et de physiopathologie8. La disponibilité d’outils génétiques avancés chez la drosophile permet aux chercheurs d’explorer la fonction de presque toutes les protéines9, avec des bibliothèques génétiques complètes pour presque tous les gènes facilement accessibles10. Associées à sa courte durée de vie et à son taux de reproduction élevé, ces caractéristiques font de la drosophile un modèle exceptionnel pour la recherche sur le cerveau11. Cela a conduit à des réalisations importantes, notamment le développement d’une carte cérébrale complète de la mouche12, et a même contribué à un prix Nobel pour l’élucidation des mécanismes neuronaux des rythmes circadiens et des horloges moléculaires 13,14,15. En conséquence, la drosophile reste un système puissant et polyvalent, faisant progresser notre compréhension du fonctionnement du cerveau et fournissant des informations sans précédent sur les processus neurologiques.
L’immunohistochimie et l’immunofluorescence sont des outils fondamentaux pour étudier l’expression des protéines in situ. Contrairement à des techniques telles que le Western Blot, qui ne permet qu’une analyse semi-quantitative et est généralement effectuée dans le tissu en vrac16, ou des techniques compliquées et coûteuses comme la spectrométrie de masse pour mesurer le niveaude protéine 17, l’immunohistochimie est relativement simple et permet à la fois de quantifier l’expression des protéines et de mesurer la localisation d’une protéine dans un tissu ou une cellule. Il est important de noter que l’immunohistochimie fluorescente peut également être multiplexée pour mesurer plusieurs protéines afin d’identifier des types de cellules et de tissus spécifiques ou de répondre à plusieurs questions dans le même tissu. De plus, la fixation tissulaire peut permettre des comparaisons entre différentes conditions expérimentales, génotypes, âges et points circadiens. Cependant, l’immunohistochimie fluorescente peut être difficile et de nombreux facteurs peuvent influencer la qualité de l’image. Ce protocole optimisé de cryosection et d’immunomarquage pour le cerveau des drosophiles vise à améliorer l’imagerie à haute résolution en améliorant la préservation des tissus, la pénétration des anticorps et la visualisation des populations neuronales et des marqueurs protéiques. Développé pour relever les défis des méthodes traditionnelles, telles que la dissection complexe, les lésions tissulaires et la résolution d’imagerie limitée associée aux montures du cerveau entier18. Ce protocole combine la cryosection avec la coloration par fluorescence pour garantir l’intégrité structurelle et une imagerie nette sur plusieurs plans z. Par rapport aux préparations entières, cette méthode minimise la distorsion, facilite la diffusion plus profonde des anticorps et fournit des analyses neuroanatomiques et de localisation des protéines claires18. Sa polyvalence permet de s’adapter à d’autres tissus et organismes modèles, offrant un outil fiable et efficace pour la recherche en neurosciences19,20. Il peut être adapté pour examiner presque n’importe quelle protéine et appliqué pour étudier n’importe quelle condition, maladie ou modèle.
Protocole
1. Préparation de l’équipement
- Assurez-vous que le cryostat est sous tension et réglé à -20 °C. Allumez le chauffe-lames ou un petit incubateur, en vous assurant qu’il est réglé à 37 °C.
REMARQUE : À ce stade, les lames étiquetées peuvent être placées sur le réchaud ou l’incubateur et laissées indéfiniment jusqu’à la section.
2. Préparation des solutions
- Préparez 50 ml de 1 solution saline tamponnée au phosphate (PBS), pH 7,4, à partir de 10 fois le stock de PBS. Préparer une solution de paraformaldéhyde à 4 % dans du PBS avec un volume final de 10 ml.
- Préparez une solution de nettoyage à 70 % d’éthanol dans de l’eau dans un flacon pulvérisateur. Préparez une solution bloquante (3 % d’albumine sérique bovine (BSA) dans une solution saline tamponnée au Tris à partir de 20 fois le stock). Préparez une solution primaire d’anticorps (la dilution dépend de l’expérience). Ici, une dilution de 1:250 de l’anticorps ApoE de souris dans 3 % de BSA dans le TBS est utilisée.
- Préparez une solution secondaire d’anticorps (la dilution dépend de l’expérience). Ici, une dilution de 1:500 de Alexa Flour 750 A21037 Goat Anti-Mouse Secondary dans 3 % BSA in TBS est utilisée.
- Préparez une solution de coloration fluorescente (la dilution dépend de l’expérience). Ici, une solution de 5 μg/mL de rouge du Nil dans du PBS est préparée.
REMARQUE : Toutes les solutions, en particulier les fluorescentes, doivent être réfrigérées et stockées dans un récipient réfrigéré sombre. Ils doivent également être portés à température ambiante juste avant utilisation.
3. Prélèvement de tissus
- Après avoir obtenu des mouches dans des flacons de vieillissement, ouvrez la valve sur le tapis de CO2 et déversez rapidement les mouches sur le tapis pour éviter de vous échapper. Attendez que les mouches deviennent la plupart du temps inconscientes, cessant la plupart des mouvements. Positionnez les mouches sous le microscope SZ61 en déplaçant le tapis sous l’objectif. Ajustez le grossissement et la mise au point de manière à ce que les mouches soient clairement visibles et confortables à décapiter.
REMARQUE : Les mouches utilisées pour cet exemple sont ELAV/+ et ELAV>ApoE4 - Insérez des ciseaux à ressort entre le thorax et la tête, pressez fermement et décapitez 5 à 10 têtes de mouches par groupe expérimental. Remettez les mouches inutilisées dans leur flacon de vieillissement.
REMARQUE : S’il existe des préoccupations concernant la pénétration du fixateur, une petite incision peut être pratiquée sur la partie postérieure de la tête pour permettre une pénétration accrue de l’agent fixateur à l’étape 4.1. - À l’aide d’un pinceau, placer délicatement les têtes dans des tubes de 1,5 mL étiquetés sur de la glace jusqu’à ce que les groupes ELAV/+ et ELAV>ApoE4 aient été recueillis.
4. Fixation du tissu entier
- Retirer les tubes de la glace et pipeter 100 μL de paraformaldéhyde à 4 % dans une solution de PBS dans chaque tube, en veillant à ce que toutes les têtes soient immergées dans la solution. Si les têtes adhèrent aux parois du tube et évitent tout contact avec la solution, utilisez une brosse pour les pousser doucement vers le bas ou tapotez légèrement contre une surface horizontale pour assurer un contact approprié.
- Placer sur un agitateur orbital à l’aide d’un réglage moyen pendant 15 min. Après 15 min, jetez la solution de paraformaldéhyde et remplacez-la par 1x PBS pendant 10 min, en vous assurant que toutes les têtes sont immergées dans la solution.
- En jetant la solution précédente à chaque fois, lavez le mouchoir avec du PBS 2x pendant 10 min chacun, pour un total de 3 lavages.
- Après le lavage final, transférez les têtes dans une solution de saccharose à 10 %, en vous assurant que les têtes sont immergées dans le tube. Laissez-les toute la nuit pour une saturation optimale.
REMARQUE : Si l’imagerie le jour même est souhaitée, la perfusion de saccharose peut être réduite ; Cependant, les effets cryoprotecteurs seront également réduits proportionnellement.
5. Préparation du moule
- Remplissez un moule étiqueté à environ 50 % avec un composé à température de coupe optimale (OCT), ce qui lui permet de s’étendre aux 4 coins du moule.
- À l’aide d’un pinceau, placez soigneusement les têtes à la surface de l’OCT à l’intérieur du moule. Lorsque vous placez plusieurs groupes expérimentaux dans le même moule, assurez-vous que ces groupes sont séparés à l’intérieur du moule pour éviter toute confusion.
REMARQUE : Il est important d’éviter la dilution du composé OCT par contamination par la solution de saccharose préalable via la brosse. De plus, le placement profond dans l’OCT à l’aide de la brosse peut créer de nombreuses bulles autour des têtes. Évitez ces erreurs pour éviter des problèmes de sectionnement plus tard. - À l’aide de la pointe de la pince, poussez lentement chaque tête vers le fond du moule, les yeux tournés vers le bas. Cette orientation est sélectionnée pour une coupe à travers le plan coronal.
- Évitez de perforer ou d’écraser les têtes contre le fond du moule pendant ce processus. Alignez toutes les têtes dans les dimensions X, Y et Z de sorte que chaque section contienne tous les sujets simultanément. Assurez une immersion lente pour réduire la formation de bulles d’air.
- Une fois que toutes les têtes sont correctement alignées, placez soigneusement les moules directement à -20 °C pour les congeler.
REMARQUE : Si l’alignement des têtes est noté comme étant significativement décalé pendant le sectionnement, envisagez l’utilisation de glace sèche ou d’azote liquide pour la congélation instantanée initiale du moule. - Une fois que le moule est presque gelé, remplissez le reste d’OCT et laissez-le congeler avant de le stocker à long terme à -80 °C.
6. Cryosectionnement des moules
REMARQUE : Il est généralement conseillé de préparer et de découper un moule vierge avant de découper des moules de groupe expérimentaux. Cela permet de s’assurer du bon fonctionnement de la roue, de la lame et du verre anti-roulis immédiatement avant de sectionner les tissus.
- Fixez le mandrin au moule en appliquant une quantité généreuse d’OCT dans le moule et en plaçant le foret sur le dessus, en le pressant à plat. Laissez-le geler complètement dans le cryostat, généralement dans les 5 minutes.
- Libérez le foret et le bloc OCT du moule et placez-le dans le mandrin, en veillant à ce que le moule reste correctement orienté de haut en bas. Serrez la clé du mandrin jusqu’à ce que l’embout soit bien fixé.
- Alignez le bloc avec la lame à l’aide des boutons de réglage et des commandes de profondeur du mandrin.
- Réglez la largeur de section sur 20 μm. Coupez chaque tranche en utilisant un mouvement lent mais constant, permettant au verre anti-roulis de capturer chaque tranche. Capturez des sections à l’aide des diapositives réchauffées en touchant la diapositive sur le bord le plus proche de la section et en laissant la section s’élever sur la diapositive. Jusqu’à huit sections peuvent être montées sur une glissière de taille standard (25 mm x 75 mm x 1 mm) lorsqu’elles sont espacées de manière appropriée.
REMARQUE : Il y a une question de choix à faire lors du choix des sections à collecter. En raison de l’orientation de l’encastrement, les sections antérieures produiront de la partie antérieure et les sections ultérieures des parties postérieures de la tête. Ainsi, si l’intérêt réside dans un domaine particulier plus qu’un autre, la sélection des sections peut être ajustée en conséquence. Alternativement, toutes les sections peuvent être collectées sur plusieurs lames jusqu’à ce qu’il ne reste plus de tissu. - Laisser sécher les lames à température ambiante pendant au moins 30 minutes mais pas plus de 1 h.
7. Coloration et IHC
REMARQUE : Pour ce protocole, la méthode détaillera l’IHC à l’aide d’un anticorps primaire non conjugué. Les anticorps conjugués au fluorochrome, ou d’autres colorations de fluorescence qui peuvent être réalisées en une seule étape, doivent être utilisés avec l’anticorps secondaire si les deux doivent être utilisés ensemble.
- Immédiatement après la période de séchage, retirez l’OCT sur les bords de la lame à l’aide d’une lame de rasoir, en laissant de la place pour une bordure hydrophobe. Dessinez une bordure hydrophobe sur chaque diapositive à l’aide du marqueur. Laissez sécher pendant 5 min.
- Lavez toutes les lames 3 fois pendant 5 minutes chacune avec du PBS en pipetant doucement sur le dessus de la lame, en évitant de pipeter directement sur le tissu lorsque cela est possible.
REMARQUE : La pipette de 1000 μL est la plus utile ici. Une lame de taille standard avec du tissu doit être complètement recouverte de 750 μL de n’importe quelle solution. Des supports à glissières et des seaux peuvent également être utilisés. - Une fois les lames lavées, pipeter à 3 % de BSA dans une solution de blocage TBS sur les lames. Laisser incuber pendant 30 minutes.
- Jetez la solution bloquante et pipetez la solution d’anticorps primaire sur les lames. Dans ce cas, une dilution de 1:250 de SC-13521 ApoE dans 3 % de BSA dans du TBS. Laisser l’anticorps incuber pendant une nuit à 4 °C ou pendant 1 h à température ambiante. Utilisez des lingettes humides ou des serviettes en papier pour éviter que la solution ne se dessèche pendant la nuit.
- Jetez l’anticorps primaire et, à l’aide de la pipette, lavez-le 3 fois pendant 5 minutes chacune avec du PBS.
- Ajouter la solution d’anticorps secondaire. Dans ce cas, une dilution de 1:500 d’AF 750 Goat Anti-Mouse en plus d’une concentration de 5 μg/mL de Nile Red, le tout dans 3 % de BSA dans du TBS. Laissez incuber pendant 1 heure à température ambiante.
REMARQUE : Nous incubons simultanément un colorant fluorescent et un anticorps secondaire dans le même tampon, 3 % de BSA dans le TBS. Ceci est préféré tant qu’il n’y a pas de conflits connus entre les deux réactifs. En cas de conflit, incuber séparément et effectuer 3 lavages supplémentaires entre les incubations. - Lavez les lames 3 fois avec du PBS pendant 5 minutes chacune. Après le lavage final, laissez une petite quantité de PBS sur la lame.
8. Montage et préparation pour l’imagerie
- À l’aide d’une pipette de 1000 μL, ajoutez 3 à 5 gouttes de support de montage durcissant contenant du DAPI (0,9 μg/ml), uniformément sur la lame en évitant la chute directe sur le tissu.
- Placez la lamelle sur la glissière, en évitant toute formation de bulles d’air.
REMARQUE : L’utilisation de pinces peut aider à cela en permettant à la lamelle de glisser près de la surface de la glissière avant de finalement se libérer. - Manipulez les diapositives fraîchement montées avec soin et rangez-les à plat jusqu’à ce qu’elles soient complètement sèches. Scellez les lames à l’aide de vernis à ongles si un entreposage à long terme est prévu.
- Capturez des images dès que possible pour éviter la pourriture fluorescente.
9. Acquisition d’images
REMARQUE : Pour la capture d’image, l’utilisation du logiciel Olympus Cell Sense Dimensions sera détaillée.
- Avant l’imagerie, inspectez les lames et essuyez-les avec de l’éthanol à 70 % dans une solution d’eau. Si les diapositives sont imagées immédiatement après le montage, faites très attention lors du nettoyage pour ne pas déranger la lamelle. Laissez sécher les surfaces de la lame et de la lamelle pendant 5 minutes avant l’imagerie.
- Sélectionnez chaque canal souhaité pour capturer, dans ce cas, les canaux pour DAPI, Nile Red et AF 750.
- Sélectionnez l’agrandissement souhaité comme décrit ci-dessous. Le choix du grossissement dépend de l’expérience ; Ici, utilisez un grossissement de 10x.
REMARQUE : Tous les grossissements sont utilisables, y compris les lentilles à base d’huile. Si vous le souhaitez, appliquez de l’huile d’immersion sur la surface de la lame. - Pour chaque canal, calibrez les temps d’exposition appropriés en fonction des sujets fluorescents les plus brillants d’une expérience. Évitez la surexposition tout en générant une image aussi lumineuse que possible.
REMARQUE : En général, les deux principaux facteurs déterminants d’une mauvaise capture de processus sont la surexposition, qui entraîne une perte de définition, et l’excès de signal de fond, difficile à séparer du signal réel. De plus, les expositions doivent être réglées indépendamment pour chaque grossissement unique utilisé. - Sélectionnez le dossier à enregistrer et nommez les images fusionnées dans le menu. Après la capture, toutes les images seront situées dans ce dossier et porteront le nom défini ici.
- Capturez des images en vous concentrant d’abord sur un sujet dans le canal qui permet d’obtenir le meilleur point focal, puis commencez la collecte. Maintenez la procédure de mise au point sur chaque sujet dans le même canal pour assurer la cohérence de l’expérience.
- Capturer tous les groupes expérimentaux utilisés pour des comparaisons ultérieures le même jour afin d’éviter la désintégration fluorescente entre les groupes comparés.
- Sélectionnez l’agrandissement souhaité comme décrit ci-dessous. Le choix du grossissement dépend de l’expérience ; Ici, utilisez un grossissement de 10x.
10. Quantification
REMARQUE : La quantification peut être effectuée à l’aide de divers logiciels. Ici, l’utilisation d’Olympus CellSense Dimensions est référencée.
- Après la collecte, examinez les images. Supprimez les sections qui présentent des imperfections ou des artefacts de coupe du dossier de quantification. Sélectionnez des images qui reflètent l’objectif de quantification. Des exemples d’imperfections sont les bulles, les sections déchirées, les tissus qui se chevauchent et la poussière ou les débris.
- Pour choisir les images appropriées, assurez-vous que toutes les images présentant du tissu cérébral sont utilisées pour la quantification afin de refléter l’expression globale dans tout le cerveau. Vous pouvez également utiliser des images reflétant uniquement le cerveau avant, moyen ou postérieur pour donner un aperçu des différences d’expression dans ces zones.
- Dans les menus Comptage et Mesure, déterminez les paramètres d’intérêt et leurs limites pour la quantification des images.
- Pour quantifier l’expression ApoE par comparaison des valeurs d’intensité moyenne, sélectionnez des valeurs de seuillage telles que tous les pixels de ce canal soient pris en compte (0-infini). De plus, délimitez les régions d’intérêt à l’aide des outils de dessin disponibles.
- Exécutez le décompte et la mesure soit par lots pour tous les fichiers, soit individuellement sur chaque image.
- Pour le traitement par lots, enregistrez les paramètres et l’exécution de la quantification, puis sélectionnez le dossier dans lequel effectuer la quantification. Le traitement par lots est accessible via l’onglet du gestionnaire de macros et accélère considérablement le flux de travail.
- Exportez le tableau de données dans une feuille de calcul pour le traçage. Pour ce faire, utilisez le menu Compter et mesurer les résultats lors de l’ouverture ou de l’exportation automatique vers une table lors de l’exécution d’un lot. Ces tables de données contiendront tous les paramètres sélectionnés à l’étape 10.2.
- Pour l’analyse statistique et le traçage, tracez les données à l’aide d’une feuille de calcul directement ou à l’aide d’un autre logiciel. La familiarité avec le logiciel choisi est essentielle pour générer une représentation précise des résultats expérimentaux. Ici, les valeurs d’intensité absolue de l’expression de l’ApoE dans le cerveau du mutant ont été normalisées par rapport au contrôle, puis tracées à l’aide de GraphPad Prism.
Résultats
La méthode décrite ci-dessus permet d’obtenir une imagerie par fluorescence du cerveau de mouches adultes de manière fiable et sans dissection fastidieuse. Illustrée simplement à la figure 1, la méthode est simple et peut être mise en œuvre rapidement si tous les échantillons, équipements et matériaux sont facilement disponibles. Alternativement, en utilisant un stockage à -80 °C pendant l’étape de moulage OCT, les échantillons peuvent être conservés pour une utilisation plusieurs semaines plus tard. Les chercheurs n’ont pas besoin d’être formés longtemps pour apprendre les techniques simples de dissection et d’intégration, ce qui rend cette méthode très accessible.
Des exemples de microscopie à fluorescence réalisée à l’aide de cette méthode peuvent être vus dans la figure 2A-D. L’expression de l’anticorps (ApoE) et de la coloration fluorescente (Nile Red) est bien définie. De plus, la haute intégrité du tissu cérébral peut également être observée. Les images peuvent être clarifiées à l’aide de fonctionnalités logicielles courantes de traitement d’images, telles que la déconvolution, qui est également illustrée dans le panneau Figure 2A'-D'. La déconvolution est utile pour améliorer la netteté et le contraste et réduire le bruit.
En ce qui concerne la quantification des images, toutes les images peuvent être quantifiées pour des paramètres standard tels que le nombre d’objets, la surface moyenne de l’objet, l’intensité et la fraction de surface. Les limites de la quantification dépendent vraiment du logiciel choisi, mais en général, les paramètres énumérés ci-dessus permettent une investigation adéquate et sont disponibles dans la plupart des applications. La figure 3 montre un histogramme généré à partir de valeurs d’intensité moyennes dans les régions cérébrales de plusieurs images. Cela sert à visualiser l’intensité cérébrale moyenne d’un génotype donné. Dans ce cas, ELAV/+ et ELAV>ApoE4.
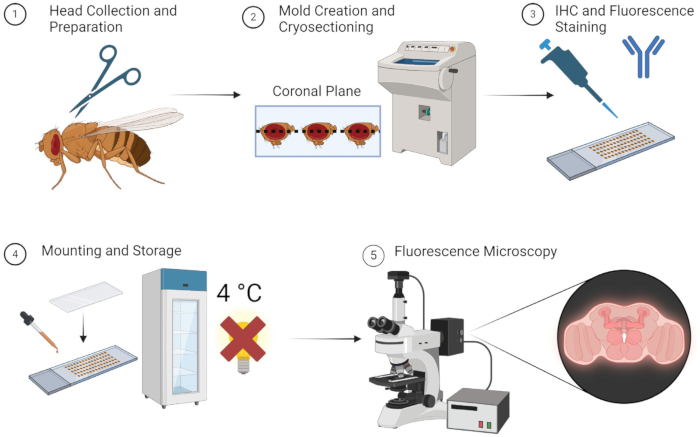
Figure 1 : Flux de travail pour la section et l’imagerie du cerveau de la drosophile. 1. Les têtes de drosophile sont collectées par décapitation à l’aide de ciseaux fins. 2. Après fixation, les têtes collectées sont intégrées avec de l’OCT dans un moule et cryosectionnées pour obtenir de fines sections de cerveau. 3. Les sections du cerveau sont soumises à une coloration immunohistochimique (IHC) avec des anticorps primaires ou une coloration fluorescente. 4. Après la coloration, les sections sont montées à l’aide d’une lamelle et stockées à 4 °C dans l’obscurité pour maintenir l’intégrité de la fluorescence. 5. Les sections du cerveau sont visualisées à l’aide de la microscopie à fluorescence pour étudier les protéines ou les structures cellulaires ciblées. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Immunohistochimie et coloration par fluorescence de têtes cryosectionnées. (A-D) Images représentatives de têtes de mouches femelles âgées de 7 semaines colorées pour l’expression de l’ApoE, les lipides (rouge du Nil) et le DAPI. Ces images démontrent l’expression de l’ApoE4 humaine (Elav>ApoE4), tandis que les mouches témoins Elav/+ n’ont pas cette expression ApoE. Coloration lipidique au rouge du Nil (Elav>ApoE4 et Elav/+). L’intégrité des tissus cérébraux à l’aide de cette méthode est également mise en évidence ici. (A'-D') Ceux-ci représentent les A, B, C et D après déconvolution. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Quantification relative de l’ApoE. Les résultats de la quantification de l’expression de la protéine ApoE dans le cerveau de drosophiles âgées de 7 semaines ont été présentés. Les valeurs absolues d’intensité ont été recueillies pour les sujets mutants Elav/+ et Elav>ApoE4, puis normalisées à Elav/+. La signification statistique entre Elav>ApoE4 et Elav/+ est apparente. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ici, nous présentons un protocole d’imagerie fluorescente précise de têtes de drosophiles cryosectionnées. Il s’agit d’une approche simple qui présente plusieurs avantages importants. À savoir, les méthodes sont suffisamment simples pour que toute personne ayant une formation de base en sécurité en laboratoire puisse les compléter, elles sont adaptables pour mesurer l’expression de n’importe quelle protéine pour laquelle des anticorps de haute qualité existent, et elles permettent de mesurer avec précision à la fois la quantité d’expression d’une protéine d’intérêt et l’endroit où cette expression se produit dans la tête. Si la qualité des tissus et des images est suffisamment élevée, cela pourrait potentiellement permettre une cartographie 3D de l’expression dans toute la tête de la drosophile .
Contrairement aux approches techniquement difficiles visant à isoler le cerveau pour l’imagerie combinées à la microscopie confocale, ce protocole permet d’imager toute la tête de la drosophile, et pas seulement le cerveau. Ceci est particulièrement important étant donné que le système visuel de la mouche est un modèle important de la fonction neuronale21, mais certaines de ces structures pourraient être perdues lors de l’isolement du cerveau. Il fournit également des tissus de contrôle en section, par exemple les muscles de la trompe, pour déterminer si l’expression de la protéine d’intérêt est spécifique à certains types de cellules ou de tissus22. Cela permet une comparaison directe entre les tissus, plutôt que d’utiliser des sections distinctes qui pourraient être affectées par de légères différences de conditions. Une autre force de ce protocole et de l’utilisation de la drosophile comme système modèle est que les têtes de mouches sont très petites19,20, de sorte qu’une imagerie fluorescente à contenu relativement élevé peut être réalisée. Nous avons été en mesure de mettre plus de 50 têtes dans un seul bloc. Avec 8 sections pouvant être placées sur une glissière de taille standard de l’industrie, 1 diapositive peut contenir 8 sections uniques par mouche pour un total de 400 sections uniques. Il est important de noter que toutes les sections sont soumises aux mêmes conditions expérimentales et aux mêmes points temporels pour obtenir une grande intégrité lors de la comparaison entre les groupes. De plus, ce protocole ne nécessite que l’utilisation d’un microscope fluorescent standard plutôt que d’un microscope confocal, ce qui peut être prohibitif pour les laboratoires ou les institutions qui ne bénéficient pas d’un soutien financier élevé et qui permettent un accès plus large à cette imagerie.
L’une des principales limites de ce protocole, qui est inhérente à l’immunomarquage, est l’importance d’utiliser des anticorps de haute qualité et des contrôles appropriés lors de l’optimisation des anticorps. Il est essentiel de vérifier que les anticorps sont sélectifs et sensibles à la protéine d’intérêt, car il y a souvent une coloration hors cible qui peut rendre difficile la détermination de la réalité du signal fluorescent. Pour ce faire, testez les anticorps primaires et secondaires. Heureusement, il est simple de le faire en raison des outils génétiques facilement disponibles chez la drosophile. Pour vérifier la qualité de l’anticorps primaire, nous recommandons de compléter le protocole avec des mouches de type sauvage et des mouches expérimentales ainsi que des mouches témoins positives qui surexpriment la protéine d’intérêt et des mouches témoins négatives dont le gène est désactivé ou renversé. Ces groupes de contrôle établiront la gamme des niveaux d’expression et de la fluorescence attendue, servant de points de référence pour évaluer où se situent les mouches expérimentales dans ce spectre. Il est essentiel de tester plusieurs dilutions de l’anticorps primaire, car une quantité insuffisante entraînera une coloration de mauvaise qualité qui n’entraînera pas une fluorescence au-dessus du fond où la protéine est présente, tandis qu’une quantité excessive d’anticorps entraînera une coloration hors cible lorsque la protéine est absente. Cette approche de dilution multiple doit inclure un groupe sans anticorps primaire, ce qui permettra de vérifier la qualité de l’anticorps secondaire, car il n’y aura de fluorescence dans ce groupe que s’il y a une fluorescence de fond et fournit un groupe témoin négatif supplémentaire qui montre les limites de la détection fluorescente par l’anticorps secondaire. Si nécessaire, utilisez différentes conditions d’incubation, c’est-à-dire le temps ou la température, pour maximiser le rapport signal/bruit dans vos images finales. Nous réitérons que des anticorps de haute qualité, ainsi que des tissus de haute qualité, sont essentiels pour une imagerie immunofluorescente de haute qualité.
Dans l’ensemble, l’imagerie immunofluorescente est un outil puissant pour étudier la biologie plus largement et les neurosciences plus spécifiquement. Ceci, combiné aux puissants outils génétiques disponibles chez la drosophile, a le potentiel de découvrir des connaissances importantes sur l’impact des protéines sur la santé et la maladie. Le cerveau de la mouche a joué un rôle démontrable dans la découverte du fonctionnement du cerveau humain et continuera de le faire. En raison de l’adaptabilité du protocole que nous décrivons ici, le rôle de presque toutes les protéines (ou lipides) dans la tête peut être étudié dans le contexte de n’importe quelle maladie ou affection, limitée uniquement par la qualité des anticorps. Ainsi, l’imagerie immunofluorescente sera probablement essentielle pour les recherches futures sur le fonctionnement du cerveau et aura un impact significatif sur la santé humaine et le développement thérapeutique.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions les membres du laboratoire Melkani pour leur aide et leurs précieux commentaires pour l’élaboration du protocole. Les crosses Elav-Gal4 (BL#458) et UAS-ApoE4 (BL#76607) ont été obtenues auprès du Bloomington Drosophila Stock Center (Bloomington, IN, USA). Ce travail a été soutenu par des subventions des National Institutes of Health (NIH) AG065992 et RF1NS133378 à G.C.M. Ce travail est également soutenu par les fonds UAB Startup 3123226 et 3123227 à G.C.M.
matériels
| Name | Company | Catalog Number | Comments |
| 1000 uL Pipette | Eppendorf | 3123000063 | |
| 1000 uL Pipette Tips | Olympus Plastics | 23-165R | |
| 10X Phosphate Buffered Saline (PBS) | Fisher | J62036.K7 | ph=7.4 |
| 200 Proof Ethanol | Decon Laboratories | 64-17-5 | |
| 20X Tris Buffered Saline | Thermo Scientific | J60877.K2 | pH=7.4 |
| AF750 Goat Anti-Mouse Secondary Antibody | Alexa Fluor | A21037 | |
| Anti-Roll Glass | IMEB | AR-14047742497 | |
| ApoE Mouse Primary Antibody | Santa Cruz | SC13521 | |
| Bovine Serum Albumin | Fisher | 9048-46-8 | |
| Centrifuge Tubes 1.5 mL | Fisher | 05-408-129 | |
| Charged Slides | Globe Scientific | 1415-15 | |
| Cryosectioning Molds | Fisher | 2363553 | |
| Cryostat | Leica | CM 3050 S | |
| Cryostat Blades | C.L. Sturkey | DT554N50 | |
| Distilled Water | |||
| Dry Ice | ??? | ??? | |
| Fine Forceps | Fine Science Tools | 11254-20 | |
| Fly Pad | Tritech Research | MINJ-DROS-FP | |
| Hardening mounting Media with Dapi | Vectashield | H-1800 | |
| Kimwipes | Kimtech | 34120 | |
| Microscope | Olympus | SZ61 | |
| Nile Red | Sigma | N3013 | |
| Optimal Cutting Temperature Compound | Fisher | 4585 | |
| Orbital Shaker | OHAUS | SHLD0415DG | |
| Paraformaldehyde 20% | Electron Microscopy Sciences | 15713 | |
| Razor Blades | Gravey | #40475 | |
| Spring Scissors | Fine Science Tools | 15000-10 | |
| Sucrose | Fisher | S5-500 |
Références
- Fabbri-Destro, M., Rizzolatti, G. Mirror neurons and mirror systems in monkeys and humans. Physiology. 23, 171-179 (2008).
- Faust, T. E., Gunner, G., Schafer, D. P. Mechanisms governing activity-dependent synaptic pruning in the developing mammalian CNS. Nat Rev Neurosci. 22, 657-673 (2021).
- Roozendaal, B., McEwen, B. S., Chattarji, S. Stress, memory and the amygdala. Nat Rev Neurosci. 10, 423-433 (2009).
- Arber, S., Costa, R. M. Networking brainstem and basal ganglia circuits for movement. Nat Rev Neurosci. 23, 342-360 (2022).
- GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 7, e105-e125 (2022).
- Huang, Y., Li, Y., Pan, H., Han, L. Global, regional, and national burden of neurological disorders in 204 countries and territories worldwide. J Glob Health. 13, 04160 (2023).
- Crick, F. Central dogma of molecular biology. Nature. 227, 561-563 (1970).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9, 235-244 (2016).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the Fly: A primer on the Drosophila model system. Genetics. 201, 815-842 (2015).
- Larkin, A., et al. FlyBase: updates to the Drosophila melanogaster knowledge base. Nucleic Acids Res. 49, D899-D907 (2021).
- Jeibmann, A., Paulus, W. Drosophila melanogaster as a model organism of brain diseases. Int J Mol Sci. 10, 407-440 (2009).
- Winding, M., et al. The connectome of an insect brain. Science. 379, eadd9330 (2023).
- Bargiello, T. A., Jackson, F. R., Young, M. W. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature. 312, 752-754 (1984).
- Zehring, W. A., et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell. 39, 369-376 (1984).
- Huang, R. C. The discoveries of molecular mechanisms for the circadian rhythm: The 2017 Nobel Prize in Physiology or Medicine. Biomed J. 41, 5-8 (2018).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 4, 429-434 (2012).
- Ong, S. E., Foster, L. J., Mann, M. Mass spectrometric-based approaches in quantitative proteomics. Methods. 29, 124-130 (2003).
- Behnke, J. A., Ye, C., Moberg, K. H., Zheng, J. Q. A protocol to detect neurodegeneration in Drosophila melanogaster whole-brain mounts using advanced microscopy. STAR Protoc. 2, 100689 (2021).
- Moraes, R. C. M., et al. Apolipoprotein E induces lipid accumulation through Dgat2 that is prevented with time-restricted feeding in Drosophila. Genes. 15 (11), 1376 (2024).
- Roth, J. R., et al. Rapamycin reduces neuronal mutant huntingtin aggregation and ameliorates locomotor performance in Drosophila. Front Aging Neurosci. 15, 1223911 (2023).
- Currier, T. A., Pang, M. M., Clandinin, T. R. Visual processing in the fly, from photoreceptors to behavior. Genetics. 224, (2023).
- McKellar, C. E., Siwanowicz, I., Dickson, B. J., Simpson, J. H. Controlling motor neurons of every muscle for fly proboscis reaching. Elife. 9, (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon