Method Article
쥐 척추 등쪽 뿔(Rat Spinal Dorsal Horn)의 심장 잠금 뉴런 반응에 대한 체세포 자극의 코딩 프로파일 연구
요약
우리는 심장 기능을 기록하고 심장 잠금 척추 등쪽 뿔 뉴런을 분석하는 것과 함께 척추 다채널 세포 외 기록을 위한 프로토콜에 대해 설명합니다. 이 방법은 침술에 의해 유발된 흉추의 내장 기능 변화의 기저에 있는 척추 메커니즘을 연구하기 위한 시간적으로 동기화된 틀을 제공합니다.
초록
많은 연구에서 전기 침술이 심혈관 질환의 치료와 예방에 도움이 될 수 있다고 제안했습니다. 그러나 그 메커니즘은 여전히 잘 이해되지 않고 있습니다. 흉추 등쪽 뿔(SDH)은 심장 조절에 영향을 미칠 수 있는 체세포 및 내장 입력을 통합하고 조절하는 데 중요한 역할을 합니다. 광범위하게 연구된 요추 SDH와 대조적으로, 흉추 SDH는 외과적 노출과 정위 고정의 어려움으로 인해 연구가 적었습니다. 이 연구에서는 심전도와 미세 전극 어레이의 기록을 결합하여 신경 활동과 심장 기능을 동시에 모니터링하기 위한 일반적인 접근 방식을 제공합니다. 또한 심장 박동과 동기화된 뉴런 활동의 발사 속도 분포를 계산하여 심장 고정 뉴런을 식별하는 방법을 설명합니다. 이 전략은 심혈관 기능과 신경 활동 사이의 상관 관계를 연구하고 말초 신경 자극에 의해 유발되는 체성 심장 반사를 이해하는 데 매우 중요합니다.
서문
침술 또는 신체 표면 자극은 전통 중국 의학(TCM)의 틀 내에서 두드러진 치료 기법으로, 신체 표면의 특정 부위를 자극함으로써 작동합니다. 그것은 구심성 경로(afferent pathways), 중추 통합(central integration) 및 자율신경 원심성 신경 기전(autonomic efferent nervous mechanisms)을 통한 내장 기능의 조절을 통해 유기체의 기능에 대한 다단계 조절을 촉진합니다. 이 치료법의 핵심은 해부학적으로 정의된 경혈의 표적 자극이 전신의 생리적 조절을 유도한다는 개념입니다. 침술요법이 심혈관 질환 관리에 있어 보완적인 방법으로서 역할을 한다는 임상적 증거가 늘어나고 있으며, 1차 예방과 보조 치료 프로토콜 모두에서 효과가 입증되고 있다 1,2.
감각 뉴런의 일차 구심성은 주로 척추 등쪽 뿔(spinal dorsal horn, SDH)에서 말단하며, 이에 따라 척추 등쪽 뿔 뉴런(spinal dorsal horn neuron, SDHN)은 체세포 입력의 통합 및 조절에 중요한 역할을 합니다 3,4,5. 또한, SDHRN은 심장 구심성(cardiac afferent)을 수신하고 심혈관 조절을 위해 척추 교감신경 신경절전 뉴런(spinal sympathetic preganglionic neuron, SPN)에 내장 정보를 전달합니다6. 심장 잠금 SPN은 척수(T1-T5)의 흉부 분절 측면 모서리에 위치하며, 축삭은 경추 또는 흉부 신경절로 돌출된 후 심장, 중간 및 하부 신경을 통해 심장에 신경을 분포시킵니다. 결과적으로, 흉추 척수는 체세포 및 내장 입력의 통합 및 조절에 중요한 역할을 하며, 이는 심장 조절에 영향을 미칠 수 있습니다. 따라서 체세포 자극이 척수의 흉부 분절에서 SDHRN의 조절을 통해 심장 기능을 어떻게 조절하는지 이해하는 것이 중요합니다.
이전 연구에서는 PC6의 전기침술(T3 척추 분절에서 동종주제 구조-기능 단위로 조직됨)이 자율신경계의 조절을 통해 심근허혈 증상을 완화할 수 있음을 입증했다 7,8,9. 그러나 신경계 활동과 함께 심박수에 대한 침술의 효과에 대한 실시간 정량적 동기화는 아직 실현되지 않았습니다. 침술 치료 후 즉각적인 자율신경 활동과 심전도(ECG) 지표만 문서화되었습니다. SDHN과 내장 생리적 기능을 연결하는 연구는 여전히 부족합니다. 흉추의 생리학적 곡률과 인접한 흉추 분절, 특히 T1-T5 사이의 좁은 공간으로 인해 이러한 영역에 접근하는 것이 어렵기 때문에 CVD 치료에서 심장 기능을 조절하는 T3 척추 동종 경혈 PC6에서 침술의 기저에 있는 척추 메커니즘을 설명할 수 있는 직접적인 증거가 부족합니다.
SDH와 침술 매개 심장 기능 조절 사이의 관계를 더 잘 이해하기 위해서는 심장 기능과 신경 활동의 동기 기록이 구현되어야 합니다. 여기에서는 심장 기능 기록과 함께 척추 다채널 세포 외 기록에 대한 일반적인 접근 방식을 제공하고 심장 잠금 SDHRN을 분석합니다. 이 방법은 침술에 의해 유발된 흉추의 내장 기능 변화의 기저에 있는 척추 메커니즘을 연구하기 위한 시간적으로 동기화된 틀을 제공합니다.
프로토콜
동물 실험 프로토콜은 국가 표준 "실험실 동물 복지에 대한 윤리적 검토 지침"(GB/T 35892-2018)의 요구 사항을 엄격하게 준수했으며 해당 기관의 윤리 위원회에서 승인했습니다. 이 연구에는 생후 6-8주, 체중 약 220g의 수컷 SPF 등급 Sprague-Dawley(SD) 쥐가 사용되었습니다. 모든 실험 중에는 실험용 가운, 장갑, 마스크를 착용했다. 시약과 사용된 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다. 실험이 끝날 무렵, 쥐는 깊은 마취 상태에서 심장 관류를 통해 안락사시킨 후 경추 탈구를 일으켰습니다.
1. 수술 전 설정
- 인공호흡기 회로를 Y자형 기관내관에 연결하여 안전하고 밀폐된 인터페이스를 보장합니다.
- 인공호흡기 디스플레이에서 안정적인 공기 흐름, 적절한 일회량 및 호흡수 설정을 확인하여 적절한 환기를 확인하십시오.
- 밝은 조명 아래에서 모든 세그먼트를 육안으로 검사하여 튜브 내부에 응축수 또는 미립자 오염 물질이 없는지 확인합니다.
- 3방향 BNC 커넥터를 사용하여 증폭된 ECG 신호를 심전도 입력과 미세 전극 어레이 기록 시스템의 아날로그 입력 포트에 동시에 공급합니다.
- 증폭된 신호를 3방향 BNC 스플리터를 통해 라우팅하여 심전도 아날로그 입력과 미세 전극 어레이 기록 시스템의 아날로그 입력 포트를 동시에 연결합니다.
- 심전도의 TTL 출력을 미세 전극 어레이 기록 시스템의 디지털 입력에 연결하여 동기화 트리거를 설정합니다. BNC-듀퐁 인터페이스 케이블을 사용하여 두 시스템에서 동시 수집을 시작하여 시간 정렬을 확인합니다.
2. 수술 전 준비
- 마취
- 흡입으로 3-5% 이소플루란으로 마취를 유도한 후 마취된 쥐에게 펜토바르비탈 나트륨(50mg/kg)을 복강내 주사합니다. 전극을 배치하기 전에 흡입 마취를 위해 이소플루란을 투여하여 농도를 ~1.2%로 유지합니다. 진행하기 전에 발가락 꼬집기를 통해 마취 깊이를 평가하는 경우에만 진행하십시오.
- 쥐의 앞쪽 목과 뒤쪽 뒤쪽에서 털을 제거합니다.
- 쥐를 따뜻한 담요 위에 누운 자세로 놓고 쥐의 눈에 연고를 발라 건조를 방지합니다. 호흡 속도를 관찰하고 집게로 발판에 압력을 가하여 금단 반응을 확인합니다.
3. 기관 삽관
- 쥐를 누운 자세로 놓고 요오드 팅크로 목 부위를 소독합니다.
- 목 정중선을 따라 약 1cm의 세로로 절개하여 근육 조직을 둔탁하게 절개합니다.
- 갑상선이 노출되면 갑상선 조직이 손상되지 않도록 주의하면서 두 갑상선 엽 사이의 얇은 막을 조심스럽게 분리합니다. 기관을 노출시키십시오.
- "Y자형 캐뉼라를 검사하여 완전히 건조되었는지 확인합니다. 스프링 가위를 사용하여 기관을 가로 절개한 다음 기관 개구부에 캐뉼라를 삽입합니다. 공기 누출 및 우발적인 발관을 방지하기 위해 3-0 비흡수성 봉합사로 기관 캐뉼라를 고정합니다.
- 목 근육과 피부를 조심스럽게 봉합하고 쥐를 인공 호흡기에 연결하십시오. 쥐의 체중7에 따라 호흡수를 85 breaths/min으로 조정하고 일회 호흡량을 3.5 mL로 조정합니다.
4. ECG 감지
- 쥐의 피부에 3개의 전극을 삽입하십시오: 양극은 왼쪽 하지에, 음극은 오른쪽 상지에, 접지 전극은 오른쪽 하지에10.
- 심전도계를 사용하여 데이터를 수집합니다(필터 설정: 100Hz에서 저역 통과, 1kHz에서 고역 통과, 샘플링 주파수: 4kHz/s). ECG 기록 소프트웨어를 사용하여 데이터를 기록, 저장 및 분석할 수 있습니다.
5. 약물 투여를 위한 심낭 카테터 삽입: 브래디키닌(BK)
- 쥐를 누운 자세로 놓고 가슴 피부를 요오드로 소독합니다.
- 왼쪽 가슴 위쪽의 1번째와 3번째 늑연골 사이에 흉선을 노출시켜 흉선을 노출시킵니다. 심낭을 노출시키기 위해 정중선을 따라 흉선을 흉선으로 흉선을 절개합니다( 그림 1C, D 참조).
- 유리 절제 바늘 끝(직경 0.5mm)을 사용하여 심낭에 작은 구멍을 만듭니다.
- 심낭의 절개 부위를 통해 말단 끝에 여러 개의 작은 구멍이 있는 10-15cm 길이의 실리콘 카테터를 삽입합니다. 바이오 접착제를 사용하여 카테터를 흉벽 조직에 고정합니다.
- 흉강을 한 겹씩 닫아 쥐의 호흡이 방해받지 않도록 합니다( 그림 1D 참조).
6. T3 척수 노출
- 쥐를 엎드린 자세로 놓고 요오드로 일상적인 소독을 수행합니다. T2에서 T6 척추까지 등 정중선을 따라 약 8cm를 절개합니다.
- 스프링 가위를 사용하여 승모근을 포함한 피부와 근육층을 자릅니다. 근육 사이에 견인기를 삽입하여 수술 영역을 더 노출시킵니다.
- 쥐의 흉추 앞쪽에 있는 지방샘과 동면샘을 조심스럽게 분리하고, 땀샘 아래의 혈관을 피한다( 그림 1E 참조).
- 머리 클램프에 붙어있는 근육과 긴 목 근육의 곧은 부분을 제거하여 T2의 가시 돌기를 노출시킵니다.
- 척추궁(semispinalis)과 척추근(spinalis muscle)을 변위시켜 척추궁(vertebral arch)을 T2에서 T6으로 노출시킨다( 그림 1E 참조). 롱거스를 사용하여 T3 척추의 가시돌기를 제거하여 T3 척수를 노출시킵니다.
참고: 흉추를 노출시키는 과정에서 T2의 척추 돌기가 T3 척수의 후속 노출을 위한 주요 힘 가하는 지점 역할을 하므로 T2의 척추 돌기를 보존하는 데 특별한 주의를 기울여야 합니다. - 경막과 지주막을 제거하고 척수 표면에 파라핀 오일을 떨어뜨려 척수 뉴런의 생존력을 유지합니다( 그림 1F 참조).
참고: 쥐의 갈색 지방 조직의 혈관은 T3, T4 또는 T5 판막에서 시작되어 정맥동처럼 분포되어 있습니다. 쥐에게 과도한 출혈을 유발할 수 있으므로 만지지 않도록 주의하십시오.
7. 흉추 고정 및 설정
- 맞춤형 척추 클램프를 사용하여 T2 및 T6의 관절 돌기를 고정합니다. 주변 근육에 식염수를 적셔 수분을 유지합니다.
- 전극 어레이를 정위 기구의 미세 조작기에 부착하고 정중선 측면 500μm의 등쪽 정중열구를 통해 T3 척추 분절의 척수 등쪽 뿔에 1,500μm 깊이까지 수직으로 삽입합니다.
- 참조 전극을 등 근육에 삽입합니다( 그림 1G 참조).
- 멀티채널 셀룰러 외 레코딩 소프트웨어를 실행하고 File(파일) | 하드웨어 구성; 장치 인터페이스 목록에서 32 채널 어레이를 선택합니다. 선택한 채널 그룹을 마우스 오른쪽 버튼으로 클릭합니다. 그런 다음 상황에 맞는 메뉴에서 속성을 선택합니다. 신호 처리 매개변수 구성: 필터 탭에서 대역 통과 필터(BP)를 250Hz - 5kHz로 설정합니다. 샘플링 속도 필드에 30kHz/s를 입력합니다. Enable Spike Processing(스파이크 처리 활성화) 상자를 선택하여 스파이크 감지 알고리즘을 활성화하면 실시간 스파이크 정렬 및 임계값 기반 이벤트 추출이 활성화됩니다.
참고: T2 및 T6의 관절 돌기를 둘러싼 근육과 조직, 특히 척추 고정을 위해 맞춤형 척추 클램프가 적용되는 부위를 철저히 청소하여 후속 실험 중 변위를 방지합니다.
8. 체세포와 BK 자극
- BK(증류수 중 1μg/mL)를 사용하여 심장 통각 자극을 유도합니다. 여러 개의 작은 구멍이 있는 실리콘 카테터에 연결된 마이크로 주사기로 BK 용액 4μL를 주입합니다11.
- 주사 후 30분 이내에 T3 척수 등쪽 뿔의 심박수 변화(증가 또는 감소)와 신경 방전(증가 또는 감소)을 관찰하여 흉추 척수 등쪽 뿔 뉴런 간의 동적 상호 작용을 식별합니다.
- 경혈 PC6(MAPC6)에서 1Hz의 자극 매개변수를 사용하여 수동 침술을 수행합니다. PC6(Neiguan 경혈)은 굴근 수근 요골과 정중 신경 줄기 사이의 복부 팔뚝의 수근 관절에 2mm 근접한 위치에 있습니다. 바늘(0.25mm x 25mm)을 ~3mm 깊이의 PC6 경혈에 삽입합니다. 체세포 자극 전후의 뉴런 활동과 심장 기능의 변화를 비교합니다.
9. 데이터 분석 및 처리
- ns6 형식으로 기록된 신경 데이터를 소프트웨어로 다음과 같이 가져옵니다.
- 파일 변환: 파일로 이동 | ns6 파일을 로드하려면 엽니다. 파일 | 다른 이름으로 저장하고 .nex5 형식을 선택하여 표준화된 스파이크 트레인 데이터를 생성합니다.
- 스파이크 정렬: 변환된 .nex5 파일을 뉴런 분류를 위한 분류 소프트웨어로 가져옵니다. 파형 특성과 주성분 분석(PCA)을 기반으로 스파이크 파형을 정렬하며, 임계값 파라미터는 베이스라인 노이즈에서 ±3 SD로 설정됩니다.
- 그런 다음 신호를 필터링하고 분류하기 위한 관련 코드를 실행합니다.
- 심박 SDRN을 분석합니다.
- R파를 참조 이벤트로 삼아 각 R파의 전후 0.2초 창 내에서 뉴런이 발화하는 횟수를 계산합니다.
- 50ms 간격으로 R파를 계수한 후 링 이벤트 히스토그램을 만듭니다. 히스토그램을 정규화하여(즉, R-wave 이벤트 전후 0.2초 동안의 평균 방전율을 뺀다) 심장 박동 동안 각 뉴런 활동의 방전율 분포를 구합니다.
- 1,000번의 셔플링 반복으로 구현된 Monte Carlo12 순열 테스트를 통해 통계적 유의성을 평가합니다. 각 하트비트 R파(범위는 0.1초 ±)의 전후 시간을 0.2초 동안 무작위화하여 무작위 하트 비트 과정에서 뉴런의 발사 속도 분포 및 신뢰 구간을 구합니다. 뉴런 심장 박동의 발화 분포가 무작위 심장 박동 과정의 발화 속도 분포의 95% 신뢰 구간을 초과하면(보다 크거나 작음) 뉴런을 심장 잠금 뉴런으로 식별합니다( 보충 파일 1 참조).
결과
위의 프로토콜에 따라, T3 SDHN은 브래디키닌(BK) 또는 체세포 니들링(somatic needling)을 주위/경혈 부위에 투여하여 노출시켰다. 이 조사는 통각 내장 입력, BK 적용 및 체성 감각 조절 중 자극 유발 신경 활성화 프로파일(유형/주파수) 및 동시 심전도(ECG) 변화를 정량화했습니다.
그림 2A는 쥐의 T3 척수의 가로 절편을 보여줍니다. 왼쪽에는 뚜렷한 층의 분포를 보여줍니다. 오른쪽에는 10분의 배양 기간 후 Dil 염료 분포를 나타내는 주황색 영역이 표시됩니다. Dil 염료가 함침된 어레이 전극을 정위 장치의 미세 조작기에 부착했습니다. 그런 다음 전극을 T3 분절에서 후방 정중 열구의 측면 500μm인 척수의 등쪽 뿔에 1,500μm 깊이까지 수직으로 삽입하고 쥐의 체중에 따라 깊이를 조정했습니다. 15분의 기록 기간 후, 관류 및 조직 채취가 수행되었으며, 이 동안 전극은 쥐 척수의 얇은 판 I에서 VIII까지의 신호를 기록했습니다. 그림 2B-D는 채널 19에서 기록된 뉴런의 래스터 플롯, 파형, 주성분 분석(PCA) 및 자기 상관을 보여줍니다. 그림 2F,G는 채널 11에서 기록된 3개의 뉴런에 대한 유사한 데이터를 보여줍니다. 이 두 채널의 데이터는 뉴런의 명확한 분류를 나타내며 후속 상관 관계 분석을 위한 신뢰할 수 있는 데이터를 제공합니다.
파란색 열은 특정 시간 프레임 내에서 누적된 신경 세포 방전 횟수를 평균 값으로 뺀 값을 보여줍니다. 그림 3A는 60초 동안의 베이스라인(BL) 기록을 보여줍니다. 채널 17c 및 채널 21a 뉴런은 T3 SDHN에 심장 고정 뉴런의 존재를 보여주며, ECG 변화에 대한 반응으로 뚜렷한 주기적 방전을 나타냅니다. 그림 3B는 심장 잠금 뉴런의 예와 함께 좌심방의 심낭에 BK를 적용한 것이 T3 SDHN에 미치는 영향을 보여줍니다. 채널 17c 뉴런은 BK 투여 후 심폐 상태가 현저히 감소한 것으로 나타났습니다. 그림 3C의 녹색 음영 영역에서 볼 수 있듯이, MAPC6 투여 후 BL 및 MAPC6 조건의 발화 주기에서 R파 주변에서 주기적인 발화를 보이는 일관된 뉴런 클러스터가 있습니다. 이 패턴은 BK 적용 후 관찰된 발사보다 더 규칙적입니다. 대조적으로, 그림 3D에서 MAPC6 이후 뉴런의 발화 패턴은 덜 뚜렷합니다. 따라서 MAPC6는 T3 척추 등쪽 각막에서 심장 관련 뉴런의 발화 빈도를 개선하여 병리학적 조건에서 심장 기능을 유지할 수 있습니다. 도 3E,F는 PC6 경혈의 침술 자극 후 BK에 의해 활성화된 T3 SDHNs의 방전 빈도가 감소한 것을 보여준다. 반대로, BK에 의해 억제된 T3 척추 뉴런의 발사 빈도 비율은 PC6 경혈의 침술 자극 후 유의하게 증가했다.
흥미롭게도, 채널 21a는 동방결절(SA)에 의한 심방 탈분극의 시작을 표시하는 P파와 방실 결절에서의 지연을 나타내는 PR 간격에 대한 반응으로 주기적이고 규칙적인 방전을 보이는 심장 잠금 뉴런으로 확인됩니다. ECG에서 P파에는 큰 변화가 없지만, BK를 적용하면 ECG의 각 P파와 Q파 사이에 3개의 뉴런 클러스터가 집중되어 P파와 더 밀접한 관계를 보여줍니다( 그림 3B의 보라색 음영 영역으로 표시됨). 심전도에 대한 P파는 심방 수축파의 정상성을 반영하는 중요한 지표이며, SA 노드에 의해 생성된 P파는 심방 탈분극 과정을 나타내므로 BK가 심방에 미치는 영향을 확인했습니다. 그러나 MAPC6 투여 후 R 파와 T 파와 관련하여 뉴런의 발화에 뚜렷한 패턴이 있었습니다. 침술 후 뉴런은 P파와 관련된 군집 패턴으로 되돌아갔는데, 이는 침술이 척추 등쪽 뿔의 같은 분절에 있는 체세포 및 내장 뉴런의 리듬을 조절하여 병리학적 심장 질환을 치료할 수 있음을 나타냅니다.

그림 1: T3 SDH의 수술 절차. (A) 인공호흡기. (B) 쥐의 기관 삽관. (C) 흉선 및 심장 해부학. (D) 흉선을 심낭으로 파이프합니다. (E) T2-8 제거 후의 흉추. (F) T3 척수. (G) 변형된 척추 클램프. (H,나) 척추 클램프의 국소 고정. (제이,케이) 신체 및 내장 자극의 개략도; 녹음하는 동안 쥐는 누운 자세로 엎드린 자세였습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
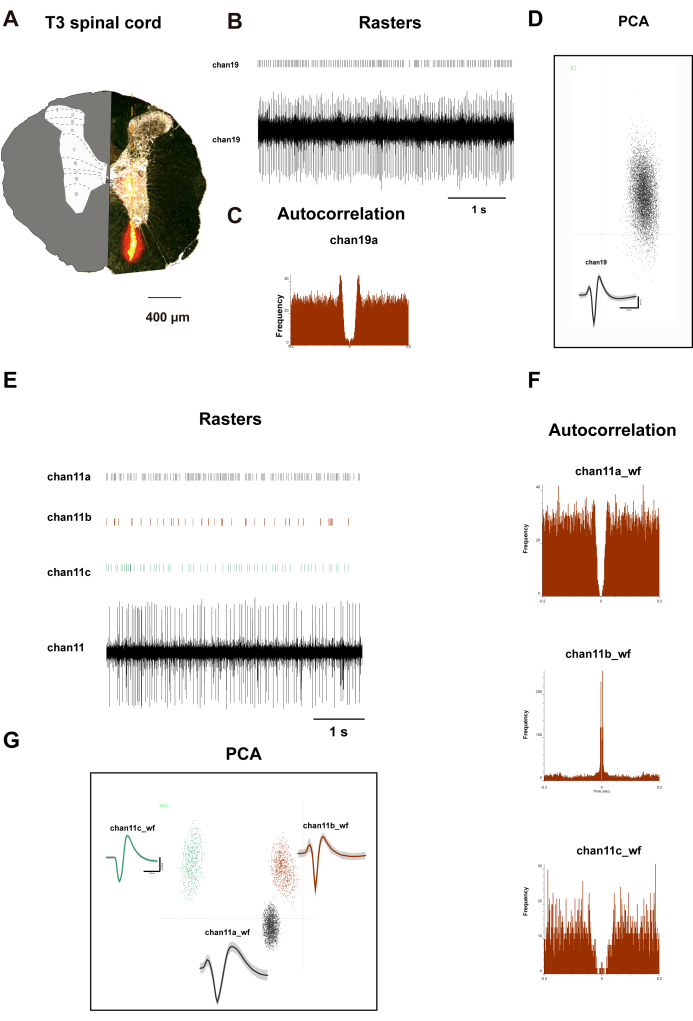
그림 2: T3 척추 등쪽 뿔 뉴런이 기록되었습니다. (A) 전극 배치 검증: 32채널 실리콘 프로브의 이식 트랙을 보여주는 횡방향 척수 절편. 삽입 사진: 공간 등록을 위해 중첩된 세포구조학적 층판 경계(I-X)가 있는 수정된 Paxinos 쥐 척수 지도. 그래프는 (B,E) 채널 19 및 채널 11 뉴런 발사 래스터 및 파형, (D,G) PCA 클러스터링 및 클러스터 다이어그램, (C,F) 자기 상관을 보여줍니다. 패널 C 와 F 에 묘사된 중앙 대칭 패턴은 채널 19 및 채널 11 뉴런에 기록된 뉴런의 독특한 발화 패턴을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
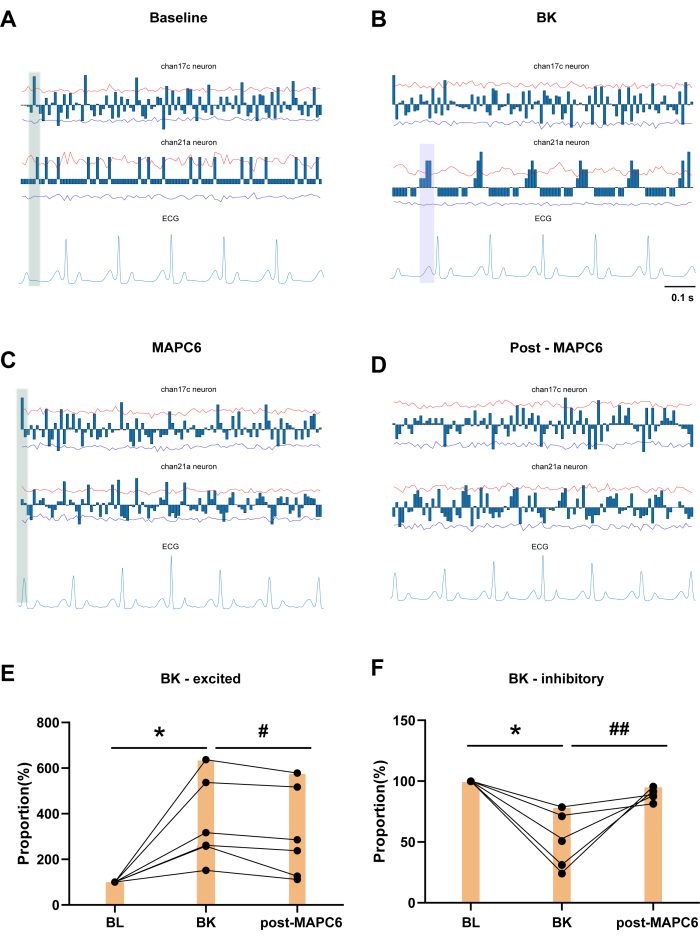
그림 3: 심낭에 국소 BK 적용이 T3 SDHN에 미치는 영향 및 심장 고정 뉴런의 예. (A) 채널 17c 및 채널 21a 뉴런은 T3 SDR에 심장 고정 뉴런의 존재를 보여줍니다. (B) BK 투여 후 30분 이내 잠금 정도의 변화 (C,D) 1분 동안 심장 잠금 뉴런 MAPC6 및 1분 동안 MAPC6 이후의 예 (E,F) MAPC6 후 BK에 반응하는 뉴런의 빈도 비율 변화. 오차 막대는 평균 ± SEM(N = 6)을 나타냅니다. *P < 0.05, BL 대비 0.05, ##P < 0.01, BK 대비 #P < 0.05, # 0.01. 쌍체 t-검정이 사용되었습니다. 약어: BL = 기준선; BK = 브래디키닌; MAPC6= 네이관(PC6)의 수동 침술. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: ECG 잠금 신경 세포 활성 분석. 70행: 조건={[t1_start,t1_end], [t2_start,t2_end], ...} 에서 시간 범위를 수정합니다. 71행에서 실험 단계 레이블 조정: conditiontitle = {'baseline','EA1','EA2'}; 조건에 정의된 시간 범위에 맞춥니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
SDH 신경 세포 코딩 프로파일을 해독하는 것은 내장 기능 장애에 대한 침술 유도 치료 효과의 신경 조절 메커니즘을 이해하는 데 필수적입니다. 여기에서는 MEA 생체 내 기록 기술과 ECG 기록 시스템을 결합하여 T3 SDHN과 ECG의 방전 활동을 동시에 기록했습니다. 심장 통증 자극은 심장에 신경을 공급하고 내장, DRG, T1-T5 척수 및 척상척수를 통해 통각 정보를 전방으로 전달하는 C형 통각 수용기를 활성화할 수 있습니다. 교감신경 구심성 섬유(sympathetic afferent fiber)는 등뿔(dorsal horn)로 들어가 중간뉴런(interneuron)으로 전달되고, 척수의 측면 뿔(lateral horn)에 있는 신경절 전 뉴런(preganglionic neuron)으로 돌출합니다. 이 신경절 전 섬유는 백색 라미 통신체로 들어가 교감신경 사슬에 합류하여 직접 또는 성상 신경절(SG)로 올라가 신경절 후 뉴런으로 변환되고, 하경추 및 중간 경추 신경절 시냅스와 신경절 후 뉴런으로 변환되어 심박수를 조절합니다13.
심혈관 질환 치료에서 PC6 경혈의 메커니즘은 매우 복잡하며 완전히 밝혀지지 않았습니다. 현재, 체성 교감신경 반사 경로는 더 중요한 경로 중 하나로 간주된다. 이 연구는 T3 척수 내의 심장 잠금 및 잠금 해제 뉴런에 대한 PC6 경혈의 조절 효과를 조사합니다. 문헌에서 MEA 기록 기술은 SDH14,15에서 (WDR(wide-dynamic range]) 뉴런의 방전을 기록하는 데 사용되었습니다. 그러나 T3 척수는 갈비뼈와 흉추 가까이에 위치하며 수술 중 기흉의 위험이 증가합니다. 대부분의 생체 내 기술과 마찬가지로 T3 척추 등쪽 뿔 뉴런은 많은 실험에서 기록되지 않았습니다. 척수 안정성의 기록은 주로 척추 안정화 장치와 적절한 마취에 달려 있다16. 요추를 안정화하는 경향이 있는 시판되는 척추 클램프의 한계를 감안하여, 본 문서에서는 처음에 흉추에 맞도록 척추 클램프를 수정하였습니다. 변형된 척추 클램프는 한 쌍의 Adson 집게, 금속 캡, 둥근 막대, 너트 및 나사로 구성됩니다. Narishige STS-B 및 SR 장치에 맞춤형 클램퍼를 장착한 후 쥐의 척추를 안정화하고 조직 이동을 방지할 수 있었습니다. 척수의 등쪽 뿔 전극을 위한 충분한 공간이 남아 있었습니다.
많은 연구에서 침술이 시상하부, 중뇌, 수질 부위의 조절을 통해 심혈관 질환에 치료 효과를 발휘할 수 있다고 보고했지만, 척수에 대한 관심은 적었다17. 더욱이, 연구자들은 기능적 전략 대신 분자적 전략을 통해 신경조절 메커니즘을 입증하는 데 익숙하다18. 심장 병태생리학에서 SDHN의 중추적인 기능과 침술의 효과에 대한 참여를 고려할 때, 침술이 기능적 수준에서 SDHN 활성의 조절을 통해 심장 기능에 영향을 미치는 과학적 메커니즘을 명확히 하기 위한 강력한 분석 방법을 개발하는 것이 필수적입니다. Li 등은 T1 등쪽 신경절 뉴런 칼슘 영상과 ECG를 동시에 기록하는 방법을 보고했으나 칼슘 영상의 시간 해상도가 낮고 밀리초 수준에서 DRG 전기 신호와 ECG 신호의 결합을 감지할 수 없다9.
SDH 전기생리학적 기록과 관련하여, Qin 등은 SDHN 활성과 ECG를 동시에 기록하였으나19, 단전극 기록 방법으로 인해 기록 플럭스가 낮았다. 따라서 본 연구에서는 고처리량 뉴런 방전 신호와 ECG 신호를 동시에 얻기 위해 ECG 기록과 결합된 MEA 전기생리학을 사용했습니다. 이를 바탕으로 NTS 뉴런 방전과 ECG 신호의 결합 정도를 분석하기 위한 분석 방법을 참조하고, MATLAB20을 통해 척수 뉴런 방전과 ECG 신호의 결합 정도를 설명하는 분석 코드를 작성한다. 리모델링은 상용 겸자를 사용하여 이루어졌기 때문에 클램핑 암의 모양은 향후 흉추의 모양에 따라 설계되어 붓기를 줄여 더 나은 고정 효과를 얻을 수 있도록 해야 합니다. 이 접근 방식은 뉴런 역학을 연구하기 위한 강력한 도구를 제공하지만 분자적으로 정의된 뉴런의 대규모 집단을 측정하는 데에는 몇 가지 제한 사항도 있습니다. 앞으로 전기생리학적 방법과 광학적 방법의 결합은 침술의 과학적 기초에 대한 이해를 심화하는 데 매우 중요할 수 있습니다.
내부수용체(Interoception)와 내부 장기에 대한 신경계의 조절은 항상 신경과학 연구의 초점이었다21,22. 침술과 같은 신체 표면 자극은 신체 구심성을 활성화하고 신경 활동과 내장 기능 변화를 조절할 수 있다23. 연구에 따르면 심장 내장 통각 정보는 흉부 분절의 척추 등쪽 뿔로 예비 전달됨 1-524. 척수 자극은 또한 난치성 협심증을 치료하는 것으로 나타났으며, 이는 해당 척수의 신경망 조절이 심장 통증을 완화할 수 있음을 나타냅니다. 그러나 우리가 아는 한, 심장 통증 중 척추 뉴런의 활동 변화와 말초 자극의 기저에 있는 척추 메커니즘은 잘 알려져 있지 않습니다. 본 연구에서는 T3 SDHN 방전 신호와 ECG 신호를 동시에 획득하고 분석하는 방법에 대해 자세히 설명한다. 이 방법은 침술 및 기타 말초 자극이 척수의 심혈관 뉴런에 미치는 조절 효과에 대한 중요한 통찰력을 제공합니다. 또한, 자율신경 반사 메커니즘을 통한 침술의 표적 장기 효과에 대한 실질적인 통찰력을 제공합니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
본 연구는 중국국가자연과학재단(National Natural Science Foundation of China, No.82330127, No.82105029), 중국 국가핵심연구개발프로그램(National Key R&D Program of China, No.2022YFC3500702), 중앙공공복지연구소 기초연구기금(No. ZZ-2023008) 및 성급 교육부 프로젝트(No. 2019JM-027)를 통해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Anesthesia System | Kent Scientific | SomnoSuite | |
| Central v6.5 | Black Microsystems | Cerebus-128 | |
| Fine Scissors | Fine Scissors | Fine Scissors | |
| Friedman-Pearson Rongeurs | Fine Science T ools | 16220-14 | |
| Gelatin Sponges | Coltene | 274-007 | |
| Intubation Cannula | Harward Apparatus | 73-2737 | |
| Isoflurane | RWD | R510 | |
| LabChart Professional Software | LabChart Professional Software | Version 8.0 | |
| microband electrode array | Neuronexus | A1x32-6mm-50-177 | |
| micromanipulator | Narishige | DMA-1510 | |
| needles | Zhongyantaihe | 0.25 mm x 0.25 mm | |
| NeuroExplorer software (V5.0) | Plexon | V5.0 | |
| offline Sorter | Plexon | V4.0 | |
| Powerlab | ADInstruments | PL26T04 | |
| rats | the Experimental Center of the Academy of Military Medical Sciences of the People's Liberation Army of China | ||
| Spinal Adaptor | N/A | N/A | Custom made |
| Spring Scissors | Fine Science Tools | 15023-10 | |
| stereotactic instrument | Narishige | SR-5R-HT |
참고문헌
- Nakahara, H., Ueda, S. Y., Kawai, E., Higashiura, R., Miyamoto, T. Effects of pre-exercise acupuncture stimulation on heart rate response during short-duration exercise. BMC Sports Sci Med Rehabil. 13 (1), 129(2021).
- de Lima Pimentel, R., Duque, A. P., Moreira, B. R., Rodrigues, L. F. J. Acupuncture for the treatment of cardiovascular diseases: A systematic review. J Acupunct Meridian Stud. 12 (2), 43-51 (2019).
- Ma, Q. A functional subdivision within the somatosensory system and its implications for pain research. Neuron. 110 (5), 749-769 (2022).
- Hsieh, M. T., Donaldson, L. F., Lumb, B. M. Differential contributions of A- and C-nociceptors to primary and secondary inflammatory hypersensitivity in the rat. Pain. 156 (6), 1074-1083 (2015).
- Meyr, A. J., Steinberg, J. S. The physiology of the acute pain pathway. Clin Podiatr Med Surg. 25 (3), 305-326 (2008).
- Ardell, J. L. Heart failure: Mechanisms of spinal cord neuromodulation for heart disease. Nat Rev Cardiol. 13 (3), 127-128 (2016).
- Xi, H., et al. Continuous peripheral electrical nerve stimulation improves cardiac function via autonomic nerve regulation in MI rats. Heart Rhythm. 21 (10), 2010-2019 (2024).
- Cui, X., et al. Referred somatic hyperalgesia mediates cardiac regulation by the activation of sympathetic nerves in a rat model of myocardial ischemia. Neurosci Bull. 38 (4), 386-402 (2022).
- Li, X., et al. In vivo thoracic dorsal root ganglia (DRG) calcium imaging and ECG recording for studying reripheral nerve stimulation. J Vis Exp. (210), e67283(2024).
- Azhar, A., El-Bassossy, H. M. Pentoxifylline alleviates cardiac ischemia and dysfunction following experimental angina in insulin resistance. PLoS One. 9 (5), e98281(2014).
- Liu, X., Zhang, Q., Han, M., Du, J. Intrapericardial capsaicin and bradykinin induce different cardiac-somatic and cardiovascular reflexes in rats. Auton Neurosci. 198, 28-32 (2016).
- Metropolis, N., Ulam, S. The Monte Carlo method. J Am StatAssoc. 44 (247), 335-341 (1949).
- Coote, J. H., Chauhan, R. A. The sympathetic innervation of the heart: Important new insights. Auton Neurosci. 199, 17-23 (2016).
- Sun, X. Y., et al. Inhibitory effect of acupoint electrostimulation with different layers and intensities on muscular inflammatory pain and spinal WDR neuron activity. Zhen Ci Yan Jiu. 49 (2), 103-109 (2024).
- Duan-Mu, C. L., et al. Electroacupuncture-induced muscular inflammatory pain relief was associated with activation of low-threshold mechanoreceptor neurons and inhibition of wide dynamic range neurons in spinal dorsal horn. Front Neurosci. 15, 687173(2021).
- Davalos, D., Akassoglou, K. In vivo imaging of the mouse spinal cord using two-photon microscopy. J Vis Exp. (59), e2760(2012).
- Li, P. Neural mechanisms of the effect of acupuncture. International Congress Series. 1238, 71-77 (2002).
- Wu, X. L., et al. Acupuncture modulation of the ACE/Ang II/AT1R and ACE2/Ang(1-7)/MasR pathways in the rostral ventrolateral medulla reduces sympathetic output and prevents cardiac injury caused by SHR hypertension. Neuroreport. 35 (13), 839-845 (2024).
- Qin, C., Farber, J. P., Foreman, R. D. Gastrocardiac afferent convergence in upper thoracic spinal neurons: a central mechanism of postprandial angina pectoris. J Pain. 8 (6), 522-529 (2007).
- Yao, Y., et al. Cardiovascular baroreflex circuit moonlights in sleep control. Neuron. 110 (23), 3986-3999.e6 (2022).
- Liu, S., et al. Somatotopic organization and intensity dependence in driving distinct NPY-expressing sympathetic pathways by electroacupuncture. Neuron. 108 (3), 436-450.e7 (2020).
- Liu, S., et al. A neuroanatomical basis for electroacupuncture to drive the vagal-adrenal axis. Nature. 598 (7882), 641-645 (2021).
- Ma, Q. Somatotopic organization of autonomic reflexes by acupuncture. Curr Opin Neurobiol. 76, 102602(2022).
- Wang, J., et al. Spinal cord stimulation reduces cardiac pain through microglial deactivation in rats with chronic myocardial ischemia. Mol Med Rep. 24 (6), 835(2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유