Method Article
Studio dei profili codificanti della stimolazione somatica sulle risposte neuronali bloccate cardiache nel corno dorsale spinale del ratto
In questo articolo
Riepilogo
Descriviamo un protocollo per la registrazione extracellulare multicanale spinale insieme alla registrazione della funzione cardiaca e all'analisi dei neuroni del corno dorsale spinale bloccati nel cuore. Questo metodo offre un quadro temporalmente sincronizzato per lo studio dei meccanismi spinali alla base dei cambiamenti funzionali viscerali toracici indotti dall'agopuntura.
Abstract
Molti studi hanno suggerito che l'elettroagopuntura può essere utile nel trattamento e nella prevenzione delle malattie cardiovascolari. Tuttavia, il suo meccanismo rimane poco compreso. Il corno dorsale spinale toracico (SDH) svolge un ruolo importante nell'integrazione e nella modulazione degli input somatici e viscerali, che possono quindi influenzare il controllo cardiaco. A differenza dell'SDH lombare, che è stato ampiamente studiato, l'SDH toracico è stato meno esplorato a causa della difficoltà di esposizione chirurgica e della fissazione stereotassica. In questo studio, forniamo un approccio generale per il monitoraggio simultaneo dell'attività neuronale e della funzione cardiaca combinando la registrazione di elettrocardiogrammi e array di microelettrodi. Inoltre, descriviamo come identificare i neuroni bloccati dal cuore calcolando la distribuzione della frequenza di attivazione dell'attività neuronale in sincronia con i battiti cardiaci. La strategia è di grande importanza per studiare la correlazione tra funzione cardiovascolare e attività neuronale, nonché per comprendere il riflesso somatocardiaco innescato dalle stimolazioni dei nervi periferici.
Introduzione
L'agopuntura o stimolazione della superficie corporea, come tecnica terapeutica di spicco nell'ambito della Medicina Tradizionale Cinese (MTC), agisce stimolando aree specifiche della superficie corporea. Facilita la regolazione multilivello delle funzioni dell'organismo attraverso la regolazione delle funzioni viscerali attraverso vie afferenti, integrazione centrale e meccanismi nervosi efferenti autonomi. Al centro di questa terapia c'è il concetto che la stimolazione mirata di agopunti anatomicamente definiti induce una regolazione fisiologica sistemica. Crescenti evidenze cliniche supportano il ruolo dell'agopuntura come modalità complementare nella gestione dei disturbi cardiovascolari, con efficacia dimostrata sia nella prevenzione primaria che nei protocolli di trattamento aggiuntivo 1,2.
Le afferenze primarie dei neuroni sensoriali terminano prevalentemente nel corno dorsale spinale (SDH), corrispondentemente, i neuroni del corno dorsale spinale (SDHN) svolgono un ruolo cruciale nell'integrazione e nella modulazione degli input somatici 3,4,5. Inoltre, gli SDHRN ricevono anche afferenze cardiache e trasmettono informazioni viscerali ai neuroni pregangliari simpatici spinali (SPN) per la modulazione cardiovascolare6. Gli SPN bloccati nel cuore si trovano nell'angolo laterale del segmento toracico del midollo spinale (T1-T5), con assoni che sporgono verso i gangli cervicali o toracici e successivamente innervano il cuore attraverso i nervi cardiaco, medio e inferiore. Di conseguenza, il midollo spinale toracico svolge un ruolo cruciale nell'integrazione e nella modulazione degli input somatici e viscerali, che possono quindi influenzare il controllo cardiaco. È quindi importante capire come la stimolazione somatica regoli la funzione cardiaca attraverso la modulazione delle SDHRN nel segmento toracico del midollo spinale.
Studi precedenti hanno dimostrato che l'elettroagopuntura al PC6 (organizzata nel segmento spinale T3 come unità omotopica struttura-funzione) può alleviare i sintomi dell'ischemia miocardica attraverso la modulazione del sistema nervoso autonomo 7,8,9. Tuttavia, la sincronizzazione quantitativa in tempo reale degli effetti dell'agopuntura sulla frequenza cardiaca con l'attività del sistema nervoso non è ancora stata realizzata. Sono stati documentati solo l'attività nervosa autonomica immediata e gli indicatori dell'elettrocardiogramma (ECG) dopo l'agopuntura. La ricerca che collega gli SDHN con le funzioni fisiologiche viscerali rimane scarsa. A causa della curvatura fisiologica delle vertebre toraciche e dello spazio ristretto tra i segmenti vertebrali toracici adiacenti, in particolare T1-T5, l'accesso a queste aree è difficile, con conseguenti scarse prove dirette per chiarire i meccanismi spinali alla base dell'agopuntura all'agopuntura omotopica spinale T3 PC6 che regola la funzione cardiaca nel trattamento delle CVD.
Per comprendere meglio la relazione tra SDH e regolazione della funzione cardiaca mediata dall'agopuntura, è necessario implementare la registrazione sincrona della funzione cardiaca e delle attività neurali. Qui, forniremo un approccio generale per la registrazione extracellulare multicanale spinale insieme alla registrazione della funzione cardiaca, nonché all'analisi delle SDHRN bloccate cardiache. Questo metodo offre un quadro temporalmente sincronizzato per lo studio dei meccanismi spinali alla base dei cambiamenti funzionali viscerali toracici indotti dall'agopuntura.
Protocollo
Il protocollo dell'esperimento sugli animali ha aderito rigorosamente ai requisiti dello standard nazionale "Linee guida per la revisione etica del benessere degli animali da laboratorio" (GB/T 35892-2018) ed è stato approvato dal Comitato Etico dell'istituto. In questo studio sono stati utilizzati ratti maschi Sprague-Dawley (SD) di grado SPF, di età compresa tra 6 e 8 settimane e del peso di circa 220 g. Camici da laboratorio, guanti e maschere sono stati indossati durante tutti gli esperimenti. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali. Al termine dell'esperimento, i ratti sono stati soppressi tramite perfusione cardiaca in anestesia profonda seguita da lussazione cervicale.
1. Configurazione preoperatoria
- Collegare il circuito del ventilatore al tubo endotracheale a forma di Y, garantendo un'interfaccia sicura ed ermetica.
- Verificare la corretta ventilazione confermando il flusso d'aria stabile, il volume corrente appropriato e le impostazioni della frequenza respiratoria sul display del ventilatore.
- Garantire l'assenza di condensa o particelle contaminanti all'interno del tubo esaminando visivamente tutti i segmenti in condizioni di illuminazione intensa.
- Alimenta simultaneamente i segnali ECG amplificati sia nell'ingresso dell'elettrocardiografo che nella porta di ingresso analogica del sistema di registrazione dell'array di microelettrodi utilizzando un connettore BNC a tre vie.
- Instradare i segnali amplificati attraverso uno splitter BNC a tre vie per collegare contemporaneamente l'ingresso analogico dell'elettrocardiografo e la porta di ingresso analogica del sistema di registrazione dell'array di microelettrodi.
- Stabilire i trigger di sincronizzazione collegando l'uscita TTL dell'elettrocardiografo all'ingresso digitale del sistema di registrazione dell'array di microelettrodi. Utilizzando un cavo di interfaccia BNC-Dupont, avviare l'acquisizione simultanea su entrambi i sistemi, verificando l'allineamento temporale.
2. Preparazione preoperatoria
- Anestetizzazione
- Indurre l'anestesia con isoflurano al 3-5% per inalazione e quindi somministrare un'iniezione intraperitoneale di pentobarbital sodico (50 mg/kg) al ratto anestetizzato. Somministrare isoflurano per anestesia per inalazione prima di posizionare gli elettrodi, mantenendo una concentrazione di ~1,2%. Procedere solo se Valutare la profondità dell'anestesia tramite un pizzico di dita dei piedi prima di procedere.
- Rimuovi i peli dal collo anteriore e dalla parte posteriore dei ratti.
- Posiziona il ratto in posizione supina su una coperta riscaldante e applica un unguento sugli occhi del ratto per evitare che si secchi. Osservare la frequenza respiratoria e verificare le risposte di ritiro esercitando pressione sul poggiapiedi con una pinza.
3. Intubazione tracheale
- Metti i ratti in posizione supina e disinfetta la zona del collo con tintura di iodio.
- Eseguire un'incisione longitudinale di circa 1 cm lungo la linea mediana del collo e sezionare senza mezzi termini il tessuto muscolare.
- Una volta esposta la ghiandola tiroidea, separare accuratamente la sottile membrana tra i due lobi tiroidei, facendo attenzione a non danneggiare il tessuto tiroideo. Procedere con l'esposizione della trachea.
- Esamina la "cannula a forma di Y" per confermare che sia completamente asciutta. Utilizzare le forbici a molla per praticare un'incisione trasversale nella trachea, seguita dall'inserimento della cannula nell'apertura tracheale. Fissare la cannula tracheale con suture 3-0 non assorbibili per evitare perdite d'aria ed estubazioni accidentali.
- Sutura con cura i muscoli del collo e la pelle e collega il ratto a un ventilatore. Regolare la frequenza respiratoria a 85 respiri/min e il volume corrente a 3,5 ml, in base al peso corporeo del ratto7 (Figura 1B).
4. Rilevamento ECG
- Inserire tre elettrodi nella pelle del ratto: l'elettrodo positivo nell'arto inferiore sinistro, l'elettrodo negativo nell'arto superiore destro e l'elettrodo di terra nell'arto inferiore destro10.
- Acquisizione dei dati tramite elettrocardiografo (impostazioni del filtro: passa-basso a 100 Hz, passa-alto a 1 kHz; frequenza di campionamento: 4 kHz/s). Utilizzare il software di registrazione ECG per registrare, salvare e analizzare i dati.
5. Cateterismo pericardico per somministrazione di farmaci bradichinina (BK)
- Metti il ratto in posizione supina e disinfetta la pelle del torace con iodio.
- Eseguire una toracotomia tra la 1a e la 3a cartilagine costale sulla parte superiore sinistra del torace per esporre il timo. Sezionare bruscamente il timo lungo la linea mediana per esporre il pericardio (vedi Figura 1C, D).
- Utilizzare la punta di un ago da dissezione in vetro (0,5 mm di diametro) per praticare una piccola apertura nel pericardio.
- Inserire un catetere in silicone, lungo 10-15 cm, con diversi piccoli fori all'estremità distale attraverso l'incisione nel pericardio. Fissare il catetere al tessuto della parete toracica utilizzando la biocolla.
- Chiudere la cavità toracica strato per strato, assicurandosi che la respirazione del ratto rimanga libera (vedi Figura 1D).
6. Esposizione del midollo spinale T3
- Posizionare il ratto in posizione prona ed eseguire la disinfezione di routine con iodio. Praticare un'incisione di circa 8 cm lungo la linea mediana della schiena dalle vertebre T2 a T6.
- Usa le forbici a molla per tagliare la pelle e gli strati muscolari, compreso il muscolo trapezio. Inserire un divaricatore tra i muscoli per esporre ulteriormente il campo chirurgico.
- Separare attentamente il grasso e le ghiandole di ibernazione nella parte anteriore delle vertebre toraciche del ratto, evitando i vasi sanguigni sotto le ghiandole (vedi Figura 1E).
- Rimuovere i muscoli che si attaccano al morsetto per la testa e la parte diritta dei muscoli lunghi del collo, esponendo i processi spinosi di T2.
- Spostare i muscoli semispinali e spinali per esporre l'arco vertebrale da T2 a T6 (vedi Figura 1E). Utilizzare i rongeurs per rimuovere il processo spinoso della vertebra T3, esponendo così il midollo spinale T3.
NOTA: Durante il processo di esposizione delle vertebre toraciche, assicurarsi che venga prestata particolare attenzione alla conservazione del processo spinoso di T2, poiché funge da punto di applicazione della forza principale per la successiva esposizione del midollo spinale T3. - Rimuovere la dura madre e la membrana aracnoidea e gocciolare olio di paraffina sulla superficie del midollo spinale per mantenere la vitalità dei neuroni spinali (vedi Figura 1F).
NOTA: I vasi sanguigni del tessuto adiposo bruno del ratto hanno origine dalla lamina T3, T4 o T5 e sono distribuiti come un seno venoso. Fare attenzione a non toccarli, poiché ciò potrebbe causare un'eccessiva perdita di sangue nel ratto.
7. Fissazione e impostazioni delle vertebre toraciche
- Usa un morsetto spinale personalizzato per fissare i processi articolari di T2 e T6. Inumidire i muscoli circostanti con soluzione salina per mantenere l'idratazione.
- Collegare l'array di elettrodi al micromanipolatore di uno strumento stereotassico e inserirlo verticalmente nel corno dorsale del midollo spinale in corrispondenza del segmento spinale T3 attraverso il solco mediano dorsale, 500 μm lateralmente alla linea mediana, a una profondità di 1.500 μm.
- Inserire l'elettrodo di riferimento nel muscolo della schiena (vedere la Figura 1G).
- Avvia il software di registrazione extracellulare multicanale e vai su File | Configurazione hardware; selezionare l'array a 32 canali dall'elenco dell'interfaccia del dispositivo; fare clic con il pulsante destro del mouse sul gruppo di canali selezionato; , quindi scegliere Proprietà dal menu contestuale . Configurare i parametri di elaborazione del segnale: Nella scheda Filtro , impostare il filtro passa-banda (BP) su 250 Hz - 5 kHz; nel campo Frequenza di campionamento , immettere 30 kHz/s; abilitare gli algoritmi di rilevamento dei picchi selezionando la casella Abilita elaborazione picchi per attivare l'ordinamento dei picchi in tempo reale e l'estrazione degli eventi basata su soglia.
NOTA: Garantire una completa pulizia dei muscoli e dei tessuti che circondano i processi articolari di T2 e T6, specialmente nella regione in cui viene applicato il morsetto spinale personalizzato per la fissazione spinale, per prevenire lo spostamento durante gli esperimenti successivi.
8. Stimoli somatici e BK
- Utilizzare BK (1 μg/mL in acqua distillata) per indurre la stimolazione nocicettiva cardiaca. Iniettare 4 μl della soluzione di BK con una micro-siringa collegata a un catetere in silicone con diverse piccole aperture11.
- Osservare le variazioni della frequenza cardiaca (aumenti o diminuzioni) e della secrezione neuronale (aumenti o diminuzioni) nel corno dorsale del midollo spinale T3 entro 30 minuti dall'iniezione per identificare le interazioni dinamiche tra i neuroni del corno dorsale del midollo spinale toracico.
- Eseguire l'agopuntura manuale al punto di agopuntura PC6 (MAPC6) utilizzando il parametro di stimolazione di 1 Hz. PC6 (punto di Neiguan) si trova a 2 mm prossimalmente all'articolazione carpale sull'avambraccio ventrale, tra il flessore radiale del carpo e il tronco nervoso mediano. Inserire gli aghi (0,25 mm x 25 mm) nei punti di agopuntura PC6 a una profondità di ~3 mm. Confrontare i cambiamenti nell'attività neuronale e nella funzione cardiaca prima e dopo gli stimoli somatici.
9. Analisi ed elaborazione dei dati
- Importa i dati neurali registrati in formato ns6 nel software come segue:
- Conversione file: vai su File | Apri per caricare il file ns6. Seleziona File | Salva con nome e scegli il formato .nex5 per generare dati standardizzati del treno spike.
- Ordinamento delle punte: Importa i file .nex5 convertiti nel software di classificazione per la classificazione neuronale. Ordina le forme d'onda dei picchi in base alle caratteristiche della forma d'onda e all'analisi dei componenti principali (PCA), con parametri di soglia impostati a ±3 SD dal rumore di base.
- Quindi, eseguire il codice pertinente per filtrare e classificare i segnali.
- Analizza gli SDRN con blocco cardiaco.
- Prendendo l'onda R come evento di riferimento, conta il numero di attivazioni dei neuroni entro una finestra di 0,2 s prima e dopo ogni onda R.
- Dopo aver contato le onde R a intervalli di 50 ms, creare un istogramma dell'evento ad anello. Normalizzare l'istogramma (cioè sottrarre la velocità di scarica media in 0,2 secondi prima e dopo l'evento dell'onda R) per ottenere la distribuzione della velocità di scarica dell'attività di ciascun neurone durante il battito cardiaco.
- Valuta la significatività statistica tramite il test di permutazione Monte Carlo12 , implementato con 1.000 iterazioni mescolate. Ottenere la distribuzione della frequenza di attivazione e l'intervallo di confidenza del neurone nel processo del battito cardiaco randomizzato randomizzando 0,2 s del tempo prima e dopo ogni onda R del battito cardiaco (l'intervallo è ± 0,1 s). Se la distribuzione di attivazione del battito cardiaco di un neurone supera (maggiore o minore) l'intervallo di confidenza del 95% della distribuzione della frequenza di attivazione del processo di battito cardiaco randomizzato, identificare il neurone come un neurone bloccato cardiaco (vedere File supplementare 1).
Risultati
Seguendo il protocollo di cui sopra, gli SDHN T3 sono stati esposti, con bradichinina (BK) o needling somatico somministrato alle regioni pericardiche/agopunturali. Questa indagine ha quantificato i profili di attivazione neuronale evocati dallo stimolo (tipo/frequenza) e le concomitanti variazioni elettrocardiografiche (ECG) durante l'input viscerale nocicettivo, l'applicazione di BK e la modulazione somatosensoriale.
La Figura 2A mostra una fetta trasversale del midollo spinale T3 del ratto. Sul lato sinistro, illustra la distribuzione delle lamine distinte. Il lato destro mostra le regioni arancioni che rappresentano la distribuzione del colorante Dil dopo un periodo di incubazione di 10 minuti. Un elettrodo array, impregnato di colorante Dil, è stato fissato al micromanipolatore di un apparato stereotassico. Gli elettrodi sono stati quindi inseriti verticalmente nel corno dorsale del midollo spinale, 500 μm lateralmente al solco mediano posteriore al segmento T3, a una profondità di 1.500 μm, con regolazioni della profondità effettuate in base al peso corporeo del ratto. Dopo un periodo di registrazione di 15 minuti, sono state condotte la perfusione e la raccolta dei tessuti, durante le quali gli elettrodi hanno registrato i segnali dalle lamine I a VIII del midollo spinale di ratto. La Figura 2B-D presenta i grafici raster, le forme d'onda, l'analisi delle componenti principali (PCA) e l'autocorrelazione dei neuroni registrati dal canale 19. Le figure 2F,G mostrano dati analoghi per tre neuroni registrati dal canale 11. I dati provenienti da questi due canali indicano una chiara classificazione dei neuroni, fornendo dati autentici per la successiva analisi di correlazione.
Le colonne blu mostrano il numero cumulativo di scariche neuronali in un certo lasso di tempo, sottratto dal valore medio. La Figura 3A mostra una registrazione di base (BL) per 60 s. I neuroni del canale 17c e del canale 21a dimostrano la presenza di neuroni cardiaci bloccati negli SDHN T3, che mostrano scariche periodiche distinte in risposta alle variazioni dell'ECG. La Figura 3B mostra l'effetto dell'applicazione di BK al pericardio nell'atrio sinistro sugli SDHN T3, insieme a un esempio di neuroni bloccati nel cuore. Il neurone del canale 17c ha mostrato una significativa riduzione del blocco cardiaco dopo la somministrazione di BK. Come illustrato nell'area ombreggiata in verde della Figura 3C, dopo la somministrazione di MAPC6, c'è un gruppo consistente di neuroni che mostrano un'attivazione periodica attorno all'onda R nei cicli di attivazione di entrambe le condizioni BL e MAPC6. Questo modello è più regolare rispetto alla cottura osservata dopo l'applicazione di BK. Al contrario, nella Figura 3D, il modello di attivazione dei neuroni dopo MAPC6 è meno distinto. Pertanto, MAPC6 può migliorare la frequenza di attivazione dei neuroni cardiaci nella cornea dorsale spinale T3, mantenendo così la funzione cardiaca in condizioni patologiche. La Figura 3E,F mostra che la frequenza di scarica degli SDHN T3 attivati da BK è diminuita dopo la stimolazione con agopuntura dell'agopunto PC6. Al contrario, la proporzione della frequenza di attivazione dei neuroni spinali T3 inibiti da BK è stata significativamente aumentata dopo la stimolazione con agopuntura dell'agopunto PC6.
È interessante notare che il canale 21a è identificato come un neurone cardiaco bloccato che mostra scariche periodiche e regolari specificamente in risposta all'onda P, che segna l'inizio della depolarizzazione atriale da parte del nodo senoatriale (SA), e l'intervallo PR, che indica il ritardo al nodo atrioventricolare. Sebbene non vi sia alcun cambiamento significativo nell'onda P nell'ECG, l'applicazione di BK determina una concentrazione di tre gruppi di neuroni tra ciascuna onda P e Q sull'ECG, dimostrando una relazione più stretta con l'onda P (come indicato dall'area ombreggiata viola nella Figura 3B). L'onda P sull'ECG è un indicatore importante che riflette la normalità delle onde di contrazione atriale e l'onda P generata dal nodo SA rappresenta il processo di depolarizzazione atriale, quindi è stato verificato l'effetto di BK sugli atri. Tuttavia, in seguito alla somministrazione di MAPC6, c'era un modello distinto nell'attivazione dei neuroni in relazione alle onde R e T. Dopo l'agopuntura, i neuroni sono tornati a un modello raggruppato associato all'onda P, indicando che l'agopuntura può trattare le malattie cardiache patologiche modulando il ritmo dei neuroni somatici e viscerali nello stesso segmento del corno dorsale spinale.

Figura 1: Procedura chirurgica del T3 SDH. (A) Ventilatore. (B) Intubazione della trachea nel ratto. (C) Anatomia del timo e del cuore. (D) Versare il timo nel pericardio. (E) T2-8 Vertebre toraciche dopo la rimozione. (F) Midollo spinale T3. (G) I morsetti delle vertebre spinali modificate. (H,I) Fissazione locale del morsetto spinale. (J,K) Un diagramma schematico della stimolazione somatica e viscerale; Durante la registrazione, i ratti erano in posizione supina e prona. Clicca qui per visualizzare una versione più grande di questa figura.
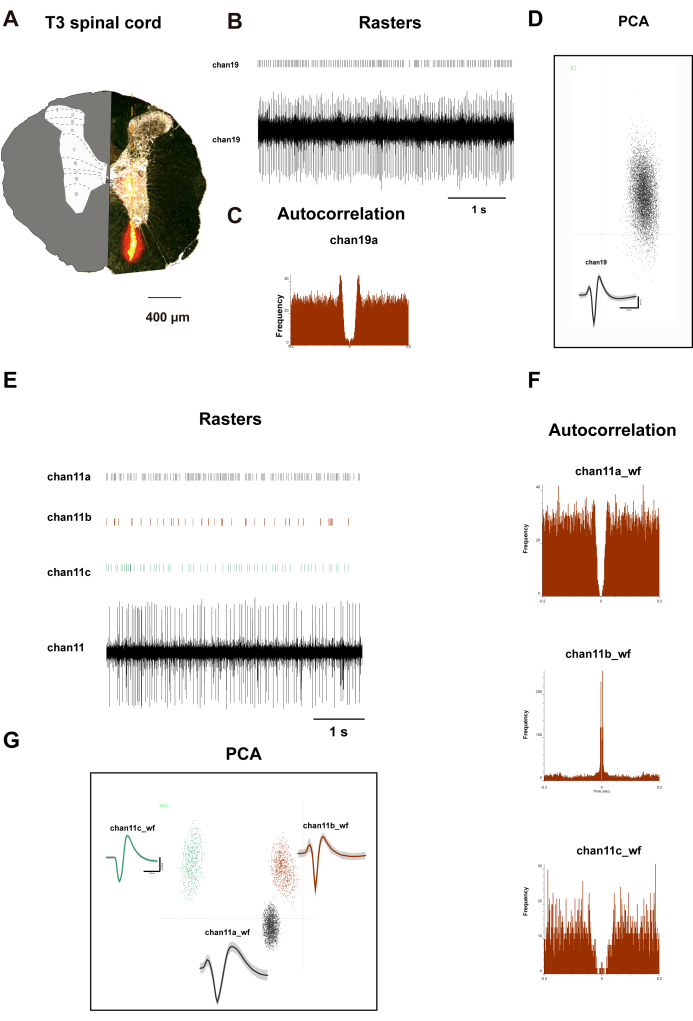
Figura 2: Neuroni del corno dorsale spinale T3 registrati. (A) Convalida del posizionamento degli elettrodi: Sezione trasversale del midollo spinale che mostra la traccia di impianto della sonda in silicone a 32 canali. Riquadro: Atlante del midollo spinale di ratto Paxinos modificato con confini citoarchitettonici delle lamine (I-X) sovrapposti per la registrazione spaziale. I grafici raffigurano i raster e le forme d'onda neuronali del canale 19 e del canale 11 (B,E), il clustering PCA (D,G) e il diagramma di cluster e le autocorrelazioni (C,F). I modelli a simmetria centrale raffigurati nei pannelli C e F mostrano i modelli di attivazione distintivi dei neuroni registrati sui neuroni del canale 19 e del canale 11. Clicca qui per visualizzare una versione più grande di questa figura.
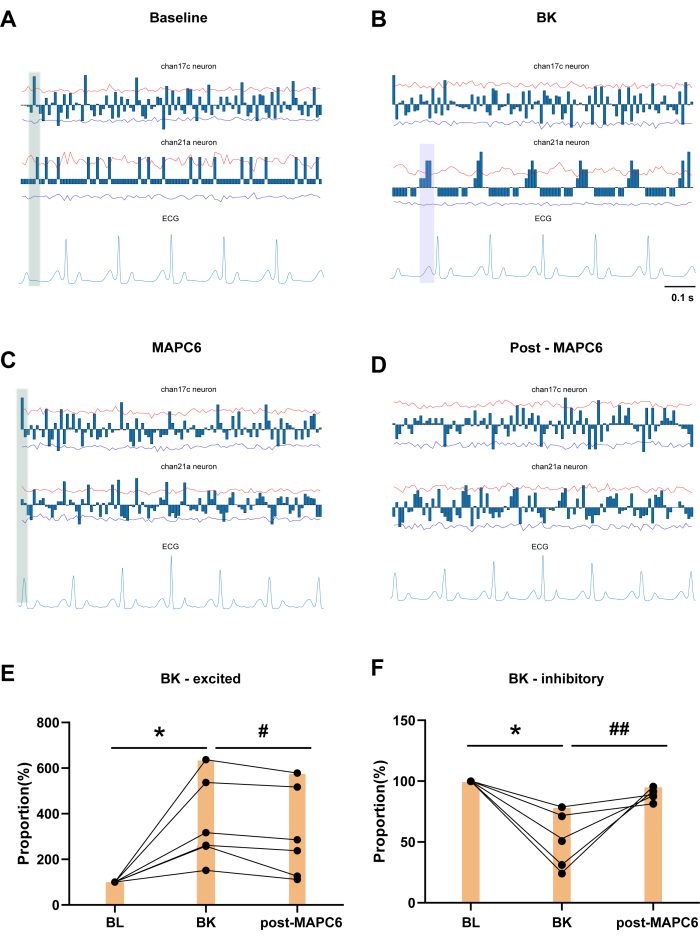
Figura 3: L'effetto dell'applicazione locale di BK al pericardio sui SDHN T3 ed esempio di neuroni bloccati nel cuore. (A) I neuroni del canale 17c e del canale 21a dimostrano la presenza di neuroni bloccati nel SDR T3. (B) Cambiamenti nel grado di blocco dopo la somministrazione di BK entro 30 minuti. (C,D) L'esempio del neurone cardiaco bloccato MAPC6 per 1 minuto e post MAPC6 per 1 minuto. (E,F) Variazione della proporzione di frequenza dei neuroni che rispondono a BK dopo MAPC6. Le barre di errore rappresentano la media ± SEM (N = 6). *P < 0,05, rispetto a BL. #P < 0,05, ##P < 0,01, rispetto a BK. È stato utilizzato un test t accoppiato. Abbreviazioni: BL = linea di base; BK = bradichinina; MAPC6= Agopuntura Manuale a Neiguan (PC6). Clicca qui per visualizzare una versione più grande di questa figura.
File supplementare 1: Analisi dell'attività neuronale bloccata dall'ECG. Nella riga 70: Modifica intervalli di tempo in condition={[t1_start,t1_end], [t2_start,t2_end], ...}. Regolare le etichette della fase sperimentale nella riga 71: conditiontitle = {'baseline','EA1','EA2'}; per allinearsi con gli intervalli di tempo definiti in Condizione. Clicca qui per scaricare questo file.
Discussione
La decodifica dei profili di codifica neuronale SDH è essenziale per comprendere il meccanismo neuromodulatorio dell'effetto terapeutico indotto dall'agopuntura sulla disfunzione viscerale. Qui, abbiamo combinato la tecnica di registrazione MEA in vivo con il sistema di registrazione ECG per registrare simultaneamente l'attività di scarica degli SDHN T3 e dell'ECG. La stimolazione del dolore cardiaco può attivare i nocicettori di tipo C che innervano il cuore e trasmettono informazioni nocicettive anteriormente attraverso i visceri, il DRG, il midollo spinale T1-T5 e il midollo sopraspinale. Le fibre afferenti simpatiche entrano nel corno dorsale, si trasmettono agli interneuroni e si proiettano ai neuroni pregangliari nel corno laterale del midollo spinale. Queste fibre pregangliari entrano nei rami comunicanti bianchi e si uniscono alla catena nervosa simpatica dove vengono convertite in neuroni postgangliari direttamente o verso l'alto fino al ganglio stellato (SG) e ai gangli cervicali inferiori e medi sinapsi con i neuroni postgangliari per controllare la frequenza cardiaca13.
Il meccanismo dell'agopunto PC6 nel trattamento delle malattie cardiovascolari è molto complesso e non è stato completamente rivelato. Attualmente, la via del riflesso somatosimpatico è considerata una delle vie più critiche. Questo studio esamina gli effetti regolatori dell'agopuntura al punto di agopuntura PC6 sui neuroni cardiaci bloccati e sbloccati all'interno del midollo spinale T3. In letteratura, le tecniche di registrazione MEA sono state utilizzate per registrare la scarica di neuroni (wide-dynamic range [WDR]) nell'SDH14,15. Tuttavia, il midollo spinale T3 è situato vicino alle costole e alle vertebre toraciche e rappresenta un aumentato rischio di pneumotorace durante le procedure chirurgiche. Come con la maggior parte delle tecniche in vivo, i neuroni del corno dorsale spinale T3 non sono registrati in molti esperimenti. La stabilità del midollo spinale dipende in gran parte dai dispositivi di stabilizzazione spinale e da un'anestesia appropriata16. Data la limitazione dei morsetti spinali commerciali, che sono inclini a stabilizzare la colonna lombare, abbiamo qui modificato il morsetto spinale per adattarlo inizialmente alla colonna vertebrale toracica. I morsetti per vertebre spinali modificati sono costituiti da un paio di pinze Adson, un cappuccio metallico, una barra tonda, dadi e viti. Dopo aver montato i morsetti su misura sul dispositivo Narishige STS-B e SR, siamo stati in grado di stabilizzare la colonna vertebrale del ratto e prevenire lo spostamento dei tessuti. È stato lasciato spazio sufficiente per l'elettrodo del corno subdorsale del midollo spinale.
Sebbene molti studi abbiano riportato che l'agopuntura potrebbe esercitare i suoi effetti terapeutici sulle malattie cardiovascolari attraverso la modulazione delle regioni ipotalamiche, mesencefaliche e midollari, è stata prestata meno attenzione al midollo spinale17. Inoltre, i ricercatori sono abituati a dimostrare il suo meccanismo neuromodulatorio attraverso strategie molecolari anziché funzionali18. Considerando la funzione fondamentale delle SDHN nella fisiopatologia cardiaca e la loro partecipazione agli effetti dell'agopuntura, è imperativo sviluppare un solido metodo analitico per chiarire i meccanismi scientifici attraverso i quali l'agopuntura influenza la funzione cardiaca attraverso la modulazione dell'attività di SDHN a livello funzionale. Sebbene Li et al. abbiano riportato il metodo di registrazione simultanea dei neuroni del calcio dei gangli della radice dorsale T1 e dell'ECG, la risoluzione temporale dell'imaging del calcio è bassa e l'accoppiamento del segnale elettrico DRG e del segnale ECG a livello di millisecondi non può essere rilevato9.
In termini di registrazione elettrofisiologica SDH, Qin et al. hanno registrato l'attività SDHN e l'ECG contemporaneamente19, ma il flusso di registrazione era basso a causa del metodo di registrazione a elettrodo singolo. Pertanto, in questo studio, abbiamo utilizzato l'elettrofisiologia MEA combinata con la registrazione ECG per ottenere contemporaneamente segnali di scarica neuronale ad alto rendimento e segnali ECG. Su questa base, ci riferiamo al metodo di analisi per analizzare il grado di accoppiamento tra la scarica dei neuroni NTS e il segnale ECG, e scriviamo il codice di analisi che descrive il grado di accoppiamento tra la scarica dei neuroni del midollo spinale e il segnale ECG attraverso MATLAB20. Poiché il rimodellamento è stato ottenuto utilizzando pinze commerciali, la forma del braccio di serraggio dovrebbe essere progettata seguendo la forma della vertebra toracica in futuro per ridurre il gonfiore e ottenere un migliore effetto di fissaggio. Sebbene questo approccio fornisca un potente strumento per studiare la dinamica neuronale, ci sono anche alcune limitazioni nella misurazione di grandi popolazioni di neuroni definiti molecolarmente. In futuro, la combinazione di metodi elettrofisiologici e ottici potrebbe essere di grande importanza per approfondire la nostra comprensione delle basi scientifiche dell'agopuntura.
L'interocezione e la regolazione del sistema nervoso sugli organi interni sono sempre state al centro della ricerca neuroscientifica21,22. La stimolazione della superficie corporea come l'agopuntura può attivare l'afferenza fisica e modulare l'attività nervosa e i cambiamenti della funzione viscerale23. Gli studi hanno dimostrato che le informazioni nocicettive viscerali cardiache vengono trasmesse preliminarmente al corno dorsale spinale dei segmenti toracici 1-524. È stato anche dimostrato che la stimolazione del midollo spinale tratta l'angina pectoris refrattaria, indicando che la modulazione della rete neurale nel midollo spinale corrispondente può alleviare il dolore cardiaco. Tuttavia, per quanto ne sappiamo, i cambiamenti nell'attività dei neuroni spinali durante il dolore cardiaco e il meccanismo spinale alla base della stimolazione periferica non sono ben compresi. Questo studio descrive in dettaglio un metodo per l'acquisizione e l'analisi simultanea dei segnali di scarica SDHN T3 e dei segnali ECG. Questo metodo fornisce informazioni significative sugli impatti regolatori dell'agopuntura e di altri stimoli periferici sui neuroni cardiovascolari nel midollo spinale. Inoltre, fornisce informazioni sostanziali sugli effetti dell'agopuntura sugli organi bersaglio attraverso i meccanismi dei riflessi neurali autonomi.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo studio è stato sostenuto dalla National Natural Science Foundation of China (No.82330127, No.82105029), dal National Key R&D Program of China (No.2022YFC3500702) e dai Fondi di ricerca di base per gli Istituti centrali di ricerca sul benessere pubblico (No. ZZ-2023008) e il progetto del Dipartimento Provinciale dell'Istruzione (n. 2019JM-027).
Materiali
| Name | Company | Catalog Number | Comments |
| Anesthesia System | Kent Scientific | SomnoSuite | |
| Central v6.5 | Black Microsystems | Cerebus-128 | |
| Fine Scissors | Fine Scissors | Fine Scissors | |
| Friedman-Pearson Rongeurs | Fine Science T ools | 16220-14 | |
| Gelatin Sponges | Coltene | 274-007 | |
| Intubation Cannula | Harward Apparatus | 73-2737 | |
| Isoflurane | RWD | R510 | |
| LabChart Professional Software | LabChart Professional Software | Version 8.0 | |
| microband electrode array | Neuronexus | A1x32-6mm-50-177 | |
| micromanipulator | Narishige | DMA-1510 | |
| needles | Zhongyantaihe | 0.25 mm x 0.25 mm | |
| NeuroExplorer software (V5.0) | Plexon | V5.0 | |
| offline Sorter | Plexon | V4.0 | |
| Powerlab | ADInstruments | PL26T04 | |
| rats | the Experimental Center of the Academy of Military Medical Sciences of the People's Liberation Army of China | ||
| Spinal Adaptor | N/A | N/A | Custom made |
| Spring Scissors | Fine Science Tools | 15023-10 | |
| stereotactic instrument | Narishige | SR-5R-HT |
Riferimenti
- Nakahara, H., Ueda, S. Y., Kawai, E., Higashiura, R., Miyamoto, T. Effects of pre-exercise acupuncture stimulation on heart rate response during short-duration exercise. BMC Sports Sci Med Rehabil. 13 (1), 129(2021).
- de Lima Pimentel, R., Duque, A. P., Moreira, B. R., Rodrigues, L. F. J. Acupuncture for the treatment of cardiovascular diseases: A systematic review. J Acupunct Meridian Stud. 12 (2), 43-51 (2019).
- Ma, Q. A functional subdivision within the somatosensory system and its implications for pain research. Neuron. 110 (5), 749-769 (2022).
- Hsieh, M. T., Donaldson, L. F., Lumb, B. M. Differential contributions of A- and C-nociceptors to primary and secondary inflammatory hypersensitivity in the rat. Pain. 156 (6), 1074-1083 (2015).
- Meyr, A. J., Steinberg, J. S. The physiology of the acute pain pathway. Clin Podiatr Med Surg. 25 (3), 305-326 (2008).
- Ardell, J. L. Heart failure: Mechanisms of spinal cord neuromodulation for heart disease. Nat Rev Cardiol. 13 (3), 127-128 (2016).
- Xi, H., et al. Continuous peripheral electrical nerve stimulation improves cardiac function via autonomic nerve regulation in MI rats. Heart Rhythm. 21 (10), 2010-2019 (2024).
- Cui, X., et al. Referred somatic hyperalgesia mediates cardiac regulation by the activation of sympathetic nerves in a rat model of myocardial ischemia. Neurosci Bull. 38 (4), 386-402 (2022).
- Li, X., et al. In vivo thoracic dorsal root ganglia (DRG) calcium imaging and ECG recording for studying reripheral nerve stimulation. J Vis Exp. (210), e67283(2024).
- Azhar, A., El-Bassossy, H. M. Pentoxifylline alleviates cardiac ischemia and dysfunction following experimental angina in insulin resistance. PLoS One. 9 (5), e98281(2014).
- Liu, X., Zhang, Q., Han, M., Du, J. Intrapericardial capsaicin and bradykinin induce different cardiac-somatic and cardiovascular reflexes in rats. Auton Neurosci. 198, 28-32 (2016).
- Metropolis, N., Ulam, S. The Monte Carlo method. J Am StatAssoc. 44 (247), 335-341 (1949).
- Coote, J. H., Chauhan, R. A. The sympathetic innervation of the heart: Important new insights. Auton Neurosci. 199, 17-23 (2016).
- Sun, X. Y., et al. Inhibitory effect of acupoint electrostimulation with different layers and intensities on muscular inflammatory pain and spinal WDR neuron activity. Zhen Ci Yan Jiu. 49 (2), 103-109 (2024).
- Duan-Mu, C. L., et al. Electroacupuncture-induced muscular inflammatory pain relief was associated with activation of low-threshold mechanoreceptor neurons and inhibition of wide dynamic range neurons in spinal dorsal horn. Front Neurosci. 15, 687173(2021).
- Davalos, D., Akassoglou, K. In vivo imaging of the mouse spinal cord using two-photon microscopy. J Vis Exp. (59), e2760(2012).
- Li, P. Neural mechanisms of the effect of acupuncture. International Congress Series. 1238, 71-77 (2002).
- Wu, X. L., et al. Acupuncture modulation of the ACE/Ang II/AT1R and ACE2/Ang(1-7)/MasR pathways in the rostral ventrolateral medulla reduces sympathetic output and prevents cardiac injury caused by SHR hypertension. Neuroreport. 35 (13), 839-845 (2024).
- Qin, C., Farber, J. P., Foreman, R. D. Gastrocardiac afferent convergence in upper thoracic spinal neurons: a central mechanism of postprandial angina pectoris. J Pain. 8 (6), 522-529 (2007).
- Yao, Y., et al. Cardiovascular baroreflex circuit moonlights in sleep control. Neuron. 110 (23), 3986-3999.e6 (2022).
- Liu, S., et al. Somatotopic organization and intensity dependence in driving distinct NPY-expressing sympathetic pathways by electroacupuncture. Neuron. 108 (3), 436-450.e7 (2020).
- Liu, S., et al. A neuroanatomical basis for electroacupuncture to drive the vagal-adrenal axis. Nature. 598 (7882), 641-645 (2021).
- Ma, Q. Somatotopic organization of autonomic reflexes by acupuncture. Curr Opin Neurobiol. 76, 102602(2022).
- Wang, J., et al. Spinal cord stimulation reduces cardiac pain through microglial deactivation in rats with chronic myocardial ischemia. Mol Med Rep. 24 (6), 835(2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon