Method Article
Estudio de los perfiles codificantes de la estimulación somática en las respuestas neuronales bloqueadas por el corazón en el asta dorsal espinal de la rata
En este artículo
Resumen
Describimos un protocolo para el registro extracelular multicanal espinal junto con el registro de la función cardíaca y el análisis de las neuronas del asta dorsal espinal bloqueadas por el corazón. Este método ofrece un marco sincronizado temporalmente para estudiar los mecanismos de la columna vertebral que subyacen a los cambios funcionales viscerales torácicos inducidos por la acupuntura.
Resumen
Muchos estudios han sugerido que la electroacupuntura puede ser beneficiosa en el tratamiento y la prevención de las enfermedades cardiovasculares. Sin embargo, su mecanismo sigue siendo poco conocido. El asta dorsal espinal torácica (SDH) desempeña un papel importante en la integración y modulación de las entradas somáticas y viscerales, que luego pueden influir en el control cardíaco. A diferencia de la SDH lumbar, que ha sido ampliamente estudiada, la SDH torácica ha sido menos explorada debido a la dificultad en la exposición quirúrgica y la fijación estereotáxica. En este estudio, proporcionamos un enfoque general para monitorear simultáneamente la actividad neuronal y la función cardíaca mediante la combinación del registro de electrocardiogramas y matrices de microelectrodos. Además, describimos cómo identificar las neuronas bloqueadas por el corazón mediante el cálculo de la distribución de la tasa de disparo de la actividad neuronal en sincronía con los latidos del corazón. La estrategia es de gran importancia para estudiar la correlación entre la función cardiovascular y la actividad neuronal, así como para comprender el reflejo somatocardíaco desencadenado por las estimulaciones de los nervios periféricos.
Introducción
La acupuntura o estimulación de la superficie corporal, como técnica terapéutica destacada dentro del marco de la Medicina Tradicional China (MTC), opera estimulando áreas específicas de la superficie corporal. Facilita la regulación multinivel de las funciones del organismo a través de la regulación de las funciones viscerales a través de las vías aferentes, la integración central y los mecanismos nerviosos eferentes autónomos. Un elemento central de esta terapia es el concepto de que la estimulación dirigida de puntos de acupuntura definidos anatómicamente induce una regulación fisiológica sistémica. Cada vez hay más evidencia clínica que apoya el papel de la acupuntura como modalidad complementaria en el manejo de los trastornos cardiovasculares, con eficacia demostrada tanto en la prevención primaria como en los protocolos de tratamiento adyuvante 1,2.
Las aferencias primarias de las neuronas sensoriales terminan predominantemente en el asta dorsal espinal (SDH), en consecuencia, las neuronas del asta dorsal espinal (SDHN) juegan un papel crucial en la integración y modulación de las entradas somáticas 3,4,5. Además, las SDHRN también reciben aferencias cardíacas y transmiten información visceral a las neuronas preganglionares simpáticas espinales (SPN) para la modulación cardiovascular6. Las SPN con bloqueo cardíaco se encuentran en la esquina lateral del segmento torácico de la médula espinal (T1-T5), con axones que se proyectan hacia los ganglios cervicales o torácicos y posteriormente inervan el corazón a través de los nervios cardíacos, medios e inferiores. Como resultado, la médula espinal torácica desempeña un papel crucial en la integración y modulación de las entradas somáticas y viscerales, que luego pueden influir en el control cardíaco. Por lo tanto, es importante comprender cómo la estimulación somática regula la función cardíaca a través de la modulación de las SDHRN en el segmento torácico de la médula espinal.
Estudios previos han demostrado que la electroacupuntura en el CP6 (organizada en el segmento espinal T3 como una unidad homotópica de estructura-función) puede aliviar los síntomas de la isquemia miocárdica a través de la modulación del sistema nervioso autónomo 7,8,9. Sin embargo, aún no se ha logrado la sincronización cuantitativa en tiempo real de los efectos de la acupuntura sobre la frecuencia cardíaca con la actividad del sistema nervioso. Solo se han documentado indicadores de actividad nerviosa autonómica inmediata y electrocardiograma (ECG) después de la acupuntura. Las investigaciones que relacionan las SDHN con las funciones fisiológicas viscerales siguen siendo escasas. Debido a la curvatura fisiológica de las vértebras torácicas y al estrecho espacio entre los segmentos vertebrales torácicos adyacentes, especialmente T1-T5, el acceso a estas áreas es un desafío, lo que resulta en escasas pruebas directas para dilucidar los mecanismos espinales subyacentes a la acupuntura en el punto de acupuntura homotópico espinal T3 PC6 que regula la función cardíaca en el tratamiento de la ECV.
Para comprender mejor la relación entre la SDH y la regulación de la función cardíaca mediada por la acupuntura, es necesario implementar el registro sincrónico de la función cardíaca y las actividades neuronales. Aquí, proporcionaremos un enfoque general para el registro extracelular multicanal espinal junto con el registro de la función cardíaca, así como el análisis de las SDHRN bloqueadas por el corazón. Este método ofrece un marco sincronizado temporalmente para estudiar los mecanismos de la columna vertebral que subyacen a los cambios funcionales viscerales torácicos inducidos por la acupuntura.
Protocolo
El protocolo de experimentación con animales se adhirió estrictamente a los requisitos de la norma nacional "Directrices para la Revisión Ética del Bienestar de los Animales de Laboratorio" (GB/T 35892-2018) y fue aprobado por el Comité de Ética de la institución. En este estudio se utilizaron ratas macho Sprague-Dawley (SD) de grado SPF, de 6 a 8 semanas de edad y con un peso aproximado de 220 g. Se usaron batas de laboratorio, guantes y máscaras durante todos los experimentos. Los detalles de los reactivos y el equipo utilizado se enumeran en la Tabla de Materiales. Al final del experimento, las ratas fueron sacrificadas mediante perfusión cardíaca bajo anestesia profunda seguida de dislocación cervical.
1. Configuración preoperatoria
- Conecte el circuito del ventilador al tubo endotraqueal en forma de Y, lo que garantiza una interfaz segura y hermética.
- Verifique la ventilación adecuada confirmando el flujo de aire estable, el volumen corriente adecuado y los ajustes de frecuencia respiratoria en la pantalla del ventilador.
- Asegúrese de que no haya contaminantes de condensado o partículas dentro de la tubería examinando visualmente todos los segmentos bajo una iluminación brillante.
- Alimente simultáneamente las señales de ECG amplificadas tanto en la entrada del electrocardiógrafo como en el puerto de entrada analógica del sistema de registro de matriz de microelectrodos mediante un conector BNC de tres vías.
- Dirija las señales amplificadas a través de un divisor BNC de tres vías para conectar simultáneamente la entrada analógica del electrocardiógrafo y el puerto de entrada analógica del sistema de registro de matriz de microelectrodos.
- Establezca disparadores de sincronización conectando la salida TTL del electrocardiógrafo a la entrada digital del sistema de registro de la matriz de microelectrodos. Utilizando un cable de interfaz BNC a Dupont, inicie la adquisición simultánea en ambos sistemas, verificando la alineación temporal.
2. Preparación preoperatoria
- Anestesia
- Inducir la anestesia con isoflurano al 3-5% por inhalación y luego administrar una inyección intraperitoneal de pentobarbital sódico (50 mg/kg) a la rata anestesiada. Administrar isoflurano para anestesia inhalatoria antes de colocar los electrodos, manteniendo una concentración de ~1,2%. Proceda solo si: Evalúe la profundidad de la anestesia mediante un pellizco en los dedos de los pies antes de continuar.
- Retira el pelo de la parte anterior del cuello y la parte posterior del dorso de las ratas.
- Coloque a la rata en posición supina sobre una manta térmica y aplique ungüento en los ojos de la rata para evitar que se seque. Observe la frecuencia respiratoria y verifique las respuestas de retirada aplicando presión a la almohadilla del pie con pinzas.
3. Intubación traqueal
- Coloque las ratas en posición supina y desinfecte el área del cuello con tintura de yodo.
- Realizar una incisión longitudinal de aproximadamente 1 cm a lo largo de la línea media del cuello y diseccionar sin rodeos el tejido muscular.
- Una vez que la glándula tiroides esté expuesta, separe cuidadosamente la membrana delgada entre los dos lóbulos tiroideos, teniendo cuidado de no dañar el tejido tiroideo. Proceda a exponer la tráquea.
- Examine la cánula en forma de "Y" para confirmar que está completamente seca. Utilice unas tijeras de resorte para hacer una incisión transversal en la tráquea, seguida de la inserción de la cánula en la abertura traqueal. Asegure la cánula traqueal con suturas no absorbibles 3-0 para evitar fugas de aire y extubaciones accidentales.
- Sutura cuidadosamente los músculos del cuello y la piel y conecta la rata a un ventilador. Ajustar la frecuencia respiratoria a 85 respiraciones/min y el volumen corriente a 3,5 mL, de acuerdo con el peso corporal de la rata7 (Figura 1B).
4. Detección de ECG
- Inserte tres electrodos en la piel de la rata: el electrodo positivo en la extremidad inferior izquierda, el electrodo negativo en la extremidad superior derecha y el electrodo de tierra en la extremidad inferior derecha10.
- Adquisición de datos mediante un electrocardiógrafo (ajustes de filtro: paso bajo a 100 Hz, paso alto a 1 kHz; frecuencia de muestreo: 4 kHz/s). Utilice el software de registro de ECG para registrar, guardar y analizar datos.
5. Cateterismo pericárdico para la administración de fármacos bradicinina (BK)
- Coloque la rata en posición supina y desinfecte la piel del pecho con yodo.
- Realizar una toracotomía entre el 1º y 3º cartílago costal en la parte superior izquierda del tórax para exponer el timo. Diseccione sin rodeos el timo a lo largo de la línea media para exponer el pericardio (ver Figura 1C, D).
- Utilice la punta de una aguja de disección de vidrio (0,5 mm de diámetro) para hacer una pequeña abertura en el pericardio.
- Insertar un catéter de silicona, de 10-15 cm de longitud, con varios orificios pequeños en su extremo distal a través de la incisión en el pericardio. Fije el catéter al tejido de la pared torácica con biopegamento.
- Cierre la cavidad torácica capa por capa, asegurándose de que la respiración de la rata permanezca sin obstrucciones (véase la figura 1D).
6. Exposición de la médula espinal T3
- Coloque a la rata en posición prona y realice una desinfección rutinaria con yodo. Realice una incisión de aproximadamente 8 cm a lo largo de la línea media de la espalda desde las vértebras T2 a T6.
- Use tijeras de resorte para cortar la piel y las capas musculares, incluido el músculo trapecio. Inserte un retractor entre los músculos para exponer aún más el campo quirúrgico.
- Separe cuidadosamente las glándulas de grasa e hibernación en la cara anterior de las vértebras torácicas de la rata, evitando los vasos sanguíneos debajo de las glándulas (ver Figura 1E).
- Retire los músculos que se unen a la pinza de cabeza y la parte recta de los músculos largos del cuello, exponiendo las apófisis espinosas de T2.
- Desplazar los músculos semiespinal y espinal para exponer el arco vertebral de T2 a T6 (ver Figura 1E). Use rongeurs para eliminar la apófisis espinosa de la vértebra T3, exponiendo así la médula espinal T3.
NOTA: Durante el proceso de exposición de las vértebras torácicas, asegúrese de que se preste especial atención a la preservación de la apófisis espinosa de T2, ya que sirve como punto principal de aplicación de fuerza para la exposición posterior de la médula espinal T3. - Retire la duramadre y la membrana aracnoidea, y gotee aceite de parafina sobre la superficie de la médula espinal para mantener la viabilidad de las neuronas espinales (véase la figura 1F).
NOTA: Los vasos sanguíneos del tejido adiposo marrón de la rata se originan en la lámina T3, T4 o T5 y se distribuyen como un seno venoso. Tenga cuidado de no tocarlos, ya que esto podría causar una pérdida excesiva de sangre en la rata.
7. Fijación y configuración de las vértebras torácicas
- Utilice una pinza espinal personalizada para asegurar las apófisis articulares de T2 y T6. Humedece los músculos circundantes con solución salina para mantener la hidratación.
- Conecte la guía de electrodos al micromanipulador de un instrumento estereotáctico e insértelo verticalmente en el asta dorsal de la médula espinal en el segmento espinal T3 a través del surco mediano dorsal, 500 μm lateral a la línea media, a una profundidad de 1.500 μm.
- Inserte el electrodo de referencia en el músculo de la espalda (véase la figura 1G).
- Inicie el software de grabación extracelular multicanal y vaya a Archivo | Configuración de hardware; Seleccione la matriz de 32 canales de la lista de interfaces del dispositivo; haga clic con el botón derecho en el grupo de canales seleccionado; y, a continuación, elija Propiedades en el menú contextual . Configure los parámetros de procesamiento de señal: En la pestaña Filtro , configure el filtro de paso de banda (BP) en 250 Hz - 5 kHz; en el campo Frecuencia de muestreo , entrada 30 kHz/s; habilite los algoritmos de detección de picos marcando la casilla Habilitar procesamiento de picos para activar la clasificación de picos en tiempo real y la extracción de eventos basada en umbrales.
NOTA: Asegúrese de que los músculos y tejidos que rodean los procesos articulares de T2 y T6, especialmente en la región donde se aplica la pinza espinal personalizada para la fijación de la columna, para evitar el desplazamiento durante los experimentos posteriores.
8. Estímulos somáticos y BK
- Utilice BK (1 μg/mL en agua destilada) para inducir la estimulación nociceptiva cardíaca. Inyectar 4 μL de la solución BK con una microjeringa conectada a un catéter de silicona con varias aberturas pequeñas11.
- Observe los cambios en la frecuencia cardíaca (aumentos o disminuciones) y la descarga neuronal (aumenta o disminuye) en el asta dorsal de la médula espinal T3 dentro de los 30 minutos posteriores a la inyección para identificar las interacciones dinámicas entre las neuronas del asta dorsal de la médula espinal torácica.
- Realizar acupuntura manual en el punto de acupuntura PC6 (MAPC6) utilizando el parámetro de estimulación de 1 Hz. PC6 (punto de acupuntura de Neiguan) se localiza a 2 mm proximal a la articulación del carpo en el antebrazo ventral, entre el flexor radial del carpo y el tronco del nervio mediano. Inserte las agujas (0,25 mm x 25 mm) en los puntos de acupuntura PC6 a una profundidad de ~3 mm. Compara los cambios en la actividad neuronal y la función cardíaca antes y después de los estímulos somáticos.
9. Análisis y tratamiento de datos
- Importe los datos neuronales registrados en formato ns6 en el software de la siguiente manera:
- Conversión de archivos: Vaya a Archivo | Abrir para cargar el archivo ns6. Seleccionar archivo | Guardar como y elija el formato .nex5 para generar datos estandarizados del tren de picos.
- Spike Sorting: Importe los archivos .nex5 convertidos en el software de clasificación para la clasificación neuronal. Clasifique las formas de onda de los picos en función de las características de la forma de onda y el análisis de componentes principales (PCA), con parámetros de umbral establecidos en ±3 SD a partir del ruido de referencia.
- A continuación, ejecute el código correspondiente para filtrar y categorizar las señales.
- Analice los SDRN con bloqueo cardíaco.
- Tomando la onda R como evento de referencia, cuente el número de disparos de neuronas dentro de una ventana de 0,2 s antes y después de cada onda R.
- Después de contar las ondas R a intervalos de 50 ms, cree un histograma de eventos de anillo. Normalice el histograma (es decir, reste la tasa de descarga promedio en 0,2 s antes y después del evento de onda R) para obtener la distribución de la tasa de descarga de la actividad de cada neurona durante el latido del corazón.
- Evalúe la significación estadística a través de las pruebas de permutación Monte Carlo12 , implementadas con 1.000 iteraciones aleatorias. Obtenga la distribución de la tasa de disparo y el intervalo de confianza de la neurona en el proceso de latidos cardíacos aleatorios aleatorizando 0,2 s del tiempo antes y después de cada onda R de latidos cardíacos (el rango es ± 0,1 s). Si la distribución de disparo de los latidos del corazón de una neurona excede (mayor o menor que) el intervalo de confianza del 95% de la distribución de la tasa de disparo del proceso de latidos cardíacos aleatorios, identifique la neurona como una neurona bloqueada por el corazón (consulte el Archivo complementario 1).
Resultados
Siguiendo el protocolo anterior, se expusieron las SDHN T3, con bradicinina (BK) o punción somática administrada en regiones pericárdicas/puntos de acupuntura. Esta investigación cuantificó los perfiles de activación neuronal evocados por estímulos (tipo/frecuencia) y los cambios electrocardiográficos (ECG) concurrentes durante la entrada visceral nociceptiva, la aplicación de BK y la modulación somatosensorial.
La figura 2A muestra un corte transversal de la médula espinal T3 de la rata. En el lado izquierdo, ilustra la distribución de láminas distintas. El lado derecho muestra regiones naranjas que representan la distribución del colorante Dil después de un período de incubación de 10 minutos. Un electrodo de matriz, impregnado con colorante Dil, se fijó al micromanipulador de un aparato estereotáctico. A continuación, los electrodos se insertaron verticalmente en el asta dorsal de la médula espinal, 500 μm laterales al surco mediano posterior en el segmento T3, a una profundidad de 1.500 μm, con ajustes de profundidad realizados de acuerdo con el peso corporal de la rata. Después de un período de registro de 15 minutos, se llevó a cabo la perfusión y la recolección de tejidos, durante los cuales los electrodos registraron las señales de las láminas I a VIII de la médula espinal de rata. La Figura 2B-D presenta los gráficos ráster, las formas de onda, el análisis de componentes principales (PCA) y la autocorrelación de las neuronas registradas en el canal 19. La figura 2F, G muestra datos análogos para tres neuronas registradas desde el canal 11. Los datos de estos dos canales indican una clasificación clara de las neuronas, proporcionando datos auténticos para el posterior análisis de correlación.
Las columnas azules muestran el número acumulado de descargas neuronales dentro de un cierto período de tiempo, restado por el valor promedio. La Fig. 3A muestra un registro de referencia (BL) durante 60 s. Las neuronas del canal 17c y del canal 21a demuestran la presencia de neuronas bloqueadas por el corazón en las SDHN T3, que exhiben distintas descargas periódicas en respuesta a las variaciones del ECG. La Figura 3B muestra el efecto de la aplicación de BK al pericardio en la aurícula izquierda sobre las SDHN T3, junto con un ejemplo de neuronas bloqueadas cardíacamente. La neurona del canal 17c mostró una reducción significativa en el bloqueo cardíaco después de la administración de BK. Como se muestra en el área sombreada en verde de la Figura 3C, después de la administración de MAPC6, hay un grupo consistente de neuronas que exhiben disparos periódicos alrededor de la onda R en los ciclos de disparo de las condiciones BL y MAPC6. Este patrón es más regular que la cocción observada después de la aplicación de BK. Por el contrario, en la Figura 3D, el patrón de disparo de las neuronas después de MAPC6 es menos distinto. Por lo tanto, MAPC6 puede mejorar la frecuencia de disparo de las neuronas relacionadas con el corazón en la córnea dorsal espinal T3, manteniendo así la función cardíaca en condiciones patológicas. La Figura 3E, F muestra que la frecuencia de descarga de las SDHN T3 activadas por BK disminuyó después de la estimulación con acupuntura del punto de acupuntura PC6. Por el contrario, la proporción de frecuencia de disparo de las neuronas espinales T3 inhibidas por BK aumentó significativamente después de la estimulación con acupuntura del punto de acupuntura PC6.
Curiosamente, el canal 21a se identifica como una neurona bloqueada por el corazón que exhibe descargas periódicas y regulares específicamente en respuesta a la onda P, que marca el inicio de la despolarización auricular por el nódulo sinoauricular (SA), y el intervalo PR, que indica el retraso en el nódulo auriculoventricular. Aunque no hay un cambio significativo en la onda P en el ECG, la aplicación de BK da como resultado una concentración de tres grupos de neuronas entre cada onda P y Q en el ECG, lo que demuestra una relación más estrecha con la onda P (como lo indica el área sombreada de color púrpura en la Figura 3B). La onda P en el ECG es un indicador importante que refleja la normalidad de las ondas de contracción auricular, y la onda P generada por el nódulo SA representa el proceso de despolarización auricular, por lo que se verificó el efecto de la BK en las aurículas. Sin embargo, después de la administración de MAPC6, hubo un patrón distinto en la activación de las neuronas en relación con las ondas R y T. Después de la acupuntura, las neuronas volvieron a un patrón agrupado asociado con la onda P, lo que indica que la acupuntura puede tratar enfermedades cardíacas patológicas mediante la modulación del ritmo de las neuronas somáticas y viscerales en el mismo segmento del asta dorsal espinal.

Figura 1: Procedimiento quirúrgico de la SDH T3. (A) Ventilador. (B) Intubación de tráquea en rata. (C) Timo y anatomía del corazón. (D) Introduzca el timo en el pericardio. (E) T2-8 Vértebras torácicas después de la extirpación. (F) Médula espinal T3. (G) Las pinzas de vértebras espinales modificadas. (H,I) Fijación local de pinza espinal. (J,K) Un diagrama esquemático de la estimulación somática y visceral; Durante la grabación, las ratas estaban en decúbito supino y boca abajo. Haga clic aquí para ver una versión más grande de esta figura.
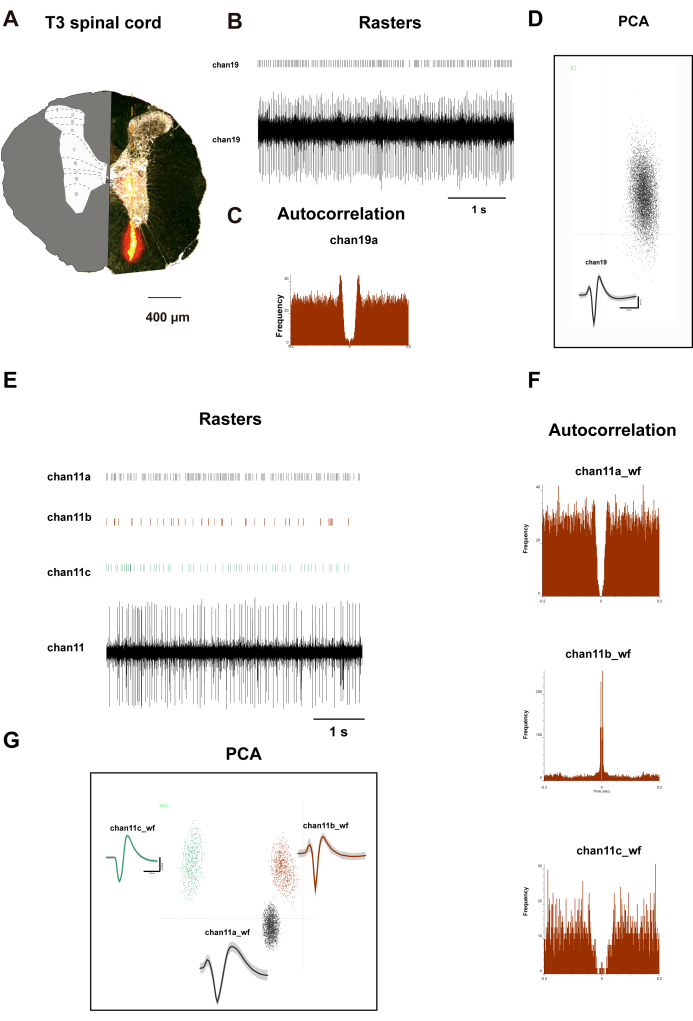
Figura 2: Neuronas del asta dorsal espinal T3 registradas. (A) Validación de la colocación de electrodos: Sección transversal de la médula espinal que muestra la pista de implantación de la sonda de silicona de 32 canales. Recuadro: Atlas modificado de la médula espinal de rata Paxinos con límites de láminas citoarquitectónicas (I-X) superpuestos para el registro espacial. Los gráficos representan los rásteres y las formas de onda de disparo neuronal del canal 19 y del canal 11 (B,E), la agrupación en clústeres y el diagrama de clústeres PCA (D,G) y las autocorrelaciones (C,F). Los patrones simétricos centrales representados en los paneles C y F muestran los patrones de disparo distintivos de las neuronas registrados en las neuronas del canal 19 y del canal 11. Haga clic aquí para ver una versión más grande de esta figura.
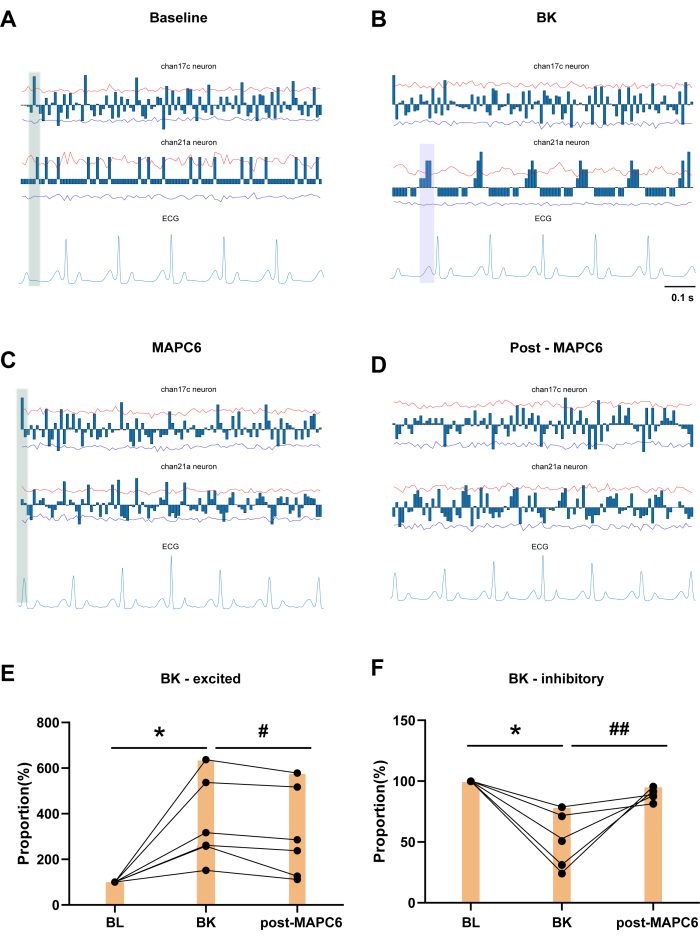
Figura 3: El efecto de la aplicación local de BK al pericardio en las SDHN T3 y ejemplo de neuronas bloqueadas cardíacas. (A) Las neuronas del canal 17c y del canal 21a demuestran la presencia de neuronas bloqueadas cardíacas en la SDR T3. (B) Cambios en el grado de bloqueo después de la administración de BK dentro de los 30 min. (C,D) El ejemplo de la neurona bloqueada cardíacamente MAPC6 durante 1 min y post MAPC6 durante 1 min. (E,F) Cambio en la proporción de frecuencia de las neuronas que responden a BK después de MAPC6. Las barras de error representan la media ± SEM (N = 6). *P < 0.05, en comparación con BL. #P < 0.05, ##P < 0.01, en comparación con BK. Se utilizó una prueba t pareada. Abreviaturas: BL = línea de base; BK = bradicinina; MAPC6= Acupuntura Manual en Neiguan (PC6). Haga clic aquí para ver una versión más grande de esta figura.
Ficha complementaria 1: Análisis de la actividad neuronal bloqueada por ECG. En la línea 70: Modificar rangos de tiempo en condition={[t1_start,t1_end], [t2_start,t2_end], ...}. Ajuste las etiquetas de fase experimental en la línea 71: conditiontitle = {'baseline','EA1','EA2'}; para alinearse con los intervalos de tiempo definidos en la condición. Haga clic aquí para descargar este archivo.
Discusión
La decodificación de los perfiles de codificación neuronal de SDH es esencial para comprender el mecanismo neuromodulador del efecto terapéutico inducido por la acupuntura sobre la disfunción visceral. Aquí, combinamos la técnica de registro in vivo MEA con el sistema de registro de ECG para registrar simultáneamente la actividad de descarga de los SDHN T3 y el ECG. La estimulación del dolor cardíaco puede activar los nociceptores de tipo C que inervan el corazón y transmiten información nociceptiva anteriormente a través de las vísceras, DRG, médula espinal T1-T5 y supramédula espinal. Las fibras aferentes simpáticas ingresan al asta dorsal, se transmiten a las interneuronas y se proyectan a las neuronas preganglionares en el asta lateral de la médula espinal. Estas fibras preganglionares entran en las ramas comunicadas blancas y se unen a la cadena nerviosa simpática donde se convierten en neuronas postganglionares directamente o hacia arriba hasta el ganglio estrellado (SG), y los ganglios cervicales inferior y medio hacen sinapsis con las neuronas postganglionares para controlar la frecuencia cardíaca13.
El mecanismo del punto de acupuntura PC6 en el tratamiento de las enfermedades cardiovasculares es muy complejo y no se ha revelado completamente. En la actualidad, la vía refleja somatosimpática se considera una de las vías más críticas. Este estudio examina los efectos reguladores de la acupuntura en el punto de acupuntura PC6 en las neuronas bloqueadas y desbloqueadas cardíacas dentro de la médula espinal T3. En la literatura, se han utilizado técnicas de registro de MEA para registrar la descarga de neuronas (de amplio rango dinámico [WDR]) en la SDH14,15. Sin embargo, la médula espinal T3 está situada cerca de las costillas y las vértebras torácicas y presenta un mayor riesgo de neumotórax durante los procedimientos quirúrgicos. Al igual que con la mayoría de las técnicas in vivo, las neuronas del asta dorsal espinal T3 no se registran en muchos experimentos. El registro de la estabilidad de la médula espinal depende en gran medida de los dispositivos de estabilización de la columna vertebral y de la anestesia adecuada16. Dado la limitación de las pinzas espinales comerciales, que se inclinan para estabilizar la columna lumbar, aquí modificamos la pinza espinal para que se adapte a la columna torácica al principio. Los pinzadores de vértebras espinales modificados están construidos con un par de pinzas Adson, una tapa de metal, una barra redonda, tuercas y tornillos. Después de montar las pinzas hechas a medida en el dispositivo Narishige STS-B y SR, pudimos estabilizar la columna vertebral de la rata y evitar el desplazamiento del tejido. Se dejó suficiente espacio para el electrodo del asta subdorsal de la médula espinal.
Aunque muchos estudios han informado que la acupuntura podría ejercer sus efectos terapéuticos sobre las enfermedades cardiovasculares a través de la modulación de las regiones hipotálama, mesencéfalo y medular, se ha prestado menos atención a la médula espinal17. Además, los investigadores están acostumbrados a demostrar su mecanismo neuromodulador a través de estrategias moleculares en lugar de funcionales18. Teniendo en cuenta la función fundamental de los SDHN en la fisiopatología cardíaca y su participación en los efectos de la acupuntura, es imperativo desarrollar un método analítico sólido para aclarar los mecanismos científicos por los cuales la acupuntura influye en la función cardíaca a través de la modulación de la actividad de SDHN a nivel funcional. A pesar de que Li et al. informaron sobre el método de registro simultáneo de las imágenes de calcio y ECG de las neuronas de los ganglios de la raíz dorsal T1, la resolución temporal de las imágenes de calcio es baja y el acoplamiento de la señal eléctrica de DRG y la señal de ECG a nivel de milisegundos no se puede detectar9.
En cuanto al registro electrofisiológico de la SDH, Qin et al. registraron la actividad de la SDHN y el ECG simultáneamente19, pero el flujo de registro fue bajo debido al método de registro de un solo electrodo. Por lo tanto, en este estudio, utilizamos la electrofisiología MEA combinada con el registro de ECG para obtener señales de descarga neuronal de alto rendimiento y señales de ECG al mismo tiempo. Sobre esta base, nos referimos al método de análisis para analizar el grado de acoplamiento entre la descarga de neuronas NTS y la señal de ECG, y escribimos el código de análisis que describe el grado de acoplamiento entre la descarga de neuronas de la médula espinal y la señal de ECG a través de MATLAB20. Debido a que la remodelación se logró utilizando pinzas comerciales, la forma del brazo de sujeción debe diseñarse siguiendo la forma de la vértebra torácica en el futuro para reducir la hinchazón y lograr un mejor efecto de fijación. Aunque este enfoque proporciona una poderosa herramienta para estudiar la dinámica neuronal, también existen algunas limitaciones en la medición de grandes poblaciones de neuronas definidas molecularmente. En el futuro, la combinación de métodos electrofisiológicos y ópticos puede ser de gran importancia para profundizar nuestra comprensión de las bases científicas de la acupuntura.
La interocepción y la regulación del sistema nervioso en los órganos internos siempre han sido el foco de la investigación en neurociencia21,22. La estimulación de la superficie corporal, como la acupuntura, puede activar la aferencia física y modular la actividad nerviosa y los cambios en la función visceral23. Los estudios han demostrado que la información nociceptiva visceral cardíaca se transmite preliminarmente al asta dorsal espinal de los segmentos torácicos 1-524. También se ha demostrado que la estimulación de la médula espinal trata la angina de pecho refractaria, lo que indica que la modulación de la red neuronal en la médula espinal correspondiente puede aliviar el dolor cardíaco. Sin embargo, hasta donde sabemos, los cambios en la actividad de las neuronas espinales durante el dolor cardíaco y el mecanismo espinal que subyace a la estimulación periférica no se comprenden bien. Este estudio detalla un método para la adquisición y el análisis concurrentes de señales de descarga T3 SDHN y señales de ECG. Este método proporciona información significativa sobre los impactos reguladores de la acupuntura y otros estímulos periféricos en las neuronas cardiovasculares de la médula espinal. Además, proporciona información sustancial sobre los efectos de la acupuntura en los órganos diana a través de mecanismos reflejos neuronales autónomos.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este estudio fue apoyado por la Fundación Nacional de Ciencias Naturales de China (No.82330127, No.82105029), el Programa Nacional Clave de Investigación y Desarrollo de China (No.2022YFC3500702) y los Fondos de Investigación Fundamental para los Institutos Centrales de Investigación de Bienestar Público (No. ZZ-2023008) y el Proyecto de la Secretaría Provincial de Educación (Nº 2019JM-027).
Materiales
| Name | Company | Catalog Number | Comments |
| Anesthesia System | Kent Scientific | SomnoSuite | |
| Central v6.5 | Black Microsystems | Cerebus-128 | |
| Fine Scissors | Fine Scissors | Fine Scissors | |
| Friedman-Pearson Rongeurs | Fine Science T ools | 16220-14 | |
| Gelatin Sponges | Coltene | 274-007 | |
| Intubation Cannula | Harward Apparatus | 73-2737 | |
| Isoflurane | RWD | R510 | |
| LabChart Professional Software | LabChart Professional Software | Version 8.0 | |
| microband electrode array | Neuronexus | A1x32-6mm-50-177 | |
| micromanipulator | Narishige | DMA-1510 | |
| needles | Zhongyantaihe | 0.25 mm x 0.25 mm | |
| NeuroExplorer software (V5.0) | Plexon | V5.0 | |
| offline Sorter | Plexon | V4.0 | |
| Powerlab | ADInstruments | PL26T04 | |
| rats | the Experimental Center of the Academy of Military Medical Sciences of the People's Liberation Army of China | ||
| Spinal Adaptor | N/A | N/A | Custom made |
| Spring Scissors | Fine Science Tools | 15023-10 | |
| stereotactic instrument | Narishige | SR-5R-HT |
Referencias
- Nakahara, H., Ueda, S. Y., Kawai, E., Higashiura, R., Miyamoto, T. Effects of pre-exercise acupuncture stimulation on heart rate response during short-duration exercise. BMC Sports Sci Med Rehabil. 13 (1), 129(2021).
- de Lima Pimentel, R., Duque, A. P., Moreira, B. R., Rodrigues, L. F. J. Acupuncture for the treatment of cardiovascular diseases: A systematic review. J Acupunct Meridian Stud. 12 (2), 43-51 (2019).
- Ma, Q. A functional subdivision within the somatosensory system and its implications for pain research. Neuron. 110 (5), 749-769 (2022).
- Hsieh, M. T., Donaldson, L. F., Lumb, B. M. Differential contributions of A- and C-nociceptors to primary and secondary inflammatory hypersensitivity in the rat. Pain. 156 (6), 1074-1083 (2015).
- Meyr, A. J., Steinberg, J. S. The physiology of the acute pain pathway. Clin Podiatr Med Surg. 25 (3), 305-326 (2008).
- Ardell, J. L. Heart failure: Mechanisms of spinal cord neuromodulation for heart disease. Nat Rev Cardiol. 13 (3), 127-128 (2016).
- Xi, H., et al. Continuous peripheral electrical nerve stimulation improves cardiac function via autonomic nerve regulation in MI rats. Heart Rhythm. 21 (10), 2010-2019 (2024).
- Cui, X., et al. Referred somatic hyperalgesia mediates cardiac regulation by the activation of sympathetic nerves in a rat model of myocardial ischemia. Neurosci Bull. 38 (4), 386-402 (2022).
- Li, X., et al. In vivo thoracic dorsal root ganglia (DRG) calcium imaging and ECG recording for studying reripheral nerve stimulation. J Vis Exp. (210), e67283(2024).
- Azhar, A., El-Bassossy, H. M. Pentoxifylline alleviates cardiac ischemia and dysfunction following experimental angina in insulin resistance. PLoS One. 9 (5), e98281(2014).
- Liu, X., Zhang, Q., Han, M., Du, J. Intrapericardial capsaicin and bradykinin induce different cardiac-somatic and cardiovascular reflexes in rats. Auton Neurosci. 198, 28-32 (2016).
- Metropolis, N., Ulam, S. The Monte Carlo method. J Am StatAssoc. 44 (247), 335-341 (1949).
- Coote, J. H., Chauhan, R. A. The sympathetic innervation of the heart: Important new insights. Auton Neurosci. 199, 17-23 (2016).
- Sun, X. Y., et al. Inhibitory effect of acupoint electrostimulation with different layers and intensities on muscular inflammatory pain and spinal WDR neuron activity. Zhen Ci Yan Jiu. 49 (2), 103-109 (2024).
- Duan-Mu, C. L., et al. Electroacupuncture-induced muscular inflammatory pain relief was associated with activation of low-threshold mechanoreceptor neurons and inhibition of wide dynamic range neurons in spinal dorsal horn. Front Neurosci. 15, 687173(2021).
- Davalos, D., Akassoglou, K. In vivo imaging of the mouse spinal cord using two-photon microscopy. J Vis Exp. (59), e2760(2012).
- Li, P. Neural mechanisms of the effect of acupuncture. International Congress Series. 1238, 71-77 (2002).
- Wu, X. L., et al. Acupuncture modulation of the ACE/Ang II/AT1R and ACE2/Ang(1-7)/MasR pathways in the rostral ventrolateral medulla reduces sympathetic output and prevents cardiac injury caused by SHR hypertension. Neuroreport. 35 (13), 839-845 (2024).
- Qin, C., Farber, J. P., Foreman, R. D. Gastrocardiac afferent convergence in upper thoracic spinal neurons: a central mechanism of postprandial angina pectoris. J Pain. 8 (6), 522-529 (2007).
- Yao, Y., et al. Cardiovascular baroreflex circuit moonlights in sleep control. Neuron. 110 (23), 3986-3999.e6 (2022).
- Liu, S., et al. Somatotopic organization and intensity dependence in driving distinct NPY-expressing sympathetic pathways by electroacupuncture. Neuron. 108 (3), 436-450.e7 (2020).
- Liu, S., et al. A neuroanatomical basis for electroacupuncture to drive the vagal-adrenal axis. Nature. 598 (7882), 641-645 (2021).
- Ma, Q. Somatotopic organization of autonomic reflexes by acupuncture. Curr Opin Neurobiol. 76, 102602(2022).
- Wang, J., et al. Spinal cord stimulation reduces cardiac pain through microglial deactivation in rats with chronic myocardial ischemia. Mol Med Rep. 24 (6), 835(2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados