Method Article
ラット脊髄背角における心臓ロックニューロン応答に対する体細胞刺激のコードプロファイルの研究
要約
心機能の記録と心臓にロックされた脊髄後角ニューロンの分析と並行して、脊椎マルチチャネル細胞外記録のプロトコルについて説明します。この方法は、鍼治療によって誘発される胸部内臓機能変化の根底にある脊椎メカニズムを研究するための時間的に同期したフレームワークを提供します。
要約
多くの研究が、電気鍼治療が心血管疾患の治療と予防に有益である可能性があることを示唆しています。しかし、そのメカニズムはよくわかっていません。胸部脊髄後角(SDH)は、体細胞と内臓の入力を統合して調節する重要な役割を果たしており、それが心臓制御に影響を与える可能性があります。広く研究されてきた腰椎SDHとは対照的に、胸部SDHは外科的曝露と定位固定の難しさのためにあまり探求されていません。本研究では、心電図の記録と微小電極アレイを組み合わせて、神経細胞の活動と心機能を同時にモニタリングする一般的なアプローチを提供します。さらに、心拍と同期したニューロン活動の発火率分布を計算することにより、心臓ロックニューロンを特定する方法について説明します。この戦略は、心血管機能とニューロン活動の相関関係を研究するため、また末梢神経刺激によって引き起こされる体性心反射を理解するために非常に重要です。
概要
鍼治療または体表面刺激は、伝統的な中国医学(TCM)の枠組みの中で著名な治療技術として、体表面の特定の領域を刺激することによって機能します。これは、求心性経路、中枢統合、および自律神経遠心性神経メカニズムを介した内臓機能の調節を通じて、生物の機能のマルチレベルの調節を促進します。この治療法の中心となるのは、解剖学的に定義されたツボの標的刺激が全身の生理学的調節を誘発するという概念です。臨床的証拠の増加は、心血管障害の管理における補完的なモダリティとしての鍼治療の役割を支持しており、一次予防と補助治療プロトコルの両方で有効性が実証されています1,2。
感覚ニューロンの一次求心性神経は、主に脊髄背角(SDH)で終結し、それに応じて、脊髄背角ニューロン(SDHN)は、体細胞入力3,4,5の統合と調節において重要な役割を果たします。さらに、SDHRNは心筋求心性神経も受け取り、心血管調節のための脊髄交感神経節前ニューロン(SPN)に内臓情報を伝達します6。心臓ロックされたSPNは、脊髄の胸部セグメント(T1-T5)の外側角に位置し、軸索が頸部または胸部神経節に突き出ており、その後、心臓神経、中神経、および下部神経を介して心臓を神経支配します。その結果、胸部脊髄は、体細胞入力と内臓入力の統合と調節に重要な役割を果たし、心臓制御に影響を与える可能性があります。したがって、体細胞刺激が脊髄の胸部セグメントのSDHRNの調節を通じて心機能をどのように調節するかを理解することが重要です。
これまでの研究では、PC6(T3脊髄部にホモトピック構造機能単位として組織化)での電気鍼治療が、自律神経系の調節を通じて心筋虚血の症状を緩和できることが実証されている7,8,9。しかし、鍼治療が心拍数に及ぼす影響と神経系の活動とをリアルタイムで定量的に同期させることは、まだ実現されていません。鍼治療後の即時の自律神経活動と心電図(ECG)指標のみが文書化されています。SDHNと内臓生理機能を結びつける研究は、まだ少ないのが現状です。胸椎の生理学的湾曲と隣接する胸椎セグメント、特にT1-T5の間の狭いスペースのために、これらの領域へのアクセスは困難であり、CVDの治療における心機能を調節するT3脊髄ホモトピックPC6での鍼治療の根底にある脊髄メカニズムを解明するための直接的な証拠はほとんどありません。
SDHと鍼治療による心機能調節との関係をより深く理解するためには、心機能と神経活動の同期記録を実施する必要があります。ここでは、脊椎マルチチャネル細胞外記録と心機能記録、および心臓ロックSDHRNの分析のための一般的なアプローチを提供します。この方法は、鍼治療によって誘発される胸部内臓機能変化の根底にある脊椎メカニズムを研究するための時間的に同期したフレームワークを提供します。
プロトコル
動物実験プロトコルは、国家基準「実験動物の福祉に関する倫理的審査のためのガイドライン」(GB / T 35892-2018)の要件を厳格に遵守し、機関の倫理委員会によって承認されました。この研究では、6〜8週齢、体重約220gの雄SPFグレードのSprague-Dawley(SD)ラットを使用しました。実験では、実験用ガウン、手袋、マスクを着用しました。試薬や使用した機器の詳細は、 資料表に記載されています。実験のエンドポイントでは、ラットは深い麻酔下で心臓灌流によって安楽死させられ、その後子宮頸部脱臼が行われました。
1. 術前セットアップ
- 人工呼吸器回路をY字型の気管内チューブに接続し、安全で気密性の高いインターフェースを確保します。
- ベンチレーターのディスプレイで安定した気流、適切な一回換気量、呼吸数の設定を確認して、適切な換気を確認します。
- チューブ内に凝縮物や粒子状の汚染物質がないことを確認するには、明るい照明の下ですべてのセグメントを目視で検査します。
- 増幅された心電図信号を、3ウェイBNCコネクタを使用して、心電計入力と微小電極アレイ記録システムのアナログ入力ポートの両方に同時に供給します。
- 増幅された信号を3方向BNCスプリッターに通し、心電計アナログ入力と微小電極アレイ記録システムのアナログ入力ポートを同時に接続します。
- 心電計のTTL出力を微小電極アレイ記録システムのデジタル入力に接続することにより、同期トリガーを確立します。BNC-デュポンインターフェースケーブルを使用して、両方のシステムで同時集録を開始し、時間アライメントを確認します。
2. 術前準備
- 麻酔
- 吸入により3〜5%イソフルランで麻酔を誘発し、次に、麻酔をかけたラットにペントバルビタールナトリウム(50 mg / kg)の腹腔内注射を投与します。.電極を配置する前に、吸入麻酔用のイソフルランを投与し、濃度を~1.2%に保ちます。続行する前に、つま先をつまんで麻酔の深さを評価する場合にのみ続行してください。
- ラットの前首と後部の毛を取り除きます。
- ラットを温熱ブランケットの上で仰臥位に置き、乾燥を防ぐためにラットの目に軟膏を塗布します。呼吸数を観察し、鉗子でフットパッドに圧力を加えて離脱反応を確認します。
3. 気管挿管
- ラットを仰臥位に置き、ヨウ素チンキ剤で首の部分を消毒します。
- 首の正中線に沿って約1cmの縦方向の切開を行い、筋肉組織を鈍く解剖します。
- 甲状腺が露出したら、甲状腺組織を傷つけないように注意しながら、2つの甲状腺葉の間に薄い膜を慎重に分離します。気管を露出させます。
- 「Y字型カニューレ」を調べて、完全に乾いていることを確認します。スプリングハサミを使用して気管を横切開し、続いてカニューレを気管開口部に挿入します。気管カニューレを3-0の非吸収性縫合糸で固定し、空気漏れや偶発的な抜管を防ぎます。
- 首の筋肉と皮膚を慎重に縫合し、ラットを人工呼吸器に接続します。ラットの体重に応じて 、呼吸数を85呼吸/分に、一回換気量を3.5mLに調整します7(図1B)。
4. 心電図検出
- ラットの皮膚に3つの電極を挿入します:正極を左下肢に、負極を右上肢に、接地電極を右下肢10に挿入します。
- 心電計(フィルタ設定:100Hzローパス、1kHzハイパス、サンプリング周波数:4kHz/s)を用いてデータを取得します。ECG記録ソフトウェアを使用して、データを記録、保存、および分析します。
5. ブラジキニン(BK)投与のための心膜カテーテル法
- ラットを仰臥位に置き、胸部の皮膚をヨウ素で消毒します。
- 胸腺を露出させるために、左上胸部の第1肋軟骨と第3肋軟骨の間で開胸術を行います。正中線に沿って胸腺を鈍く解剖して、心膜を露出させます( 図1C、Dを参照)。
- ガラス解剖針(直径0.5mm)の先端を使用して、心膜に小さな開口部を作ります。
- 長さ10〜15 cmのシリコンカテーテルを挿入し、その遠位端にいくつかの小さな穴を開けて、心膜の切開部を通します。バイオグルーを使用してカテーテルを胸壁組織に固定します。
- ラットの呼吸が妨げられないように、胸腔を層ごとに閉じます( 図1Dを参照)。
6. T3脊髄の露出
- ラットを腹臥位に置き、ヨウ素による定期的な消毒を行います。T2椎骨からT6椎骨まで背中の正中線に沿って約8cmを切開します。
- スプリングハサミを使用して、僧帽筋を含む皮膚と筋肉の層を切り開きます。筋肉の間にリトラクターを挿入して、手術野をさらに露出させます。
- ラットの胸椎の前面で脂肪腺と冬眠腺を慎重に分離し、腺の下の血管を避けます( 図1Eを参照)。
- ヘッドクランプに付着している筋肉と長い首の筋肉の直線部分を取り除き、T2の棘突起を露出させます。
- 半棘筋と脊椎筋を変位させて、椎弓をT2からT6に露出させます( 図1Eを参照)。ロンゲールを使用してT3椎骨の棘突起を取り除き、それによってT3脊髄を露出させます。
注:胸椎を露出させる過程では、T2の棘突起を保存することに特別な注意が払われていることを確認してください。これは、T3脊髄のその後の露出のための主要な力の印加点として機能するためです。 - 硬膜とくも膜を切除し、脊髄の表面にパラフィンオイルを滴下して、脊髄ニューロンの生存率を維持します( 図1Fを参照)。
注:ラットの褐色脂肪組織の血管は、T3、T4、またはT5椎弓板で発生し、静脈洞のように分布しています。ラットの過度の失血を引き起こす可能性があるため、それらに触れないように注意してください。
7.胸椎の固定と設定
- カスタム脊椎クランプを使用して、T2とT6の関節突起を固定します。生理食塩水で周囲の筋肉を湿らせ、水分補給を維持します。
- 定位装置のマイクロマニピュレータに電極アレイを取り付け、正中線から500μm横方向の背側正中溝を介してT3脊髄節の脊髄背角に垂直に挿入し、1,500μmの深さまで挿入します。
- 参照電極を背中の筋肉に挿入します( 図1Gを参照)。
- マルチチャンネル細胞外記録ソフトウェアを起動し、[ファイル] |ハードウェア構成;デバイスインターフェースリストから32チャンネルアレイを選択します。選択したチャネルグループを右クリックします。をクリックし、コンテキストメニューから [プロパティ] を選択します。信号処理パラメータの設定:「フィルタ」タブで、バンドパスフィルタ(BP)を250 Hz - 5 kHzに設定します。に ampリングレートフィールドで、30 kHz / sを入力します。[Enable Spike Processing] チェックボックスをオンにして、スパイク検出アルゴリズムを有効にします。これにより、リアルタイムのスパイクソートとしきい値ベースのイベント抽出がアクティブになります。
注:T2およびT6の関節突起を取り巻く筋肉および組織、特にカスタム脊椎クランプが脊椎固定に適用される領域において、その後の実験中の変位を防ぐために、完全なクリアランスを確保してください。
8. 体細胞刺激とBK刺激
- BK(蒸留水で1μg / mL)を使用して、心臓侵害受容刺激を誘発します。.いくつかの小さな開口部11を有するシリコーンカテーテルに接続されたマイクロシリンジを用いて、BK溶液4μLを注入する。
- 注射後30分以内にT3脊髄背角の心拍数変化(増加または減少)とニューロン放電(増加または減少)を観察して、胸部脊髄背角ニューロン間の動的相互作用を特定します。
- PC6(内関経穴)は、腹側前腕の手根関節の近位2mm、橈骨屈筋と正中神経幹の間に位置しています。針(0.25 mm x 25 mm)をPC6のツボに~3mmの深さで挿入します。体細胞刺激の前後の神経活動と心機能の変化を比較します。
9. データ分析と処理
- ns6形式で記録されたニューラルデータをソフトウェアにインポートするには、次のようにします。
- ファイル変換: [ファイル]に移動します|ns6 ファイルをロードするために開きます。 [ファイル] |[名前を付けて保存 ] を選択し、.nex5 形式を選択して、標準化されたスパイク トレイン データを生成します。
- スパイクソーティング:変換された.nex5ファイルを神経細胞分類用の分類ソフトウェアにインポートします。波形特性と主成分解析(PCA)に基づいてスパイク波形をソートし、スレッショルド・パラメータをベースライン・ノイズから±3SDに設定します。
- 次に、シグナルのフィルタリングと分類に関連するコードを実行します。
- 心臓ロックされたSDRNを解析します。
- R波を基準イベントとして、各R波の前後の0.2秒のウィンドウ内でのニューロンの発火数をカウントします。
- 50 ミリ秒間隔で R 波をカウントした後、リング イベント ヒストグラムを作成します。ヒストグラムを正規化(つまり、R波イベントの前後の0.2秒の平均放電率を差し引く)して、心拍中の各ニューロンの活動の放電率分布を取得します。
- モンテカルロ12 順列検定 (1,000 回のシャッフル反復で実装) を使用して統計的有意性を評価します。各心拍R波の前後の時間の0.2秒をランダム化することにより、ランダム化された心拍の過程におけるニューロンの発火率分布と信頼区間を取得します(範囲は0.1秒±)。ニューロンの心拍の発火分布が、無作為化された心拍プロセスの発火率分布の95%信頼区間を超える(または小さい)場合は、ニューロンを心臓ロックニューロンとして識別します( 補足ファイル1を参照)。
結果
上記のプロトコルに従って、T3 SDHNを曝露し、ブラジキニン(BK)または体細胞ニードリングを心膜周囲/ツボ領域に投与しました。この調査では、侵害受容性内臓入力、BK適用、および体性感覚調節中の刺激誘発ニューロン活性化プロファイル(タイプ/周波数)と同時心電図(ECG)の変化を定量化しました。
図2Aは、ラットのT3脊髄の横切片を示しています。左側は、明確な層の分布を示しています。右側は、10分間のインキュベーション期間後のDil色素の分布を表すオレンジ色の領域を示しています。Dil色素を含浸させたアレイ電極を定位装置のマイクロマニピュレータに貼り付けた。次に、電極を脊髄の背角に垂直に挿入し、T3セグメントの後正中溝から500μm外側に、ラットの体重に応じて深さを調整しながら、1,500μmの深さまで挿入しました。15分間の記録期間の後、灌流と組織採取が行われ、その間、電極はラット脊髄の椎弓板IからVIIIまでの信号を記録しました。図2B-Dは、チャネル19から記録されたニューロンのラスタープロット、波形、主成分分析(PCA)、および自己相関を示しています。図2F,Gは、チャネル11から記録された3つのニューロンの類似データを示しています。これら2つのチャネルからのデータは、ニューロンの明確な分類を示しており、その後の相関分析のための本物のデータを提供します。
青い列は、特定の時間枠内のニューロン放電の累積数に平均値を差し引いたものを示しています。 図3A は、60秒間のベースライン(BL)記録を示しています。チャネル17cおよびチャネル21aニューロンは、T3 SDHNに心臓ロックニューロンの存在を示し、ECG変動に応答して明確な周期的放電を示します。 図3B は、T3 SDHNに対する左心房の心膜へのBK適用の影響と、心臓ロックニューロンの例を示しています。チャネル17cニューロンは、BK投与後に心臓ロックの有意な減少を示しました。 図3Cの緑色の網掛け領域に示されているように、MAPC6の投与後、BLおよびMAPC6条件の両方の発火サイクルにおいて、R波の周囲で周期的な発火を示すニューロンの一貫したクラスターが存在する。このパターンは、BK適用後に観察される発砲よりも規則的です。対照的に、 図3Dでは、MAPC6後のニューロンの発火パターンはそれほど明確ではありません。したがって、MAPC6はT3脊髄背角膜の心臓関連ニューロンの発火頻度を改善し、それによって病的条件下で心機能を維持することができます。 図3E、F は、PC6ツボの鍼治療刺激後にBKによって活性化されたT3 SDHNの放電頻度が減少したことを示しています。逆に、BKによって阻害されたT3脊髄ニューロンの発火頻度の割合は、PC6ツボの鍼治療刺激後に有意に増加しました。
興味深いことに、チャネル21aは、洞房結節(SA)による心房脱分極の開始を示すP波と、房室結節での遅延を示すPR間隔に特異的に応答して周期的で規則的な放電を示す心臓ロックニューロンとして同定されます。心電図のP波に大きな変化はありませんが、BKの適用により、心電図上の各P波とQ波の間に3つのニューロンクラスターが集中し、P波とより密接な関係が示されます( 図3Bの紫色の網掛け領域で示されています)。心電図上のP波は心房収縮波の正常性を反映する重要な指標であり、SAノードが生成するP波は心房の脱分極過程を表しており、BKの心房への影響が検証されました。しかし、MAPC6の投与後、R波とT波に関連してニューロンの発火に明確なパターンが見られました。鍼治療後、ニューロンはP波に関連するクラスターパターンに戻り、鍼治療が脊髄背角の同じセグメントの体細胞ニューロンと内臓ニューロンのリズムを調節することにより、病的な心疾患を治療できることを示しています。

図1:T3 SDHの外科的処置(A)人工呼吸器。(B)ラットの気管の挿管。(C)胸腺と心臓の解剖学。(D)胸腺を心膜にパイプでつなぎます。(E)T2-8 切除後の胸椎。(F)T3脊髄。(G)修正された脊椎クランパー。(H,I)脊椎クランプの局所固定。(J,K)体性および内臓刺激の概略図。記録中、ラットは仰臥位で腹臥位にありました。この図の拡大版を表示するには、ここをクリックしてください。
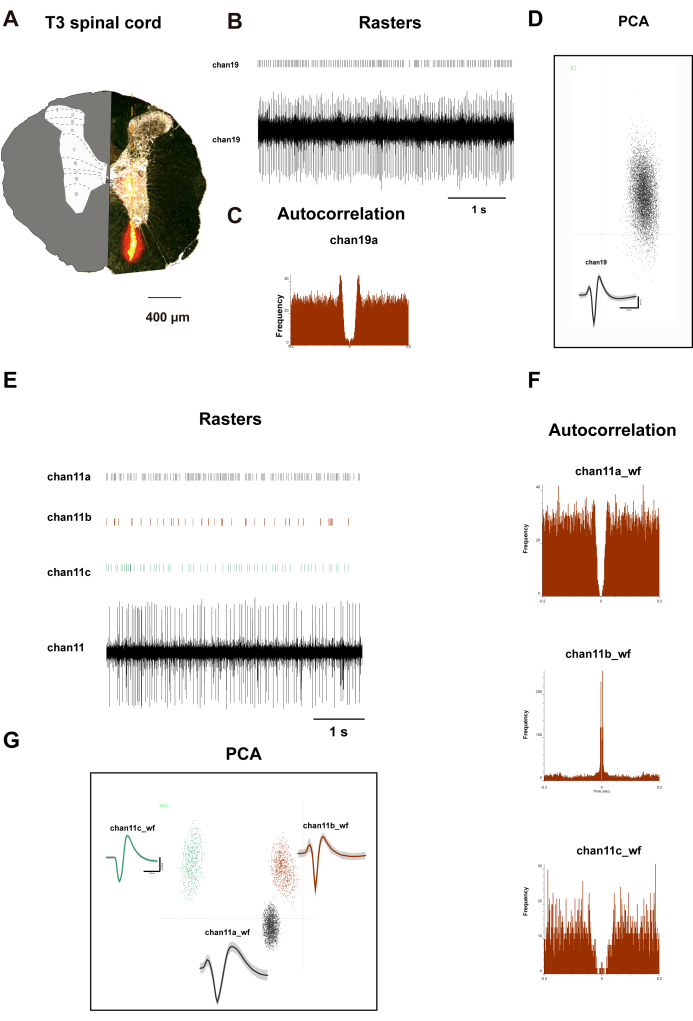
図2:T3脊髄後角ニューロンの記録 (A)電極配置の検証:32チャンネルシリコンプローブの移植トラックを示す脊髄横断部。挿入図:空間レジストレーションのために重ね合わせられた細胞アーキテクトニック層境界(I-X)を備えた修正されたPaxinosラット脊髄アトラス。グラフは、(B,E) チャネル 19 とチャネル 11 のニューロン発火ラスターと波形、(D,G) PCA クラスタリングとクラスター図、(C,F) 自己相関を示しています。パネル C と F に描かれた中央対称のパターンは、チャネル19とチャネル11のニューロンに記録されたニューロンの特徴的な発火パターンを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
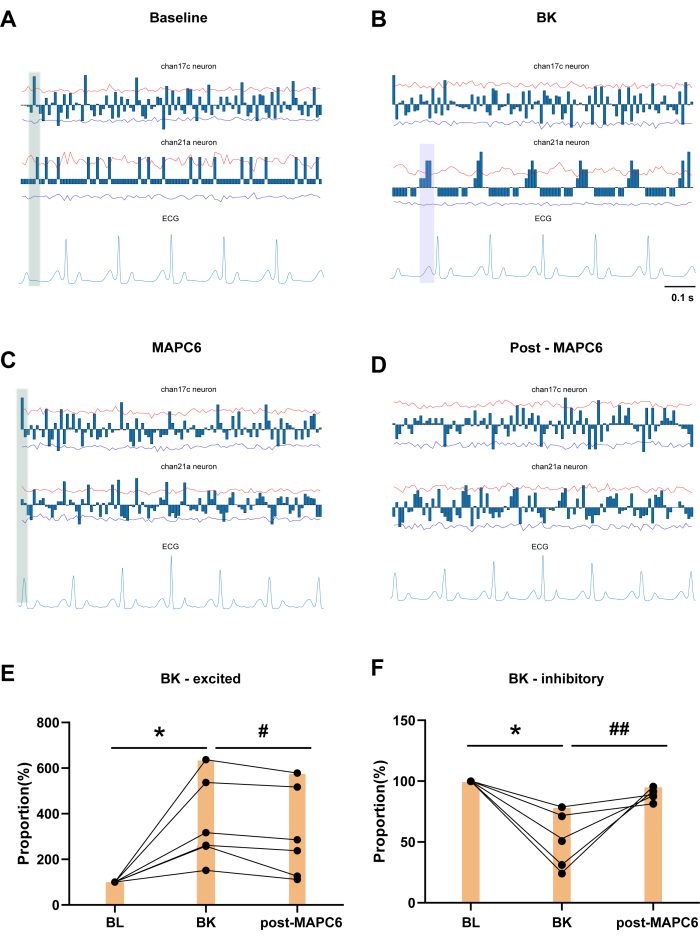
図3:T3 SDHNに対する心膜への局所BK適用の影響と心臓ロックニューロンの例(A)チャネル17cおよびチャネル21aニューロンは、T3 SDRにおける心臓ロックニューロンの存在を示しています。(B) BK投与後30分以内のロッキング度の変化 (C,D) 心臓ロックニューロンMAPC6を1分間、MAPC6を1分間後とする例 (E,F) MAPC6後のBKに応答するニューロンの周波数比率の変化。エラーバーは平均±SEM(N = 6)を表します。*P<0.05、BL #P < 0.05、##P < 0.01、BKと比較して。対応のあるt検定を使用しました。略語:BL =ベースライン;BK =ブラジキニン;MAPC6 =内関(PC6)での手動鍼治療。この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:ECGロックされたニューロン活動分析。 70行目:condition={[t1_start,t1_end], [t2_start,t2_end], ...}の時間範囲を変更してください。71行目の実験フェーズラベルを調整します: conditiontitle = {'baseline','EA1','EA2'};条件で定義された時間範囲に合わせます。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
SDHニューロンコーディングプロファイルの解読は、鍼治療による内臓機能障害に対する治療効果の神経調節メカニズムを理解するために不可欠です。ここでは、MEA in vivo 記録技術とECG記録システムを組み合わせて、T3 SDHNとECGの放電活性を同時に記録しました。心臓の痛みの刺激は、心臓を神経支配し、内臓、DRG、T1-T5脊髄、および脊髄上を通じて前方に侵害受容情報を伝達するC型侵害受容器を活性化できます。交感神経求心性線維は背角に入り、介在ニューロンに中継し、脊髄の外側角の節前ニューロンに投射します。これらの節前線維は、白いラミコミュニカンスに入り、交感神経鎖に結合し、そこで星状神経節(SG)に直接または上向きに節後ニューロンに変換され、下頸神経節および中頸神経節シナプスと節後ニューロンに変換されて心拍数を制御します13。
心血管疾患の治療におけるPC6ツボのメカニズムは非常に複雑で、完全には明らかにされていません。現在、体性交感神経反射経路は、より重要な経路の1つと考えられています。この研究では、PC6 ツボでの鍼治療が T3 脊髄内の心臓ロックニューロンとロック解除ニューロンに及ぼす調節効果を調べます。文献では、SDH14,15の(ワイドダイナミックレンジ[WDR])ニューロンの放電を記録するためにMEA記録技術が使用されています。ただし、T3脊髄は肋骨と胸椎の近くに位置しているため、外科的処置中に気胸のリスクが高くなります。ほとんどのin vivo技術と同様に、T3脊髄背角ニューロンは多くの実験で記録されていません。脊髄の安定性の記録は、脊椎安定化装置と適切な麻酔に大きく依存します16。腰椎を安定させる傾向がある市販の脊椎クランプの制限を考慮して、ここでは、最初に胸椎に合うように脊椎クランプを変更しました。変更された脊椎クランパーは、一対のAdson鉗子、金属キャップ、丸棒、ナット、およびネジで構成されています。成重STS-BおよびSRデバイスに特注クランパーを装着したところ、ラットの背骨を安定させ、組織の変位を防ぐことができました。脊髄の背下角電極のために十分なスペースが残されました。
多くの研究が、鍼治療が視床下部、中脳、および髄質領域の調節を通じて心血管疾患に治療効果を発揮する可能性があることを報告していますが、脊髄17にはあまり注意が払われていません。さらに、研究者は、機能的戦略ではなく分子的戦略を通じてその神経調節メカニズムを実証することに慣れています18。心病態生理学におけるSDHNの極めて重要な機能と鍼治療の効果への関与を考慮すると、鍼治療が機能レベルでのSDHN活性の調節を通じて心機能に影響を与える科学的メカニズムを明らかにするための堅牢な分析方法を開発することが不可欠です。Liらは、T1後根神経節ニューロンのカルシウムイメージングと心電図の同時記録方法を報告したが、カルシウムイメージングの時間分解能は低く、DRG電気信号と心電図信号のミリ秒レベルでの結合は検出できない9。
SDH電気生理学的記録に関しては、QinらはSDHN活性と心電図を同時に記録した19が、単一電極記録法のため記録磁束は低かった。そこで、本研究では、MEA電気生理学と心電図記録を併用し、ハイスループットな神経細胞放電信号と心電図信号を同時に取得しました。これに基づいて、NTSニューロンの放電とECG信号との結合の程度を解析するための解析方法を参照し、脊髄ニューロンの放電とECG信号の結合の程度を記述する解析コードをMATLAB20で記述します。改造は市販の鉗子を使用して達成されたため、クランプアームの形状は、将来、胸椎の形状に合わせて設計し、腫れを減らしてより良い固定効果を達成する必要があります。このアプローチは、ニューロンのダイナミクスを研究するための強力なツールを提供しますが、分子的に定義されたニューロンの大規模な集団を測定するにはいくつかの制限もあります。将来的には、電気生理学的方法と光学的方法の組み合わせは、鍼治療の科学的基礎についての理解を深めるために大きな意味を持つかもしれません。
内受容感覚と内臓の神経系の調節は、常に神経科学研究の焦点でした21,22。鍼治療などの体表刺激は、身体求心性を活性化し、神経活動と内臓機能の変化を調節することができる23。研究によると、心臓の内臓侵害受容情報は、胸部セグメント1-524の脊髄背角に事前に伝達されることが示されている。脊髄刺激は難治性狭心症の治療にも示されており、対応する脊髄の神経ネットワークの調節が心臓の痛みを緩和する可能性があることを示しています。しかし、私たちの知る限りでは、心臓痛時の脊髄ニューロンの活動の変化や、末梢刺激の根底にある脊髄メカニズムはよくわかっていません。この研究では、T3 SDHN放電信号とECG信号を同時に取得および解析する方法について詳しく説明します。この方法は、鍼治療やその他の末梢刺激が脊髄の心血管ニューロンに及ぼす調節の影響について、重要な洞察を提供します。さらに、自律神経反射メカニズムを介した鍼治療の標的臓器効果に関する実質的な洞察を提供します。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
本研究は、中国国家自然科学基金会(第82330127号、第82105029号)、中国国家重点研究開発プログラム(第2022YFC3500702号)、中央厚生研究所基礎研究費(第2022号)の助成を受けて行われました。ZZ-2023008)と州教育局プロジェクト(No.2019JM-027)の2019年10月15日を199年10月19日、州教育局プロジェクトとして認定しました。
資料
| Name | Company | Catalog Number | Comments |
| Anesthesia System | Kent Scientific | SomnoSuite | |
| Central v6.5 | Black Microsystems | Cerebus-128 | |
| Fine Scissors | Fine Scissors | Fine Scissors | |
| Friedman-Pearson Rongeurs | Fine Science T ools | 16220-14 | |
| Gelatin Sponges | Coltene | 274-007 | |
| Intubation Cannula | Harward Apparatus | 73-2737 | |
| Isoflurane | RWD | R510 | |
| LabChart Professional Software | LabChart Professional Software | Version 8.0 | |
| microband electrode array | Neuronexus | A1x32-6mm-50-177 | |
| micromanipulator | Narishige | DMA-1510 | |
| needles | Zhongyantaihe | 0.25 mm x 0.25 mm | |
| NeuroExplorer software (V5.0) | Plexon | V5.0 | |
| offline Sorter | Plexon | V4.0 | |
| Powerlab | ADInstruments | PL26T04 | |
| rats | the Experimental Center of the Academy of Military Medical Sciences of the People's Liberation Army of China | ||
| Spinal Adaptor | N/A | N/A | Custom made |
| Spring Scissors | Fine Science Tools | 15023-10 | |
| stereotactic instrument | Narishige | SR-5R-HT |
参考文献
- Nakahara, H., Ueda, S. Y., Kawai, E., Higashiura, R., Miyamoto, T. Effects of pre-exercise acupuncture stimulation on heart rate response during short-duration exercise. BMC Sports Sci Med Rehabil. 13 (1), 129(2021).
- de Lima Pimentel, R., Duque, A. P., Moreira, B. R., Rodrigues, L. F. J. Acupuncture for the treatment of cardiovascular diseases: A systematic review. J Acupunct Meridian Stud. 12 (2), 43-51 (2019).
- Ma, Q. A functional subdivision within the somatosensory system and its implications for pain research. Neuron. 110 (5), 749-769 (2022).
- Hsieh, M. T., Donaldson, L. F., Lumb, B. M. Differential contributions of A- and C-nociceptors to primary and secondary inflammatory hypersensitivity in the rat. Pain. 156 (6), 1074-1083 (2015).
- Meyr, A. J., Steinberg, J. S. The physiology of the acute pain pathway. Clin Podiatr Med Surg. 25 (3), 305-326 (2008).
- Ardell, J. L. Heart failure: Mechanisms of spinal cord neuromodulation for heart disease. Nat Rev Cardiol. 13 (3), 127-128 (2016).
- Xi, H., et al. Continuous peripheral electrical nerve stimulation improves cardiac function via autonomic nerve regulation in MI rats. Heart Rhythm. 21 (10), 2010-2019 (2024).
- Cui, X., et al. Referred somatic hyperalgesia mediates cardiac regulation by the activation of sympathetic nerves in a rat model of myocardial ischemia. Neurosci Bull. 38 (4), 386-402 (2022).
- Li, X., et al. In vivo thoracic dorsal root ganglia (DRG) calcium imaging and ECG recording for studying reripheral nerve stimulation. J Vis Exp. (210), e67283(2024).
- Azhar, A., El-Bassossy, H. M. Pentoxifylline alleviates cardiac ischemia and dysfunction following experimental angina in insulin resistance. PLoS One. 9 (5), e98281(2014).
- Liu, X., Zhang, Q., Han, M., Du, J. Intrapericardial capsaicin and bradykinin induce different cardiac-somatic and cardiovascular reflexes in rats. Auton Neurosci. 198, 28-32 (2016).
- Metropolis, N., Ulam, S. The Monte Carlo method. J Am StatAssoc. 44 (247), 335-341 (1949).
- Coote, J. H., Chauhan, R. A. The sympathetic innervation of the heart: Important new insights. Auton Neurosci. 199, 17-23 (2016).
- Sun, X. Y., et al. Inhibitory effect of acupoint electrostimulation with different layers and intensities on muscular inflammatory pain and spinal WDR neuron activity. Zhen Ci Yan Jiu. 49 (2), 103-109 (2024).
- Duan-Mu, C. L., et al. Electroacupuncture-induced muscular inflammatory pain relief was associated with activation of low-threshold mechanoreceptor neurons and inhibition of wide dynamic range neurons in spinal dorsal horn. Front Neurosci. 15, 687173(2021).
- Davalos, D., Akassoglou, K. In vivo imaging of the mouse spinal cord using two-photon microscopy. J Vis Exp. (59), e2760(2012).
- Li, P. Neural mechanisms of the effect of acupuncture. International Congress Series. 1238, 71-77 (2002).
- Wu, X. L., et al. Acupuncture modulation of the ACE/Ang II/AT1R and ACE2/Ang(1-7)/MasR pathways in the rostral ventrolateral medulla reduces sympathetic output and prevents cardiac injury caused by SHR hypertension. Neuroreport. 35 (13), 839-845 (2024).
- Qin, C., Farber, J. P., Foreman, R. D. Gastrocardiac afferent convergence in upper thoracic spinal neurons: a central mechanism of postprandial angina pectoris. J Pain. 8 (6), 522-529 (2007).
- Yao, Y., et al. Cardiovascular baroreflex circuit moonlights in sleep control. Neuron. 110 (23), 3986-3999.e6 (2022).
- Liu, S., et al. Somatotopic organization and intensity dependence in driving distinct NPY-expressing sympathetic pathways by electroacupuncture. Neuron. 108 (3), 436-450.e7 (2020).
- Liu, S., et al. A neuroanatomical basis for electroacupuncture to drive the vagal-adrenal axis. Nature. 598 (7882), 641-645 (2021).
- Ma, Q. Somatotopic organization of autonomic reflexes by acupuncture. Curr Opin Neurobiol. 76, 102602(2022).
- Wang, J., et al. Spinal cord stimulation reduces cardiac pain through microglial deactivation in rats with chronic myocardial ischemia. Mol Med Rep. 24 (6), 835(2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved