Method Article
표피 각질 세포 증식 역학을 연구하기 위한 타임랩스 사진을 사용한 라이브 셀 이미징
요약
여기에서는 계대 0 각질세포의 계통을 수동으로 추적하는 데 사용할 수 있고 세포 분열 운명 및 세포 주기 기간을 포함한 증식 지표를 수집할 수 있는 살아있는 세포 이미징 분석 방법을 제공합니다.
초록
생세포 이미징은 in vitro에서 각질 세포 거동을 연구하기 위해 진화하고 있지만 다소 어려운 방법입니다. 역사적으로 각질세포 분열 거동은 클론 분석, 면역염색 및 세포주기 분석과 같은 방법을 통해 조사되었습니다. 이러한 방법 중 어느 것도 단일 세포 수준에서 각질 세포 거동을 실시간으로 분석할 수 없습니다. 지난 10년 동안 그룹들은 라벨링 없이 각질세포 줄기세포와 헌신적인 전구세포를 식별하기 위해 살아있는 세포 이미징을 활용했습니다. 각 그룹의 분열 행동, 말단 분화 속도 및 세포 주기 지속 시간에서 차이점이 확인되었습니다. 여기에서는 타임랩스 사진을 이용한 각질세포 생세포 이미징 방법과 그 분석에 대해 설명합니다. 이 방법은 in vivo 행동을 가장 밀접하게 모방하기 위해 비계대 각질 세포를 사용하는 것이 좋습니다. 라이브 셀 이미징은 단일 세포 수준에서 줄기 세포 및 투입된 전구 세포 행동을 연구하고 분열 운명, 세포 주기 기간 및 기타 증식 지표를 결정할 수 있는 고유한 기능을 제공합니다.
서문
세포 집단이 장기간에 걸쳐 확장됨에 따라 실시간으로 in vitro 에서 세포 집단을 시각화할 수 있는 기능은 라이브 셀 이미징의 고유한 이점입니다. 라이브 셀 이미징을 통해 세포 운동성, 이동 및 증식을 단일 세포 수준에서 평가할 수 있습니다. 이 프로토콜의 목표는 타임 랩스 사진을 통해 각질 세포 배양의 시각화를 최적화하고, 세포 거동에 대한 세분화된 데이터를 얻기 위해 수동으로 추적할 수 있는 비디오를 제작하는 것입니다.
우리의 초점은 증식 역학에 있습니다. 살아있는 세포 이미징 비디오의 분석을 통해 계통 트리를 설명할 수 있으며, 분열 사이의 시간(세포주기 기간에 대한 대리자)과 딸 세포의 추가 분열 대 분화로 이어지는 분열의 비율을 평가할 수 있습니다.
1차 각질세포를 다룰 때 기증자 간 변동성이 크며 세포 증식 시도가 자주 실패합니다. 이 때문에 많은 연구자들은 종종 in vitro1에서 여러 번의 계대를 거친 후에 HaCaT 세포 또는 신생아 각질세포와 같은 증식성이 높은 각질세포를 사용하기로 선택합니다. 혈통 추적을 위해 성인 또는 노화된 피부에서 1차 각질세포를 배양하는 것은 어려울 수 있습니다. 그러나 세포주 또는 남성 포피에서 배양된 세포를 사용하는 데에는 문제가 있습니다. 반복적인 계대 배양은 세포에서 생체 내 상태와 현저히 다른 결과를 낳습니다2. 또한, HaCaT 세포는 여러 분석에서 일차 각질세포와 다르게 반응하는 것으로 나타났습니다 3,4,5. in vivo 세포와 가장 유사한 세포를 활용하기 위해 성인 인간 기증자의 계대 0 각질세포를 활용합니다. 각질세포 줄기세포(Keratinocyte stem cell)와 헌신적인 전구세포(committed progenitor)는 행동에서 뚜렷한 차이를 보이기 때문에 두 집단의 콜로니(colony)를 살아있는 세포 이미징(live cell imaging)을 통해 구별할 수 있습니다6. 장기간에 걸쳐 단일 각질세포의 거동을 시각화할 수 있는 비교적 새로운 능력은 유사한 기술을 사용한 소수의 이전 연구에서만 사용되었다 6,7,8. 이 프로토콜은 IncuCyte S3 Live-Cell Analysis System을 활용하는 일차 각질세포의 라이브 셀 이미징을 간략하게 설명합니다. 구성된 계통 나무에서 군체 유형(줄기세포 대 헌신적인 전구세포)과 세포 주기 지속 기간 및 분화 분열의 비율을 결정할 수 있습니다.
프로토콜
이 연구는 헬싱키 선언에 따라 수행되었습니다. 모든 인체 조직은 UCSF(University of California, San Francisco) IRB(institutional review board)의 승인을 받은 후 획득했으며, 사용된 모든 조직에 대해 동의를 얻었습니다.
1. 통로 0 인간 각질 세포의 저속 촬영
참고: 이 프로토콜은 IncuCyte S3 및 SX5에만 해당됩니다.
- 연구에 인체 조직을 사용하기 위해 기관의 인간 연구 위원회로부터 적절한 승인을 받았는지 확인합니다.
- 앞서 설명한 바와 같이 신선한 피부에서 각질 세포를 분리한다9.
- 분석에 대한 시딩 밀도를 측정합니다. 서로 다른 공여자의 여러 희석된 샘플로 파일럿 연구를 실행하여 연구를 위한 적절한 콜로니를 확보하고 관찰 기간 동안 콜로니 중복을 초래하는 과도한 콜로니를 방지하는 데 필요한 세포의 밀도를 이해합니다. 이러한 요인이 결과를 변경할 수 있으므로 동일한 실험 조건(동일한 플레이트, 시약 등)에서 이러한 파일럿을 실행합니다.
참고: 파종 밀도가 너무 낮으면 성장이 불충분해지는 반면, 파종 밀도가 너무 높으면 현장에 세포가 밀집되어 세포를 정확하게 추적할 수 없게 됩니다.- 채취 매체에서 4°C로 보관된 채취에서 48시간 미만의 신생아 포피에서 Passage 0 각질세포의 경우 파종 밀도가 1000-5000/cm2인지 확인하십시오. P1 각질 세포의 경우 500-2000 cells/cm2를 사용합니다. 통로가 멀어질수록 파종 밀도가 낮아집니다.
- 선택한 플레이트 크기의 플레이트 셀.
참고: 96개의 웰 플레이트와 마이크로플레이트는 반월판 효과가 있어 불균일한 세포 분포를 초래하며 성장의 대부분은 이미저 필드 밖에 있습니다. 더 큰 웰이 있는 플레이트(예: 24웰 플레이트)를 사용하면 더 많은 데이터를 캡처할 수 있습니다. 24웰 플레이트를 사용하면 최대 36개 필드를 시각화할 수 있는 반면, 96웰 플레이트를 사용하면 최대 5개 필드만 시각화할 수 있습니다. 그러나 기기에서 캡처하는 필드의 수는 유한하며 더 많은 필드가 이미저의 용량을 더 많이 사용하게 됩니다. 일반적으로 24웰 플레이트가 사용됩니다.- 플레이트에 세포가 고르게 분포되도록 다양한 기술을 사용할 수 있습니다. 먼저, 각 웰을 개별적으로 파종하는 대신 특정 희석액에서 모든 웰에 필요한 총 배지를 마이크로튜브로 분취합니다. 그런 다음 부분 표본이 원하는 밀도에 도달하는 데 필요한 총 세포 수를 피펫팅하고 튜브를 부드럽게 뒤집어 세포를 균일하게 분포시킵니다.
- 도금 후 플레이트를 십자형으로 세 번(위아래, 왼쪽-오른쪽) 움직인 후 조심스럽게 인큐베이터로 옮깁니다.
주의 : 마이크로플레이트를 사용하는 경우 타임 랩스 현미경은 이미징 시 열을 발생시키고 해당 웰에서 매체의 증발을 유발할 수 있으므로 웰의 바깥쪽 행과 열을 피하십시오. 실험용 웰은 플레이트 중앙에 그룹화되어야 하며 증발/가장자리 효과를 줄이기 위해 최대 용량으로 PBS 또는 기타 멸균 유체를 포함하는 웰로 둘러싸야 합니다.
- 37°C 및 5% CO2 에서 24시간 동안 세포를 배양하여 접착을 허용합니다.
- 24시간 후에 미디어를 교체하십시오.
알림: 흡입 시 성장하는 단층을 방해하지 마십시오. 항상 데워진 매체(37°C)를 사용하고 측벽을 사용하여 매체를 웰로 부드럽게 흘려보냅니다. 여기에 사용된 배지는 Epilife/Supplement S7/Primocin입니다. 이 응용 분야에는 장기 라이브 셀 이미징을 위해 배지에 항생제를 사용하는 것이 좋습니다. 여러 동시 실험에 사용되는 기계에서 확장된 배양은 오염 위험이 높습니다. 페니실린(Penicillin)과 스트렙토마이신(streptomycin)이 일반적으로 사용됩니다. - 왼쪽 하단의 큰 삼각형 버튼을 눌러 인큐베이터를 열고 표시등이 녹색일 때 트레이를 엽니다. 선박을 열린 베이에 넣으십시오. 그런 다음 왼쪽 하단의 동일한 버튼을 사용하여 트레이를 닫습니다. 열려는 버튼이 빨간색일 때 트레이를 열지 마십시오. 이는 활발하게 스캔 중임을 의미하며 스캔이 중단된다는 의미입니다.
주의: 컨트롤러 모듈의 화면을 보는 것부터 시작하여 스캔이 없는지 확인합니다. 다음 스캔까지의 시간과 스캔 길이를 알려줍니다. 스캔이 시작되면 스캔이 완료될 때까지 시간을 제공합니다. - 컴퓨터에서 응용 프로그램을 열고 적절한 사용자 ID와 암호를 사용하여 로그인합니다. 일정을 선택합니다.
- 일정 아래 왼쪽 상단 모서리에 있는 + 버튼을 눌러 일정에 플레이트를 추가합니다.
- Scan on Schedule(일정에 따라 스캔)을 선택하고 Next(다음)를 클릭합니다.
- New(새로 만들기)를 선택하고 Next(다음)를 클릭합니다.
참고: 이 플레이트가 이전 또는 실행 중인 실험과 동일한 경우 이전 복사 또는 현재 복사 를 사용하여 실험 형식을 신속하게 지정할 수 있습니다. - 스캔 유형으로 표준을 선택하고 다음을 클릭합니다.
참고: Image Lock은 초점 손실/이미지 점프 발생을 최소화하는 데 도움이 되는 독점적인 96웰 플레이트로, 이러한 문제에 직면한 경우 도움이 될 수 있습니다. 다른 스캔 유형은 계보 추적에 특히 유용하지 않습니다. - 스캔 설정의 경우 10x objective에서 phase channel using the phase channel 를 선택하고 Next를 클릭합니다.
참고: 위상 채널을 선택하는 한, 데이터가 캡처된 후 분석을 시작할 수 있으므로 이 시점에서 분석 옵션을 선택할 필요가 없습니다. - 선박을 선택하고 Next(다음)를 클릭합니다. 대부분의 일반적인 용기는 기계와 호환되지만 마이크로플레이트가 아닌 용기는 타임랩스 현미경의 베이에 맞도록 특수 부착물이 필요할 수 있습니다.
- 선박을 배치할 빈 베이를 선택하고 Next(다음)를 클릭합니다.
- 스캔할 웰과 웰별 이미지를 선택하고 Next(다음)를 클릭합니다. 예상 검사 시간은 화면 왼쪽 하단에 제공됩니다.
- 원하는 명명 규칙을 사용하여 실험의 이름을 지정합니다. 나중에 참조할 수 있도록 실험의 플레이트 맵을 만든 다음 확인을 누릅니다. 마지막으로 다음을 클릭합니다.
- 스캔이 완료된 후 세포별 분석을 시작해야 하므로 데이터 수집 후까지 분석을 연기합니다. 다음을 클릭합니다.
- 마지막으로 이미징 빈도를 설정합니다. 30분 동안 발생하는 유사분열을 안정적으로 추적하려면 20분 간격으로 각질 세포를 스캔합니다. 다음을 누르고 설정을 확인하여 실험을 시작합니다.
참고: 스캔 시간은 겹칠 수 없으며 제조업체는 스캔하는 동안 기기를 유휴 상태로 둘 것을 권장합니다. 20분 간격은 최대 10분을 스캔하는 데 소요된다는 것을 의미합니다. 24웰 플레이트의 12웰이 웰당 36개의 뷰로 이미지화되는 경우 스캔을 완료하는 데 7분이 걸리므로 계획을 세울 때 실험에 사용할 수 있는 리소스를 항상 염두에 두어야 합니다.- 기계를 쉴 시간이 충분하지 않은 경우 알림이 표시되며, 스캔 시간이 겹치면 선박을 일정에 추가할 수 없습니다. 선박이 일정한 간격으로 일정에 맞지 않으면 트레이 위치 예약을 클릭하고 다음을 누르십시오.
- 화면 상단의 일정을 두 번 클릭하고 예비 선박을 선택한 다음 수동으로 클릭하여 열린 시간 슬롯에 이미지를 추가합니다. 또는 일정이 열리면 마우스 오른쪽 버튼을 클릭하여 예약된 모든 스캔 시간을 삭제하고 마우스 오른쪽 버튼을 클릭하여 정기적으로 스캔 그룹에 대한 새 스캔 시간을 설정합니다.
참고: 이렇게 하면 새 시간이 설정될 때까지 현재 기계에 있는 모든 실험이 중단됩니다. 플로피 디스크 아이콘을 눌러 저장하거나 빨간색 X를 눌러 일정 변경을 취소하는 것을 잊지 마십시오. 원하는 웰 또는 뷰를 선택하는 것은 기계가 매개변수 선택 시 예상 스캔 시간을 즉시 제공하기 때문에 간단한 프로세스입니다. 스캔 기간은 선택한 플레이트의 유형과 브랜드, 스캔할 웰 또는 보기의 수에 따라 다릅니다. 이를 통해 사용자는 기계의 용량에 맞게 스캔 매개변수를 조정할 수 있습니다.
- 각질세포의 경우 48시간마다 배지를 교체하십시오. 올바른 플레이트 방향을 보장하려면 용기가 기계에 배치될 때마다 첫 번째 스캔이 완료될 때까지 기다립니다(시간이 허용하는 경우). 그것은 간단한 실수입니다. 행을 나타내는 문자가 베이의 왼쪽에 오도록 플레이트를 기계에 놓습니다.
- 스캔을 보려면 눈 아이콘이 있는 보기 버튼을 누른 다음 실험을 두 번 클릭합니다. 배지의 색이 갑자기 변하거나(산성화로 인해 페놀 레드 함유 배지가 노란색으로 변함), 과도한 죽은 세포가 있거나(살아있는 군체의 증식을 방해할 수 있음) 비정상적인 형태가 관찰되는 경우 배지를 조기에 교체하는 것이 좋습니다.
- 모든 우물이 정지 상태가 되거나 합류점에 도달하면 실험을 내보냅니다. 성체 집락을 ~2주 동안, 신생아를 ~10일 동안 추적하며, 이 시기에는 밀집이 발생하여 분석에 대한 수익이 감소합니다.
- 내보내려면 보기 탭을 클릭하고 최근 검사 목록 아래에서 실험을 두 번 클릭합니다(기본값은 가장 최근의 검사부터 뒤로 정렬됨). 화살표가 있는 랜드스케이프 아이콘을 클릭하고 익스포트 툴이 실행될 때까지 기다립니다.
- 표시된 대로(As displayed)를 클릭한 후 다음(Next)을 클릭합니다.
- 내보낼 각 시야를 수동으로 클릭하고 Next(다음)를 클릭합니다.
- 영화 또는 일련의 이미지를 원하는지 여부를 선택한 다음 내보낼 스캔 시간을 선택합니다. 각질 세포 계통 추적의 경우 영화 옵션을 사용하고 모든 스캔을 선택합니다(이를 신속하게 처리하기 위해 점선이 있는 빠른 모두 선택 아이콘이 있음). 다음을 클릭합니다.
- 최대 품질로 초당 1프레임으로 내보냅니다(품질 옆에 있는 막대를 사용하여 설정). 다음을 클릭합니다.
- 대상 폴더와 파일 형식을 선택합니다. 파일 이름을 지정한 다음 내보내기를 클릭합니다.
참고: 인터넷 연결 속도와 관련 컴퓨터의 속도에 따라 비디오를 내보내는 데 시간이 오래 걸릴 수 있습니다. 대규모 실험을 위해 모든 동영상 파일을 내보낼 때까지 며칠을 기다릴 수 있습니다. 타임 랩스 현미경에 원격으로 로그인할 수 있는 기능은 매우 편리합니다.
2. 타임랩스 이미징을 사용하여 계보 트리 구성 및 데이터 시트 생성
- 미디어 플레이어를 사용하여 비디오 파일을 엽니다. VLC 미디어 플레이어를 권장합니다.
- 비디오를 스크롤하여 성장하는 군체를 확인하십시오. VLC를 사용하는 경우 화살표 키를 사용하여 프레임을 앞뒤로 건너뜁니다. 추적할 식민지의 스크린샷을 찍고 식민지에 레이블을 지정합니다.
- 비디오 녹화가 끝날 때 또는 며칠 후에 관심 군체를 식별한 다음 비디오를 되감고 군집 형성 세포를 식별합니다.
참고: 여기에서 적절한 시딩 밀도를 갖는 것이 중요합니다. 너무 많은 군체가 나란히 발달하면 서로 확장되고 병합되어 세포 분열을 정확하게 추적할 수 없게 됩니다. - 세포가 분열하려고 할 때, 세포는 응축되는 것처럼 보입니다(그림 1). 분할이 발생하면 비디오를 일시 중지합니다. 분할 시간을 기록합니다(타임스탬프는 왼쪽 하단 모서리에 있음). 이 초기 구분을 스크린샷하고 콜로니와 동일한 레이블을 지정합니다. 손으로 그린 계보 다이어그램에 분할을 기록합니다(대표 결과 참조). 가능한 한 많은 세대를 계속 추적하고 문서화합니다.
참고: 이 프로세스를 촉진하고 세포를 보다 정확하게 추적하기 위해 자동 세포 추적이 개발되고 있습니다7. 분화가 최소화된 저칼슘 배양 조건에서도 기계 학습 모델은 현재 각질 세포 분열을 정확하게 추적할 수 있는 감도가 부족합니다. - 수동 계보 트리를 데이터 시트로 기록하십시오 - 스프레드시트의 색상 때문에 "녹색 시트"라고 합니다(보충 파일 1).
- 녹색 시트를 사용하여 증식 분열과 분화 분열의 비율을 계산하고, 줄기 세포와 투입된 전구 세포 군집체를 식별하고, 세포 주기 기간을 확인할 수 있습니다(대표 결과 참조).
참고: 이 기계는 자체 기본 및 세포별 분석기를 통해 데이터를 분석하여 여러 다른 분석(confluence, scratch)을 실행할 수 있습니다. 그러나 이것은 이 프로토콜의 범위를 벗어납니다.
결과
원발성 각질세포는 정형화된 방식으로 성장하며, 이는 살아있는 세포 이미징을 통해 추적할 수 있습니다. VLC 미디어 플레이어는 녹음을 조사하는 데 사용됩니다. 첫 번째 분할까지의 시간은 가변적이며 연령, 건강 상태 또는 체외 환경에 존재하는 성장 인자와 같은 기증자의 특성에 따라 며칠이 될 수 있습니다. 초기 파종 시에는 각질 세포가 작고 둥근 모양을 가지고 있습니다(그림 1). 파종 후, 콜로니를 형성하는 각질세포는 일반적으로 평평해집니다(그림 1). 이러한 납작한 각질세포는 분열하지 않는 각질세포보다 이동성이 더 높은 경향이 있습니다(보충 비디오 1). 분열 직전에는 편평한 각질세포가 중앙에서 응축된 것으로 보입니다(그림 1).
초기 분열을 제외하고, 분열(증식성 - P)할 각질세포의 95%가 이전 분열6으로부터 48시간 이내에 분열한다. 그렇지 않은 것들은 말기 분화된 것으로 간주됩니다(D)(그림 1)6. 이러한 분화된 세포는 관찰 기간이 끝날 때까지 또는 플레이트에서 들어 올려지고 후속 배지 변화 시 제거될 때까지 부착 상태를 유지합니다. 분화하는 세포는 시간이 지남에 따라 확장되는 경향이 있어 각질세포 집락의 형태가 균일하지 않습니다(그림 1). 관찰 기간이 끝나면 비디오를 내보내고 분석을 시작합니다(그림 2).
군체는 표준화된 프로세스를 사용하여 문서화됩니다. 콜로니가 위치한 비디오 접두사(A1, A2..., B1, B2...)가 사용되고 그 뒤에 콜로니 번호가 사용됩니다. 예를 들어, A2-6은 비디오 A2, 콜로니 6입니다. 분석은 계보 추적으로 시작됩니다. 군체를 식별하기 위해 비디오의 끝 부분으로 빠르게 이동한 다음 관찰 기간의 시작으로 되감아 원래 군체를 형성하는 세포를 식별합니다. 발생하는 모든 분할의 타임스탬프를 추적하고 직접 분기 다이어그램을 만들어 가능한 한 정확하게 수행할 수 있는 많은 세대를 추적합니다(그림 3). 결국에는 세포 밀도로 인해 세포 분열을 정확하게 추적하는 것이 더 이상 불가능해졌습니다(이는 일반적으로 5-7세대 경에 발생하며, 군집이 줄기 세포에서 유래했는지 아니면 헌신적인 전구 세포에서 유래했는지에 따라 달라집니다). 나중 세대에서는 식민지가 다른 식민지와 합쳐지거나 식민지가 화면 밖으로 사라지는 경우가 많습니다. 이 시점에서 추적 가능한 마지막 셀을 U(추적 불가)로 표시합니다. 항상 추적 중인 콜로니의 스크린샷을 찍고(VLC의 스냅샷 기능을 사용하여 수행할 수 있음) 위에서 설명한 명명법을 사용하여 콜로니를 표시합니다. 분석된 특정 비디오와 스크린샷과 일치시킬 수 있는 군집 번호를 포함하여 표준화된 명명법으로 스크린샷에 레이블을 지정해야 합니다.
분기 다이어그램이 구성되면 데이터를 스프레드 시트 또는 "그린 시트"(보충 파일 1)로 전송할 수 있습니다. 녹색 시트에는 분기 다이어그램을 통해 추적된 각 군체에 대해 동일한 레이블이 포함되어 있습니다. 세대를 쉽게 식별할 수 있도록 색상 강조 표시가 세대 간에 번갈아 나타납니다. 1세대의 시간 1은 세포를 도금한 후 타임랩스 현미경에 올려놓을 때까지의 기간을 나타냅니다. 보충 파일 1에서, 1세대의 시간 1은 24시간이며, 셀은 도금 후 24시간 후에 기계에 배치됩니다. 시간 2는 셀이 첫 번째 분열을 거칠 때까지의 기간을 나타냅니다. 비디오의 타임스탬프는 추가 24시간을 고려하지 않으므로 각 세대에서 시간을 수동으로 추가해야 합니다. 분기 다이어그램의 데이터를 그린 시트로 필사할 때 기계에서 제공하는 타임스탬프는 기록이 시작되기 전의 시간을 고려하지 않으므로 항상 분할 시간에 24시간을 추가합니다. ΔT는 세포주기 지속 시간입니다. 대부분의 연구6,8는 1세대의 ΔT가 항상 다음 세대의 ΔT보다 훨씬 길고 매우 가변적이어서 편향된 분석을 초래하기 때문에 분석에 포함하지 않습니다.
일단 그린 시트가 만들어지면, 어떤 콜로니가 줄기세포에서 유래하고 어떤 콜로니가 투신된 전구세포에서 유래하는지 결정할 수 있습니다. 주로 증식성 분열을 보이고(그림 1) 관찰 기간이 끝날 때까지 지속되는 군집은 줄기세포 군집(stemcell colonies)으로 간주된다6. 관찰 기간 동안 말단적으로 분화하는 군체(그림 1)는 committed progenitor colonies6로 간주된다. 그런 다음 줄기세포 콜로니와 투입된 전구 콜로니의 평균 ΔT를 각각 계산할 수 있습니다. 총 분열에 대한 D 분열의 비율을 나누면, 줄기 세포/투입된 전구 콜로니의 모든 풀링된 분열을 각각 또는 세대별로 분화 분열의 비율을 계산할 수 있습니다. 그린 시트는 정보를 효율적으로 얻기 위해 데이터를 구성하는 유용한 방법이며 연구 목표에 필요한 데이터와 통계에 따라 발전합니다.
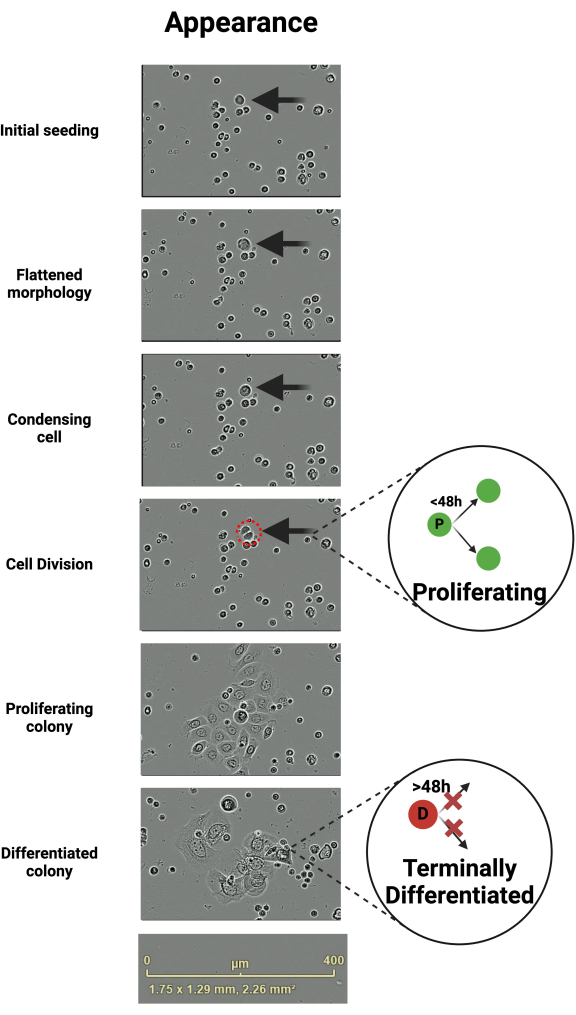
그림 1: 세포 분열 및 분열 용어로 이어지는 각질세포 형태의 변화. 각질세포는 세포 분열로 이어지는 형태학적 변화의 정형화된 순서를 통해 진행됩니다. 이 그림은 시간이 지남에 따라 이러한 일련의 사건을 겪는 각질 세포를 묘사합니다. 분열하려는 개별 세포는 운동성이 있으며 처음에는 편평한 형태를 취하고 분열 직전에 중앙에서 응축됩니다. 계속 증식할 딸세포는 생성된 후 48시간 이내에 분열하며, 그렇지 않으면 말기로 분화된 것으로 간주됩니다. 눈금 막대 400μm. BioRender에서 생성되었습니다. Ghadially, R. (2025) https://BioRender.com/k40e714 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 타임랩스 현미경에서 데이터 내보내기. 기기에서 데이터를 내보내는 방법에 대한 가이드입니다. BioRender에서 생성되었습니다. Ghadially, R. (2024) BioRender.com/x99d452 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
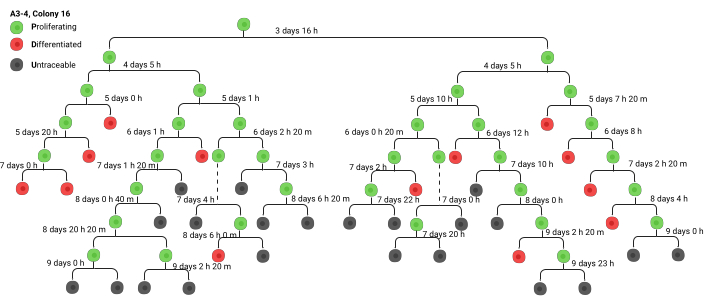
그림 3. Precursor Branch diagram (Lineage tree) (선구자 분기 다이어그램)는 녹색 시트 생성을 알립니다. 일반적으로 손으로 그린 계보 트리의 예입니다. 약어: h: 시간, m: 분. BioRender에서 생성되었습니다. Ghadially, R. (2025) https://BioRender.com/wbt7z8x 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1. 공개되지 않은 라이브 셀 이미징 데이터의 예시 데이터 시트(녹색 시트). 게시되지 않은 데이터를 포함하는 그린 시트의 예입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 비디오 1. 각질세포 라이브 셀 이미징 비디오의 예. 각질세포 집락을 추적하기에 적합한 세포 밀도를 가진 살아있는 세포 이미징 비디오 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
각질세포의 생세포 이미징은 줄기세포와 투질된 전구세포의 분열 거동을 추적하는 무표지 방법입니다. 표피의 유지가 줄기세포와 전구세포의 증식 동역학에 의존한다는 점을 감안할 때10, 이러한 각질세포 집단의 변화와 다양한 조건에서 이들이 어떻게 영향을 받는지에 대한 세분화된 이해는 발견된 결함을 개선하기 위한 치료법의 개발을 촉진합니다.
궁극적으로 라이브 셀 이미징을 통한 계통 추적은 사용 가능한 데이터를 얻는 데 달려 있습니다. 군집 형성 단위는 타임랩스 촬영으로 생성된 비디오에서 명확하게 볼 수 있어야 합니다. 새로 분리된 계대 0 세포에서는 진정한 클론 밀도를 얻기가 어렵습니다. 도금된 각질세포의 3%-4%만이 궁극적으로 콜로니를 형성합니다11. 세포가 너무 많으면 분열을 추적하거나 초기 군집 형성 세포를 식별하는 것조차 불가능할 수 있습니다. 세포가 너무 적으면 군체가 형성되지 않을 수 있습니다. 마찬가지로, 시야를 가리는 것은 무엇이든 계통 추적을 통해 세포를 추적할 수 없게 만듭니다. 섬유아세포 피더를 사용하면 섬유아세포가 시야를 가리기 때문에 분열을 추적하기 어려울 수 있습니다. 마찬가지로, 침전물, 세포 파편, 심지어 판 뚜껑의 응결도 성장하는 군체를 가릴 수 있습니다. 마이크로플레이트가 선택한 베이에 단단히 삽입되었는지 확인하지 않는 것과 같은 작은 작업조차도 이미지가 세포에 초점을 맞추지 않기 때문에 궁극적으로 실험 실패로 이어질 수 있습니다. 그렇기 때문에 군집이 기계에서 자라는 동안 매일 군체를 모니터링하고 첫 번째 스캔 후까지 항상 남아 있으며, 매체 교체를 위해 기계에서 마이크로플레이트를 제거할 때마다 타임랩스 사진으로 세포가 캡처되고 있는지 확인하는 것이 매우 중요합니다. 파편으로 인해 발생할 수 있는 또 다른 문제는 이미지 점프입니다. 일반적으로 현미경은 움직이지 않는 고정된 시야를 가지고 있지만, 파편이 쌓이거나 세포 밀도가 너무 높아지면 기계가 시야를 잃고 플레이트의 다른 부분으로 이동할 수 있습니다. 이를 피하기 위해 기계 제조업체는 초점 손실을 방지하는 그리드가 있는 특수 유형의 96웰 플레이트를 개발했습니다.
기계는 이미지를 캡처하는 동안 열을 발생시킵니다. 이미지를 캡처할 때 장치가 37°C로 평형을 이루도록 현미경이 포함된 인큐베이터의 온도를 36.5°C로 낮추는 것이 중요합니다. 표면적이 더 작은 플레이트(96웰 플레이트)를 사용하는 경우 추가로 발생하는 열을 고려하십시오. 주변 웰을 실험에 사용하지 말고(첫 번째 및 마지막 행/열) 실험용 웰을 다른 유체(멸균 PBS)로 최대한 채우고 통기성 테이프를 사용하여 매체의 증발 손실을 줄이는 것이 좋습니다. 가장자리 효과를 최소화하기 위해 조사할 수 있는 시판되는 플레이트가 있습니다12. 그러나 앞서 언급한 방법을 통해 권장되는 호환 가능한 마이크로플레이트를 사용할 수 있었습니다.
비디오를 분석할 때 조사관은 군체의 비정상적인 분열 패턴을 인식해야 합니다. 예를 들어, 10일 동안 한 시야 내에 분열이 없었고 시야의 가장자리에서 시작된 만연한 군체 형성이 있는 경우 새로운 군체의 첫 번째 분열이 될 가능성은 거의 없습니다. 주변 시야에서 성장하는 군체가 새로운 군체라기보다는 포획된 판의 부분을 잠식했을 가능성이 높습니다. 이는 소프트웨어 제품군에 로그인하여 확인할 수 있으며, 이 소프트웨어는 특정 시점의 전체 플레이트(기록된 모든 보기 포함)를 묘사하고 한 시야에서 다른 시야로 세포의 이동을 표시할 수 있습니다.
이 방법의 주요 한계는 노동 집약적인 특성입니다. 또한5세대 이후의 세포 분열을 추적하는 것은 어렵고 무엇이 언제 분열하는지 정확하게 포착하기 위해 비디오를 다시 시청하고 몇 시간의 작업이 필요합니다. 여러 가지 딥 러닝 자동 세포 추적 알고리즘이 개발되고 있으며, 이는 결국 향후 몇 년 동안 순수한 AI 기반 분석으로 이어질 것입니다 7,13,14. 그때까지는 이 프로토콜에 자세히 설명된 것과 같은 수동 추적이 계보 데이터를 개발할 수 있는 실현 가능한 방법입니다.
공개
없음.
감사의 말
이 작업은 미국(U.S.)의 Merit Review Award Number I01 CX001816의 지원을 받았습니다. 재향 군인 업무부 임상 과학 R&D(CSRD) 서비스. 이 내용은 미국 재향 군인회 또는 미국 정부의 견해를 나타내지 않습니다. 실험을 수행할 수 있도록 타임 랩스 현미경을 사용할 수 있도록 해주신 Michael Rosenblum 박사님께 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 96 Well Imagelock plate | Sartorius | BA-04856 | Suggested microplate compatible with machine if using a 96 well plate. |
| 24 well plate | Corning | 3524 | Suggested microplate compatible with machine if using a 24 well plate. |
| Amphotericin B, 50 mL | Corning | 30-003-CF | Dilute to 5x (comes in 100x stock) for 5x PSA - 1x for media changes |
| Epilife, 50 mL | Gibco | MEP1500CA | Add S7, consider primocin |
| IncuCyte S3 | Sartorius | 4637 | Imager (Zoom/SX5 acceptable alternatives) |
| Penicillin/Streptomycin, 100 mL | Corning | 30-002-Cl | Dilute to 5x (comes in 100x stock) |
| Primocin | Invivogen | ant-pm-05 | 1 mL per 500 mL media |
| Supplement S7 | Gibco | S0175 | Added to epilife |
참고문헌
- Mateu, R., et al. Functional differences between neonatal and adult fibroblasts and keratinocytes: Donor age affects epithelial-mesenchymal crosstalk in vitro. Int J Mol Med. 38 (4), 1063-1074 (2016).
- Handl, J., Čapek, J., Majtnerová, P., Báčová, J., Roušar, T. The effect of repeated passaging on the susceptibility of human proximal tubular HK-2 cells to toxic compounds. Physiol Res. 69 (4), 731-738 (2020).
- Moran, M. C., et al. Characterization of human keratinocyte cell lines for barrier studies. JID Innov. 1 (2), 100018(2021).
- Seo, M. -D., Kang, T. J., Lee, C. H., Lee, A. -Y., Noh, M. HaCaT keratinocytes and primary epidermal keratinocytes have different transcriptional profiles of cornified envelope-associated genes to T helper cell cytokines. Biomol Ther. 20 (2), 171-176 (2012).
- Jahn, M., et al. Different immortalized keratinocyte cell lines display distinct capabilities to differentiate and reconstitute an epidermis in vitro. Exp Dermatol. 33 (1), e14985(2024).
- Xiao, T., et al. Short cell cycle duration is a phenotype of human epidermal stem cells. Stem Cell Res Ther. 15 (1), 76(2024).
- Hirose, T., Kotoku, J., Toki, F., Nishimura, E. K., Nanba, D. Label-free quality control and identification of human keratinocyte stem cells by deep learning-based automated cell tracking. Stem Cells. 39 (8), 1091-1100 (2021).
- Roshan, A., Murai, K., Fowler, J., Simons, B. D., Nikolaidou-Neokosmidou, V., Jones, P. H. Human keratinocytes have two interconvertible modes of proliferation. Nat Cell Biol. 18 (2), 145-156 (2016).
- Abegaze, B., Ijeh, N., Vittimberga, B., Ghadially, R. Generating primary cultures for the purpose of keratinocyte live cell imaging. J Vis Exp. , In Press (2024).
- Piedrafita, G., et al. A single-progenitor model as the unifying paradigm of epidermal and esophageal epithelial maintenance in mice. Nat Commun. 11 (1), 1429(2020).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Dermatol. 28 (2), 107-112 (2019).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochem Biophys Rep. 26, 100987(2021).
- Malin-Mayor, C., et al. Automated reconstruction of whole-embryo cell lineages by learning from sparse annotations. Nat Biotechnol. 41 (1), 44-49 (2023).
- Waliman, M., et al. Automated cell lineage reconstruction using label-free 4D microscopy. Genetics. 228 (2), iyae135(2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유