Method Article
使用延时摄影进行活细胞成像以研究表皮角质形成细胞增殖动力学
摘要
在这里,我们提供了一种活细胞成像分析方法,可用于手动跟踪第 0 代角质形成细胞的谱系,并允许收集增殖指标,包括细胞分裂命运和细胞周期持续时间。
摘要
活细胞成像是一种不断发展且具有一定挑战性的方法,用于研究 体外角质形成细胞的行为。从历史上看,角质形成细胞分裂行为是通过克隆分析、免疫染色和细胞周期分析等方法研究的。这些方法都不允许在单细胞水平上实时分析角质形成细胞的行为。在过去的十年中,研究小组利用活细胞成像来识别角质形成细胞干细胞和定型祖细胞,而无需标记。已经确定了每个组的分裂行为、终末分化速率和细胞周期持续时间的差异。在这里,描述了一种使用延时摄影进行角质形成细胞活细胞成像的方法及其分析。建议利用未传代的角质形成细胞,以便该方法最接近 地模拟体内 行为。活细胞成像提供了一种独特的能力,可以在单细胞水平上研究干细胞和定型祖细胞的行为,并确定分裂命运、细胞周期持续时间以及其他增殖指标。
引言
活细胞成像能够在 细胞 群长时间扩增时实时可视化细胞群,这是活细胞成像的一个独特优势。活细胞成像允许在单细胞水平上评估细胞运动、迁移和增殖。该协议的目标是通过延时摄影优化角质形成细胞培养物的可视化,制作视频,然后可以手动跟踪以获得有关细胞行为的精细数据。
我们的重点是增殖动力学。从活细胞成像视频的分析中,可以阐明谱系树,并且可以评估分裂之间的时间(细胞周期持续时间的代表)以及导致子细胞进一步分裂与分化的分裂比例。
在处理原代角质形成细胞时,供体间存在很大的供体差异,并且细胞增殖的尝试经常失败。正因为如此,许多研究人员选择使用高度增殖的角质形成细胞,例如 HaCaT 细胞或新生儿角质形成细胞,通常是在它们经过体外多次传代1 之后。从成人或老年皮肤中培养原代角质形成细胞以进行谱系追踪可能具有挑战性。然而,使用来自细胞系或男性包皮的传代细胞存在问题。重复传代导致细胞与其体内状态显著不同2。此外,在多次检测中,HaCaT 细胞的反应与原代角质形成细胞不同 3,4,5。为了利用与体内对应物最相似的细胞,利用来自成人供体的 0 代角质形成细胞。角质形成细胞干细胞和定型祖细胞在行为上表现出明显的差异,这使得可以通过活细胞成像来区分来自任一群体的集落6。这种相对新颖的长期可视化单个角质形成细胞行为的能力仅在之前使用类似技术的少数研究中使用过 6,7,8。该方案概述了使用 IncuCyte S3 活细胞分析系统对原代角质形成细胞进行活细胞成像。从构建的谱系树中,可以确定集落类型(干细胞与定型祖细胞),以及细胞周期持续时间和分化分裂的比例。
研究方案
这项研究是根据赫尔辛基宣言进行的。所有人体组织均在加州大学旧金山分校 (UCSF) 机构审查委员会 (IRB) 批准后获得,并且使用的所有组织均获得同意。
1. 第 0 代人类角质形成细胞的延时摄影
注意:此协议特定于 IncuCyte S3 和 SX5。
- 确保已获得该机构人类研究委员会的适当批准,以使用人体组织进行研究。
- 如前所述,从新鲜皮肤中分离角质形成细胞9.
- 确定测定的接种密度。使用来自不同供体的多种稀释度的样品进行中试研究,以了解确保有足够的集落进行研究所需的细胞密度,同时防止过多的集落导致在观察期间出现集落重叠。在相同的实验条件(相同的板、试剂等)下运行这些试验,因为这些因素会改变结果。
注意:接种密度太低会导致生长不足,而接种密度过高会导致由于田间细胞拥挤而无法准确跟踪细胞。- 对于来自新生儿包皮的第0代角质形成细胞,来自储存在4°C的收集培养基中的集合,请确保接种密度为1000-5000 / cm2。对于 P1 角质形成细胞,使用 500-2000 个细胞/cm2。通道越远,晶种密度越低。
- 在所选板尺寸上电镀单元。
注:96 孔板和微孔板具有弯月面效应,导致细胞分布不均匀,大部分生长在成像仪区域之外。具有较大孔的板(例如 24 孔板)允许捕获更多数据。24 孔板允许最多观察 36 个视野,而 96 孔板最多只能观察 5 个视野。然而,仪器上捕获的场数是有限的,更多的场会占用更多的成像仪容量。通常使用 24 孔板。- 为了实现细胞在板上的均匀分布,可以使用各种技术。首先,不要单独接种每个孔,而是将所有孔所需的总培养基以特定稀释度分装到微管中。然后,移液取等分试样达到所需密度所需的细胞总数,并轻轻倒置试管以均匀分布细胞。
- 铺板后,以交叉模式移动板 3 次(上-下、左-右),然后小心地转移到培养箱中。
注意:如果使用微孔板,请避免使用孔的外行和外列,因为延时显微镜在成像时会产生热量,并可能导致这些孔中的介质蒸发。实验孔应分组在板的中心,并用含有 PBS 或其他最大容量无菌液体的孔包围,以减少蒸发/边缘效应。
- 将细胞在 37 °C 和 5% CO2 下孵育 24 小时以允许粘附。
- 24 小时后更换培养基。
注意: 抽吸时不要打扰生长的单层。始终使用加热的培养基 (37 °C),并使用侧壁轻轻地将培养基流入孔中。此处使用的培养基是 Epilife/Supplement S7/Primocin。对于此应用,建议在培养基中使用抗生素进行长期活细胞成像。在用于多个同时实验的机器中扩展培养存在很高的污染风险。青霉素和链霉素是常用的。 - 当指示灯为绿色时,按下左下角的大三角形按钮打开培养箱,打开托盘。将容器放在开放的海湾中。然后,使用左下角的相同按钮关闭托盘。当打开按钮为红色时,切勿打开托盘,因为这意味着它正在主动扫描,扫描将中断。
注意: 确保没有扫描,首先查看控制器模块上的屏幕。它告知距离下一次扫描的时间以及扫描的长度。如果扫描已开始,它将提供扫描完成之前的时间。 - 在计算机上打开应用程序,并使用相应的用户 ID 和密码登录。选择 Schedule (计划)。
- 按计划下方左上角的 + 按钮,将板添加到计划中。
- 选择 Scan on Schedule(按计划扫描),然后单击 Next(下一步)。
- 选择 新建,然后单击 下一步。
注意:如果此板与先前或正在运行的实验相同,则可使用 Copy Previous 或 Copy Current 来加快实验的格式设置。 - 选择 Standard (标准 ) 作为扫描类型,然后单击 Next (下一步)。
注意:Image Lock 是一种专有的 96 孔板,有助于最大限度地减少失焦/图像跳跃的发生,这在遇到这些问题时可能会有所帮助。其他扫描类型对于世系跟踪不是特别有用。 - 对于扫描设置,使用 10 倍物镜的相位通道选择 Adherent Cell-by-Cell ,然后单击 下一步。
注:只要选择了相位通道,此时就不需要选择分析选项,因为可以在捕获数据后启动分析。 - 选择容器,然后单击 Next(下一步)。大多数常见的容器都与该机器兼容,但非微孔板可能需要特殊附件才能安装在延时显微镜的托架中。
- 选择一个空隔间以放置容器,然后单击 Next(下一步)。
- 选择要扫描的孔以及每个孔的图像,然后单击 Next(下一步)。预计扫描持续时间将在屏幕左下角提供。
- 使用所需的命名约定为实验命名。创建实验的板图以供将来参考,然后点击 Ok(确定)。最后,点击 下一步.
- 将分析推迟到数据收集之后,因为必须在扫描完成后开始逐个细胞分析。单击 Next。
- 最后,设置成像频率。为了可靠地跟踪超过 30 分钟发生的有丝分裂,请每隔 20 分钟扫描一次角质形成细胞。按 Next 并确认设置以开始实验。
注意:扫描时间不能重叠,制造商建议机器在扫描期间保持静止状态。如果间隔为 20 分钟,则意味着最多应花费 10 分钟进行扫描。如果以每孔 36 个视图对 24 孔板的 12 个孔进行成像,则扫描需要 7 分钟才能完成,因此在计划时请始终注意可用于实验的资源。- 如果机器休息的时间不足,则会收到通知,如果扫描时间重叠,则无法将容器添加到计划中。如果船舶无法定期按计划排列,请单击 Reserve tray location 并 点击 Next。
- 双击屏幕顶部的船期表,选择备用船舶,然后手动点击以在开放时段添加图片。或者,在计划打开后右键单击以删除所有计划的扫描时间,右键单击以定期为扫描组设置新的扫描时间。
注意:这将中断机器上当前的所有实验,直到设置新的时间。不要忘记点击软盘图标进行保存,或点击红色的 X 取消对计划的更改。选择所需的孔或视图是一个简单的过程,因为机器在选择参数时会立即提供估计的扫描时间。扫描持续时间取决于所选孔板的类型和品牌,以及要扫描的孔或视图的数量。这允许用户调整扫描参数以匹配计算机的容量。
- 对于角质形成细胞,每 48 小时更换一次培养基。为确保印版方向正确,请等待每次将容器放入机器时(如果时间允许)完成第一次扫描。这是一个很容易犯的错误。将板放入机器中,使表示行的字母位于托架的左侧。
- 要查看扫描内容,请按带有眼睛图标的 View (查看) 按钮,然后双击实验。如果培养基的颜色突然变化(含酚红的培养基因酸化而变黄),如果存在过多的死细胞(可能干扰活菌落的增殖),或者如果观察到异常形态,请考虑尽早更换培养基。
- 一旦所有孔都变为静止状态或达到汇合,请导出实验。跟踪成虫菌落 ~2 周,跟踪新生儿菌落 ~10 天,此时拥挤会导致分析的回报递减。
- 要导出,请单击 View 选项卡,然后双击最近扫描列表下的实验(默认为从最近的扫描向后排序)。单击带箭头的 Landscape 图标,然后等待导出工具启动。
- 单击 As Displayed,然后单击 Next。
- 手动单击要导出的每个视图字段,然后单击 Next。
- 选择是否需要短片或一系列图像,然后选择要导出的扫描时间。对于角质形成细胞谱系追踪,请使用电影选项并选择所有扫描(有一个带有虚线的快速 全选 图标可加快此作)。单击 Next。
- 以每秒 1 帧的速度以最高品质导出(使用品质旁边的栏设置此项)。单击 Next。
- 选择目标文件夹和文件类型。为文件命名,然后单击 Export。
注意:导出视频可能需要很长时间,具体取决于 Internet 连接和所涉及的计算机的速度。准备好等待多天才能导出所有视频文件以进行更大规模的实验。能够远程登录延时显微镜非常方便。
2. 使用延时成像构建谱系树并生成数据表
- 使用媒体播放器打开视频文件。建议使用 VLC 媒体播放器。
- 滚动浏览视频并识别不断增长的菌落。使用 VLC 时,使用箭头键向前和向后跳过帧。截取要跟踪的菌落的屏幕截图并标记菌落。
- 在视频录制结束时或几天后确定感兴趣的集落,然后倒带视频并识别集落形成细胞。
注意:这就是具有适当的接种密度很重要的地方。如果太多的集落彼此相邻发育,它们会相互扩展和融合,从而无法准确追踪细胞分裂。 - 当细胞即将分裂时,它似乎会凝结(图 1)。发生除法时暂停视频。记录除法的时间(时间戳位于左下角)。截取这个初始划分,并给它一个与菌落相同的标签。在手绘谱系图中记录部门(参见代表性结果)。继续跟踪和记录尽可能多的世代。
注:自动细胞追踪功能已经/正在开发中,以加快这一过程并更准确地追踪细胞7.即使在分化最小的低钙培养条件下,机器学习模型目前也缺乏准确跟踪角质形成细胞分裂的灵敏度。 - 将手动世系树转录到数据表中 - 由于电子表格中的颜色(补充文件 1),因此命名为“绿色表格”。
- 使用绿片计算增殖和分化分裂的比例,鉴定干细胞和定型祖细胞集落以及细胞周期持续时间(参见代表性结果)。
注:该机器能够通过自己的基本和逐细胞分析仪分析数据,以运行多种其他分析(汇合、划痕)。但是,这超出了本协议的范围。
结果
原代角质形成细胞以刻板的方式生长,可以通过活细胞成像进行追踪。VLC 媒体播放器用于调查记录。第一次分裂的时间是可变的,可能是多天,具体取决于供体的特征,例如年龄、健康状况或 体外 环境中存在的生长因子。初接种完后,角质形成细胞具有小而圆的外观(图 1)。接种后,形成集落的角质形成细胞通常会变平(图 1)。这些扁平的角质形成细胞往往比它们的非分裂对应物更具移动性(补充视频 1)。在分裂之前,扁平的角质形成细胞似乎在中央凝结(图 1)。
除初始分裂外,95% 的将要分裂(增殖 - P)的角质形成细胞在前一次分裂6 的 48 小时内分裂。那些没有的被认为是终末分化的 (D)(图 1)6。这些分化的细胞保持粘附状态,直到观察期结束,或者直到它们从板中抬起并在随后的培养基更换时被去除。分化的细胞往往会随着时间的推移而扩增,导致角质形成细胞集落的形态不均匀(图 1)。观察期结束后导出视频并开始分析(图 2)。
使用标准化流程记录菌落。使用菌落所在的视频前缀 (A1, A2..., B1, B2...),后跟菌落编号。例如,A2-6 将是视频 A2,菌落 6。分析从世系追踪开始。快进到视频的结尾以识别菌落,然后倒回观察期的开始以识别原始的菌落形成细胞。跟踪所有除法的时间戳,并手动创建一个分支图,尽可能准确地跟踪尽可能多的代(图 3)。最终,由于细胞密度的原因,不再可能准确追踪细胞分裂(这通常发生在第 5-7 代左右,取决于集落是来自干细胞还是定型祖细胞)。在后来的世代中,该殖民地经常与另一个殖民地合并,或者该殖民地离开屏幕。此时,将最后一个可跟踪单元格标记为 U (untraceable)。始终对正在跟踪的菌落进行屏幕截图(这可以使用 VLC 上的快照功能完成)并使用上述命名法标记菌落。确保使用标准化命名法标记屏幕截图,包括分析的特定视频和可与屏幕截图匹配的菌落编号。
一旦构建了分支图,数据就可以传输到电子表格或“绿表”(补充文件 1)。绿色片材包含通过分支图跟踪的每个菌落的相同标签。为了便于识别世代,颜色高光在世代之间交替。第 1 代的时间 1 是指从电镀细胞到将它们放在延时显微镜上的时间。在补充文件 1 中,第 1 代的时间 1 为 24 小时,因为细胞在接种后 24 小时放置在机器上。时间 2 表示单元格进行第一次分裂之前的持续时间。回想一下,视频中的时间戳没有考虑额外的 24 小时,因此需要在每一代中手动添加小时数。将数据从分支图转录到绿页时,请始终将除法时间增加 24 小时,因为机器提供的时间戳未考虑记录开始前的时间。ΔT 是细胞周期持续时间。大多数研究 6,8 在分析中不包括第一代的 ΔT,因为它总是比后几代的 ΔT 长得多,并且变化很大,导致分析偏斜。
一旦构建了绿片,就可以确定哪些菌落起源于干细胞,哪些菌落起源于定型祖细胞。主要显示增殖性分裂的集落(图 1)并持续到观察期结束被认为是干细胞集落6。在观察期间终末分化(图 1)的菌落被认为是定型祖细胞落6。然后可以分别计算干细胞集落和定型祖细胞集落的平均 ΔT。通过将 D 分裂的比例除以总分裂的比例,可以计算分化分裂的比例,可以分别计算干细胞/定型祖细胞集落的所有合并分裂,也可以按世代计算。绿表是一种组织数据以有效获取信息的有用方法,它会根据研究目标所需的数据和统计数据而变化。
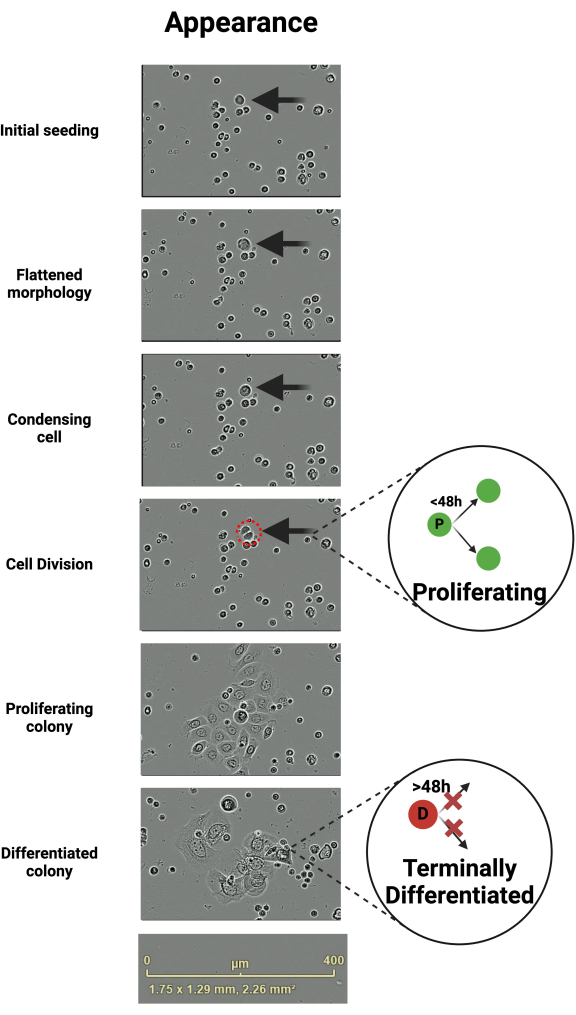
图 1:导致细胞分裂和分裂术语的角质形成细胞形态的变化。 角质形成细胞通过导致细胞分裂的形态变化的刻板序列进行。该图描绘了角质形成细胞随时间发生这一系列事件。即将分裂的单个细胞是运动的,最初呈现扁平形态,并在分裂前立即在中央浓缩。将继续增殖的子细胞在产生后 48 小时内分裂,否则它们被认为是终末分化的。比例尺 400 μm。在 BioRender 中创建。Ghadially, R. (2025) https://BioRender.com/k40e714 请单击此处查看此图的较大版本。

图 2:从延时显微镜导出数据。有关如何从本机导出数据的指南。在 BioRender 中创建。Ghadially, R. (2024) BioRender.com/x99d452 请单击此处查看此图的较大版本。
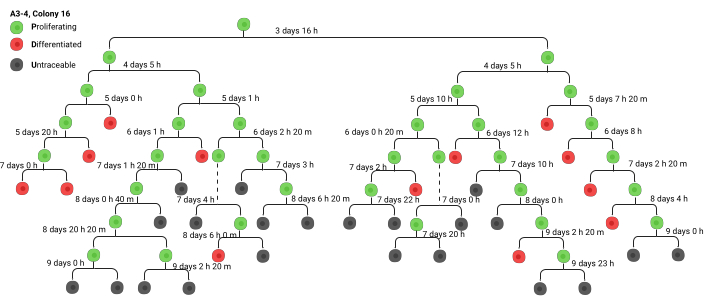
图 3.前体分支图(谱系树),为绿色工作表的创建提供信息。 世系树的示例,通常是手绘的。缩写: h: 小时, m: 分钟。在 BioRender 中创建。Ghadially, R. (2025) https://BioRender.com/wbt7z8x 请单击此处查看此图的较大版本。
补充文件 1.未发表的活细胞成像数据的示例数据表(绿色表格)。包含未发布数据的绿色工作表示例。 请点击此处下载此文件。
补充视频 1.角质形成细胞活细胞成像视频示例。 具有适合细胞密度的活细胞成像视频,可追踪角质形成细胞集落 请点击此处下载此文件。
讨论
角质形成细胞的活细胞成像是一种无需标记的方法,用于跟踪干细胞和定型祖细胞的分裂行为。鉴于表皮的维持取决于干细胞和定型祖细胞的增殖动力学10,对这些角质形成细胞群的变化以及它们在各种条件下的影响有细致的了解有助于开发治疗方法来改善发现的缺陷。
最终,通过活细胞成像进行谱系追踪取决于获得可用数据。菌落形成单位需要在延时摄影生成的视频中清晰可见。对于新鲜分离的 0 代细胞,很难获得真正的克隆密度。只有 3%-4% 的铺板角质形成细胞最终形成集落11。细胞过多可能会导致无法追踪分裂,甚至无法识别最初的集落形成细胞。细胞太少,可能无法形成集落。同样,任何遮挡视野的东西都无法通过谱系追踪来追踪细胞。使用成纤维细胞饲养层可能会使追踪分裂变得困难,因为成纤维细胞会遮挡视野。同样,沉淀物、细胞碎片,甚至板盖上的冷凝物都会掩盖不断增长的菌落。即使是像不能确保微孔板牢固插入所选槽这样小的事情,最终也可能导致实验失败,因为图像不会聚焦在细胞上。这就是为什么每天监测细胞落在机器中生长时非常重要的原因,并且始终保持到第一次扫描后,每当从机器中取出微孔板以更换培养基时,以确保通过延时摄影捕获细胞。碎片可能导致的另一个问题是图像跳跃。通常,显微镜具有固定的视野,不会移动,但当碎片堆积或细胞密度过高时,机器可能会失去视野并跳到板的不同部分。为避免这种情况,该机器的制造商开发了一种特殊类型的 96 孔板,该板带有防止失焦的网格。
本机在拍摄图像时会产生热量。重要的是将包含显微镜的培养箱的温度降低到 36.5 °C,以便在捕获图像时设备平衡至 37 °C。当使用表面积较小的板(96 孔板)时,请考虑产生的额外热量。不要将外围孔用于实验(第一行和最后一行/列),并考虑用其他液体(无菌 PBS)最大限度地填充实验孔周围的孔,并使用透气胶带以减少培养基的蒸发损失。市面上的印版可以进行研究,以尽量减少边缘效应12。但是,上述方法允许使用推荐的兼容微孔板。
在分析视频时,研究人员需要认识到其菌落的异常分裂模式。例如,如果一个视图内 10 天没有划分,然后从视野边缘开始形成猖獗的菌落,则不太可能是新菌落的第一次划分。很可能是来自周围视野的不断增长的菌落侵占了捕获的板部分,而不是一个新的菌落。这可以通过登录软件套件来验证,该软件套件可以描述特定时间点的整个板(包含所有记录的视图),并显示细胞从一个视野到另一个视野的迁移。
这种方法的主要限制是其劳动密集型性质。此外,追踪第 5 代之后的细胞分裂很困难,需要数小时的工作,重新观看视频以准确捕捉分裂的内容和时间。目前正在开发多种深度学习自动细胞跟踪算法,最终将在未来几年实现完全基于 AI 的分析 7,13,14。在此之前,手动跟踪(如本协议中详述)是开发谱系数据的可行方法。
披露声明
没有。
致谢
这项工作得到了来自美国 (U.S.) 的 Merit Review Award Number I01 CX001816 的支持。退伍军人事务部临床科学研发(CSRD)服务。内容不代表美国退伍军人事务部或美国政府的观点。我们感谢 Michael Rosenblum 博士为我们提供他的延时显微镜来进行我们的实验。
材料
| Name | Company | Catalog Number | Comments |
| 96 Well Imagelock plate | Sartorius | BA-04856 | Suggested microplate compatible with machine if using a 96 well plate. |
| 24 well plate | Corning | 3524 | Suggested microplate compatible with machine if using a 24 well plate. |
| Amphotericin B, 50 mL | Corning | 30-003-CF | Dilute to 5x (comes in 100x stock) for 5x PSA - 1x for media changes |
| Epilife, 50 mL | Gibco | MEP1500CA | Add S7, consider primocin |
| IncuCyte S3 | Sartorius | 4637 | Imager (Zoom/SX5 acceptable alternatives) |
| Penicillin/Streptomycin, 100 mL | Corning | 30-002-Cl | Dilute to 5x (comes in 100x stock) |
| Primocin | Invivogen | ant-pm-05 | 1 mL per 500 mL media |
| Supplement S7 | Gibco | S0175 | Added to epilife |
参考文献
- Mateu, R., et al. Functional differences between neonatal and adult fibroblasts and keratinocytes: Donor age affects epithelial-mesenchymal crosstalk in vitro. Int J Mol Med. 38 (4), 1063-1074 (2016).
- Handl, J., Čapek, J., Majtnerová, P., Báčová, J., Roušar, T. The effect of repeated passaging on the susceptibility of human proximal tubular HK-2 cells to toxic compounds. Physiol Res. 69 (4), 731-738 (2020).
- Moran, M. C., et al. Characterization of human keratinocyte cell lines for barrier studies. JID Innov. 1 (2), 100018(2021).
- Seo, M. -D., Kang, T. J., Lee, C. H., Lee, A. -Y., Noh, M. HaCaT keratinocytes and primary epidermal keratinocytes have different transcriptional profiles of cornified envelope-associated genes to T helper cell cytokines. Biomol Ther. 20 (2), 171-176 (2012).
- Jahn, M., et al. Different immortalized keratinocyte cell lines display distinct capabilities to differentiate and reconstitute an epidermis in vitro. Exp Dermatol. 33 (1), e14985(2024).
- Xiao, T., et al. Short cell cycle duration is a phenotype of human epidermal stem cells. Stem Cell Res Ther. 15 (1), 76(2024).
- Hirose, T., Kotoku, J., Toki, F., Nishimura, E. K., Nanba, D. Label-free quality control and identification of human keratinocyte stem cells by deep learning-based automated cell tracking. Stem Cells. 39 (8), 1091-1100 (2021).
- Roshan, A., Murai, K., Fowler, J., Simons, B. D., Nikolaidou-Neokosmidou, V., Jones, P. H. Human keratinocytes have two interconvertible modes of proliferation. Nat Cell Biol. 18 (2), 145-156 (2016).
- Abegaze, B., Ijeh, N., Vittimberga, B., Ghadially, R. Generating primary cultures for the purpose of keratinocyte live cell imaging. J Vis Exp. , In Press (2024).
- Piedrafita, G., et al. A single-progenitor model as the unifying paradigm of epidermal and esophageal epithelial maintenance in mice. Nat Commun. 11 (1), 1429(2020).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Dermatol. 28 (2), 107-112 (2019).
- Mansoury, M., Hamed, M., Karmustaji, R., Al Hannan, F., Safrany, S. T. The edge effect: A global problem. The trouble with culturing cells in 96-well plates. Biochem Biophys Rep. 26, 100987(2021).
- Malin-Mayor, C., et al. Automated reconstruction of whole-embryo cell lineages by learning from sparse annotations. Nat Biotechnol. 41 (1), 44-49 (2023).
- Waliman, M., et al. Automated cell lineage reconstruction using label-free 4D microscopy. Genetics. 228 (2), iyae135(2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。