Method Article
비장 및 심장 대식세포와 골수 단핵구의 생체 외 대사 플럭스 분석
요약
여기에서는 골수, 비장 및 경색된 심장에서 대식세포를 추출하고 이후에 살아있는 세포의 대사 플럭스를 평가하는 방법을 자세히 설명합니다.
초록
대사 재프로그래밍(metabolic reprogramming)은 단핵구/대식세포 활성화와 전염증 상태와 항염증 상태 사이의 분극(polarization)의 특징입니다. 예를 들어, 전염증성(즉, M1 유사) 단핵구/대식세포는 혐기성 해당과정에 대한 의존도가 높고 미토콘드리아 산화 인산화에 대한 의존도가 낮은 반면, 항염증성(M2 유사) 대식세포는 미토콘드리아의 포도당 및 지방산 산화에 더 많이 의존합니다. 여기에서는 신체의 두 가지 주요 단핵구/대식세포 저장소인 비장과 골수, 심근경색 후 심장과 같은 손상된 조직에서 대식세포를 추출하기 위한 심층적인 프로토콜에 대해 설명합니다.
대식세포 또는 단핵구는 항체 태그가 부착된 마이크로비즈를 사용하여 면역자기 분류를 통해 추출되며, 이는 표현형을 손상시키지 않고 세포에 쉽게 결합합니다. 그런 다음 추출된 세포를 96웰 플레이트에서 배양한 다음 대사 플럭스 분석기를 사용하여 세포 외 플럭스 분석을 수행합니다. 해당과정(glycolysis)과 미토콘드리아 산화 인산화(mitochondrial oxidative phosphorylation)는 모두 적은 수의 세포(최소 2-3개 ×10-5 개 세포)에서 동시에 측정할 수 있습니다. 이 방법은 1일 안에 쉽게 수행할 수 있으며 신뢰할 수 있고 반복 가능한 결과를 생성합니다. 궁극적으로 이러한 방법은 부상 및 질병에 대한 면역 및 염증 반응 중 대사 변화에 대한 이해를 높이는 데 도움이 되며, 이는 면역 대사 경로에 대한 새로운 치료 표적의 개발로 이어질 수 있습니다.
서문
면역대사는 다양한 병리학적 질병 및 손상 상태에 걸쳐 면역 세포에서 대사 재프로그래밍의 역할을 연구하는 꽃을 피우는 분야입니다. 대식세포는 염증, 감염에 대한 반응, 항원 제시 및 상처 치유에 중요한 역할을 하는 선천면역 체계의 핵심 부분입니다1. 대식세포가 서로 다른 질병 상태에 걸쳐 전염증제와 항염증제(M1 유사 및 M2 유사) 하위 집합 사이에서 어떻게 분극화되는지 이해하는 것은 지속적이고 집중적인 연구가 필요한 영역입니다. 최근 연구에서는 대사 재프로그래밍(metabolic reprogramming)이 대식세포 분극의 기저에 있는 핵심 메커니즘으로 확인되었습니다. 현재의 패러다임은 대체로 M1 유사 대식세포(일반적으로 단핵구와 유사)는 전염증 기능을 촉진하기 위해 해당과정에 더 의존하는 반면, M2 유사 대식세포는 전염증 기능을 억제하고 항염증 과정에 연료를 공급하기 위해 미토콘드리아 산화 인산화에 더 많이 의존한다는 것입니다2. 다양한 질병 상태에서 대식세포 대사가 어떻게 변화하는지 이해하면 대사 경로를 표적으로 하는 데 사용할 수 있는 잠재적 치료법에 대한 통찰력을 얻을 수 있습니다.
예를 들어, 본 연구실은 심근경색(MI)3,4,5 중 대식세포 대사 재프로그래밍의 역할을 광범위하게 조사했습니다. 대식세포는 MI 중 염증 및 상처 치유 반응에 중요한 역할을 하며, 경색된 심장이 대체 흉터 조직을 형성하기 위해 리모델링을 거치면서 M1 유사 표현형에서 M2 유사 표현형으로 분극 형성을 겪습니다. 본 명세서에 기술된 방법을 사용하여, 우리는 이러한 분극이 포도당 및 글루타민 대사, 미토콘드리아 기능의 독특한 변화를 특징으로 한다는 것을 입증하였다. 우리는 심장 대식세포뿐만 아니라 비장 대식세포 및 골수 단핵구를 추출하는 방법을 설명하며, 이는 세포 외 플럭스 분석과 결합하여 하루 만에 체외 대사 플럭스를 평가할 수 있습니다. 우리는 설명된 방법이 면역 세포 대사 표현형을 평가하기 위한 표준화된 접근 방식을 제공하여 이 중요한 주제를 연구하는 실험실 전체에서 재현성을 향상시키기를 바랍니다.
프로토콜
아래 방법은 대식세포를 추출하고 MI, 비장 및 골수에 따른 경색된 심장의 대사 플럭스에 대한 생체 외 분석을 수행하기 위한 프로토콜을 설명합니다(그림 1). MI 심장과 비장의 경우 사용되는 추출 방법은 동일합니다. 마우스와 관련된 모든 프로토콜은 University of Mississippi Medical Center 기관 동물 관리 및 사용 위원회(프로토콜 #1371, Mouton)의 승인을 받았습니다.
1. 경색된 심장과 비장에서 대식세포 추출
참고: 조직 대식세포 추출은 음성 선택 전략을 사용하여 먼저 Ly6G-마이크로비드로 표지된 호중구를 제거한 다음 양성 선택 전략을 사용하여 CD11b-마이크로비드 3,4,5,6으로 대식세포를 얻습니다. 이 프로토콜을 수행할 때는 신속하게 작업하고 세포를 차갑게 유지하십시오.
- AALAC 및 기관 지침에 따라 이소플루란 과다 투여 후 심장을 제거하여 마우스를 안락사시킵니다.
- 심장과 비장을 신속하게 제거하고 조직의 무게를 잰다.
- 분석 전에 인산염 완충 식염수(PBS)에 EDTA(2mM) 및 0.5% 소 혈청 알부민(w/v)을 용해시켜 PEB 완충액을 준비합니다. 차갑게 유지하십시오.
- 차가운 행크의 균형 잡힌 소금 용액(HBSS)에 심장을 넣습니다. 멸균 메스로 작은 조각으로 다집니다.
- 600 U/mL 콜라겐분해효소 II형 및 60 U/mL DNase I형을 함유한 분해 용액을 준비합니다. MACS 세포 해리 튜브에서 10mL의 분해 용액에 조직을 혼합합니다.
알림: 각 조직(실온)에 10mL를 사용할 수 있도록 소화 용액을 충분히 만드십시오. - 제조업체의 프로토콜에 따라 세포 해리기를 사용하여 조직을 배양합니다. 이것은 다진 조직을 37°C에서 ~1시간 동안 부드럽게 회전시켜 세포 현탁액을 생성합니다.
- 현탁액을 15mL 코니컬 튜브로 옮기고 300 × g 의 4°C에서 10분 동안 원심분리합니다.
- 펠릿을 PEB 완충액 1mL에 재현탁합니다. 단일 셀 현탁액을 생성하려면 30μm 필터 위에 현탁액을 적용합니다.
- 적혈구를 용해하려면 1x 적혈구 용해 용액 10mL를 추가합니다. 4 °C의 어두운 곳에서 5-10분 동안 배양합니다.
- 현탁액을 300 × g 에서 4 °C에서 10 분 동안 원심 분리하십시오.
- 펠릿을 PEB 1mL에 재현탁시키고 혈구계를 사용하여 세포를 계수합니다.
- 현탁액을 300 × g 에서 4 °C에서 10 분 동안 원심 분리하십시오.
- 호중구를 제거하려면 107 세포 당 90μL의 PEB 버퍼와 10μL의 anti-Ly6G 마이크로비드를 혼합하여 마이크로비드를 준비합니다. 세포 펠릿을 마이크로비드 현탁액과 혼합하고 4°C의 어둠 속에서 10분 동안 배양합니다.
- 결합되지 않은 마이크로비드를 세척하려면 PEB 완충액 10mL를 추가하고 300×g의 4°C에서 10 분 동안 원 심분리합니다.
- 마그네틱 스탠드에 마그네틱 컬럼(MS 또는 LS)을 준비합니다. 0.5-1.0mL의 PEB 완충액을 추가하여 컬럼을 적십니다.
참고: 면역 세포가 풍부한 조직(즉, 비장)의 경우 자기 기둥이 쉽게 막혀 흐름이 멈출 수 있습니다. 따라서 비장에는 LS 컬럼을 사용하는 것이 좋습니다. - 세포 펠릿을 500μL의 PEB 완충액에 재현탁합니다. 세포 현탁액을 자기 컬럼에 추가하고 표지되지 않은 세포(즉, 비호중구)가 통과하도록 합니다. 500μL의 PEB 버퍼로 컬럼을 2x 세척합니다. 표지되지 않은 세포(즉, 대식세포 및 기타 세포)를 15mL 원뿔형 튜브에 모읍니다.
- 현탁액을 300 × g 에서 4 °C에서 10 분 동안 원심 분리하십시오.
- 107 cells당 90μL의 PEB buffer와 10μL의 anti-CD11b microbead를 혼합하여 microbead를 준비합니다. 세포 펠릿을 마이크로비드 현탁액과 혼합하고 4°C의 어둠 속에서 15분 동안 배양합니다.
- 1.13-1.15단계를 반복합니다.
- 표지된 대식세포는 자성 컬럼에 결합됩니다. 이를 수집하려면 마그네틱 스탠드에서 마그네틱 컬럼을 분리하고 새 15mL 원뿔형 튜브 위에 놓습니다.
- 0.1% 소 태아 혈청(FBS)이 보충된 RPMI 배지 1mL를 컬럼에 추가합니다. 플런저를 사용하여 대식세포를 튜브로 추출합니다. 혈구계를 사용하여 대식세포를 세십시오.
참고: 대식세포는 이제 튜브에 있으며 추가 분석에 사용할 준비가 되었습니다.
2. 골수에서 monocytes의 적출
참고: 골수에서 단핵구를 추출하는 것은 림프구, 자연살해세포, 수지상 세포, 적혈구 세포 및 과립구(즉, 호중구)를 포함한 비단핵구를 면역자기적으로 표지하고 제거하는 음성 선택 전략을 사용합니다.
- AALAC 및 기관 지침에 따라 이소플루란 과다 투여 후 심장을 제거하여 마우스를 안락사시킵니다.
- 마우스에서 다리를 제거합니다. 차가운 HBSS에서는 뼈가 깨끗해질 때까지 경골과 대퇴골에서 근육을 절개합니다.
- 뼈의 양쪽 끝을 조심스럽게 잘라냅니다. 10mL 주사기와 27G 바늘을 사용하여 PEB 완충액이 있는 15mL 원뿔형 튜브에 골수를 씻어냅니다. 현탁액을 300 × g 에서 4 °C에서 10 분 동안 원심 분리하십시오.
- 1.8-1.12단계를 수행합니다.
- 전체 세포의 5 ×7 개당 PEB 완충액 175μL, FcR 차단 시약 25μL, 단핵구 비오틴 항체 칵테일 50μL를 추가합니다. 4 °C의 어두운 곳에서 5분 동안 배양합니다.
- PEB 완충액 10mL와 원심분리기를 300×g에서 4°C에서 10 분 동안 첨가 하여 세척합니다.
- 펠릿을 수집하고 500μL의 PEB 완충액과 100μL의 항비오틴 마이크로비드에 세포를 다시 현탁시킵니다. 4 °C의 어두운 곳에서 10분 동안 배양합니다.
- 마그네틱 스탠드에 마그네틱 컬럼(LS)을 준비합니다. PEB 완충액 1.0mL를 추가하여 컬럼을 적십니다.
- 세포 현탁액을 컬럼에 즉시 적용합니다. 15mL 튜브를 사용하여 단핵구가 포함된 플로우스루를 수집합니다. 비단핵구는 자성 컬럼에 결합됩니다.
- 1mL의 PEB 버퍼로 컬럼을 2x 세척합니다. 혈구계를 사용하여 단핵구를 계수합니다.
- 다음 단계를 위해 단핵구를 준비하려면 300 × g 에서 4°C에서 10분 동안 원심분리합니다. 플럭스 분석의 경우, 1mL의 RPMI + 0.1% FBS에 세포 펠렛을 재현탁합니다. 유세포 분석을 위해 세포를 차가운 PEB에 보관하고 염색을 진행합니다.
3. 대사 플럭스 분석을 위한 세포 준비
- 센서 카트리지에 수분을 공급합니다(분석 전날).
- 포장에서 센서 카트리지를 꺼냅니다. 웰에서 센서 플레이트(녹색)를 제거하고 200μL의 캘리브런트 유체를 각 웰에 피펫팅합니다. 센서 플레이트를 카트리지 플레이트 상단에 다시 놓아 센서가 교정액에 잠기도록 합니다.
- 카트리지를 CO2 가 아닌 가습 인큐베이터(37°C)에 밤새 넣습니다.
- 세포 도금
- 96웰 배양 플레이트에 200μL의 배지에 있는 세포를 최소 1시간 동안 플레이트링합니다. 배경 측정을 위해 하나 이상의 웰을 비워 둡니다(빈 웰에 대해 동일한 양의 매체 사용).
참고: 최적의 세포 수는 실험 전에 결정해야 합니다. 자세한 내용은 토론의 "문제 해결 팁"을 참조하십시오. - 분석을 수행할 준비가 되면 대사 플럭스 배지(즉, 포도당, 글루타민, 피루브산 등이 없는 기초 RPMI 또는 DMEM)를 준비합니다. 해당과정 스트레스 테스트의 경우, 기저 배지에 2mM 글루타민이 보충되어 있는지 확인합니다. 미토콘드리아 스트레스 테스트의 경우 기저 배지에 2mM 글루타민, 10mM 포도당 및 1mM 피루브산이 보충되었는지 확인합니다.
- 천천히 피펫팅하여 기존 배지를 새 기저 배지로 조심스럽게 교체합니다(세포가 제거되지 않도록 주의). 현미경으로 세포가 여전히 존재하는지 확인하십시오.
- 셀 플레이트를 비 CO2 가습 인큐베이터(37°C)에 놓습니다.
- 96웰 배양 플레이트에 200μL의 배지에 있는 세포를 최소 1시간 동안 플레이트링합니다. 배경 측정을 위해 하나 이상의 웰을 비워 둡니다(빈 웰에 대해 동일한 양의 매체 사용).
- 플럭스 플레이트 적재
- 인큐베이터에서 수화된 센서 카트리지/플럭스 플레이트를 회수합니다.
- 해당작용 또는 미토콘드리아 스트레스 테스트를 위한 테스트 화합물을 준비합니다.
- 해당과정(Glycolysis): 해당과정(glycolysis) 기초 배지를 사용하여 포도당을 3mL, 올리고마이신을 270μL(100μM), 2-데옥시글루코스를 3mL에 용해시켜 원액을 만듭니다. 10μM의 작동 중인 올리고마이신 용액을 만듭니다.
- 미토콘드리아: 미토콘드리아 기저 매체를 사용하여 올리고마이신을 630μL(100μM)에, 카르보닐 시안화물-p-트리플루오로메톡시페닐히드라존(FCCP)을 720μL(100μM)에, 로테논/안티마이신 A를 540μL(50μM)에 용해시켜 스톡 용액을 만듭니다. 올리고마이신(0.5-2.5μM), FCCP(0.125-2.0μM) 및 로테논/안티마이신 A(0.5μM)의 작업 솔루션을 만듭니다.
참고: 1.5μM 올리고마이신과 2.0μM FCCP가 최상의 결과를 생성한다는 것을 발견했습니다.
- 포트 A-20 μL, 포트 B-22 μL, 포트 C-25 μL, 포트 D-27 μL을 사용하여 화합물을 포트에 로드 테스트합니다. 선택 사항: 선택한 약물 또는 화합물을 포트 A에 로드하고 테스트 화합물을 포트 B, C 및 D에 로드하여 해당과정 또는 미토콘드리아 호흡에 대한 급성 효과를 평가합니다. 추가 약물 또는 화합물을 사용하지 않는 경우 포트 D를 비워 두십시오.
- 분석 실행
- 소프트웨어를 열고 미토콘드리아 스트레스 테스트를 선택합니다.
참고: 이 프로그램은 세포외 산성화율(ECAR)을 측정하므로 해당과정 스트레스 테스트에도 사용할 수 있습니다. - 사용할 웰을 선택합니다. 배경을 빼려면 최소 1개의 웰에 셀이 없는지 확인하십시오.
- 프로그램을 실행합니다. 플레이트가 보정되도록 뚜껑을 제거한 상태로 플럭스 플레이트를 로드합니다(~20분).
- 플레이트가 보정된 후 소프트웨어는 셀 플레이트를 로드하라는 메시지를 표시합니다. 인큐베이터에서 세포판을 꺼내고 플럭스 플레이트의 바닥을 제거한 다음 세포판을 홀더에 넣습니다. 실행을 누릅니다. 분석이 완료되는 데 ~2.5시간이 소요됩니다.
- 대사 플럭스 소프트웨어7 또는 선택한 기타 분석 소프트웨어를 사용하여 결과를 분석합니다.
- 소프트웨어를 열고 미토콘드리아 스트레스 테스트를 선택합니다.
결과
서로 다른 조직에서 얻은 일반적인 세포 수는 동물의 크기, 나이 및 성별에 따라 다릅니다. 성체 수컷 마우스(즉, 생후 16주, ~30g)의 경우 비장은 3.0-4.0 × 106 대식세포를 산출할 수 있는 반면, 골수(2개의 경골과 2개의 대퇴골)는 일반적으로 1.0-1.5 × 106 단핵구를 산출합니다(그림 2A). 경색된 심장은 일반적으로 MI 4,5,6 이후 날에 따라 높은 수치를 산출합니다. 3일차에 수율은 일반적으로 심장당 ~1.5 × 106 세포입니다. 건강한 심장에는 일반적으로 대식세포가 거의 없습니다(0.1-0.2 × 105/심장)6. 따라서 건강한 심장(경색되지 않은 심장)의 대식세포를 대조군으로 사용하는 경우 여러 개의 심장을 통합해야 할 수 있습니다. 그림 2B는 추출된 대식세포 또는 단핵구의 대표적인 유세포 분석 플롯을 보여주며, CD11b에 대해 매우 양성이고 Ly6G에 대해 음성인 집단을 보여줍니다. 심장 및 비장 대식세포는 단핵구 마커 Ly6C에 대해 이질성을 보이는 반면, 골수 단핵구는 Ly6C에 대해 매우 양성입니다. 경색된 심장, 비장 및 골수(즉, 전체 조직)에서 분류된 호중구(심장 및 비장) 및 정렬되지 않은 세포에 대한 대표적인 유세포 분석 플롯은 보충 그림 S1, 보충 그림 S2 및 보충 그림 S3에 표시되어 있습니다.
세포외 플럭스 분석의 결과는 ECAR(mPh/min) 및 산소 소비율(OCR, pmol O2/min)의 변화로 표시됩니다. 결과는 일반적으로 y축에 ECAR 또는 OCR이 있고 x축에 시간이 있는 선 그래프로 표시됩니다(그림 3). 특정 측정값은 막대 그래프로 표시됩니다.
원시 데이터에서 여러 대사 매개변수를 계산할 수 있습니다. 또한 각 웰의 OCR/ECAR 비율을 계산하여 해당작용과 미토콘드리아 호흡에 대한 의존도를 파악할 수 있으며, 이는 다양한 조건에서 변할 수 있습니다4. 예를 들어, 대식세포 대사의 변화를 평가하기 위해 생쥐(성체 수컷 C57BL/6J)를 하룻밤 동안 단식시켰습니다. 혈당 수치가 감소하고 혈중 케톤이 증가하여 공복 표현형이 확인되었으며(보충 그림 S4), 이는 순환 백혈구 및 호중구를 감소시켰습니다(Hemavet 950FS Auto Blood Analyzer; 보충 그림 S5). 먹이를 먹인 마우스와 공복한 마우스에서 골수 단핵구와 비장 대식세포를 분리하고 세포외 플럭스 분석을 통해 대사 변화를 평가했습니다(그림 4). 골수 단핵구에서 공복은 미토콘드리아 스트레스 검사와 해당과정 스트레스 검사 모두에서 해당과정을 감소시키고 OCR/ECAR 비율을 증가시켰습니다(그림 4A). 비장 대식세포에서 단식은 해당작용에 큰 영향을 미치지 않았지만 예비 용량과 ATP 관련 호흡은 증가했습니다(그림 4B). 그림 4C 는 수술 3일 후 경색된 심장에서 분리된 대식세포의 대사 흐름의 예를 보여줍니다.
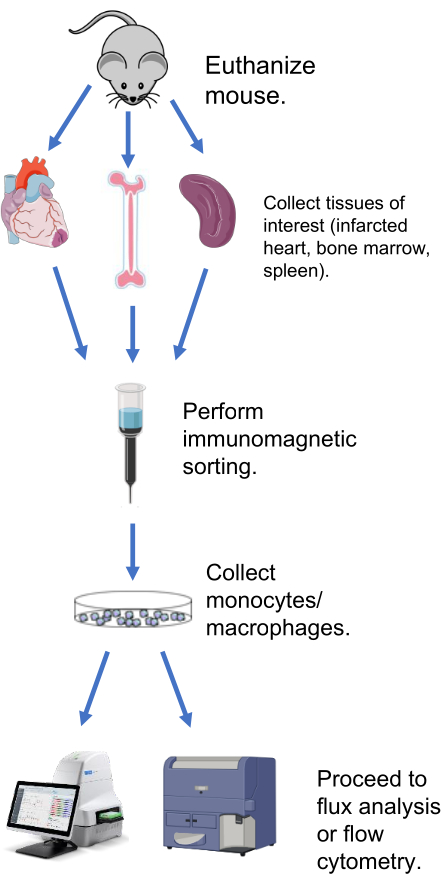
그림 1: 추출된 대식세포/단핵구의 대사 플럭스 분석의 대표적인 개략도.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
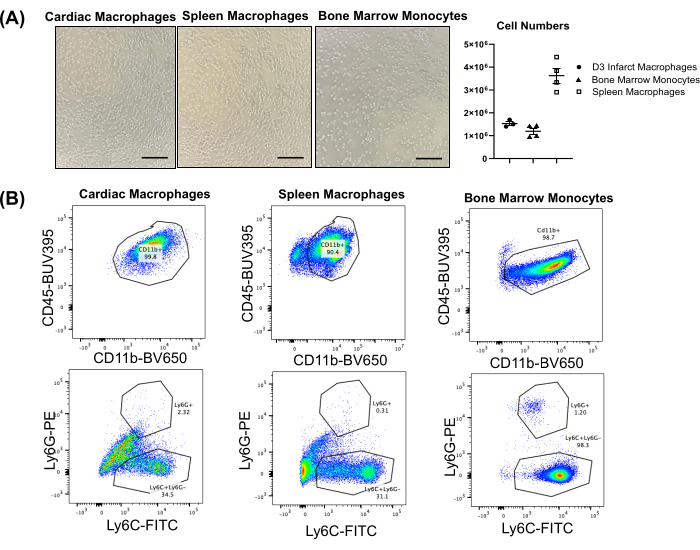
그림 2: 마우스에서 분리된 심장 및 비장 대식세포와 골수 단핵구의 대표적인 결과. (A) 분리된 심장 및 비장 대식세포, 골수 단핵구의 대표적인 이미지(4x); 마우스당 평균 셀 수. 스케일 바 = 1mm. (B) 심장(심근경색 3일차) 및 비장 대식세포 및 골수 단핵구의 대표적인 유세포 분석 플롯. CD45는 범백혈구 마커로, CD11b는 골수성 세포 마커로 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
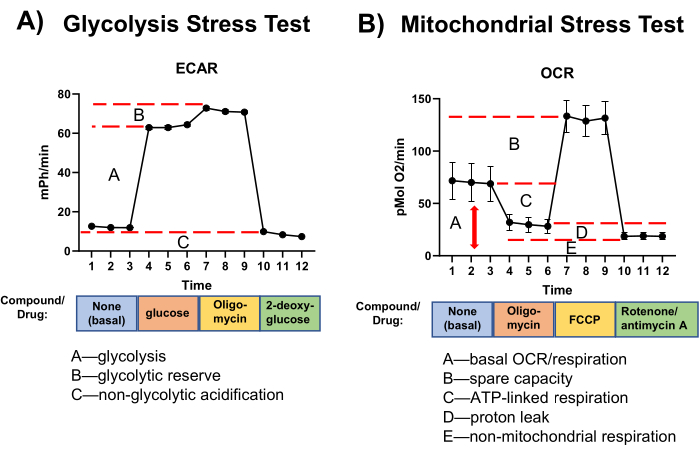
그림 3: 테스트의 대표적인 결과. (A) 해당과정 및 (B) 미토콘드리아 스트레스 테스트. N = 3개의 독립적인 측정(비장 대식세포). 평균 ± SEM. 약어: ECAR = 세포외 산성화 속도; OCR = 산소 소비율; FCCP = 카르보닐 시안화물-p-트리플루오로메톡시페닐히드라존. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
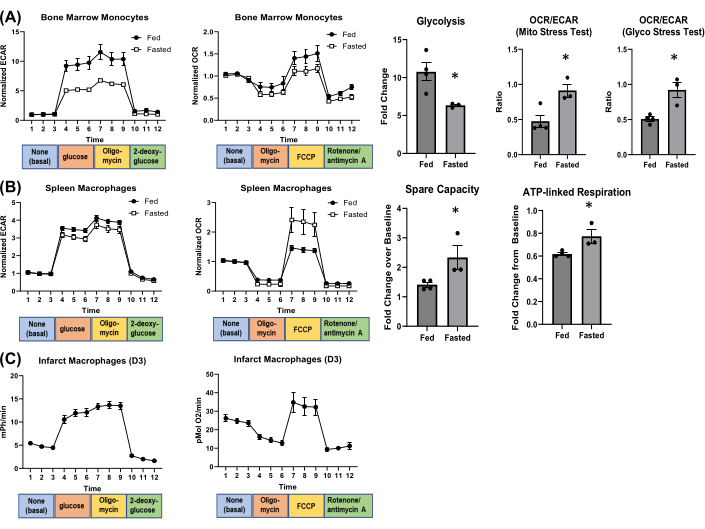
그림 4: 야간 단식이 세포 대사에 미치는 영향.(A) 골수 단핵구 및 (B) 비장 대식세포 대사. (C) 심근경색 후 3일 후의 심장 대식세포의 대표적인 세포외 플럭스 플롯. N = 각 그룹당 3-4개. 약기 : FCCP = 카르 보닐 시안화물 -p-trifluoromethoxyphenylhydrazone. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 대표적인 유세포 분석 플롯과 먹이를 주고 공복한 마우스의 혈당 및 케톤 수치. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
당사의 방법은 골수, 비장 및 경색된 심장에서 대식세포를 빠르게 추출하는 방법을 자세히 설명하며, 이를 사용하여 세포외 대사 플럭스 분석과 같은 다운스트림 분석을 수행할 수 있습니다. 이 두 가지 방법의 조합은 다양한 질병 또는 부상 상태 또는 운동과 같은 대사 상태에서 대식세포의 대사 변화를 정량화할 수 있는 강력한 도구입니다. 우리의 방법은 골수와 비장 대식세포에 초점을 맞췄지만, 복막 구획8과 같은 다른 대식세포 저장소를 사용할 수 있습니다. 이 방법을 처음 사용하는 것은 아니지만 이 기사가 실험실 전반에 걸쳐 노출을 늘리고 표준화를 개선하는 데 도움이 되기를 바랍니다.
이러한 방법에서 얻은 데이터는 다양한 대식세포 구획의 대사 상태에 대한 귀중한 통찰력을 제공하지만, 대사에 대한 보다 완전한 그림을 얻기 위해 대사 플럭스 데이터를 보완하기 위해 다른 방법을 사용하는 것이 좋습니다. 예를 들어, 대사 플럭스 데이터를 대사체학(즉, 세포 내 대사 산물의 정량화) 및 유전자/단백질 발현 및/또는 대사 효소의 활성과 결합하면 대식세포의 대사 상태에 대한 균형 잡힌 평가를 생성하는 데 자주 사용됩니다 5,9. 많은 경우, 동일한 동물의 세포를 다른 분석에 사용할 수 있습니다.
경험에 비추어 볼 때, 프로토콜 최적화에는 여러 단계의 문제 해결 이 포함될 수 있습니다. 가장 중요한 것 중 하나는 신속하게 작업하고 세포를 차갑게 유지하여 세포 수율과 생존력을 높이는 것입니다. 세포 외 플럭스에 대한 최적의 세포 수를 결정하는 것은 또 다른 핵심 포인트인데, 너무 적은 수의 세포는 검출 가능한 신호를 제공하지 않는 반면, 너무 많은 세포는 배지의 영양분을 고갈시켜 주입된 화합물에 대한 반응을 나타내지 않기 때문입니다. 대식세포의 경우, MI 심장의 2.0 × 105 세포와 96웰 플레이트의 3.0 × 105 세포가 가장 신뢰할 수 있고 재현성 있는 결과를 제공한다는 것을 발견했습니다. 그러나 이는 실험실마다 다를 수 있습니다. 샘플과 그룹 간에 동일한 셀 번호가 사용되도록 각별한 주의를 기울여야 합니다. 세포 수가 다르면 분석에 사용된 약물에 대해 서로 다른 반응을 보이며 원치 않는 변동성을 유발할 수 있습니다.
실험을 수행하기 전에 분석에 포함된 주입 약물(올리고마이신, FCCP)의 최적 농도도 최적화해야 합니다. 예를 들어, 1.5μM 올리고마이신과 2.0μM FCCP가 가장 강력한 반응을 생성한다는 것을 발견했습니다. 또 다른 일반적인 오류는 추출 후 세포가 배양 접시에 부착될 수 있는 충분한 시간을 허용하지 않아 세포 외 플럭스 배지로 변경할 때 세포가 손실되는 것입니다. 세포가 부착할 수 있도록 최소 1시간에서 최대 2시간을 제안합니다.
너무 공격적으로 피펫팅하면 세포가 손실될 수도 있습니다. 매우 조심스럽게 피펫팅하고 현미경으로 세포를 자주 확인하는 것이 좋습니다. 마지막 요점은 플럭스 플레이트를 준비할 때, 특히 해당과정 스트레스 테스트를 수행할 때 신속하게 작업하는 것입니다. 이러한 세포는 분석 전에 포도당이 부족하기 때문에 배양 시간이 길어짐(기저 배지에서 1시간 이상)은 포도당에 대한 초기 반응을 변경할 수 있습니다. 일반 매체를 기초 매체로 교체한 후(~30분) 플레이트를 보정한 후(~20분 소요) 플럭스 플레이트를 즉시 준비하는 것이 좋습니다. Interassay 변동성은 항상 고려해야 합니다. 그룹 간에 직접 비교를 할 때는 항상 동일한 플레이트 또는 실험 내에서 모든 그룹을 수행하기 위해 노력해야 합니다.
자주 사용되는 두 가지 표준 분석법(해당과정 스트레스 및 미토콘드리아 스트레스 검사)에 대해 설명했지만, 미토콘드리아 연료 플렉스 검사(mitochondrial fuel flex test)10, 지방산/팔미테이트 산화(fatty acid/palmitate oxidation) 11 및 ATP 속도 분석법(ATP rate assay)12과 같은 다른 대사 경로를 평가하는 데 사용할 수 있는 몇 가지 다른 표준화된 분석법이 있다는 점에 유의해야 합니다. 새로운 연구에서 T 세포 대사 프로파일링 키트에 공급되는 BAM15 언커플러의 효능이 입증되었습니다. BAM15는 FCCP보다 세포독성 효과가 적은 더 신뢰할 수 있는 언커플러인 것으로 보인다13. 향후 연구에서는 대식세포의 대사 평가에서 이러한 분리의 잠재력을 탐구해야 합니다.
이 방법에는 몇 가지 제한 사항이 있습니다. 첫 번째는 단계 수로 인해 한 사람이 적시에 수행하기 어려울 수 있다는 것입니다. 특히 더 많은 수의 샘플(최대 8개)을 사용하는 경우 결과의 품질을 향상시키기 위해 두 사람이 함께 작업하는 것이 좋습니다. 우리는 하루에 8개 이상의 샘플을 처리하는 것이 어렵다는 것을 발견했습니다. 또 다른 한계는 분석이 생체 외(ex vivo)로 수행되기 때문에 추출 절차가 세포 표현형6에 변화를 일으킬 가능성이 항상 있다는 것입니다. 이러한 제한을 제거할 수 있는 명확한 방법은 없지만, MI14 이후 대식세포 젖산 생성을 시각화하기 위해 과분극 자기 공명 영상(hyperpolarized magnetic resonance imaging)과 같은 생체 내 이미징 기술이 사용되어 왔으며 우리가 설명하는 생체 외 방법을 보완하거나 대체하는 것으로 계속 발전할 것으로 기대됩니다. 세포외 플럭스(extracellular flux) 방법의 한계는 해당과정(glycolysis)과 OXPHOS(OXPHOS) 사이의 변화를 포착할 수 있지만, 이러한 경로 내에서 ATP 생산 속도의 변화를 완전히 반영하지는 못한다는 것입니다15. 또한, 배지의 산성화(ECAR)의 변화는 해당과정에 의한 젖산 생성을 항상 반영하는 것은 아니지만 중탄산염15로 전환되는 TCA 회로에 의한 CO2 생성의 영향을 받을 수도 있습니다. 따라서 사용자는 해당과정 및 OXPHOS에서 ATP 생성 속도를 계산하는 것이 유리할 수 있으며, 이를 통해 이러한 경로가 전체 ATP 생성에 미치는 기여도를 평가할 수 있습니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 작업을 위해 NIH/NHBLI 166737, NIH R00 HL146888, NIH U54HL169191, NIH/NIGMS P20GM104357 및 NIH/NIGMS P30GM149404 이 작업을 지원한 자금에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Anti-CD11b Microbeads UltraPure, mouse | Miltenyi Biotec | 130-126-725 | |
| Anti-Ly6G Microbeads UltraPure, mouse | Miltenyi Biotec | 130-120-337 | |
| Collagenase type II | Worthington | NC9522060 | |
| Dnase type I | MillPore Sigma | 11284932001 | |
| GentleMACS Octo Dissociator | Miltenyi Biotec | 130-096-427 | |
| GentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | MACS cell dissociation tubes |
| Hank balanced salt solution | Fisher Scientific | 14-025-076 | |
| LS Magnetic Columns | Miltenyi Biotec | 130-042-401 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MS Magnetic Columns | Miltenyi Biotec | 130-042-201 | |
| Monocyte Isolation Kit Bone Marrow, mouse | Miltenyi Biotec | 130-100-629 | includes 1 mL of monocyte biotin-antibody cocktail, 2 mL of anti-biotin microbeads, 1 mL of FcR blocking reagent |
| OctoMACS Separator | Miltenyi Biotec | 130-042-108 | |
| Pre-separation filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-091-051 | |
| Red Blood Cell Lysis Solution (10x) | Miltenyi Biotec | 130-094-183 | |
| Seahorse XFe96 Analyzer | Agilent | ||
| Seahorse XFe96 FluxPak | Agilent | 103792-100 | 18 Pro sensor cartridges, 18 Pro Cell Cutlure Microplates, 1 bottle of Seahorse XF Calibrant Solution |
| Seahorse XF Glycolysis Stress Test Kit | Agilent | 103020-100 | 6 single-use pouches, each with glucose, oligomycin, and 2-deoxy-D-glucose |
| Seahorse XF Mitochondrial Stress Test Kit | Agilent | 103015-100 | 6 single-use pouches, each with oligomycin, FCCP, and rotenone/antimycin A |
| Seahorse XF RPMI Medium, pH 7.4, 500 mL | Agilent | 103576-100 | no phenol red, bicarbonate, glucose, pyruvate, or glutamine |
참고문헌
- Ma, Y., Mouton, A. J., Lindsey, M. L. Cardiac macrophage biology in the steady-state heart, the aging heart, and following myocardial infarction. Transl Res. 191, 15-28 (2018).
- Mouton, A. J., Li, X., Hall, M. E., Hall, J. E. Obesity, hypertension, and cardiac dysfunction: Novel roles of immunometabolism in macrophage activation and inflammation. Circ Res. 126 (6), 789-806 (2020).
- Mouton, A. J., et al. Dimethyl fumarate preserves left ventricular infarct integrity following myocardial infarction via modulation of cardiac macrophage and fibroblast oxidative metabolism. J Mol Cell Cardiol. 158, 38-48 (2021).
- Mouton, A. J., et al. Temporal changes in glucose metabolism reflect polarization in resident and monocyte-derived macrophages after myocardial infarction. Front Cardiovasc Med. 10, 1136252 (2023).
- Mouton, A. J., et al. Glutamine metabolism improves left ventricular function but not macrophage-mediated inflammation following myocardial infarction. Am J Physiol Cell Physiol. 327 (3), C571-C586 (2024).
- Mouton, A. J., et al. Mapping macrophage polarization over the myocardial infarction time continuum. Basic Res Cardiol. 113 (4), 26 (2018).
- . XF software. Agilent Seahorse Analytics Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-software/agilent-seahorse-analytics-787485 (2025)
- Matsuura, Y., et al. Diabetes suppresses glucose uptake and glycolysis in macrophages. Circ Res. 130 (5), 779-781 (2022).
- Alexander, R. K., et al. Bmal1 integrates mitochondrial metabolism and macrophage activation. Elife. 9, e54090 (2020).
- Wan, Y., et al. miR-34a regulates macrophage-associated inflammation and angiogenesis in alcohol-induced liver injury. Hepatol Commun. 7 (4), e0089 (2023).
- Nomura, M., et al. Fatty acid oxidation in macrophage polarization. Nat Immunol. 17 (3), 216-217 (2016).
- Li, X., et al. Glycolytic reprogramming in macrophages and MSCs during inflammation. Front Immunol. 14, 1199751 (2023).
- Desousa, B. R., et al. Calculation of ATP production rates using the Seahorse XF Analyzer. EMBO Rep. 24 (10), e56380 (2023).
- Lewis, A. J. M., et al. Noninvasive immunometabolic cardiac inflammation imaging using hyperpolarized magnetic resonance. Circ Res. 122 (8), 1084-1093 (2018).
- Walls, J., Romero, M. Assessing T cell bioenergetic poise and spare respiratory capacity using extracellular flux analysis. Agilent Technologies application note. , 5994-4494 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유