Method Article
Analyse du flux métabolique ex vivo dans les macrophages spléniques et cardiaques et les monocytes de la moelle osseuse
Dans cet article
Résumé
Ici, nous décrivons en détail les méthodes d’extraction des macrophages de la moelle osseuse, de la rate et du cœur infarctus, puis d’évaluation du flux métabolique dans les cellules vivantes.
Résumé
La reprogrammation métabolique est une caractéristique de l’activation des monocytes/macrophages et de la polarisation entre les états pro- et anti-inflammatoires. Par exemple, les monocytes/macrophages pro-inflammatoires (c’est-à-dire de type M1) dépendent davantage de la glycolyse anaérobie et moins de la phosphorylation oxydative mitochondriale, tandis que les macrophages anti-inflammatoires (de type M2) dépendent davantage de l’oxydation du glucose et des acides gras dans les mitochondries. Nous décrivons ici des protocoles approfondis pour extraire les macrophages des deux principaux réservoirs de monocytes/macrophages du corps, la rate et la moelle osseuse, ainsi que des tissus lésés tels que le cœur après un infarctus du myocarde.
Les macrophages ou les monocytes sont extraits par tri immunomagnétique à l’aide de microbilles marquées d’anticorps, qui se lient facilement aux cellules sans compromettre leurs phénotypes. Les cellules extraites sont ensuite cultivées dans des plaques à 96 puits, suivies d’une analyse des flux extracellulaires à l’aide d’un analyseur de flux métabolique. La glycolyse et la phosphorylation oxydative mitochondriale peuvent être mesurées simultanément dans un petit nombre de cellules (aussi peu que 2-3 × 105 cellules). Cette méthode peut facilement être réalisée en 1 jour et produit des résultats fiables et reproductibles. En fin de compte, ces méthodes contribuent à améliorer notre compréhension des changements métaboliques au cours des réponses immunitaires et inflammatoires aux blessures et aux maladies, ce qui pourrait conduire au développement de nouvelles cibles thérapeutiques pour les voies immunométaboliques.
Introduction
L’immunométabolisme est un domaine en plein essor qui étudie le rôle de la reprogrammation métabolique dans les cellules immunitaires à travers différentes maladies pathologiques et états de blessures. Les macrophages sont un élément clé du système immunitaire inné qui joue un rôle essentiel dans l’inflammation, la réponse à l’infection, la présentation de l’antigène et la cicatrisation des plaies1. Comprendre comment les macrophages se polarisent entre les sous-ensembles pro- et anti-inflammatoires (de type M1 et M2) à travers différents états pathologiques est un domaine de recherche continu et intense. Des études récentes ont identifié la reprogrammation métabolique comme un mécanisme clé sous-jacent à la polarisation des macrophages. Le paradigme actuel est que, d’une manière générale, les macrophages de type M1 (qui sont généralement de type monocyte) dépendent davantage de la glycolyse pour alimenter les fonctions pro-inflammatoires, tandis que les macrophages de type M2 s’appuient davantage sur la phosphorylation oxydative mitochondriale pour réprimer les fonctions pro-inflammatoires et alimenter les processus anti-inflammatoires2. Comprendre comment le métabolisme des macrophages est modifié dans différents états pathologiques peut donner un aperçu des thérapies potentielles qui pourraient être utilisées pour cibler les voies métaboliques.
À titre d’exemple, notre laboratoire a étudié de manière approfondie le rôle de la reprogrammation métabolique des macrophages lors d’un infarctus du myocarde (IM)3,4,5. Les macrophages jouent un rôle clé dans la réponse inflammatoire et la cicatrisation des plaies au cours de l’infarctus du myocarde et, en tant que tels, subissent une polarisation des phénotypes de type M1 vers les phénotypes de type M2 lorsque le cœur infarctus subit un remodelage pour former du tissu cicatriciel de remplacement. En utilisant les méthodes décrites ici, nous avons démontré que cette polarisation est caractérisée par des changements uniques dans le métabolisme du glucose et de la glutamine, ainsi que dans la fonction mitochondriale. Nous décrivons des méthodes d’extraction de macrophages cardiaques, ainsi que de macrophages spléniques et de monocytes de moelle osseuse, qui peuvent être combinées à l’analyse des flux extracellulaires pour évaluer le flux métabolique ex vivo en une seule journée. Nous espérons que les méthodes décrites offrent une approche standardisée pour évaluer les phénotypes métaboliques des cellules immunitaires afin d’améliorer la reproductibilité dans les laboratoires qui étudient ce sujet important.
Protocole
Les méthodes ci-dessous décrivent des protocoles d’extraction des macrophages et d’analyse ex vivo du flux métabolique du cœur infarctus à la suite d’un infarctus du myocarde, de la rate et de la moelle osseuse (Figure 1). Pour l’infarctus du myocarde cardiaque et de la rate, la méthode d’extraction utilisée est identique. Tous les protocoles impliquant des souris ont été approuvés par le comité institutionnel de soin et d’utilisation des animaux du centre médical de l’Université du Mississippi (Protocole #1371, Mouton).
1. Extraction des macrophages du cœur et de la rate infarctus
REMARQUE : L’extraction des macrophages tissulaires utilise une stratégie de sélection négative pour éliminer d’abord les neutrophiles, qui sont marqués avec des microbilles Ly6G, puis une stratégie de sélection positive pour obtenir des macrophages avec des microbilles CD11b 3,4,5,6. Lors de l’exécution de ce protocole, travaillez rapidement et gardez les cellules froides.
- Euthanasier la souris conformément aux directives de l’AALAC et de l’établissement par surdose d’isoflurane suivie de l’ablation du cœur.
- Retirez rapidement le cœur et la rate et pesez les tissus.
- Avant l’essai, préparer le tampon PEB en dissolvant l’EDTA (2 mM) et 0,5 % d’albumine sérique bovine (p/v) dans une solution saline tamponnée au phosphate (PBS). Conserver au froid.
- Placez le cœur dans la solution saline équilibrée froide de Hank (HBSS). Hacher avec un scalpel stérile en petits morceaux.
- Préparez une solution de digestion contenant 600 U/mL de collagénase de type II et 60 U/mL de DNase de type I. Mélangez le tissu dans 10 mL de la solution de digestion dans un tube de dissociation cellulaire MACS.
REMARQUE : Préparez suffisamment de solution de digestion pour utiliser 10 ml pour chaque mouchoir (température ambiante). - Incuber les tissus à l’aide du dissociateur cellulaire selon le protocole du fabricant. Cela incubera le tissu haché à 37 °C avec une rotation douce pendant ~1 h pour générer une suspension cellulaire.
- Déplacer la suspension dans des tubes coniques de 15 mL et centrifuger à 300 × g pendant 10 min à 4 °C.
- Remettre la pastille en suspension dans 1 mL de tampon PEB. Pour générer une suspension unicellulaire, appliquez la suspension sur un filtre de 30 μm.
- Pour lyser les globules rouges, ajoutez 10 ml de 1 solution de lyse des globules rouges. Incuber pendant 5 à 10 min dans l’obscurité à 4 °C.
- Centrifuger la suspension pendant 300 × g pendant 10 min à 4 °C.
- Remettre la pastille en suspension dans 1 mL de PEB et compter les cellules à l’aide d’un hémacytomètre.
- Centrifuger la suspension à 300 × g pendant 10 min à 4 °C.
- Pour éliminer les neutrophiles, préparez les microbilles en mélangeant 90 μL de tampon PEB avec 10 μL de microbilles anti-Ly6G par 10à 7 cellules. Mélangez la pastille cellulaire avec la suspension de microbilles et incubez pendant 10 min dans l’obscurité à 4 °C.
- Pour éliminer les microbilles non liées, ajouter 10 ml de tampon PEB et centrifuger à 300 × g pendant 10 min à 4 °C.
- Préparez des colonnes magnétiques (MS ou LS) sur un support magnétique. Mouillez les colonnes en ajoutant 0,5 à 1,0 mL de tampon PEB.
REMARQUE : Pour les tissus avec une abondance de cellules immunitaires (c’est-à-dire la rate), la colonne magnétique peut facilement se boucher et cesser de couler. Ainsi, nous recommandons d’utiliser des colonnes LS pour la rate. - Remettre en suspension la pastille cellulaire dans 500 μL de tampon PEB. Ajoutez la suspension cellulaire à la colonne magnétique et laissez passer les cellules non marquées (c’est-à-dire les non-neutrophiles). Lavez la colonne 2x avec 500 μL de tampon PEB. Prélever les cellules non marquées (c.-à-d. les macrophages et autres cellules) dans un tube conique de 15 ml.
- Centrifuger la suspension à 300 × g pendant 10 min à 4 °C.
- Préparez les microbilles en mélangeant 90 μL de tampon PEB avec 10 μL de microbilles anti-CD11b par 10à 7 cellules. Mélangez la pastille cellulaire avec la suspension de microbilles et incubez pendant 15 min dans l’obscurité à 4 °C.
- Répétez les étapes 1.13-1.15.
- Les macrophages marqués seront liés à la colonne magnétique. Pour les récupérer, détachez la colonne magnétique du support magnétique et placez-la sur un nouveau tube conique de 15 ml.
- Ajouter 1 mL de milieu RPMI complété par 0,1 % de sérum de veau fœtal (FBS) dans la colonne. Utilisez le piston pour extraire les macrophages dans le tube. Comptez les macrophages à l’aide d’un hémacytomètre.
REMARQUE : Les macrophages sont maintenant dans le tube et prêts à être utilisés pour d’autres dosages.
2. Extraction des monocytes de la moelle osseuse
REMARQUE : L’extraction des monocytes de la moelle osseuse utilise une stratégie de sélection négative dans laquelle les non-monocytes, y compris les lymphocytes, les cellules tueuses naturelles, les cellules dendritiques, les cellules érythroïdes et les granulocytes (c’est-à-dire les neutrophiles), sont marqués et éliminés par immunomagnétisme.
- Euthanasier la souris conformément aux directives de l’AALAC et de l’établissement par surdose d’isoflurane suivie de l’ablation du cœur.
- Retirez les pattes de la souris. Dans le HBSS froid, disséquez le muscle loin du tibia et du fémur jusqu’à ce que les os soient propres.
- Coupez soigneusement les deux extrémités de l’os. À l’aide d’une seringue de 10 ml munie d’une aiguille de 27 g, rincer la moelle osseuse dans un tube conique de 15 mL muni d’un tampon PEB. Centrifuger la suspension à 300 × g pendant 10 min à 4 °C.
- Effectuez les étapes 1.8 à 1.12.
- Ajouter 175 μL de tampon PEB, 25 μL de réactif bloquant FcR et 50 μL de cocktail biotine-anticorps monocytaire par 5 × 107 cellules totales. Incuber 5 min dans l’obscurité à 4 °C.
- Laver en ajoutant 10 mL de tampon PEB et centrifuger à 300 × g pendant 10 min à 4 °C.
- Récupérez la pastille et remettez les cellules en suspension dans 500 μL de tampon PEB et 100 μL de microbilles anti-biotine. Incuber 10 min dans l’obscurité à 4 °C.
- Préparez des colonnes magnétiques (LS) sur un support magnétique. Mouillez les colonnes en ajoutant 1,0 mL de tampon PEB.
- Appliquez immédiatement la suspension de cellule sur la colonne. À l’aide d’un tube de 15 ml, recueillir le circuit qui contient les monocytes. Les non-monocytes sont liés à la colonne magnétique.
- Lavez la colonne 2 fois avec 1 mL de tampon PEB. Comptez les monocytes à l’aide d’un hémacytomètre.
- Pour préparer les monocytes à l’étape suivante, centrifuger à 300 × g pendant 10 min à 4 °C. Pour l’analyse de flux, remettre en suspension la pastille de cellule dans 1 mL de RPMI + 0,1 % FBS. Pour la cytométrie en flux, conservez les cellules dans du PEB froid et procédez à la coloration.
3. Préparation des cellules pour l’analyse des flux métaboliques
- Hydrater la cartouche du capteur (la veille du dosage)
- Retirez la cartouche du capteur de son emballage. Retirez la plaque du capteur (verte) des puits et pipetez 200 μL de liquide d’étalonnage dans chaque puits. Replacez la plaque du capteur sur le dessus de la plaque de la cartouche afin que les capteurs soient immergés dans le fluide d’étalonnage.
- Placez la cartouche dans un incubateur humidifié sans CO2 (37 °C) pendant la nuit.
- Placage des cellules
- Plaquez les cellules dans une plaque de culture à 96 puits dans 200 μL de milieu pendant au moins 1 h. Laissez au moins un puits vide pour les mesures d’arrière-plan (utilisez le même volume de support pour les puits vides).
REMARQUE : Le nombre optimal de cellules doit être déterminé avant l’expérimentation. Pour plus de détails, consultez la section « Conseils de dépannage » de la discussion. - Lorsque vous êtes prêt à effectuer le test, préparez le milieu de flux métabolique (c’est-à-dire RPMI ou DMEM basal sans glucose, glutamine, pyruvate, etc.). Pour le test d’effort de glycolyse, assurez-vous que le milieu basal est complété par 2 mM de glutamine. Pour le test d’effort mitochondrial, assurez-vous que le milieu basal est complété par 2 mM de glutamine, 10 mM de glucose et 1 mM de pyruvate.
- Remplacez soigneusement l’ancien média par un nouveau média basal en pipetant lentement (attention à ne déloger aucune cellule). Vérifiez les cellules au microscope pour vous assurer qu’elles sont toujours présentes.
- Placez la plaque cellulaire dans un incubateur humidifié sans CO2 (37 °C).
- Plaquez les cellules dans une plaque de culture à 96 puits dans 200 μL de milieu pendant au moins 1 h. Laissez au moins un puits vide pour les mesures d’arrière-plan (utilisez le même volume de support pour les puits vides).
- Chargement de la plaque de flux
- Récupérez la cartouche de capteur d’hydratation/plaque de flux de l’incubateur.
- Préparez les composés d’essai pour la glycolyse ou l’essai de stress mitochondrial.
- Glycolyse : À l’aide d’un milieu de base de glycolyse, créer des solutions mères en dissolvant du glucose dans 3 ml, de l’oligomycine dans 270 μL (100 μM) et du 2-désoxyglucose dans 3 mL. Créez une solution d’oligomycine fonctionnelle de 10 μM.
- Mitochondriale : À l’aide d’un milieu basal mitochondrial, créer des solutions mères en dissolvant l’oligomycine dans 630 μL (100 μM), le cyanure de carbonyle-p-trifluorométhoxyphénylhydrazone (FCCP) dans 720 μL (100 μM) et la roténone/antimycine A dans 540 μL (50 μM). Créer des solutions fonctionnelles d’oligomycine (0,5 à 2,5 μM), de FCCP (0,125 à 2,0 μM) et de roténone/antimycine A (0,5 μM).
REMARQUE : Nous avons constaté que l’oligomycine de 1,5 μM et le FCCP de 2,0 μM produisent les meilleurs résultats.
- Chargez les composés dans les orifices en utilisant les volumes suivants : orifice A-20 μL, orifice B-22 μL, orifice C-25 μL, orifice D-27 μL. Facultatif : Chargez le médicament ou le composé de votre choix dans l’orifice A et testez les composés dans les orifices B, C et D pour évaluer les effets aigus sur la glycolyse ou la respiration mitochondriale. Si vous n’utilisez pas de médicament ou de composé supplémentaire, laissez le port D vide.
- Exécution du test
- Ouvrez le logiciel et sélectionnez Test d’effort mitochondrial.
REMARQUE : Ce programme peut également être utilisé pour le test de stress de glycolyse, car le taux d’acidification extracellulaire (ECAR) est mesuré. - Sélectionnez les puits qui seront utilisés. Pour soustraire l’arrière-plan, assurez-vous qu’au moins 1 puits n’a pas de cellules.
- Exécutez le programme. Chargez la plaque de flux avec le couvercle retiré afin que la plaque soit calibrée (~20 min).
- Une fois la plaque calibrée, le logiciel vous demandera de charger la plaque cellulaire. Sortez la plaque cellulaire de l’incubateur, retirez le bas de la plaque de flux et placez la plaque cellulaire dans le support. Appuyez sur exécuter. Le test prendra ~2,5 h.
- Analysez les résultats à l’aide d’un logiciel de flux métabolique7 ou d’un autre logiciel analytique de votre choix.
- Ouvrez le logiciel et sélectionnez Test d’effort mitochondrial.
Résultats
Le nombre de cellules typiques obtenu à partir des différents tissus dépend de la taille, de l’âge et du sexe de l’animal. Pour une souris mâle adulte (c.-à-d. âgée de 16 semaines, ~30 g), la rate peut produire 3,0 à 4,0 × 106 macrophages, tandis que la moelle osseuse (deux tibias et deux fémurs) produit généralement 1,0 à 1,5 × 106 monocytes (figure 2A). Le cœur infarctus donne généralement des chiffres élevés, selon le jour suivant les MI4, 5 et 6. Au jour 3, le rendement est généralement de ~1,5 × 106 cellules/cœur. Le cœur sain a généralement très peu de macrophages (0,1-0,2 × 105/cœur)6 ; Ainsi, si l’on utilise des macrophages du cœur sain (cœur non infarctus) comme contrôle, il peut être nécessaire de regrouper plusieurs cœurs. La figure 2B illustre des graphiques représentatifs de cytométrie en flux à partir de macrophages ou de monocytes extraits, montrant des populations très positives pour CD11b et négatives pour Ly6G. Les macrophages cardiaques et spléniques montrent une hétérogénéité pour le marqueur monocytaire Ly6C, tandis que les monocytes de la moelle osseuse sont très positifs pour Ly6C. Des graphiques représentatifs de cytométrie en flux pour les neutrophiles triés (cœur et rate) et les cellules non triées du cœur, de la rate et de la moelle osseuse infarctus (c’est-à-dire le tissu entier) sont présentés dans les figures supplémentaires S1, S2 et S3.
Les résultats de l’analyse des flux extracellulaires sont représentés par des modifications de l’ECAR (mPh/min) et du taux de consommation d’oxygène (OCR, pmol O2/min). Les résultats sont généralement présentés sous forme de graphique linéaire avec l’ECAR ou l’OCR sur l’axe des y et le temps sur l’axe des x (Figure 3). Les mesures spécifiques sont affichées sous forme de graphiques à barres.
À partir des données brutes, on peut calculer plusieurs paramètres métaboliques. On peut également calculer le rapport OCR/ECAR de chaque puits pour donner une idée de la dépendance à la glycolyse par rapport à la respiration mitochondriale, qui peut changer dans différentes conditions4. Par exemple, nous avons fait jeûner des souris (mâle adulte C57BL/6J) pendant la nuit pour évaluer les changements dans le métabolisme des macrophages. Un phénotype à jeun a été confirmé par une diminution de la glycémie et une augmentation des cétones sanguines (figure supplémentaire S4), ce qui a entraîné une diminution des leucocytes et des neutrophiles circulants (Hemavet 950FS Auto Blood Analyzer ; Figure supplémentaire S5). Nous avons isolé les monocytes de la moelle osseuse et les macrophages spléniques de souris nourries par rapport aux souris à jeun et évalué les changements métaboliques par analyse des flux extracellulaires (Figure 4). Dans les monocytes de la moelle osseuse, le jeûne a diminué la glycolyse et augmenté le rapport OCR/ECAR dans le test de stress mitochondrial et le test de stress de glycolyse (Figure 4A). Dans les macrophages de la rate, le jeûne n’a pas affecté de manière significative la glycolyse, mais a augmenté la capacité de réserve et la respiration liée à l’ATP (Figure 4B). La figure 4C montre un exemple de flux métabolique dans des macrophages isolés du cœur infarctus 3 jours après l’opération.
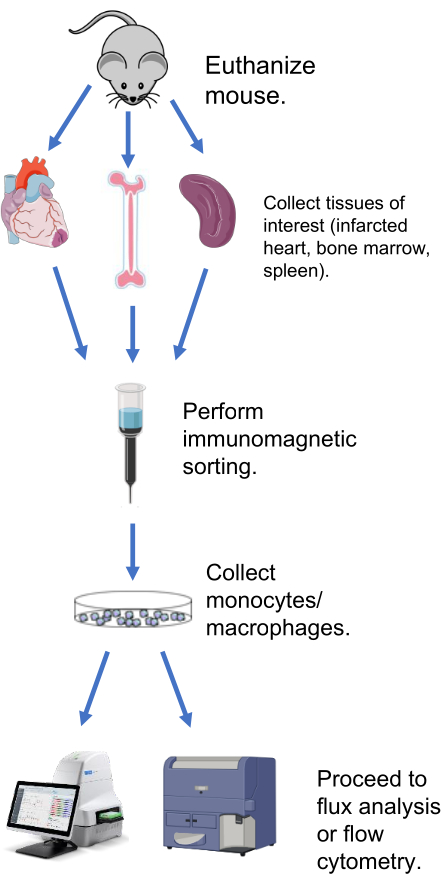
Figure 1 : Schéma représentatif de l’analyse des flux métaboliques dans les macrophages/monocytes extraits. Veuillez cliquer ici pour voir une version agrandie de cette figure.
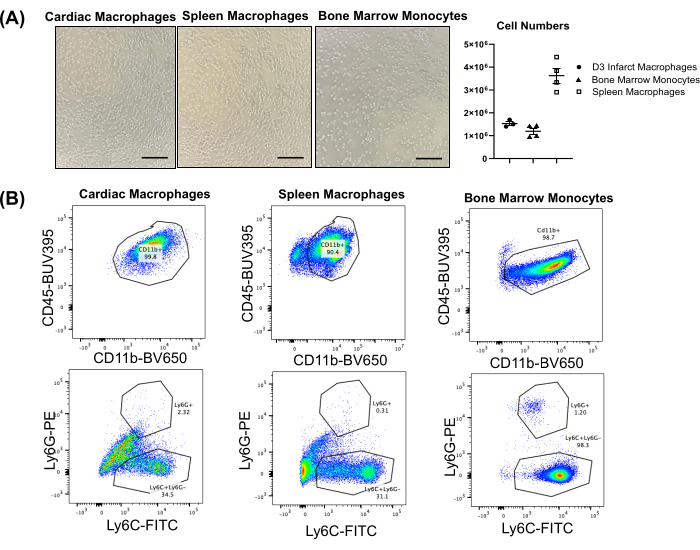
Figure 2 : Résultats représentatifs de macrophages cardiaques et spléniques et de monocytes de moelle osseuse isolés chez la souris. (A) Images représentatives de macrophages cardiaques et spléniques isolés et de monocytes de moelle osseuse (4x) ; Nombre moyen de cellules par souris. Barre d’échelle = 1 mm. (B) Graphiques de cytométrie en flux représentatifs des macrophages cardiaques (infarctus du myocarde jour 3) et de la rate et des monocytes de la moelle osseuse. CD45 a été utilisé comme marqueur pan-leucocytaire, et CD11b a été utilisé comme marqueur de cellules myéloïdes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
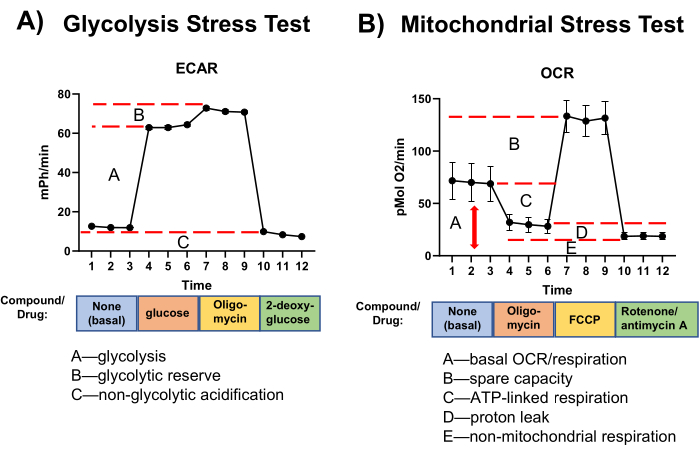
Figure 3 : Résultats représentatifs des tests. (A) Glycolyse et (B) Tests de stress mitochondrial. N = 3 mesures indépendantes (macrophages spléniques). Moyenne ± MEB. Abréviations : ECAR = taux d’acidification extracellulaire ; OCR = taux de consommation d’oxygène ; FCCP = cyanure de carbonyle-p-trifluorométhoxyphénylhydrazone. Veuillez cliquer ici pour voir une version agrandie de cette figure.
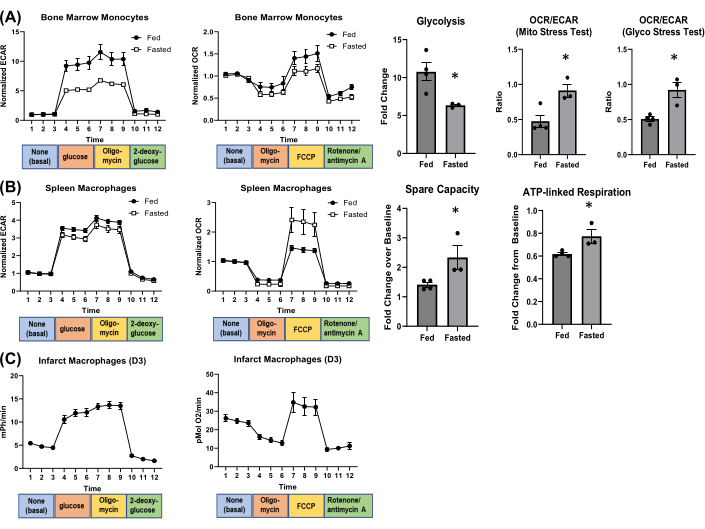
Figure 4 : Impact du jeûne nocturne sur le métabolisme cellulaire. (A) Monocytes de la moelle osseuse et (B) métabolisme des macrophages de la rate. (C) Graphiques représentatifs des flux extracellulaires des macrophages cardiaques 3 jours après l’infarctus du myocarde. N = 3-4 par groupe. Abréviation : FCCP = cyanure de carbonyle-p-trifluorométhoxyphénylhydrazone. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Graphiques représentatifs de cytométrie en flux et taux de glucose et de cétones dans le sang de souris nourries et à jeun. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Notre méthode détaille l’extraction rapide des macrophages de la moelle osseuse, de la rate et du cœur infarctus, qui peuvent ensuite être utilisés pour effectuer des analyses en aval telles que l’analyse des flux métaboliques extracellulaires. La combinaison de ces deux méthodes est un outil puissant qui permet de quantifier les changements métaboliques dans les macrophages sous différents états de maladie ou de blessure, ou dans des états métaboliques tels que l’exercice. Alors que notre méthode s’est concentrée sur la moelle osseuse et les macrophages spléniques, d’autres réservoirs de macrophages peuvent être utilisés, tels que le compartiment péritonéal8. Bien que nous ne soyons pas les premiers à utiliser cette méthode, nous espérons que cet article augmentera la visibilité et améliorera la normalisation dans les laboratoires.
Bien que les données obtenues à partir de ces méthodes donnent un aperçu inestimable de l’état métabolique des différents compartiments de macrophages, il est fortement recommandé d’utiliser d’autres méthodes pour compléter les données de flux métaboliques afin d’obtenir une image plus complète du métabolisme. Par exemple, la combinaison des données de flux métabolique avec la métabolomique (c’est-à-dire la quantification des métabolites intracellulaires) et l’expression génique/protéique et/ou l’activité des enzymes métaboliques est souvent utilisée pour créer une évaluation complète des états métaboliques dans les macrophages 5,9. Dans de nombreux cas, les cellules d’un même animal peuvent être utilisées pour différents tests.
D’après notre expérience, l’optimisation du protocole peut impliquer un dépannage à plusieurs étapes différentes. L’une des choses les plus importantes est de travailler rapidement et de garder les cellules froides, ce qui augmentera le rendement et la viabilité des cellules. Déterminer le nombre optimal de cellules pour le flux extracellulaire est un autre point clé, car trop peu de cellules ne donneront pas un signal détectable, tandis que trop de cellules épuiseront les nutriments dans le milieu et ne montreront donc pas de réponse aux composés injectés. Pour les macrophages, nous avons constaté que 2,0 × 10cellules 5 du cœur de l’IM et 3,0 × 105 dans une plaque de 96 puits donnent les résultats les plus fiables et les plus reproductibles. Cependant, cela peut varier d’un laboratoire à l’autre. Il faut veiller tout particulièrement à ce que le nombre de cellules soit égal entre les échantillons et les groupes. Différents nombres de cellules ont des réponses différentes aux médicaments utilisés dans le test et peuvent introduire une variabilité indésirable.
Les concentrations optimales de drogues injectées incluses dans le test (oligomycine, FCCP) doivent également être optimisées avant la réalisation des expériences. Par exemple, nous avons constaté que l’oligomycine de 1,5 μM et le FCCP de 2,0 μM produisent les réponses les plus robustes. Une autre erreur courante est de ne pas laisser aux cellules suffisamment de temps après l’extraction pour adhérer à la boîte de culture, ce qui entraîne la perte de cellules lors du passage au milieu de flux extracellulaire. Nous suggérons au moins 1 h, et jusqu’à 2 h, pour permettre aux cellules d’adhérer.
Un pipetage trop agressif peut également entraîner une perte de cellules ; Il est recommandé de pipeter très soigneusement et de vérifier fréquemment les cellules au microscope. Un dernier point est de travailler rapidement lors de la préparation de la plaque de flux, en particulier lors de la réalisation du test de stress de glycolyse. Étant donné que ces cellules sont privées de glucose avant le test, des temps d’incubation plus longs (plus de 1 h dans le milieu basal) peuvent modifier la réponse initiale au glucose. Nous vous suggérons de préparer immédiatement la plaque de flux après avoir remplacé le média normal par le média de base (~30 min), puis de calibrer la plaque (ce qui prend ~20 min). La variabilité inter-essais doit toujours être prise en compte. Lors de comparaisons directes entre groupes, il faut toujours s’efforcer d’effectuer tous les groupes dans la même plaque ou expérience.
Bien que nous ayons décrit deux tests standard fréquemment utilisés (tests de stress de glycolyse et tests de stress mitochondrial), il convient de noter qu’il existe plusieurs autres tests standardisés qui peuvent être utilisés pour évaluer d’autres voies métaboliques, tels que le test de flexion du carburant mitochondrial10, l’oxydation des acides gras/palmitates11 et le test du taux d’ATP12. De nouvelles études ont démontré l’efficacité du découpleur BAM15, qui est fourni dans le kit de profilage métabolique des cellules T. BAM15 semble être un découpleur plus fiable que le FCCP avec moins d’effets cytotoxiques13. Des études futures devraient explorer le potentiel de ce découpleur dans l’évaluation métabolique des macrophages.
Cette méthode présente certaines limites. La première est qu’en raison du nombre de pas, il peut être difficile pour une seule personne d’effectuer en temps opportun. En particulier, lors de l’utilisation d’un nombre plus élevé d’échantillons (jusqu’à 8), il est recommandé de faire travailler deux personnes ensemble pour améliorer la qualité des résultats. Nous avons constaté qu’il est difficile de traiter plus de huit échantillons par jour, même avec deux personnes. Une autre limitation est que, puisque le test est effectué ex vivo, il est toujours possible que la procédure d’extraction provoque des changements dans le phénotypecellulaire 6. Bien qu’il n’y ait pas de moyen évident d’éliminer cette limitation, des techniques d’imagerie in vivo telles que l’imagerie par résonance magnétique hyperpolarisée ont été utilisées pour visualiser la production de lactate de macrophages après MI14 et, espérons-le, continueront d’évoluer en complément ou en remplacement de la méthode ex vivo que nous décrivons. Une limite de la méthode du flux extracellulaire est que, bien qu’elle puisse capturer les décalages entre la glycolyse et l’OXPHOS, elle ne reflète pas entièrement les changements dans le taux de production d’ATP dans ces voies15. De plus, les changements dans l’acidification du milieu (ECAR) ne reflètent pas toujours la production d’acide lactique par glycolyse, mais peuvent également être influencés par la génération de CO2 par le cycle du TCA, qui est converti en bicarbonate15. Ainsi, il peut être avantageux pour les utilisateurs de calculer le taux de production d’ATP à partir de la glycolyse et de l’OXPHOS, ce qui permet d’évaluer les contributions de ces voies à la production globale d’ATP.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous tenons à souligner le financement qui a soutenu ce travail : NIH/NHBLI 166737, NIH R00 HL146888, NIH U54HL169191, NIH/NIGMS P20GM104357 et NIH/NIGMS P30GM149404 pour ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| Anti-CD11b Microbeads UltraPure, mouse | Miltenyi Biotec | 130-126-725 | |
| Anti-Ly6G Microbeads UltraPure, mouse | Miltenyi Biotec | 130-120-337 | |
| Collagenase type II | Worthington | NC9522060 | |
| Dnase type I | MillPore Sigma | 11284932001 | |
| GentleMACS Octo Dissociator | Miltenyi Biotec | 130-096-427 | |
| GentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | MACS cell dissociation tubes |
| Hank balanced salt solution | Fisher Scientific | 14-025-076 | |
| LS Magnetic Columns | Miltenyi Biotec | 130-042-401 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MS Magnetic Columns | Miltenyi Biotec | 130-042-201 | |
| Monocyte Isolation Kit Bone Marrow, mouse | Miltenyi Biotec | 130-100-629 | includes 1 mL of monocyte biotin-antibody cocktail, 2 mL of anti-biotin microbeads, 1 mL of FcR blocking reagent |
| OctoMACS Separator | Miltenyi Biotec | 130-042-108 | |
| Pre-separation filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-091-051 | |
| Red Blood Cell Lysis Solution (10x) | Miltenyi Biotec | 130-094-183 | |
| Seahorse XFe96 Analyzer | Agilent | ||
| Seahorse XFe96 FluxPak | Agilent | 103792-100 | 18 Pro sensor cartridges, 18 Pro Cell Cutlure Microplates, 1 bottle of Seahorse XF Calibrant Solution |
| Seahorse XF Glycolysis Stress Test Kit | Agilent | 103020-100 | 6 single-use pouches, each with glucose, oligomycin, and 2-deoxy-D-glucose |
| Seahorse XF Mitochondrial Stress Test Kit | Agilent | 103015-100 | 6 single-use pouches, each with oligomycin, FCCP, and rotenone/antimycin A |
| Seahorse XF RPMI Medium, pH 7.4, 500 mL | Agilent | 103576-100 | no phenol red, bicarbonate, glucose, pyruvate, or glutamine |
Références
- Ma, Y., Mouton, A. J., Lindsey, M. L. Cardiac macrophage biology in the steady-state heart, the aging heart, and following myocardial infarction. Transl Res. 191, 15-28 (2018).
- Mouton, A. J., Li, X., Hall, M. E., Hall, J. E. Obesity, hypertension, and cardiac dysfunction: Novel roles of immunometabolism in macrophage activation and inflammation. Circ Res. 126 (6), 789-806 (2020).
- Mouton, A. J., et al. Dimethyl fumarate preserves left ventricular infarct integrity following myocardial infarction via modulation of cardiac macrophage and fibroblast oxidative metabolism. J Mol Cell Cardiol. 158, 38-48 (2021).
- Mouton, A. J., et al. Temporal changes in glucose metabolism reflect polarization in resident and monocyte-derived macrophages after myocardial infarction. Front Cardiovasc Med. 10, 1136252 (2023).
- Mouton, A. J., et al. Glutamine metabolism improves left ventricular function but not macrophage-mediated inflammation following myocardial infarction. Am J Physiol Cell Physiol. 327 (3), C571-C586 (2024).
- Mouton, A. J., et al. Mapping macrophage polarization over the myocardial infarction time continuum. Basic Res Cardiol. 113 (4), 26 (2018).
- . XF software. Agilent Seahorse Analytics Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-software/agilent-seahorse-analytics-787485 (2025)
- Matsuura, Y., et al. Diabetes suppresses glucose uptake and glycolysis in macrophages. Circ Res. 130 (5), 779-781 (2022).
- Alexander, R. K., et al. Bmal1 integrates mitochondrial metabolism and macrophage activation. Elife. 9, e54090 (2020).
- Wan, Y., et al. miR-34a regulates macrophage-associated inflammation and angiogenesis in alcohol-induced liver injury. Hepatol Commun. 7 (4), e0089 (2023).
- Nomura, M., et al. Fatty acid oxidation in macrophage polarization. Nat Immunol. 17 (3), 216-217 (2016).
- Li, X., et al. Glycolytic reprogramming in macrophages and MSCs during inflammation. Front Immunol. 14, 1199751 (2023).
- Desousa, B. R., et al. Calculation of ATP production rates using the Seahorse XF Analyzer. EMBO Rep. 24 (10), e56380 (2023).
- Lewis, A. J. M., et al. Noninvasive immunometabolic cardiac inflammation imaging using hyperpolarized magnetic resonance. Circ Res. 122 (8), 1084-1093 (2018).
- Walls, J., Romero, M. Assessing T cell bioenergetic poise and spare respiratory capacity using extracellular flux analysis. Agilent Technologies application note. , 5994-4494 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon