Method Article
Análisis del flujo metabólico ex vivo en macrófagos esplénicos y cardíacos y monocitos de médula ósea
En este artículo
Resumen
Aquí, describimos en detalle los métodos para extraer macrófagos de la médula ósea, el bazo y el corazón infartado, y posteriormente evaluar el flujo metabólico en células vivas.
Resumen
La reprogramación metabólica es un sello distintivo de la activación de monocitos/macrófagos y de la polarización entre los estados proinflamatorios y antiinflamatorios. Por ejemplo, los monocitos/macrófagos proinflamatorios (es decir, similares a M1) muestran una mayor dependencia de la glucólisis anaeróbica y menos de la fosforilación oxidativa mitocondrial, mientras que los macrófagos antiinflamatorios (similares a M2) muestran una mayor dependencia de la oxidación de la glucosa y los ácidos grasos en las mitocondrias. Aquí, describimos protocolos detallados para extraer macrófagos de los dos principales reservorios de monocitos/macrófagos en el cuerpo, el bazo y la médula ósea, así como de tejidos lesionados como el corazón después de un infarto de miocardio.
Los macrófagos o monocitos se extraen por clasificación inmunomagnética mediante el uso de microesferas marcadas con anticuerpos, que se unen fácilmente a las células sin comprometer sus fenotipos. A continuación, las células extraídas se cultivan en placas de 96 pocillos, seguidas de un análisis de flujo extracelular mediante un analizador de flujo metabólico. Tanto la glucólisis como la fosforilación oxidativa mitocondrial se pueden medir simultáneamente en un pequeño número de células (tan solo 2-3 × 105 células). Este método se puede realizar fácilmente en 1 día y produce resultados confiables y repetibles. En última instancia, estos métodos ayudan a mejorar nuestra comprensión de los cambios metabólicos durante las respuestas inmunitarias e inflamatorias a lesiones y enfermedades, lo que podría conducir al desarrollo de nuevas dianas terapéuticas para las vías inmunometabólicas.
Introducción
El inmunometabolismo es un campo en auge que estudia el papel de la reprogramación metabólica en las células inmunitarias a través de diferentes enfermedades patológicas y estados de lesión. Los macrófagos son una parte clave del sistema inmunitario innato que desempeña un papel fundamental en la inflamación, la respuesta a la infección, la presentación de antígenosy la cicatrización de heridas. Comprender cómo los macrófagos se polarizan entre subconjuntos proinflamatorios y antiinflamatorios (similares a M1 y M2) en diferentes estados de enfermedad es un área de investigación continua e intensa. Estudios recientes han identificado la reprogramación metabólica como un mecanismo clave que subyace a la polarización de los macrófagos. El paradigma actual es que, en términos generales, los macrófagos similares a M1 (que suelen ser similares a los monocitos) dependen más de la glucólisis para alimentar las funciones proinflamatorias, mientras que los macrófagos similares a M2 dependen más de la fosforilación oxidativa mitocondrial para sofocar las funciones proinflamatorias y alimentar los procesos antiinflamatorios2. Comprender cómo se altera el metabolismo de los macrófagos en diferentes estados de la enfermedad puede proporcionar información sobre posibles terapias que podrían usarse para dirigirse a las vías metabólicas.
A modo de ejemplo, nuestro laboratorio ha investigado ampliamente el papel de la reprogramación metabólica de los macrófagos durante el infarto de miocardio (IM)3,4,5. Los macrófagos desempeñan un papel clave en la respuesta inflamatoria y de cicatrización de heridas durante el infarto de miocardio y, como tales, experimentan una polarización de fenotipos similares a M1 a M2 a medida que el corazón infartado se remodela para formar tejido cicatricial de reemplazo. Utilizando los métodos descritos en este documento, hemos demostrado que esta polarización se caracteriza por cambios únicos en el metabolismo de la glucosa y la glutamina, y en la función mitocondrial. Describimos métodos para extraer macrófagos cardíacos, así como macrófagos esplénicos y monocitos de médula ósea, que pueden combinarse con análisis de flujo extracelular para evaluar el flujo metabólico ex vivo en un solo día. Esperamos que los métodos descritos ofrezcan un enfoque estandarizado para evaluar los fenotipos metabólicos de las células inmunitarias con el fin de mejorar la reproducibilidad en los laboratorios que estudian este importante tema.
Protocolo
Los métodos a continuación describen los protocolos para extraer macrófagos y realizar análisis ex vivo del flujo metabólico del corazón infartado después del infarto de miocardio, el bazo y la médula ósea (Figura 1). Para el corazón y el bazo del infarto de miocardio, el método de extracción utilizado es idéntico. Todos los protocolos que involucran ratones fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales del Centro Médico de la Universidad de Mississippi (Protocolo # 1371, Mouton).
1. Extracción de macrófagos del corazón y el bazo infartados
NOTA: La extracción de macrófagos tisulares utiliza una estrategia de selección negativa para eliminar primero los neutrófilos, que están marcados con microperlas Ly6G, y luego una estrategia de selección positiva para obtener macrófagos con microperlas CD11b 3,4,5,6. Al realizar este protocolo, trabaje rápidamente y mantenga las celdas frías.
- Sacrificar al ratón de acuerdo con las directrices institucionales y de la AALAC mediante una sobredosis de isoflurano seguida de la extirpación del corazón.
- Extirpar el corazón y el bazo rápidamente y pesar los tejidos.
- Antes del ensayo, prepare el tampón PEB disolviendo EDTA (2 mM) y albúmina sérica bovina al 0,5% (p/v) en solución salina tamponada con fosfato (PBS). Mantener frío.
- Coloque el corazón en una solución salina equilibrada fría de Hank (HBSS). Picar con un bisturí estéril en trozos pequeños.
- Prepare una solución de digestión que contenga 600 U/mL de colagenasa tipo II y 60 U/mL de DNasa tipo I. Mezcle el tejido en 10 mL de la solución de digestión en un tubo de disociación celular MACS.
NOTA: Prepare una cantidad suficiente de la solución de digestión para usar 10 mL por cada pañuelo (temperatura ambiente). - Incubar los tejidos utilizando el disociador celular según el protocolo del fabricante. Esto incubará el tejido picado a 37 °C con un giro suave durante ~ 1 h para generar una suspensión celular.
- Coloque la suspensión en tubos cónicos de 15 ml y centrifuga a 300 × g durante 10 min a 4 °C.
- Vuelva a suspender el pellet en 1 mL de tampón PEB. Para generar una suspensión unicelular, aplique la suspensión sobre un filtro de 30 μm.
- Para lisar los glóbulos rojos, agregue 10 ml de 1x solución de lisis de glóbulos rojos. Incubar durante 5-10 min en la oscuridad a 4 °C.
- Centrifugar la suspensión durante 300 × g durante 10 min a 4 °C.
- Vuelva a suspender el pellet en 1 mL de PEB y cuente las células con un hematitómetro.
- Centrifugar la suspensión a 300 × g durante 10 min a 4 °C.
- Para eliminar los neutrófilos, prepare las microperlas mezclando 90 μL de tampón PEB con 10 μL de microperlas anti-Ly6G por cada 107 células. Mezcle el pellet de celdas con la suspensión de microperlas e incube durante 10 minutos en la oscuridad a 4 °C.
- Para lavar las microesferas no unidas, añadir 10 mL de tampón PEB y centrifugar a 300 × g durante 10 min a 4 °C.
- Prepare columnas magnéticas (MS o LS) en un soporte magnético. Humedece las columnas añadiendo 0,5-1,0 mL de tampón PEB.
NOTA: En el caso de los tejidos con abundantes células inmunitarias (es decir, el bazo), la columna magnética puede obstruirse fácilmente y dejar de fluir. Por lo tanto, recomendamos usar columnas LS para el bazo. - Vuelva a suspender el pellet de celda en 500 μL de tampón PEB. Agregue la suspensión celular a la columna magnética y deje que las células no marcadas (es decir, los no neutrófilos) pasen a través de ella. Lave la columna 2 veces con 500 μL de tampón PEB. Recoja las células no marcadas (es decir, macrófagos y otras células) en un tubo cónico de 15 ml.
- Centrifugar la suspensión a 300 × g durante 10 min a 4 °C.
- Prepare las microperlas mezclando 90 μL de tampón PEB con 10 μL de microperlas anti-CD11b por cada 107 células. Mezcle el pellet de celdas con la suspensión de microperlas e incube durante 15 minutos en la oscuridad a 4 °C.
- Repita los pasos 1.13 a 1.15.
- Los macrófagos marcados se unirán a la columna magnética. Para recogerlos, separe la columna magnética del soporte magnético y colóquela sobre un nuevo tubo cónico de 15 mL.
- Añadir 1 mL de medio RPMI suplementado con 0,1% de suero fetal bovino (FBS) a la columna. Utilice el émbolo para extraer los macrófagos en el tubo. Cuente los macrófagos con un hematitómetro.
NOTA: Los macrófagos están ahora en el tubo y listos para su uso en ensayos posteriores.
2. Extracción de monocitos de la médula ósea
NOTA: La extracción de monocitos de la médula ósea utiliza una estrategia de selección negativa en la que los no monocitos, incluidos los linfocitos, las células asesinas naturales, las células dendríticas, las células eritroides y los granulocitos (es decir, los neutrófilos), se marcan y eliminan inmunomagnéticamente.
- Sacrificar al ratón de acuerdo con las directrices institucionales y de la AALAC mediante una sobredosis de isoflurano seguida de la extirpación del corazón.
- Retire las patas del mouse. En el HBSS frío, diseccione el músculo lejos de la tibia y el fémur hasta que los huesos estén limpios.
- Corta con cuidado ambos extremos del hueso. Con una jeringa de 10 mL con una aguja de 27 G, enjuague la médula ósea y colóquela en un tubo cónico de 15 mL con tampón PEB. Centrifugar la suspensión a 300 × g durante 10 min a 4 °C.
- Realice los pasos 1.8 a 1.12.
- Añadir 175 μL de tampón PEB, 25 μL de reactivo bloqueante de FcR y 50 μL de cóctel de biotina-anticuerpo monocitario por cada 5 × 107 de células totales. Incubar durante 5 min en la oscuridad a 4 °C.
- Lavar añadiendo 10 mL de tampón PEB y centrífuga a 300 × g durante 10 min a 4 °C.
- Recoja el gránulo y vuelva a suspender las células en 500 μL de tampón PEB y 100 μL de microesferas anti-biotina. Incubar durante 10 min en la oscuridad a 4 °C.
- Prepare columnas magnéticas (LS) en un soporte magnético. Humedece las columnas añadiendo 1,0 mL de tampón PEB.
- Aplique inmediatamente la suspensión de celdas a la columna. Use un tubo de 15 mL para recoger el flujo, que contiene los monocitos. Los no monocitos se unen a la columna magnética.
- Lave la columna 2 veces con 1 mL de tampón PEB. Cuente los monocitos con un hematitómetro.
- Para preparar los monocitos para el siguiente paso, centrifugar a 300 × g durante 10 min a 4 °C. Para el análisis de flujo, vuelva a suspender el pellet de celda en 1 mL de RPMI + 0,1% FBS. Para la citometría de flujo, mantenga las células en PEB frío y proceda con la tinción.
3. Preparación de las células para el análisis del flujo metabólico
- Hidratar el cartucho del sensor (el día antes del ensayo)
- Retire el cartucho del sensor de su paquete. Retire la placa del sensor (verde) de los pocillos y pipetee 200 μL de fluido calibrante en cada pocillo. Vuelva a colocar la placa del sensor en la parte superior de la placa del cartucho para que los sensores queden sumergidos en el líquido calibrante.
- Coloque el cartucho en una incubadora humidificada sin CO2 (37 °C) durante la noche.
- Recubrimiento de las células
- Coloque las células en una placa de cultivo de 96 pocillos en 200 μl de medio durante al menos 1 h. Deje al menos un pocillo en blanco para las mediciones de fondo (utilice el mismo volumen de medios para los pocillos en blanco).
NOTA: El número óptimo de células debe determinarse antes de la experimentación. Consulte "Sugerencias para la solución de problemas" en la discusión para obtener más detalles. - Cuando esté listo para realizar el ensayo, prepare el medio de flujo metabólico (es decir, RPMI basal o DMEM sin glucosa, glutamina, piruvato, etc.). Para la prueba de esfuerzo de glucólisis, asegúrese de que el medio basal esté suplementado con 2 mM de glutamina. Para la prueba de esfuerzo mitocondrial, asegúrese de que el medio basal esté suplementado con 2 mM de glutamina, 10 mM de glucosa y 1 mM de piruvato.
- Reemplace con cuidado el medio viejo por uno nuevo pipeteando lentamente (tenga cuidado de no desprender ninguna célula). Revise las células bajo un microscopio para asegurarse de que aún estén presentes.
- Coloque la placa celular en una incubadora humidificada sin CO2 (37 °C).
- Coloque las células en una placa de cultivo de 96 pocillos en 200 μl de medio durante al menos 1 h. Deje al menos un pocillo en blanco para las mediciones de fondo (utilice el mismo volumen de medios para los pocillos en blanco).
- Carga de la placa de fundente
- Recupere el cartucho del sensor hidratado/placa de flujo de la incubadora.
- Prepare los compuestos de prueba para la glucólisis o la prueba de esfuerzo mitocondrial.
- Glucólisis: Usando medios basales de glucólisis, cree soluciones madre disolviendo glucosa en 3 mL, oligomicina en 270 μL (100 μM) y 2-desoxiglucosa en 3 mL. Cree una solución de oligomicina de trabajo de 10 μM.
- Mitocondrial: Utilizando medios basales mitocondriales, cree soluciones madre disolviendo oligomicina en 630 μL (100 μM), cianuro de carbonilo-p-trifluorometoxifenilhidrazona (FCCP) en 720 μL (100 μM) y rotenona/antimicina A en 540 μL (50 μM). Cree soluciones funcionales de oligomicina (0,5-2,5 μM), FCCP (0,125-2,0 μM) y rotenona/antimicina A (0,5 μM).
NOTA: Hemos encontrado que 1,5 μM de oligomicina y 2,0 μM de FCCP producen los mejores resultados.
- Cargue los compuestos de prueba en los puertos utilizando los siguientes volúmenes: puerto A-20 μL, puerto B-22 μL, puerto C-25 μL, puerto D-27 μL. Opcional: Cargue el fármaco o compuesto de elección en el puerto A y pruebe los compuestos en los puertos B, C y D para evaluar los efectos agudos sobre la glucólisis o la respiración mitocondrial. Si no está usando un medicamento o compuesto adicional, deje vacío el puerto D.
- Ejecución del ensayo
- Abra el software y seleccione Prueba de esfuerzo mitocondrial.
NOTA: Este programa también se puede utilizar para la prueba de esfuerzo de glucólisis, ya que se mide la tasa de acidificación extracelular (ECAR). - Seleccione los pozos que se utilizarán. Para restar el fondo, asegúrese de que al menos 1 pozo no tenga celdas.
- Ejecute el programa. Cargue la placa de fundente sin la tapa para que la placa esté calibrada (~20 min).
- Después de calibrar la placa, el software dará un mensaje para cargar la placa de celda. Saque la placa de celdas de la incubadora, retire la parte inferior de la placa de flujo y coloque la placa de celdas en el soporte. Presione ejecutar. El ensayo tardará ~2,5 h en completarse.
- Analice los resultados utilizando el software de flujo metabólico7 u otro software analítico de su elección.
- Abra el software y seleccione Prueba de esfuerzo mitocondrial.
Resultados
El número típico de células obtenido de los diferentes tejidos depende del tamaño, la edad y el sexo del animal. Para un ratón macho adulto (es decir, 16 semanas de edad, ~30 g), el bazo puede producir 3,0-4,0 × 106 macrófagos, mientras que la médula ósea (dos tibias y dos fémures) suele producir 1,0-1,5 × 106 monocitos (Figura 2A). El corazón infartado también suele producir números altos, dependiendo del día posterior al infarto de miocardio 4,5,6. En el día 3, el rendimiento suele ser de ~1,5 × 106 células/corazón. El corazón sano suele tener muy pocos macrófagos (0,1-0,2 × 105/corazón)6; Por lo tanto, si se utilizan macrófagos del corazón sano (no infartado) como control, puede ser necesario agrupar varios corazones. La Figura 2B ilustra gráficos representativos de citometría de flujo a partir de macrófagos o monocitos extraídos, que muestran poblaciones que son altamente positivas para CD11b y negativas para Ly6G. Los macrófagos cardíacos y esplénicos muestran heterogeneidad para el marcador de monocitos Ly6C, mientras que los monocitos de médula ósea son altamente positivos para Ly6C. En la Figura S1, la Figura Suplementaria S2 y la Figura Suplementaria S3 se muestran gráficas representativas de citometría de flujo para neutrófilos clasificados (corazón y bazo) y células no clasificadas del corazón, el bazo y la médula ósea infartados (es decir, tejido completo).
Los resultados del análisis de flujo extracelular se representan como cambios en el ECAR (mPh/min) y la tasa de consumo de oxígeno (OCR, pmol O2/min). Por lo general, los resultados se presentan en un gráfico de líneas con ECAR u OCR en el eje Y y tiempo en el eje X (Figura 3). Las medidas específicas se muestran como gráficos de barras.
A partir de los datos brutos, se pueden calcular varios parámetros metabólicos. También se puede calcular la relación OCR/ECAR de cada pocillo para dar una idea de la dependencia de la glucólisis frente a la respiración mitocondrial, que puede cambiar en diferentes condiciones4. Por ejemplo, ayunamos ratones (machos adultos C57BL/6J) durante la noche para evaluar los cambios en el metabolismo de los macrófagos. Un fenotipo en ayunas fue confirmado por la disminución de los niveles de glucosa en sangre y el aumento de las cetonas en sangre (Figura suplementaria S4), lo que disminuyó los leucocitos circulantes y los neutrófilos (Hemavet 950FS Auto Blood Analyzer; Figura suplementaria S5). Aislamos monocitos de médula ósea y macrófagos esplénicos de ratones alimentados frente a ratones en ayunas y evaluamos los cambios metabólicos mediante análisis de flujo extracelular (Figura 4). En los monocitos de médula ósea, el ayuno disminuyó la glucólisis y aumentó la relación OCR/ECAR tanto en la prueba de esfuerzo mitocondrial como en la prueba de esfuerzo de glucólisis (Figura 4A). En los macrófagos del bazo, el ayuno no afectó significativamente a la glucólisis, pero aumentó la capacidad ociosa y la respiración ligada al ATP (Figura 4B). La figura 4C muestra un ejemplo de flujo metabólico en macrófagos aislados del corazón infartado 3 días después de la cirugía.
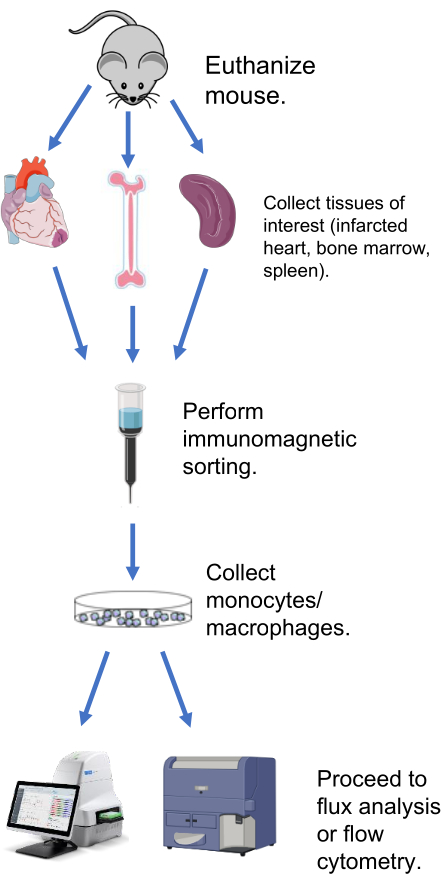
Figura 1: Esquema representativo del análisis de flujo metabólico en macrófagos/monocitos extraídos. Haga clic aquí para ver una versión más grande de esta figura.
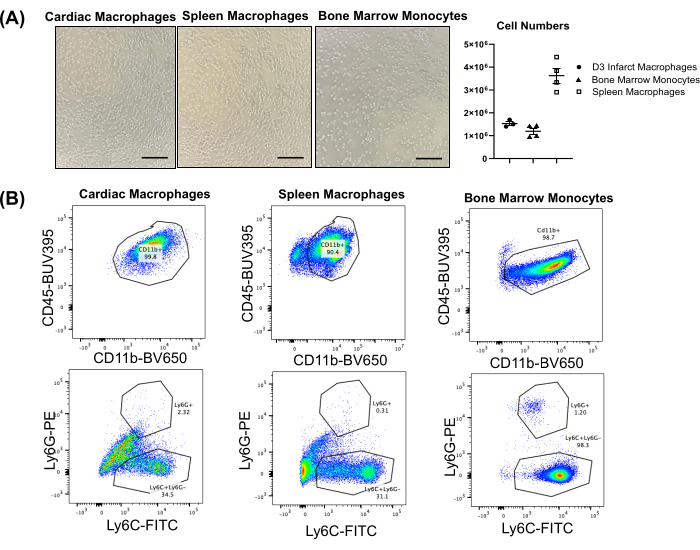
Figura 2: Resultados representativos de macrófagos cardíacos y esplénicos y monocitos de médula ósea aislados de ratones. (A) Imágenes representativas de macrófagos cardíacos y esplénicos aislados, y monocitos de médula ósea (4x); Promedio de números de celdas por ratón. Barra de escala = 1 mm. (B) Gráficos representativos de citometría de flujo de macrófagos cardíacos (infarto de miocardio día 3) y bazo y monocitos de médula ósea. CD45 se utilizó como marcador panleucocitario y CD11b como marcador de células mieloides. Haga clic aquí para ver una versión más grande de esta figura.
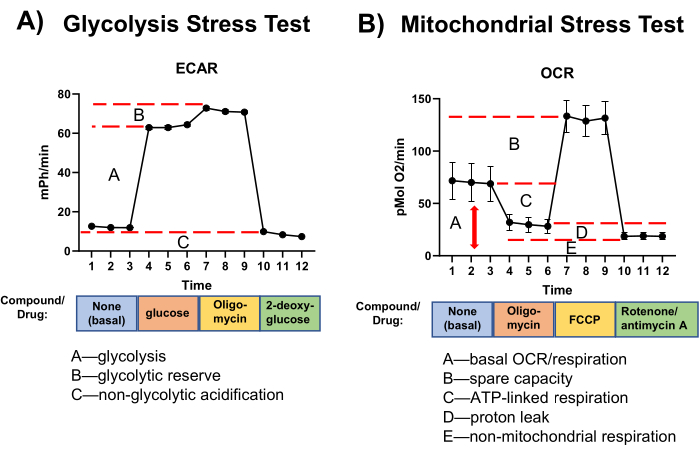
Figura 3: Resultados representativos de las pruebas. (A) Glucólisis y (B) pruebas de esfuerzo mitocondrial. N = 3 mediciones independientes (macrófagos esplénicos). Media ± SEM. Abreviaturas: ECAR = tasa de acidificación extracelular; OCR = tasa de consumo de oxígeno; FCCP = cianuro de carbonilo-p-trifluorometoxifenilhidrazona. Haga clic aquí para ver una versión más grande de esta figura.
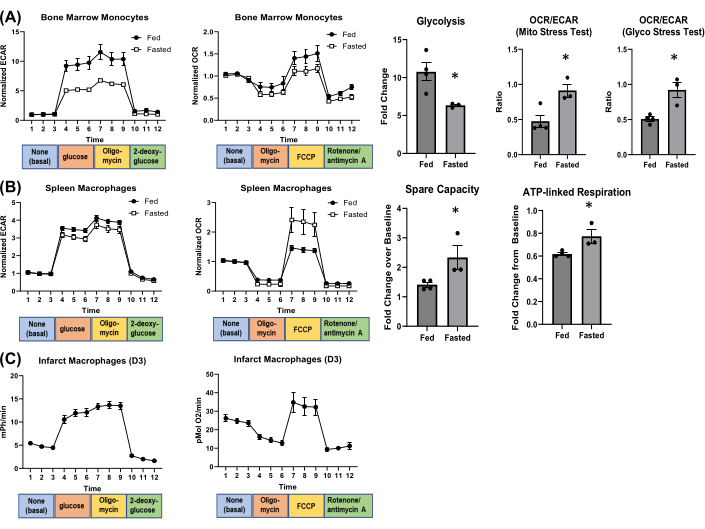
Figura 4: Impacto del ayuno nocturno en el metabolismo celular. (A) Metabolismo de monocitos de médula ósea y (B) macrófagos del bazo. (C) Gráficos representativos de flujo extracelular de macrófagos cardíacos 3 días después del infarto de miocardio. N = 3-4 cada grupo. Abreviatura: FCCP = cianuro de carbonilo-p-trifluorometoxifenilhidrazona. Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1: Gráficos representativos de citometría de flujo y niveles de glucosa y cetonas en sangre de ratones alimentados y en ayunas. Haga clic aquí para descargar este archivo.
Discusión
Nuestro método detalla la extracción rápida de macrófagos de la médula ósea, el bazo y el corazón infartado, que luego se pueden utilizar para realizar análisis posteriores, como el análisis de flujo metabólico extracelular. La combinación de estos dos métodos es una herramienta poderosa que puede cuantificar los cambios metabólicos en los macrófagos bajo diferentes estados de enfermedad o lesión, o estados metabólicos como el ejercicio. Si bien nuestro método se centró en la médula ósea y los macrófagos esplénicos, se pueden utilizar otros reservorios de macrófagos, como el compartimento peritoneal8. Aunque no somos los primeros en utilizar este método, esperamos que este artículo aumente la exposición y mejore la estandarización en todos los laboratorios.
Si bien los datos obtenidos de estos métodos brindan información invaluable sobre el estado metabólico de los diferentes compartimentos de macrófagos, se recomienda encarecidamente utilizar otros métodos para complementar los datos de flujo metabólico para obtener una imagen más completa del metabolismo. Por ejemplo, la combinación de los datos de flujo metabólico con la metabolómica (es decir, la cuantificación de metabolitos intracelulares) y la expresión de genes/proteínas y/o la actividad de las enzimas metabólicas se utiliza a menudo para crear una evaluación completa de los estados metabólicos de los macrófagos 5,9. En muchos casos, las células del mismo animal se pueden utilizar para diferentes ensayos.
En nuestra experiencia, la optimización del protocolo puede implicar la resolución de problemas en varios pasos diferentes. Una de las cosas más importantes es trabajar rápidamente y mantener las células frías, lo que aumentará el rendimiento y la viabilidad de las células. Determinar el número óptimo de células para el flujo extracelular es otro punto clave, ya que muy pocas células no darán una señal detectable, mientras que demasiadas células agotarán los nutrientes en el medio y, por lo tanto, no mostrarán una respuesta a los compuestos inyectados. En el caso de los macrófagos, hemos descubierto que 2,0 × 105 células del corazón del IM y 3,0 × 105 en una placa de 96 pocillos proporcionan los resultados más fiables y reproducibles. Sin embargo, esto puede variar de un laboratorio a otro. Se debe tener especial cuidado para garantizar que se utilicen números de células iguales entre muestras y grupos. Diferentes números de células tienen diferentes respuestas a los fármacos utilizados en el ensayo y pueden introducir una variabilidad no deseada.
Las concentraciones óptimas de fármacos inyectables incluidos en el ensayo (oligomicina, FCCP) también deben optimizarse antes de realizar los experimentos. Por ejemplo, hemos encontrado que 1,5 μM de oligomicina y 2,0 μM de FCCP producen las respuestas más robustas. Otro error común es no permitir que las células se adhieran a la placa de cultivo después de la extracción, lo que resulta en la pérdida de células al cambiar al medio de flujo extracelular. Sugerimos al menos 1 h, y hasta 2 h, para permitir que las células se adhieran.
El pipeteo demasiado agresivo también puede provocar la pérdida de células; Se recomienda pipetear con mucho cuidado y revisar las células con frecuencia bajo un microscopio. Un último punto es trabajar rápidamente al preparar la placa de flujo, particularmente cuando se realiza la prueba de esfuerzo de glucólisis. Dado que estas células están privadas de glucosa antes del ensayo, los tiempos de incubación más largos (más de 1 h en el medio basal) pueden alterar la respuesta inicial a la glucosa. Sugerimos preparar inmediatamente la placa de fundente después de reemplazar el medio normal con el medio basal (~ 30 min) y luego calibrar la placa (lo que lleva ~ 20 min). Siempre se debe tener en cuenta la variabilidad del interensayo. Al hacer comparaciones directas entre grupos, siempre se debe hacer un esfuerzo para realizar todos los grupos dentro de la misma placa o experimento.
Si bien describimos dos ensayos estándar que se usan con frecuencia (pruebas de estrés por glucólisis y pruebas de estrés mitocondrial), debe tenerse en cuenta que hay varios otros ensayos estandarizados que se pueden usar para evaluar otras vías metabólicas, como la prueba de flexión de combustible mitocondrial10, la oxidación de ácidos grasos/palmitato11 y el ensayo de tasa de ATP12. Nuevos estudios han demostrado la eficacia del desacoplador BAM15, que se suministra en el kit de perfil metabólico de células T. BAM15 parece ser un desacoplador más fiable que el FCCP con menos efectos citotóxicos13. Estudios futuros deberían explorar el potencial de este desacoplador en la evaluación metabólica de los macrófagos.
Este método tiene algunas limitaciones. La primera es que debido a la cantidad de pasos, puede ser difícil que una persona lo realice de manera oportuna. En particular, cuando se utiliza un mayor número de muestras (hasta 8), se recomienda que dos personas trabajen juntas para mejorar la calidad de los resultados. Hemos descubierto que es difícil procesar más de ocho muestras en un día, incluso con dos personas. Otra limitación es que, dado que el ensayo se realiza ex vivo, siempre existe la posibilidad de que el procedimiento de extracción provoque cambios en el fenotipo celular6. Si bien no existe una forma obvia de eliminar esta limitación, se han utilizado técnicas de imagen in vivo , como la resonancia magnética hiperpolarizada, para visualizar la producción de lactato de macrófagos después de MI14 y, con suerte, continuarán evolucionando como complemento o reemplazo del método ex vivo que describimos. Una limitación del método de flujo extracelular es que, si bien puede capturar cambios entre la glucólisis y OXPHOS, no refleja completamente los cambios en la tasa de producción de ATP dentro de estas vías15. Además, los cambios en la acidificación del medio (ECAR) no siempre pueden reflejar la producción de ácido láctico por glucólisis, sino que también pueden verse influenciados por la generación de CO2 por el ciclo del TCA, que se convierte en bicarbonato15. Por lo tanto, puede ser ventajoso para los usuarios calcular la tasa de producción de ATP a partir de la glucólisis y OXPHOS, lo que puede evaluar las contribuciones de estas vías a la producción general de ATP.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Nos gustaría agradecer la financiación que apoyó este trabajo: NIH/NHBLI 166737, NIH R00 HL146888, NIH U54HL169191, NIH/NIGMS P20GM104357 y NIH/NIGMS P30GM149404 por este trabajo.
Materiales
| Name | Company | Catalog Number | Comments |
| Anti-CD11b Microbeads UltraPure, mouse | Miltenyi Biotec | 130-126-725 | |
| Anti-Ly6G Microbeads UltraPure, mouse | Miltenyi Biotec | 130-120-337 | |
| Collagenase type II | Worthington | NC9522060 | |
| Dnase type I | MillPore Sigma | 11284932001 | |
| GentleMACS Octo Dissociator | Miltenyi Biotec | 130-096-427 | |
| GentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | MACS cell dissociation tubes |
| Hank balanced salt solution | Fisher Scientific | 14-025-076 | |
| LS Magnetic Columns | Miltenyi Biotec | 130-042-401 | |
| MACS MultiStand | Miltenyi Biotec | 130-042-303 | |
| MS Magnetic Columns | Miltenyi Biotec | 130-042-201 | |
| Monocyte Isolation Kit Bone Marrow, mouse | Miltenyi Biotec | 130-100-629 | includes 1 mL of monocyte biotin-antibody cocktail, 2 mL of anti-biotin microbeads, 1 mL of FcR blocking reagent |
| OctoMACS Separator | Miltenyi Biotec | 130-042-108 | |
| Pre-separation filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-091-051 | |
| Red Blood Cell Lysis Solution (10x) | Miltenyi Biotec | 130-094-183 | |
| Seahorse XFe96 Analyzer | Agilent | ||
| Seahorse XFe96 FluxPak | Agilent | 103792-100 | 18 Pro sensor cartridges, 18 Pro Cell Cutlure Microplates, 1 bottle of Seahorse XF Calibrant Solution |
| Seahorse XF Glycolysis Stress Test Kit | Agilent | 103020-100 | 6 single-use pouches, each with glucose, oligomycin, and 2-deoxy-D-glucose |
| Seahorse XF Mitochondrial Stress Test Kit | Agilent | 103015-100 | 6 single-use pouches, each with oligomycin, FCCP, and rotenone/antimycin A |
| Seahorse XF RPMI Medium, pH 7.4, 500 mL | Agilent | 103576-100 | no phenol red, bicarbonate, glucose, pyruvate, or glutamine |
Referencias
- Ma, Y., Mouton, A. J., Lindsey, M. L. Cardiac macrophage biology in the steady-state heart, the aging heart, and following myocardial infarction. Transl Res. 191, 15-28 (2018).
- Mouton, A. J., Li, X., Hall, M. E., Hall, J. E. Obesity, hypertension, and cardiac dysfunction: Novel roles of immunometabolism in macrophage activation and inflammation. Circ Res. 126 (6), 789-806 (2020).
- Mouton, A. J., et al. Dimethyl fumarate preserves left ventricular infarct integrity following myocardial infarction via modulation of cardiac macrophage and fibroblast oxidative metabolism. J Mol Cell Cardiol. 158, 38-48 (2021).
- Mouton, A. J., et al. Temporal changes in glucose metabolism reflect polarization in resident and monocyte-derived macrophages after myocardial infarction. Front Cardiovasc Med. 10, 1136252 (2023).
- Mouton, A. J., et al. Glutamine metabolism improves left ventricular function but not macrophage-mediated inflammation following myocardial infarction. Am J Physiol Cell Physiol. 327 (3), C571-C586 (2024).
- Mouton, A. J., et al. Mapping macrophage polarization over the myocardial infarction time continuum. Basic Res Cardiol. 113 (4), 26 (2018).
- . XF software. Agilent Seahorse Analytics Available from: https://www.agilent.com/en/product/cell-analysis/real-time-cell-metabolic-analysis/xf-software/agilent-seahorse-analytics-787485 (2025)
- Matsuura, Y., et al. Diabetes suppresses glucose uptake and glycolysis in macrophages. Circ Res. 130 (5), 779-781 (2022).
- Alexander, R. K., et al. Bmal1 integrates mitochondrial metabolism and macrophage activation. Elife. 9, e54090 (2020).
- Wan, Y., et al. miR-34a regulates macrophage-associated inflammation and angiogenesis in alcohol-induced liver injury. Hepatol Commun. 7 (4), e0089 (2023).
- Nomura, M., et al. Fatty acid oxidation in macrophage polarization. Nat Immunol. 17 (3), 216-217 (2016).
- Li, X., et al. Glycolytic reprogramming in macrophages and MSCs during inflammation. Front Immunol. 14, 1199751 (2023).
- Desousa, B. R., et al. Calculation of ATP production rates using the Seahorse XF Analyzer. EMBO Rep. 24 (10), e56380 (2023).
- Lewis, A. J. M., et al. Noninvasive immunometabolic cardiac inflammation imaging using hyperpolarized magnetic resonance. Circ Res. 122 (8), 1084-1093 (2018).
- Walls, J., Romero, M. Assessing T cell bioenergetic poise and spare respiratory capacity using extracellular flux analysis. Agilent Technologies application note. , 5994-4494 (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados