Method Article
シングルセルマイクロリットル液滴培養オミクスシステムを使用した自動およびハイスループット微生物モノクローナル培養およびピッキング
要約
このプロトコールでは、シングルセルマイクロリットル液滴培養オミクスシステム(MISS細胞)を使用して、微生物モノクローナルの単離、培養、ピッキングを行う方法について説明します。MISS細胞は、液滴マイクロ流体技術に基づく統合ワークフローを実現し、優れた液滴単分散性、高並行培養、ハイスループットのバイオマス検出を提供します。
要約
純粋な細菌培養は、微生物培養の研究に不可欠です。固体プレート、ウェルプレート、マイクロリアクターをベースとした従来の方法は、煩雑な手順や低スループットによって妨げられ、微生物培養研究の急速な進歩を妨げています。これらの課題を解決するために、私たちは、液滴マイクロ流体技術を活用した微生物モノクローナルの単離、培養、スクリーニングに自動化されたハイスループットプラットフォームであるSingle-cell Microliter-droplet Culture Omics System(MISS cell)の開発に成功しました。このシステムは、多数の単一細胞液滴を生成し、モノクローナルコロニーを短時間で培養、スクリーニング、および収集できるため、微生物の分離からピッキングまでの統合プロセスが容易になります。このプロトコールでは、ヒト腸内細菌叢の単離と培養を例に、その応用を実証し、固体板培養法を用いて微生物の単離効率、モノクローナル培養性能、スクリーニングスループットを比較しました。実験ワークフローはシンプルで、試薬の消費量は非常に少なかった。ソリッドプレート培養法と比較して、MISS細胞はより多様な腸内細菌叢種を培養することができ、微生物培養研究に大きな可能性と価値を提供します。
概要
微生物培養学は、食品産業における有益な微生物の研究、環境微生物の多様性、新しい抗菌化合物のスクリーニング、および疾患に関連するヒトマイクロバイオームの研究に幅広い用途があります1,2,3,4。従来の方法は、主に固体プレート、ウェルプレート、またはマイクロリアクターに基づいてモノクローナルコロニーを取得および選択するため、操作は簡単ですが、複数のステップのためにスループットが低くなります。この制限は、微生物の突然変異誘発スクリーニング、微生物培養学研究、高生産性コロニー選択などのアプリケーションを妨げており、これらはすべて広範なモノクローナルスクリーニングを必要とします。
最近、さまざまなシングルセル検出および分注装置が、微生物サンプルの処理速度を大幅に向上させると同時に、手作業による取り扱いによる労力とエラーを最小限に抑えるように設計されています5。しかし、これらの機器は通常、従来の方法内の特定のステップにのみ対応しており、多くの場合、大規模な機器の統合が必要で、かなりのスペースを占有し、高いコストが発生します。そのため、上記の欠点を補うために、低コストで普遍的に適用可能な微生物培養およびスクリーニングプラットフォームを開発することが急務でした。
これまでの研究では、シングルセルマイクロリットル液滴培養オミクスシステム(MISS細胞、以下「オミクスシステム」)6と呼ばれる自動化されたハイスループットスクリーニングプラットフォームの開発に成功しました。このプラットフォームは、液滴マイクロ流体技術を利用しており、微生物の分離、培養、ピッキングの自動化と統合を実現することが期待されています7,8,9,10。オミクスシステムは、サンプリングモジュール、マイクロ流体チップ、液滴検出および収集システムなど、いくつかの主要モジュールで構成されており、微生物学研究における効率的なシングルセルの分離、培養、モノクローナルスクリーニング、および収集を可能にします。私たちはすでにオミクスシステムを利用して、Corynebacterium glutamicum6のハイスループット突然変異誘発スクリーニングを達成しています。
Omicsシステムの自動化とハイスループットスクリーニング機能により、微生物培養への応用により、大量の微生物データを迅速に取得することが期待されます。このプロトコルでは、MISS細胞の詳細な操作手順を紹介し、例としてヒト腸内細菌叢の単離と培養を行い、微生物の単一細胞の単離、培養、モノクローナル検出、およびスクリーニングのプロセスを実証しました。オミクスシステムの操作は簡単で、研究者はソフトウェアの指示に従うだけで、マイクロチューブと液滴生成マイクロ流体チップの順次取り付け、パラメータ設定、サンプル調製を行うことができます。
ソフトウェア操作インターフェースでは、オミクスシステムは、分離、培養、スクリーニングの3つの主要な機能に分かれています。研究者は、実験に応じて異なるステージを選択できます。さらに、液滴スクリーニング段階では、研究者は蛍光シグナルと光学濃度の2つの検出モードから選択できます。このソフトウェアは、飛沫スクリーニングプロセスをリアルタイムで視覚化します。最後に、研究者は、特定の実験要求に基づいて、培養条件、検出波長、収集ウェルの数などのパラメーターを柔軟に設定でき、いつでも装置を一時停止して他の操作を行うことができます。MISS細胞は、微生物にやさしいハイスループットのモノクローナルスクリーニングプラットフォームであり、操作が簡単で試薬の消費が最小限に抑えられています。
プロトコル
すべての研究手順は、関連するすべての倫理規制に準拠しています。手続きは、清華大学の科学技術倫理委員会によって承認されました。ヒトの腸内細菌叢を研究するために、重大な病状のない健康な成人から便サンプルを採取し、書面によるインフォームドコンセントを提供しました。
1.機器のインストール
- Omics システム装置は、清潔な環境または無菌環境 (無菌室や嫌気性ベンチなど) に置きます。機器は精密機器であり、施設に配置するときは、次の点を考慮してください。
- 機器を常圧および常温に維持します。
- 機器を強い電界、磁場、および熱放射源から遠ざけてください。
- 機器の設置エリアが2,500 mm(D)x 1,500 mm(W)x 2,000 mm(H)の寸法を超えていることを確認してください。
- 機器の環境湿度を60%未満に維持します。
2. 事前準備
- オミクスシステム、コンピュータ、オミックスシステムオペレーティングソフトウェアの電源を順次オンにします。
- MISS細胞マイクロチューブと液滴生成マイクロ流体チップの取り付け:
- 液滴発生および培養チャンバー(図1A)のドアを開き、マイクロチューブおよび液滴生成マイクロ流体チップの保護カバーを垂直に取り外します。使い捨てシリンジを使用して、液滴培養チャンバー内の加湿器に10mLの滅菌蒸留水を追加し(図1C)、マイクロチューブと液滴生成マイクロ流体チップの保護カバーを再度取り付けます。
- マイクロチューブと液滴生成マイクロ流体チップの滅菌パッケージを開き、培養チャンバーの真上に垂直に置きます(図1C)。
- ソフトウェアインタフェースで、[ Installation](インストール )をクリックします(図2A)。この時点で、ポップアップウィンドウが表示され、「 マイクロチューブと液滴生成マイクロ流体チップの交換を確認しますか?」 というプロンプトが表示されます。 「はい 」をクリックして、インストールを開始します。
- 気泡除去剤を取り出し、液滴発生培養室内の気泡除去剤配置に逆さまに固定します。気泡除去剤の液滴入口チューブと液滴出口チューブを押さないように注意してください(図1E)。
- 気泡除去剤の液滴出口チューブをclに取り付けますampその下のバルブで、液滴検出収集チャンバーに向けられた穴を通過させます(図1B)。
- 飛沫検出収集チャンバーのドアを開き、飛沫出口チューブにすでに接続されている検出チューブを検出ソケットに垂直に挿入し、検出チューブが完全に挿入されていることを確認します(図1D)。
注意: 検出チューブを挿入するときは、チューブが曲がらないように垂直に挿入してください。 - 検出チューブを固定しているネジを時計回りに締めます。検出チューブが完全に挿入され、固定されていることを確認したら、飛沫検出収集チャンバーのドアを閉めます。
- マイクロチューブと液滴発生マイクロ流体チップから、10本のシリコンチューブがあり、それぞれに番号(L01-L10)がラベルされています。ラベルが付けられた各チューブを対応する番号のclに接続しますamp バルブ(01-10)(図1C)。
- マイクロチューブおよび液滴生成マイクロ流体チップからのクイックコネクタを、C1からO1、C2からO2、C4からO4、CFからOFに、オミクスシステムの対応するポートに接続します。
注:マイクロチューブと液滴生成マイクロ流体チップの取り付けが完了しました。C3 を O3 に接続する必要はありません。 - マイクロチューブと液滴生成マイクロ流体チップの取り付けが完了すると、ポップアップウィンドウが表示され、 液滴チューブのクランプバルブが開きます。マイクロチューブと液滴生成マイクロ流体チップの取り付けが完了したら、[ OK ]をクリックします。マイクロチューブからのすべてのシリコンチューブと液滴発生マイクロ流体チップが対応するクランプバルブに取り付けられていることを確認したら、[ OK]をクリックします。
- 装置の初期化
- 初期化を実行する前に、 設定 インターフェース(図2B)をクリックして、関連するパラメータを設定します。 検出モード(ODベースまたは蛍光ベースの検出;ここではOD)、インキュベーション温度(37°C)と時間(30日= 720時間)、攪拌機の速度(20 rpm)、OD検出の波長(600 nm)、蛍光検出の励起波長と発光波長。
注:このプロトコルでヒト腸内細菌叢の分離と培養に使用されるパラメータは、括弧内に記載されています。パラメータを設定するときは、栽培温度を5°Cから50°Cの間で設定する必要があります。 検出モードを選択する際、液滴検出モジュールのファイバーが同じでない場合は、光ファイバーを交換する必要があります(手順2.3.2を参照)。パラメータの設定時には、オイル相の基準値(基本スペクトル)がソフトウェアによって自動的に識別されるため、手動での調整が不要です。 - 検出された光ファイバの交換
- 検出されたファイバーをファイバーホルダーから取り外し(反時計回りに緩めます)、液滴モジュールのファイバー固定ネジを緩めます(図1D)。
- 光ファイバーを使用しない場合は、モジュールから取り外し、ファイバーホルダーに挿入して締めてください。検出されたファイバーを検出ポートに挿入し、モジュールのファイバー固定ネジを締めます。光ファイバーの交換が完了しました。
- ホームインターフェースに切り替えて[初期化]をクリックすると、オミクスシステムは、インジェクションポンプ、温度設定、廃液排出試験、スクリーニングモジュール、液滴検出モジュールなどのコンポーネントのセルフチェックを実行できます。
- 初期化時には、廃液ポートに75%アルコール1mLを注入し、液が正常に流出するかを観察し、液滴検出モジュールからの廃液排出試験を行います。
- スクリーニングモジュールテストでは、プレート配置に96ウェルプレートを置き、プレートの動きが正常かどうかを観察します。
- 初期化を実行する前に、 設定 インターフェース(図2B)をクリックして、関連するパラメータを設定します。 検出モード(ODベースまたは蛍光ベースの検出;ここではOD)、インキュベーション温度(37°C)と時間(30日= 720時間)、攪拌機の速度(20 rpm)、OD検出の波長(600 nm)、蛍光検出の励起波長と発光波長。
3.液滴の生成
- ヒト腸内細菌叢サンプルの収集と処理
- チャンバーポットと便容器を準備し、手を洗い、手袋を着用して新鮮な便のサンプルを収集します。
注:便サンプルを採取するときは、尿の汚染をできるだけ避けてください。事前に排尿し、スツールを清潔で乾燥した容器に入れることをお勧めします。 - 適切な量のミッドセグメントスツールを無菌的に収集し、滅菌したクライオバイアル(バイアルあたり約3〜5 g)に密封します。バイアルをすぐに氷の上に置いて、その後の分注とラベリングを行います。
注:便サンプルが大きい場合、またはすぐに収集できない場合は、最大で2時間以内に収集する必要があります。 - 嫌気性ベンチで、滅菌綿棒または便サンプリングツールを使用して、ミッドセグメントのサンプルを収集します。
注:便の表層には、脱落した腸粘膜細胞が含まれており、外部汚染が発生しやすいです。空気にさらされると、一部の微生物DNAが分解し始めます。 - 収集した便サンプルを2mLの滅菌マイクロ遠心チューブまたは滅菌クライオバイアルに移し、各チューブには0.5〜2.0gの便が含まれています。サンプルごとに凍結用のアリコートを2つ準備します。
- 新鮮な便サンプルを滅菌生理食塩水に再懸濁し、便100 mgごとに1 mLの溶液で希釈します。.大きな粒子が見えなくなるまで、便を完全に混ぜます。
- 10分間自然沈降した後、細孔径200メッシュ(0.075 mm)、400メッシュ(0.038 mm)、800メッシュ(0.018 mm)の滅菌メッシュフィルターで上清を順次ろ過し、未消化の食品と小さな粒子状物質を除去します。最後に、濾液を滅菌遠心分離チューブに集めます。
- ろ過した糞便懸濁液10μLを採取し、血球計算盤と倒立蛍光顕微鏡を用いて微生物濃度を測定します。
注:糞便サンプル上清を異なるメッシュサイズでろ過した後、いくつかの小さな糞便粒子が残ります。したがって、微生物濃度を決定する際には、顕微鏡で観察された活性粒子が微生物と見なされ、微生物濃度の概算しかできません。 - 糞便懸濁液を1.5 mLの滅菌遠心チューブに移し、日付、微生物濃度、およびサンプル名をラベル付けします。一部はその後の実験用に取っておきます。残りは将来使用するために4°Cで保存してください。
注:サンプル情報(サンプル名、収集時間)を迅速に記録して、サンプルが同時に収集されるようにします(哺乳類の腸内微生物の時間的リズムの変化を考慮してください)。サンプルの収集と処理全体は、嫌気性環境で行う必要があります。
- チャンバーポットと便容器を準備し、手を洗い、手袋を着用して新鮮な便のサンプルを収集します。
- 最初の糞便懸濁液の準備
- Brain Heart Broth(BHI)培地をメーカーのプロトコルに従って調製し、121°Cで15分間オートクレーブして滅菌します。
- ステップ 3.1.8 の糞便懸濁液を BHI 培地で段階希釈して、~50 細胞/mL の濃度を達成します。
注:サンプルボトルを充填するには、少なくとも40 mLの糞便懸濁液を準備します。 - 小さな磁気攪拌バーが底にあることを確認し、希釈した糞便懸濁液をサンプルボトルにサンプル添加位置まで注ぎます。キャップをねじ込んで締めます。次に、クイックコネクタAをクイックコネクタBに挿入して、サンプルのロードプロセスを完了します(図3A)。
- サンプルボトルを所定の位置に置き、クイックコネクターAとBをサンプルボトルから分離します。サンプルボトルのクイックコネクタAをオミックスシステムのO3ポートに、マイクロチューブと液滴発生マイクロ流体チップのC3コネクタをクイックコネクタBに接続し、液滴生成培養チャンバーのドアを閉めます(図3B)。
- 液滴生成
- ソフトウェアの ホーム インターフェースで生成する液滴チューブの必要な数を選択します(図2A)。
注:各ランでは最大10個の液滴チューブを生成でき、各チューブは約5,000個の液滴を生成します。 - ソフトウェアのホームインターフェースで[Produce]をクリックして、シングルセルの液滴生成を開始します。
注意: 廃液ポンプの排出が機能しているかどうかを確認します。液滴生成中、各液滴の容量は2.0μLです。液滴生成の説明については、ディスカッションのセクションを参照してください。 - ブザーアラームが液滴の生成が終了したことを示すのを待ちます。clを閉じますamp C3コネクタ(図1E)のamp サンプルボトルを取り外します。
- ソフトウェアの ホーム インターフェースで生成する液滴チューブの必要な数を選択します(図2A)。
4.液滴栽培
- ソフトウェアの ホーム インターフェースで液滴生成時と同じ液滴チューブ番号を選択し、[ 培養]をクリックして、培養時間と温度を確認して、プロセスを開始します。 ホーム インターフェースのプログレスバーを監視して、栽培の進行状況と残り時間を表示します。
- ブザーアラームが液滴栽培が終了したことを示すのを待ちます。栽培時間を延長する必要がある場合は、 設定 インターフェースで直接時間を調整してください。
5.飛沫スクリーニング
- オミクスシステムの UV ボタンを押して紫外線(UV)ライトをオンにし(図1A)、液滴検出および収集チャンバーに30分間照射してから、UVライトをオフにします。
注意: UVライトをオンにする前に、液滴検出および収集チャンバーのドアが閉じていることを確認してください。 - スーパークリーンベンチで、液滴の収集に使用した96ウェルプレートをすべて開き、蓋なしで互いに積み重ね、下から上に順番に番号を付けます。トップウェルプレートが蓋で覆われていることを確認してください。
注:各ランは最大10枚の96ウェルプレートを収容でき、プレートの数は液滴の総数によって異なります。 - 液滴検出収集チャンバーのドアを開け、ウェルプレートを所定の位置に置き(図1D)、上部ウェルプレートから蓋を取り出し、チャンバーのドアを閉めます。
- オミクスシステムのUVライトを30分間オンにして、二次滅菌を行います。
- 気泡除去剤の取り付け
- 気泡除去器を配置位置から取り外し、キャップのネジを緩め、蝶の形をしたネジをキャップから取り外します(図3C)。
- 気泡除去剤に気泡除去油200mLを流し込み、オミックス装置上の気泡除去剤のキャップでボトルをしっかりとねじ込み、気泡除去剤の配置に逆さまに固定します。気泡除去剤の取り付けが完了しました。
注意: 気泡除去剤を配置に固定するときは、オイルが漏れないように注意してください。漏れが発生した場合は、蓋を締めてください。
- ホームインターフェースでソーティング用の液滴チューブを選択し、[ソーティング]をクリックして、収集するウェルプレートの数を入力して、プロセスを開始します。液滴スクリーニングが開始されたら、液滴の光学密度(OD)または蛍光値のリアルタイム測定値を示すプロセス表示エリアを観察します。
- 約20〜30個の液滴を分析して、OD値を確認します。たとえば、大多数の OD 値が ~0.2 (空の液滴の OD 値に相当) であることが判明した場合は、ポアソン分布に基づいて、 OD の下限しきい値 を 0.5 に、 OD 上限しきい値 を 4.0 に設定します。この範囲内の液滴は、自動的に96ウェルプレートに収集されます(図4A)。
注:ランベルトベールの法則によれば、空の液滴のOD値は、液滴内の培地組成によって決まります。通常、ODの下限しきい値は、空の液滴と微生物を含む液滴を明確に区別するために、空の液滴のOD値よりも0.2〜0.3単位高く設定されます。 - ブザーアラームが液滴のスクリーニングと収集が終了したことを示すのを待ちます。液滴検出収集チャンバーのドアを開け、ウェルプレートの蓋を上部のウェルプレートに置き、すべてのウェルプレートをまとめてチャンバーから取り出して、その後のシーケンシングとバックアップを行います。
6.ヒートマップのデータエクスポートと表示
- [ データのエクスポート ]をクリックして、収集した液滴信号データを保存します(図4A、B)。
- [ヒートマップ]をクリックし、液滴収集データファイルを選択し、ソフトウェアによって表示されたマイクロプレートに収集された液滴のOD値を観察します。これらのOD値をヒートマップとして視覚化し、色の強度がウェル全体のOD分布に対応し、収集されたモノクローナルOD値を明確かつ直感的に表現します(図4A、C)。
7. MISSセルのクリーニング
- 実験が完了したら、クリーニングが必要な液滴チューブを選択し、[ Clean ]をクリックして機器のクリーニングを開始します。
8. 微生物モノクローナルバックアップとシーケンシングサンプル調製
- シーケンシングサンプル調製
- 嫌気性ベンチで、回収した液滴プレートの各ウェルに100μLのBHI培地を加え、ピペッティングでよく混合した後、各ウェルから10μLを取り出し、1本の15mL滅菌チューブに移します。ボルテックスして混合微生物懸濁液を得る。
- 混合微生物懸濁液に5 mLのリン酸緩衝生理食塩水を加え、1,000 × g で10分間遠心分離し、上清を取り除き、微生物ペレットを液体窒素に入れて急速凍結します。シーケンシングサンプル調製が完了しました。
- 16S rDNAのV3およびV4ドメインを標的とする16S rDNAアンプリコンシーケンシング法を使用します。使用した特定のシーケンシングプライマーは、341F:ACTCCTACGGGAGGCAGCAおよび806R:GGACTACHVGGGTWTCTAATです。
- 微生物モノクローナルサンプル凍結保存:
- 液滴プレートの各ウェルから10 μLのサンプルを採取した後(ステップ8.1.1から)、各ウェルに30 μLのグリセロールを加えます。プレートを-80°C未満に置き、微生物株を保存します。
結果
主要な微生物群集を構成するヒトの腸内細菌叢は、腸内に約4×1013 の微生物が宿していると推定されており、その膨大な数と複雑な組成を示しています11。本研究では、腸内細菌叢の単離と培養を目指し、MISS細胞のハイスループット性能を実証するためのコントロールとしてソリッドプレート法を用いた。
まず、同じ糞便懸濁液を使用して、両方の方法のシングルセル単離スループットを比較しました。MISS細胞では、低濃度の微生物を使用し、液滴中の微生物の分布確率をポアソン分布に基づいて計算することができました: P(λ,x) = λx e-λ/x!、 ここでλ は液滴上の平均細胞数であり、微生物濃度と液滴量を掛けることで計算できます。x は、液滴にカプセル化されたセルの数です。ここでは、初期微生物懸濁濃度=0.1(初期微生物濃度は50細胞/mL、液滴量は2.0μL)とし、エンプティ液滴、シングルセル液滴、マルチセル液滴が発生する確率は、それぞれ90.5%(x = 0)、9.1%(x = 1)、0.4%(x ≥ 2)であることを示しています。
オミクスシステムでは、約30,000液滴/hの速度で液滴を作製し、6本のポリテトラフルオロエチレンチューブ(外径1.67mm、内径1.07mm)で30日間培養しました。最終的に、OD検出モードを使用して検出モジュールを通じて液滴をスクリーニングし、96ウェルプレートに細菌を含む液滴を収集し、1,057の標的モノクローナル株を取得しました。対照的に、固体プレート培養法では、固体寒天プレートの濃度は3.0 × 103 細胞/mLで、合計100 mmのシャーレ(各プレートには初期微生物懸濁液100μL)が含まれていました。30日間の栽培後、プレートから536のコロニーが摘み取られました。オミクスシステムでは、ソリッドプレート法に比べて1.97倍多くのモノクローナルクローンが得られました。このことは、マイクロ流体液滴を用いたシングルセルモノクローナル培養が、微生物を効果的に分離し、コロニー間の競合阻害を排除できることを示しました。
次に、すべてのモノクローナル株について16Sシーケンシング解析を行い、前述の2つの方法から得られた種の多様性を比較しました。家族レベルでの種の多様性に関しては、同じ34の家族を両方の方法で強化することができます。具体的には、オミクスシステムは、未分類のBacteroidales、Bacillales Thermoactinomycetaceae、Burkholderiales Comamonadaceae、および未分類のEnterobacteralesの4つのファミリーをさらに濃縮し(図5B)、元の微生物懸濁液中のClostridiales Family_XI、Clostridiales Acidaminococcaceae、Desulfovibrionales Desulfovibrionaceae、およびEnterobacterales Enterobacteriaceaeの低存在量を容易に濃縮しました(図5D)。
属レベルでは、74の微生物属を両方の方法で濃縮することができ、MISS細胞法はさらに13の微生物属を濃縮することができました: Bacillaceae Bacillus、Bacillaceae Oceanobacillus、Bacillaceae Pseudogracilibacillus、Thermoactinomycetaceae Kroppenstedtia、Peptoniphilaceae Phocea、Clostridiaceae Anaerosalibacter、Peptoniphilaceae Ezakiella、Peptoniphilaceae W5053、XI unclassified、Clostridiaceae Clostridioides、Comamonadaceae Pelomonas、および2つの未分類の微生物種 (図5C)。その中でも、元の微生物懸濁液にあまり含まれていなかった Enterococcaceae属Enterococcus 属と Acidaminococcaceae Phascolarctobacterium 属は、オミクスシステムを使用して簡単に濃縮できました(図5E)。予想通り、これら2つの属は それぞれEnterococcaceae と Acidaminococcaceae のファミリーに属しており、ファミリー分析から同じ結果が観察されました。全体として、科および属レベルでは、MISS細胞培養法の種濃縮は、固体プレート培養法と比較して、それぞれ30.6%および37.9%増加しました。これらの結果から、MISS細胞培養法は、元の微生物懸濁液中に低の割合で存在する株や増殖性能が劣る菌株に対して、より良い増殖条件を提供することが示されました。

図 1:MISSセルの構造と必須コンポーネント。 (ある)MISSセルの外観。1. 液滴生成と培養チャンバー、2.液滴検出および収集チャンバー、3.液滴収集チャンバーの照明ボタンとUVボタン。(B)液滴生成および培養チャンバーの内部。液滴生成、液滴インキュベーション、飛沫スクリーニングのための気泡除去をこのチャンバーで行います。4.液滴培養チャンバー、5.マイクロチューブおよび液滴生成マイクロ流体チップからのシリコーンチューブをクランプするためのクランプバルブ。クランプバルブには、1から10、左から右、6の順に番号が付けられています。気泡除去剤の配置、7.液滴生成およびスクリーニング用ポート(O1-O4):油相、サンプル相、気相は、これらのポートを介してMISSセルに接続されています。8.廃棄物ポート(OF)、9。気泡除去剤の液滴出口チューブをクランプするためのクランプバルブ、10。飛沫検出収集室に通じる開口部、11.サンプルボトルの配置;配置の下にはマグネチックスターラーがあり、サンプルの攪拌速度を制御するために使用できます。(C)液滴培養室の俯瞰図。チャンバー内には、加湿器用の水入口があります。シリンジを使用して滅菌蒸留水10mLを追加し、保護カバーとマイクロチューブおよび液滴発生マイクロ流体チップを取り付け、右図に示すように、マイクロチューブからのシリコーンチューブを対応するクランプバルブにクランプします。12.液滴培養チャンバー内の加湿器用の水入口ポート、13。マイクロチューブと液滴発生マイクロ流体チップ。(D)液滴検出および収集チャンバーの内部。左の画像は、3つのウェルプレートの配置と、配置間でウェルプレートを移動するハンドリングロボットアームを示しています。右側の画像は、液滴検出および収集モジュールの拡大ビューを示しています (左側の画像の赤い四角形)。96ウェルプレートの配置 14.前に、15。中、および16。液滴収集後。17. 96ウェルプレートハンドリングロボットアーム。液滴の検出と収集中、ロボットアームは1つの96ウェルプレートを液滴検出モジュール近くのウェルプレート位置に移動します。液滴の収集が完了したら、ウェルプレートを別の場所に移動し、プロセスが完了するまで同じ操作を続けます。18.液滴検出および収集モジュール。19.検出ファイバー用のファイバーホルダー。検出ファイバーには2種類(ODベースと蛍光ベースの検出)があります。一方の検出ファイバーを使用すると、もう一方の検出ファイバーがファイバーホルダーに挿入されます。20.検出チューブ。このチューブは、気泡除去剤の液滴出口チューブにすでに接続されています。21. ODベースおよび蛍光ベースの検出ファイバー。検出ファイバーには、それぞれの名前でラベルが付けられています。22.光源の光ファイバー。23.検出チューブが挿入されている検出ソケット。24.検出ファイバーを固定するためのファイバー固定ネジ。25.検出チューブを固定するネジ。検出チューブを検出穴に適切に挿入した後、ネジを締めます。26.廃液ポート。27.収集信号の外側に液滴を排出するための廃液管。(E)マイクロチューブ、液滴発生マイクロ流体チップ、および気泡除去剤を対応する配置に取り付けます。4 つのチューブ (C1、C2、C4、および CF) は、それぞれ MISS セルの対応するポートに接続されています。(O1、O2、O4、および OF)。28.マイクロチューブと液滴発生マイクロ流体チップの保護カバー。29.気泡除去剤。30.気泡除去剤への液滴入口チューブ。31.気泡除去剤からの液滴出口チューブ。32.クランプC3コネクタのバルブ。略語:MISS =シングルセルマイクロリットル液滴培養オミクスシステム;OD = 光学密度。 この図の拡大版を表示するには、ここをクリックしてください。

図2:MISSセルの操作ソフトウェアインターフェース (A)ソフトウェアの ホーム インターフェース。1.操作チャンバー内の温度。2.機能インターフェース。操作するインターフェースは、 ホーム インターフェースとパラメータ 設定 インターフェースの2つです。3.マイクロチューブと液滴生成マイクロ流体チップの取り付けおよび取り外しボタン。4.機能の選択:初期化、生産、文化、並べ替え、停止、およびクリーニングの6つの関数から選択できます。5.プロセス表示エリア:このエリアには、操作情報、実行時間、および収集されたドロップレットデータが表示されます。6. 96ウェルプレート表示エリア:現在の収集プレート番号と液滴収集ウェルの位置のリアルタイム表示。7.液滴検出および収集データの表示領域。8.上限と下限の設定と液滴数の表示領域を並べ替えます。採取する液滴の範囲は、液滴のシグナル(OD/蛍光強度)に応じて設定されます。MISS細胞システムは、収集された液滴の総数をカウントします。9.コレクションデータをエクスポートし、プレートのヒートマップを表示するためのボタン。10.液滴チューブ領域。液滴生成、液滴培養、液滴スクリーニング、洗浄のために操作するチューブの数を選択します。(B)ソフトウェアのパラメータ 設定 インターフェース。11. 液滴選別時に検出したスペクトル値(OD/蛍光強度)をリアルタイムに表示します。12.検出波長、基本スペクトル値、ODモードなどのOD検出設定パラメータ。2つのODモードがあります:有効平均値(値法1)は、液滴スペクトル値の平均値を計算します。最小値(Value Method 2)は、液滴スペクトル値の最小値を信号として取ります。13.励起(デバイス構成)、発光波長(350-800 nm)、およびベーススペクトル値を含む蛍光検出セットアップパラメータ。14.検出モード(OD /蛍光強度)、インキュベーション温度、インキュベーション時間、試薬ボトル内のサンプルの攪拌速度の選択を含むシステムセットアップパラメータ。15.液滴の識別とサンプル収集設定のパラメータ。略語:MISS =シングルセルマイクロリットル液滴培養オミクスシステム;OD = 光学密度。 この図の拡大版を表示するには、ここをクリックしてください。

図3:サンプルボトルと気泡除去剤の取り付け (A)MISS細胞のサンプルボトル。微生物懸濁液は、サンプルボトルのサンプル添加位置に追加されます。すぐに蓋を締め、クイックコネクタAとBを接続します。最後に、サンプルボトルをMISSセル上のサンプルボトル配置に配置します。(B)サンプルボトルの取り付け。クイックコネクタAとBは、それぞれMISSセルのO3ポートと、マイクロチューブと液滴発生マイクロ流体チップのC3コネクタに接続されています。(C)気泡除去剤の取り付け。気泡除去剤を取り付ける際は、気泡除去油の入ったボトルを取り付ける前に、まず蝶の形をしたネジをフタから取り外します。略語:MISS = Single-cell Microliter-droplet Culture Omics System この図の拡大版を表示するには、ここをクリックしてください。
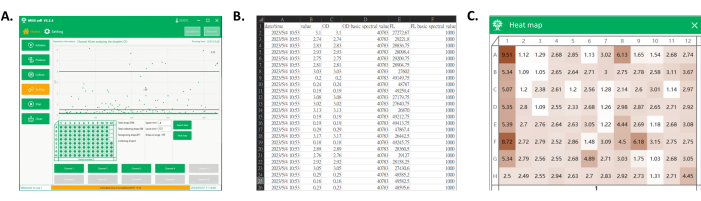
図4:データエクスポートと収集したウェルプレートのヒートマップ(A)液滴検出および収集中のソフトウェアのメインインターフェース。プロセス表示エリアには、各液滴信号が表示され、目的の範囲の液滴がウェルプレートに収集されます。(B)エクスポートされたデータの一部のスクリーンショット。エクスポートされるデータには、収集された液滴のスペクトル信号(列CおよびE)とその検出時間(列A)が含まれます。(C)プレートのヒートマップのスクリーンショット。収集された液滴からの信号に基づいて、値を正規化してプレートのヒートマップを取得し、後で各クローンのモノクローナル株の培養性能を色に基づいて区別するために使用できます。この図の拡大版を表示するには、ここをクリックしてください。

図5:MISS細胞における腸内微生物のモノクローナル単離と培養の結果。 (A)腸内細菌叢の分離、培養、および同定のためのワークフロー図。初期微生物懸濁液、ソリッドプレート法、およびMISS細胞法を使用して、同じ腸内細菌叢を分離および培養し、その後、シーケンシング分析を行います。(B,D)腸内細菌叢の単離と培養から得られたモノクローナルコロニーの家族レベルの分析( B はベン図分析、 D はコミュニティ構成分析を示しています)。(C,E)腸内細菌叢の単離と培養から得られたモノクローナルコロニーの属レベルの分析で、 C はベン図分析、 E はコミュニティ組成分析を示しています。略称:MISS=シングルセルマイクロリットル液滴培養オミクスシステム。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコールでは、自動化されたハイスループットの微生物モノクローナル単離、培養、検出、および収集のためのMISS細胞の操作について概説しています。腸内細菌叢の20~30%しか単離および培養できない従来の方法と比較して2,12、オミクスシステムを使用して得られたモノクローナルクローンの数は、固体プレートから得られたモノクローナルクローンの数よりも1.97倍多かった。この比較から、MISS細胞はシングルセル単離、モノクローナル培養、スクリーニングに優れていることが分かります。
シングルセル単離では、オミクスシステムによりポアソン分布に従ってシングルセルの液滴が得られ、良好なモノクローナル性が確保されました。さらに、オミクスシステムは最大5,000液滴/hの速度で液滴を生成し、液滴サイズが小さいため試薬の消費量を大幅に削減しながら、ハイスループットなシングルセル単離を可能にしました。液滴生成時には、マイクロチューブ上のフローフォーカシングチャネルを使用しました。Omicsシステムは、インジェクションポンプを使用して、油相、サンプル溶液、およびガスをフローフォーカシングチャネルに押し込み、液滴を形成します。ユーザーは、液滴がチャネルを通じて正常に生成されるか、液滴チューブを直接見ることによって観察できます。マイクロチューブと液滴生成マイクロ流体チップからのシリコーンチューブは、10個の液滴チューブの端に接続されています。1つの液滴チューブに十分な液滴(~5,000個の液滴)が発生すると、クランプバルブはチューブのシリコンチューブを自動的にクランプし、次のチューブに液滴を生成し続けます。
モノクローナル株の培養では、液滴中の微生物が優れたガス交換性能、高い並行培養、効率的な物質移動の恩恵を受け、低存在量または増殖困難な株に最適な生育条件を提供しました。モノクローナル株スクリーニングでは、オミクスシステムは蛍光およびODベースのバイオマス検出をサポートし、これにより、微生物の増殖性能と目的の特定の遺伝子またはタンパク質の発現レベルに基づいて検出を行うことができた13。さらに、Omicsシステムでは、重力による液滴のウェルプレートへの堆積を採用しました。このパッシブスクリーニング法とスイングアームを組み合わせることで、安定した高精度な飛沫スクリーニングを実現し、バイオフレンドリーなスクリーニングプラットフォームとなっています。さらに、オミクスシステムは、単一の微生物の分離から最終的なクローンスクリーニングまでのプロセスを完全自動化し、人件費と時間コストを削減しました。
オミクスシステムの性能を考えると、微生物培養や微生物突然変異誘発スクリーニングだけでなく、高生産性株の選択や主要な機能遺伝子のマイニングなどの他のアプリケーションにも使用できる可能性があります6。正確な実験結果を得るために、研究者は単離、培養、スクリーニングする種に基づいて実験条件を最適化することができます。まず、オミクスシステムにおけるシングルセル液滴の生成はポアソン分布に従い、λ値が低いと、生成される液滴の大部分が空またはシングルセル液滴であることが保証されます。これまでの研究では、オミクスシステムにおいてシングルセル液滴を生成するための最適な微生物濃度範囲が16.8-69.7細胞/mL(λ=0.035-0.145)であることを検証しました6。サンプル懸濁液を調製する際には、モノクローナル性の精度を高めるために、この濃度範囲内で希釈することが重要です。次に、オミクスシステムを使用する前に、微生物の増殖条件を最適化する必要があります。微生物の酸素必要量に基づいて、研究者は液滴生成の気相として窒素または酸素のいずれかを選択できます。第三に、液滴検出中、吸光度または蛍光は、液滴を照射した後に受ける光の強度によって決定されます。したがって、同じサンプルから得られる数値は、以前の研究14で観察されたように、サンプルの厚さの違いにより、液滴検出と分光光度計の測定とで異なる可能性があります。したがって、実験を行う前に、実験サンプルの検量線を設定することをお勧めします。
さらに、オミクスシステムの性能を哺乳類細胞などの他の種への応用にも改善しており、これには、油相の細胞への生体適合性(例えば、フッ素化油はガス溶解性が高く、哺乳類細胞培養により適している15,16)、細胞のせん断力に対する二相流速の影響17、18,19、および液滴サイズの最適化13,20。これらの改善により、細胞株開発、シングルB細胞抗体スクリーニング、ハイブリドーマ抗体の探索などの生物医学研究におけるオミクスシステムの使用が大幅に促進される可能性があります。オミクスシステムの3つのコア運用モジュールである液滴生成、培養、スクリーニングに基づいて、研究者は実験の要求に応じて適切なモジュールを選択できます。さらに、液滴注入および液滴分裂モジュールを本明細書に記載のシステムに追加して、試薬の添加を行ったり、菌株ライブラリーを確立したりすることができる。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
本研究は、広東省の主要地域における研究開発プロジェクト(2024B1111130002)、河北省の研究開発プロジェクト(22375503D)、安徽省工業微生物学分子育種研究所のオープニングプロジェクト(Grant ELMB-07)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Merck KGaA, Darmstadt, Germany | P5731-500EA | For solid plate preparation |
| 30 mL Stool Containers | Boen Healthcare Co., Ltd | 611101 | For collecting the stool samples |
| 37 °C constant temperature incubator | Shanghai Yiheng Technology Co., Ltd. | LRH-150 | Cultivate the solid plate in the incubator |
| 96-well Clear Flat Bottom Polystyrene TC-treated Microplates | Corning | 3599 | For well plate movement detection and droplet collection |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| Air bubble removal oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S-oil | The oil in the air bubble remover during droplet screening |
| Air bubble remover | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S | Exclude the gas phase between droplets before performing droplet detection and collection |
| Anaerobic bench | Argon and Nitrogen Space Equipment Business Department, Haiyu Town, Changshu City | VGB-4CM | For aseptic operation and UV sterilization under anaerobic condition |
| Autoclave | Puhexi Health and Medical Equipment Co., Ltd. | MLS-830L | For autoclaving BHI medium, EP tube, and so on. |
| Brain Heart Infusion (BHI) Broth | Qingdao High-tech Industrial Park Haibo Biotechnology Co., Ltd | HB8297-1 | Components of the BHI medium The ingredient list: 38.5 g/L BHI Broth in distilled water |
| Cell Spreader | Merck KGaA, Darmstadt, Germany | HS8151 | Inoculate the microbial solution onto the solid plate |
| Centrifuge tube, 15 mL | Beijing Xinhengyan Technology Co., Ltd | HB53397 | For microbial solution preparation |
| Computer | Lenovo | E450 | Software installation and MISS cell control |
| Cryovial | Thermo Fisher | 2.0 mL | For stool preservation |
| Distilled water | Beijing Mreda Technology Co., Ltd. | M306444-100ml | Add into humidifier to keep the humidity in droplet cultivation chamber |
| EP tube | Thermo Fisher | 2.0 mL | For collecting the stool samples |
| Fluorescent inverted microscope | Olympus Life Science (LS) | CKX53 | Check and calculate the microbial concentration |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| Hemocytometer | Acmec | AYA0810-1ea | Calculate the microbial concentration |
| KCl | Ambeed | A442876 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| KH2PO4 | MACKLIN | P815661 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| Mesh filter | Anping Jiufeng Wire Mesh Manufacturing Co., Ltd | 200 mesh (0.075 mm), 400 mesh (0.038 mm), 800 mesh (0.018 mm) | Remove undigested food and smaller particulate matter from the stool samples |
| Micro-tubing and droplet generation microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISC-B2 | For droplet generation and droplet incubation |
| MISS cell oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-BOS-B | The oil phase for droplet microfluidics |
| MISS cell software | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell V3.2.4 | Perform experimental operations on the MISS cell instrument |
| Na2HPO4 | Solarbio | D7292 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| NaCl | GENERAL-REAGENT | G81793J | Components of the physiological saline solution The ingredient list: 9 g/L NaCl in distilled water |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Polytetrafluoroethylene tube | Shenzhen WOER Heat-shrinkable Material Co., Ltd. | 3401000141 | For droplet incubation. This material was already included in micro-tubing and droplet generation microfluidic chip |
| Sample bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-bottle | Sampling of microbial solution |
| Single Cell Microliter-droplet Culture Omics System (MISS cell) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-G3f | Performing the microbial monoclonal isolation, cultivation, detection and collection |
| Superspeed Centrifuge | Thermo Fisher | Sorvall Lynx 4000 | Prepare the microbial solution for sequencing |
| Syringe | Jiangsu Zhiyu Medical Instructment Co., Ltd | 10 mL | Draw the distilled water and inject it into the humidifier in droplet cultivation chamber |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
参考文献
- Hahn, M. W., Koll, U., Schmidt, J., Hurst, C. J. Isolation and cultivation of bacteria. The structure and function of aquatic microbial communities. , 313-351 (2019).
- Xu, M. Q., Pan, F., Peng, L. H., Yang, Y. S. Advances in the isolation, cultivation, and identification of gut microbes. Mil Med Res. 11 (1), 34 (2024).
- Lattermann, C., Büchs, J. Microscale and miniscale fermentation and screening. Curr Opin Biotechnol. 35, 1-6 (2015).
- Huang, Y., et al. High-throughput microbial culturomics using automation and machine learning. Nat Biotechnol. 41 (10), 1424-1433 (2023).
- Brehm-Stecher Byron, F., Johnson Eric, A. Single-cell microbiology: Tools, technologies, and applications. Microbiol Mol Biol Rev. 68 (3), 538-559 (2004).
- Jian, X., et al. Single-cell microliter-droplet screening system (miss cell): An integrated platform for automated high-throughput microbial monoclonal cultivation and picking. Biotechnol Bioeng. 120 (3), 778-792 (2023).
- Hu, B., et al. One cell at a time: Droplet-based microbial cultivation, screening and sequencing. Mar Life Sci Technol. 3 (2), 169-188 (2021).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-expanding the toolbox of microfluidic single-cell cultivations. J Mol Biol. 431 (23), 4569-4588 (2019).
- He, Z., Wu, H., Yan, X., Liu, W. Recent advances in droplet microfluidics for microbiology. Chinese Chemical Letters. 33 (4), 1729-1742 (2022).
- Kaminski, T. S., Garstecki, P. Controlled droplet microfluidic systems for multistep chemical and biological assays. Chem Soc Rev. 46 (20), 6210-6226 (2017).
- Sender, R., Fuchs, S., Milo, R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 164 (3), 337-340 (2016).
- Simrén, M., et al. Intestinal microbiota in functional bowel disorders: A rome foundation report. Gut. 62 (1), 159-176 (2013).
- Periyannan Rajeswari, P. K., Joensson, H. N., Andersson-Svahn, H. Droplet size influences division of mammalian cell factories in droplet microfluidic cultivation. Electrophoresis. 38 (2), 305-310 (2017).
- Jian, X., et al. Microbial microdroplet culture system (mmc): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnol Bioeng. 117 (6), 1724-1737 (2020).
- Baret, J. -. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Kubie, L. S. The solubility of O2, CO2, and N2 in mineral oil and the transfer of carbon dioxide from oil to air. J Biol Chem. 72 (2), 545-548 (1927).
- Poon, C. Measuring the density and viscosity of culture media for optimized computational fluid dynamics analysis of in vitro devices. J Mech Behav Biomed Mater. 126, 105024 (2022).
- Yao, J., Lin, F., Kim, H. S., Park, J. The effect of oil viscosity on droplet generation rate and droplet size in a t-junction microfluidic droplet generator. Micromachines. 10 (12), 808 (2019).
- Venkateshwarlu, A., Bharti, R. P. Effects of capillary number and flow rates on the hydrodynamics of droplet generation in two-phase cross-flow microfluidic systems. Journal of the Taiwan Institute of Chemical Engineers. 129, 64-79 (2021).
- Nekouei, M., Vanapalli, S. A. Volume-of-fluid simulations in microfluidic t-junction devices: Influence of viscosity ratio on droplet size. Physics of Fluids. 29, 032007 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved