Method Article
Tek Hücreli Mikrolitre Damlacık Kültürü Omik Sistemini Kullanarak Otomatik ve Yüksek Verimli Mikrobiyal Monoklonal Yetiştirme ve Toplama
Bu Makalede
Özet
Bu protokol, mikrobiyal monoklonal izolasyon, yetiştirme ve toplama işlemlerini gerçekleştirmek için Tek hücreli Mikrolitre damlacık Kültür Omik Sisteminin (MISS hücresi) nasıl kullanılacağını açıklar. MISS hücresi, mükemmel damlacık monodispersisitesi, yüksek paralel yetiştirme ve yüksek verimli biyokütle tespiti sunan damlacık mikroakışkan teknolojisine dayalı entegre bir iş akışı sağlar.
Özet
Saf bakteri kültürleri, mikrobiyal kültür çalışmaları için gereklidir. Katı plakalara, kuyu plakalarına ve mikro reaktörlere dayalı geleneksel yöntemler, hantal prosedürler ve düşük verim nedeniyle engellenerek mikrobiyal kültür araştırmalarının hızlı ilerlemesini engellemektedir. Bu zorlukların üstesinden gelmek için, mikrobiyal monoklonal izolasyon, yetiştirme ve tarama için damlacık mikroakışkan teknolojisini kullanan otomatik bir yüksek verimli platform olan Tek Hücreli Mikrolitre damlacık Kültür Omik Sistemini (MISS hücresi) başarıyla geliştirdik. Bu sistem, çok sayıda tek hücreli damlacık üretebilir ve kısa sürede monoklonal kolonileri yetiştirebilir, tarayabilir ve toplayabilir, bu da mikrobiyal izolasyondan toplamaya kadar entegre bir süreci kolaylaştırır. Bu protokolde, örnek olarak insan bağırsak mikrobiyotasının izolasyonu ve kültivasyonunu kullanarak uygulamasını gösterdik ve katı plaka kültürü yöntemini kullanarak mikrobiyal izolasyon verimliliğini, monoklonal kültür performansını ve tarama verimini karşılaştırdık. Deneysel iş akışı basitti ve reaktif tüketimi çok düşüktü. Katı plaka kültürü yöntemleriyle karşılaştırıldığında, MISS hücresi, mikrobiyal kültür araştırmaları için önemli bir potansiyel ve değer sunarak daha fazla çeşitlilikte bağırsak mikrobiyota türü yetiştirebilir.
Giriş
Mikrobiyal kültüromik, gıda endüstrisindeki faydalı mikropların araştırılmasında, çevresel mikropların çeşitliliğinde, yeni antimikrobiyal bileşiklerin taranmasında ve hastalık 1,2,3,4 ile ilgili olarak insan mikrobiyomunda geniş uygulamalara sahiptir. Monoklonal kolonileri elde etmek ve seçmek için esas olarak katı plakalara, kuyu plakalarına veya mikro reaktörlere dayanan geleneksel yöntemlerin kullanımı kolaydır, ancak çoklu adımları nedeniyle düşük verimden muzdariptir. Bu sınırlama, tümü kapsamlı monoklonal tarama gerektiren mikrobiyal mutajenez taraması, mikrobiyal kültür çalışmaları ve yüksek verimli koloni seçimi gibi uygulamaları engeller.
Son zamanlarda, mikrobiyal numunelerin işleme hızını önemli ölçüde artırırken, işçiliği azaltmak ve manuel kullanımdan kaynaklanan hataları en aza indirmek için çeşitli tek hücreli algılama ve dağıtma cihazları tasarlanmıştır5. Bununla birlikte, bu cihazlar tipik olarak geleneksel yöntemlerde yalnızca belirli adımları ele alır, genellikle kapsamlı ekipman entegrasyonu gerektirir, önemli ölçüde yer kaplar ve yüksek maliyetlere neden olur. Bu nedenle, yukarıda belirtilen eksiklikleri telafi etmek için düşük maliyetli, evrensel olarak uygulanabilir bir mikrobiyal kültür ve tarama platformu geliştirmeye acil bir ihtiyaç vardı.
Önceki çalışmalarımızda, Tek Hücreli Mikrolitre damlacık Kültür Omik Sistemi (MISS hücresi, bundan böyle "Omik sistemi" olarak anılacaktır)6 olarak bilinen otomatik, yüksek verimli bir tarama platformunu başarıyla geliştirdik. Bu platform, mikrobiyal izolasyon, yetiştirme vetoplama 7,8,9,10'da otomasyon ve entegrasyon sağlama sözü veren damlacık mikroakışkan teknolojisini kullanır. Omics sistemi, mikrobiyoloji araştırmalarında verimli tek hücre izolasyonu, kültivasyon, monoklonal tarama ve toplama sağlayan bir örnekleme modülü, mikroakışkan çip, damlacık algılama ve toplama sistemi dahil olmak üzere birkaç temel modülden oluşur. Corynebacterium glutamicum6'nın yüksek verimli mutajenez taramasını elde etmek için Omics sistemini zaten kullandık.
Omics sisteminin otomasyon ve yüksek verimli tarama yetenekleri nedeniyle, mikrobiyal kültüre uygulanmasının büyük miktarda mikrobiyal veriyi hızlı bir şekilde elde etmesi beklenmektedir. Bu protokolde, mikrobiyal tek hücre izolasyonu, kültivasyon, monoklonal tespit ve tarama sürecini göstermek için bir örnek olarak insan bağırsak mikrobiyotasının izolasyonu ve kültivasyonu ile MISS hücresinin ayrıntılı operasyonel prosedürünü tanıttık. Omics sisteminin çalışması basittir ve araştırmacıların yalnızca mikro boru ve damlacık üretimi mikroakışkan çipinin sıralı kurulumu, parametre ayarları ve numune hazırlama için yazılım yönünü takip etmeleri gerekir.
Yazılım işletim arayüzünde, Omics sistemi üç ana işleve ayrılmıştır: izolasyon, yetiştirme ve tarama. Araştırmacılar deneye göre farklı aşamalar seçebilirler. Ayrıca, damlacık tarama aşamasında, araştırmacılar iki algılama modundan birini seçebilirler: floresan sinyali veya optik yoğunluk. Yazılım, damlacık tarama işleminin gerçek zamanlı görselleştirilmesini sağlar. Son olarak, araştırmacılar kültür koşulları, tespit edilen dalga boyu ve toplama kuyularının sayısı gibi parametreleri kendi özel deneysel taleplerine göre yapılandırma esnekliğine sahiptir ve diğer işlemleri gerçekleştirmek için cihazı istedikleri zaman duraklatabilirler. MISS hücresi, basit kullanım ve minimum reaktif tüketimi ile mikrop dostu, yüksek verimli bir monoklonal tarama platformudur.
Protokol
Tüm çalışma prosedürleri ilgili tüm etik düzenlemelere uygundur. Prosedürler Tsinghua Üniversitesi Bilim ve Teknoloji Etik Komitesi tarafından onaylandı. İnsan bağırsak mikrobiyotasını incelemek için, önemli bir tıbbi durumu olmayan ve yazılı bilgilendirilmiş onam veren sağlıklı bir yetişkinden dışkı örnekleri toplandı.
1. Enstrüman kurulumu
- Omics sistem cihazını temiz veya steril bir ortama (steril oda veya anaerobik tezgah gibi) yerleştirin. Cihaz hassas bir cihazdır ve tesise yerleştirirken aşağıdakileri göz önünde bulundurun:
- Cihazı normal basınç ve sıcaklık altında tutun.
- Cihazı güçlü elektrik alanlarından, manyetik alanlardan ve ısı radyasyonu kaynaklarından uzak tutun.
- Cihaz yerleştirme alanının 2.500 mm (D) x 1.500 mm (G) x 2.000 mm (Y) boyutlarını aştığından emin olun.
- Cihazın çevresel nemini %60'ın altında tutun.
2. Hazırlıklar
- Omics sisteminin, bilgisayarın ve Omics sistemi işletim yazılımının gücünü sırayla açın.
- MISS hücre mikro boru ve damlacık üretimi mikroakışkan çip kurulumu:
- Damlacık oluşturma ve yetiştirme odasının kapısını açın (Şekil 1A) ve mikro boru ve damlacık oluşturma mikroakışkan çipi için koruyucu kapağı dikey olarak çıkarın. Damlacık yetiştirme odasının içindeki nemlendiriciye 10 mL steril damıtılmış su eklemek için tek kullanımlık bir şırınga kullanın (Şekil 1C) ve mikro boru ve damlacık üretimi mikroakışkan çipi için koruyucu kapağı yeniden takın.
- Mikro boru ve damlacık oluşturma mikroakışkan çipinin steril ambalajını açın ve dikey olarak doğrudan yetiştirme odasının üzerine yerleştirin (Şekil 1C).
- Yazılım arayüzünde, Kurulum'a tıklayın (Şekil 2A). Bu noktada, şu istemi içeren bir açılır pencere belirir: Mikro boru ve damlacık oluşturma mikroakışkan çipinin değiştirilmesini onaylayın? Yüklemeyi başlatmak için Evet'e tıklayın.
- Hava kabarcığı çıkarıcıyı çıkarın ve damlacık oluşturma ve yetiştirme odasındaki hava kabarcığı çıkarıcı yerleşimine baş aşağı sabitleyin. Hava kabarcığı çıkarıcının damlacık giriş ve çıkış borularına bastırmamaya dikkat edin (Şekil 1E).
- Hava kabarcığı çıkarıcının damlacık çıkış borusunu altındaki sıkıştırma valfine takın ve damlacık algılama ve toplama odasına yönlendirilen delikten geçmesine izin verin (Şekil 1B).
- Damlacık algılama ve toplama odasının kapısını açın, damlacık çıkış borusuna zaten bağlı olan algılama tüpünü algılama soketine dikey olarak yerleştirin ve algılama tüpünün tam olarak yerleştirildiğinden emin olun (Şekil 1D).
NOT: Algılama tüpünü yerleştirirken, tüp üzerinde herhangi bir bükülme olmadan dikey olarak yerleştirin. - Algılama tüpünü sabitleyen vidayı saat yönünde sıkın. Algılama tüpünün tam olarak yerleştirildiğini ve sabitlendiğini onayladıktan sonra, damlacık algılama ve toplama odasının kapısını kapatın.
- Mikro boru ve damlacık oluşturma mikroakışkan çipinden, her biri bir numara (L01-L10) ile etiketlenmiş 10 silikon tüp vardır. Etiketli her tüpü ilgili numaralı kelepçe valfine (01-10) bağlayın (Şekil 1C).
- Mikro boru ve damlacık oluşturma mikroakışkan çipinden gelen hızlı konektörü Omics sistemindeki ilgili bağlantı noktasına bağlayın: C1'den O1'e, C2'den O2'ye, C4'ten O4'e ve CF'den OF'ye.
NOT: Mikro boru ve damlacık oluşturma mikroakışkan çipinin kurulumu tamamlanmıştır. C3'ün O3'e bağlanmasına gerek yoktur. - Mikro boru ve damlacık üretimi mikroakışkan çip kurulumu tamamlandıktan sonra, Damlacık borusu sıkıştırma valfinin açılmasını isteyen bir açılır pencere belirir. Mikro tüp ve damlacık oluşturma mikroakışkan çip kurulumu tamamlandığında Tamam'a tıklayın. Mikro boru ve damlacık oluşturma mikroakışkan çipindeki tüm silikon tüplerin ilgili kelepçe valfine takıldığından emin olduktan sonra, Tamam'a tıklayın.
- Enstrüman başlatma
- Başlatmayı gerçekleştirmeden önce, ilgili parametreleri yapılandırmak için Ayar arayüzüne (Şekil 2B) tıklayın: algılama modu (OD tabanlı veya floresan tabanlı algılama; OD burada), inkübasyon sıcaklığı (37 °C) ve zaman (30 gün = 720 saat), karıştırıcı hızı (20 rpm), OD algılamanın dalga boyu (600 nm) ve floresan algılamanın uyarma ve emisyon dalga boyu.
NOT: Bu protokolde insan bağırsak mikrobiyotasının izolasyonu ve kültivasyonu için kullanılan parametreler parantez içinde verilmiştir. Parametreleri ayarlarken, yetiştirme sıcaklığı 5 °C ile 50 °C arasında olmalıdır. Algılama modunu seçerken, damlacık algılama modülündeki fiber aynı değilse optik fiber değiştirilmelidir (bkz. adım 2.3.2). Parametreleri yapılandırırken, yağ fazı referans değeri (temel spektral) yazılım tarafından otomatik olarak tanımlanır ve manuel ayarlama ihtiyacını ortadan kaldırır. - Tespit edilen optik fiberin değiştirilmesi
- Algılanan fiberi fiber tutucudan çıkarın (saat yönünün tersine çevirerek çıkarın) ve damlacık modülündeki fiber sabitleme vidasını gevşetin (Şekil 1D).
- Optik fiber kullanılmayacaksa, modülden çıkarın, fiber tutucuya takın ve sıkın. Algılanan fiberi algılama portuna yerleştirin ve modüldeki fiber sabitleme vidasını sıkın. Optik fiberin değiştirilmesi tamamlandı.
- Ana arayüze dönün ve Başlat'a tıklayın Omics sisteminin enjeksiyon pompası, sıcaklık ayarları, atık sıvı boşaltma testi, tarama modülü ve damlacık algılama modülü dahil olmak üzere bileşenlerini kendi kendine kontrol etmesine izin vermek için.
- Başlatma sırasında, atık sıvı portuna 1 mL %75 alkol enjekte ederek ve sıvının normal şekilde akıp akmadığını gözlemleyerek damlacık algılama modülünden atık sıvı boşaltma testi gerçekleştirin.
- Tarama modülü testi için, plaka yerleşimine 96 oyuklu bir plaka yerleştirin ve plaka hareketinin normal olup olmadığını gözlemleyin.
- Başlatmayı gerçekleştirmeden önce, ilgili parametreleri yapılandırmak için Ayar arayüzüne (Şekil 2B) tıklayın: algılama modu (OD tabanlı veya floresan tabanlı algılama; OD burada), inkübasyon sıcaklığı (37 °C) ve zaman (30 gün = 720 saat), karıştırıcı hızı (20 rpm), OD algılamanın dalga boyu (600 nm) ve floresan algılamanın uyarma ve emisyon dalga boyu.
3. Damlacık oluşumu
- İnsan bağırsak mikrobiyota örneklerinin toplanması ve işlenmesi
- Bir hazne kabı ve dışkı kapları hazırlayın, ellerinizi yıkayın ve taze dışkı örnekleri toplamak için eldiven giyin.
NOT: Dışkı örnekleri toplarken, idrar kontaminasyonundan mümkün olduğunca kaçının. Önceden idrara çıkmak ve dışkıyı temiz, kuru bir kaba koymak daha iyidir. - Uygun miktarda orta segment dışkıyı aseptik olarak toplayın ve sterilize edilmiş kriyoviyallerde (flakon başına yaklaşık 3-5 g) kapatın. Daha sonra alıntılama ve etiketleme için şişeleri hemen buzun üzerine yerleştirin.
NOT: Dışkı örneği büyükse veya hemen alınamıyorsa, en fazla 2 saat içinde toplanmalıdır. - Anaerobik tezgahta, orta segment numunesi toplamak için steril bir çubuk veya dışkı numune alma aleti kullanın.
NOT: Dışkı yüzey tabakası dökülmüş bağırsak mukozal hücreleri içerir ve dış kontaminasyona eğilimlidir; havaya maruz kaldıktan sonra, bazı mikrobiyal DNA'lar bozulmaya başlar. - Toplanan dışkı örneklerini, her biri 0.5-2.0 g dışkı içerecek şekilde 2 mL steril mikrosantrifüj tüplerine veya steril kriyoviyallere aktarın. Numune başına dondurmak için iki alikot hazırlayın.
- Taze dışkı örneğini steril fizyolojik tuzlu su çözeltisi içinde yeniden süspanse edin, her 100 mg dışkı 1 mL çözelti içinde seyreltilir. Büyük parçacıklar görünmeyene kadar dışkıyı iyice karıştırın.
- 10 dakika boyunca doğal çökeltmeden sonra, sindirilmemiş yiyecekleri ve daha küçük partikül maddeleri uzaklaştırmak için süpernatanı 200 gözenekli (0,075 mm), 400 gözenekli (0,038 mm) ve 800 gözenekli (0,018 mm) gözenekli filtrelerden sırayla süzün. Son olarak, süzüntüyü steril santrifüj tüplerinde toplayın.
- Filtrelenmiş dışkı süspansiyonunun 10 μL'sini alın ve bir hemositometre ve ters çevrilmiş bir floresan mikroskobu kullanarak mikrobiyal konsantrasyonu belirleyin.
NOT: Dışkı numunesi süpernatanı farklı ağ boyutlarında filtreledikten sonra, bazı küçük dışkı parçacıkları kalır. Bu nedenle, mikrobiyal konsantrasyonu belirlerken, mikroskop altında gözlemlenen aktif partiküller mikroorganizma olarak kabul edilir ve bu da mikrobiyal konsantrasyonun yalnızca yaklaşık olarak hesaplanmasına izin verir. - Dışkı süspansiyonunu 1.5 mL'lik bir steril santrifüj tüpüne aktarın ve tarih, mikrobiyal konsantrasyon ve numune adı ile etiketleyin. Bir kısmını sonraki deneyler için ayırın ve geri kalanını ileride kullanmak üzere 4 °C'de saklayın.
NOT: Numunelerin aynı anda toplandığından emin olmak için numune bilgilerini (numune adı, toplama zamanı) derhal kaydedin (memeli bağırsağı mikrobiyal temporal ritim değişiklikleri göz önünde bulundurularak). Tüm numune toplama ve işleme anaerobik bir ortamda gerçekleştirilmelidir.
- Bir hazne kabı ve dışkı kapları hazırlayın, ellerinizi yıkayın ve taze dışkı örnekleri toplamak için eldiven giyin.
- İlk dışkı süspansiyonu için hazırlık
- Beyin Kalp Suyu (BHI) ortamını üreticinin protokolüne göre hazırlayın ve 121 °C'de 15 dakika otoklavlayarak sterilize edin.
- Adım 3.1.8'den fekal süspansiyonu alın ve ~ 50 hücre / mL'lik bir konsantrasyon elde etmek için BHI ortamı ile seri seyreltmeler gerçekleştirin.
NOT: Numune şişesini doldurmak için en az 40 mL dışkı süspansiyonu hazırlayın. - Altta küçük bir manyetik karıştırma çubuğu olduğundan emin olarak, seyreltilmiş dışkı süspansiyonunu numune ekleme konumuna kadar numune şişesine dökün. Kapağı vidalayın ve sıkın. Ardından, numune yükleme işlemini tamamlamak için hızlı konektör A'yı hızlı konektör B'ye takın (Şekil 3A).
- Numune şişesini belirtilen konuma yerleştirin ve numune şişesinden A ve B hızlı konektörlerini ayırın. Numune şişesinin hızlı konektörünü A'yı Omics sistemindeki O3 bağlantı noktasına bağlayın ve mikro boru ve damlacık oluşturma mikroakışkan çipindeki C3 konektörünü hızlı konektör B'ye bağlayın. Damlacık oluşturma ve yetiştirme odasının kapısını kapatın (Şekil 3B).
- Damlacık üretimi
- Yazılımın ana arayüzünde oluşturulacak istenen damlacık hortumu sayısını seçin (Şekil 2A).
NOT: Her çalıştırma, her tüp yaklaşık 5.000 damlacık üreten 10 adede kadar damlacık borusu üretebilir. - Tek hücreli damlacık üretimini başlatmak için yazılımın ana arayüzünde Üret'e tıklayın.
NOT: Atık sıvı pompasının tahliyesinin çalışıp çalışmadığını onaylayın. Damlacık üretimi sırasında, her damlacık 2.0 μL'lik bir hacme sahiptir. Damlacık oluşumunun açıklaması için tartışma bölümüne bakın. - Sesli uyarı alarmının damlacık oluşumunun bittiğini göstermesini bekleyin. cl'yi kapatınamp C3 konektörü üzerindeki (Şekil 1E) ve s'yi çıkarın.amp şişe.
- Yazılımın ana arayüzünde oluşturulacak istenen damlacık hortumu sayısını seçin (Şekil 2A).
4. Damlacık yetiştiriciliği
- Yazılımın ana arayüzünde damlacık oluşturma sırasındakiyle aynı damlacık boru numarasını seçin, Kültür'e tıklayın, yetiştirme süresini ve sıcaklığını onaylayın ve işleme başlayın. Yetiştirme ilerlemesini ve kalan süreyi gösteren ana arayüzdeki ilerleme çubuğunu izleyin.
- Sesli uyarı alarmının damlacık ekiminin bittiğini göstermesini bekleyin. Yetiştirme süresinin uzatılması gerekiyorsa, süreyi doğrudan Ayar arayüzünde ayarlayın.
5. Damlacık taraması
- Ultraviyole (UV) ışığını açmak için Omics sistemindeki UV düğmesine basın (Şekil 1A), damlacık algılama ve toplama odasını 30 dakika boyunca ışınlayın ve ardından UV ışığını kapatın.
NOT: UV ışığını açmadan önce, damlacık algılama ve toplama haznesinin kapısının kapalı olduğundan emin olun. - Süper temiz bir tezgahta, damlacıkları toplamak için kullanılan 96 oyuklu plakaların tümünü açın ve bunları aşağıdan yukarıya doğru sırayla numaralandırarak kapaksız olarak üst üste istifleyin. Üst kuyu plakasının bir kapakla kapatıldığından emin olun.
NOT: Her çalıştırma, on adede kadar 96 oyuklu plakayı barındırabilir ve plaka sayısı, toplam damlacık sayısına bağlıdır. - Damlacık algılama ve toplama haznesinin kapısını açın, kuyu plakalarını belirlenen konumlara yerleştirin (Şekil 1D), kapağı üst kuyu plakasından çıkarın ve haznenin kapısını kapatın.
- İkincil sterilizasyonu gerçekleştirmek için Omics sistemindeki UV ışığını 30 dakika boyunca açın.
- Hava kabarcığı çıkarıcının montajı
- Hava kabarcığı çıkarıcıyı yerleştirme konumundan çıkarın, kapağı sökün ve kelebek şeklindeki vidayı kapaktan çıkarın (Şekil 3C).
- 200 mL hava kabarcığı giderici yağı hava kabarcığı çıkarıcıya dökün, şişeyi Omics sistemindeki hava kabarcığı çıkarıcının kapağıyla sıkıca vidalayın ve ardından çıkarıcıyı hava kabarcığı çıkarıcı yerleşimine baş aşağı sabitleyin. Hava kabarcığı çıkarıcının kurulumu tamamlandı.
NOT: Hava kabarcığı çıkarıcıyı yerleşime sabitlerken, yağ sızıntısı olmadığından emin olun. Herhangi bir sızıntı meydana gelirse, kapağı sıkın.
- Ev arayüzünde sıralama için damlacık borusunu seçin, Sıralama'ya tıklayın, toplanacak kuyu plakalarının sayısını girin ve ardından işlemi başlatın. Damlacık taraması başladıktan sonra, damlacık optik yoğunluğunun (OD) veya floresan değerlerinin gerçek zamanlı ölçümlerini gösteren proses ekranları alanını gözlemleyin.
- OD değerini kontrol etmek için yaklaşık 20-30 damlacığı analiz edin. Örneğin, çoğunluğun boş damlacıkların OD değerine karşılık gelen ~0.2'lik bir OD değerine sahip olduğu bulunursa, Poisson dağılımına dayalı olarak, alt OD eşiğini 0.5 ve üst OD eşiğini 4.0 olarak ayarlayın. Bu aralıktaki damlacıklar otomatik olarak 96 oyuklu plakalarda toplanacaktır (Şekil 4A).
NOT: Beer-Lambert Yasasına göre, boş damlacıkların OD değeri, damlacıklar içindeki kültür ortamı bileşimi tarafından belirlenir. Tipik olarak, düşük OD eşiği, boş damlacıklar ile mikroorganizma içeren damlacıklar arasında net bir ayrım sağlamak için boş damlacıkların OD değerinden 0.2-0.3 birim daha yüksek olarak ayarlanır. - Sesli uyarı alarmının damlacık taramasının ve toplamanın bittiğini göstermesini bekleyin. Damlacık algılama ve toplama odasının kapısını açın, kuyu plakası kapağını üst kuyu plakasına yerleştirin ve ardından sonraki sıralama ve yedeklemeyi gerçekleştirmek için tüm kuyu plakalarını birlikte odadan çıkarın.
6. Veri aktarımı ve ısı haritalarının görüntülenmesi
- Toplanan damlacık sinyali verilerini kaydetmek için Verileri dışa aktar'a tıklayın (Şekil 4A,B).
- Isı haritası'na tıklayın, damlacık toplama veri dosyasını seçin ve yazılım tarafından görüntülenen mikroplakada toplanan damlacıkların OD değerlerini gözlemleyin. Bu OD değerlerini, renk yoğunluğunun kuyular boyunca OD dağılımına karşılık geldiği ve toplanan monoklonal OD değerlerinin net ve sezgisel bir temsilini sağlayan bir ısı haritası olarak görselleştirin (Şekil 4A,C).
7. MISS hücresinin temizlenmesi
- Deneyi tamamladıktan sonra, temizlenmesi gereken damlacık borusunu seçin ve cihaz temizliğini başlatmak için Temizle'ye tıklayın.
8. Mikrobiyal monoklonal yedekleme ve dizileme numune hazırlama
- Sıralama numunesi hazırlama
- Anaerobik tezgahta, toplanan damlacık plakasının her bir oyuğuna 100 μL BHI besiyeri ekleyin, pipetleme ile iyice karıştırın ve ardından her oyuktan 10 μL alın ve hepsini 15 mL'lik bir steril tüpe aktarın. Karışık bir mikrobiyal süspansiyon elde etmek için girdap.
- Karışık mikrobiyal süspansiyona 5 mL fosfat tamponlu salin ekleyin, 1.000 × g'da 10 dakika santrifüjleyin, süpernatanı çıkarın ve mikrobiyal peleti hızlı dondurma için sıvı nitrojene yerleştirin. Sıralama numunesi hazırlığı tamamlandı.
- 16S rDNA'nın V3 ve V4 alanını hedefleyen 16S rDNA amplikon dizileme yöntemlerini kullanın. Kullanılan spesifik sıralama primerleri aşağıdaki gibidir: 341F: ACTCCTACGGGAGGCAGCA ve 806R: GGACTACHVGGGTWTCTAAT.
- Mikrobiyal monoklonal numune kriyoprezervasyonu:
- Damlacık plakalarındaki her bir oyuktan 10 μL numune topladıktan sonra (adım 8.1.1'den itibaren), her oyuğa 30 μL gliserol ekleyin. Mikrobiyal suşun korunması için plakaları -80 °C'nin altına yerleştirin.
Sonuçlar
Baskın mikrobiyal topluluğu oluşturan insan bağırsak mikrobiyotasının, bağırsakta yaklaşık 4 × 1013 mikroorganizma barındırdığı tahmin edilmektedir, bu da çok sayıda ve karmaşık bileşimini sergilemektedir11. Bu çalışmada, bağırsak mikrobiyotasını izole etmeyi ve kültürlemeyi amaçladık ve MISS hücresinin yüksek verimli performansını göstermek için katı plaka yöntemini kontrol olarak kullandık.
İlk olarak, her iki yöntemin tek hücreli izolasyon verimini karşılaştırmak için aynı dışkı süspansiyonunu kullandık. MISS hücresinde, damlacıklardaki mikroorganizmaların dağılım olasılığının Poisson dağılımına dayalı olarak hesaplanabildiği düşük mikrobiyal konsantrasyonlar kullandık: P(λ,x) = λx e-λ/x!, burada λ , mikrobiyal konsantrasyon ile damlacık hacminin çarpılmasıyla hesaplanabilen damlacıklar üzerindeki ortalama hücre sayısıdır; x, damlacıklarda kapsüllenen hücrelerin sayısıdır. Burada, = 0.1'lik bir başlangıç mikrobiyal süspansiyon konsantrasyonu kullandık (başlangıç mikrobiyal konsantrasyon 50 hücre / mL ve damlacık hacmi 2.0 μL'dir), bu da boş damlacıkların, tek hücreli damlacıkların ve çok hücreli damlacıkların meydana gelme olasılığının sırasıyla %90.5 (x = 0), %9.1 (x = 1) ve %0.4 (x ≥ 2) olduğunu gösterir.
Omics sisteminde, 5.000 damlacık/saat hızında yaklaşık 30.000 damlacık ürettik ve bunları 30 gün boyunca altı politetrafloroetilen tüpte (OD 1.67 mm, ID 1.07 mm) yetiştirdik. Sonuç olarak, 96 oyuklu plakalarda bakteri içeren damlacıkları toplamak için OD algılama modunu kullanarak damlacıkları algılama modülü aracılığıyla taradık ve 1.057 hedef monoklonal suş elde ettik. Buna karşılık, katı plaka kültürü yöntemiyle, katı agar plakasının konsantrasyonu, toplam on adet 100 mm Petri kabı (her plaka 100 μL başlangıç mikrobiyal süspansiyonu ile) ile 3.0 ×10 3 hücre / mL idi. 30 günlük ekimden sonra, plakalardan 536 koloni toplandı. Omics sistemi, katı plaka yönteminden 1.97 kat daha fazla monoklonal klon verdi. Bu, mikroakışkan damlacıklarda tek hücreli monoklonal kültivasyonun, koloniler arasındaki rekabetçi inhibisyonu ortadan kaldırırken mikroorganizmaları etkili bir şekilde izole edebileceğini gösterdi.
Daha sonra, tüm monoklonal suşlar üzerinde 16S dizileme analizi yaptık ve yukarıda belirtilen iki yöntemden elde edilen tür çeşitliliğini karşılaştırdık. Aile düzeyinde tür çeşitliliği açısından, aynı 34 aile her iki yöntemle de zenginleştirilebilir. Spesifik olarak, Omics sistemi dört aileyi daha da zenginleştirdi: Sınıflandırılmamış Bacteroidales, Bacillales Thermoactinomycetaceae, Burkholderiales Comamonadaceae ve sınıflandırılmamış Enterobacterales (Şekil 5B) ve orijinal mikrobiyal süspansiyondaki Clostridiales Family_XI, Clostridiales Acidaminococcaceae, Desulfovibrionales Desulfovibrionaceae ve Enterobacterales Enterobacteriaceae'nin düşük bolluğunu kolayca zenginleştirdi (Şekil 5D) olarak adlandırılır.
Cins düzeyinde, 74 mikrobiyal cins her iki yöntemle de zenginleştirilebilirken, MISS hücre yöntemi ayrıca 13 mikrobiyal cinsi zenginleştirdi: Bacillaceae Bacillus, Bacillaceae Oceanobacillus, Bacillaceae Pseudogracilibacillus, Thermoactinomycetaceae Kroppenstedtia, Peptoniphilaceae Phocea, Clostridiaceae Anaerosalibacter, Peptoniphilaceae Ezakiella, Peptoniphilaceae W5053, XI sınıflandırılmamış, Clostridiaceae Clostridioides, Comamonadaceae Pelomonas ve iki sınıflandırılmamış mikrobiyal tür (Şekil 5C). Bunlar arasında, orijinal mikrobiyal süspansiyonda daha düşük miktarda bulunan Enterococcaceae Enterococcus ve Acidaminococcaceae Phascolarctobacterium cinsleri, Omics sistemi kullanılarak kolayca zenginleştirildi (Şekil 5E). Beklendiği gibi, bu iki cins sırasıyla Enterococcaceae ve Acidaminococcaceae familyasına aitti ve burada aile analizinden aynı sonuçları gözlemledik. Genel olarak, aile ve cins düzeylerinde, MISS hücre kültürü yönteminin tür zenginleştirmesi, katı plaka kültürü yöntemine kıyasla sırasıyla %30.6 ve %37.9 oranında artmıştır. Bu sonuçlar, MISS hücre kültürü yönteminin, düşük oranlarda bulunan veya orijinal mikrobiyal süspansiyonda düşük büyüme performansına sahip olan suşlar için daha iyi büyüme koşulları sağladığını gösterdi.

Şekil 1: MISS hücresinin yapısı ve temel bileşenleri. (A) MISS hücresinin dışı. 1. Damlacık üretimi ve yetiştirme odası, 2. Damlacık algılama ve toplama odası, 3. Damlacık toplama haznesinin aydınlatma ve UV düğmeleri. (B) Damlacık üretimi ve yetiştirme odasının içi. Damlacık üretimi, damlacık inkübasyonu ve damlacık taraması için hava kabarcığı giderme işlemleri bu odada gerçekleştirilir. 4. Damlacık yetiştirme odası, 5. Mikro boru ve damlacık oluşturma mikroakışkan çipinden silikon tüpleri sıkıştırmak için sıkıştırma valfleri; Sıkıştırma valfleri 1'den 10'a, soldan sağa, 6'ya kadar sırayla numaralandırılmıştır. Hava kabarcığı giderici yerleştirme, 7. Damlacık üretimi ve taraması için portlar (O1-O4): yağ, numune ve gaz fazı bu portlar aracılığıyla MISS hücresine bağlanır. 8. Atık limanı (OF), 9. Hava kabarcığı çıkarıcının damlacık çıkış borusunu sıkıştırmak için sıkıştırma valfi, 10. Damlacık algılama ve toplama odasına giden açıklık, 11. Numune şişesi yerleştirme; Yerleşimin altında, numunenin karıştırma hızını kontrol etmek için kullanılabilecek manyetik bir karıştırıcı vardır.(C) Damlacık yetiştirme odasının üstten görünümü. Odanın içinde, bir nemlendirici için bir su giriş portu vardır. 10 mL steril damıtılmış su eklemek için bir şırınga kullanılır, koruyucu kapak ve mikro boru ve damlacık oluşturma mikroakışkan çipi takılır ve mikro borudan gelen silikon tüpler, sağdaki şekilde gösterildiği gibi ilgili kelepçe valflerine kenetlenir. 12. Damlacık yetiştirme odasındaki nemlendirici için bir su giriş portu, 13. Mikro boru ve damlacık üretimi mikroakışkan çip. (D) Damlacık algılama ve toplama odasının içi. Soldaki resim, üç kuyu plakası yerleşimini ve kuyu plakasını yerleşimler arasında hareket ettiren taşıma robotik kolunu göstermektedir. Sağdaki resim, damlacık algılama ve toplama modülünün yakınlaştırılmış görünümünü gösterir (soldaki resimde kırmızı dikdörtgen). 96 kuyu plakasının yerleştirilmesi 14. Daha önce, 15. sırasında ve 16. damlacık toplandıktan sonra. 17. 96 kuyu plakası taşıma robotik kolu. Damlacık algılama ve toplama sırasında robotik kol, 96 oyuklu bir plakayı damlacık algılama modülünün yakınındaki kuyu plakası yerleşimine hareket ettirir. Damlacık toplama işlemi tamamlandıktan sonra kuyu plakası başka bir yerleşime taşınır ve işlem tamamlanana kadar aynı işleme devam edilir. 18. Damlacık algılama ve toplama modülü. 19. Algılama lifi için lif tutucu. İki algılama lifi vardır (OD tabanlı ve floresan tabanlı algılama). Bir algılama fiberi kullanıldığında, diğeri fiber tutucuya yerleştirilir. 20. Algılama tüpü. Bu tüp, hava kabarcığı çıkarıcının damlacık çıkış borusuna zaten bağlıdır. 21. OD bazlı ve floresan bazlı algılama fiberi; Algılama lifleri kendi adlarıyla etiketlenir. 22. Işık kaynağının optik fiberi. 23. Algılama tüpünün takıldığı algılama soketi. 24. Algılama fiberini sabitlemek için fiber sabitleme vidası. 25. Algılama tüpünü sabitleyen vida. Algılama tüpünü algılama deliğine düzgün bir şekilde yerleştirdikten sonra vidayı sıkın. 26. Atık sıvı portu. 27. Toplama sinyalinin dışındaki damlacıkların boşaltılması için atık tüp. (E) Mikro borunun, damlacık üreten mikroakışkan çipin ve hava kabarcığı çıkarıcının ilgili yerleşime takılması. Dört boru (C1, C2, C4 ve CF) sırasıyla MISS hücresinin ilgili bağlantı noktalarına bağlanır. (O1, O2, O4 ve OF). 28. Mikro boru ve damlacık üretimi mikroakışkan çip için koruyucu kapak. 29. Hava kabarcığı çıkarıcı. 30. Hava kabarcığı çıkarıcıya damlacık giriş borusu. 31. Hava kabarcığı çıkarıcıdan damlacık çıkış borusu. 32. C3 konektöründeki sıkıştırma valfi. Kısaltmalar: MISS = Tek Hücreli Mikrolitre damlacık Kültürü Omik Sistemi; OD = optik yoğunluk. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: MISS hücresinin işletim yazılımı arayüzü. (A) Yazılımın ana arayüzü. 1. Çalışma odasındaki sıcaklık. 2. Fonksiyon arayüzü. Çalıştırılacak iki arayüz vardır: ev arayüzü ve parametre ayar arayüzü. 3. Mikro boru ve damlacık oluşturma, mikroakışkan çip takma ve çıkarma düğmeleri. 4. İşlev seçimi: Aralarından seçim yapabileceğiniz altı işlev vardır: Başlat, Üret, Kültür, Sıralama, Durdur ve Temizle. 5. İşlem görüntüleme alanı: çalışma bilgileri, çalışma süresi ve toplanan damlacık verileri bu alanda gösterilir. 6. 96 oyuklu plaka görüntüleme alanı: mevcut toplama plakası numarasının ve damlacık toplama kuyusu konumunun gerçek zamanlı gösterimi. 7. Damlacık algılama ve toplama verilerinin görüntüleme alanı. 8. Üst ve alt limit ayarı ve damlacık sayısı görüntüleme alanını sıralama. Toplanan damlacık aralığı, damlacık sinyaline (OD/ floresan yoğunluğu) göre ayarlanır. MISS hücre sistemi, toplanan toplam damlacık sayısını sayar. 9. Toplama verilerini dışa aktarmak ve plakaların ısı haritalarını görüntülemek için düğmeler. 10. Damlacık boru alanı. Damlacık üretimi, damlacık yetiştirme, damlacık taraması ve temizleme için çalıştırılacak boru sayısını seçin. (B) Yazılımın parametre ayar arayüzü. 11. Damlacık ayırma sırasında tespit edilen spektral değerlerin gerçek zamanlı gösterimi (OD / floresan yoğunluğu). 12. Algılama dalga boyu, temel spektral değer ve OD modu dahil olmak üzere OD algılama kurulum parametreleri. İki OD modu vardır: damlacık spektral değerinin ortalama değerini hesaplayan efektif ortalama değer (değer yöntemi 1); ve damlacık spektral değerinin minimum değerini sinyal olarak alan minimum değer (değer yöntemi 2). 13. Uyarma (cihaz konfigürasyonu), emisyon dalga boyu (350-800 nm) ve temel spektral değer dahil olmak üzere floresan algılama kurulum parametreleri. 14. Algılama modu seçimi (OD / floresan yoğunluğu), inkübasyon sıcaklığı, inkübasyon süresi ve reaktif şişesindeki numunenin karıştırma hızı dahil olmak üzere sistem kurulum parametreleri. 15. Damlacık tanımlama ve numune toplama ayarları için parametreler. Kısaltmalar: MISS = Tek Hücreli Mikrolitre damlacık Kültürü Omik Sistemi; OD = optik yoğunluk. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Numune şişesinin ve hava kabarcığı çıkarıcının montajı. (A) MISS hücre numune şişesi. Mikrobiyal süspansiyon, numune ekleme pozisyonuna numune şişesine eklenir. Kapak hemen sıkılır ve hızlı bağlantı elemanları A ve B bağlanır. Son olarak, numune şişesi, MISS hücresi üzerindeki numune şişesi yerleşimine yerleştirilir. (B) Numune şişesinin montajı. Hızlı konektörler A ve B, sırasıyla MISS hücresindeki O3 bağlantı noktasına ve mikro boru ve damlacık oluşturma mikroakışkan çipinden gelen C3 konektörüne bağlanır. (C) Hava kabarcığı çıkarıcının montajı. Hava kabarcığı çıkarıcıyı takarken, hava kabarcığı çıkarma yağı içeren şişeyi takmadan önce kelebek şeklindeki vida kapaktan çıkarılır. Kısaltma: MISS = Tek Hücreli Mikrolitre damlacık Kültür Omik Sistemi Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
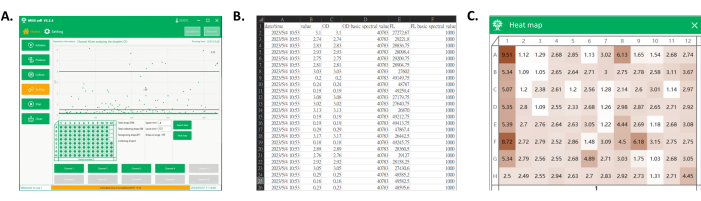
Şekil 4: Toplanan kuyu plakasının veri aktarımı ve ısı haritası. (A) Damlacık algılama ve toplama sırasında yazılımın ana arayüzü. Proses görüntüleme alanında, her bir damlacık sinyali gösterilir ve istenen aralıktaki damlacıklar kuyu plakasına toplanır. (B) Dışa aktarılan verilerin bir kısmının ekran görüntüsü. Dışa aktarılan veriler, toplanan damlacıkların spektral sinyalini (sütun C ve E) ve algılama sürelerini (sütun A) içerir. (C) Plakanın ısı haritasının ekran görüntüsü. Toplanan damlacıklardan gelen sinyallere dayanarak, değerler plakanın bir ısı haritasını elde etmek için normalleştirilir, bu daha sonra her bir klonun monoklonal suşlarının kültür performansını renge dayalı olarak ayırt etmek için kullanılabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: MISS hücresinde monoklonal izolasyon ve bağırsak mikroorganizmalarının kültivasyon sonuçları. (A) Bağırsak mikrobiyotasının izolasyonu, kültivasyonu ve tanımlanması için iş akışı şeması. İlk mikrobiyal süspansiyon, katı plaka yöntemi ve MISS hücre yöntemi, aynı bağırsak mikrobiyotasını izole etmek ve kültürlemek için kullanılır, ardından sıralama analizi yapılır. (B,D) Bağırsak mikrobiyotasının izolasyonu ve kültivasyonundan elde edilen monoklonal kolonilerin aile düzeyinde analizi, burada B Venn diyagramı analizini ve D topluluk kompozisyon analizini gösterir. (C,E) Bağırsak mikrobiyotasının izolasyonu ve kültivasyonundan elde edilen monoklonal kolonilerin cins düzeyinde analizi, burada C , Venn diyagramı analizini ve E , topluluk kompozisyon analizini gösterir. Kısaltma: MISS = Tek hücreli Mikrolitre damlacık Kültür Omik Sistemi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, otomatik ve yüksek verimli mikrobiyal monoklonal izolasyon, yetiştirme, tespit ve toplama için MISS hücresinin çalışmasını ana hatlarıyla belirtir. Bağırsak mikrobiyotasının sadece ~%20-30'unun izole edilebildiği ve kültürlenebildiğigeleneksel yöntemlerle karşılaştırıldığında 2,12, Omics sistemi kullanılarak elde edilen monoklonal klonların sayısı katı plakalardan elde edilenlerden 1,97 kat daha yüksekti. Bu karşılaştırma, MISS hücresinin tek hücre izolasyonu, monoklonal kültivasyon ve taramada avantajlara sahip olduğunu ortaya koymaktadır.
Tek hücreli izolasyon için, Omics sistemi Poisson dağılımına göre tek hücreli damlacıklar elde etti ve bu da iyi bir monoklonalite sağladı. Ek olarak, Omics sistemi 5.000 damlacık/saate kadar bir hızda damlacıklar üreterek, küçük damlacık boyutu nedeniyle reaktif tüketimini önemli ölçüde azaltırken yüksek verimli tek hücreli izolasyon sağlar. Damlacık üretimi sırasında, mikro boru üzerinde bir akış odaklama kanalı kullanıldı. Omics sistemi, yağ fazını, numune çözeltisini ve gazı akış odaklama kanalına itmek ve damlacıklar oluşturmak için enjeksiyon pompasını kullanır. Kullanıcılar, damlacıkların kanal aracılığıyla veya doğrudan damlacık borusuna bakarak başarılı bir şekilde üretilip üretilmediğini gözlemleyebilir. Mikro tüp ve damlacık üreten mikroakışkan çipten gelen silikon tüpler, 10 damlacık tüpünün ucuna bağlanır. Bir damlacık borusunda (~ 5.000 damlacık) yeterli damlacık oluştuğunda, sıkıştırma valfi borunun silikon tüplerini otomatik olarak sıkıştıracak ve damlacığı bir sonraki boruya oluşturmaya devam edecektir.
Monoklonal suş yetiştiriciliği için, damlacıklardaki mikroorganizmalar, düşük bollukta veya büyümesi zor suşlar için en uygun büyüme koşullarını sağlayarak mükemmel gaz değişim performansından, yüksek paralel yetiştirmeden ve verimli kütle transferinden yararlandı. Monoklonal suş taraması için, Omics sistemi floresan ve OD bazlı biyokütle tespitini destekledi, bu nedenle tespit mikrobiyal büyüme performansına ve ilgilenilen spesifik bir gen veya proteinin ekspresyon seviyesine dayanabilir13. Ayrıca, Omics sistemi, kuyu plakalarına yerçekimi kaynaklı damlacık biriktirme kullandı. Bu pasif tarama yöntemini bir salıncak kolu ile birleştirerek, kararlı ve son derece hassas damlacık taraması elde etti ve bu da onu biyo-dostu bir tarama platformu haline getirdi. Ayrıca, Omics sistemi, tek bir mikroorganizmanın izolasyonundan son klonal taramaya kadar tam otomatik bir süreç elde etti ve bu da işçilik ve zaman maliyetlerini azalttı.
Omics sisteminin performansı göz önüne alındığında, mikrobiyal kültür ve mikrobiyal mutajenez taramasının yanı sıra yüksek verimli suş seçimi ve anahtar fonksiyonel genlerin madenciliği gibi diğer uygulamalar için kullanılabilir6. Doğru deneysel sonuçlar elde etmek için araştırmacılar, izole edilecek, kültürlenecek ve taranacak türlere göre deney koşullarını optimize edebilir. İlk olarak, Omics sisteminde tek hücreli damlacıkların oluşturulması, düşük bir λ değerinin üretilen damlacıkların ağırlıklı olarak boş veya tek hücreli damlacıklar olmasını sağladığı Poisson dağılımını takip eder. Önceki çalışmamızda, Omik sistemde tek hücreli damlacıklar oluşturmak için optimal mikrobiyal konsantrasyon aralığını 16.8-69.7 hücre / mL (λ = 0.035-0.145) olarak doğruladık.6. Numune süspansiyonlarını hazırlarken, monoklonite doğruluğunu artırmak için bu konsantrasyon aralığında seyreltmek çok önemlidir. İkincisi, Omics sistemini kullanmadan önce, mikrobiyal büyüme koşullarını optimize etmek gerekir. Mikroorganizmanın oksijen gereksinimlerine bağlı olarak, araştırmacılar damlacık oluşumu için gaz fazı olarak nitrojen veya oksijeni seçebilirler. Üçüncüsü, damlacık tespiti sırasında, absorbans veya floresan, damlacıklar aydınlatıldıktan sonra alınan ışığın yoğunluğu ile belirlenir. Sonuç olarak, aynı numuneden elde edilen sayısal değerler, önceki çalışmamızda14 gözlemlendiği gibi, numune kalınlığındaki farklılıklar nedeniyle damlacık algılama ve spektrofotometre ölçümü arasında farklılık gösterebilir. Bu nedenle, deneyleri gerçekleştirmeden önce deney numuneleri için bir kalibrasyon eğrisi oluşturulması önerilir.
Ayrıca, yağ fazının hücrelere biyouyumluluğu da dahil olmak üzere memeli hücreleri gibi diğer türlerin uygulanmasına yönelik Omik sistemin performansını da iyileştiriyoruz (örneğin, florlu yağ daha yüksek gaz çözünürlüğüne sahiptir ve memeli hücre kültürü için daha uygundur15,16), iki fazlı akış hızının hücresel kesme kuvvetiüzerindeki etkisi 17, 18,19 ve damlacık boyutunun optimizasyonu13,20. Bu iyileştirmeler, Omics sisteminin hücre hattı geliştirme, tek B hücreli antikor taraması ve hibridoma antikor keşfi gibi biyomedikal araştırmalarda kullanımını önemli ölçüde kolaylaştırabilir. Omics sisteminin üç temel operasyonel modülüne (damlacık üretimi, yetiştirme ve tarama) dayanarak, araştırmacılar deneyin taleplerine göre uygun modülleri seçebilirler. Ek olarak, damlacık enjeksiyonu ve damlacık ayırma modülü, reaktif eklemesi gerçekleştirmek veya gerinim kitaplıkları oluşturmak için burada açıklanan sisteme eklenebilir.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma, Guangdong Eyaletinin kilit alanlarındaki Araştırma ve Geliştirme projeleri (2024B1111130002), Hebei Eyaleti Araştırma ve Geliştirme projeleri (22375503D) ve Endüstriyel Mikrobiyoloji Moleküler Islahı için Anhui Mühendislik Laboratuvarı Açılış Projesi (Grant ELMB-07) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Merck KGaA, Darmstadt, Germany | P5731-500EA | For solid plate preparation |
| 30 mL Stool Containers | Boen Healthcare Co., Ltd | 611101 | For collecting the stool samples |
| 37 °C constant temperature incubator | Shanghai Yiheng Technology Co., Ltd. | LRH-150 | Cultivate the solid plate in the incubator |
| 96-well Clear Flat Bottom Polystyrene TC-treated Microplates | Corning | 3599 | For well plate movement detection and droplet collection |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| Air bubble removal oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S-oil | The oil in the air bubble remover during droplet screening |
| Air bubble remover | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S | Exclude the gas phase between droplets before performing droplet detection and collection |
| Anaerobic bench | Argon and Nitrogen Space Equipment Business Department, Haiyu Town, Changshu City | VGB-4CM | For aseptic operation and UV sterilization under anaerobic condition |
| Autoclave | Puhexi Health and Medical Equipment Co., Ltd. | MLS-830L | For autoclaving BHI medium, EP tube, and so on. |
| Brain Heart Infusion (BHI) Broth | Qingdao High-tech Industrial Park Haibo Biotechnology Co., Ltd | HB8297-1 | Components of the BHI medium The ingredient list: 38.5 g/L BHI Broth in distilled water |
| Cell Spreader | Merck KGaA, Darmstadt, Germany | HS8151 | Inoculate the microbial solution onto the solid plate |
| Centrifuge tube, 15 mL | Beijing Xinhengyan Technology Co., Ltd | HB53397 | For microbial solution preparation |
| Computer | Lenovo | E450 | Software installation and MISS cell control |
| Cryovial | Thermo Fisher | 2.0 mL | For stool preservation |
| Distilled water | Beijing Mreda Technology Co., Ltd. | M306444-100ml | Add into humidifier to keep the humidity in droplet cultivation chamber |
| EP tube | Thermo Fisher | 2.0 mL | For collecting the stool samples |
| Fluorescent inverted microscope | Olympus Life Science (LS) | CKX53 | Check and calculate the microbial concentration |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| Hemocytometer | Acmec | AYA0810-1ea | Calculate the microbial concentration |
| KCl | Ambeed | A442876 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| KH2PO4 | MACKLIN | P815661 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| Mesh filter | Anping Jiufeng Wire Mesh Manufacturing Co., Ltd | 200 mesh (0.075 mm), 400 mesh (0.038 mm), 800 mesh (0.018 mm) | Remove undigested food and smaller particulate matter from the stool samples |
| Micro-tubing and droplet generation microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISC-B2 | For droplet generation and droplet incubation |
| MISS cell oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-BOS-B | The oil phase for droplet microfluidics |
| MISS cell software | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell V3.2.4 | Perform experimental operations on the MISS cell instrument |
| Na2HPO4 | Solarbio | D7292 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| NaCl | GENERAL-REAGENT | G81793J | Components of the physiological saline solution The ingredient list: 9 g/L NaCl in distilled water |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Polytetrafluoroethylene tube | Shenzhen WOER Heat-shrinkable Material Co., Ltd. | 3401000141 | For droplet incubation. This material was already included in micro-tubing and droplet generation microfluidic chip |
| Sample bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-bottle | Sampling of microbial solution |
| Single Cell Microliter-droplet Culture Omics System (MISS cell) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-G3f | Performing the microbial monoclonal isolation, cultivation, detection and collection |
| Superspeed Centrifuge | Thermo Fisher | Sorvall Lynx 4000 | Prepare the microbial solution for sequencing |
| Syringe | Jiangsu Zhiyu Medical Instructment Co., Ltd | 10 mL | Draw the distilled water and inject it into the humidifier in droplet cultivation chamber |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
Referanslar
- Hahn, M. W., Koll, U., Schmidt, J., Hurst, C. J. Isolation and cultivation of bacteria. The structure and function of aquatic microbial communities. , 313-351 (2019).
- Xu, M. Q., Pan, F., Peng, L. H., Yang, Y. S. Advances in the isolation, cultivation, and identification of gut microbes. Mil Med Res. 11 (1), 34 (2024).
- Lattermann, C., Büchs, J. Microscale and miniscale fermentation and screening. Curr Opin Biotechnol. 35, 1-6 (2015).
- Huang, Y., et al. High-throughput microbial culturomics using automation and machine learning. Nat Biotechnol. 41 (10), 1424-1433 (2023).
- Brehm-Stecher Byron, F., Johnson Eric, A. Single-cell microbiology: Tools, technologies, and applications. Microbiol Mol Biol Rev. 68 (3), 538-559 (2004).
- Jian, X., et al. Single-cell microliter-droplet screening system (miss cell): An integrated platform for automated high-throughput microbial monoclonal cultivation and picking. Biotechnol Bioeng. 120 (3), 778-792 (2023).
- Hu, B., et al. One cell at a time: Droplet-based microbial cultivation, screening and sequencing. Mar Life Sci Technol. 3 (2), 169-188 (2021).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-expanding the toolbox of microfluidic single-cell cultivations. J Mol Biol. 431 (23), 4569-4588 (2019).
- He, Z., Wu, H., Yan, X., Liu, W. Recent advances in droplet microfluidics for microbiology. Chinese Chemical Letters. 33 (4), 1729-1742 (2022).
- Kaminski, T. S., Garstecki, P. Controlled droplet microfluidic systems for multistep chemical and biological assays. Chem Soc Rev. 46 (20), 6210-6226 (2017).
- Sender, R., Fuchs, S., Milo, R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 164 (3), 337-340 (2016).
- Simrén, M., et al. Intestinal microbiota in functional bowel disorders: A rome foundation report. Gut. 62 (1), 159-176 (2013).
- Periyannan Rajeswari, P. K., Joensson, H. N., Andersson-Svahn, H. Droplet size influences division of mammalian cell factories in droplet microfluidic cultivation. Electrophoresis. 38 (2), 305-310 (2017).
- Jian, X., et al. Microbial microdroplet culture system (mmc): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnol Bioeng. 117 (6), 1724-1737 (2020).
- Baret, J. -. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Kubie, L. S. The solubility of O2, CO2, and N2 in mineral oil and the transfer of carbon dioxide from oil to air. J Biol Chem. 72 (2), 545-548 (1927).
- Poon, C. Measuring the density and viscosity of culture media for optimized computational fluid dynamics analysis of in vitro devices. J Mech Behav Biomed Mater. 126, 105024 (2022).
- Yao, J., Lin, F., Kim, H. S., Park, J. The effect of oil viscosity on droplet generation rate and droplet size in a t-junction microfluidic droplet generator. Micromachines. 10 (12), 808 (2019).
- Venkateshwarlu, A., Bharti, R. P. Effects of capillary number and flow rates on the hydrodynamics of droplet generation in two-phase cross-flow microfluidic systems. Journal of the Taiwan Institute of Chemical Engineers. 129, 64-79 (2021).
- Nekouei, M., Vanapalli, S. A. Volume-of-fluid simulations in microfluidic t-junction devices: Influence of viscosity ratio on droplet size. Physics of Fluids. 29, 032007 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır