Method Article
Culture et cueillette monoclonales microbiennes automatisées et à haut débit à l’aide du système omique de culture de gouttelettes de microlitres à cellule unique
Dans cet article
Résumé
Ce protocole décrit comment utiliser le système omiques de culture de gouttelettes de microlitres unicellulaires (cellule MISS) pour effectuer l’isolement, la culture et la cueillette monoclonales microbiennes. La cellule MISS réalise un flux de travail intégré basé sur la technologie microfluidique des gouttelettes, qui offre une excellente monodispersité des gouttelettes, une culture parallèle élevée et une détection de la biomasse à haut débit.
Résumé
Les cultures bactériennes pures sont essentielles pour l’étude de la culturomique microbienne. Les méthodes traditionnelles basées sur des plaques solides, des plaques de puits et des microréacteurs sont entravées par des procédures lourdes et un faible débit, ce qui entrave les progrès rapides de la recherche sur la culturomique microbienne. Pour relever ces défis, nous avons réussi à développer le système omiques de culture de gouttelettes de microlitres à cellule unique (cellule Miss), une plateforme automatisée à haut débit qui utilise la technologie microfluidique des gouttelettes pour l’isolement, la culture et le criblage des monoclonaux microbiens. Ce système peut générer un grand nombre de gouttelettes unicellulaires et cultiver, cribler et collecter des colonies monoclonales en peu de temps, facilitant ainsi un processus intégré allant de l’isolement microbien à la cueillette. Dans ce protocole, nous avons démontré son application en utilisant l’isolement et la culture du microbiote intestinal humain comme exemple et avons comparé l’efficacité de l’isolement microbien, les performances de la culture monoclonale et le débit de criblage à l’aide de la méthode de culture sur plaque solide. Le flux de travail expérimental était simple et la consommation de réactifs était très faible. Par rapport aux méthodes de culture sur plaque solide, la cellule MISS pourrait cultiver une plus grande diversité d’espèces de microbiote intestinal, offrant un potentiel et une valeur significatifs pour la recherche sur la culturomique microbienne.
Introduction
La culturomique microbienne a de nombreuses applications dans la recherche sur les microbes bénéfiques dans l’industrie alimentaire, la diversité des microbes environnementaux, le dépistage de nouveaux composés antimicrobiens et le microbiome humain en relation avec la maladie 1,2,3,4. Les méthodes traditionnelles, principalement basées sur des plaques solides, des plaques de puits ou des micro-réacteurs pour obtenir et prélever des colonies monoclonales, sont faciles à utiliser mais souffrent d’un faible débit en raison de leurs multiples étapes. Cette limitation entrave des applications telles que le criblage de mutagénèse microbienne, les études de culturomique microbienne et la sélection de colonies à haut rendement, qui nécessitent toutes un criblage monoclonal approfondi.
Récemment, divers dispositifs de détection et de distribution de cellules uniques ont été conçus pour améliorer considérablement la vitesse de traitement des échantillons microbiens, tout en réduisant la main-d’œuvre et en minimisant les erreurs de manipulation manuelle5. Cependant, ces instruments ne traitent généralement que des étapes spécifiques dans le cadre des méthodes traditionnelles, nécessitant souvent une intégration poussée de l’équipement, occupant un espace important et engageant des coûts élevés. Par conséquent, il était urgent de développer une plate-forme de culture et de criblage microbiens peu coûteuse et universellement applicable pour compenser les lacunes mentionnées ci-dessus.
Dans le cadre de nos travaux précédents, nous avons développé avec succès une plateforme de criblage automatisée à haut débit, connue sous le nom de Single-cell Microliter-droplet Culture Omics System (MISS cell, ci-après dénommée « le système Omics »)6. Cette plate-forme utilise la technologie microfluidique des gouttelettes, qui promet d’atteindre l’automatisation et l’intégration dans l’isolation, la culture et la cueillette microbiennes 7,8,9,10. Le système Omics comprend plusieurs modules clés, notamment un module d’échantillonnage, une puce microfluidique, un système de détection et de collecte de gouttelettes, permettant l’isolement, la culture, le criblage monoclonal et la collecte efficaces de cellules uniques dans la recherche en microbiologie. Nous avons déjà utilisé le système Omics pour réaliser un criblage par mutagénèse à haut débit de Corynebacterium glutamicum6.
En raison de l’automatisation et des capacités de criblage à haut débit du système omique, son application à la culturomique microbienne devrait permettre d’obtenir rapidement une grande quantité de données microbiennes. Dans ce protocole, nous avons introduit la procédure opérationnelle détaillée de la cellule MESL, avec l’isolement et la culture du microbiote intestinal humain comme exemple pour démontrer le processus d’isolement, de culture, de détection monoclonale et de criblage de cellules uniques microbiennes. Le fonctionnement du système Omics est simple, et les chercheurs n’ont qu’à suivre les instructions du logiciel pour l’installation séquentielle des microtubes et de la puce microfluidique de génération de gouttelettes, le réglage des paramètres et la préparation des échantillons.
Dans l’interface de fonctionnement du logiciel, le système Omics est divisé en trois fonctions principales : l’isolation, la culture et le dépistage. Les chercheurs peuvent sélectionner différentes étapes en fonction de l’expérience. De plus, lors de l’étape de criblage des gouttelettes, les chercheurs peuvent choisir entre deux modes de détection : le signal fluorescent ou la densité optique. Le logiciel permet de visualiser en temps réel le processus de dépistage des gouttelettes. Enfin, les chercheurs ont la possibilité de configurer des paramètres tels que les conditions de culture, la longueur d’onde détectée et le nombre de puits de collecte en fonction de leurs demandes expérimentales spécifiques, et ils peuvent mettre l’instrument en pause à tout moment pour effectuer d’autres opérations. La cellule MISS est une plate-forme de criblage monoclonal à haut débit, respectueuse des microbes, avec un fonctionnement simple et une consommation minimale de réactifs.
Protocole
Toutes les procédures d’étude sont conformes à toutes les réglementations éthiques en vigueur. Les procédures ont été approuvées par le Comité d’éthique des sciences et des technologies de l’Université Tsinghua. Pour l’étude du microbiote intestinal humain, des échantillons de selles ont été prélevés chez un adulte en bonne santé sans condition médicale importante, qui a donné un consentement éclairé écrit.
1. Installation de l’instrument
- Placez l’instrument du système Omics dans un environnement propre ou stérile (comme une salle stérile ou un banc anaérobie). L’instrument est un appareil de précision, et lorsque vous le placez dans l’installation, tenez compte de ce qui suit :
- Maintenez l’instrument à une pression et une température normales.
- Gardez l’instrument à l’écart des champs électriques puissants, des champs magnétiques et des sources de rayonnement thermique.
- Assurez-vous que la zone de placement de l’instrument dépasse les dimensions de 2 500 mm (P) x 1 500 mm (L) x 2 000 mm (H).
- Maintenez l’humidité ambiante de l’instrument en dessous de 60 %.
2. Préparatifs
- Mettez séquentiellement sous tension le système Omics, l’ordinateur et le logiciel d’exploitation du système Omics.
- Installation de micro-tubes de cellules MISS et de puces microfluidiques de génération de gouttelettes :
- Ouvrez la porte de la chambre de génération et de culture des gouttelettes (Figure 1A) et retirez verticalement le couvercle de protection de la puce microfluidique de génération de microtubes et de gouttelettes. À l’aide d’une seringue jetable, ajoutez 10 ml d’eau distillée stérile dans l’humidificateur à l’intérieur de la chambre de culture des gouttelettes (figure 1C) et réinstallez le couvercle de protection du microtube et de la puce microfluidique de génération de gouttelettes.
- Ouvrez l’emballage stérile de la puce microfluidique de génération de microtubes et de gouttelettes et placez-le verticalement directement au-dessus de la chambre de culture (Figure 1C).
- Sur l’interface du logiciel, cliquez sur Installation (Figure 2A). À ce stade, une fenêtre contextuelle s’affiche avec l’invite Confirmer le remplacement du micro-tube et de la puce microfluidique de génération de gouttelettes ? Cliquez sur Oui pour démarrer l’installation.
- Sortez l’extracteur de bulles d’air et fixez-le à l’envers sur le dissolvant d’air placé dans la chambre de génération de gouttelettes et de culture. Veillez à ne pas appuyer sur les tubes d’entrée et de sortie des gouttelettes de l’extracteur de bulles d’air (Figure 1E).
- Fixez le tube de sortie des gouttelettes de l’extracteur de bulles d’air à la vanne de serrage située en dessous de celui-ci et laissez-le passer à travers le trou qui est dirigé vers la chambre de détection et de collecte des gouttelettes (Figure 1B).
- Ouvrez la porte de la chambre de détection et de collecte des gouttelettes, insérez verticalement le tube de détection, déjà connecté au tube de sortie des gouttelettes, dans la prise de détection et assurez-vous que le tube de détection est complètement inséré (Figure 1D).
REMARQUE : Lors de l’insertion du tube de détection, insérez-le verticalement sans aucun coude sur le tube. - Serrez la vis qui fixe le tube de détection dans le sens des aiguilles d’une montre. Après avoir vérifié que le tube de détection est complètement inséré et sécurisé, fermez la porte de la chambre de détection et de collecte des gouttelettes.
- À partir de la puce microfluidique de génération de micro-tubes et de gouttelettes, il existe 10 tubes en silicone, chacun étiqueté avec un numéro (L01-L10). Connectez chaque tube étiqueté à la vanne de serrage numérotée correspondante (01-10) (Figure 1C).
- Connectez le connecteur rapide du micro-tube et de la puce microfluidique de génération de gouttelettes au port correspondant sur le système Omics : C1 à O1, C2 à O2, C4 à O4 et CF à OF.
REMARQUE : L’installation du micro-tube et de la puce microfluidique de génération de gouttelettes est terminée. C3 n’a pas besoin d’être connecté à O3. - Une fois l’installation de la puce microfluidique de génération de microtubes et de gouttelettes terminée, une fenêtre contextuelle s’affiche et indique que la vanne de serrage du tube de gouttelettes est ouverte. Cliquez sur OK lorsque l’installation de la puce microfluidique de génération de microtubes et de gouttelettes est terminée. Après vous être assuré que tous les tubes en silicone du micro-tube et de la puce microfluidique de génération de gouttelettes sont fixés à la vanne de serrage correspondante, cliquez sur OK.
- Initialisation de l’instrument
- Avant d’effectuer l’initialisation, cliquez sur l’interface de réglage (Figure 2B) pour configurer les paramètres pertinents : mode de détection (détection basée sur OD ou par fluorescence ; CO ici), la température d’incubation (37 °C) et le temps (30 jours = 720 h), la vitesse de l’agitateur (20 tr/min), la longueur d’onde de détection de la DO (600 nm) et la longueur d’onde d’excitation et d’émission de la détection de fluorescence.
REMARQUE : Les paramètres utilisés pour l’isolement et la culture du microbiote intestinal humain dans ce protocole sont indiqués entre parenthèses. Lors du réglage des paramètres, la température de culture doit être comprise entre 5 °C et 50 °C. Lors de la sélection du mode de détection, la fibre optique doit être remplacée si la fibre du module de détection de gouttelettes n’est pas la même (voir étape 2.3.2). Lors de la configuration des paramètres, la valeur de référence de la phase huileuse (spectrale de base) est automatiquement identifiée par le logiciel, ce qui élimine le besoin de réglages manuels. - Le remplacement de la fibre optique détectée
- Retirez la fibre détectée du support de fibre (dévissez la vis dans le sens inverse des aiguilles d’une montre) et desserrez la vis de fixation de la fibre sur le module de gouttelettes (Figure 1D).
- Si la fibre optique ne sera pas utilisée, retirez-la du module, insérez-la dans le support de fibre et serrez-la. Insérez la fibre détectée dans le port de détection et serrez la vis de fixation de la fibre sur le module. Le remplacement de la fibre optique est terminé.
- Tournez-vous vers l’interface d’accueil et cliquez sur Initialiser pour laisser le système Omics effectuer une auto-vérification de ses composants, y compris la pompe d’injection, les paramètres de température, le test de décharge des déchets liquides, le module de dépistage et le module de détection de gouttelettes.
- Lors de l’initialisation, effectuez un test de décharge des déchets liquides à partir du module de détection des gouttelettes en injectant 1 mL d’alcool à 75 % dans l’orifice des déchets liquides et en observant si le liquide s’écoule normalement.
- Pour le test du module de criblage, placez une plaque à 96 puits sur le placement de la plaque et observez si le mouvement de la plaque est normal.
- Avant d’effectuer l’initialisation, cliquez sur l’interface de réglage (Figure 2B) pour configurer les paramètres pertinents : mode de détection (détection basée sur OD ou par fluorescence ; CO ici), la température d’incubation (37 °C) et le temps (30 jours = 720 h), la vitesse de l’agitateur (20 tr/min), la longueur d’onde de détection de la DO (600 nm) et la longueur d’onde d’excitation et d’émission de la détection de fluorescence.
3. Génération de gouttelettes
- Collecte et traitement d’échantillons de microbiote intestinal humain
- Préparez un pot de chambre et des récipients pour les selles, lavez-vous les mains et portez des gants pour prélever des échantillons de selles fraîches.
REMARQUE : Lorsque vous prélevez des échantillons de selles, évitez autant que possible la contamination de l’urine. Il est préférable d’uriner au préalable et de placer les selles dans un récipient propre et sec. - Prélever de manière aseptique la quantité appropriée de selles du segment médian et les sceller dans des flacons cryogéniques stérilisés (environ 3 à 5 g par flacon). Placez immédiatement les flacons sur de la glace pour l’aliquotage et l’étiquetage.
REMARQUE : Si l’échantillon de selles est volumineux ou ne peut pas être prélevé immédiatement, il doit être prélevé dans les 2 heures au maximum. - Dans la paillasse anaérobie, utilisez un écouvillon stérile ou un outil de prélèvement de selles pour prélever un échantillon du segment médian.
REMARQUE : La couche superficielle des selles contient des cellules de la muqueuse intestinale éliminées et est sujette à la contamination externe ; après l’exposition à l’air, une partie de l’ADN microbien commence à se dégrader. - Transvaser les échantillons de selles prélevés dans des tubes de microcentrifugation stériles de 2 mL ou des cryoflacons stériles, chaque tube contenant de 0,5 à 2,0 g de selles. Préparez deux aliquotes pour la congélation par échantillon.
- Remettre en suspension l’échantillon de selles fraîches dans une solution saline physiologique stérile, avec chaque 100 mg de selles dilué dans 1 mL de solution. Mélangez soigneusement les selles jusqu’à ce qu’aucune grosse particule ne soit visible.
- Après une sédimentation naturelle de 10 min, filtrez séquentiellement le surnageant à travers des filtres à mailles stériles avec des pores de 200 mailles (0,075 mm), 400 mailles (0,038 mm) et 800 mailles (0,018 mm) pour éliminer les aliments non digérés et les particules plus petites. Enfin, collectez le filtrat dans des tubes à centrifuger stériles.
- Prélever 10 μL de suspension fécale filtrée et déterminer la concentration microbienne à l’aide d’un hémocytomètre et d’un microscope à fluorescence inversée.
REMARQUE : Après avoir filtré le surnageant de l’échantillon fécal à travers différentes tailles de mailles, il reste des particules fécales plus petites. Par conséquent, lors de la détermination de la concentration microbienne, les particules actives observées au microscope sont considérées comme des micro-organismes, ce qui ne permet qu’un calcul approximatif de la concentration microbienne. - Transférez la suspension fécale dans un tube à centrifuger stérile de 1,5 mL et étiquetez-le avec la date, la concentration microbienne et le nom de l’échantillon. Réservez-en une partie pour les expériences ultérieures et conservez le reste à 4 °C pour une utilisation future.
REMARQUE : Consigner rapidement les renseignements sur l’échantillon (nom de l’échantillon, heure de prélèvement) pour s’assurer que les échantillons sont prélevés en même temps (compte tenu des changements du rythme temporel microbien intestinal des mammifères). L’ensemble de la collecte et du traitement des échantillons doit être effectué dans un environnement anaérobie.
- Préparez un pot de chambre et des récipients pour les selles, lavez-vous les mains et portez des gants pour prélever des échantillons de selles fraîches.
- Préparation à la suspension fécale initiale
- Préparez le milieu du bouillon cerveau-cœur (BHI) selon le protocole du fabricant et stérilisez-le en autoclave à 121 °C pendant 15 min.
- Prendre la suspension fécale de l’étape 3.1.8 et effectuer des dilutions en série avec un milieu BHI pour obtenir une concentration de ~50 cellules/mL.
REMARQUE : Pour remplir le flacon d’échantillon, préparez au moins 40 ml de suspension fécale. - En vous assurant qu’une petite barre d’agitation magnétique se trouve au fond, versez la suspension fécale diluée dans le flacon d’échantillon jusqu’à la position d’ajout de l’échantillon. Vissez le capuchon et serrez-le. Ensuite, insérez le connecteur rapide A dans le connecteur rapide B pour terminer le processus de chargement de l’échantillon (Figure 3A).
- Placez le flacon d’échantillon dans la position désignée et séparez les raccords rapides A et B du flacon d’échantillon. Connectez le connecteur rapide A de la bouteille d’échantillon à l’orifice O3 du système Omics, et le connecteur C3 de la puce microfluidique de génération de microtubes et de gouttelettes se connecte au connecteur rapide B. Fermez la porte de la chambre de génération de gouttelettes et de culture (Figure 3B).
- Génération de gouttelettes
- Sélectionnez le nombre de tubes de gouttelettes à générer sur l’interface d’accueil du logiciel (Figure 2A).
REMARQUE : Chaque cycle peut produire jusqu’à 10 tubes de gouttelettes, chaque tube générant environ 5 000 gouttelettes. - Cliquez sur Produire dans l’interface d’accueil du logiciel pour démarrer la génération de gouttelettes à cellule unique.
REMARQUE : Confirmez si le refoulement de la pompe de vidange de liquide fonctionne ou non. Au cours de la génération de gouttelettes, chaque gouttelette a un volume de 2,0 μL. Voir la section de discussion pour une description de la génération de gouttelettes. - Attendez que l’alarme sonore indique que la génération des gouttelettes est terminée. Fermez la pince du connecteur C3 (Figure 1E) et retirez le flacon d’échantillon.
- Sélectionnez le nombre de tubes de gouttelettes à générer sur l’interface d’accueil du logiciel (Figure 2A).
4. Culture de gouttelettes
- Sélectionnez le même numéro de tube de gouttelettes que lors de la génération des gouttelettes sur l’interface d’accueil du logiciel, cliquez sur Culture, confirmez le temps et la température de culture et commencez le processus. Surveillez la barre de progression sur l’interface d’accueil qui indique la progression de la culture et le temps restant.
- Attendez que l’alarme sonore indique que la culture des gouttelettes est terminée. Si le temps de culture doit être prolongé, ajustez le temps directement sur l’interface de réglage .
5. Criblage de gouttelettes
- Appuyez sur le bouton UV du système Omics pour allumer la lumière ultraviolette (UV) (Figure 1A), irradier la chambre de détection et de collecte des gouttelettes pendant 30 min, puis éteindre la lumière UV.
REMARQUE : Avant d’allumer la lumière UV, assurez-vous que la porte de détection des gouttelettes et la chambre de collecte sont fermées. - Dans un banc super propre, ouvrez toutes les plaques à 96 puits utilisées pour recueillir les gouttelettes et empilez-les les unes sur les autres sans couvercles, en les numérotant séquentiellement de bas en haut. Assurez-vous que la plaque supérieure est recouverte d’un couvercle.
REMARQUE : Chaque cycle peut accueillir jusqu’à dix plaques de 96 puits, et le nombre de plaques dépend du nombre total de gouttelettes. - Ouvrez la porte de la chambre de détection et de collecte des gouttelettes, placez les plaques de puits dans les positions désignées (Figure 1D), retirez le couvercle de la plaque de puits supérieure et fermez la porte de la chambre.
- Allumez la lumière UV du système Omics pendant 30 minutes pour effectuer la stérilisation secondaire.
- Installation de l’extracteur de bulles d’air
- Retirez l’extracteur de bulles d’air de sa position de placement, dévissez le capuchon et retirez la vis en forme de papillon du capuchon (Figure 3C).
- Versez 200 ml d’huile d’élimination des bulles d’air dans l’extracteur de bulles d’air, vissez fermement la bouteille avec le bouchon de l’extracteur de bulles d’air sur le système Omics, puis fixez le dissolvant à l’envers sur l’emplacement de l’extracteur de bulles d’air. L’installation de l’extracteur de bulles d’air est terminée.
REMARQUE : Lors de la fixation du dissolvant de bulles d’air sur le placement, assurez-vous qu’aucune fuite d’huile ne s’échappe. En cas de fuite, serrez le couvercle.
- Sélectionnez le tube de gouttelettes à trier sur l’interface d’accueil , cliquez sur Tri, entrez le nombre de plaques de puits à collecter, puis démarrez le processus. Une fois le criblage des gouttelettes commencé, observez la zone d’affichage du processus, qui montre les mesures en temps réel de la densité optique des gouttelettes (DO) ou des valeurs de fluorescence.
- Analysez environ 20 à 30 gouttelettes pour vérifier la valeur OD. Par exemple, si la majorité d’entre eux ont une valeur de DO de ~0,2, ce qui correspond à la valeur de DO des gouttelettes vides, sur la base de la distribution de Poisson, définissez le seuil de DO inférieur à 0,5 et le seuil de DO supérieur à 4,0. Les gouttelettes à l’intérieur de cette plage seront automatiquement collectées en plaques de 96 puits (Figure 4A).
REMARQUE : Selon la loi de Beer-Lambert, la valeur de DO des gouttelettes vides est déterminée par la composition du milieu de culture à l’intérieur des gouttelettes. En règle générale, le seuil de DO inférieur est supérieur de 0,2 à 0,3 unité à la valeur de DO des gouttelettes vides afin d’assurer une distinction claire entre les gouttelettes vides et les gouttelettes contenant des micro-organismes. - Attendez que l’alarme sonore indique que le dépistage et la collecte des gouttelettes sont terminés. Ouvrez la porte de la chambre de détection et de collecte des gouttelettes, placez le couvercle de la plaque de puits sur la plaque de puits supérieure, puis sortez toutes les plaques de puits de la chambre ensemble pour effectuer le séquençage et la sauvegarde ultérieurs.
6. Exportation des données et affichage des cartes thermiques
- Cliquez sur Exporter les données pour enregistrer les données de signal de gouttelettes collectées (Figure 4A,B).
- Cliquez sur Carte thermique, sélectionnez le fichier de données de collecte des gouttelettes et observez les valeurs de DO des gouttelettes collectées dans la microplaque affichée par le logiciel. Visualisez ces valeurs de DO sous la forme d’une carte thermique, où l’intensité de la couleur correspond à la distribution de DO dans les puits, fournissant une représentation claire et intuitive des valeurs de DO monoclonales collectées (Figure 4A,C).
7. Nettoyage de la cellule MISS
- Une fois l’expérience terminée, sélectionnez le tube de gouttelettes à nettoyer, puis cliquez sur Nettoyer pour commencer le nettoyage de l’instrument.
8. Sauvegarde monoclonale microbienne et préparation de l’échantillon de séquençage
- Séquençage de la préparation des échantillons
- Dans la paillasse anaérobie, ajoutez 100 μL de milieu BHI dans chaque puits de la plaque de gouttelettes collectée, mélangez bien par pipetage, puis prélevez 10 μL de chaque puits et transférez le tout dans un tube stérile de 15 mL. Vortex pour obtenir une suspension microbienne mixte.
- Ajouter 5 ml de solution saline tamponnée au phosphate dans la suspension microbienne mixte, centrifuger à 1 000 × g pendant 10 min, retirer le surnageant et placer la pastille microbienne dans de l’azote liquide pour une congélation rapide. La préparation de l’échantillon de séquençage est terminée.
- Utilisez des méthodes de séquençage d’amplicon d’ADNr 16S ciblant le domaine V3 et V4 de l’ADNr 16S. Les amorces de séquençage spécifiques utilisées sont les suivantes : 341F : ACTCCTACGGGAGGCAGCA et 806R : GGACTACHVGGGTWTCTAAT.
- Cryoconservation d’échantillons monoclonaux microbiens :
- Après avoir prélevé 10 μL de l’échantillon de chaque puits dans les plaques de gouttelettes (à l’étape 8.1.1), ajoutez 30 μL de glycérol dans chaque puits. Placez les plaques à une température inférieure à -80 °C pour préserver les souches microbiennes.
Résultats
On estime que le microbiote intestinal humain, qui constitue la communauté microbienne prédominante, abrite environ 4 ×10 13 micro-organismes dans l’intestin, ce qui met en évidence son grand nombre et sa composition complexe11. Dans cette étude, nous avons cherché à isoler et à cultiver le microbiote intestinal et avons utilisé la méthode de la plaque solide comme contrôle pour démontrer les performances à haut débit de la cellule MISS.
Tout d’abord, nous avons utilisé la même suspension fécale pour comparer le débit d’isolement de cellules uniques des deux méthodes. Dans la cellule MELS, nous avons utilisé de faibles concentrations microbiennes, où la probabilité de distribution des micro-organismes dans les gouttelettes a pu être calculée sur la base de la distribution de Poisson : P(λ,x) = λx e-λ/x !, où λ est le nombre moyen de cellules sur les gouttelettes, qui peut être calculé en multipliant la concentration microbienne et le volume des gouttelettes ; x est le nombre de cellules encapsulées dans les gouttelettes. Ici, nous avons utilisé une concentration microbienne initiale en suspension de = 0,1 (la concentration microbienne initiale est de 50 cellules/ml et le volume des gouttelettes est de 2,0 μL), indiquant que la probabilité de gouttelettes vides, de gouttelettes unicellulaires et de gouttelettes multicellulaires est de 90,5 % (x = 0), 9,1 % (x = 1) et 0,4 % (x ≥ 2), respectivement.
Dans le système Omics, nous avons généré environ 30 000 gouttelettes à un taux de 5 000 gouttelettes/h et les avons cultivées dans six tubes en polytétrafluoroéthylène (D.E. 1,67 mm, D.I. 1,07 mm) pendant 30 jours. En fin de compte, nous avons examiné les gouttelettes à travers le module de détection en utilisant le mode de détection OD pour collecter des gouttelettes contenant des bactéries dans des plaques de 96 puits et avons obtenu 1 057 souches monoclonales cibles. En revanche, dans le cadre de la méthode de culture sur plaque solide, la concentration de la plaque de gélose solide était de 3,0 × 103 cellules/mL avec un total de dix boîtes de Pétri de 100 mm (chaque plaque contenant 100 μL de la suspension microbienne initiale). Après 30 jours de culture, 536 colonies ont été cueillies dans les plaques. Le système Omics a produit 1,97 fois plus de clones monoclonaux que la méthode de la plaque pleine. Cela indique que la culture monoclonale unicellulaire dans des gouttelettes microfluidiques peut isoler efficacement les micro-organismes tout en éliminant l’inhibition compétitive entre les colonies.
Ensuite, nous avons effectué une analyse de séquençage 16S sur toutes les souches monoclonales et comparé la diversité des espèces obtenue à partir des deux méthodes susmentionnées. En termes de diversité des espèces au niveau des familles, les mêmes 34 familles ont pu être enrichies par les deux méthodes. Plus précisément, le système omiques a enrichi quatre familles : Bacteroidales non classifiés, Bacillales Thermoactinomycetaceae, Burkholderiales Comamonadaceae et Enterobacterales non classifiés (figure 5B) et a facilement enrichi l’abondance inférieure de Clostridiales Family_XI, Clostridiales Acidaminococcaceae, Desulfovibrionales Desulfovibrionaceae et Enterobacterales Enterobacteriaceae dans la suspension microbienne d’origine (figure 5D).
Au niveau du genre, 74 genres microbiens ont pu être enrichis par les deux méthodes, tandis que la méthode cellulaire MISS a enrichi 13 genres microbiens : Bacillaceae Bacillus, Bacillaceae Oceanobacillus, Bacillaceae Pseudogracilibacillus, Thermoactinomycetaceae Kroppenstedtia, Peptoniphilaceae Phocea, Clostridiaceae Anaerosalibacter, Peptoniphilaceae Ezakiella, Peptoniphilaceae W5053, XI non classifié, Clostridiaceae Clostridioides, Comamonadaceae Pelomonas, et deux espèces microbiennes non classées (Figure 5C). Parmi eux, les genres Enterococcaceae Enterococcus et Acidaminococcaceae Phascolarctobacterium, qui étaient en plus faible abondance dans la suspension microbienne d’origine, ont été facilement enrichis à l’aide du système Omics (Figure 5E). Comme prévu, ces deux genres appartenaient respectivement à la famille des Enterococcaceae et des Acidaminococcaceae , où nous avons observé les mêmes résultats de l’analyse de la famille. Dans l’ensemble, au niveau de la famille et du genre, l’enrichissement en espèces de la méthode de culture cellulaire MISS a augmenté de 30,6 % et 37,9 %, respectivement, par rapport à la méthode de culture sur plaque solide. Ces résultats ont montré que la méthode de culture cellulaire MISS offrait de meilleures conditions de croissance pour les souches présentes en faibles proportions ou ayant de faibles performances de croissance dans la suspension microbienne d’origine.

Graphique 1: Structure et composants essentiels de la cellule MSL. (Un) Extérieur de la cellule MISS. 1. Génération de gouttelettes et chambre de culture, 2. Chambre de détection et de collecte des gouttelettes, 3. Boutons d’éclairage et UV de la chambre de collecte des gouttelettes. (B) Intérieur de la chambre de génération de gouttelettes et de culture. La génération de gouttelettes, l’incubation des gouttelettes et l’élimination des bulles d’air pour le criblage des gouttelettes sont effectuées dans cette chambre. 4. Chambre de culture de gouttelettes, 5. Vannes de serrage pour le serrage des tubes en silicone à partir de la puce microfluidique de génération de micro-tubes et de gouttelettes ; Les vannes de serrage sont numérotées séquentiellement de 1 à 10, de gauche à droite, 6. Placement du dissolvant de bulles d’air, 7. Orifices de génération et de criblage de gouttelettes (O1-O4) : l’huile, l’échantillon et la phase gazeuse sont connectés à la cellule MISS par ces ports. 8. Port de déchets (OF), 9. Vanne de serrage pour le serrage du tube de sortie des gouttelettes de l’extracteur de bulles d’air, 10. L’ouverture menant à la chambre de détection et de collecte des gouttelettes, 11. Placement de la bouteille d’échantillon ; Il y a un agitateur magnétique sous le placement, qui peut être utilisé pour contrôler la vitesse d’agitation de l’échantillon.(C) Vue aérienne de la chambre de culture des gouttelettes. À l’intérieur de la chambre, il y a un orifice d’entrée d’eau pour un humidificateur. Une seringue est utilisée pour ajouter 10 ml d’eau distillée stérile, le couvercle de protection et le micro-tube et la puce microfluidique de génération de gouttelettes sont installés, et les tubes en silicone du micro-tube sont fixés aux vannes de serrage correspondantes, comme le montre la figure de droite. 12. Un orifice d’entrée d’eau pour l’humidificateur dans la chambre de culture des gouttelettes, 13. La puce microfluidique de génération de micro-tubes et de gouttelettes. (D) Intérieur de la chambre de détection et de collecte des gouttelettes. L’image de gauche montre trois emplacements de plaque de puits et le bras robotique de manipulation déplaçant la plaque de puits entre les placements. L’image de droite montre la vue agrandie du module de détection et de collecte de gouttelettes (rectangle rouge sur l’image de gauche). Placement de 96 plaques de puits 14. avant, 15. pendant, et 16. après la collecte des gouttelettes. 17. Bras robotique de manutention de plaque à 96 puits. Lors de la détection et de la collecte des gouttelettes, le bras robotique déplace une plaque de 96 puits vers le placement de la plaque de puits près du module de détection de gouttelettes. Une fois la collecte des gouttelettes terminée, la plaque de puits est déplacée vers un autre endroit et la même opération est poursuivie jusqu’à ce que le processus soit terminé. 18. Module de détection et de collecte de gouttelettes. 19. Le support de fibre pour la fibre de détection. Il existe deux fibres de détection (la détection basée sur l’OD et la détection basée sur la fluorescence). Lorsqu’une fibre de détection est utilisée, l’autre est insérée dans le support de fibre. 20. Le tube de détection. Ce tube est déjà connecté au tube de sortie des gouttelettes de l’extracteur de bulles d’air. 21. La fibre de détection à base d’OD et la fibre de détection basée sur la fluorescence ; Les fibres de détection sont étiquetées avec leurs noms respectifs. 22. La fibre optique de la source lumineuse. 23. La prise de détection où le tube de détection est inséré. 24. La vis de fixation de la fibre pour fixer la fibre de détection. 25. La vis qui fixe le tube de détection. Serrez la vis après avoir correctement inséré le tube de détection dans le trou de détection. 26. Le port des déchets liquides. 27. Tube à déchets pour l’évacuation des gouttelettes en dehors du signal de collecte. (E) Installation du micro-tube, de la puce microfluidique de génération de gouttelettes et de l’extracteur de bulles d’air à l’emplacement correspondant. Les quatre tubes (C1, C2, C4 et CF) sont respectivement connectés aux ports correspondants de la cellule MISS. (O1, O2, O4 et OF). 28. Le couvercle de protection pour le micro-tube et la puce microfluidique de génération de gouttelettes. 29. Le dissolvant de bulles d’air. 30. Le tube d’entrée des gouttelettes vers l’extracteur de bulles d’air. 31. Le tube de sortie des gouttelettes du dissolvant de bulles d’air. 32. Vanne de serrage sur le connecteur C3. Abréviations : MISS = Single-cell Microliter-droplet Culture Omics System ; OD = densité optique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Interface du logiciel de fonctionnement de la cellule MISS. (A) L’interface d’accueil du logiciel. 1. Température dans la chambre de fonctionnement. 2. Interface de fonction. Il y a deux interfaces à utiliser : l’interface d’accueil et l’interface de paramétrage. 3. Boutons d’installation et de retrait de puces microfluidiques de génération de micro-tubes et de gouttelettes. 4. Sélection de fonction : vous avez le choix entre six fonctions : Initialiser, Produire, Culture, Trier, Arrêter et Nettoyer. 5. Zone d’affichage du processus : les informations de fonctionnement, le temps de fonctionnement et les données de gouttelettes collectées sont affichés dans cette zone. 6. Zone d’affichage de la plaque à 96 puits : affichage en temps réel du numéro de la plaque de collecte actuelle et de la position du puits de collecte des gouttelettes. 7. Affichez la zone de détection des gouttelettes et les données de collecte. 8. Tri du réglage des limites supérieures et inférieures et de la zone d’affichage du nombre de gouttelettes. La portée de la gouttelette collectée est réglée en fonction du signal de la gouttelette (OD / intensité fluorescente). Le système de cellules MISS compte le nombre total de gouttelettes collectées. 9. Boutons pour exporter les données de collection et afficher les cartes thermiques des plaques. 10. Zone de tube de gouttelettes. Sélectionnez le nombre de tubes à utiliser pour la génération de gouttelettes, le culture des gouttelettes, le criblage des gouttelettes et le nettoyage. (B) L’interface de réglage des paramètres du logiciel. 11. Affichage en temps réel des valeurs spectrales détectées lors du tri des gouttelettes (OD/intensité fluorescente). 12. Paramètres de configuration de la détection OD, y compris la longueur d’onde de détection, la valeur spectrale de base et le mode OD. Il existe deux modes OD : la valeur moyenne effective (méthode de valeur 1), qui calcule la valeur moyenne de la valeur spectrale de la gouttelette ; et la valeur minimale (méthode de valeur 2), qui prend la valeur minimale de la valeur spectrale de la gouttelette comme signal. 13. Paramètres de configuration de la détection de fluorescence, y compris l’excitation (configuration du dispositif), la longueur d’onde d’émission (350-800 nm) et la valeur spectrale de base. 14. Paramètres de configuration du système, y compris la sélection du mode de détection (OD/intensité fluorescente), la température d’incubation, le temps d’incubation et la vitesse d’agitation de l’échantillon dans la bouteille de réactif. 15. Paramètres d’identification des gouttelettes et de prélèvement d’échantillons. Abréviations : MISS = Single-cell Microliter-droplet Culture Omics System ; OD = densité optique. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Installation de la bouteille d’échantillon et de l’extracteur de bulles d’air. (A) La bouteille d’échantillon de la cellule MISS. La suspension microbienne est ajoutée à la bouteille d’échantillon à la position d’ajout de l’échantillon. Le couvercle est immédiatement serré et les connecteurs rapides A et B sont connectés. Enfin, la bouteille d’échantillon est placée dans le placement de la bouteille d’échantillon sur la cellule MISS. (B) L’installation de la bouteille d’échantillon. Les connecteurs rapides A et B sont connectés au port O3 de la cellule MISS et au connecteur C3 de la puce microfluidique de génération de microtubes et de gouttelettes, respectivement. (C) L’installation de l’extracteur de bulles d’air. Lors de l’installation de l’extracteur de bulles d’air, la vis en forme de papillon est d’abord retirée du couvercle avant d’installer la bouteille contenant l’huile d’élimination des bulles d’air. Abréviation : MISS = Single-cell Microliter-droplet Culture Omics System Veuillez cliquer ici pour voir une version agrandie de cette figure.
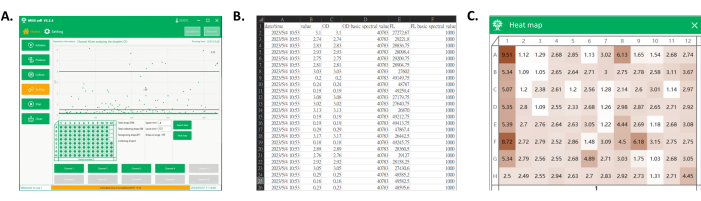
Figure 4 : Exportation des données et carte thermique de la plaque à puits collectée. (A) L’interface principale du logiciel pendant la détection et la collecte des gouttelettes. Dans la zone d’affichage du processus, chaque signal de gouttelettes est affiché et les gouttelettes dans la plage souhaitée sont collectées sur la plaque du puits. (B) Capture d’écran d’une partie des données exportées. Les données exportées comprennent le signal spectral des gouttelettes collectées (colonnes C et E) et leurs temps de détection (colonne A). (C) Capture d’écran de la carte thermique de la plaque. Sur la base des signaux des gouttelettes collectées, les valeurs sont normalisées pour obtenir une carte thermique de la plaque, qui pourrait être utilisée ultérieurement pour différencier les performances de culture des souches monoclonales de chaque clone en fonction de la couleur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Résultats de l’isolement monoclonal et de la culture de micro-organismes intestinaux dans la cellule MELS. (A) Schéma de travail pour l’isolement, la culture et l’identification du microbiote intestinal. La suspension microbienne initiale, la méthode de la plaque solide et la méthode des cellules MISS sont utilisées pour isoler et cultiver le même microbiote intestinal suivi d’une analyse de séquençage. (B,D) Analyse au niveau de la famille des colonies monoclonales obtenues à partir de l’isolement et de la culture du microbiote intestinal, où B montre l’analyse du diagramme de Venn et D montre l’analyse de la composition de la communauté. (C, E) Analyse au niveau du genre des colonies monoclonales obtenues à partir de l’isolement et de la culture du microbiote intestinal, où C montre l’analyse du diagramme de Venn et E montre l’analyse de la composition de la communauté. Abréviation : MISS = Single-cell Microliter-droplet Culture Omics System. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole décrit le fonctionnement de la cellule MISS pour l’isolement, la culture, la détection et la collecte monoclonaux microbiens automatisés et à haut débit. Par rapport aux méthodes traditionnelles par lesquelles seulement ~20 à 30 % du microbiote intestinal pouvait être isolé et cultivé 2,12, le nombre de clones monoclonaux obtenus à l’aide du système omiques était 1,97 fois plus élevé que ceux obtenus à partir de plaques solides. Cette comparaison révèle que la cellule MISS présente des avantages dans l’isolement unicellulaire, la culture monoclonale et le dépistage.
Pour l’isolement unicellulaire, le système Omics a obtenu des gouttelettes unicellulaires selon la distribution de Poisson, ce qui a assuré une bonne monoclonalité. De plus, le système Omics a généré des gouttelettes à une vitesse allant jusqu’à 5 000 gouttelettes/h, ce qui a permis d’isoler une seule cellule à haut débit tout en réduisant considérablement la consommation de réactifs en raison de la petite taille des gouttelettes. Au cours de la génération des gouttelettes, un canal de focalisation d’écoulement sur le micro-tube a été utilisé. Le système Omics utilise la pompe d’injection pour pousser la phase huileuse, la solution d’échantillon et le gaz dans le canal de focalisation de l’écoulement et former des gouttelettes. Les utilisateurs peuvent observer si les gouttelettes sont générées avec succès par le canal ou en regardant directement le tube de gouttelettes. Les tubes en silicone du micro-tube et de la puce microfluidique de génération de gouttelettes sont connectés à l’extrémité des 10 tubes de gouttelettes. Lorsqu’un nombre suffisant de gouttelettes sont générées dans un tube de gouttelettes (~5 000 gouttelettes), la vanne de serrage serre automatiquement les tubes en silicone du tube et continue à générer les gouttelettes dans le tube suivant.
Pour la culture de souches monoclonales, les micro-organismes présents dans les gouttelettes ont bénéficié d’excellentes performances d’échange gazeux, d’une culture parallèle élevée et d’un transfert de masse efficace, offrant des conditions de croissance optimales pour les souches peu abondantes ou difficiles à cultiver. Pour le criblage de souches monoclonales, le système Omics a pris en charge la détection de la biomasse basée sur la fluorescence et la DO grâce à laquelle la détection pourrait être basée sur les performances de croissance microbienne et le niveau d’expression d’un gène ou d’une protéine d’intérêtspécifique 13. De plus, le système Omics utilisait le dépôt de gouttelettes induit par la gravité dans les plaques de puits. En combinant cette méthode de criblage passif avec un bras oscillant, elle a permis d’obtenir un criblage de gouttelettes stable et très précis, ce qui en fait une plate-forme de criblage respectueuse de la biodiversité. De plus, le système Omics a réalisé un processus entièrement automatisé allant de l’isolement d’un seul micro-organisme au criblage clonal final, ce qui a réduit les coûts de main-d’œuvre et de temps.
Compte tenu des performances du système omiques, il pourrait être utilisé pour la culturomique microbienne et le criblage de la mutagénèse microbienne, ainsi que pour d’autres applications telles que la sélection de souches à haute production et l’exploitation de gènes fonctionnels clés6. Pour obtenir des résultats expérimentaux précis, les chercheurs peuvent optimiser les conditions expérimentales en fonction des espèces à isoler, à cultiver et à dépister. Tout d’abord, la génération de gouttelettes unicellulaires dans le système omiques suit la distribution de Poisson, où une faible valeur λ garantit que les gouttelettes générées sont principalement des gouttelettes vides ou unicellulaires. Dans nos travaux précédents, nous avons validé la plage de concentration microbienne optimale pour générer des gouttelettes unicellulaires dans le système omiques à 16,8-69,7 cellules/mL (λ = 0,035-0,145)6. Lors de la préparation de suspensions d’échantillons, il est crucial de diluer dans cette plage de concentration pour améliorer la précision de la monoclonalité. Deuxièmement, avant d’utiliser le système omique, il est nécessaire d’optimiser les conditions de croissance microbienne. En fonction des besoins en oxygène du micro-organisme, les chercheurs peuvent choisir l’azote ou l’oxygène comme phase gazeuse pour la génération de gouttelettes. Troisièmement, lors de la détection des gouttelettes, l’absorbance ou la fluorescence est déterminée par l’intensité de la lumière reçue après l’éclairage des gouttelettes. Par conséquent, les valeurs numériques obtenues à partir d’un même échantillon peuvent différer entre la détection de gouttelettes et la mesure par spectrophotomètre en raison de différences d’épaisseur d’échantillon, comme observé dans nos travaux précédents14. Par conséquent, il est recommandé d’établir une courbe d’étalonnage pour les échantillons expérimentaux avant de réaliser les expériences.
De plus, nous améliorons également les performances du système Omics à l’application d’autres espèces telles que les cellules de mammifères, y compris la biocompatibilité de la phase huileuse aux cellules (par exemple, l’huile fluorée a une solubilité gazeuse plus élevée et convient mieux à la culture de cellules de mammifères15,16), l’effet du débit diphasique sur la force de cisaillement cellulaire17, 18,19, et l’optimisation de la taille des gouttelettes13,20. Ces améliorations pourraient faciliter considérablement l’utilisation du système omiques dans la recherche biomédicale, comme le développement de lignées cellulaires, le dépistage d’anticorps à cellules B uniques et la découverte d’anticorps d’hybridomes. Sur la base des trois modules opérationnels de base du système omiques - génération de gouttelettes, culture et criblage - les chercheurs peuvent choisir les modules appropriés en fonction des exigences de l’expérience. De plus, le module d’injection et de séparation des gouttelettes peut être ajouté au système décrit dans le présent document pour effectuer l’ajout de réactifs ou établir des bibliothèques de souches.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Cette étude a été soutenue par les projets de recherche et développement dans des zones clés de la province du Guangdong (2024B1111130002), les projets de recherche et développement de la province du Hebei (22375503D) et le projet d’ouverture du laboratoire d’ingénierie de l’Anhui pour la sélection moléculaire de microbiologie industrielle (subvention ELMB-07).
matériels
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Merck KGaA, Darmstadt, Germany | P5731-500EA | For solid plate preparation |
| 30 mL Stool Containers | Boen Healthcare Co., Ltd | 611101 | For collecting the stool samples |
| 37 °C constant temperature incubator | Shanghai Yiheng Technology Co., Ltd. | LRH-150 | Cultivate the solid plate in the incubator |
| 96-well Clear Flat Bottom Polystyrene TC-treated Microplates | Corning | 3599 | For well plate movement detection and droplet collection |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| Air bubble removal oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S-oil | The oil in the air bubble remover during droplet screening |
| Air bubble remover | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S | Exclude the gas phase between droplets before performing droplet detection and collection |
| Anaerobic bench | Argon and Nitrogen Space Equipment Business Department, Haiyu Town, Changshu City | VGB-4CM | For aseptic operation and UV sterilization under anaerobic condition |
| Autoclave | Puhexi Health and Medical Equipment Co., Ltd. | MLS-830L | For autoclaving BHI medium, EP tube, and so on. |
| Brain Heart Infusion (BHI) Broth | Qingdao High-tech Industrial Park Haibo Biotechnology Co., Ltd | HB8297-1 | Components of the BHI medium The ingredient list: 38.5 g/L BHI Broth in distilled water |
| Cell Spreader | Merck KGaA, Darmstadt, Germany | HS8151 | Inoculate the microbial solution onto the solid plate |
| Centrifuge tube, 15 mL | Beijing Xinhengyan Technology Co., Ltd | HB53397 | For microbial solution preparation |
| Computer | Lenovo | E450 | Software installation and MISS cell control |
| Cryovial | Thermo Fisher | 2.0 mL | For stool preservation |
| Distilled water | Beijing Mreda Technology Co., Ltd. | M306444-100ml | Add into humidifier to keep the humidity in droplet cultivation chamber |
| EP tube | Thermo Fisher | 2.0 mL | For collecting the stool samples |
| Fluorescent inverted microscope | Olympus Life Science (LS) | CKX53 | Check and calculate the microbial concentration |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| Hemocytometer | Acmec | AYA0810-1ea | Calculate the microbial concentration |
| KCl | Ambeed | A442876 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| KH2PO4 | MACKLIN | P815661 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| Mesh filter | Anping Jiufeng Wire Mesh Manufacturing Co., Ltd | 200 mesh (0.075 mm), 400 mesh (0.038 mm), 800 mesh (0.018 mm) | Remove undigested food and smaller particulate matter from the stool samples |
| Micro-tubing and droplet generation microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISC-B2 | For droplet generation and droplet incubation |
| MISS cell oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-BOS-B | The oil phase for droplet microfluidics |
| MISS cell software | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell V3.2.4 | Perform experimental operations on the MISS cell instrument |
| Na2HPO4 | Solarbio | D7292 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| NaCl | GENERAL-REAGENT | G81793J | Components of the physiological saline solution The ingredient list: 9 g/L NaCl in distilled water |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Polytetrafluoroethylene tube | Shenzhen WOER Heat-shrinkable Material Co., Ltd. | 3401000141 | For droplet incubation. This material was already included in micro-tubing and droplet generation microfluidic chip |
| Sample bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-bottle | Sampling of microbial solution |
| Single Cell Microliter-droplet Culture Omics System (MISS cell) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-G3f | Performing the microbial monoclonal isolation, cultivation, detection and collection |
| Superspeed Centrifuge | Thermo Fisher | Sorvall Lynx 4000 | Prepare the microbial solution for sequencing |
| Syringe | Jiangsu Zhiyu Medical Instructment Co., Ltd | 10 mL | Draw the distilled water and inject it into the humidifier in droplet cultivation chamber |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
Références
- Hahn, M. W., Koll, U., Schmidt, J., Hurst, C. J. Isolation and cultivation of bacteria. The structure and function of aquatic microbial communities. , 313-351 (2019).
- Xu, M. Q., Pan, F., Peng, L. H., Yang, Y. S. Advances in the isolation, cultivation, and identification of gut microbes. Mil Med Res. 11 (1), 34 (2024).
- Lattermann, C., Büchs, J. Microscale and miniscale fermentation and screening. Curr Opin Biotechnol. 35, 1-6 (2015).
- Huang, Y., et al. High-throughput microbial culturomics using automation and machine learning. Nat Biotechnol. 41 (10), 1424-1433 (2023).
- Brehm-Stecher Byron, F., Johnson Eric, A. Single-cell microbiology: Tools, technologies, and applications. Microbiol Mol Biol Rev. 68 (3), 538-559 (2004).
- Jian, X., et al. Single-cell microliter-droplet screening system (miss cell): An integrated platform for automated high-throughput microbial monoclonal cultivation and picking. Biotechnol Bioeng. 120 (3), 778-792 (2023).
- Hu, B., et al. One cell at a time: Droplet-based microbial cultivation, screening and sequencing. Mar Life Sci Technol. 3 (2), 169-188 (2021).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-expanding the toolbox of microfluidic single-cell cultivations. J Mol Biol. 431 (23), 4569-4588 (2019).
- He, Z., Wu, H., Yan, X., Liu, W. Recent advances in droplet microfluidics for microbiology. Chinese Chemical Letters. 33 (4), 1729-1742 (2022).
- Kaminski, T. S., Garstecki, P. Controlled droplet microfluidic systems for multistep chemical and biological assays. Chem Soc Rev. 46 (20), 6210-6226 (2017).
- Sender, R., Fuchs, S., Milo, R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 164 (3), 337-340 (2016).
- Simrén, M., et al. Intestinal microbiota in functional bowel disorders: A rome foundation report. Gut. 62 (1), 159-176 (2013).
- Periyannan Rajeswari, P. K., Joensson, H. N., Andersson-Svahn, H. Droplet size influences division of mammalian cell factories in droplet microfluidic cultivation. Electrophoresis. 38 (2), 305-310 (2017).
- Jian, X., et al. Microbial microdroplet culture system (mmc): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnol Bioeng. 117 (6), 1724-1737 (2020).
- Baret, J. -. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Kubie, L. S. The solubility of O2, CO2, and N2 in mineral oil and the transfer of carbon dioxide from oil to air. J Biol Chem. 72 (2), 545-548 (1927).
- Poon, C. Measuring the density and viscosity of culture media for optimized computational fluid dynamics analysis of in vitro devices. J Mech Behav Biomed Mater. 126, 105024 (2022).
- Yao, J., Lin, F., Kim, H. S., Park, J. The effect of oil viscosity on droplet generation rate and droplet size in a t-junction microfluidic droplet generator. Micromachines. 10 (12), 808 (2019).
- Venkateshwarlu, A., Bharti, R. P. Effects of capillary number and flow rates on the hydrodynamics of droplet generation in two-phase cross-flow microfluidic systems. Journal of the Taiwan Institute of Chemical Engineers. 129, 64-79 (2021).
- Nekouei, M., Vanapalli, S. A. Volume-of-fluid simulations in microfluidic t-junction devices: Influence of viscosity ratio on droplet size. Physics of Fluids. 29, 032007 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon