Method Article
زراعة وقطف وحيدة النسيلة الميكروبية الآلية وعالية الإنتاجية باستخدام نظام Omics لزراعة قطرات الميكرولتر أحادية الخلية
In This Article
Summary
يصف هذا البروتوكول كيفية استخدام نظام أوميكسات ثقافة قطرات ميكرولتر أحادية الخلية (خلية MISS) لإجراء عزل وحيدة النسيلة الميكروبية وزراعتها وقطفها. تحقق خلية MISS سير عمل متكاملا يعتمد على تقنية الموائع الدقيقة للقطرات ، والتي توفر تشتت أحادي ممتاز للقطرات ، وزراعة متوازية عالية ، واكتشاف الكتلة الحيوية عالية الإنتاجية.
Abstract
تعتبر الثقافات البكتيرية النقية ضرورية لدراسة الثقافات الميكروبية. يتم إعاقة الطرق التقليدية القائمة على الألواح الصلبة وألواح الآبار والمفاعلات الدقيقة بسبب الإجراءات المرهقة والإنتاجية المنخفضة ، مما يعيق التقدم السريع لأبحاث الثقافات الميكروبية. لمواجهة هذه التحديات ، نجحنا في تطوير نظام Omics لزراعة قطرات الميكرولتر أحادية الخلية (MISS cell) ، وهو عبارة عن منصة آلية عالية الإنتاجية تستخدم تقنية الموائع الدقيقة للقطرات لعزل وحيدة النسيلة الميكروبية وزراعتها وفحصها. يمكن لهذا النظام توليد عدد كبير من القطرات أحادية الخلية وزراعة المستعمرات وحيدة النسيلة وفحصها وجمعها في وقت قصير ، مما يسهل عملية متكاملة من العزل الميكروبي إلى الانتقاء. في هذا البروتوكول ، أظهرنا تطبيقه باستخدام عزل وزراعة ميكروبات الأمعاء البشرية كمثال وقارنا كفاءة العزل الميكروبي ، وأداء الثقافة أحادية النسيلة ، وإنتاجية الفحص باستخدام طريقة زراعة الصفيحة الصلبة. كان سير العمل التجريبي بسيطا ، وكان استهلاك الكاشف منخفضا جدا. بالمقارنة مع طرق زراعة الصفائح الصلبة ، يمكن لخلية MISS أن تزرع تنوعا أكبر من أنواع الجراثيم الأمعاء ، مما يوفر إمكانات وقيمة كبيرة لأبحاث التثقيف الميكروبي.
Introduction
للثقافة الميكروبية تطبيقات واسعة في البحث عن الميكروبات المفيدة في صناعة الأغذية ، وتنوع الميكروبات البيئية ، وفحص المركبات الجديدة المضادة للميكروبات ، والميكروبيوم البشري فيما يتعلق بالمرض1،2،3،4. الطرق التقليدية ، التي تعتمد بشكل أساسي على الألواح الصلبة أو ألواح الآبار أو المفاعلات الدقيقة للحصول على مستعمرات وحيدة النسيلة واختيارها ، سهلة التشغيل ولكنها تعاني من إنتاجية منخفضة بسبب خطواتها المتعددة. يعيق هذا القيد تطبيقات مثل فحص الطفرات الميكروبية ، ودراسات الثقافات الميكروبية ، واختيار المستعمرات عالية الإنتاج ، وكلها تتطلب فحصا أحادي النسيلة مكثفا.
في الآونة الأخيرة ، تم تصميم العديد من أجهزة الكشف والتوزيع أحادية الخلية لتعزيز سرعة معالجة العينات الميكروبية بشكل كبير ، مع تقليل العمالة وتقليل الأخطاء الناتجة عن المناولة اليدوية5. ومع ذلك، فإن هذه الصكوك لا تتناول عادة سوى خطوات محددة ضمن الطرق التقليدية، وغالبا ما تتطلب تكاملا واسعا للمعدات، وتشغل مساحة كبيرة، وتتكبد تكاليف عالية. لذلك ، كانت هناك حاجة ملحة لتطوير استزراع ميكروبي منخفض التكلفة وقابل للتطبيق عالميا ومنصة للفحص للتعويض عن أوجه القصور المذكورة أعلاه.
في عملنا السابق ، نجحنا في تطوير منصة فحص آلية عالية الإنتاجية ، تعرف باسم نظام Omics لزراعة قطرات ميكرولتر أحادية الخلية (خلية MISS ، المشار إليها فيما يلي باسم "نظام Omics")6. تستخدم هذه المنصة تقنية الموائع الدقيقة بالقطرات ، والتي تبشر بتحقيق الأتمتة والتكامل في عزل الميكروبات وزراعتها وقطفها7،8،9،10. يشتمل نظام Omics على العديد من الوحدات الرئيسية ، بما في ذلك وحدة أخذ العينات ، ورقاقة الموائع الدقيقة ، ونظام الكشف عن القطرات وجمعها ، مما يتيح عزل خلية واحدة بكفاءة ، وزراعة ، وفحص أحادي النسيلة ، والتجميع في أبحاث علم الأحياء الدقيقة. لقد استخدمنا بالفعل نظام Omics لتحقيق فحص الطفرات عالي الإنتاجية ل Corynebacterium glutamicum6.
نظرا للأتمتة وقدرات الفحص عالية الإنتاجية لنظام Omics ، من المتوقع أن يؤدي تطبيقه على الثقافات الميكروبية إلى الحصول بسرعة على كمية كبيرة من البيانات الميكروبية. في هذا البروتوكول ، قدمنا الإجراء التشغيلي التفصيلي لخلية MISS ، مع عزل وزراعة ميكروبات الأمعاء البشرية كمثال لإثبات عملية عزل الخلية الميكروبية المفردة ، والزراعة ، والكشف عن أحادي النسيلة ، والفحص. تشغيل نظام Omics بسيط ، ويحتاج الباحثون فقط إلى اتباع اتجاه البرنامج للتثبيت المتسلسل للأنابيب الدقيقة ورقاقة الموائع الدقيقة لتوليد القطرات ، وإعدادات المعلمات ، وإعداد العينة.
في واجهة تشغيل البرنامج ، ينقسم نظام Omics إلى ثلاث وظائف رئيسية - العزل والزراعة والفحص. يمكن للباحثين تحديد مراحل مختلفة وفقا للتجربة. علاوة على ذلك ، خلال مرحلة فحص القطرات ، يمكن للباحثين الاختيار من بين وضعين للكشف: إشارة الفلورسنت أو الكثافة البصرية. يوفر البرنامج تصورا في الوقت الفعلي لعملية فحص القطرات. أخيرا ، يتمتع الباحثون بالمرونة لتكوين معلمات مثل ظروف الاستزراع ، والطول الموجي المكتشف ، وعدد آبار التجميع بناء على متطلباتهم التجريبية المحددة ، ويمكنهم إيقاف الأداة مؤقتا في أي وقت لتنفيذ عمليات أخرى. خلية MISS عبارة عن منصة فحص أحادية النسيلة صديقة للميكروبات وعالية الإنتاجية مع تشغيل بسيط واستهلاك أقل كاشف.
Protocol
جميع إجراءات الدراسة متوافقة مع جميع اللوائح الأخلاقية ذات الصلة. تمت الموافقة على الإجراءات من قبل لجنة أخلاقيات العلوم والتكنولوجيا بجامعة تسينغهوا. لدراسة ميكروبات الأمعاء البشرية ، تم جمع عينات البراز من شخص بالغ يتمتع بصحة جيدة ليس لديه حالات طبية كبيرة ، والذي أعطى موافقة خطية مستنيرة.
1. تركيب الصك
- ضع أداة نظام Omics في بيئة نظيفة أو معقمة (مثل غرفة معقمة أو مقعد لاهوائي). الأداة عبارة عن جهاز دقيق ، وعند وضعه في المنشأة ، ضع في اعتبارك ما يلي:
- حافظ على الجهاز تحت الضغط ودرجة الحرارة العادية.
- احتفظ بالجهاز بعيدا عن المجالات الكهربائية القوية والمجالات المغناطيسية ومصادر الإشعاع الحراري.
- تأكد من أن مساحة وضع الجهاز تتجاوز أبعاد 2,500 مم (عمق) × 1,500 مم (عرض) × 2,000 مم (ارتفاع).
- حافظ على الرطوبة البيئية للأداة أقل من 60٪.
2. الاستعدادات
- قم بتشغيل الطاقة بشكل تسلسلي لنظام Omics والكمبيوتر وبرنامج تشغيل نظام Omics.
- تركيب رقاقة الموائع الدقيقة لخلية MISS وتوليد القطرات:
- افتح باب غرفة توليد القطرات وزراعتها (الشكل 1 أ) وقم بإزالة الغطاء الواقي عموديا للأنابيب الدقيقة ورقاقة الموائع الدقيقة لتوليد القطارات. استخدم حقنة يمكن التخلص منها لإضافة 10 مل من الماء المقطر المعقم إلى المرطب داخل غرفة زراعة القطرات (الشكل 1 ج) وأعد تثبيت الغطاء الواقي للأنابيب الدقيقة ورقاقة الموائع الدقيقة لتوليد القطارات.
- افتح العبوة المعقمة لشريحة الموائع الدقيقة لتوليد الأنابيب الدقيقة والقطرات وضعها عموديا فوق غرفة الزراعة مباشرة (الشكل 1 ج).
- على واجهة البرنامج ، انقر فوق التثبيت (الشكل 2 أ). في هذه المرحلة ، تظهر نافذة منبثقة مع المطالبة ، تأكيد استبدال الأنابيب الدقيقة وشريحة الموائع الدقيقة لتوليد القطرات؟ انقر فوق نعم لبدء التثبيت.
- أخرج مزيل فقاعات الهواء وثبته رأسا على عقب على وضع مزيل فقاعة الهواء في غرفة توليد القطرات والزراعة. احرص على عدم الضغط على أنابيب مدخل ومخرج القطرات لمزيل فقاعة الهواء (الشكل 1E).
- قم بتوصيل أنبوب مخرج القطرات لمزيل فقاعة الهواء بصمام التثبيت الموجود تحته واتركه يمر عبر الفتحة ، والتي يتم توجيهها إلى غرفة الكشف عن القطرات وجمعها (الشكل 1 ب).
- افتح باب غرفة الكشف عن القطرات وجمعها ، وأدخل أنبوب الكشف عموديا ، المتصل بالفعل بأنبوب مخرج القطرات ، في مقبس الكشف ، وتأكد من إدخال أنبوب الكشف بالكامل (الشكل 1 د).
ملاحظة: عند إدخال أنبوب الكشف ، أدخله عموديا دون أي انحناءات على الأنبوب. - شد المسمار الذي يثبت أنبوب الكشف في اتجاه عقارب الساعة. بعد التأكد من إدخال أنبوب الكشف وتأمينه بالكامل ، أغلق باب غرفة الكشف عن القطرات وجمعها.
- من رقاقة الموائع الدقيقة لتوليد الأنابيب الدقيقة والقطرات ، هناك 10 أنابيب سيليكون ، كل منها مكتوب برقم (L01-L10). قم بتوصيل كل أنبوب مسمى بصمام المشبك المرقم المقابل (01-10) (الشكل 1C).
- قم بتوصيل الموصل السريع من شريحة الموائع الدقيقة لتوليد الأنابيب الدقيقة والقطرات بالمنفذ المقابل في نظام Omics: C1 إلى O1 و C2 إلى O2 و C4 إلى O4 و CF إلى OF.
ملاحظة: اكتمل تركيب رقاقة الموائع الدقيقة لتوليد الأنابيب الدقيقة والقطرات. لا يحتاج C3 إلى الاتصال ب O3. - بعد اكتمال تركيب رقاقة الموائع الدقيقة لتوليد الأنابيب الدقيقة والقطرات ، تظهر نافذة منبثقة تطالب بفتح صمام تثبيت أنابيب القطرات. انقر فوق "موافق " عند اكتمال تركيب رقاقة الموائع الدقيقة لتوليد الأنابيب الدقيقة والقطرات. بعد التأكد من توصيل جميع أنابيب السيليكون من الأنابيب الدقيقة ورقاقة الموائع الدقيقة لتوليد القطرات بصمام المشبك المقابل ، انقر فوق موافق.
- تهيئة الأداة
- قبل إجراء التهيئة ، انقر فوق واجهة الإعداد (الشكل 2 ب) لتكوين المعلمات ذات الصلة: وضع الكشف (الكشف المستند إلى OD أو الكشف المستند إلى التألق ؛ OD هنا) ، ودرجة حرارة الحضانة (37 درجة مئوية) والوقت (30 يوما = 720 ساعة) ، وسرعة المحرض (20 دورة في الدقيقة) ، والطول الموجي للكشف عن OD (600 نانومتر) ، والإثارة والطول الموجي للانبعاث للكشف عن التألق.
ملاحظة: يتم إعطاء المعلمات المستخدمة لعزل وزراعة ميكروبات الأمعاء البشرية في هذا البروتوكول بين قوسين. عند ضبط المعلمات ، يجب أن تكون درجة حرارة الزراعة بين 5 درجات مئوية و 50 درجة مئوية. عند تحديد وضع الكشف، يجب استبدال الألياف الضوئية إذا لم تكن الألياف الموجودة في وحدة الكشف عن القطرات متشابهة (انظر الخطوة 2.3.2). عند تكوين المعلمات ، يتم تحديد القيمة المرجعية لطور الزيت (الطيف الأساسي) تلقائيا بواسطة البرنامج ، مما يلغي الحاجة إلى التعديلات اليدوية. - استبدال الألياف الضوئية المكتشفة
- قم بإزالة الألياف المكتشفة من حامل الألياف (قم بفك عكس اتجاه عقارب الساعة) وفك برغي تثبيت الألياف في وحدة القطرات (الشكل 1D).
- إذا لم يتم استخدام الألياف الضوئية ، فقم بإزالتها من الوحدة ، وأدخلها في حامل الألياف ، واربطها. أدخل الألياف المكتشفة في منفذ الكشف ، وشد برغي تثبيت الألياف على الوحدة. تم الانتهاء من استبدال الألياف الضوئية.
- انتقل إلى واجهة الصفحة الرئيسية وانقر فوق تهيئة للسماح لنظام Omics بإجراء فحص ذاتي لمكوناته، بما في ذلك مضخة الحقن وإعدادات درجة الحرارة واختبار تفريغ نفايات السوائل ووحدة الفرز ووحدة الكشف عن القطرات.
- أثناء التهيئة ، قم بإجراء اختبار تصريف نفايات السوائل من وحدة الكشف عن القطرات عن طريق حقن 1 مل من الكحول بنسبة 75٪ في منفذ نفايات السائل ومراقبة ما إذا كان السائل يتدفق بشكل طبيعي.
- لاختبار وحدة الفرز ، ضع لوحة 96 بئرا على موضع اللوحة ولاحظ ما إذا كانت حركة اللوحة طبيعية.
- قبل إجراء التهيئة ، انقر فوق واجهة الإعداد (الشكل 2 ب) لتكوين المعلمات ذات الصلة: وضع الكشف (الكشف المستند إلى OD أو الكشف المستند إلى التألق ؛ OD هنا) ، ودرجة حرارة الحضانة (37 درجة مئوية) والوقت (30 يوما = 720 ساعة) ، وسرعة المحرض (20 دورة في الدقيقة) ، والطول الموجي للكشف عن OD (600 نانومتر) ، والإثارة والطول الموجي للانبعاث للكشف عن التألق.
3. توليد القطرات
- جمع ومعالجة عينات ميكروبات الأمعاء البشرية
- قم بإعداد وعاء الغرفة وحاويات البراز ، واغسل يديك ، وارتد القفازات لجمع عينات البراز الطازجة.
ملاحظة: عند جمع عينات البراز ، تجنب تلوث البول قدر الإمكان. من الأفضل التبول مسبقا ، ووضع البراز في وعاء نظيف وجاف. - اجمع الكمية المناسبة من البراز المتوسط بشكل معقم وأغلقه في كريمات معقمة (حوالي 3-5 جم لكل قارورة). ضع القوارير على الثلج على الفور لتصنيفها ووضع العلامات عليها لاحقا.
ملاحظة: إذا كانت عينة البراز كبيرة أو لا يمكن جمعها على الفور ، فيجب جمعها في غضون ساعتين على الأكثر. - في المقعد اللاهوائي ، استخدم مسحة معقمة أو أداة أخذ عينات من البراز لجمع عينة من الجزء المتوسط.
ملاحظة: تحتوي الطبقة السطحية للبراز على خلايا غشاء مخاطية معوية متساقطة وعرضة للتلوث الخارجي. بعد التعرض للهواء ، يبدأ بعض الحمض النووي الميكروبي في التحلل. - انقل عينات البراز التي تم جمعها إلى أنابيب طرد مركزي دقيقة معقمة سعة 2 مل أو كريوفيالات معقمة ، مع احتواء كل أنبوب على 0.5-2.0 جم من البراز. قم بإعداد حصتين للتجميد لكل عينة.
- أعد تعليق عينة البراز الطازج في محلول ملحي فسيولوجي معقم ، مع تخفيف كل 100 مجم من البراز في 1 مل من المحلول. امزج البراز جيدا حتى لا تظهر جزيئات كبيرة.
- بعد الترسيب الطبيعي لمدة 10 دقائق ، قم بتصفية المادة الطافية بالتتابع من خلال مرشحات شبكية معقمة بأحجام مسام تبلغ 200 شبكة (0.075 مم) و 400 شبكة (0.038 مم) و 800 شبكة (0.018 مم) لإزالة الطعام غير المهضوم والجسيمات الأصغر. أخيرا ، اجمع المرشح في أنابيب الطرد المركزي المعقمة.
- خذ 10 ميكرولتر من معلق البراز المصفى وحدد التركيز الميكروبي باستخدام مقياس كثافة الدم والمجهر الفلوري المقلوب.
ملاحظة: بعد تصفية المادة الطافية لعينة البراز من خلال أحجام شبكية مختلفة ، تبقى بعض جزيئات البراز الأصغر. لذلك ، عند تحديد التركيز الميكروبي ، تعتبر الجسيمات النشطة التي لوحظت تحت المجهر كائنات دقيقة ، مما يسمح فقط بحساب تقريبي للتركيز الميكروبي. - انقل معلق البراز إلى أنبوب طرد مركزي معقم سعة 1.5 مل وقم بتسميه بالتاريخ والتركيز الميكروبي واسم العينة. احتفظ ببعضها للتجارب اللاحقة ، وقم بتخزين الباقي عند 4 درجات مئوية كاستخدام مستقبلي.
ملاحظة: قم بتسجيل معلومات العينة على الفور (اسم العينة ، وقت التجميع) لضمان جمع العينات في نفس الوقت (مع الأخذ في الاعتبار تغيرات الإيقاع الزمني الميكروبي للأمعاء في الثدييات). يجب أن يتم جمع العينات ومعالجتها بالكامل في بيئة لاهوائية.
- قم بإعداد وعاء الغرفة وحاويات البراز ، واغسل يديك ، وارتد القفازات لجمع عينات البراز الطازجة.
- التحضير لتعليق البراز الأولي
- قم بإعداد وسط مرق قلب الدماغ (BHI) وفقا لبروتوكول الشركة المصنعة وتعقيمه عن طريق التعقيم عند 121 درجة مئوية لمدة 15 دقيقة.
- خذ تعليق البراز من الخطوة 3.1.8 وقم بإجراء عمليات تخفيف تسلسلية مع وسط BHI لتحقيق تركيز ~ 50 خلية / مل.
ملاحظة: لملء زجاجة العينة ، قم بإعداد 40 مل على الأقل من تعليق البراز. - تأكد من وجود قضيب تحريك مغناطيسي صغير في الأسفل ، اسكب تعليق البراز المخفف في زجاجة العينة حتى وضع إضافة العينة. اربط الغطاء وشده. بعد ذلك ، أدخل الموصل السريع A في الموصل السريع B لإكمال عملية تحميل العينة (الشكل 3 أ).
- ضع زجاجة العينة في الموضع المحدد وافصل الموصلات السريعة A و B عن زجاجة العينة. قم بتوصيل الموصل السريع A لزجاجة العينة بمنفذ O3 في نظام Omics ، ويتصل الموصل C3 الموجود على الأنابيب الدقيقة ورقاقة الموائع الدقيقة بالموصل السريع B. أغلق باب غرفة توليد القطرات وزراعتها (الشكل 3 ب).
- توليد القطرات
- حدد العدد المطلوب من أنابيب القطرات التي سيتم إنشاؤها على الواجهة الرئيسية للبرنامج (الشكل 2 أ).
ملاحظة: يمكن أن ينتج كل تشغيل ما يصل إلى 10 أنابيب قطرات ، حيث يولد كل أنبوب ما يقرب من 5,000 قطرة. - انقر فوق إنتاج في الواجهة الرئيسية للبرنامج لبدء إنشاء قطرات أحادية الخلية.
ملاحظة: تأكد مما إذا كان تفريغ مضخة نفايات السوائل يعمل أم لا. أثناء توليد القطرات ، يبلغ حجم كل قطرة 2.0 ميكرولتر. راجع قسم المناقشة للحصول على وصف لتوليد القطرات. - انتظر حتى يشير إنذار الصافرة إلى انتهاء توليد القطرات. أغلق المشبك الموجود على موصل C3 (الشكل 1E) وقم بإزالة زجاجة العينة.
- حدد العدد المطلوب من أنابيب القطرات التي سيتم إنشاؤها على الواجهة الرئيسية للبرنامج (الشكل 2 أ).
4. زراعة القطرات
- حدد نفس رقم أنابيب القطرات كما هو الحال أثناء إنشاء القطرات على الواجهة الرئيسية للبرنامج ، وانقر فوق الثقافة ، وقم بتأكيد وقت الزراعة ودرجة الحرارة ، وابدأ العملية. راقب شريط التقدم على الواجهة المنزلية الذي يوضح تقدم الزراعة والوقت المتبقي.
- انتظر حتى يشير إنذار الصافرة إلى أن زراعة القطرات قد انتهت. إذا كان يجب تمديد وقت الزراعة ، فاضبط الوقت مباشرة على واجهة الإعداد .
5. فحص القطرات
- اضغط على زر الأشعة فوق البنفسجية في نظام Omics لتشغيل ضوء الأشعة فوق البنفسجية (الشكل 1 أ) ، وقم بإشعاع غرفة الكشف عن القطرات وجمعها لمدة 30 دقيقة ، ثم قم بإيقاف تشغيل ضوء الأشعة فوق البنفسجية.
ملاحظة: قبل تشغيل ضوء الأشعة فوق البنفسجية ، تأكد من إغلاق باب غرفة الكشف عن القطرات وجمعها. - في مقعد فائق النظافة ، افتح جميع الألواح المكونة من 96 بئرا المستخدمة لجمع القطرات وتكديسها فوق بعضها البعض بدون أغطية ، وترقيمها بالتتابع من الأسفل إلى الأعلى. تأكد من تغطية لوحة البئر العلوية بغطاء.
ملاحظة: يمكن أن تستوعب كل جولة ما يصل إلى عشر ألواح سعة 96 بئرا ، ويعتمد عدد الألواح على العدد الإجمالي للقطرات. - افتح باب غرفة الكشف عن القطرات وجمعها ، ضع ألواح البئر في المواضع المحددة (الشكل 1 د) ، وأخرج الغطاء من لوحة البئر العلوية ، وأغلق باب الغرفة.
- قم بتشغيل ضوء الأشعة فوق البنفسجية على نظام Omics لمدة 30 دقيقة لإجراء التعقيم الثانوي.
- تركيب مزيل فقاعة الهواء
- قم بإزالة مزيل فقاعة الهواء من موضع وضعه ، وفك الغطاء ، وقم بإزالة المسمار على شكل فراشة من الغطاء (الشكل 3C).
- صب 200 مل من زيت إزالة فقاعة الهواء في مزيل فقاعة الهواء ، وقم بربط الزجاجة بإحكام بغطاء مزيل فقاعة الهواء على نظام Omics ، ثم قم بتثبيت المزيل رأسا على عقب على موضع مزيل فقاعة الهواء. اكتمل تركيب مزيل فقاعة الهواء.
ملاحظة: عند تثبيت مزيل فقاعة الهواء على الموضع ، تأكد من عدم تسرب الزيت. في حالة حدوث أي تسرب ، شد الغطاء.
- حدد أنبوب القطرات للفرز على الواجهة الرئيسية ، وانقر فوق فرز ، وأدخل عدد ألواح البئر المراد جمعها ، ثم ابدأ العملية. بعد بدء فحص القطيرات ، راقب منطقة عرض العملية ، والتي تعرض قياسات في الوقت الفعلي للكثافة البصرية للقطرات (OD) أو قيم التألق.
- قم بتحليل ما يقرب من 20-30 قطرة للتحقق من قيمة OD. على سبيل المثال ، إذا وجد أن الأغلبية لها قيمة OD ~ 0.2 ، والتي تتوافق مع قيمة OD للقطرات الفارغة ، بناء على توزيع Poisson ، فقم بتعيين عتبة OD السفلية على 0.5 ، وعتبة OD العليا على 4.0. سيتم جمع القطرات ضمن هذا النطاق تلقائيا في 96 لوحة بئر (الشكل 4 أ).
ملاحظة: وفقا لقانون Beer-Lambert ، يتم تحديد قيمة OD للقطرات الفارغة من خلال تكوين وسط الثقافة داخل القطرات. عادة ما يتم تعيين عتبة OD الدنيا أعلى بمقدار 0.2-0.3 وحدة من قيمة OD للقطرات الفارغة لضمان التمييز الواضح بين القطرات الفارغة والقطرات المحتوية على الكائنات الحية الدقيقة. - انتظر حتى يشير إنذار الصافرة إلى الانتهاء من فحص القطرات وجمعها. افتح باب غرفة الكشف عن القطرات وجمعها ، ضع غطاء لوحة البئر على لوحة البئر العلوية ، ثم أخرج جميع ألواح البئر من الغرفة معا لإجراء التسلسل والنسخ الاحتياطي اللاحق.
6. تصدير البيانات وعرض خرائط الحرارة
- انقر فوق تصدير البيانات لحفظ بيانات إشارة القطرة التي تم جمعها (الشكل 4 أ ، ب).
- انقر فوق خريطة الحرارة ، وحدد ملف بيانات جمع القطرات ، ولاحظ قيم OD للقطرات التي تم جمعها في الصفيحة الدقيقة التي يعرضها البرنامج. تصور قيم OD هذه كخريطة حرارية ، حيث تتوافق شدة اللون مع توزيع OD عبر الآبار ، مما يوفر تمثيلا واضحا وبديهايا لقيم OD أحادية النسيلة المجمعة (الشكل 4 أ ، ج).
7. تنظيف خلية MISS
- بعد الانتهاء من التجربة، حدد أنبوب القطرات الذي يتطلب التنظيف، وانقر فوق تنظيف لبدء تنظيف الأدوات.
8. النسخ الاحتياطي أحادي النسيلة الميكروبي وإعداد عينة التسلسل
- إعداد عينة التسلسل
- في المقعد اللاهوائي ، أضف 100 ميكرولتر من وسط BHI إلى كل بئر من صفيحة القطرات المجمعة ، واخلطها جيدا عن طريق سحب العينات ، ثم خذ 10 ميكرولتر من كل بئر وانقلها كلها إلى أنبوب معقم واحد سعة 15 مل. دوامة للحصول على تعليق ميكروبي مختلط.
- أضف 5 مل من المحلول الملحي المخزن بالفوسفات إلى المعلق الميكروبي المختلط ، وجهاز الطرد المركزي عند 1,000 × جم لمدة 10 دقائق ، وقم بإزالة المادة الطافية ، ووضع الحبيبات الميكروبية في النيتروجين السائل للتجميد السريع. اكتمل إعداد عينة التسلسل.
- استخدم طرق تسلسل amplicon 16S rDNA التي تستهدف المجال V3 و V4 ل 16S rDNA. بادئات التسلسل المحددة المستخدمة هي كما يلي: 341F: ACTCCTACGGGAGGCAGCA و 806R: GGACTACHVGGGTWTCTAAT.
- حفظ عينة ميكروبية أحادية النسيلة بالتبريد:
- بعد جمع 10 ميكرولتر من العينة من كل بئر في ألواح القطرات (من الخطوة 8.1.1) ، أضف 30 ميكرولتر من الجلسرين إلى كل بئر. ضع الألواح تحت -80 درجة مئوية للحفاظ على السلالة الميكروبية.
النتائج
تشير التقديرات إلى أن ميكروبات الأمعاء البشرية ، التي تشكل المجتمع الميكروبي السائد ، تحتوي على ما يقرب من 4 × 1013 كائنا دقيقا في الأمعاء ، مما يعرض أعدادها الهائلة وتكوينها المعقد11. في هذه الدراسة ، هدفنا إلى عزل وزراعة ميكروبات الأمعاء واستخدمنا طريقة الصفيحة الصلبة كعنصر تحكم لإثبات الأداء عالي الإنتاجية لخلية MISS.
أولا ، استخدمنا نفس تعليق البراز لمقارنة إنتاجية عزل الخلية المفردة لكلتا الطريقتين. في خلية MISS ، استخدمنا تركيزات ميكروبية منخفضة ، حيث يمكن حساب احتمال توزيع الكائنات الحية الدقيقة في القطرات بناء على توزيع بواسون: P (λ ، x) = λx e-λ / x! ، حيث λ هو متوسط عدد الخلايا فوق القطرات ، والذي يمكن حسابه بضرب التركيز الميكروبي وحجم القطرات ؛ x هو عدد الخلايا المغلفة في القطرات. هنا ، استخدمنا تركيز معلق ميكروبي أولي = 0.1 (التركيز الميكروبي الأولي هو 50 خلية / مل وحجم القطرات 2.0 ميكرولتر) ، مما يشير إلى احتمال حدوث قطرات فارغة ، وقطرات أحادية الخلية ، وقطرات متعددة الخلايا هي 90.5٪ (x = 0) ، 9.1٪ (x = 1) ، و 0.4٪ (x ≥ 2) ، على التوالي.
في نظام Omics ، أنتجنا ما يقرب من 30,000 قطرة بمعدل 5,000 قطرة / ساعة وزرعناها في ستة أنابيب بولي تترافلورو إيثيلين (OD 1.67 مم ، معرف 1.07 مم) لمدة 30 يوما. في النهاية ، قمنا بفحص القطرات من خلال وحدة الكشف باستخدام وضع الكشف OD لجمع القطرات المحتوية على البكتيريا في ألواح 96 بئرا وحصلنا على 1,057 سلالة أحادية النسيلة المستهدفة. في المقابل ، من خلال طريقة زراعة الألواح الصلبة ، كان تركيز صفيحة الأجار الصلبة 3.0 × 103 خلايا / مل مع ما مجموعه عشرة أطباق بتري 100 مم (كل صفيحة بها 100 ميكرولتر من المعلق الميكروبي الأولي). بعد 30 يوما من الزراعة ، تم قطف 536 مستعمرة من اللوحات. أنتج نظام Omics استنساخا أحادي النسيلة بمقدار 1.97 ضعفا أكثر من طريقة اللوحة الصلبة. يشير هذا إلى أن الزراعة أحادية النسيلة أحادية الخلية في قطرات الموائع الدقيقة يمكن أن تعزل الكائنات الحية الدقيقة بشكل فعال مع القضاء على التثبيط التنافسي بين المستعمرات.
بعد ذلك ، أجرينا تحليل تسلسل 16S على جميع السلالات أحادية النسيلة وقارنا تنوع الأنواع الذي تم الحصول عليه من الطريقتين المذكورتين أعلاه. من حيث تنوع الأنواع على مستوى الأسرة ، يمكن إثراء نفس العائلات ال 34 عبر كلتا الطريقتين. على وجه التحديد ، قام نظام Omics بإثراء أربع عائلات: Bacteroidales غير المصنفة ، و Bacillales Thermoactinomycetaceae ، و Burkholderiales Comamonadaceae ، و Enterobacterales غير المصنف (الشكل 5 ب) وأثرى بسهولة الوفرة المنخفضة من Clostridiales Family_XI و Clostridiales acidaminococcaceae و Desulfovibrionales Desulfovibrionaceae و Enterobacterales Enterobacteriaceae في المعلق الميكروبي الأصلي (الشكل 5 د).
على مستوى الجنس ، يمكن إثراء 74 جنسا ميكروبيا بكلتا الطريقتين ، في حين أن طريقة خلية MISS إثراء 13 جنسا ميكروبيا: Bacillaceae Bacillus ، Bacillaceae Oceanobacillus ، Bacillaceae Pseudogracilibacillus ، Thermoactinomycetaceae Kroppenstedtia ، Peptoniphilaceae Phocea ، Clostridiaceae Anaerosalibacter ، Peptoniphilaceae Ezakiella ، Peptoniphilaceae W5053 ، XI غير مصنف ، Clostridiaceae Clostridioides ، Comamonadaceae Pelomonas ، ونوعان من الميكروبات غير المصنفة (الشكل 5 ج). من بينها ، تم إثراء الأجناس Enterococcaceae Enterococcus و Acidaminococcaceae Phascolarctobacterium ، التي كانت منخفضة الوفرة في المعلق الميكروبي الأصلي ، بسهولة باستخدام نظام Omics (الشكل 5E). كما هو متوقع ، ينتمي هذان الجنسان إلى عائلة Enterococcaceae و Acidaminococcaceae ، على التوالي ، حيث لاحظنا نفس النتائج من تحليل الأسرة. بشكل عام ، على مستوى الأسرة والجنس ، زاد تخصيب الأنواع بطريقة زراعة الخلايا MISSS بنسبة 30.6٪ و 37.9٪ على التوالي ، مقارنة بطريقة زراعة الصفائح الصلبة. أظهرت هذه النتائج أن طريقة زراعة الخلايا MISS وفرت ظروف نمو أفضل لتلك السلالات التي كانت موجودة بنسب منخفضة أو كان أداء نمو ضعيف في المعلق الميكروبي الأصلي.

الشكل 1الهيكل والمكونات الأساسية لخلية MISS.: (A) الجزء الخارجي من خلية MISS. 1. غرفة توليد وزراعة القطرات ، 2. غرفة الكشف عن القطرات وجمعها ، 3. أزرار الإضاءة والأشعة فوق البنفسجية لغرفة جمع القطرات. (B) داخل غرفة توليد القطرات والزراعة. يتم إجراء توليد القطرات وحضانة القطرات وإزالة الفقاعات الهوائية لفحص القطيرات في هذه الغرفة. 4. غرفة زراعة القطرات ، 5. صمامات التثبيت لتثبيت أنابيب السيليكون من الأنابيب الدقيقة ورقاقة الموائع الدقيقة لتوليد القطرات ؛ يتم ترقيم صمامات التثبيت بالتتابع من 1 إلى 10 ، من اليسار إلى اليمين ، 6. وضع مزيل فقاعات الهواء ، 7. منافذ توليد القطرات والغربلة (O1-O4): يتم توصيل طور الزيت والعينة والغاز بخلية MISS من خلال هذه المنافذ. 8. ميناء النفايات (OF) ، 9. صمام لقط لتثبيت أنبوب مخرج القطرات لمزيل فقاعة الهواء ، 10. الفتحة المؤدية إلى غرفة الكشف عن القطرات وجمعها ، 11. وضع زجاجة العينة ؛ يوجد محرك مغناطيسي أسفل الموضع، والذي يمكن استخدامه للتحكم في سرعة تحريك العينة.(C) منظر علوي لغرفة زراعة القطرات. يوجد داخل الغرفة منفذ مدخل مياه لجهاز الترطيب. يتم استخدام حقنة لإضافة 10 مل من الماء المقطر المعقم ، ويتم تثبيت الغطاء الواقي ورقاقة الموائع الدقيقة للأنابيب الدقيقة والقطرات ، ويتم تثبيت أنابيب السيليكون من الأنابيب الدقيقة على صمامات المشبك المقابلة ، كما هو موضح في الشكل الموجود على اليمين. 12. منفذ مدخل المياه للمرطب في غرفة زراعة القطرات ، 13. رقاقة الموائع الدقيقة لتوليد الأنابيب الدقيقة والقطرات. (D) داخل غرفة الكشف عن القطرات وجمعها. تظهر الصورة الموجودة على اليسار ثلاثة مواضع لألواح البئر والذراع الروبوتية للمناولة التي تحرك لوحة البئر بين المواضع. تظهر الصورة الموجودة على اليمين طريقة العرض المكبرة لوحدة اكتشاف القطرات وجمعها (مستطيل أحمر في الصورة على اليسار). وضع 96 لوحة بئر 14. قبل ، 15. أثناء, و 16. بعد جمع القطرات. 17. 96 ذراع آلي للتعامل مع لوحة البئر. أثناء اكتشاف القطرات وجمعها ، يقوم الذراع الآلي بتحريك صفيحة واحدة مكونة من 96 بئرا إلى موضع لوحة البئر بالقرب من وحدة الكشف عن القطرات. بعد اكتمال جمع القطرات ، يتم نقل لوحة البئر إلى موضع آخر وتستمر نفس العملية حتى تكتمل العملية. 18. وحدة الكشف عن القطرات وجمعها. 19. حامل الألياف لألياف الكشف. هناك نوعان من ألياف الكشف (الكشف القائم على OD والكشف القائم على الفلورة). عند استخدام إحدى ألياف الكشف ، يتم إدخال الأخرى في حامل الألياف. 20. أنبوب الكشف. هذا الأنبوب متصل بالفعل بأنبوب مخرج القطرات لمزيل فقاعة الهواء. 21. ألياف الكشف القائمة على OD والقائمة على التألق ؛ يتم تصنيف ألياف الكشف بأسمائها الخاصة. 22. الألياف الضوئية لمصدر الضوء. 23. مقبس الكشف حيث يتم إدخال أنبوب الكشف. 24. برغي تثبيت الألياف لتأمين ألياف الكشف. 25. المسمار الذي يؤمن أنبوب الكشف. شد المسمار بعد إدخال أنبوب الكشف في فتحة الكشف بشكل صحيح. 26. ميناء نفايات السائل. 27. أنبوب النفايات لتفريغ القطرات خارج إشارة التجميع. (E) تركيب الأنابيب الدقيقة ، رقاقة الموائع الدقيقة لتوليد القطرات ، ومزيل فقاعات الهواء في الموضع المقابل. ترتبط الأنابيب الأربعة (C1 و C2 و C4 و CF) على التوالي بالمنافذ المقابلة لخلية MISS. (O1 و O2 و O4 و OF). 28. الغطاء الواقي للأنابيب الدقيقة وشريحة الموائع الدقيقة لتوليد القطرات. 29. مزيل فقاعة الهواء. 30. أنبوب مدخل القطرات إلى مزيل فقاعة الهواء. 31. أنبوب مخرج القطرات من مزيل فقاعة الهواء. 32. صمام لقط على موصل C3. الاختصارات: MISS = نظام أوميكسات ثقافة قطرات ميكرولتر أحادية الخلية ؛ OD = الكثافة البصرية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: واجهة برنامج التشغيل لخلية MISS. (أ) الواجهة الرئيسية للبرنامج. 1. درجة الحرارة في غرفة العملية. 2. واجهة الوظيفة. هناك واجهتان للعمل: واجهة المنزل وواجهة إعداد المعلمات. 3. أزرار تركيب وإزالة رقاقة الموائع الدقيقة لتوليد الأنابيب الدقيقة. 4. اختيار الوظيفة: هناك ست وظائف للاختيار من بينها: التهيئة ، والإنتاج ، والثقافة ، والفرز ، والإيقاف ، والتنظيف. 5. منطقة عرض العملية: يتم عرض معلومات التشغيل ووقت التشغيل وبيانات القطرات التي تم جمعها في هذه المنطقة. 6. منطقة عرض لوحة 96 جيدا: عرض في الوقت الحقيقي لرقم لوحة التجميع الحالي وموضع بئر جمع القطرات. 7. عرض منطقة الكشف عن القطرات وجمع البيانات. 8. فرز إعداد الحد العلوي والسفلي ومنطقة عرض عدد القطرات. يتم ضبط نطاق القطرة المجمعة وفقا لإشارة القطرة (OD / شدة الفلورسنت). يحسب نظام الخلايا MISS إجمالي عدد القطرات التي تم جمعها. 9. أزرار لتصدير بيانات التجميع وعرض خرائط الحرارة للوحات. 10. منطقة أنابيب القطرات. حدد عدد الأنابيب التي سيتم تشغيلها لتوليد القطرات وزراعة القطرات وفحص القطرات والتنظيف. (ب) واجهة إعداد المعلمات للبرنامج. 11. عرض في الوقت الحقيقي للقيم الطيفية المكتشفة أثناء فرز القطرات (OD / شدة الفلورسنت). 12. معلمات إعداد الكشف عن OD ، بما في ذلك الطول الموجي للكشف والقيمة الطيفية الأساسية ووضع OD. هناك نوعان من أساليب OD: القيمة المتوسطة الفعالة (طريقة القيمة 1) ، والتي تحسب القيمة المتوسطة للقيمة الطيفية للقطرات. والقيمة الدنيا (طريقة القيمة 2) ، والتي تأخذ الحد الأدنى للقيمة الطيفية للقطرة كإشارة. 13. معلمات إعداد الكشف عن التألق ، بما في ذلك الإثارة (تكوين الجهاز) ، والطول الموجي للانبعاث (350-800 نانومتر) ، والقيمة الطيفية الأساسية. 14. معلمات إعداد النظام ، بما في ذلك اختيار وضع الكشف (OD / شدة الفلورسنت) ، ودرجة حرارة الحضانة ، ووقت الحضانة ، وسرعة تحريك العينة في زجاجة الكاشف. 15. معلمات لتحديد القطرات وإعدادات جمع العينات. الاختصارات: MISS = نظام أوميكسات ثقافة قطرات ميكرولتر أحادية الخلية ؛ OD = الكثافة البصرية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تركيب زجاجة العينة ومزيل فقاعات الهواء. (أ) زجاجة عينة خلية MISS. يضاف التعليق الميكروبي إلى زجاجة العينة إلى موضع إضافة العينة. يتم شد الغطاء على الفور وتوصيل الموصلات السريعة A و B. أخيرا ، يتم وضع زجاجة العينة في وضع زجاجة العينة على خلية MISS. (ب) تركيب زجاجة العينة. يتم توصيل الموصلات السريعة A و B بمنفذ O3 على خلية MISS والموصل C3 من الأنابيب الدقيقة وشريحة الموائع الدقيقة لتوليد القطرات ، على التوالي. (ج) تركيب مزيل الفقاعات الهوائية. عند تثبيت مزيل فقاعة الهواء ، تتم إزالة المسمار على شكل فراشة من الغطاء أولا قبل تثبيت الزجاجة التي تحتوي على زيت إزالة فقاعة الهواء. اختصار: MISS = نظام Omics لثقافة قطرات ميكرولتر أحادية الخلية الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
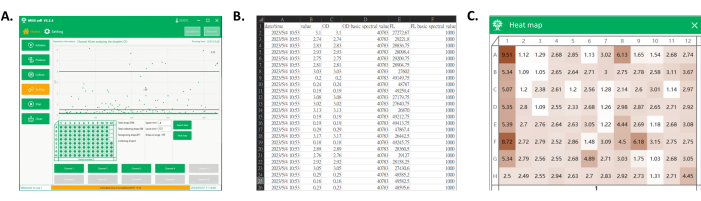
الشكل 4: تصدير البيانات وخريطة الحرارة للوحة البئر المجمعة. (أ) الواجهة الرئيسية للبرنامج أثناء اكتشاف القطرات وجمعها. في منطقة عرض العملية ، يتم عرض كل إشارة قطرة ، ويتم جمع القطرات في النطاق المطلوب إلى لوحة البئر. (ب) لقطة شاشة لجزء من البيانات المصدرة. وتشمل البيانات المصدرة الإشارة الطيفية للقطرات المجمعة (العمودين C وE) وأوقات اكتشافها (العمود A). (ج) لقطة شاشة لخريطة الحرارة للوحة. بناء على الإشارات من القطرات المجمعة ، يتم تطبيع القيم للحصول على خريطة حرارية للوحة ، والتي يمكن استخدامها لاحقا للتمييز بين أداء ثقافة السلالات أحادية النسيلة لكل استنساخ بناء على اللون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: نتائج العزل أحادي النسيلة وزراعة الكائنات الحية الدقيقة المعوية في خلية MISS. (أ) مخطط سير العمل لعزل وزراعة وتحديد ميكروبات الأمعاء. يتم استخدام التعليق الميكروبي الأولي ، وطريقة الصفيحة الصلبة ، وطريقة خلية MISS لعزل وزراعة نفس الجراثيم الأمعاء متبوعا بتحليل التسلسل. (ب ، د) تحليل على مستوى الأسرة للمستعمرات وحيدة النسيلة التي تم الحصول عليها من عزل وزراعة ميكروبات الأمعاء ، حيث يظهر B تحليل مخطط Venn و D يوضح تحليل تكوين المجتمع. (ج، ه) تحليل على مستوى الجنس للمستعمرات وحيدة النسيلة التي تم الحصول عليها من عزل وزراعة ميكروبات الأمعاء ، حيث يظهر C تحليل مخطط Venn و E يوضح تحليل تكوين المجتمع. الاختصار: MISS = نظام Omics لثقافة قطرات ميكرولتر أحادية الخلية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يحدد هذا البروتوكول تشغيل خلية MISS للعزل الآلي وعالي الإنتاجية وحيدة النسيلة الميكروبية وزراعتها وكشفها وجمعها. بالمقارنة مع الطرق التقليدية التي يمكن من خلالها عزل واستزراع ~ 20٪ -30٪ فقط من ميكروبات الأمعاء2،12 ، كان عدد المستنسخة أحادية النسيلة التي تم الحصول عليها باستخدام نظام Omics أعلى بمقدار 1.97 مرة من تلك التي تم الحصول عليها من الصفائح الصلبة. تكشف هذه المقارنة أن خلية MISS لها مزايا في عزل الخلية المفردة ، والزراعة أحادية النسيلة ، والفحص.
لعزل الخلية المفردة ، حصل نظام Omics على قطرات أحادية الخلية وفقا لتوزيع Poisson ، مما يضمن أحادية النسيلة جيدة. بالإضافة إلى ذلك ، أنتج نظام Omics قطرات بمعدل يصل إلى 5,000 قطرة / ساعة ، مما يتيح عزل خلية واحدة عالي الإنتاجية مع تقليل استهلاك الكاشف بشكل كبير بسبب حجم القطرات الصغيرة. أثناء توليد القطرات ، تم استخدام قناة تركيز التدفق على الأنابيب الدقيقة. يستخدم نظام Omics مضخة الحقن لدفع طور الزيت ومحلول العينة والغاز إلى قناة تركيز التدفق وتشكيل قطرات. يمكن للمستخدمين ملاحظة ما إذا كانت القطرات قد تم إنشاؤها بنجاح من خلال القناة أو من خلال النظر إلى أنابيب القطرات مباشرة. يتم توصيل أنابيب السيليكون من الأنابيب الدقيقة ورقاقة الموائع الدقيقة لتوليد القطرات بنهاية 10 أنابيب قطرات. عندما يتم إنشاء قطرات كافية في أنبوب قطرة واحد (~ 5,000 قطرة) ، سيقوم صمام التثبيت تلقائيا بتثبيت أنابيب السيليكون للأنبوب والاستمرار في توليد القطرة في الأنبوب التالي.
بالنسبة لزراعة السلالة أحادية النسيلة ، استفادت الكائنات الحية الدقيقة في القطرات من أداء تبادل الغازات الممتاز ، والزراعة المتوازية العالية ، ونقل الكتلة الفعال ، مما يوفر ظروف نمو مثالية للسلالات منخفضة الوفرة أو التي يصعب نموها. بالنسبة لفحص السلالة أحادية النسيلة ، دعم نظام Omics الكشف عن الكتلة الحيوية المضان والقائم على OD والذي يمكن أن يعتمد الكشف على أداء النمو الميكروبي ومستوى التعبير عن جين أو بروتين معين ذي أهمية13. علاوة على ذلك ، استخدم نظام Omics ترسيب القطرات الناجم عن الجاذبية في ألواح الآبار. من خلال الجمع بين طريقة الفحص السلبية هذه وذراع التأرجح ، حققت فحصا مستقرا ودقيقا للغاية للقطرات ، مما يجعلها منصة فحص صديقة للبيئة. علاوة على ذلك ، حقق نظام Omics عملية مؤتمتة بالكامل من عزل كائن حي دقيق واحد إلى الفحص النسيلي النهائي ، مما قلل من تكاليف العمالة والوقت.
بالنظر إلى أداء نظام Omics ، يمكن استخدامه في علم الثقافات الميكروبية وفحص الطفرات الميكروبية ، بالإضافة إلى تطبيقات أخرى مثل اختيار السلالة عالية الإنتاج وتعدين الجينات الوظيفية الرئيسية6. للحصول على نتائج تجريبية دقيقة ، يمكن للباحثين تحسين الظروف التجريبية بناء على الأنواع المراد عزلها واستزراعها وفحصها. أولا ، يتبع توليد قطرات أحادية الخلية في نظام Omics توزيع Poisson ، حيث تضمن قيمة λ المنخفضة أن تكون القطرات المتولدة في الغالب فارغة أو قطرات أحادية الخلية. في عملنا السابق ، تحققنا من صحة نطاق التركيز الميكروبي الأمثل لتوليد قطرات أحادية الخلية في نظام Omics ليكون 16.8-69.7 خلية / مل (λ = 0.035-0.145) 6. عند تحضير معلقات العينة ، من الضروري التخفيف ضمن نطاق التركيز هذا لتعزيز دقة أحادية النسيلة. ثانيا ، قبل استخدام نظام Omics ، من الضروري تحسين ظروف النمو الميكروبي. بناء على متطلبات الأكسجين للكائنات الحية الدقيقة ، يمكن للباحثين اختيار إما النيتروجين أو الأكسجين كمرحلة غازية لتوليد القطيرات. ثالثا ، أثناء اكتشاف القطرات ، يتم تحديد الامتصاص أو التألق من خلال شدة الضوء المستلمة بعد إضاءة القطرات. وبالتالي ، قد تختلف القيم العددية التي تم الحصول عليها من نفس العينة بين اكتشاف القطرات وقياس مقياس الطيف الضوئي بسبب الاختلافات في سمك العينة ، كما لوحظ في عملنا السابق14. لذلك ، يوصى بإنشاء منحنى معايرة للعينات التجريبية قبل إجراء التجارب.
علاوة على ذلك ، نقوم أيضا بتحسين أداء نظام Omics لتطبيق الأنواع الأخرى مثل خلايا الثدييات ، بما في ذلك التوافق الحيوي لطور الزيت مع الخلايا (على سبيل المثال ، يتمتع الزيت المفلور بقابلية أعلى للذوبان في الغاز وهو أكثر ملاءمة لزراعة خلايا الثدييات15،16) ، تأثير معدل التدفق ثنائي الطور على قوة القص الخلوية17 ، 18،19 ، وتحسين حجم القطرة13،20. قد تسهل هذه التحسينات بشكل كبير استخدام نظام Omics في البحوث الطبية الحيوية مثل تطوير خط الخلايا ، وفحص الأجسام المضادة للخلية البائية المفردة ، واكتشاف الأجسام المضادة للورم الهجين. استنادا إلى الوحدات التشغيلية الأساسية الثلاث لتوليد قطرات نظام Omics وزراعتها وفحصها ، يمكن للباحثين اختيار الوحدات المناسبة وفقا لمتطلبات التجربة. بالإضافة إلى ذلك ، يمكن إضافة وحدة حقن القطرات وتقسيم القطرات إلى النظام الموضح هنا لإجراء إضافة الكاشف أو إنشاء مكتبات إجهاد.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
تم دعم هذه الدراسة من قبل مشاريع البحث والتطوير في المناطق الرئيسية لمقاطعة قوانغدونغ (2024B1111130002) ، ومشاريع البحث والتطوير في مقاطعة خبي (22375503D) ، والمشروع الافتتاحي لمختبر Anhui الهندسي للتربية الجزيئية لعلم الأحياء الدقيقة الصناعية (Grant ELMB-07).
Materials
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Merck KGaA, Darmstadt, Germany | P5731-500EA | For solid plate preparation |
| 30 mL Stool Containers | Boen Healthcare Co., Ltd | 611101 | For collecting the stool samples |
| 37 °C constant temperature incubator | Shanghai Yiheng Technology Co., Ltd. | LRH-150 | Cultivate the solid plate in the incubator |
| 96-well Clear Flat Bottom Polystyrene TC-treated Microplates | Corning | 3599 | For well plate movement detection and droplet collection |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| Air bubble removal oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S-oil | The oil in the air bubble remover during droplet screening |
| Air bubble remover | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S | Exclude the gas phase between droplets before performing droplet detection and collection |
| Anaerobic bench | Argon and Nitrogen Space Equipment Business Department, Haiyu Town, Changshu City | VGB-4CM | For aseptic operation and UV sterilization under anaerobic condition |
| Autoclave | Puhexi Health and Medical Equipment Co., Ltd. | MLS-830L | For autoclaving BHI medium, EP tube, and so on. |
| Brain Heart Infusion (BHI) Broth | Qingdao High-tech Industrial Park Haibo Biotechnology Co., Ltd | HB8297-1 | Components of the BHI medium The ingredient list: 38.5 g/L BHI Broth in distilled water |
| Cell Spreader | Merck KGaA, Darmstadt, Germany | HS8151 | Inoculate the microbial solution onto the solid plate |
| Centrifuge tube, 15 mL | Beijing Xinhengyan Technology Co., Ltd | HB53397 | For microbial solution preparation |
| Computer | Lenovo | E450 | Software installation and MISS cell control |
| Cryovial | Thermo Fisher | 2.0 mL | For stool preservation |
| Distilled water | Beijing Mreda Technology Co., Ltd. | M306444-100ml | Add into humidifier to keep the humidity in droplet cultivation chamber |
| EP tube | Thermo Fisher | 2.0 mL | For collecting the stool samples |
| Fluorescent inverted microscope | Olympus Life Science (LS) | CKX53 | Check and calculate the microbial concentration |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| Hemocytometer | Acmec | AYA0810-1ea | Calculate the microbial concentration |
| KCl | Ambeed | A442876 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| KH2PO4 | MACKLIN | P815661 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| Mesh filter | Anping Jiufeng Wire Mesh Manufacturing Co., Ltd | 200 mesh (0.075 mm), 400 mesh (0.038 mm), 800 mesh (0.018 mm) | Remove undigested food and smaller particulate matter from the stool samples |
| Micro-tubing and droplet generation microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISC-B2 | For droplet generation and droplet incubation |
| MISS cell oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-BOS-B | The oil phase for droplet microfluidics |
| MISS cell software | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell V3.2.4 | Perform experimental operations on the MISS cell instrument |
| Na2HPO4 | Solarbio | D7292 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| NaCl | GENERAL-REAGENT | G81793J | Components of the physiological saline solution The ingredient list: 9 g/L NaCl in distilled water |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Polytetrafluoroethylene tube | Shenzhen WOER Heat-shrinkable Material Co., Ltd. | 3401000141 | For droplet incubation. This material was already included in micro-tubing and droplet generation microfluidic chip |
| Sample bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-bottle | Sampling of microbial solution |
| Single Cell Microliter-droplet Culture Omics System (MISS cell) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-G3f | Performing the microbial monoclonal isolation, cultivation, detection and collection |
| Superspeed Centrifuge | Thermo Fisher | Sorvall Lynx 4000 | Prepare the microbial solution for sequencing |
| Syringe | Jiangsu Zhiyu Medical Instructment Co., Ltd | 10 mL | Draw the distilled water and inject it into the humidifier in droplet cultivation chamber |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
References
- Hahn, M. W., Koll, U., Schmidt, J., Hurst, C. J. Isolation and cultivation of bacteria. The structure and function of aquatic microbial communities. , 313-351 (2019).
- Xu, M. Q., Pan, F., Peng, L. H., Yang, Y. S. Advances in the isolation, cultivation, and identification of gut microbes. Mil Med Res. 11 (1), 34 (2024).
- Lattermann, C., Büchs, J. Microscale and miniscale fermentation and screening. Curr Opin Biotechnol. 35, 1-6 (2015).
- Huang, Y., et al. High-throughput microbial culturomics using automation and machine learning. Nat Biotechnol. 41 (10), 1424-1433 (2023).
- Brehm-Stecher Byron, F., Johnson Eric, A. Single-cell microbiology: Tools, technologies, and applications. Microbiol Mol Biol Rev. 68 (3), 538-559 (2004).
- Jian, X., et al. Single-cell microliter-droplet screening system (miss cell): An integrated platform for automated high-throughput microbial monoclonal cultivation and picking. Biotechnol Bioeng. 120 (3), 778-792 (2023).
- Hu, B., et al. One cell at a time: Droplet-based microbial cultivation, screening and sequencing. Mar Life Sci Technol. 3 (2), 169-188 (2021).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-expanding the toolbox of microfluidic single-cell cultivations. J Mol Biol. 431 (23), 4569-4588 (2019).
- He, Z., Wu, H., Yan, X., Liu, W. Recent advances in droplet microfluidics for microbiology. Chinese Chemical Letters. 33 (4), 1729-1742 (2022).
- Kaminski, T. S., Garstecki, P. Controlled droplet microfluidic systems for multistep chemical and biological assays. Chem Soc Rev. 46 (20), 6210-6226 (2017).
- Sender, R., Fuchs, S., Milo, R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 164 (3), 337-340 (2016).
- Simrén, M., et al. Intestinal microbiota in functional bowel disorders: A rome foundation report. Gut. 62 (1), 159-176 (2013).
- Periyannan Rajeswari, P. K., Joensson, H. N., Andersson-Svahn, H. Droplet size influences division of mammalian cell factories in droplet microfluidic cultivation. Electrophoresis. 38 (2), 305-310 (2017).
- Jian, X., et al. Microbial microdroplet culture system (mmc): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnol Bioeng. 117 (6), 1724-1737 (2020).
- Baret, J. -. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Kubie, L. S. The solubility of O2, CO2, and N2 in mineral oil and the transfer of carbon dioxide from oil to air. J Biol Chem. 72 (2), 545-548 (1927).
- Poon, C. Measuring the density and viscosity of culture media for optimized computational fluid dynamics analysis of in vitro devices. J Mech Behav Biomed Mater. 126, 105024 (2022).
- Yao, J., Lin, F., Kim, H. S., Park, J. The effect of oil viscosity on droplet generation rate and droplet size in a t-junction microfluidic droplet generator. Micromachines. 10 (12), 808 (2019).
- Venkateshwarlu, A., Bharti, R. P. Effects of capillary number and flow rates on the hydrodynamics of droplet generation in two-phase cross-flow microfluidic systems. Journal of the Taiwan Institute of Chemical Engineers. 129, 64-79 (2021).
- Nekouei, M., Vanapalli, S. A. Volume-of-fluid simulations in microfluidic t-junction devices: Influence of viscosity ratio on droplet size. Physics of Fluids. 29, 032007 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved