Method Article
マウス脳脊髄サンプルの抽出および組織透明化調製
* これらの著者は同等に貢献しました
要約
この研究では、蛍光シグナルを保持した透明な全脳および脊髄サンプルを抽出および調製するためのプロトコルを提示し、実験効率とデータの完全性を高めて神経科学研究を前進させます。
要約
中枢神経系に焦点を当てた神経科学研究には、細胞分布、ニューロンの接続性、分子動力学など、さまざまな要因を完全に理解する必要があります。脳と脊髄全体を調査する従来の方法論では、組織切片の分離、切片化、スキャン、その後の3次元画像再構成の労働集約的なプロセスが含まれることがよくあります。この従来のアプローチは、時間がかかり、面倒な場合があります。組織透明化と全臓器イメージング技術の進歩は、脳全体と脊髄の解析に革命をもたらしました。これらの革新的な方法の可能性を最大限に引き出すためには、脳サンプルを脊髄への接続を維持しながら抽出し、クリアすることが不可欠です。このプロトコルは、脊髄に接続された脳のサンプルを準備するための詳細で体系的なガイドを提供し、抽出とクリアリングの手順を概説しています。これらのプロセスを合理化することにより、このアプローチは実験効率とデータの完全性を大幅に向上させ、それによって神経科学研究の進歩を促進し、中枢神経系の複雑さに対するより包括的な研究を可能にします。
概要
神経分布の正確なマッピングと分析は、中枢神経系の構造的および機能的組織に関する貴重な洞察を提供し、革新的な治療戦略への道を開き、神経メカニズムの全体的な理解を深めます。現在、研究者が脊髄に接続された脳サンプルを調製および抽出し、組織クリアリングを成功させるためのガイドとなる包括的なビデオチュートリアルが不足しています。
組織透明化には、疎水性、親水性、ハイドロゲルベース、組織拡大型などのいくつかの方法があります1,2,3。組織清算の技術は、脾臓4、肺5、腓腹筋6、脳7、脊髄8、腎臓9などの臓器の研究に広く適用されています。私たちのプロトコルでは、蛍光マーカーで標識された脊髄に接続された全脳サンプルを調製する方法についての詳細な指示を提供します STOCK Tg (Thy1-EGFP) MJrs/J 系統マウス。サンプル抽出のステップバイステップのガイダンスを提供し、組織透明化親水性キットを使用した透明化プロトコルについて説明します。このプロトコルは、研究者が脳脊髄サンプルの抽出から調製、その後のスキャンまでの全プロセスを習得するのに役立ちます。これにより、実験効率が向上するだけでなく、サンプルの完全性と品質が確保され、神経科学研究をサポートするためのより正確で信頼性の高いデータが提供されます。
従来の切片化、イメージング、および3次元再構成方法10,11と比較して、ここで提示されたアプローチは、(1)構造的完全性の向上:全臓器構造を維持することにより、この方法は、切片化12で発生する可能性のある重要な情報を失うリスクを減らすなど、いくつかの重要な利点を提供します;(2)包括的なデータ取得:組織クリアリングキットを使用することで、従来の技術では達成が難しかった細胞の詳細なマッピングが可能になります。(3)効率と精度:このプロトコルは、サンプル抽出からイメージングまでの全プロセスを合理化し、免疫組織化学または染色手順に必要な時間を短縮し、切片化およびマウント13に関連するエラーを最小限に抑えます。
このプロトコルは、データが不完全で断片化されることが多い従来のセクショニング方法の制限を克服します。このプロトコルは、脳と脊髄の接続をそのまま維持し、最新の組織透明化方法を利用することで、複雑な神経メカニズムと機能を理解するために重要な中枢神経系のより全体的なビューを提供します。この方法の主な目的は、蛍光ニューロンマーカーで標識された脊髄に接続された全脳サンプルを調製することにより、中枢神経系の包括的なイメージングを可能にすることです。このプロトコルは、高度な解剖学的方法と組織透明化技術を使用して、神経構造と細胞分布の詳細な視覚化を容易にすることを目的としています。
プロトコル
すべての動物実験は、Animal Research Reporting In Vivo Experiments(ARRIVE)ガイドラインおよびNational Institutes of Health Guides for the Care and Use of Laboratory Animalsに準拠して実施されました。本研究は、上海交通大学医学部仁済病院の動物管理および使用委員会によって承認されました。ここでは、7-8週齢のSTOCK Tg(Thy1-EGFP)MJrs/J系統雄マウス(C57BL/6J x CBA由来)を本研究に用いた。動物は商業的に入手され( 材料の表を参照)、標準的なケージ(22°C±2°C、12時間/12時間の明暗サイクル、餌、水 を自由に)に収容されました。
1.灌流
- 1 mLシリンジを使用して腹腔内注射で投与された1.25%トリブロモエタノール(0.02 mL / kg、 材料の表を参照)を使用して成体マウスに深く麻酔をかけます。.つま先のつま先つまみ反応で麻酔の深さを確認します。
- スチールクランプを使用して、マウスの手足を白いアクリル板に固定します。マウスの2つの大腿骨の間の皮膚を切り取り、横隔膜に達するまで上向きに切り続けます。横隔膜を通して胸部の両側を開き、はさみとまっすぐな鉗子を使用して心臓を露出させます。
- 0.7mmの注入針を左心室に挿入します。右心房付属器に1〜2mmの切開を行います。
- 10 U/mL のヘパリンナトリウムを 10 mL/分の割合で含有する 1x PBS で ?? 動ポンプ ( 材料の表を参照) を使用して ?? 血を完全に除去します。.肝臓が完全に青白くなることは、クリアランスが成功したことを示します。
- 予冷した4% PFA50 mLをペリスタルティックポンプで10 mL/minの速度で灌流します。マウスの尻尾のカールや筋肉のけいれんなどの兆候を監視します。
注:灌流に失敗すると、その後の清算プロセスに影響を与える可能性があります。
2.サンプル抽出
- サンプルの損傷を避けるために、ハサミと鉗子を使用して脳全体と脊髄を慎重に解剖します。
- マウスの背面と頭の皮膚を点眼ハサミで分離します。両肢の後肢の上部後端を結ぶ線が脊柱と交差する点で脊椎を切断します。
- マウスの首と背中から筋肉と脂肪組織を取り除き、背骨と頭蓋骨を露出させます。脊柱管の下端から脊柱と脊髄の左右の中間線の隙間に沿って、ヴィーナスハサミで切り取ります。
- 切断された脊椎の上部と両側を取り外して、脊髄を露出させます。脳の接続に到達するまで手順を繰り返します。
- 金星ハサミの片方の刃の先端を大孔と脳の間に置きます。矢状中央縫合糸に沿ってスライドさせて切断し、頭蓋骨を開きます。鉗子を使用して頭蓋骨を切除し、脳を露出させます。
- 鉗子と金針ハサミを使用して、マウスの脳脊髄組織を頭蓋端から取り除きます。
注意: 切り傷や表面の損傷は、その後のクリアリング中に悪化する可能性があり、予測できないサンプルの損傷を引き起こす可能性があります。サンプルの取り扱いには注意してください。 - 解剖鉗子を使用して、実体顕微鏡下で脊髄膜を切除します。
- 縫合糸を使用して、脳脊髄サンプルを固定プレート( 材料の表を参照)に固定します。サンプル量4% PFAの20倍以上を加え、4°Cのシェーカーに載せてゆっくりと撹拌します。16-24時間一晩固定します。
注:過剰に固定すると、タンパク質の架橋が過剰になり、透明化効率が低下します14。固定が不十分または遅延すると、抗原の分解や組織形態の破壊を引き起こす可能性があります。 - PFAを廃棄し、サンプルを1x PBSで3回洗浄します。PBSの容量がサンプル量の10倍以上であることを確認し、サンプルを完全に沈めます。各洗浄は、シェーカーで60rpm以上の速度で攪拌しながら2時間続き、残留PFAを完全に除去します。
3. ティッシュクリアリング
注:ここでは、ティッシュクリアリングキットを使用します( 材料の表を参照)。
- 溶液Aと溶液Bを9:1の質量比で混合して、脂質除去溶液を調製します。
注:脂質除去溶液の容量は、サンプルの容量の20倍以上にすることをお勧めします。 - 固定組織を50 mLの遠心チューブに入れ、50 mLの脂質除去溶液を加えます。遠心分離チューブを37°Cのシェーカーに入れ、60rpmで穏やかに振とうして脂質を除去します。脂質除去液を3〜5日間毎日交換します。完了を判断するには、遠心分離管を目盛り線付きのライトボックスに置きます。黒い目盛りの線がサンプルを通してはっきりと見え、歪みがなければ、プロセスは完了です。
- サンプルを20 mLの溶液Cに入れ、25°Cのシェーカーに置き、屈折率マッチングのために60rpm未満で振とうします。24時間後にソリューションCを変更します。サンプルを溶液Cに完全に浸した培養皿を、目盛り線付きのライトボックスに置きます。黒い目盛りの線がサンプルを通してはっきりと見え、歪みがなければ、マッチングプロセスは完了です。
注:成体マウス組織の場合、屈折率のマッチングは通常2日以内に完了します。
4. ティッシュ埋め込み
- 200mLのガラス瓶に147gの溶液Cを入れたゲル溶液を調製し、3.0gのアガロースを加え、ボルテックスでよく混合し、沸騰するまで電子レンジで加熱し、すぐに電子レンジの電源を切ります。アガロースが溶解するまで、遠心チューブを37°Cのインキュベーターに移します。
注:必要に応じてゲル溶液を新鮮に調製することをお勧めします。 - 透明化したサンプルを深さ2 mmの37 °Cゲル溶液の層で型に埋め込み、4 °Cの冷蔵庫で半固化するまで30分間冷却します。屈折率を一致させたサンプルを型に入れ、サンプルの上部が水平またはわずかに下になるようにゲル溶液を追加します。
- 金型を4°C冷蔵庫に2時間戻します。金型表面と同じ高さになるまでゲル溶液を加えます。カバースリップで覆います。4°Cの冷蔵庫で2時間固化を促進します。埋め込まれたサンプルは、4°Cの冷蔵庫で一晩保管してください。できるだけ早くイメージングを進めてください。
5. スキャン
- ピンセットでカバースリップをはがし、埋め込まれたサンプルを取り出します。サンプルを50 mLのチューブに入れ、30 mLのイメージング溶液を加えてサンプルを完全に浸します。
- 502接着剤を塗布して、サンプルをサンプルホルダーにしっかりと貼り付けます。ホルダーを撮像装置に固定します。
- 説明に従ってスキャンソフトウェアを実行します。倍率セクションで倍率レベルを4倍にします。 [キャリブレーション] ボタンをクリックして、キャリブレーションモードをアクティブにします。
- [プレビュー]ボタンをクリックして、プレビューモードに入ります。Z方向移動ボタンをクリックすると、生成されたライトシートがサンプルを通過するまで、サンプルチャンバーの底部からサンプルをゆっくりと上に移動します。
- 適切なレーザーチャンネルと照明モードオプションを選択します。サンプルのスキャンパス方向を選択します。 「Auto Scan 」ボタンをクリックして、サンプルのキャプチャを開始します。
結果
このプロトコルは、STOCK Tg (Thy1-EGFP) MJrs/J系統の雄マウスの脊髄に接続された全脳を成功裏に分離します。また、サンプルを透明にし、蛍光シグナルが完全に保存および捕捉されることを保証し、元の蛍光の完全性を維持する鮮明で詳細な画像を提供します。
図1は無傷の脳脊髄を示しており、このプロトコルで概説されている解剖手順が正確であることを示しています。さらに、組織の透明化は高精度で行われ、複雑な神経構造を視覚化できる透明な標本が生成されました。さらに、 図2 は、蛍光シグナルイメージングを行った脳脊髄サンプルが非常によく保存されており、元の蛍光の完全性を保持した鮮明で詳細な画像を提供していることを示しています。 図3 は、 図2に示されている個々の細胞の高倍率画像を示しています。

図1:無傷の脳脊髄。 脳組織は、クリアリングの前後に脊髄に接続されています。スケールバー= 2 mm。 この図の拡大版を表示するには、ここをクリックしてください。
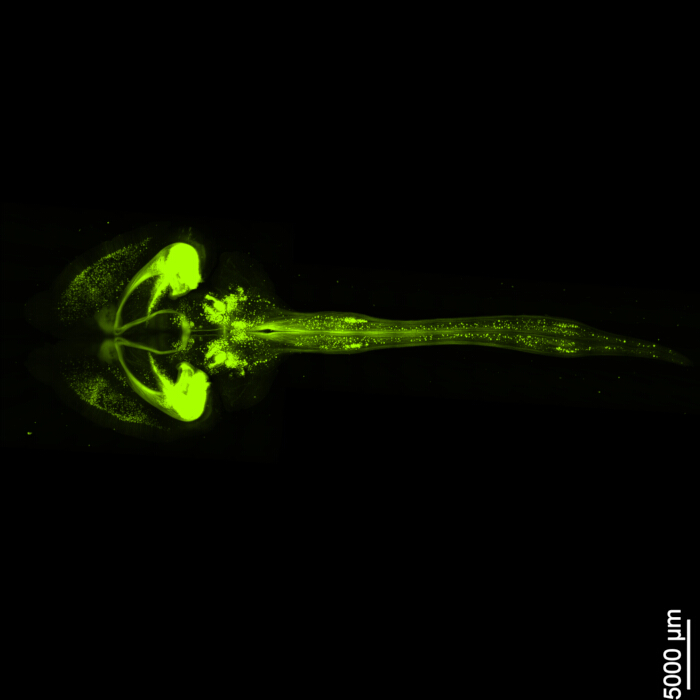
図2:3次元蛍光EGFP。 この画像は、脳全体と脊髄への接続を示しています。スケールバー = 5000 μm. この図の拡大版を表示するには、ここをクリックしてください。
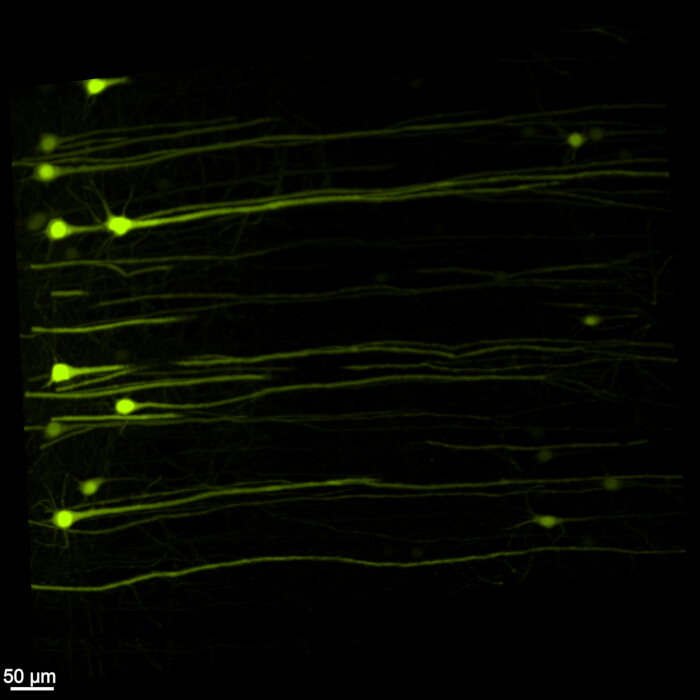
図3:高倍率3次元蛍光EGFP。 脳脊髄サンプル内の個々のEGFP発現細胞を強調した高倍率画像。スケールバー = 50 μm. この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
提案された実験プロトコルは、蛍光神経追跡ウイルスで標識された脊髄に脳が接続されているマウスを使用することを含む。このプロトコルは、脊髄に接続されたままの全脳サンプルを準備するための包括的で詳細な指示を提供します。このプロトコルは、各ステップを細心の注意を払って概説しており、研究者がプロセスを正確に再現できるようにします。
このプロトコルのいくつかの重要なステップは、クリアリングとイメージングの品質向上に貢献しています。脊髄に繋がっている全脳サンプルを完全に抽出することは重要な課題です。脳と脊髄の完全性を維持することは、正確なトレースとその後の分析に不可欠です。サンプルを採取する際、その後の清算プロセスで切開部や表面の損傷が悪化し、予測できない損傷につながる可能性があります。サンプルの完全性を確保するためには、材料に指定されているビーナスハサミと解剖ピンセットを使用して、細心の注意を払ってサンプリングすることが重要です。脳脊髄サンプルを縫合糸で固定プレートに固定することは、液体に浸かっている間の重力、圧力、またはその他の要因によって引き起こされる変形を防ぐための重要なステップです。
以前の研究は、しばしば脳または脊髄8 の構造と機能のいずれかにのみ焦点を当てていました。しかし、中枢神経系はまとまりのあるユニットとして機能しています。脳から下方への信号の伝達と、脊髄を介してより高い中枢への末梢信号の上方への伝達は複雑なプロセスです。包括的な脳脊髄サンプルへのアクセスは、これらのシグナルの統合を調査する上で有利です。
利用可能な主要な組織透明化アプローチには、疎水性、親水性、ハイドロゲルベース、および組織拡大透明化方法があります1,2,3。基本的な原理と方法は同じです:光を回折する分子(脂質、顔料、リン酸カルシウムなど)を、イメージング媒体の屈折率に一致する他の分子で置き換えます2,15。親水性クリア法は、通常、毒性の問題が少なく、蛍光タンパク質および色素のシグナルの保存により効果的です1,2,3;ただし、いくつかの欠点があります。それらは組織の腫れや体積の変動を引き起こし、サンプルの構造的完全性に影響を与える可能性があります。尿素やホルムアミドなどの高水和性化合物を使用すると、タンパク質の変性を引き起こし、組織の生物学的関連性に影響を与える可能性があります。さらに、これらの方法は一般的にシンプルで蛍光標識に適合しますが、より大きな組織に最適な透明化を実現するには、さまざまな化学物質を含む複雑なプロトコルが必要になることが多く、プロセスが複雑になる可能性があります。さらに、特定の組織コンパートメントを調整するための正確な化学混合物の必要性が複雑さを増し、特定のアプリケーションに対して慎重な最適化が必要になります。
組織透明化およびイメージング技術の進歩により、ライトシート蛍光顕微鏡16を用いて、蛍光タンパク質を内因的に発現する細胞または蛍光標識抗体で標識された異なる細胞の神経の分布および体積をマッピングすることが可能になりました。透明化した組織におけるマルチプレックス分子検出技術の開発は急速に進んでいます。これらの方法により、単一のサンプルからさまざまな生物学的分析物を同時にプロファイリングすることができ、これは腫瘍微小環境や高密度のニューロンネットワークなどの複雑な生物学的システムを理解するために重要です。さらに、FISHやDNA Exchange Imagingなどの方法は、DNAバーコーディングと迅速なイメージングを通じてマルチプレックスを強化する上で有望であることを示しています。高度にマルチプレックス化されたタンパク質イメージングの未来は、核酸標識抗体を特異的、高感度、およびマルチプレックス検出に使用し、複雑な組織の包括的な解析を可能にすることにあるかもしれません17。
結論として、クリアされた脳脊髄サンプルを抽出して調製するための有望な方法について説明します。私たちの研究は、研究者が関連する研究を行うのに役立ちます。私たちのプロトコルは、PFA灌流マウスで組織の透明性を達成しました。しかし、最近の出版物では、科学者がマウスの皮膚に適用して一時的に透明にすることができる無毒の染料を発見したと報告されています18。これにより、研究者は血管や内臓など、皮膚の下の生理学的構造を観察することができます。この技術は、近い将来、厚さや透明性の向上により、中枢神経系や末梢神経系、呼吸器系、循環器系など様々なマウス臓器の 生体内 観察が可能になるなど、より高度なものとなる可能性がある19。
開示事項
著者は、競合する利益を宣言しません。
謝辞
中国国家自然科学基金会(XY Sunに助成金NO.82101249およびNO.82471204)。中国ポスドク研究財団(助成金番号2022M722125からXY Sunへ)。
資料
| Name | Company | Catalog Number | Comments |
| 1 ml syringe | Shandong Weigao Group Medical Polymer | ||
| 502 glue | Deli Group | ||
| BD insulin syringe | Becton,Dickinson and Company | 328421 | |
| Bend toothed dissecting forceps | Jinzhong | JD1050 | |
| Circular steel clamp | Weili | ||
| Fine scissors | Jinzhong | y00030 | |
| Hemostatic forceps bent with tooth | Jinzhong | J31020 | |
| Hemostatic forceps straight with tooth | Jinzhong | J31010 | |
| Infusion needle 0.7mm | Kindly Group | ||
| Light box scale line | Nuohai Life Science | NH210901 | |
| Microdissection straight forceps | Jinzhong | WA3020 | |
| NobeliumSoftware | Nuohai Life Science | Scanning software | |
| paraformaldehyde | Biosharp | BL539A | |
| Peristaltic pumps | Nuohai Life Science | NH1000 | |
| Peristaltic pumps head | Nuohai Life Science | NH-15 | |
| Phosphate buffered saline | Servicebio | G4202 | |
| Sodium heparin | Shanghai Pharma | H31022051 | |
| STOCK Tg (Thy1-EGFP) MJrs/J strain mice | Jackson Laboratory | 007788 | |
| Straight toothed dissecting forceps | Jinzhong | JD1060 | |
| Tissue clearing Kit(hyrophilic) | Nuohai Life Science | NH-CR-210701 | |
| Tissue culture treater 100mm x 20mm | NEST | 704001 | |
| Tissue scissors | Jinzhong | J21040 | |
| Tribromoethanol | Aibei Biotechnology | M2910 | |
| Venus scissors | Jinzhong | YBC010 |
参考文献
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21 (2), 61-79 (2020).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annu Rev Cell Dev Biol. 32, 713-741 (2016).
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chem Biol. 23 (1), 137-157 (2016).
- Wu, M., et al. Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity. Cell. 187 (12), 2935-2951.e19 (2024).
- Liu, T., et al. Local sympathetic innervations modulate the lung innate immune responses. Sci Adv. 6 (20), eaay1497 (2020).
- Qi, Y., et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 5 (1), eaau8355 (2019).
- Bagnoli, S., Terzibasi Tozzini, E., Cellerino, A. Whole-Brain clearing and immunofluorescence in Nothobranchius furzeri. Cold Spring Harb Protoc. 2023 (9), 698-704 (2023).
- Lu, T., Shinozaki, M., Nagoshi, N., Nakamura, M., Okano, H. 3D imaging of supraspinal inputs to the thoracic and lumbar spinal cord mapped by retrograde tracing and light-sheet microscopy. J Neurochem. 162 (4), 352-370 (2022).
- Saritas, T., Puelles, V. G., Su, X. T., Ellison, D. H., Kramann, R. Optical clearing and imaging of immunolabeled kidney tissue. J Vis Exp. (149), e60002 (2019).
- Song, J. H., et al. Precise mapping of single neurons by calibrated 3D reconstruction of brain slices reveals topographic projection in mouse visual cortex. Cell Rep. 31 (8), 107682 (2020).
- Fournel, R., Veruki, M. L., Hartveit, E. Digital reconstruction and quantitative morphometric analysis of bipolar cells in live rat retinal slices. J Comp Neurol. 530 (10), 1700-1728 (2022).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat Methods. 15 (12), 1033-1036 (2018).
- Peng, Y. C., et al. Rapid histological assessment of prostate specimens in the three-dimensional space by hydrophilic tissue clearing and confocal microscopy. J Histochem Cytochem. 70 (8), 597-608 (2022).
- Singhal, P., et al. Evaluation of histomorphometric changes in tissue architecture in relation to alteration in fixation protocol - An in vitro study. J Clin Diagn Res. 10 (8), ZC28-ZC32 (2016).
- Tainaka, K., et al. Chemical landscape for tissue clearing based on hydrophilic reagents. Cell Rep. 24 (8), 2196-2210.e9 (2018).
- Lee, S. H., Son, H. J. Second wave, late-stage neuroinflammation in cleared brains of aged 5xFAD Alzheimer's mice detected by macrolaser light sheet microscopy imaging. Int J Mol Sci. 24 (23), 242317058 (2023).
- Zhao, J., Lai, H. M., Qi, Y., He, D., Sun, H. Current status of tissue clearing and the path forward in neuroscience. ACS Chem Neurosci. 12 (1), 5-29 (2021).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385 (6713), eadm6869 (2024).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385, eadm6869 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved