Method Article
Estrazione e pulizia dei tessuti Preparazione di campioni di cervello e midollo spinale di topo
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio presenta un protocollo per l'estrazione e la preparazione di campioni chiari di intero cervello e midollo spinale con segnali fluorescenti conservati, migliorando l'efficienza sperimentale e l'integrità dei dati per far progredire la ricerca neuroscientifica.
Abstract
La ricerca neuroscientifica incentrata sul sistema nervoso centrale richiede una comprensione approfondita di vari fattori, tra cui la distribuzione cellulare, la connettività neuronale e la dinamica molecolare. Le metodologie tradizionali per studiare l'intero cervello e il midollo spinale spesso comportano l'isolamento, il sezionamento e la scansione di fette di tessuto, seguite dal laborioso processo di ricostruzione tridimensionale dell'immagine. Questo approccio convenzionale può richiedere molto tempo e essere ingombrante. I progressi nella pulizia dei tessuti e nelle tecniche di imaging dell'intero organo hanno rivoluzionato l'analisi dell'intero cervello e del midollo spinale. Per massimizzare il potenziale di questi metodi innovativi, è essenziale estrarre e cancellare campioni di cervello mantenendo la loro connessione con il midollo spinale. Questo protocollo fornisce una guida dettagliata e sistematica per la preparazione di campioni del cervello collegati al midollo spinale, delineando le procedure di estrazione e pulizia. Semplificando questi processi, questo approccio migliora significativamente l'efficienza sperimentale e l'integrità dei dati, favorendo così i progressi nella ricerca neuroscientifica e consentendo indagini più complete sulle complessità del sistema nervoso centrale.
Introduzione
La mappatura e l'analisi accurate della distribuzione nervosa forniscono preziose informazioni sull'organizzazione strutturale e funzionale del sistema nervoso centrale, aprendo la strada a strategie terapeutiche innovative e migliorando la nostra comprensione generale dei meccanismi neurali. Attualmente, mancano video tutorial completi per guidare i ricercatori nella preparazione e nell'estrazione di campioni cerebrali collegati al midollo spinale e nel raggiungimento di una pulizia dei tessuti di successo.
Sono disponibili diversi approcci di pulizia dei tessuti: idrofobici, idrofili, a base di idrogel e metodi di pulizia dell'espansione dei tessuti 1,2,3. La tecnica di pulizia dei tessuti è ampiamente applicata nello studio di organi come la milza4, i polmoni5, il muscolo gastrocnemio6, il cervello7, il midollo spinale8 e i reni9. Il nostro protocollo fornirà istruzioni dettagliate su come preparare campioni di cervello intero collegati al midollo spinale che sono stati marcati con un marcatore fluorescente utilizzando topi STOCK Tg (Thy1-EGFP) MJrs/J cep. Offrirà una guida passo passo per l'estrazione del campione e descriverà il protocollo di pulizia utilizzando kit idrofili per la pulizia dei tessuti. Questo protocollo aiuta i ricercatori a padroneggiare l'intero processo, dall'estrazione del campione di midollo spinale alla preparazione e alla successiva scansione. Ciò non solo migliorerà l'efficienza sperimentale, ma garantirà anche l'integrità e la qualità dei campioni, fornendo dati più accurati e affidabili a supporto della ricerca neuroscientifica.
Rispetto ai metodi convenzionali di sezionamento, imaging e ricostruzione tridimensionale10,11, l'approccio qui presentato offre diversi vantaggi chiave, come (1) una maggiore integrità strutturale: mantenendo la struttura dell'intero organo, questo metodo riduce il rischio di perdita di informazioni critiche che possono verificarsi con il sezionamento12; (2) acquisizione completa dei dati: l'uso di un kit di pulizia dei tessuti consente una mappatura dettagliata delle cellule che sono difficili da ottenere con le tecniche tradizionali; (3) Efficienza e accuratezza: il protocollo semplifica l'intero processo, dall'estrazione del campione all'imaging, riducendo il tempo richiesto dalle procedure di immunoistochimica o colorazione e minimizzando gli errori associati al sezionamento e al montaggio13.
Il protocollo supera i limiti dei metodi di sezionamento tradizionali, che spesso si traducono in dati incompleti e frammentati. Preservando la connessione cervello-midollo spinale intatta e utilizzando moderni metodi di pulizia dei tessuti, questo protocollo fornisce una visione più olistica del sistema nervoso centrale, che è fondamentale per comprendere i complessi meccanismi e funzioni neurali. L'obiettivo principale di questo metodo è quello di consentire l'imaging completo del sistema nervoso centrale preparando campioni di cervello intero collegati al midollo spinale, che sono stati marcati con marcatori neuronali fluorescenti. Questo protocollo mira a facilitare la visualizzazione dettagliata delle strutture neurali e delle distribuzioni cellulari utilizzando metodi anatomici avanzati e tecniche di pulizia dei tessuti.
Protocollo
Tutti gli esperimenti sugli animali sono stati condotti in conformità con le linee guida ARRIVE (Animal Research Reporting In Vivo Experiments) e la Guida del National Institutes of Health per la cura e l'uso degli animali da laboratorio. Il presente studio è stato approvato dal Comitato per la cura e l'uso degli animali dell'ospedale Renji, Shanghai Jiaotong University School of Medicine. Qui, per il presente studio sono stati utilizzati topi maschi del ceppo MJrs/J STOCK Tg (Thy1-EGFP) di 7-8 settimane (origine C57BL/6J x CBA). Gli animali sono stati ottenuti commercialmente (vedi Tabella dei materiali) e alloggiati in gabbie standard (22 °C ± 2 °C, 12 h/12 h ciclo luce/buio, cibo e acqua ad libitum).
1. Perfusione
- Anestetizzare profondamente i topi adulti utilizzando tribromoetanolo all'1,25% (0,02 ml/kg, vedere la tabella dei materiali) somministrato mediante iniezione intraperitoneale utilizzando una siringa da 1 ml. Controllare la profondità dell'anestesia in base alla risposta al pizzicamento delle dita dei piedi.
- Fissa gli arti del mouse alla tavola acrilica bianca usando i morsetti in acciaio. Tagliare la pelle tra i due femori del topo e continuare a tagliare verso l'alto fino a raggiungere il diaframma. Apri entrambi i lati del torace attraverso il diaframma per esporre il cuore usando forbici e pinze dritte.
- Inserire un ago per infusione da 0,7 mm nel ventricolo sinistro. Praticare un'incisione di 1-2 mm nell'appendice atriale destra.
- Perfondere con 1x PBS contenente 10 U/mL di eparina sodica a una velocità di 10 mL/min con una pompa peristaltica (vedere la Tabella dei materiali) per eliminare completamente il sangue. Il fegato che diventa completamente pallido indica una clearance riuscita.
- Perfondere con 50 mL di PFA al 4% pre-raffreddato con una pompa peristaltica a una velocità di 10 mL/min. Monitora la presenza di segni come l'arricciamento della coda del topo e le contrazioni muscolari.
NOTA: La perfusione non riuscita può influire sui successivi processi di compensazione.
2. Estrazione del campione
- Sezionare con cura l'intero cervello e il midollo spinale utilizzando forbici e pinze per evitare di danneggiare il campione.
- Separare la pelle sul dorso e sulla testa del topo usando le forbici oftalmiche. Recidere la colonna vertebrale nel punto in cui la linea che collega i bordi posteriori superiori di entrambi gli arti si interseca con la colonna vertebrale.
- Rimuovere il tessuto muscolare e adiposo dal collo e dalla parte posteriore del topo per esporre la colonna vertebrale e il cranio. Taglia lungo lo spazio della linea mediana tra i lati sinistro e destro della colonna vertebrale e del midollo spinale dall'estremità inferiore del canale vertebrale usando le forbici per la venere.
- Rimuovere la parte superiore e i lati bilaterali della colonna vertebrale recisa per esporre il midollo spinale. Ripeti i passaggi fino a raggiungere la connessione cerebrale.
- Posiziona la punta di una lama delle forbici di Venere tra il forame magno e il cervello. Far scorrere e tagliare lungo la sutura medio-sagittale per aprire il cranio. Usa il forcipe per rimuovere il cranio ed esporre il cervello.
- Rimuovere il tessuto cervello-midollo spinale del topo dall'estremità cranica usando una pinza e le forbici per la venere.
NOTA: I tagli o i danni alla superficie possono essere esacerbati durante la successiva pulizia, causando potenzialmente danni imprevedibili al campione. Maneggiare i campioni con cura. - Utilizzare una pinza da dissezione per rimuovere la membrana del midollo spinale sotto lo stereomicroscopio.
- Fissare il campione di midollo encefalico e spinale alla piastra di fissaggio (vedi Tabella dei materiali) utilizzando punti di sutura. Aggiungere almeno 20 volte il volume del campione di PFA al 4% e posizionarlo su un agitatore a 4 °C per un'agitazione lenta. Fissare durante la notte per 16-24 ore.
NOTA: L'eccessiva fissazione porta a un'eccessiva reticolazione delle proteine, riducendo l'efficienza di eliminazione14. Una fissazione insufficiente o ritardata può causare la degradazione dell'antigene e la distruzione della morfologia dei tessuti. - Scartare il PFA e lavare il campione 3 volte con 1 PBS. Assicurarsi che il volume di PBS sia almeno 10 volte il volume del campione, immergendo completamente il campione. Ogni lavaggio dura 2 ore con agitazione su agitatore ad una velocità non inferiore a 60 giri/min per rimuovere a fondo il PFA residuo.
3. Pulizia dei tessuti
NOTA: In questo caso viene utilizzato un kit per la pulizia dei tessuti (vedere la tabella dei materiali).
- Preparare la soluzione per la rimozione dei lipidi mescolando la soluzione A e la soluzione B con un rapporto di massa di 9:1.
NOTA: Si raccomanda che il volume della soluzione per la rimozione dei lipidi sia superiore a 20 volte il volume del campione. - Posizionare il tessuto fissato in una provetta da centrifuga da 50 mL e aggiungere 50 mL della soluzione per la rimozione dei lipidi. Porre la provetta da centrifuga in un agitatore a 37 °C, agitando delicatamente a 60 giri/min per la rimozione dei lipidi. Cambiare la soluzione per la rimozione dei lipidi ogni giorno per 3-5 giorni. Per determinare il completamento, posizionare la provetta da centrifuga su una scatola luminosa con una linea di scala. Se la linea della scala nera è chiaramente visibile e non distorta attraverso il campione, il processo è completo.
- Immergere il campione in 20 mL di soluzione C su un agitatore a 25 °C, agitando a meno di 60 giri/min per la corrispondenza dell'indice di rifrazione. Cambiare la soluzione C dopo 24 ore. Posizionare il piatto di coltura con il campione completamente immerso nella soluzione C su una scatola luminosa con una linea di scala. Se la linea della scala nera è chiaramente visibile e non distorta attraverso il campione, il processo di corrispondenza è completo.
NOTA: Per i tessuti di topo adulto, la corrispondenza dell'indice di rifrazione viene in genere completata entro 2 giorni.
4. Inclusione tissutale
- Preparare la soluzione in Gel con 147 g di Soluzione C in un flacone di vetro da 200 ml, aggiungere 3,0 g di agarosio, mescolare bene a spirale, quindi microonde fino a ebollizione e spegnere immediatamente il microonde. Trasferire la provetta da centrifuga in un'incubatrice a 37 °C fino a quando l'agarosio non si scioglie.
NOTA: Si consiglia di preparare la soluzione in gel fresca secondo necessità. - Incorporare il campione chiarificato con uno strato profondo 2 mm di soluzione gel a 37 °C nello stampo e raffreddare in frigorifero a 4 °C per 30 minuti fino a semi-solidificazione. Posizionare il campione con indice di rifrazione corrispondente nello stampo e aggiungere la soluzione di gel in modo che sia livellato o leggermente al di sotto della parte superiore del campione.
- Rimettere lo stampo in frigorifero a 4 °C per 2 ore. Aggiungere la soluzione di gel fino a raggiungere il livello della superficie dello stampo. Coprire con un vetrino coprioggetti. Accelerare la solidificazione in frigorifero a 4 °C per 2 ore. Conservare il campione incorporato per una notte in frigorifero a 4 °C. Procedere con l'imaging il prima possibile.
5. Scansione
- Rimuovere il vetrino coprioggetti con una pinzetta ed estrarre il campione incorporato. Posizionare il campione in una provetta da 50 ml e aggiungere 30 ml di soluzione di imaging per immergere completamente il campione.
- Applicare l'adesivo 502 per fissare saldamente il campione sul supporto del campione. Fissare il supporto al dispositivo di imaging.
- Eseguire il software di scansione come descritto. Selezionare il livello di ingrandimento di 4x nella sezione di ingrandimento. Fare clic sul pulsante Calibrazione per attivare la modalità di calibrazione.
- Fare clic sul pulsante Anteprima per accedere alla modalità di anteprima. Fare clic sul pulsante di movimento della direzione Z per spostare lentamente il campione verso l'alto dal fondo della camera del campione fino a quando il foglio luminoso generato non passa attraverso il campione.
- Selezionare il canale laser appropriato e l'opzione della modalità di illuminazione. Selezionare la direzione del percorso di scansione per il campione. Fare clic sul pulsante Scansione automatica per avviare l'acquisizione del campione.
Risultati
Questo protocollo isola con successo l'intero cervello collegato al midollo spinale in topi maschi STOCK Tg (Thy1-EGFP) MJrs/J cep. Inoltre, rende trasparenti i campioni, assicurando che i segnali fluorescenti siano completamente preservati e acquisiti, fornendo immagini chiare e dettagliate che mantengono l'integrità della fluorescenza originale.
La Figura 1 mostra un midollo encefalico-spinale intatto, dimostrando che le fasi di dissezione descritte in questo protocollo sono precise. Inoltre, la pulizia dei tessuti è stata eseguita con elevata precisione, producendo campioni trasparenti che consentono la visualizzazione di strutture neurali complesse. Inoltre, la Figura 2 mostra che il campione di midollo encefalico e spinale con l'imaging del segnale fluorescente è notevolmente ben conservato, fornendo immagini chiare e dettagliate che mantengono l'integrità della fluorescenza originale. La Figura 3 presenta un'immagine con un ingrandimento maggiore delle singole cellule raffigurate nella Figura 2.

Figura 1: Midollo spinale cerebrale intatto. Il tessuto cerebrale è collegato al midollo spinale, sia prima che dopo la pulizia. Barra della scala = 2 mm. Clicca qui per visualizzare una versione più grande di questa figura.
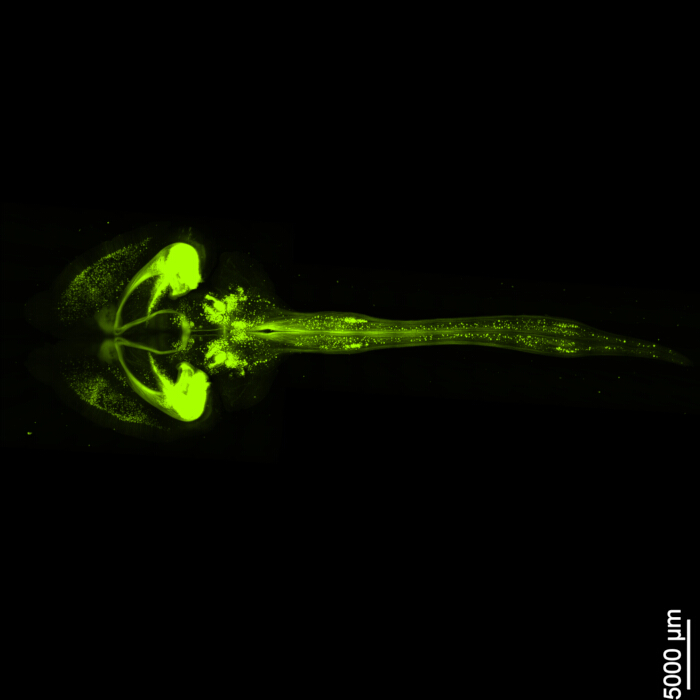
Figura 2: EGFP fluorescente tridimensionale. L'immagine mostra l'intero cervello insieme alla sua connessione con il midollo spinale. Barra di scala = 5000 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
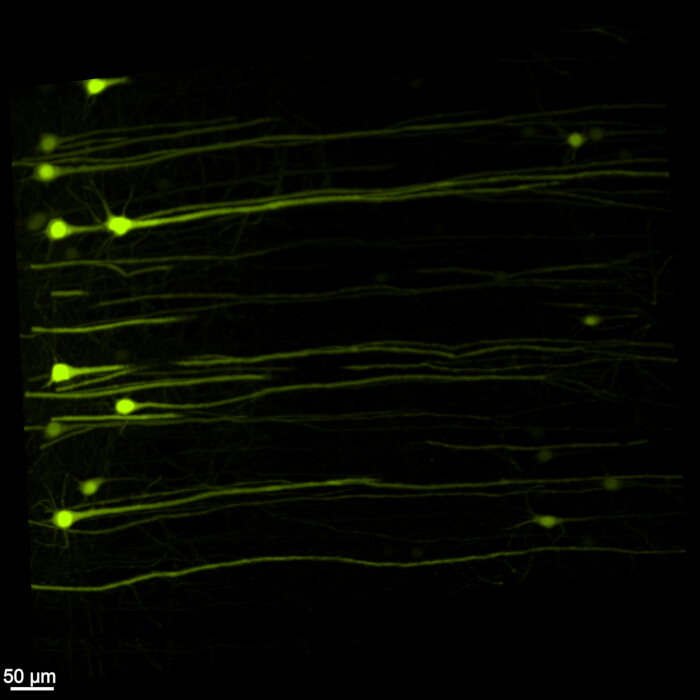
Figura 3: EGFP fluorescente tridimensionale ad alto ingrandimento. Un'immagine con ingrandimento più elevato che evidenzia le singole cellule che esprimono EGFP all'interno del campione di midollo encefalico-spinale. Barra di scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il protocollo sperimentale proposto prevede l'utilizzo di topi il cui cervello è collegato al midollo spinale marcato con virus di tracciamento neurale fluorescenti. Questo protocollo fornisce istruzioni complete e dettagliate sulla preparazione di campioni di cervello intero che rimangono collegati al midollo spinale. Il protocollo delinea meticolosamente ogni fase, assicurando che i ricercatori possano replicare il processo con precisione.
Diversi passaggi critici di questo protocollo contribuiscono a migliorare la qualità del clearing e dell'imaging. L'estrazione completa di campioni di cervello intero che sono collegati al midollo spinale è un compito importante. Mantenere l'integrità del cervello e del midollo spinale è fondamentale per un tracciamento accurato e la successiva analisi. Durante la raccolta dei campioni, le incisioni o i danni alla superficie possono esacerbarsi durante il successivo processo di sgombero, portando potenzialmente a danni imprevedibili. Per garantire l'integrità dei campioni, è fondamentale utilizzare le forbici per la venere e le pinzette da dissezione specificate nei materiali per un campionamento meticoloso. Fissare il campione di midollo encefalico-spinale alla piastra di fissaggio con punti di sutura è un passaggio cruciale per prevenire la deformazione causata dalla gravità, dalla pressione o da altri fattori durante l'immersione in un liquido.
La ricerca precedente si è spesso concentrata esclusivamentesulla struttura e la funzione del cervello o del midollo spinale. Tuttavia, il sistema nervoso centrale funziona come un'unità coesa. La trasmissione dei segnali dal cervello verso il basso e la trasmissione verso l'alto dei segnali periferici attraverso il midollo spinale ai centri superiori è un processo complesso. L'accesso a campioni completi di midollo encefalico e spinale è vantaggioso per studiare l'integrazione di questi segnali.
Sono disponibili diversi approcci primari di pulizia dei tessuti: idrofobici, idrofili, a base di idrogel e metodi di pulizia dell'espansione dei tessuti 1,2,3. I principi e i metodi di base sono gli stessi: sostituire le molecole che diffrangono la luce (come lipidi, pigmenti e fosfato di calcio) con altre molecole che corrispondono all'indice di rifrazione del mezzo di imaging 2,15. I metodi di chiarificazione idrofila in genere pongono meno problemi di tossicità e sono più efficaci nel preservare i segnali delle proteine fluorescenti e dei coloranti 1,2,3; Tuttavia, presentano diversi inconvenienti. Possono causare gonfiore dei tessuti e fluttuazioni di volume, compromettendo potenzialmente l'integrità strutturale dei campioni. L'uso di composti iperidratanti come l'urea e la formammide può portare alla denaturazione delle proteine, influenzando la rilevanza biologica dei tessuti. Inoltre, sebbene questi metodi siano generalmente semplici e compatibili con la marcatura fluorescente, ottenere una pulizia ottimale per tessuti più grandi richiede spesso protocolli complessi che coinvolgono varie sostanze chimiche, che possono complicare il processo. Inoltre, la necessità di miscele chimiche precise per regolare specifici compartimenti tissutali aumenta la complessità, richiedendo un'attenta ottimizzazione per applicazioni specifiche.
I progressi nelle tecniche di pulizia dei tessuti e di imaging ci hanno permesso di mappare la distribuzione dei nervi e il volume di diverse cellule che esprimono intrinsecamente proteine fluorescenti o sono marcate con anticorpi marcati in fluorescenza, utilizzando la microscopia a fluorescenza a foglio di luce16. Lo sviluppo di tecniche di rilevazione molecolare multiplex in tessuti puliti sta avanzando rapidamente. Questi metodi consentono la profilazione simultanea di vari analiti biologici da singoli campioni, che è fondamentale per comprendere sistemi biologici complessi come i microambienti tumorali e le reti neuronali dense. Inoltre, metodi come FISH e DNA Exchange Imaging si dimostrano promettenti nel migliorare il multiplexing attraverso il DNA barcoding e l'imaging rapido. Il futuro dell'imaging proteico altamente multiplex potrebbe risiedere nell'utilizzo di anticorpi coniugati con acido nucleico per la rilevazione specifica, sensibile e multiplexata, consentendo un'analisi completa di tessuti complessi17.
In conclusione, descriviamo un modo promettente per estrarre e preparare campioni di cervello e midollo spinale chiariti. Il nostro studio aiuterà i ricercatori a svolgere ricerche pertinenti. Il nostro protocollo ha raggiunto la trasparenza del tessuto nei topi perfusi con PFA. Tuttavia, una recente pubblicazione riporta che gli scienziati hanno scoperto un colorante non tossico che può essere applicato sulla pelle del topo per renderla temporaneamente trasparente18. Ciò consente ai ricercatori di osservare le strutture fisiologiche sotto la pelle, compresi i vasi sanguigni e gli organi interni. Questa tecnologia potrebbe diventare più avanzata nel prossimo futuro, con miglioramenti nello spessore e nel grado di trasparenza, consentendo l'osservazione in vivo di vari organi del topo, tra cui il sistema nervoso centrale e periferico, il sistema respiratorio e il sistema circolatorio19.
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Fondazione Nazionale di Scienze Naturali della Cina (sovvenzione n. 82101249 e n. 82471204 a XY Sun). Fondazione di ricerca post-dottorato della Cina (sovvenzione n. 2022M722125 a XY Sun).
Materiali
| Name | Company | Catalog Number | Comments |
| 1 ml syringe | Shandong Weigao Group Medical Polymer | ||
| 502 glue | Deli Group | ||
| BD insulin syringe | Becton,Dickinson and Company | 328421 | |
| Bend toothed dissecting forceps | Jinzhong | JD1050 | |
| Circular steel clamp | Weili | ||
| Fine scissors | Jinzhong | y00030 | |
| Hemostatic forceps bent with tooth | Jinzhong | J31020 | |
| Hemostatic forceps straight with tooth | Jinzhong | J31010 | |
| Infusion needle 0.7mm | Kindly Group | ||
| Light box scale line | Nuohai Life Science | NH210901 | |
| Microdissection straight forceps | Jinzhong | WA3020 | |
| NobeliumSoftware | Nuohai Life Science | Scanning software | |
| paraformaldehyde | Biosharp | BL539A | |
| Peristaltic pumps | Nuohai Life Science | NH1000 | |
| Peristaltic pumps head | Nuohai Life Science | NH-15 | |
| Phosphate buffered saline | Servicebio | G4202 | |
| Sodium heparin | Shanghai Pharma | H31022051 | |
| STOCK Tg (Thy1-EGFP) MJrs/J strain mice | Jackson Laboratory | 007788 | |
| Straight toothed dissecting forceps | Jinzhong | JD1060 | |
| Tissue clearing Kit(hyrophilic) | Nuohai Life Science | NH-CR-210701 | |
| Tissue culture treater 100mm x 20mm | NEST | 704001 | |
| Tissue scissors | Jinzhong | J21040 | |
| Tribromoethanol | Aibei Biotechnology | M2910 | |
| Venus scissors | Jinzhong | YBC010 |
Riferimenti
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21 (2), 61-79 (2020).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annu Rev Cell Dev Biol. 32, 713-741 (2016).
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chem Biol. 23 (1), 137-157 (2016).
- Wu, M., et al. Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity. Cell. 187 (12), 2935-2951.e19 (2024).
- Liu, T., et al. Local sympathetic innervations modulate the lung innate immune responses. Sci Adv. 6 (20), eaay1497 (2020).
- Qi, Y., et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 5 (1), eaau8355 (2019).
- Bagnoli, S., Terzibasi Tozzini, E., Cellerino, A. Whole-Brain clearing and immunofluorescence in Nothobranchius furzeri. Cold Spring Harb Protoc. 2023 (9), 698-704 (2023).
- Lu, T., Shinozaki, M., Nagoshi, N., Nakamura, M., Okano, H. 3D imaging of supraspinal inputs to the thoracic and lumbar spinal cord mapped by retrograde tracing and light-sheet microscopy. J Neurochem. 162 (4), 352-370 (2022).
- Saritas, T., Puelles, V. G., Su, X. T., Ellison, D. H., Kramann, R. Optical clearing and imaging of immunolabeled kidney tissue. J Vis Exp. (149), e60002 (2019).
- Song, J. H., et al. Precise mapping of single neurons by calibrated 3D reconstruction of brain slices reveals topographic projection in mouse visual cortex. Cell Rep. 31 (8), 107682 (2020).
- Fournel, R., Veruki, M. L., Hartveit, E. Digital reconstruction and quantitative morphometric analysis of bipolar cells in live rat retinal slices. J Comp Neurol. 530 (10), 1700-1728 (2022).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat Methods. 15 (12), 1033-1036 (2018).
- Peng, Y. C., et al. Rapid histological assessment of prostate specimens in the three-dimensional space by hydrophilic tissue clearing and confocal microscopy. J Histochem Cytochem. 70 (8), 597-608 (2022).
- Singhal, P., et al. Evaluation of histomorphometric changes in tissue architecture in relation to alteration in fixation protocol - An in vitro study. J Clin Diagn Res. 10 (8), ZC28-ZC32 (2016).
- Tainaka, K., et al. Chemical landscape for tissue clearing based on hydrophilic reagents. Cell Rep. 24 (8), 2196-2210.e9 (2018).
- Lee, S. H., Son, H. J. Second wave, late-stage neuroinflammation in cleared brains of aged 5xFAD Alzheimer's mice detected by macrolaser light sheet microscopy imaging. Int J Mol Sci. 24 (23), 242317058 (2023).
- Zhao, J., Lai, H. M., Qi, Y., He, D., Sun, H. Current status of tissue clearing and the path forward in neuroscience. ACS Chem Neurosci. 12 (1), 5-29 (2021).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385 (6713), eadm6869 (2024).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385, eadm6869 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon