Method Article
استخراج وتنظيف الأنسجة تحضير عينات الدماغ والحبل الشوكي للفئران
* These authors contributed equally
In This Article
Summary
تقدم هذه الدراسة بروتوكولا لاستخراج وإعداد عينات من الدماغ والحبل الشوكي التي تم تطهيرها مع إشارات الفلورسنت المحفوظة ، مما يعزز الكفاءة التجريبية وسلامة البيانات لتعزيز أبحاث علم الأعصاب.
Abstract
تتطلب أبحاث علم الأعصاب التي تركز على الجهاز العصبي المركزي فهما شاملا للعوامل المختلفة ، بما في ذلك توزيع الخلايا والاتصال العصبي والديناميكيات الجزيئية. غالبا ما تتضمن المنهجيات التقليدية لفحص الدماغ والحبل الشوكي بالكامل عزل شرائح الأنسجة وتقسيمها ومسحها ضوئيا ، تليها عملية كثيفة العمالة لإعادة بناء الصورة ثلاثية الأبعاد. يمكن أن يكون هذا النهج التقليدي مضيعة للوقت ومرهقا. أحدثت التطورات في تقنيات تنظيف الأنسجة وتصوير الأعضاء بالكامل ثورة في تحليل الدماغ والحبل الشوكي بالكامل. لتعظيم إمكانات هذه الأساليب المبتكرة ، من الضروري استخراج عينات الدماغ وتنظيفها مع الحفاظ على اتصالها بالحبل الشوكي. يوفر هذا البروتوكول دليلا مفصلا ومنهجيا لإعداد عينات من الدماغ المتصلة بالحبل الشوكي ، مع تحديد إجراءات القلع والتنظيف. من خلال تبسيط هذه العمليات ، يعزز هذا النهج بشكل كبير الكفاءة التجريبية وسلامة البيانات ، وبالتالي تعزيز التقدم في أبحاث علم الأعصاب وتمكين إجراء تحقيقات أكثر شمولا في تعقيدات الجهاز العصبي المركزي.
Introduction
يوفر رسم الخرائط والتحليل الدقيق لتوزيع الأعصاب رؤى قيمة حول التنظيم الهيكلي والوظيفي للجهاز العصبي المركزي ، مما يمهد الطريق لاستراتيجيات علاجية مبتكرة وتعزيز فهمنا العام للآليات العصبية. حاليا ، تفتقر دروس الفيديو الشاملة لتوجيه الباحثين في إعداد واستخراج عينات الدماغ المتصلة بالحبل الشوكي وتحقيق إزالة الأنسجة بنجاح.
هناك العديد من طرق إزالة الأنسجة المتاحة: طرق إزالة الأنسجة الكارهة للماء ، والمحبة للماء ، والقائمة على الهائل الهيدروجيمي ، وطرق تطهير توسيع الأنسجة1،2،3. يتم تطبيق تقنية تطهير الأنسجة على نطاق واسع في دراسة الأعضاء مثل الطحال4 ، والرئتين5 ، وعضلة المعدة6 ، والدماغ7 ، والحبل الشوكي8 ، والكلى9. سيوفر بروتوكولنا إرشادات مفصلة حول كيفية تحضير عينات الدماغ بالكامل المتصلة بالحبل الشوكي والتي تم تصنيفها بعلامة الفلورسنت باستخدام فئران سلالة STOCK Tg (Thy1-EGFP) MJrs / J. سيقدم إرشادات خطوة بخطوة لاستخراج العينات ويصف بروتوكول المقاصة باستخدام مجموعات محبة للماء لتنظيف الأنسجة. يساعد هذا البروتوكول الباحثين على إتقان العملية برمتها من استخراج عينة الدماغ والحبل الشوكي إلى التحضير والمسح اللاحق. لن يؤدي ذلك إلى تعزيز الكفاءة التجريبية فحسب ، بل سيضمن أيضا سلامة العينات وجودتها ، مما يوفر بيانات أكثر دقة وموثوقية لدعم أبحاث علم الأعصاب.
بالمقارنة مع طرق التقسيم التقليدية والتصوير وإعادة البناءثلاثية الأبعاد 10،11 ، فإن النهج المقدم هنا يوفر العديد من المزايا الرئيسية ، مثل (1) السلامة الهيكلية المحسنة: من خلال الحفاظ على بنية العضو بأكمله ، تقلل هذه الطريقة من خطر فقدان المعلومات الهامة التي يمكن أن تحدث مع التقسيم12; (2) الحصول على البيانات الشاملة: يسمح استخدام مجموعة أدوات إزالة الأنسجة برسم خرائط مفصلة للخلايا التي يصعب تحقيقها باستخدام التقنيات التقليدية ؛ (3) الكفاءة والدقة: يبسط البروتوكول العملية برمتها من استخراج العينة إلى التصوير ، مما يقلل من الوقت الذي تتطلبه الكيمياء المناعية أو إجراءات التلوين ويقلل من الأخطاء المرتبطة بالتقسيم والتركيب13.
يتغلب البروتوكول على قيود طرق التقسيم التقليدية ، والتي غالبا ما تؤدي إلى بيانات غير مكتملة ومجزأة. من خلال الحفاظ على العلاقة السليمة بين الدماغ والحبل الشوكي واستخدام الأساليب الحديثة لإزالة الأنسجة ، يوفر هذا البروتوكول رؤية أكثر شمولية للجهاز العصبي المركزي ، وهو أمر بالغ الأهمية لفهم الآليات والوظائف العصبية المعقدة. الهدف الأساسي من هذه الطريقة هو تمكين التصوير الشامل للجهاز العصبي المركزي عن طريق إعداد عينات دماغية كاملة متصلة بالحبل الشوكي ، والتي تم تصنيفها بعلامات عصبية فلورية. يهدف هذا البروتوكول إلى تسهيل التصور التفصيلي للهياكل العصبية وتوزيعات الخلايا باستخدام الأساليب التشريحية المتقدمة وتقنيات إزالة الأنسجة.
Protocol
أجريت جميع التجارب على وفقا لإرشادات تقارير التجارب في الجسم الحي (ARRIVE) ودليل المعاهد الوطنية للصحة لرعاية واستخدام المختبر. تمت الموافقة على هذه الدراسة من قبل لجنة رعاية واستخدامه في مستشفى رينجي ، كلية الطب بجامعة شنغهاي جياوتونغ. هنا ، تم استخدام ذكور الفئران من سلالة STOCK Tg (Thy1-EGFP) MJrs / J البالغة من العمر 7-8 أسابيع (أصل C57BL / 6J x CBA) في هذه الدراسة. تم الحصول على تجاريا (انظر جدول المواد) وإيواؤها في أقفاص قياسية (22 درجة مئوية ± 2 درجة مئوية ، 12 ساعة / 12 ساعة دورة الضوء / الظلام ، الطعام ، والماء المخصص).
1. التروية
- تخدير الفئران البالغة بعمق باستخدام 1.25٪ ثلاثي البروم إيثانول (0.02 مل / كجم ، انظر جدول المواد) يتم إعطاؤه عن طريق الحقن داخل الصفاق باستخدام حقنة 1 مل. تحقق من عمق التخدير عن طريق استجابة قرصة إصبع القدم.
- ثبت أطراف الماوس على لوح الأكريليك الأبيض باستخدام المشابك الفولاذية. اقطع الجلد بين عظمي الفخذ في الفأر واستمر في القطع لأعلى حتى تصل إلى الحجاب الحاجز. افتح جانبي الصدر من خلال الحجاب الحاجز لكشف القلب باستخدام المقص والملقط المستقيم.
- أدخل إبرة تسريب 0.7 مم في البطين الأيسر. قم بعمل شق 1-2 مم في الزائدة الأذينية اليمنى.
- Perfuse مع 1x PBS يحتوي على 10 U / مل من هيبارين الصوديوم بمعدل 10 مل / دقيقة بمضخة تمعجية (انظر جدول المواد) لتنقية الدم تماما. يشير تحول الكبد إلى شاحب تماما إلى التصفية الناجحة.
- النفخ مع 50 مل من PFA المبرد مسبقا 4٪ بمضخة تمعجية بمعدل 10 مل / دقيقة. راقب علامات مثل تجعد ذيل الفأر وارتعاش العضلات.
ملاحظة: يمكن أن يؤثر التروية غير الناجحة على عمليات المقاصة اللاحقة.
2. استخراج العينة
- قم بتشريح الدماغ والحبل الشوكي بالكامل بعناية باستخدام المقص والملقط لتجنب إتلاف العينة.
- افصل الجلد الموجود على ظهر الفأر ورأسه باستخدام مقص العيون. قطع العمود الفقري عند النقطة التي يتقاطع فيها الخط الذي يربط الحواف الخلفية العلوية لكلا الطرفين مع العمود الفقري.
- قم بإزالة الأنسجة العضلية والدهنية من رقبة الفأر وظهره لكشف العمود الفقري والجمجمة. اقطع على طول فجوة خط الوسط بين الجانبين الأيسر والأيمن من العمود الفقري والحبل الشوكي من الطرف السفلي من القناة الفقرية باستخدام مقص كوكب الزهرة.
- قم بإزالة الجزء العلوي والجوانب الجانبية من العمود الفقري المقطوع لكشف الحبل الشوكي. كرر الخطوات حتى تصل إلى اتصال الدماغ.
- ضع طرف شفرة واحدة من مقص الزهرة بين الثقبة الماغنوم والدماغ. حرك واقطع على طول خياطة منتصف السهمية لفتح الجمجمة. استخدم الملقط لإزالة الجمجمة وفضح الدماغ.
- قم بإزالة أنسجة الدماغ والحبل الشوكي للفأر من نهاية الجمجمة باستخدام الملقط ومقص الزهرة.
ملاحظة: يمكن أن تتفاقم الجروح أو تلف السطح أثناء الإزالة اللاحقة، مما قد يتسبب في تلف العينة بشكل غير متوقع. تعامل مع العينات بعناية. - استخدم ملقط تشريح لإزالة غشاء الحبل الشوكي تحت المجهر المجسم.
- ثبت عينة الدماغ والحبل الشوكي في لوحة التثبيت (انظر جدول المواد) باستخدام الغرز. أضف ما لا يقل عن 20 ضعف حجم العينة البالغ 4٪ PFA وضعه على شاكر عند 4 درجات مئوية للتقليب البطيء. إصلاح بين عشية وضحاها لمدة 16-24 ساعة.
ملاحظة: يؤدي التثبيت المفرط إلى الربط المفرط للبروتين ، مما يقلل من كفاءة المقاصة14. يمكن أن يتسبب التثبيت غير الكافي أو المتأخر في تدهور المستضد وتدمير مورفولوجيا الأنسجة. - تخلص من PFA واغسل العينة 3x باستخدام 1x PBS. تأكد من أن حجم PBS لا يقل عن 10 أضعاف حجم العينة ، مع غمر العينة بالكامل. تستمر كل غسلة لمدة ساعتين مع تحريك على شاكر بسرعة لا تقل عن 60 دورة في الدقيقة لإزالة PFA المتبقي تماما.
3. تطهير الأنسجة
ملاحظة: هنا ، يتم استخدام مجموعة أدوات إزالة الأنسجة (انظر جدول المواد).
- تحضير محلول إزالة الدهون عن طريق خلط الحل A والمحلول B بنسبة كتلة 9: 1.
ملاحظة: يوصى بأن يكون حجم محلول إزالة الدهون أكثر من 20 ضعف حجم العينة. - ضع الأنسجة الثابتة في أنبوب طرد مركزي سعة 50 مل وأضف 50 مل من محلول إزالة الدهون. ضع أنبوب الطرد المركزي في شاكر عند 37 درجة مئوية ، مع رجه برفق عند 60 دورة في الدقيقة لإزالة الدهون. قم بتغيير محلول إزالة الدهون يوميا لمدة 3-5 أيام. لتحديد الاكتمال ، ضع أنبوب الطرد المركزي على صندوق ضوئي بخط مقياس. إذا كان خط المقياس الأسود مرئيا بوضوح وغير مشوه من خلال العينة ، فإن العملية قد اكتملت.
- ضع العينة في 20 مل من المحلول C على شاكر عند 25 درجة مئوية ، مع رجها عند أقل من 60 دورة في الدقيقة لمطابقة معامل الانكسار. قم بتغيير الحل C بعد 24 ساعة. ضع طبق الثقافة مع العينة مغمورة بالكامل في الحل C على صندوق خفيف بخط مقياس. إذا كان خط المقياس الأسود مرئيا بوضوح وغير مشوه من خلال العينة ، فإن عملية المطابقة تكتمل.
ملاحظة: بالنسبة لأنسجة الفئران البالغة ، تكتمل مطابقة معامل الانكسار عادة في غضون يومين.
4. تضمين الأنسجة
- تحضير محلول الجل مع 147 جم من المحلول C في زجاجة زجاجية سعة 200 مل ، أضف 3.0 جم من الاغاروز ، واخلطه جيدا عن طريق الدوامة ، ثم الميكروويف حتى الغليان وأطفئ الميكروويف على الفور. انقل أنبوب الطرد المركزي إلى حاضنة عند 37 درجة مئوية حتى يذوب الاغاروز.
ملاحظة: يوصى بتحضير محلول الجل طازجا حسب الحاجة. - قم بتضمين العينة التي تم تنظيفها بطبقة بعمق 2 مم من محلول هلام 37 درجة مئوية في القالب وتبرد في ثلاجة 4 درجات مئوية لمدة 30 دقيقة حتى تصبح شبه صلبة. ضع العينة المتطابقة مع معامل الانكسار في القالب وأضف محلول الجل ليكون مستويا أو أقل بقليل من الجزء العلوي من العينة.
- ضع القالب مرة أخرى في الثلاجة 4 درجات مئوية لمدة ساعتين. أضف محلول الجل حتى يتساو مع سطح القالب. غطيها بغطاء. تسريع التصلب في الثلاجة 4 درجات مئوية لمدة 2 ساعة. قم بتخزين العينة المضمنة طوال الليل في الثلاجة 4 درجات مئوية. تابع التصوير في أسرع وقت ممكن.
5. المسح الضوئي
- قم بإزالة الغطاء بالملاقط وأخرج العينة المضمنة. ضع العينة في أنبوب سعة 50 مل وأضف 30 مل من محلول التصوير لغمر العينة بالكامل.
- ضع مادة لاصقة 502 لتثبيت العينة بإحكام على حامل العينة. ثبت الحامل على جهاز التصوير.
- قم بتشغيل برنامج المسح كما هو موضح. حدد مستوى التكبير 4x في قسم التكبير. انقر فوق الزر "معايرة" لتنشيط وضع المعايرة.
- انقر فوق الزر "معاينة " للدخول إلى وضع المعاينة. انقر فوق زر حركة الاتجاه Z لتحريك العينة ببطء لأعلى من أسفل حجرة العينة حتى تمر ورقة الضوء التي تم إنشاؤها عبر العينة.
- حدد خيار قناة الليزر ووضع الإضاءة المناسبين. حدد اتجاه مسار المسح الضوئي للعينة. انقر فوق الزر Auto Scan لبدء التقاط العينة.
النتائج
يعمل هذا البروتوكول على عزل الدماغ بأكمله المتصل بالحبل الشوكي بنجاح في الفئران الذكور من سلالة STOCK Tg (Thy1-EGFP) MJrs / J. كما أنه يجعل العينات شفافة ، مما يضمن الحفاظ على إشارات الفلورسنت والتقاطها بالكامل ، مما يوفر صورا واضحة ومفصلة تحافظ على سلامة التألق الأصلي.
يعرض الشكل 1 حبل دماغي نخاعي سليما ، مما يدل على أن خطوات التشريح الموضحة في هذا البروتوكول دقيقة. بالإضافة إلى ذلك ، تم إجراء إزالة الأنسجة بدقة عالية ، مما أدى إلى إنتاج عينات شفافة تمكن من تصور الهياكل العصبية المعقدة. علاوة على ذلك ، يوضح الشكل 2 أن عينة الدماغ والحبل الشوكي مع تصوير إشارة الفلورسنت محفوظة جيدا بشكل ملحوظ ، مما يوفر صورا واضحة ومفصلة تحتفظ بسلامة التألق الأصلي. يقدم الشكل 3 صورة تكبير أعلى للخلايا الفردية الموضحة في الشكل 2.

الشكل 1: الحبل الشوكي الدماغي السليم. ترتبط أنسجة المخ بالحبل الشوكي ، قبل التنظيف وبعده. شريط المقياس = 2 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
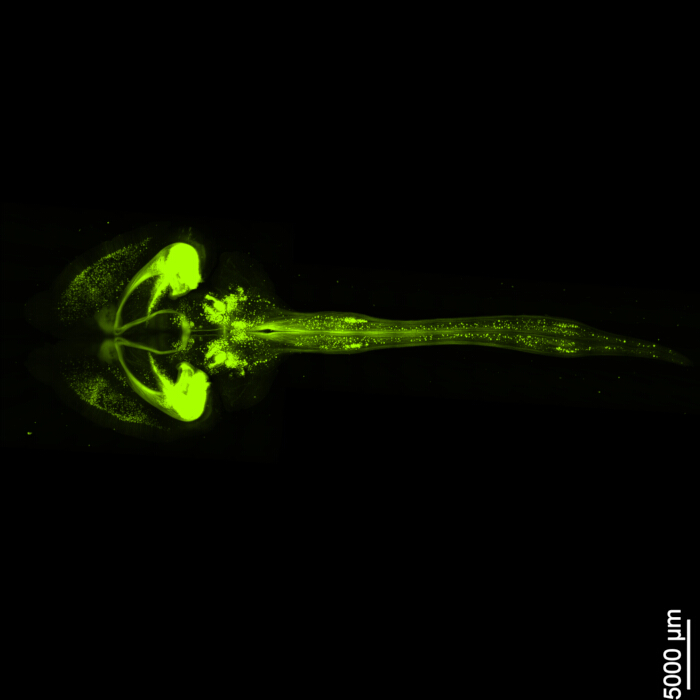
الشكل 2: EGFP الفلوري ثلاثي الأبعاد. تظهر الصورة الدماغ بأكمله مع ارتباطه بالحبل الشوكي. شريط المقياس = 5000 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
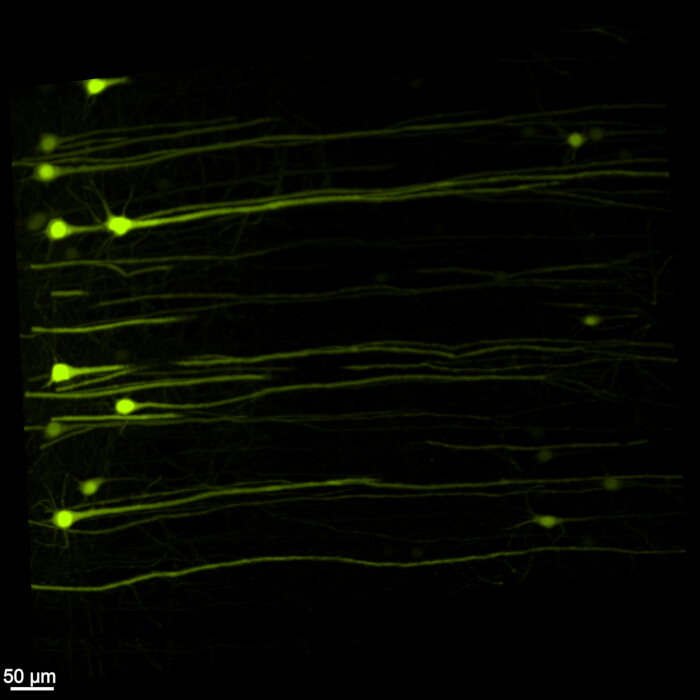
الشكل 3: EGFP الفلوري ثلاثي الأبعاد عالي التكبير. صورة تكبير أعلى تسلط الضوء على الخلايا الفردية التي تعبر عن EGFP داخل عينة الدماغ والحبل الشوكي. شريط المقياس = 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يتضمن البروتوكول التجريبي المقترح استخدام الفئران التي ترتبط أدمغتها بالحبال الشوكية المسمى بفيروسات التتبع العصبي الفلوري. يوفر هذا البروتوكول تعليمات شاملة ومفصلة حول إعداد عينات الدماغ الكاملة التي تظل متصلة بالحبل الشوكي. يحدد البروتوكول بدقة كل خطوة ، مما يضمن أن الباحثين يمكنهم تكرار العملية بدقة.
تساهم العديد من الخطوات الحاسمة في هذا البروتوكول في تحسين جودة المقاصة والتصوير. يعد استخراج عينات الدماغ الكاملة المتصلة بالحبل الشوكي مهمة مهمة. يعد الحفاظ على سلامة الدماغ والحبل الشوكي أمرا بالغ الأهمية للتتبع الدقيق والتحليل اللاحق. عند جمع العينات ، قد تتفاقم الشقوق أو تلف السطح أثناء عملية الإزالة اللاحقة ، مما قد يؤدي إلى ضرر لا يمكن التنبؤ به. لضمان سلامة العينات ، من الضروري استخدام مقص فينوس وملاقط التشريح المحددة في المواد لأخذ العينات الدقيقة. يعد تثبيت عينة الدماغ والحبل الشوكي على لوحة التثبيت بالخيوط خطوة حاسمة لمنع التشوه الناجم عن الجاذبية أو الضغط أو عوامل أخرى أثناء غمرها في السائل.
غالبا ما ركزت الأبحاث السابقة حصريا على بنية ووظيفة الدماغ أو الحبل الشوكي8 . ومع ذلك ، يعمل الجهاز العصبي المركزي كوحدة متماسكة. يعد نقل الإشارات من الدماغ إلى الأسفل ونقل الإشارات الطرفية عبر الحبل الشوكي إلى المراكز العليا عملية معقدة. يعد الوصول إلى عينات شاملة من الدماغ والحبل الشوكي مفيدا للتحقيق في تكامل هذه الإشارات.
هناك العديد من الأساليب الأولية المتاحة لتطهير الأنسجة: طرق إزالة الأنسجة الكارهة للماء ، والمحبة للماء ، والقائمة على الهيمدروجيل ، وتطهير الأنسجة1،2،3. المبادئ والأساليب الأساسية هي نفسها: استبدال الجزيئات التي تنحرف الضوء (مثل الدهون والأصباغ وفوسفات الكالسيوم) بجزيئات أخرى تتطابق مع معامل الانكسار لوسط التصوير2،15. عادة ما تشكل طرق المقاصة المحبة للماء مشكلات سمية أقل وتكون أكثر فعالية في الحفاظ على إشارات البروتينات والأصباغ الفلورية1،2،3 ؛ ومع ذلك ، لديهم العديد من العيوب. يمكن أن تسبب تورم الأنسجة وتقلبات الحجم ، مما قد يؤثر على السلامة الهيكلية للعينات. قد يؤدي استخدام مركبات فرط الترطيب مثل اليوريا والفورماميد إلى تمسخ البروتين ، مما يؤثر على الأهمية البيولوجية للأنسجة. بالإضافة إلى ذلك ، في حين أن هذه الطرق بسيطة بشكل عام ومتوافقة مع وضع العلامات الفلورية ، فإن تحقيق المقاصة المثلى للأنسجة الكبيرة غالبا ما يتطلب بروتوكولات معقدة تتضمن مواد كيميائية مختلفة ، مما قد يعقد العملية. علاوة على ذلك ، فإن الحاجة إلى مخاليط كيميائية دقيقة لضبط مقصورات أنسجة معينة تضيف إلى التعقيد ، مما يتطلب تحسينا دقيقا لتطبيقات محددة.
مكنتنا التطورات في تقنيات تطهير الأنسجة والتصوير من رسم خريطة لتوزيع الأعصاب وحجم الخلايا المختلفة التي إما تعبر جوهريا عن بروتينات الفلورسنت أو يتم تصنيفها بأجسام مضادة ذات علامات فلورية ، باستخدام الفحص المجهري الفلوري16. يتقدم تطوير تقنيات الكشف الجزيئي متعددة الإرسال في الأنسجة التي تم تطهيرها بسرعة. تسمح هذه الطرق بالتنميط المتزامن لمختلف التحليلات البيولوجية من عينات مفردة ، وهو أمر بالغ الأهمية لفهم الأنظمة البيولوجية المعقدة مثل البيئات الدقيقة للورم والشبكات العصبية الكثيفة. بالإضافة إلى ذلك ، تظهر طرق مثل FISH و DNA Exchange Imaging واعدة في تعزيز تعدد الإرسال من خلال الترميز الشريطي للحمض النووي والتصوير السريع. قد يكمن مستقبل تصوير البروتين متعدد الإرسال بدرجة عالية في استخدام الأجسام المضادة المترافقة بالحمض النووي للكشف المحدد والحساس ومضاعف الإرسال ، مما يتيح تحليلا شاملا للأنسجة المعقدة17.
في الختام ، نصف طريقة واعدة لاستخراج وإعداد عينات من الدماغ والحبل الشوكي التي تم تطهيرها. ستساعد دراستنا الباحثين على إجراء البحوث ذات الصلة. حقق بروتوكولنا أنسجة شفافية في الفئران المغذية ب PFA. ومع ذلك ، أفاد منشور حديث أن العلماء اكتشفوا صبغة غير سامة يمكن وضعها على جلد الفأر لجعلها شفافة مؤقتا18. يسمح ذلك للباحثين بمراقبة الهياكل الفسيولوجية تحت الجلد ، بما في ذلك الأوعية الدموية والأعضاء الداخلية. قد تصبح هذه التقنية أكثر تقدما في المستقبل القريب ، مع تحسينات في سمك ودرجة الشفافية ، مما يتيح المراقبة في الجسم الحي لأعضاء الفئران المختلفة ، بما في ذلك الجهاز العصبي المركزي والمحيطي والجهاز التنفسي والدورةالدموية 19.
Disclosures
ويعلن أصحاب البلاغ عدم وجود مصالح متضاربة.
Acknowledgements
المؤسسة الوطنية للعلوم الطبيعية في الصين (المنحة رقم 82101249 ورقم 82471204 إلى XY Sun). مؤسسة أبحاث ما بعد الدكتوراه في الصين (المنحة رقم 2022M722125 إلى XY Sun).
Materials
| Name | Company | Catalog Number | Comments |
| 1 ml syringe | Shandong Weigao Group Medical Polymer | ||
| 502 glue | Deli Group | ||
| BD insulin syringe | Becton,Dickinson and Company | 328421 | |
| Bend toothed dissecting forceps | Jinzhong | JD1050 | |
| Circular steel clamp | Weili | ||
| Fine scissors | Jinzhong | y00030 | |
| Hemostatic forceps bent with tooth | Jinzhong | J31020 | |
| Hemostatic forceps straight with tooth | Jinzhong | J31010 | |
| Infusion needle 0.7mm | Kindly Group | ||
| Light box scale line | Nuohai Life Science | NH210901 | |
| Microdissection straight forceps | Jinzhong | WA3020 | |
| NobeliumSoftware | Nuohai Life Science | Scanning software | |
| paraformaldehyde | Biosharp | BL539A | |
| Peristaltic pumps | Nuohai Life Science | NH1000 | |
| Peristaltic pumps head | Nuohai Life Science | NH-15 | |
| Phosphate buffered saline | Servicebio | G4202 | |
| Sodium heparin | Shanghai Pharma | H31022051 | |
| STOCK Tg (Thy1-EGFP) MJrs/J strain mice | Jackson Laboratory | 007788 | |
| Straight toothed dissecting forceps | Jinzhong | JD1060 | |
| Tissue clearing Kit(hyrophilic) | Nuohai Life Science | NH-CR-210701 | |
| Tissue culture treater 100mm x 20mm | NEST | 704001 | |
| Tissue scissors | Jinzhong | J21040 | |
| Tribromoethanol | Aibei Biotechnology | M2910 | |
| Venus scissors | Jinzhong | YBC010 |
References
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21 (2), 61-79 (2020).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annu Rev Cell Dev Biol. 32, 713-741 (2016).
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chem Biol. 23 (1), 137-157 (2016).
- Wu, M., et al. Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity. Cell. 187 (12), 2935-2951.e19 (2024).
- Liu, T., et al. Local sympathetic innervations modulate the lung innate immune responses. Sci Adv. 6 (20), eaay1497 (2020).
- Qi, Y., et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 5 (1), eaau8355 (2019).
- Bagnoli, S., Terzibasi Tozzini, E., Cellerino, A. Whole-Brain clearing and immunofluorescence in Nothobranchius furzeri. Cold Spring Harb Protoc. 2023 (9), 698-704 (2023).
- Lu, T., Shinozaki, M., Nagoshi, N., Nakamura, M., Okano, H. 3D imaging of supraspinal inputs to the thoracic and lumbar spinal cord mapped by retrograde tracing and light-sheet microscopy. J Neurochem. 162 (4), 352-370 (2022).
- Saritas, T., Puelles, V. G., Su, X. T., Ellison, D. H., Kramann, R. Optical clearing and imaging of immunolabeled kidney tissue. J Vis Exp. (149), e60002 (2019).
- Song, J. H., et al. Precise mapping of single neurons by calibrated 3D reconstruction of brain slices reveals topographic projection in mouse visual cortex. Cell Rep. 31 (8), 107682 (2020).
- Fournel, R., Veruki, M. L., Hartveit, E. Digital reconstruction and quantitative morphometric analysis of bipolar cells in live rat retinal slices. J Comp Neurol. 530 (10), 1700-1728 (2022).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat Methods. 15 (12), 1033-1036 (2018).
- Peng, Y. C., et al. Rapid histological assessment of prostate specimens in the three-dimensional space by hydrophilic tissue clearing and confocal microscopy. J Histochem Cytochem. 70 (8), 597-608 (2022).
- Singhal, P., et al. Evaluation of histomorphometric changes in tissue architecture in relation to alteration in fixation protocol - An in vitro study. J Clin Diagn Res. 10 (8), ZC28-ZC32 (2016).
- Tainaka, K., et al. Chemical landscape for tissue clearing based on hydrophilic reagents. Cell Rep. 24 (8), 2196-2210.e9 (2018).
- Lee, S. H., Son, H. J. Second wave, late-stage neuroinflammation in cleared brains of aged 5xFAD Alzheimer's mice detected by macrolaser light sheet microscopy imaging. Int J Mol Sci. 24 (23), 242317058 (2023).
- Zhao, J., Lai, H. M., Qi, Y., He, D., Sun, H. Current status of tissue clearing and the path forward in neuroscience. ACS Chem Neurosci. 12 (1), 5-29 (2021).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385 (6713), eadm6869 (2024).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385, eadm6869 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved