Method Article
Extraktion und Gewebereinigung Aufbereitung von Proben aus dem Gehirn und dem Rückenmark der Maus
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Studie stellt ein Protokoll für die Extraktion und Aufbereitung von geklärten Ganzhirn- und Rückenmarksproben mit konservierten Fluoreszenzsignalen vor, das die experimentelle Effizienz und Datenintegrität verbessert, um die neurowissenschaftliche Forschung voranzutreiben.
Zusammenfassung
Die neurowissenschaftliche Forschung, die sich auf das zentrale Nervensystem konzentriert, erfordert ein gründliches Verständnis verschiedener Faktoren, einschließlich der Zellverteilung, der neuronalen Konnektivität und der molekularen Dynamik. Traditionelle Methoden zur Untersuchung des gesamten Gehirns und des Rückenmarks umfassen oft das Isolieren, Schneiden und Scannen von Gewebeschnitten, gefolgt von dem arbeitsintensiven Prozess der dreidimensionalen Bildrekonstruktion. Dieser herkömmliche Ansatz kann sowohl zeitaufwändig als auch umständlich sein. Fortschritte bei der Gewebereinigung und der Bildgebung ganzer Organe haben die Analyse des gesamten Gehirns und des Rückenmarks revolutioniert. Um das Potenzial dieser innovativen Methoden zu maximieren, ist es unerlässlich, Gehirnproben zu entnehmen und zu entfernen, während ihre Verbindung zum Rückenmark erhalten bleibt. Dieses Protokoll bietet einen detaillierten und systematischen Leitfaden für die Vorbereitung von Proben des Gehirns, die mit dem Rückenmark verbunden sind, und beschreibt die Entnahme- und Reinigungsverfahren. Durch die Rationalisierung dieser Prozesse verbessert dieser Ansatz die experimentelle Effizienz und Datenintegrität erheblich, wodurch Fortschritte in der neurowissenschaftlichen Forschung gefördert und umfassendere Untersuchungen der Komplexität des zentralen Nervensystems ermöglicht werden.
Einleitung
Die genaue Kartierung und Analyse der Nervenverteilung liefert wertvolle Einblicke in die strukturelle und funktionelle Organisation des zentralen Nervensystems, ebnet den Weg für innovative therapeutische Strategien und verbessert unser allgemeines Verständnis der neuronalen Mechanismen. Derzeit fehlen umfassende Video-Tutorials, die Forscher bei der Vorbereitung und Extraktion von Gehirnproben, die mit dem Rückenmark verbunden sind, und bei der erfolgreichen Gewebereinigung unterstützen.
Es stehen verschiedene Ansätze zur Gewebereinigung zur Verfügung: hydrophobe, hydrophile, hydrogelbasierte und gewebeexpandierende Clearing-Methoden 1,2,3. Die Technik der Gewebereinigung wird häufig bei der Untersuchung von Organen wie Milz4, Lunge5, Gastrocnemius-Muskel6, Gehirn7, Rückenmark8 und Nieren9 angewendet. Unser Protokoll enthält detaillierte Anweisungen zur Vorbereitung von Ganzhirnproben, die mit dem Rückenmark verbunden sind und mit Fluoreszenzmarkern unter Verwendung von Mäusen des STOCK Tg (Thy1-EGFP) MJrs/J-Stammes markiert wurden. Es bietet eine Schritt-für-Schritt-Anleitung für die Probenextraktion und beschreibt das Clearing-Protokoll mit hydrophilen Tissue-Clearing-Kits. Dieses Protokoll hilft den Forschern, den gesamten Prozess von der Entnahme der Hirn-Rückenmarks-Probe über die Vorbereitung bis hin zum anschließenden Scannen zu beherrschen. Dies wird nicht nur die experimentelle Effizienz verbessern, sondern auch die Integrität und Qualität der Proben sicherstellen und genauere und zuverlässigere Daten zur Unterstützung der neurowissenschaftlichen Forschung liefern.
Im Vergleich zu herkömmlichen Schnitt-, Bildgebungs- und dreidimensionalen Rekonstruktionsmethoden10,11 bietet der hier vorgestellte Ansatz mehrere entscheidende Vorteile, wie z. B. (1) eine verbesserte strukturelle Integrität: Durch die Beibehaltung der gesamten Organstruktur verringert diese Methode das Risiko des Verlusts kritischer Informationen, die bei Schnitten auftreten können12; (2) Umfassende Datenerfassung: Die Verwendung eines Gewebe-Clearing-Kits ermöglicht eine detaillierte Kartierung von Zellen, die mit herkömmlichen Techniken nur schwer zu erreichen ist; (3) Effizienz und Genauigkeit: Das Protokoll rationalisiert den gesamten Prozess von der Probenextraktion bis zur Bildgebung, reduziert den Zeitaufwand für Immunhistochemie oder Färbeverfahren und minimiert Fehler im Zusammenhang mit dem Schneiden und Einbetten13.
Das Protokoll überwindet die Einschränkungen herkömmlicher Abschnittsmethoden, die oft zu unvollständigen und fragmentierten Daten führen. Durch die Beibehaltung der intakten Hirn-Rückenmark-Verbindung und den Einsatz moderner Gewebereinigungsmethoden bietet dieses Protokoll eine ganzheitlichere Sicht auf das zentrale Nervensystem, was für das Verständnis komplexer neuronaler Mechanismen und Funktionen entscheidend ist. Das primäre Ziel dieser Methode ist es, eine umfassende Bildgebung des zentralen Nervensystems zu ermöglichen, indem Ganzhirnproben hergestellt werden, die mit dem Rückenmark verbunden sind und mit fluoreszierenden neuronalen Markern markiert wurden. Dieses Protokoll zielt darauf ab, eine detaillierte Visualisierung von neuronalen Strukturen und Zellverteilungen mit Hilfe fortschrittlicher anatomischer Methoden und Gewebereinigungstechniken zu ermöglichen.
Protokoll
Alle Tierversuche wurden in Übereinstimmung mit den Richtlinien für Tierversuche (Animal Research Reporting In Vivo Experiments, ARRIVE) und dem Leitfaden der National Institutes of Health für die Pflege und Verwendung von Labortieren durchgeführt. Die vorliegende Studie wurde vom Animal Care and Use Committee des Renji Hospital der Shanghai Jiaotong University School of Medicine genehmigt. Hier wurden für die vorliegende Studie 7-8 Wochen alte männliche Mäuse des Stammes STOCK Tg (Thy1-EGFP) MJrs/J (C57BL/6J x CBA-Herkunft) verwendet. Die Tiere wurden kommerziell gewonnen (siehe Materialtabelle) und in Standardkäfigen untergebracht (22 °C ± 2 °C, 12 h/12 h Hell-/Dunkelzyklus, Futter und Wasser ad libitum).
1. Durchblutung
- Erwachsene Mäuse werden mit 1,25 % Tribromethanol (0,02 ml/kg, siehe Materialtabelle) tief anästhesiert, die durch intraperitoneale Injektion mit einer 1-ml-Spritze verabreicht wird. Überprüfen Sie die Tiefe der Anästhesie durch Zehenkneifreaktion.
- Befestigen Sie die Gliedmaßen der Maus mit Stahlklammern an der weißen Acrylplatte. Schneiden Sie die Haut zwischen den beiden Oberschenkelknochen der Maus ein und schneiden Sie weiter nach oben, bis Sie das Zwerchfell erreichen. Öffnen Sie beide Seiten des Brustkorbs durch das Zwerchfell, um das Herz mit einer Schere und einer geraden Pinzette freizulegen.
- Führen Sie eine 0,7-mm-Infusionsnadel in den linken Ventrikel ein. Machen Sie einen 1-2 mm Schnitt im rechten Vorhofohr.
- Perfusion mit 1x PBS mit 10 U/ml Natriumheparin in einer Geschwindigkeit von 10 mL/min mit einer Peristaltikpumpe (siehe Materialtabelle), um das Blut vollständig zu reinigen. Die völlige Blasse der Leber deutet auf eine erfolgreiche Heilungsstörung hin.
- Perfusion mit 50 mL vorgekühltem 4 % PFA mit einer Schlauchpumpe mit einer Geschwindigkeit von 10 mL/min. Achten Sie auf Anzeichen wie das Einrollen des Mausschwanzes und Muskelzuckungen.
HINWEIS: Eine nicht erfolgreiche Perfusion kann sich auf nachfolgende Clearing-Prozesse auswirken.
2. Entnahme der Probe
- Präparieren Sie vorsichtig das gesamte Gehirn und das Rückenmark mit einer Schere und Pinzette, um eine Beschädigung der Probe zu vermeiden.
- Trennen Sie die Haut auf dem Rücken und dem Kopf der Maus mit einer Augenschere. Durchtrennen Sie die Wirbelsäule an der Stelle, an der die Linie, die die oberen Hinterkanten beider Gliedmaßen verbindet, mit der Wirbelsäule schneidet.
- Entfernen Sie Muskel- und Fettgewebe vom Hals und Rücken der Maus, um die Wirbelsäule und den Schädel freizulegen. Schneiden Sie mit einer Venusschere entlang des Mittellinienspalts zwischen der linken und rechten Seite der Wirbelsäule und des Rückenmarks vom unteren Ende des Wirbelkanals aus.
- Entfernen Sie den oberen Teil und die beidseitigen Seiten der durchtrennten Wirbelsäule, um das Rückenmark freizulegen. Wiederholen Sie die Schritte, bis Sie die Gehirnverbindung erreicht haben.
- Platzieren Sie die Spitze einer Klinge der Venusschere zwischen dem Foramen magnum und dem Gehirn. Gleiten und schneiden Sie entlang der mittleren sagittalen Naht, um den Schädel zu öffnen. Benutze eine Pinzette, um den Schädel zu entfernen und das Gehirn freizulegen.
- Entfernen Sie das Hirn-Rückenmarksgewebe der Maus mit einer Pinzette und einer Venusschere vom Schädelende.
HINWEIS: Schnittwunden oder Oberflächenschäden können sich beim anschließenden Reinigen verschlimmern, was zu unvorhersehbaren Probenschäden führen kann. Gehen Sie vorsichtig mit Proben um. - Verwenden Sie eine Präparierzange, um die Rückenmarksmembran unter dem Stereomikroskop zu entfernen.
- Befestigen Sie die Hirn-Rückenmarks-Probe mit Nähten auf der Fixierplatte (siehe Materialtabelle). Mindestens das 20-fache des Probenvolumens von 4 % PFA zugeben und auf einen Schüttler bei 4 °C stellen, um es langsam zu bewegen. Über Nacht für 16-24 h fixieren.
HINWEIS: Eine Überfixierung führt zu einer übermäßigen Proteinvernetzung, wodurch die Clearing-Effizienz verringertwird 14. Eine unzureichende oder verzögerte Fixierung kann zu einem Abbau von Antigenen und einer Zerstörung der Gewebemorphologie führen. - Entsorgen Sie das PFA und waschen Sie die Probe 3x mit 1x PBS. Stellen Sie sicher, dass das PBS-Volumen mindestens das 10-fache des Probenvolumens beträgt, und tauchen Sie die Probe vollständig ein. Jede Wäsche dauert 2 Stunden, wobei auf einem Schüttler mit einer Geschwindigkeit von mindestens 60 U/min gerührt wird, um PFA-Reste gründlich zu entfernen.
3. Reinigung des Gewebes
HINWEIS: Hier wird ein Gewebe-Clearing-Kit verwendet (siehe Materialtabelle).
- Bereiten Sie die Lipidentfernungslösung vor, indem Sie Lösung A und Lösung B in einem Massenverhältnis von 9:1 mischen.
HINWEIS: Es wird empfohlen, dass das Volumen der Lipidentfernungslösung mehr als das 20-fache des Volumens der Probe betragen sollte. - Legen Sie das fixierte Gewebe in ein 50-ml-Zentrifugenröhrchen und fügen Sie 50 ml der Lipidentfernungslösung hinzu. Stellen Sie das Zentrifugenröhrchen bei 37 °C in einen Schüttler und schütteln Sie es vorsichtig bei 60 U/min, um die Lipide zu entfernen. Wechseln Sie die Lipidentfernungslösung täglich für 3-5 Tage. Um die Fertigstellung zu bestimmen, stellen Sie das Zentrifugenröhrchen auf einen Leuchtkasten mit einer Skalenlinie. Wenn die schwarze Skalenlinie deutlich sichtbar und unverzerrt durch die Probe hindurch zu sehen ist, ist der Vorgang abgeschlossen.
- Legen Sie die Probe in 20 mL Lösung C bei 25 °C auf einen Schüttler und schütteln Sie sie bei weniger als 60 U/min, um den Brechungsindex anzupassen. Lösung C nach 24 h wechseln. Stellen Sie die Kulturschale mit der vollständig in Lösung C eingetauchten Probe auf einen Leuchtkasten mit einer Skalenlinie. Wenn die schwarze Skalenlinie deutlich sichtbar und unverzerrt in der Probe zu sehen ist, ist der Abgleichsprozess abgeschlossen.
HINWEIS: Bei adulten Mausgeweben ist die Brechungsindexanpassung in der Regel innerhalb von 2 Tagen abgeschlossen.
4. Einbettung von Gewebe
- Bereiten Sie die Gellösung mit 147 g Lösung C in einer 200-ml-Glasflasche vor, fügen Sie 3,0 g Agarose hinzu, mischen Sie gut durch Vortexen, dann in der Mikrowelle bis zum Kochen und schalten Sie die Mikrowelle sofort aus. Das Zentrifugenröhrchen wird in einen Inkubator bei 37 °C überführt, bis sich die Agarose aufgelöst hat.
HINWEIS: Es wird empfohlen, die Gellösung bei Bedarf frisch zuzubereiten. - Die geklärte Probe wird mit einer 2 mm tiefen Schicht 37 °C Gellösung in die Form eingebettet und in einem 4 °C Kühlschrank 30 Minuten lang abgekühlt, bis sie halbfest ist. Legen Sie die auf den Brechungsindex abgestimmte Probe in die Form und fügen Sie die Gellösung so hinzu, dass sie waagerecht oder leicht unter der Oberseite der Probe liegt.
- Stellen Sie die Form wieder für 2 h in den 4 °C Kühlschrank. Fügen Sie die Gellösung hinzu, bis sie auf Höhe der Formoberfläche ist. Abdeckung mit Deckglas. Beschleunigen Sie die Erstarrung im 4 °C kühlen Kühlschrank für 2 h. Lagern Sie die eingebettete Probe über Nacht im 4 °C-Kühlschrank. Fahren Sie so schnell wie möglich mit der Bildgebung fort.
5. Scannen
- Entfernen Sie das Deckglas mit einer Pinzette und nehmen Sie die eingebettete Probe heraus. Geben Sie die Probe in ein 50-ml-Röhrchen und fügen Sie 30 ml Bildgebungslösung hinzu, um die Probe vollständig einzutauchen.
- Tragen Sie den Klebstoff 502 auf, um die Probe fest auf dem Probenhalter zu befestigen. Befestigen Sie die Halterung am Bildgebungsgerät.
- Führen Sie die Scansoftware wie beschrieben aus. Wählen Sie bei der Vergrößerung die Vergrößerungsstufe von 4x aus. Klicken Sie auf die Schaltfläche Kalibrierung , um den Kalibrierungsmodus zu aktivieren.
- Klicken Sie auf die Schaltfläche Vorschau , um den Vorschaumodus aufzurufen. Klicken Sie auf die Schaltfläche für die Bewegung in Z-Richtung , um die Probe langsam vom Boden der Probenkammer nach oben zu bewegen, bis das erzeugte Lichtblatt die Probe passiert.
- Wählen Sie die entsprechende Option für den Laserkanal und den Beleuchtungsmodus aus. Wählen Sie die Scanpfadrichtung für die Probe aus. Klicken Sie auf die Schaltfläche Auto Scan , um die Aufnahme der Probe zu starten.
Ergebnisse
Dieses Protokoll isoliert erfolgreich das gesamte Gehirn, das mit dem Rückenmark verbunden ist, in männlichen Mäusen des Stammes STOCK Tg (Thy1-EGFP) MJrs/J. Es macht die Proben auch transparent und stellt sicher, dass die Fluoreszenzsignale vollständig erhalten und erfasst werden, und liefert klare und detaillierte Bilder, die die Integrität der ursprünglichen Fluoreszenz bewahren.
Abbildung 1 zeigt ein intaktes Hirn-Rückenmark, was zeigt, dass die in diesem Protokoll beschriebenen Dissektionsschritte präzise sind. Darüber hinaus wurde die Gewebereinigung mit hoher Genauigkeit durchgeführt, wodurch transparente Proben hergestellt wurden, die die Visualisierung komplizierter neuronaler Strukturen ermöglichen. Darüber hinaus zeigt Abbildung 2 , dass die Hirn-Rückenmarks-Probe mit der Fluoreszenzsignalbildgebung bemerkenswert gut erhalten ist und klare und detaillierte Bilder liefert, die die Integrität der ursprünglichen Fluoreszenz beibehalten. Abbildung 3 zeigt ein Bild mit höherer Vergrößerung der einzelnen Zellen, die in Abbildung 2 dargestellt sind.

Abbildung 1: Intaktes Rückenmark des Gehirns. Das Hirngewebe ist sowohl vor als auch nach der Reinigung mit dem Rückenmark verbunden. Maßstabsleiste = 2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
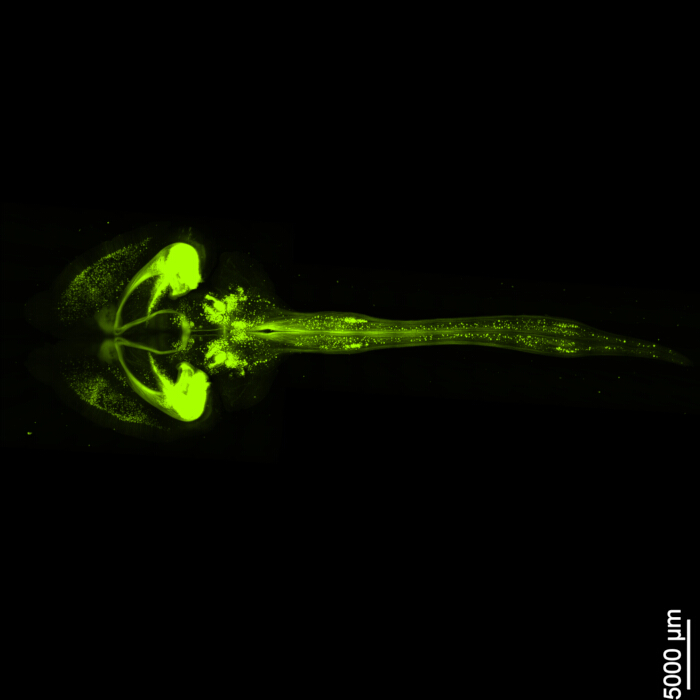
Abbildung 2: Dreidimensionales fluoreszierendes EGFP. Das Bild zeigt das gesamte Gehirn mit seiner Verbindung zum Rückenmark. Maßstabsleiste = 5000 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
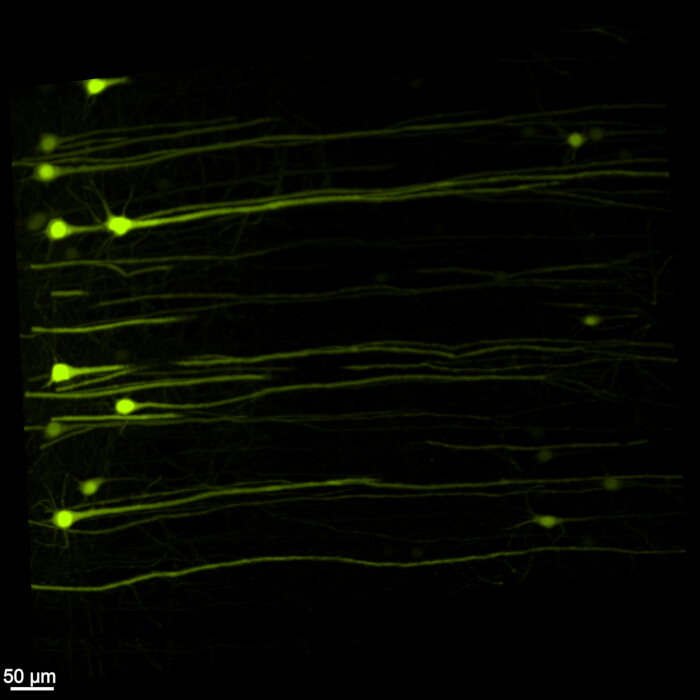
Abbildung 3: Dreidimensionales fluoreszierendes EGFP mit hoher Vergrößerung. Ein Bild mit höherer Vergrößerung, das einzelne EGFP-exprimierende Zellen in der Hirn-Rückenmarks-Probe hervorhebt. Maßstabsleiste = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das vorgeschlagene experimentelle Protokoll beinhaltet die Verwendung von Mäusen, deren Gehirne mit Rückenmark verbunden sind, die mit fluoreszierenden neuronalen Tracing-Viren markiert sind. Dieses Protokoll enthält umfassende und detaillierte Anweisungen zur Vorbereitung von Ganzhirnproben, die mit dem Rückenmark verbunden bleiben. Das Protokoll beschreibt jeden Schritt akribisch und stellt sicher, dass die Forscher den Prozess mit Präzision replizieren können.
Mehrere kritische Schritte in diesem Protokoll tragen zur Verbesserung der Qualität der Klärung und Bildgebung bei. Die vollständige Extraktion von Ganzhirnproben, die mit dem Rückenmark verbunden sind, ist eine wichtige Aufgabe. Die Aufrechterhaltung der Integrität des Gehirns und des Rückenmarks ist entscheidend für eine genaue Rückverfolgung und anschließende Analyse. Bei der Probenentnahme können sich Schnitte oder Oberflächenschäden während des anschließenden Räumungsprozesses verschlimmern, was zu unvorhersehbaren Schäden führen kann. Um die Integrität der Proben zu gewährleisten, ist es wichtig, die Venusschere und die Sezierpinzette zu verwenden, die in den Materialien für eine sorgfältige Probenahme spezifiziert sind. Das Befestigen der Gehirn-Rückenmarks-Probe mit Nähten auf der Fixierplatte ist ein entscheidender Schritt, um Verformungen zu verhindern, die durch Schwerkraft, Druck oder andere Faktoren verursacht werden, während sie in Flüssigkeit getaucht werden.
Bisherige Forschungen konzentrierten sich oft ausschließlich auf die Struktur und Funktion des Gehirns oder des Rückenmarks8 . Das zentrale Nervensystem funktioniert jedoch als zusammenhängende Einheit. Die Übertragung von Signalen vom Gehirn nach unten und die Übertragung von peripheren Signalen nach oben durch das Rückenmark zu höheren Zentren ist ein komplexer Prozess. Der Zugang zu umfassenden Hirn-Rückenmarks-Proben ist von Vorteil, um die Integration dieser Signale zu untersuchen.
Es gibt mehrere primäre Ansätze zur Gewebereinigung: hydrophobe, hydrophile, hydrogelbasierte und gewebeexpandierende Clearing-Methoden 1,2,3. Die zugrundeliegenden Prinzipien und Methoden sind die gleichen: Moleküle, die Licht beugen (wie Lipide, Pigmente und Kalziumphosphat), werden durch andere Moleküle ersetzt, die dem Brechungsindex des Bildgebungsmediums entsprechen 2,15. Hydrophile Clearing-Methoden stellen in der Regel weniger Toxizitätsprobleme dar und sind wirksamer bei der Konservierung der Signale von fluoreszierenden Proteinen und Farbstoffen 1,2,3; Sie haben jedoch einige Nachteile. Sie können Gewebeschwellungen und Volumenschwankungen verursachen, die möglicherweise die strukturelle Integrität der Proben beeinträchtigen. Die Verwendung von hyperhydratisierenden Verbindungen wie Harnstoff und Formamid kann zu einer Denaturierung von Proteinen führen, was sich auf die biologische Relevanz des Gewebes auswirkt. Darüber hinaus sind diese Methoden zwar im Allgemeinen einfach und mit der Fluoreszenzmarkierung kompatibel, aber das Erreichen einer optimalen Reinigung für größere Gewebe erfordert oft komplexe Protokolle mit verschiedenen Chemikalien, die den Prozess erschweren können. Darüber hinaus erhöht der Bedarf an präzisen chemischen Mischungen zur Einstellung bestimmter Gewebekompartimente die Komplexität und erfordert eine sorgfältige Optimierung für bestimmte Anwendungen.
Fortschritte bei der Gewebereinigung und bildgebenden Verfahren haben es uns ermöglicht, die Verteilung von Nerven und das Volumen verschiedener Zellen zu kartieren, die entweder intrinsisch fluoreszierende Proteine exprimieren oder mit fluoreszenzmarkierten Antikörpern markiert sind, und zwar mit Hilfe der Lichtblatt-Fluoreszenzmikroskopie16. Die Entwicklung von molekularen Multiplex-Detektionstechniken in geklärten Geweben schreitet rasant voran. Diese Methoden ermöglichen die gleichzeitige Profilierung verschiedener biologischer Analyten aus einzelnen Proben, was für das Verständnis komplexer biologischer Systeme wie Tumormikroumgebungen und dichter neuronaler Netzwerke von entscheidender Bedeutung ist. Darüber hinaus sind Methoden wie FISH und DNA Exchange Imaging vielversprechend bei der Verbesserung des Multiplexings durch DNA-Barcoding und schnelle Bildgebung. Die Zukunft der hochmultiplexierten Proteinbildgebung könnte in der Verwendung von Nukleinsäure-konjugierten Antikörpern für den spezifischen, sensitiven und multiplexierten Nachweis liegen, die eine umfassende Analyse komplexer Gewebe ermöglichen17.
Abschließend beschreiben wir einen vielversprechenden Weg zur Extraktion und Aufbereitung von geklärten Hirn-Rückenmarks-Proben. Unsere Studie wird Forschern helfen, relevante Forschung durchzuführen. Unser Protokoll erreichte transparentes Gewebe in PFA-perfundierten Mäusen. In einer kürzlich erschienenen Veröffentlichung wird jedoch berichtet, dass Wissenschaftler einen ungiftigen Farbstoff entdeckt haben, der auf die Haut von Mäusen aufgetragen werden kann, um sie vorübergehend transparent zu machen18. Auf diese Weise können die Forscher die physiologischen Strukturen unter der Haut beobachten, einschließlich der Blutgefäße und der inneren Organe. Diese Technologie könnte in naher Zukunft weiterentwickelt werden, mit Verbesserungen in der Dicke und dem Grad der Transparenz, die eine In-vivo-Beobachtung verschiedener Mausorgane ermöglichen, einschließlich des zentralen und peripheren Nervensystems, des Atmungssystems und des Kreislaufsystems19.
Offenlegungen
Die Autoren erklären, dass keine konkurrierenden Interessen bestehen.
Danksagungen
Nationale Naturwissenschaftliche Stiftung von China (Stipendium Nr. 82101249 und Nr. 82471204 an XY Sun). Postdoctoral Research Foundation of China (Stipendium Nr. 2022M722125 an XY Sun).
Materialien
| Name | Company | Catalog Number | Comments |
| 1 ml syringe | Shandong Weigao Group Medical Polymer | ||
| 502 glue | Deli Group | ||
| BD insulin syringe | Becton,Dickinson and Company | 328421 | |
| Bend toothed dissecting forceps | Jinzhong | JD1050 | |
| Circular steel clamp | Weili | ||
| Fine scissors | Jinzhong | y00030 | |
| Hemostatic forceps bent with tooth | Jinzhong | J31020 | |
| Hemostatic forceps straight with tooth | Jinzhong | J31010 | |
| Infusion needle 0.7mm | Kindly Group | ||
| Light box scale line | Nuohai Life Science | NH210901 | |
| Microdissection straight forceps | Jinzhong | WA3020 | |
| NobeliumSoftware | Nuohai Life Science | Scanning software | |
| paraformaldehyde | Biosharp | BL539A | |
| Peristaltic pumps | Nuohai Life Science | NH1000 | |
| Peristaltic pumps head | Nuohai Life Science | NH-15 | |
| Phosphate buffered saline | Servicebio | G4202 | |
| Sodium heparin | Shanghai Pharma | H31022051 | |
| STOCK Tg (Thy1-EGFP) MJrs/J strain mice | Jackson Laboratory | 007788 | |
| Straight toothed dissecting forceps | Jinzhong | JD1060 | |
| Tissue clearing Kit(hyrophilic) | Nuohai Life Science | NH-CR-210701 | |
| Tissue culture treater 100mm x 20mm | NEST | 704001 | |
| Tissue scissors | Jinzhong | J21040 | |
| Tribromoethanol | Aibei Biotechnology | M2910 | |
| Venus scissors | Jinzhong | YBC010 |
Referenzen
- Ueda, H. R., et al. Tissue clearing and its applications in neuroscience. Nat Rev Neurosci. 21 (2), 61-79 (2020).
- Tainaka, K., Kuno, A., Kubota, S. I., Murakami, T., Ueda, H. R. Chemical principles in tissue clearing and staining protocols for whole-body cell profiling. Annu Rev Cell Dev Biol. 32, 713-741 (2016).
- Susaki, E. A., Ueda, H. R. Whole-body and whole-organ clearing and imaging techniques with single-cell resolution: Toward organism-level systems biology in mammals. Cell Chem Biol. 23 (1), 137-157 (2016).
- Wu, M., et al. Innervation of nociceptor neurons in the spleen promotes germinal center responses and humoral immunity. Cell. 187 (12), 2935-2951.e19 (2024).
- Liu, T., et al. Local sympathetic innervations modulate the lung innate immune responses. Sci Adv. 6 (20), eaay1497 (2020).
- Qi, Y., et al. FDISCO: Advanced solvent-based clearing method for imaging whole organs. Sci Adv. 5 (1), eaau8355 (2019).
- Bagnoli, S., Terzibasi Tozzini, E., Cellerino, A. Whole-Brain clearing and immunofluorescence in Nothobranchius furzeri. Cold Spring Harb Protoc. 2023 (9), 698-704 (2023).
- Lu, T., Shinozaki, M., Nagoshi, N., Nakamura, M., Okano, H. 3D imaging of supraspinal inputs to the thoracic and lumbar spinal cord mapped by retrograde tracing and light-sheet microscopy. J Neurochem. 162 (4), 352-370 (2022).
- Saritas, T., Puelles, V. G., Su, X. T., Ellison, D. H., Kramann, R. Optical clearing and imaging of immunolabeled kidney tissue. J Vis Exp. (149), e60002 (2019).
- Song, J. H., et al. Precise mapping of single neurons by calibrated 3D reconstruction of brain slices reveals topographic projection in mouse visual cortex. Cell Rep. 31 (8), 107682 (2020).
- Fournel, R., Veruki, M. L., Hartveit, E. Digital reconstruction and quantitative morphometric analysis of bipolar cells in live rat retinal slices. J Comp Neurol. 530 (10), 1700-1728 (2022).
- Lin, R., et al. Cell-type-specific and projection-specific brain-wide reconstruction of single neurons. Nat Methods. 15 (12), 1033-1036 (2018).
- Peng, Y. C., et al. Rapid histological assessment of prostate specimens in the three-dimensional space by hydrophilic tissue clearing and confocal microscopy. J Histochem Cytochem. 70 (8), 597-608 (2022).
- Singhal, P., et al. Evaluation of histomorphometric changes in tissue architecture in relation to alteration in fixation protocol - An in vitro study. J Clin Diagn Res. 10 (8), ZC28-ZC32 (2016).
- Tainaka, K., et al. Chemical landscape for tissue clearing based on hydrophilic reagents. Cell Rep. 24 (8), 2196-2210.e9 (2018).
- Lee, S. H., Son, H. J. Second wave, late-stage neuroinflammation in cleared brains of aged 5xFAD Alzheimer's mice detected by macrolaser light sheet microscopy imaging. Int J Mol Sci. 24 (23), 242317058 (2023).
- Zhao, J., Lai, H. M., Qi, Y., He, D., Sun, H. Current status of tissue clearing and the path forward in neuroscience. ACS Chem Neurosci. 12 (1), 5-29 (2021).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385 (6713), eadm6869 (2024).
- Ou, Z., et al. Achieving optical transparency in live animals with absorbing molecules. Science. 385, eadm6869 (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten