Method Article
肝臓メタボロミクスを用いた貧血治療のための伝統的なハーブシロップのメカニズムの評価
要約
この研究では、主に、貧血の治療におけるShi-Liu-Bu-Xue Syrupの有効性を調査するための肝臓メタボロミクスの応用を紹介します。
要約
ウイグルの有名な薬として、Shi-Liu-Bu-Xueシロップ(SLBXS)は、20年以上にわたって中国で貧血の治療に広く使用されてきました。しかし、貧血の治療におけるその有効性の根本的なメカニズムは不明のままです。この研究では、貧血の治療におけるSLBXSの潜在的な調節メカニズムを決定するために、肝臓メタボロミクスが主に採用されました。アセチルフェニルヒドラジン誘導性貧血マウスモデルにおけるSLBXSの作用機序を特徴付けるために、肝臓メタボロミクスプロファイリングを実施しました。SLBXSは、肝臓指数、白血球数、血小板数を減少させ、赤血球数、ヘモグロビン、ヘマトクリット値を増加させることが示されました。コアターゲットは、ウェスタンブロッティングを用いた検証のために選択しました。SLBXSは、貧血マウスの肝臓組織におけるHIF-1α、NOS3、VEGFA、およびGLAタンパク質のダウンレギュレーションによって示されるように、主にガラクトース代謝とHIF-1シグナル伝達経路を調節することにより、貧血に対する有意な治療効果を示しました。本研究は、貧血治療におけるSLBXS投与による肝代謝の潜在的な制御機構を明らかにするものである。
概要
貧血は、世界人口の25%、あらゆる年齢の人々、特に青年や妊婦に影響を及ぼし、差し迫った蔓延する世界的な健康問題です1,2,3。早産や妊産婦死亡のリスク増加と関連しており、身体発達障害や心血管機能の低下につながる可能性があります4。この状態はまた、青年期の健康状態に悪影響を及ぼし、感染症や心不全を引き起こす可能性があります5。現在の治療法には、主に輸血、鉄補給、エリスロポエチン療法などがあります。しかし、これらの治療法には、アナフィラキシー、胃腸の不調、鉄分過剰、じんましんなどの欠点や副作用があります1。したがって、貧血の治療には副作用の少ない効果的な薬剤を特定することが重要です。
ウイグル医学を含む伝統的な中国医学には、多因子製剤、マルチターゲット効果、マルチリンク相互作用、多因子疾患の予防と治療における副作用の少なさなど、いくつかの利点があります。Shi-Liu-Bu-Xue Syrup(SLBXS)は、ウイグル医学の注目すべき伝統的な薬剤で、血液強壮剤や血液産生に使用されます。肝臓の熱を減少させる血液調節薬として認められており、貧血治療のためのマイノリティ医薬品の臨床使用に関するガイドラインにも掲載されています。また、中国国家食品薬品監督管理局(Z20026094)6,7,8によってライセンスされています。過去20年間、SLBXSは貧血関連疾患の治療に中国で広く使用されてきました。しかし、貧血を治療するためのその潜在的なメカニズムは不明のままであり、さらなる研究が必要です。メタボロミクスは、疾患、薬物介入、または環境条件9に対する生体システムの動的代謝応答を調べるもので、外部刺激後の生体試料中の代謝バイオマーカーの変化を評価することにより、伝統的な漢方薬の作用機序を解明するためにますます利用されるようになってきている9,10。
したがって、この研究では、貧血の治療におけるSLBXSの根本的な治療メカニズムを決定するために、肝臓メタボロミクスアプローチが採用されました。まず、アセチルフェニルヒドラジン(APH)誘導性貧血マウスモデルを確立しました。次に、肝臓メタボロミクスとガスクロマトグラフィー-質量分析法(GC-MS)およびSLBXS投与後の多変量データ法を用いて、内因性代謝産物の代謝経路を調査しました。最後に、SLBXSの抗貧血効果と分子メカニズムを解明するために、主要な標的を実験的に分析しました。
プロトコル
すべての実験手順は、湖北中医薬大学(HBUCMS201912015)の実験動物倫理委員会によって承認されました。雄のC57BL/6マウス(体重20-22g)を、相対湿度50%-60%、温度22°C±2°Cの特定の病原体フリールームに収容し、12時間の明かり/12時間の暗サイクルにかけ、餌と水への自由なアクセスを提供しました。実験が始まる前に、すべてのマウスが環境に順応するために1週間与えられました。マウスは、対照群、モデル、Fu-Fang-E-Jiao Syrup(FFEJS、陽性薬、7.8mL/kgで胃内投与)、SLBXS(11.7mL/kgで胃内投与)の4群(n = 12)のいずれかにランダムに割り付けられました。対照群とモデル群のマウスは、同量の生理食塩水を受け取りました。すべてのグループのマウスに、対応する薬物の胃内投与を1日1回、2週間行いました。この研究で使用された薬剤、試薬、および機器の詳細は、 資料表に記載されています。
1. マウスにおける貧血モデルの確立
- 電子天びんを使用して2 gのアセチルフェニルヒドラジン(APH)を秤量し、150 mLビーカーに移します。.生理食塩水100mLを加え、APHが完全に溶解するまでガラス棒で攪拌します。
- ステップ 1.1 で調製した 2% APH を 1日目、4 日目、7 日目に 200 mg/kg、100 mg/kg、100 mg/kg の用量で皮下注射することにより、貧血のマウスモデルを確立します 11。
注:初日から、FFEJS(7.8 mL / kg)およびSLBXS(11.7 mL / kg)グループのマウスに、1日1回2週間胃内投与を行いました。対照群とモデル群のマウスは、同量の生理食塩水を1日1回、2週間投与されました。
2.肝臓指数の決定
- 実験の最後に、電子スケールを使用して各マウスの体重を量ります。
- 2%イソフルランを吸入してマウスに麻酔をかけます。マウスの眼球を絞って、充血して突き出るようにします。鉗子で眼球をすばやく取り除き、ヘパリン処理されたサンプルチューブに血液を採取します。
- ステップ2.2で麻酔したマウスを手術用マニピュレーションプレートに固定します。
- メスで腹部の正中線に沿って完全に切開します。無傷の肝臓組織12を慎重に解剖して分離し、次いで電子天秤でその重量を測定する。
注:各マウスの肝臓指数は、次の式を使用して計算されます:肝臓指数=肝臓重量/体重。
3. 血液学的解析
- 血液凝固を防ぐために、ステップ2.2からヘパリン化された血液サンプルを含むチューブを静かに振ってください。.
- 血液サンプルを注射針の下に置いて、注射針に完全に浸されていることを確認します。
- 自動検出ボタンをクリックすると、全自動血液細胞分析装置を使用して赤血球数(RBC)、ヘマトクリット(HCT)、白血球数(WBC)、ヘモグロビン(HGB)レベル、および血小板数(PLT)が測定されます。
4. 肝臓メタボロミクス研究
- 肝臓サンプル調製
- ステップ2.4の肝臓組織サンプル(50 mg)を、予め冷却したメタノール1 mLでホモジナイズします。18,759 x g で4°Cで10分間遠心分離し、沈殿物を除去します。
- 上清200μLをピペットでサンプルバイアルに移し、凍結乾燥機で35°Cで2時間真空乾燥します。
- 乾燥したサンプルを、ピリジン中の塩酸メトキシアミン40 mg/mL溶液40 μLと40 μLを30 °Cで90分間反応させます。 次に、80 μLのN-メチル-N-(トリメチルシリル)トリフルオロアセトアミド(MSTFA)と1%トリメチルクロロシラン(TMCS)を加え、37°Cで60分間インキュベートします。
- 10 μLのn-ヘキサンをバイアルに添加して、誘導体化反応を終了します。
- 肝臓代謝分析
- 誘導体化したサンプル(1 μL)をGC-MSシステムを使用して分析します。DB-5MS キャピラリーカラム (30 m × 0.25 mm × 0.25 μm) を使用して誘導体を分離します。
注:オーブン温度プログラムの条件は次のように設定されました:60°Cで1分間。10 °C/分の速度で325 °Cまで上昇させ、10分間維持します。インジェクター、イオン源、MSの温度はそれぞれ250°C、230°C、150°Cに設定しました。キャリアガスにはヘリウム(99.999%)を流速1.1mL/minで用い、分割比を10:1とした。70 eVの電子ビームエネルギーと5.9分の溶媒遅延時間を使用しました。
- 誘導体化したサンプル(1 μL)をGC-MSシステムを使用して分析します。DB-5MS キャピラリーカラム (30 m × 0.25 mm × 0.25 μm) を使用して誘導体を分離します。
- データ処理と分析
- 互換性のあるMassHunterソフトウェアを使用して、生のGC-MSデータを取得および変換します。
- Automated Mass Spectral Deconvolution and Identification System(AMDIS)ツール12を使用してスペクトル解析を実施します。
- NISTおよびHMDBデータベースを使用して、すべての代謝物を同定します( 「材料表」を参照)。
- データをMetaboAnalystツールにインポートして、偏最小二乗判別分析(PLS-DA)、 t検定、経路分析、およびネットワーク分析12を行います。
5. ウェスタンブロット解析
- マウスの肝臓組織から総タンパク質を抽出します
- ステップ 2.4 の肝臓組織 50 mg と細胞溶解液 250 μL を 1 mL ガラス製ホモジナイザーに加え、氷上で 5 分間粉砕します。
- ステップ5.1.1の肝臓組織ホモジネートをピペッターを使用して1.5 mLの微量遠心チューブに移し、18,759 x g で4°Cで10分間遠心分離します。 次に、ピペッターを使用して上清を新しい1.5 mLチューブに移します。
- タンパク質濃度の測定とタンパク質サンプルの前処理
- ステップ5.1.2から2μLの上清、18μLのPBS、および180μLのBCAワーキング溶液を96ウェルマイクロタイタープレート8に加えます。
- プレートを発振器で30秒間振動させ、37°Cで30分間放置し、マイクロプレートリーダーを使用して562nmでの吸光度を決定します。
- SDS-PAGEを用いて全タンパク質を分離し、ポリフッ化ビニリデン膜に移し、5%脱脂乳でブロックします8。
- ステップ5.3のメンブレンをHIF-1α(1:1000)、VEGFA(1:1000)、GLA(1:1000)、NOS3(1:1000)、およびβ-アクチン(1:5000)に対する一次抗体と4°Cで一晩インキュベートします。
- ステップ5.4のメンブレンを抗体インキュベーションボックスに入れ、TBST10 mLを加え、室温で111 x g で水平に振とうして、結合していない一次抗体をそれぞれ5分間3回洗い流します。
- ステップ5.5から各メンブレンにヤギ抗ウサギIgG (H + L)-HRP (1:1000)200 μLを添加し、室温で2時間インキュベートします。次に、ステップ5.5を繰り返して、未結合の二次抗体(ヤギ抗ウサギIgG(H + L)-HRP)を洗い流します。
- ステップ5.6から各メンブレンの表面に200μLの超高感度ECL化学発光溶液を添加し、自動化学発光イメージング分析システムを使用してタンパク質バンドをすぐに可視化します。
6. 統計分析
- 統計ソフトウェアとグラフ作成ソフトウェアを使用して、一元配置分散分析とそれに続くテューキー検定を使用してデータを分析します。
- 結果を平均±標準偏差(SD)として表示し、0.05< P値を 統計的に有意と見なします。
結果
貧血のマウスモデルの成功した確立を確認し、貧血に対するSLBXSの影響を分析するために、肝臓指数と血液学的パラメータが最初に調査されました。 図1 は、モデル群が対照群と比較して、赤血球数(RBC)、ヘモグロビン(HGB)、およびヘマトクリット(HCT)の有意な減少(P < 0.01)を示したことを示しています。逆に、モデル群の肝臓指数、白血球数(WBC)、血小板数(PLT)は著しく高かった(P < 0.05 または P < 0.01)。これらの結果から、貧血モデルが成功裏に確立されたことが確認された。肝臓指数、WBC、およびPLTは、モデル群と比較してSLBXS群で有意に低かった(P < 0.05 または P < 0.01)一方、モデル群の減少したRBC、HGB、およびHCTは、SLBXSによる治療後に著しく上昇しました(P < 0.05 または P < 0.01)。SLBXS群とFu-Fang-E-Jiao Syrup(FFEJS)群のパラメータ間に有意差はなかった。これらの結果は、SLBXSが貧血の症状を改善できることを示しています。
図2に、コントロールグループ、モデルグループ、SLBXSグループ、FFEJSグループの肝臓サンプルの一般的なトータルイオンクロマトグラム(TIC)を示します。顕著な違いは、コントロール、モデル、SLBXS、およびFFEJSグループ間の代謝物プロファイルで明らかです。.
PLS-DA(Partial Least Squares Discriminant Analysis)は、判別分析に使用される教師あり統計手法で、代謝物発現とサンプルクラスとの関係をモデル化してサンプルクラスを予測します。PLS-DAスコアプロット(図3A)は、対照群、モデル群、SLBXS群、FFEJS群の間で明確な分離を示しています。対照群とモデル群の間のスコアプロットを図3Bに示します。図3Bでは、モデルグループが対照群から大きく分離されています。これは、貧血がマウスの正常な代謝を阻害することを示しており、貧血モデルの開発に成功したことが確認されています。図 3C は、モデルと SLBXS グループに基づく PLS-DA スコア プロットを示しています。各代謝物の発現パターンがサンプルグループの分類にどの程度強く影響するかを評価し、主要なマーカー代謝物を特定するために、変数の予測重要度(VIP)値を計算しました。通常、スクリーニング基準としてVIP値>1.0が使用されます(図3D)。次に、確立されたPLS-DAモデルを検証するために、クロスバリデーションが使用されました。図 3E に示すように、このモデルは良好な R² (0.95) と Q2 (0.86) の値を示しており、PLS-DA モデルの信頼性が高く、オーバーフィッティングのリスクが最小限であることを示しています。VIP > 1 および P < 0.05 の代謝物は、差次代謝物として分類されました。合計29の差次代謝物が同定されました(表1を参照)。.この結果は、SLBXSがキシロース、テトラコサン、α-トコフェロール、D-グルコースなどの代謝物をアップレギュレートし、ポルフィンなどの代謝物をダウンレギュレーションできることを示唆しています。これら29の差次代謝物のパスウェイエンリッチメント解析をMetaboAnalystを用いて行ったところ、15のパスウェイと関連していることが明らかになりました。これらの中で、ガラクトース代謝と乳糖分解(P < 0.05)は、SLBXSの貧血治療に関与する最も適切な代謝経路として特定されました(図3Fおよび図4)。
図5 は、HIF-1α、VEGFA、GLA、およびNOS3のタンパク質発現レベルが、対照群と比較してモデル群で有意に上昇したことを示しています(P < 0.01)。SLBXSは、モデル群で観察されたHIF-1α、VEGFA、GLA、NOS3発現のアップレギュレーションを有意に逆転させました(P < 0.01)。
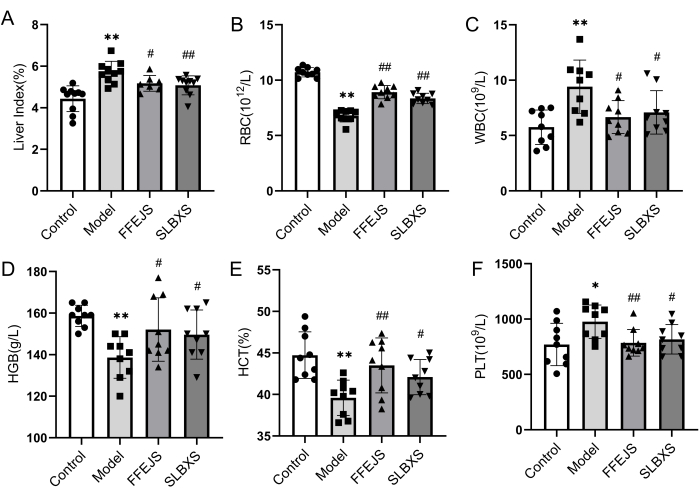
図1:投与14日後の貧血マウスの肝臓指数および末梢血ルーチンに対するSLBXSの影響。(B)SLBXSはRBCレベルを増加させました。(C)SLBXSはWBCレベルを減少させた。(D)SLBXSはHGBレベルを増加させました。(E)SLBXSはHCTレベルを増加させました。(F)SLBXSはPLTレベルを減少させた。制御 vs モデル、*P < 0.05、**P < 0.01;モデル対FFEJSまたはSLBXS、#P < 0.05、##P < 0.01。SLBXS、Shi-Liu-Bu-Xueシロップ;RBC、赤血球;WBC、白血球;HGB、ヘモグロビン;HCT、ヘマトクリット;PLT、血小板。この図の拡大版を表示するには、ここをクリックしてください。
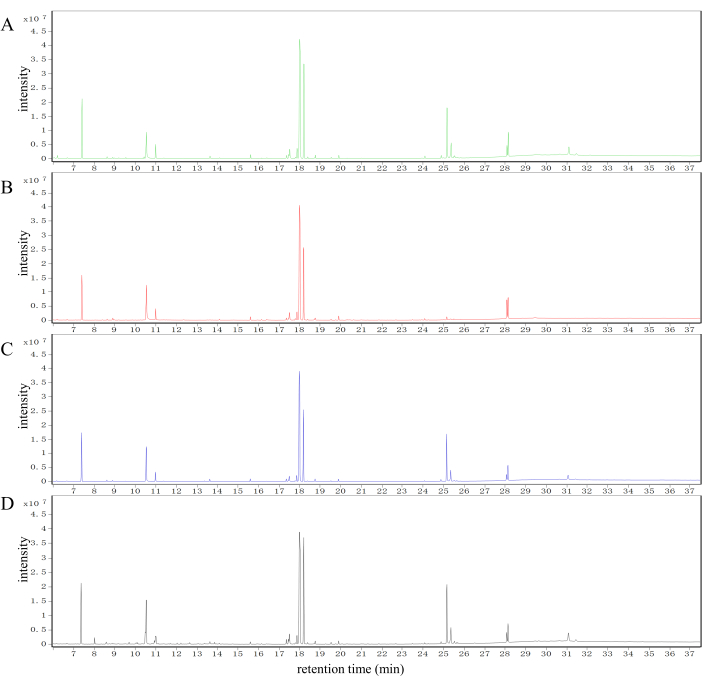
図2:GC-MSシステムにおけるマウスの異なるグループからの肝臓サンプルの代謝差の分析。 コントロール(A)、モデル(B)、SLBXS(C)、およびFFEJSグループ(D)から得られた肝臓サンプルのTICです。TIC、トータルイオンクロマトグラム;SLBXS、Shi-Liu-Bu-Xueシロップ;FFEJS、Fu-Fang-E-Jiaoシロップ。 この図の拡大版を表示するには、ここをクリックしてください。
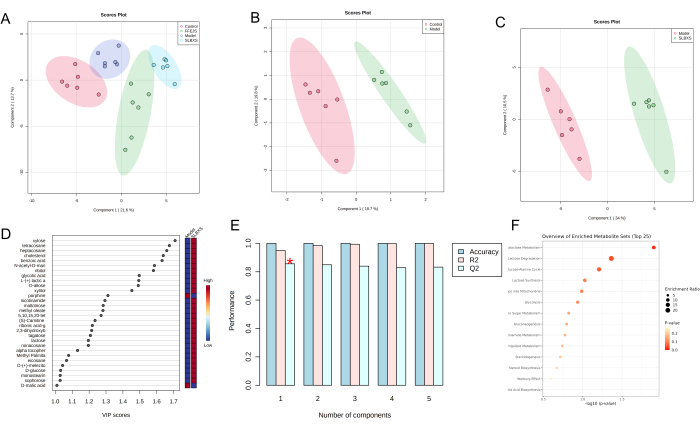
図3:マウスの異なるグループからの肝臓サンプルの代謝差のデータ分析。 コントロール、モデル、SLBXS、および FFEJS グループの肝臓 PLS-DA スコア プロット (A);コントロールグループとモデルグループのPLS-DAスコアプロット(B)。PLS-DAスコアプロット(C)、VIPスコアプロット(D)、およびメタボロミクス分析を使用したモデルとSLBXSグループ間の交差検証(E)。差次代謝産物の経路濃縮解析(F)。SLBXS、Shi-Liu-Bu-Xueシロップ;FFEJS、Fu-Fang-E-Jiaoシロップ。 この図の拡大版を表示するには、ここをクリックしてください。

図4:貧血治療のためのSLBXSの調節ネットワーク この図の拡大版を見るには、ここをクリックしてください。

図5:ウェスタンブロッティングによるマウス肝臓のHIF-1α、VEGFA、GLA、NOS3タンパク質レベルの測定。 (A)代表的な異なるタンパク質バンド。(B)異なるタンパク質の発現レベルの統計解析。データは平均 SD (n = 3)、**P < 0.01 対コントロールグループ; ##P < 0.01 対モデルグループ。 この図の拡大版を表示するには、ここをクリックしてください。
表1:示差代謝物の要約。この表をダウンロードするには、ここをクリックしてください。
ディスカッション
貧血は、世界中の多くの人々、特に発展途上国で罹患している一般的な状態です1。中国では、患者は貧血の兆候や症状を緩和するために、ウイグル医学を含む伝統的な漢方薬を頻繁に使用しています。SLBXSは、長年にわたって臨床診療で使用されてきたウイグルの薬です。しかし、貧血に対するその正確な作用機序は、まだよくわかっていません13。本研究では、アセチルフェニルヒドラジン(APH)誘発性貧血のマウスモデルを確立し、メタボロミクス解析を通じてSLBXSの貧血治療の根底にあるメカニズムを解明しました。
メタボロミクスは、生体サンプル中の低分子代謝物の定性的および定量的分析を通じて、疾患の診断、潜在的なバイオマーカーの発見、疾患の病因の探索を行うための貴重なツールです。この研究では、アセチルフェニルヒドラジン(APH)を使用して貧血のモデルを構築しました。APHは、特にグルコース-6-リン酸デヒドロゲナーゼを妨害することにより、赤血球にゆっくりと進行する酸化的損傷を引き起こす強力な酸化剤であり、ヘモグロビン(HGB)の変性とハインツ体の形成を促進します。また、赤血球の膜タンパク質や脂質を直接破壊し、赤血球の膜溶解、破裂、崩壊を引き起こし、溶血性貧血を引き起こします14,15。肝臓は、人体で最大の消化腺であり、エネルギー貯蔵と代謝調節に重要な役割を果たし、代謝と異化作用のバランスを維持しています16。本研究では、モデルマウスの肝臓肥大は、SLBXS投与14日後に有意に緩和されました。肝臓がSLBXSの標的臓器である可能性が高いかどうかを判断し、関連するメカニズムを解明するには、さらなる研究が必要です。そこで、ガスクロマトグラフィー質量分析法(GC-MS)を用いて、貧血マウスの肝臓における代謝物を検出しました。メタボロミクス解析により、29のバイオマーカーと、ガラクトース代謝とラクトース分解という2つの主要な代謝経路が特定されました。
ザクロには、タンニン、フラボノイド、アルカロイド、有機酸など、多くの有効成分が報告されています17,18。これらの成分は、抗酸化作用、抗炎症作用、抗菌作用、抗腫瘍作用など、さまざまな薬理作用を発揮します。証拠は、ザクロジュースがポリフェノール含有量が高いため、抗酸化活性の点で赤ワインや緑茶よりも強力であることを示唆しています19,20。これらの化合物は、フリーラジカルの捕捉または中和、金属キレート化、細胞シグナル伝達経路への影響、遺伝子発現の調節など、いくつかのメカニズムを通じて抗酸化作用を示します19,20。さらに、ザクロ果実抽出物はフラボノイドが豊富で、マロンジアルデヒドと過酸化水素のレベルを低下させ、肝臓でのカタラーゼ、スーパーオキシドジスムターゼ、グルタチオンペルオキシダーゼ、およびグルタチオンレダクターゼの活性を高めることにより抗酸化効果を高めます21。ザクロ果実抽出物で処理された健康な白ウサギは、赤血球数、ヘモグロビン(HGB)レベル、および平均赤血球HGB濃度の有意な変化、ならびに出血およびプロトロンビン時間の有意な延長、プロテインC(抗凝固タンパク質)およびトロンビン-アンチトロンビン化合物レベルの著しい上昇、および血小板凝集およびフィブリノーゲン濃度の用量依存的な減少を示した。血液学的および凝固検査の結果に基づいて、ザクロは抗貧血および心臓保護効果を有する可能性があると推測できる22。インドの伝統医学では、ザクロジュースなどの植物材料が鉄欠乏性貧血を治療するための栄養補助食品として使用されており、おそらく鉄吸収の促進に関連しています23。
貧血治療におけるSLBXSのメカニズムをさらに解明するために、包括的なメタボロミクス解析を行いました。相互作用ネットワークに関与する代謝物は、α-トコフェロール、D-キシリトール、ナイアシンアミド、D-グルコース、ラクトースであり、標的はHIF1A、VEGFA、NOS3、GLAであった。α-トコフェロール(ビタミンE)は、赤血球膜24の多価不飽和脂肪酸の酸化を防ぐことにより、早期赤血球溶解を阻害する抗酸化特性を有する。したがって、それは、早期赤血球溶解を減少させ、赤血球の脆弱性を減少させることにより、潜在的な赤血球生成剤として作用し得る25。キシリトールは、非毒性の用量で、APH誘発性溶血を緩和することができます。その抗溶血効果は、赤血球にミトコンドリアが存在しないことによる酸化的損傷から保護するNADPHの生成におけるその役割に起因する可能性があります。これにより、グルタチオンレベルを維持し、ヘモグロビン、機能性タンパク質、およびその他の構造成分を過酸化損傷から保護します26,27。ニコチンアミドは、ヒトにおけるコエンザイムI(NAD)およびコエンザイムII(NADP)の合成の前駆体である28。NADは、エネルギー代謝に関与する多くの酵素にとって重要な補因子である29。D-グルコース、ラクトース、GLAは、ガラクトース代謝の重要な成分です。重要な酸素感受性転写因子として、HIF-1αは低酸素適応経路において重要であり、細胞および組織における恒常性転写応答の主要な調節因子と考えられている30,31。HIF-1αは、正常酸素条件下ではプロリルヒドロキシラーゼ(PHD)によって急速に分解されますが、低酸素条件下ではPHDが阻害され、HIF-1α32の蓄積につながります。HIF-1αは、赤血球の産生、酸素消費、血管形成、およびミトコンドリア代謝に関与する遺伝子を含む、細胞の酸素恒常性を制御する遺伝子を活性化する33。VEGFAは、主に血管内皮細胞に作用するサイトカインであり、虚血および低酸素症34の間に多くの特殊細胞で発現します。NOS3(eNOS)は、主に冠状血管の内皮や心臓の管腔表面に存在し、アルギニンやプロリンの代謝に関与し、一酸化窒素(NO)の産生を触媒します。NOは、平滑筋細胞の可溶性グアニル酸シクラーゼを活性化することにより、強力な血管拡張薬として作用する35。さらに、NOは赤血球によって産生される活性酸素種と相互作用して活性窒素酸化物種を生成し、それによって酸化的損傷を軽減する36。
最後に、メタボロミクスの結果は、ウェスタンブロッティングを使用して検証されました。その結果、HIF-1α、VEGFA、GLA、NOS3のレベルは、モデル群と比較してSLBXS治療後に減少したことが示されました。HIF-1α、VEGFA、NOS3はHIF-1シグナル伝達経路の重要な標的であり、GLAはガラクトース代謝の重要な標的です。これらの結果は、SLBXSがHIF-1シグナル伝達経路とガラクトース代謝経路の両方に影響を与える可能性を示唆しており、貧血の治療に複合的な効果を示しています。多くの研究が、貧血および関連疾患の治療におけるHIF-1およびガラクトース代謝経路の重要な役割を強調しています。貧血は血液の酸素運搬能力を低下させ、組織の低酸素症を引き起こします。HIF-1αは低酸素条件下で細胞内に蓄積し、高レベルのHIF-1αはEPOおよびVEGFの発現を増強し、安定した造血微小環境に貢献し、栄養素と酸素の輸送を促進し、細胞を低酸素損傷から保護する37,38。HIF-1経路の活性化は、赤血球生成を刺激し、ヘモグロビンレベルを増加させ、貧血状態を矯正し、鉄の恒常性を改善することが示されています39。SLBXS治療後の低酸素症の改善は、SLBXSグループで観察されたHIF-1経路におけるタンパク質発現の減少を説明しています。GLA(α-ガラクトシダーゼA)は、スタキオース、ラフィノース、メリビオースなどのガラクトオリゴ糖や、ガラクトマンナン、ガラクトグルコマンナンなどの分岐多糖類を標的とするエキソグリコシダーゼであり、α-1,6結合末端ガラクトース残基の加水分解を触媒する40。ガラクトースは、さまざまな体組織でのエネルギー産生と貯蔵を促進し、グリコシル化の前駆体として機能するため、細胞代謝に不可欠です41。ガラクトオリゴ糖の補給は、ラットの腸内での鉄の吸収を促進し、血中ヘモグロビンレベルを上昇させることができる42。本研究では、メタボロミクスとネットワーク薬理学を併用して、貧血治療におけるSLBXSの根底にある機序を検討した。HIF-1シグナル伝達経路とガラクトース代謝経路は、SLBXSの貧血治療において有意に重要であることを見出しました。この研究は、貧血の治療におけるSLBXSのメカニズムに関する新たな洞察を提供します。今後の研究では、関与する有効成分の特定と理解にもっと焦点を当てるべきです。
開示事項
著者は何も開示していません。
謝辞
この研究は、新疆ウイグル自治区自然科学基金会(2020D03021)、湖北中医薬大学伝統中国医学の主要プログラム基金(2022ZZXZ004)、天山イノベーションチームプログラム(2020D14030)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Acetylphenylhydrazine | Shanghai Aladdin Biochemical Technology Co., Ltd. | C13979660 | |
| Automatic chemiluminescence imaging analysis system | Shanghai Tanon Life Science Co., Ltd. | Tanon-5200 | |
| Bicinchoninic acid assay kit | ThermoFisher Scientific | QPBCA-1KT | |
| Capillary column | Agilent J&W Scientific, Agilent Technologies, Inc. | DB-5MS | |
| Cell lysis buffer for Western and IP | Beyotime Biotechnology | P0013 | |
| Chlorotrimethylsilane | Shanghai Aladdin Biochemical Technology Co., Ltd. | C104814 | |
| Electronic balance | Mettler-Toledo International Inc. | ME203E | |
| Electronic scale | Mettler-Toledo International Inc. | LE104E | |
| Fu-Fang-E-Jiao Syrup | Dong E E Jiao Co., Ltd. | 214020031 | |
| Fully automatic hemocyte analyzer | Shenzhen Mindray Animal Care Technology Co., Ltd. | IDEXX ProCyte Dx | |
| GC-MS system | Agilent Technologies, Inc. | 7890B-5977B | |
| GLA primary antibody | Bioworld Technology | BS77041 | |
| Glass homogenizer | Shanghai Lei Gu Instruments Co., Ltd. | B-013001 | |
| Glass rod | Shanghai Lei Gu Instruments Co., Ltd. | B-003904 | |
| GraphPad Prism software | GraphPad, La Jolla | Version 9.0 | |
| Heparinized sample tubes | Changde BKMAM Biotechnology Co., Ltd. | B-ACT1P5 | |
| HIF-1α primary antibody | Bioworld Technology | BS3514 | |
| HMDB database | http://www.hmdb.ca/ | — | |
| Isoflurane | Hebei Jindafu Pharmaceutical Co., Ltd. | 20231202 | |
| Male C57BL/6 mice | Liaoning Changsheng Biotechnology Co., Ltd. | No. SCXK [Liao] 2015-0001 | |
| MassHunter | Agilent Technologies, Inc. | B.08.00 | |
| MetaboAnalyst 5.0 | https://www.metaboanalyst.ca/ | — | |
| Methoxyamine hydrochloride | Shanghai Aladdin Biochemical Technology Co., Ltd. | E1818113 | |
| n-hexane | Shanghai Aladdin Biochemical Technology Co., Ltd. | C14878803 | |
| NIST database | http://webbook.nist.gov/chemistry/ | — | |
| NOS3 primary antibody | Bioworld Technology | BS3625 | |
| Pyridine | Shanghai Aladdin Biochemical Technology Co., Ltd. | C13026996 | |
| Saline | BIOSHARP LIFE SCIENCES | 2308262009 | |
| Shi-Liu-Bu-Xue Syrup | Xinjiang Uygur Pharmaceutical Co., Ltd. | 211277 | |
| Surgical manipulation plate | DIXSG | ZK-JPB-A | |
| VEGFA primary antibody | Bioworld Technology | AP0742 | |
| β-actin | ABclonal (Shanghai) Trading Co., Ltd. | AC026 |
参考文献
- Munoz, M., Gomez-Ramirez, S., Bhandari, S. The safety of available treatment options for iron-deficiency anemia. Expert Opin Drug Saf. 17 (2), 149-159 (2018).
- Soliman, A. T., De Sanctis, V., Yassin, M., Wagdy, M., Soliman, N. Chronic anemia and thyroid function. Acta Biomed. 88 (1), 119-127 (2017).
- Pivina, L., Semenova, Y., Dosa, M. D., Dauletyarova, M., Bjorklund, G. Iron deficiency, cognitive functions, and neurobehavioral disorders in children. J Mol Neurosci. 68 (1), 1-10 (2019).
- Lumbiganon, P., et al. Indirect causes of severe adverse maternal outcomes: a secondary analysis of the WHO Multicountry Survey on Maternal and Newborn Health. BJOG. 121 (Suppl 1), 32-39 (2014).
- Shaddy, R. E., et al. Systematic literature review on the incidence and prevalence of heart failure in children and adolescents. Pediatr Cardiol. 39 (3), 415-436 (2018).
- China Medical Association of Minorities. . Guidelines for clinical use of minority drugs. , (2018).
- Yu, W. Q. Clinical efficiency of Pomegranate blood-enriching syrup in the treatment of iron deficiency anemia. J Med Pharm Chin Minor. 26 (11), 11-12 (2020).
- Zhang, D. N., et al. Mechanism of Shiliu Buxue Syrup for anemia using integrated metabolomics and network pharmacology. Anal Biochem. 653, 114774 (2022).
- Nielsen, J. Systems biology of metabolism. Annu Rev Biochem. 86, 245-275 (2017).
- Wang, M., et al. Metabolomics highlights pharmacological bioactivity and biochemical mechanism of traditional Chinese medicine. Chem Biol Interact. 273, 133-141 (2017).
- Ben, C. N. Establishment and experimental research of "Blood Deficiency" animal model. Lab Animal Sci. (03), 5-10 (1994).
- Cao, S., et al. Integrative transcriptomics and metabolomics analyses provide hepatotoxicity mechanisms of asarum. Exp Ther Med. 20 (2), 1359-1370 (2020).
- Yang, H. Y., Liu, M. L., Luo, P., Yao, X. S., Zhou, H. Network pharmacology and metabolomics in the study of traditional Chinese medicine for cardiovascular diseases. Phytomedicine. 104, 154268 (2022).
- Croci, S., Pedrazzi, G., Passeri, G., Piccolo, P., Ortalli, I. Acetylphenylhydrazine induced haemoglobin oxidation in erythrocytes studied by Mossbauer spectroscopy. Biochim Biophys Acta. 1568 (1), 99-104 (2001).
- Liebowitz, J., Cohen, G. Increased hydrogen peroxide levels in glucose 6-phosphate dehydrogenase deficient erythrocytes expose to acetylphenylhydrazine. Biochem Pharmacol. 17 (6), 983-988 (1968).
- Tarasenko, T. N., McGuire, P. J. The liver is a metabolic and immunologic organ: A reconsideration of metabolic decompensation due to infection in inborn errors of metabolism (IEM). Mol Genet Metab. 121 (4), 283-288 (2017).
- Topalovic, A., Knezevic, M., Gacnik, S., Mikulic-Petkovsek, M. Detailed chemical composition of juice from autochthonous pomegranate genotypes (Punica granatum L.) grown in different locations in Montenegro. Food Chem. 330, 127261 (2020).
- Legua, P., et al. Total phenols and antioxidant capacity in 10 Moroccan pomegranate varieties. J Food Sci. 77 (1), C115-C120 (2012).
- Rodrigo, R., Miranda, A., Vergara, L. Modulation of endogenous antioxidant system by wine polyphenols in human disease. Clin Chim Acta. 412 (5-6), 410-424 (2011).
- Hussain, T., et al. Oxidative stress and inflammation: What polyphenols can do for us. Oxid Med Cell Longev. 2016, 7432797 (2016).
- Sudheesh, S., Vijayalakshmi, N. R. Flavonoids from Punica granatum--potential antiperoxidative agents. Fitoterapia. 76 (2), 181-186 (2005).
- Riaz, A., Khan, R. A. Anticoagulant, antiplatelet and antianemic effects of Punica granatum (pomegranate) juice in rabbits. Blood Coagul Fibrinolysis. 27 (3), 287-293 (2016).
- Balasubramani, S. P., Varghese, R. K., Vishnuprasad, C. N., Venkatasubramanian, P. Pomegranate juice enhances iron dialysability and assimilation in in-vitro cell-free and cell-based models. Plant Foods Hum Nutr. 75 (2), 272-278 (2020).
- Jilani, T., Iqbal, M. P. Does vitamin E have a role in treatment and prevention of anemia. Pak J Pharm Sci. 24 (2), 237-242 (2011).
- Farrell, P. M., Bieri, J. G., Fratantoni, J. F., Wood, R. E., di Sant'Agnese, P. A. The occurrence and effects of human vitamin E deficiency. A study in patients with cystic fibrosis. J Clin Invest. 60 (1), 233-241 (1977).
- Ukab, W. A., Sato, J., Wang, Y. M., van Eys, J. Xylitol mediated amelioration of acetylphenylhydrazine-induced hemolysis in rabbits. Metabolism. 30 (11), 1053-1059 (1981).
- Ahuja, V., et al. Biological and pharmacological potential of xylitol: A molecular insight of unique metabolism. Foods. 9 (11), 1592 (2020).
- Nikas, I. P., Paschou, S. A., Ryu, H. S. The role of nicotinamide in cancer chemoprevention and therapy. Biomolecules. 10 (3), 477 (2020).
- Katayoshi, T., Yamaura, N., Nakajo, T., Kitajima, N., Tsuji-Naito, K. Porcine placental extract increases the cellular NAD levels in human epidermal keratinocytes. Sci Rep. 12 (1), 19040 (2022).
- Bartoszewski, R., et al. Primary endothelial cell-specific regulation of hypoxia-inducible factor (HIF)-1 and HIF-2 and their target gene expression profiles during hypoxia. Faseb J. 33 (7), 7929-7941 (2019).
- Lee, S. H., Golinska, M., Griffiths, J. R. HIF-1-independent mechanisms regulating metabolic adaptation in hypoxic cancer cells. Cells. 10 (9), 2371 (2021).
- Sato, T., Takeda, N. The roles of HIF-1α signaling in cardiovascular diseases. J Cardiol. 81 (2), 202-208 (2023).
- Ratcliffe, P. J. Oxygen sensing and hypoxia signalling pathways in animals: The implications of physiology for cancer. J Physiol. 591 (8), 2027-2042 (2013).
- Li, L. J., Huang, Q., Zhang, N., Wang, G. B., Liu, Y. H. miR-376b-5p regulates angiogenesis in cerebral ischemia. Mol Med Rep. 10 (1), 527-535 (2014).
- Tejero, J., Shiva, S., Gladwin, M. T. Sources of vascular nitric oxide and reactive oxygen species and their regulation. Physiol Rev. 99 (1), 311-379 (2019).
- Fujii, J., et al. Erythrocytes as a preferential target of oxidative stress in blood. Free Radic Res. 55 (5), 562-580 (2021).
- Huang, J. W., et al. High expression of HIF-1α alleviates benzene-induced hematopoietic toxicity and immunosuppression in mice. Environ Pollut. 311, 119928 (2022).
- Zhang, Z., Yao, L., Yang, J., Wang, Z., Du, G. PI3K/Akt and HIF-1 signaling pathway in hypoxia-ischemia (Review). Mol Med Rep. 18 (4), 3547-3554 (2018).
- Del Balzo, U., et al. Nonclinical characterization of the hypoxia-inducible factor prolyl hydroxylase inhibitor roxadustat, a novel treatment of anemia of chronic kidney disease. J Pharmacol Exp Ther. 374 (2), 342-353 (2020).
- Bhatia, S., Singh, A., Batra, N., Singh, J. Microbial production and biotechnological applications of α-galactosidase. Int J Biol Macromol. 150, 1294-1313 (2020).
- Conte, F., van Buuringen, N., Voermans, N. C., Lefeber, D. J. Galactose in human metabolism, glycosylation and congenital metabolic diseases: Time for a closer look. Biochim Biophys Acta Gen Subj. 1865 (8), 129898 (2021).
- Wang, Y. Y. . Investigate the effect of galacto-oligosaccharide supplementation on intestinal absorption of iron in rats. [Master's Thesis]. , (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved