Method Article
Valutazione del meccanismo di uno sciroppo a base di erbe tradizionale per il trattamento dell'anemia utilizzando la metabolomica epatica
In questo articolo
Riepilogo
Questo studio introduce principalmente l'applicazione della metabolomica epatica nello studio dell'efficacia dello sciroppo Shi-Liu-Bu-Xue nel trattamento dell'anemia.
Abstract
Come noto medicinale uiguro, lo sciroppo Shi-Liu-Bu-Xue (SLBXS) è stato ampiamente utilizzato per trattare l'anemia in Cina per oltre 20 anni. Tuttavia, i meccanismi alla base della sua efficacia nel trattamento dell'anemia rimangono poco chiari. In questo studio, la metabolomica epatica è stata impiegata principalmente per determinare i potenziali meccanismi regolatori di SLBXS nel trattamento dell'anemia. La profilazione metabolomica epatica è stata condotta per caratterizzare il meccanismo d'azione di SLBXS in un modello murino di anemia indotta da acetilfenilidrazina. È stato dimostrato che SLBXS riduce l'indice epatico, la conta dei globuli bianchi e la conta piastrinica, aumentando al contempo la conta dei globuli rossi, l'emoglobina e i livelli di ematocrito. Gli obiettivi principali sono stati selezionati per la verifica utilizzando il Western blotting. SLBXS ha dimostrato un effetto terapeutico significativo sull'anemia principalmente regolando il metabolismo del galattosio e la via di segnalazione HIF-1, come indicato dalla sottoregolazione delle proteine HIF-1α, NOS3, VEGFA e GLA nei tessuti epatici di topi anemici. Questo studio chiarisce i potenziali meccanismi regolatori del metabolismo epatico mediante somministrazione di SLBXS nel trattamento dell'anemia.
Introduzione
L'anemia è un problema di salute globale urgente e diffuso, che colpisce il 25% della popolazione mondiale e le persone di tutte le età, in particolare gli adolescenti e le donne in gravidanza 1,2,3. È associato a un aumento del rischio di travaglio pretermine e di mortalità materna e può portare a disturbi dello sviluppo fisico e a una compromissione delle prestazioni cardiovascolari4. Questa condizione può anche avere un impatto negativo sullo stato di salute degli adolescenti, con conseguenti infezioni e insufficienza cardiaca5. I trattamenti attuali includono principalmente la trasfusione di sangue, l'integrazione di ferro e la terapia con eritropoietina. Tuttavia, questi trattamenti presentano svantaggi ed effetti collaterali negativi, come anafilassi, disturbi gastrointestinali, sovraccarico di ferro e orticaria1. Pertanto, è fondamentale identificare farmaci efficaci con meno effetti collaterali per il trattamento dell'anemia.
La medicina tradizionale cinese, compresa la medicina uigura, offre diversi vantaggi, come formulazioni multi-ingrediente, effetti multi-target, interazioni multi-link e meno effetti collaterali nella prevenzione e nel trattamento delle malattie multifattoriali. Lo sciroppo Shi-Liu-Bu-Xue (SLBXS) è un notevole agente tradizionale della medicina uigura utilizzato per i tonici del sangue e la produzione di sangue. È riconosciuto come un farmaco regolatore del sangue che può ridurre il calore del fegato ed è stato incluso nelle linee guida per l'uso clinico di farmaci minoritari per il trattamento dell'anemia. È inoltre autorizzato dalla Food and Drug Administration (Z20026094) dello Stato cinese6,7,8. Negli ultimi due decenni, SLBXS è stato ampiamente utilizzato in Cina per trattare le condizioni legate all'anemia. Tuttavia, i suoi potenziali meccanismi per il trattamento dell'anemia rimangono sconosciuti e richiedono ulteriori indagini. La metabolomica, che esamina le risposte metaboliche dinamiche dei sistemi biologici a malattie, interventi farmacologici o condizioni ambientali9, è sempre più utilizzata per chiarire i meccanismi d'azione della medicina tradizionale cinese valutando i cambiamenti nei biomarcatori metabolici in campioni biologici a seguito di stimoli esterni 9,10.
Di conseguenza, in questo studio è stato adottato un approccio di metabolomica epatica per determinare i meccanismi terapeutici sottostanti di SLBXS nel trattamento dell'anemia. In primo luogo, è stato stabilito un modello murino di anemia indotta da acetilfenilidrazina (APH). Successivamente, le vie metaboliche dei metaboliti endogeni sono state studiate utilizzando la metabolomica epatica con gascromatografia-spettrometria di massa (GC-MS) e metodi di dati multivariati dopo la somministrazione di SLBXS. Infine, i bersagli chiave sono stati analizzati sperimentalmente per chiarire gli effetti anti-anemici e i meccanismi molecolari di SLBXS.
Protocollo
Tutte le procedure sperimentali sono state approvate dal Comitato Etico degli Animali da Laboratorio dell'Università di Medicina Cinese di Hubei (HBUCMS201912015). I topi maschi C57BL/6 (peso 20-22 g) sono stati alloggiati in una stanza specifica priva di agenti patogeni con un'umidità relativa del 50%-60% e una temperatura di 22 °C ± 2 °C, sottoposti a un ciclo di 12 ore luce/12 ore di buio e dotati di libero accesso a cibo e acqua. Prima dell'inizio dell'esperimento, a tutti i topi è stata concessa una settimana per acclimatarsi all'ambiente. I topi sono stati assegnati in modo casuale a uno dei seguenti quattro gruppi (n = 12): controllo, modello, sciroppo Fu-Fang-E-Jiao (FFEJS, un farmaco positivo, somministrato per via intragastrica a 7,8 ml/kg) e SLBXS (somministrato per via intragastrica a 11,7 ml/kg). I topi nei gruppi di controllo e modello hanno ricevuto volumi uguali di soluzione salina. Ai topi di tutti i gruppi è stata somministrata la somministrazione intragastrica dei farmaci corrispondenti una volta al giorno per 2 settimane. I dettagli dei farmaci, dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Istituzione di un modello di anemia nei topi
- Pesare 2 g di acetilfenilidrazina (APH) utilizzando una bilancia elettronica e trasferirlo in un becher da 150 mL. Aggiungere 100 ml di soluzione salina e mescolare con una bacchetta di vetro fino a quando l'APH non è completamente sciolto.
- Stabilire il modello murino di anemia iniettando per via sottocutanea il 2% di APH come preparato al passaggio 1.1 il 1°, 4° e 7° giorno a dosaggi di 200 mg/kg, 100 mg/kg e 100 mg/kg, rispettivamente 11.
NOTA: A partire dal primo giorno, ai topi dei gruppi FFEJS (7,8 ml/kg) e SLBXS (11,7 ml/kg) è stata somministrata una volta al giorno per 2 settimane. I topi nei gruppi di controllo e modello hanno ricevuto volumi uguali di soluzione salina una volta al giorno per 2 settimane.
2. Determinazione dell'indice epatico
- Al termine dell'esperimento, pesare ogni topo utilizzando una bilancia elettronica.
- Anestetizzare i topi inalando isoflurano al 2%. Stringi il bulbo oculare dei topi per renderlo iperemico e sporgente. Rimuovere rapidamente il bulbo oculare con una pinza e raccogliere il sangue in provette per campioni eparinizzate.
- Fissare i topi anestetizzati dal passaggio 2.2 a una piastra di manipolazione chirurgica.
- Fai un'incisione completa lungo la linea mediana dell'addome con un bisturi. Sezionare e isolare con cura il tessuto epatico intatto12, quindi misurarne il peso con una bilancia elettronica.
NOTA: L'indice epatico di ciascun topo viene calcolato utilizzando la seguente formula: Indice epatico = peso epatico/peso corporeo.
3. Analisi ematologiche
- Agitare delicatamente la provetta contenente il campione di sangue eparinizzato dal passaggio 2.2 per prevenire la coagulazione del sangue.
- Posizionare il campione di sangue sotto l'ago per iniezione per assicurarsi che sia completamente immerso nell'ago.
- Fare clic sul pulsante Rilevamento automatico per misurare la conta dei globuli rossi (RBC), l'ematocrito (HCT), la conta dei globuli bianchi (WBC), i livelli di emoglobina (HGB) e la conta piastrinica (PLT) utilizzando un analizzatore di emociti completamente automatico.
4. Studio di metabolomica epatica
- Preparazione di campioni di fegato
- Omogeneizzare i campioni di tessuto epatico (50 mg) dalla fase 2.4 con 1 mL di metanolo pre-raffreddato. Centrifugare a 18,759 x g per 10 minuti a 4 °C per eliminare il precipitato.
- Trasferire 200 μl di surnatante in una fiala di campione utilizzando una pipetta e asciugare sotto vuoto in un liofilizzatore a 35 °C per 2 ore.
- Far reagire i campioni essiccati con 40 μL di una soluzione da 40 mg/mL di metossiammina cloridrato in piridina per 90 minuti a 30 °C. Quindi, aggiungere 80 μl di N-metil-N-(trimetilsilil)trifluoroacetammide (MSTFA) con l'1% di trimetilclorosilano (TMCS) e incubare per 60 minuti a 37 °C.
- Aggiungere 10 μL di n-esano alla fiala per terminare la reazione di derivatizzazione.
- Analisi metabolica epatica
- Analizzare i campioni derivatizzati (1 μL) utilizzando un sistema GC-MS. Separare i derivati utilizzando una colonna capillare DB-5MS (30 m × 0,25 mm × 0,25 μm).
NOTA: Le condizioni del programma di temperatura del forno sono state impostate come segue: 60 °C per 1 min; aumentare a 325 °C a una velocità di 10 °C/min e mantenere per 10 minuti. Le temperature dell'iniettore, della sorgente ionica e della MS sono state impostate rispettivamente a 250 °C, 230 °C e 150 °C. L'elio (99,999%) è stato utilizzato come gas di trasporto a una velocità di flusso di 1,1 mL/min e il rapporto di divisione è stato impostato su 10:1. Sono stati utilizzati un'energia del fascio di elettroni di 70 eV e un tempo di ritardo del solvente di 5,9 minuti.
- Analizzare i campioni derivatizzati (1 μL) utilizzando un sistema GC-MS. Separare i derivati utilizzando una colonna capillare DB-5MS (30 m × 0,25 mm × 0,25 μm).
- Elaborazione e analisi dei dati
- Acquisisci e converti i dati grezzi GC-MS utilizzando il software MassHunter compatibile.
- Condurre analisi spettrali utilizzando lo strumento AMDIS (Automated Mass Spectral Deconvolution and Identification System)12.
- Identificare tutti i metaboliti utilizzando i database NIST e HMDB (vedi Tabella dei materiali).
- Importa i dati nello strumento MetaboAnalyst per l'analisi discriminante dei minimi quadrati parziali (PLS-DA), i test t, l'analisi dei percorsi e l'analisi delle reti12.
5. Analisi del Western blot
- Estrarre le proteine totali dal tessuto epatico di topo
- Aggiungere 50 mg di tessuto epatico dal passaggio 2.4 e 250 μL di lisato cellulare a un omogeneizzatore di vetro da 1 mL e macinare con ghiaccio per 5 minuti.
- Trasferire l'omogeneizzato di tessuto epatico dal passaggio 5.1.1 a una provetta per microcentrifuga da 1,5 mL utilizzando un pipettatore e centrifugare a 18.759 x g per 10 minuti a 4 °C. Quindi trasferire il surnatante in una nuova provetta da 1,5 mL utilizzando un pipettatore.
- Determinazione delle concentrazioni proteiche e pre-elaborazione dei campioni proteici
- Aggiungere 2 μl di surnatante dal passaggio 5.1.2, 18 μl di PBS e 180 μl di soluzione di lavoro BCA a una piastra per microtitolazione a 96 pozzetti8.
- Far oscillare la piastra su un oscillatore per 30 s, lasciarla per 30 minuti a 37 °C e determinare l'assorbanza a 562 nm utilizzando un lettore di micropiastre.
- Separare le proteine totali utilizzando SDS-PAGE, trasferirle sulle membrane di fluoruro di polivinilidene e bloccarle con il 5% di latte scremato8.
- Incubare le membrane dalla fase 5.3 con anticorpi primari contro HIF-1α (1:1000), VEGFA (1:1000), GLA (1:1000), NOS3 (1:1000) e β-actina (1:5000) per una notte a 4 °C.
- Collocare le membrane del passaggio 5.4 in una scatola di incubazione degli anticorpi, aggiungere 10 mL di TBST e agitare orizzontalmente a 111 x g a temperatura ambiente per lavare via gli anticorpi primari non legati tre volte per 5 minuti ciascuna.
- Aggiungere 200 μL di IgG (H + L)-HRP di capra anti-coniglio (1:1000) a ciascuna membrana dal passaggio 5.5 e incubare per 2 ore a temperatura ambiente. Quindi, ripetere il passaggio 5.5 per lavare via l'anticorpo secondario non legato (capra anti-coniglio IgG (H + L)-HRP).
- Aggiungere 200 μl di soluzione chemiluminescente ECL ad altissima sensibilità sulla superficie di ciascuna membrana dal passaggio 5.6 e visualizzare immediatamente le bande proteiche utilizzando un sistema di analisi automatico di imaging a chemiluminescenza.
6. Analisi statistica
- Analizza i dati utilizzando software statistici e grafici con ANOVA unidirezionale seguita dal test di Tukey.
- Presentare i risultati come media ± deviazione standard (SD) e considerare un valore P < 0,05 come statisticamente significativo.
Risultati
Per confermare il successo dell'istituzione del modello murino di anemia e analizzare l'effetto di SLBXS sull'anemia, sono stati prima studiati l'indice epatico e i parametri ematologici. La Figura 1 illustra che il gruppo modello ha mostrato una diminuzione significativa (P < 0,01) della conta dei globuli rossi (RBC), dell'emoglobina (HGB) e dell'ematocrito (HCT) rispetto al gruppo di controllo. Al contrario, l'indice epatico, la conta dei globuli bianchi (WBC) e la conta piastrinica (PLT) nel gruppo modello erano notevolmente più alti (P < 0,05 o P < 0,01). Questi risultati confermano che il modello di anemia è stato stabilito con successo. L'indice epatico, i globuli bianchi e i PLT erano significativamente più bassi nel gruppo SLBXS rispetto al gruppo modello (P < 0,05 o P < 0,01), mentre i globuli rossi, HGB e HCT diminuiti nel gruppo modello erano marcatamente elevati dopo il trattamento con SLBXS (P < 0,05 o P < 0,01). Non c'era alcuna differenza significativa tra i parametri nei gruppi SLBXS e Fu-Fang-E-Jiao Syrup (FFEJS). Questi risultati indicano che SLBXS può migliorare i sintomi dell'anemia.
I tipici cromatogrammi ionici totali (TIC) dei campioni di fegato dei gruppi di controllo, modello, SLBXS e FFEJS sono presentati nella Figura 2. Differenze marcate sono evidenti nei profili dei metaboliti tra i gruppi di controllo, modello, SLBXS e FFEJS.
L'analisi discriminante dei minimi quadrati parziali (PLS-DA) è un metodo statistico supervisionato utilizzato per l'analisi discriminante, che modella la relazione tra l'espressione dei metaboliti e la classe del campione per prevedere la classe del campione. Il grafico dei punteggi PLS-DA (Figura 3A) mostra una netta separazione tra i gruppi di controllo, modello, SLBXS e FFEJS. Il grafico del punteggio tra il gruppo di controllo e quello del modello è mostrato nella Figura 3B, dove il gruppo del modello è significativamente separato dal gruppo di controllo. Ciò indica che l'anemia interrompe il normale metabolismo nei topi, confermando che il modello di anemia è stato sviluppato con successo. La Figura 3C mostra il grafico del punteggio PLS-DA in base al modello e ai gruppi SLBXS. Il valore VIP (Variable Importance in Projection) è stato calcolato per valutare quanto fortemente il modello di espressione di ciascun metabolita influenzi la classificazione dei gruppi di campioni e per aiutare a identificare i metaboliti marcatori chiave. Un valore VIP >1,0 viene in genere utilizzato come criterio di screening (Figura 3D). La convalida incrociata è stata quindi impiegata per convalidare il modello PLS-DA stabilito. Come mostrato nella Figura 3E, il modello mostrava buoni valori di R² (0,95) e Q2 (0,86), indicando che il modello PLS-DA era affidabile con un rischio minimo di overfitting. I metaboliti con > VIP 1 e P < 0,05 sono stati classificati come metaboliti differenziali. Sono stati identificati un totale di 29 metaboliti differenziali (vedi Tabella 1). I risultati suggeriscono che l'SLBXS potrebbe sovraregolare metaboliti come xilosio, tetracosano, alfa-tocoferolo e D-glucosio, riducendo al contempo la sottoregolazione di metaboliti come la porfina. L'analisi dell'arricchimento del percorso di questi 29 metaboliti differenziali, condotta utilizzando MetaboAnalyst, ha rivelato che erano correlati a 15 percorsi. Tra queste, il metabolismo del galattosio e la degradazione del lattosio (P < 0,05) sono stati identificati come le vie metaboliche più pertinenti coinvolte nel trattamento dell'anemia da parte di SLBXS (Figura 3F e Figura 4).
La Figura 5 dimostra che i livelli di espressione proteica di HIF-1α, VEGFA, GLA e NOS3 erano significativamente elevati nel gruppo modello rispetto al gruppo di controllo (P < 0,01). SLBXS ha invertito significativamente l'upregolazione dell'espressione di HIF-1α, VEGFA, GLA e NOS3 osservata nel gruppo modello (P < 0,01).
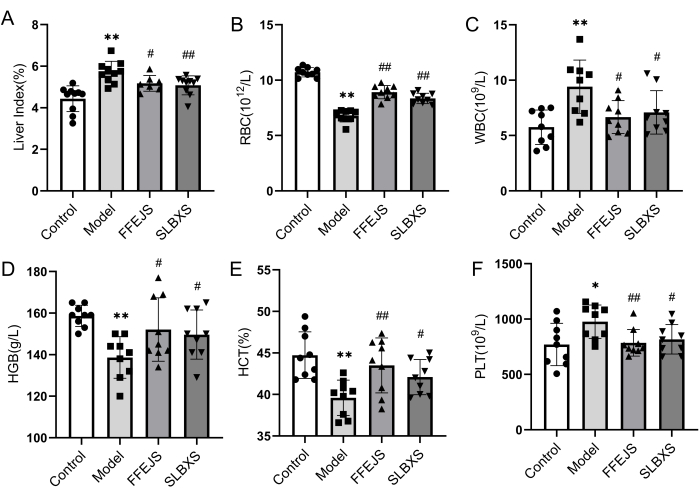
Figura 1: Effetti della SLBXS sull'indice epatico e sulla routine del sangue periferico dei topi con anemia dopo 14 giorni di somministrazione. (A) La SLBXS ha diminuito l'indice epatico. (B) SLBXS ha aumentato i livelli di globuli rossi. (C) SLBXS ha diminuito i livelli di globuli bianchi. (D) SLBXS ha aumentato i livelli di HGB. (E) SLBXS ha aumentato i livelli di HCT. (F) SLBXS ha diminuito i livelli di PLT. Controllo vs Modello, *P < 0,05, **P < 0,01; Modello vs FFEJS o SLBXS, #P < 0.05, ##P < 0.01. SLBXS, sciroppo Shi-Liu-Bu-Xue; globuli rossi, globuli rossi; WBC, globuli bianchi; HGB, emoglobina; HCT, ematocrito; PLT, piastrine. Clicca qui per visualizzare una versione più grande di questa figura.
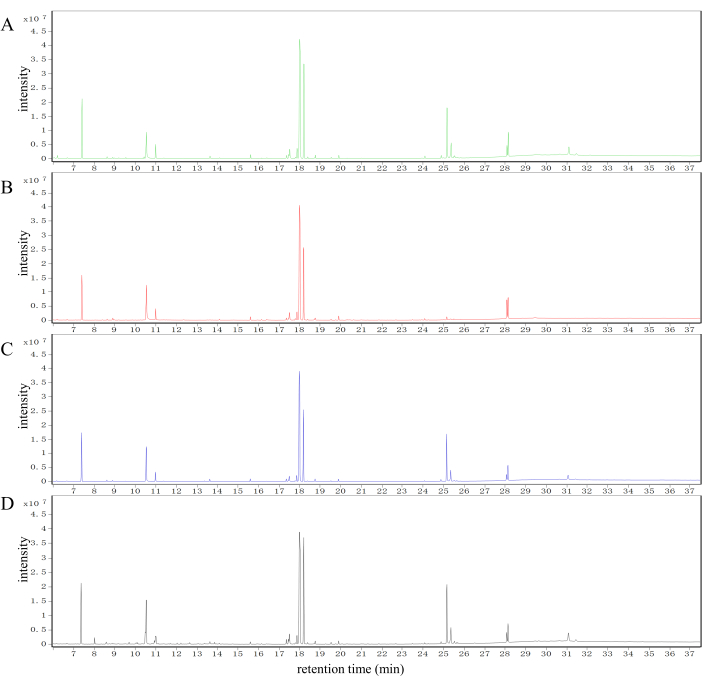
Figura 2: Analisi delle differenze metaboliche di campioni di fegato provenienti da diversi gruppi di topi nel sistema GC-MS. TIC di campioni di fegato ottenuti dai gruppi di controllo (A), modello (B), SLBXS (C) e FFEJS (D). TIC, cromatogrammi ionici totali; SLBXS, sciroppo Shi-Liu-Bu-Xue; FFEJS, sciroppo Fu-Fang-E-Jiao. Clicca qui per visualizzare una versione più grande di questa figura.
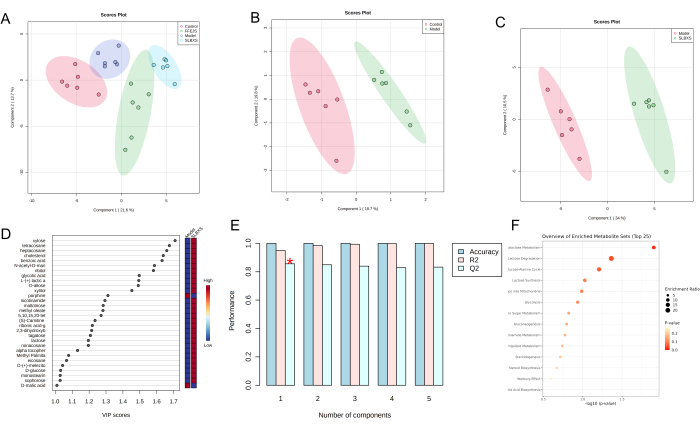
Figura 3: Analisi dei dati delle differenze metaboliche in campioni di fegato di diversi gruppi di topi. Grafici del punteggio PLS-DA del fegato dei gruppi di controllo, modello, SLBXS e FFEJS (A); grafici dei punteggi PLS-DA dei gruppi di controllo e modello (B); grafici del punteggio PLS-DA (C), grafici del punteggio VIP (D) e convalida incrociata (E) tra il modello e i gruppi SLBXS utilizzando l'analisi metabolomica; analisi dell'arricchimento della via dei metaboliti differenziali (F). SLBXS, sciroppo Shi-Liu-Bu-Xue; FFEJS, sciroppo Fu-Fang-E-Jiao. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: La rete regolatoria di SLBXS per il trattamento dell'anemia. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Determinazione dei livelli di proteine HIF-1α, VEGFA, GLA e NOS3 nel fegato di topi mediante Western blotting. (A) Bande proteiche diverse rappresentative. (B) Analisi statistica dei livelli di espressione di diverse proteine. I dati sono presentati come SD media (n = 3), **P < 0,01 vs. il gruppo di controllo; ##P < 0,01 contro il gruppo di modelli. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella 1: Riassunto dei metaboliti differenziali. Clicca qui per scaricare questa tabella.
Discussione
L'anemia è una condizione comune che colpisce molte persone in tutto il mondo, in particolare nei paesi in via di sviluppo1. In Cina, i pazienti usano spesso la medicina tradizionale cinese, compresa la medicina uigura, per alleviare i segni e i sintomi dell'anemia. SLBXS è un medicinale uiguro utilizzato nella pratica clinica da molti anni; Tuttavia, il suo esatto meccanismo d'azione contro l'anemia rimane poco compreso13. In questo studio, è stato stabilito un modello murino di anemia indotta da acetilfenilidrazina (APH) per chiarire i meccanismi alla base della SLBXS nel trattamento dell'anemia attraverso l'analisi metabolomica.
La metabolomica è uno strumento prezioso per diagnosticare le malattie, scoprire potenziali biomarcatori ed esplorare la patogenesi delle malattie attraverso l'analisi qualitativa e quantitativa dei metaboliti di piccole molecole in campioni biologici. In questo studio, l'acetilfenilidrazina (APH) è stata utilizzata per costruire un modello di anemia. L'APH è un forte agente ossidante che provoca un danno ossidativo lento e progressivo agli eritrociti, in particolare interferendo con la glucosio-6-fosfato deidrogenasi, promuovendo la denaturazione dell'emoglobina (HGB) e la formazione di corpi Heinz. Distrugge anche direttamente le proteine di membrana e i lipidi degli eritrociti, portando alla lisi della membrana, alla rottura e alla disintegrazione degli eritrociti, con conseguente anemia emolitica14,15. Il fegato, essendo la più grande ghiandola digestiva del corpo umano, svolge un ruolo cruciale nell'immagazzinamento dell'energia e nella regolazione metabolica, mantenendo l'equilibrio tra metabolismo e catabolismo16. In questo studio, i fegati ingrossati dei topi modello sono stati significativamente alleviati dopo 14 giorni di somministrazione di SLBXS. Sono necessari ulteriori studi per determinare se il fegato è un probabile organo bersaglio per SLBXS e per chiarire i meccanismi correlati. Di conseguenza, la gascromatografia-spettrometria di massa (GC-MS) è stata utilizzata per rilevare i metaboliti nel fegato dei topi con anemia. L'analisi metabolomica ha identificato ventinove biomarcatori e due vie metaboliche chiave: il metabolismo del galattosio e la degradazione del lattosio.
Molti componenti attivi, tra cui tannini, flavonoidi, alcaloidi e acidi organici, sono stati riportati nel melograno17,18. Questi ingredienti esercitano vari effetti farmacologici, tra cui attività antiossidanti, antinfiammatorie, antibatteriche e antitumorali. Le prove suggeriscono che il succo di melograno è più potente del vino rosso e del tè verde in termini di attività antiossidante a causa del suo maggiore contenuto di polifenoli19,20. Questi composti mostrano i loro effetti antiossidanti attraverso diversi meccanismi, tra cui l'eliminazione o la neutralizzazione dei radicali liberi, la chelazione dei metalli, l'influenza delle vie di segnalazione cellulare e la regolazione dell'espressione genica19,20. Inoltre, l'estratto di melograno è ricco di flavonoidi, che potenziano gli effetti antiossidanti riducendo i livelli di malondialdeide e perossido di idrogeno e aumentando le attività della catalasi, della superossido dismutasi, della glutatione perossidasi e della glutatione reduttasi nel fegato21. I conigli bianchi sani trattati con estratto di melograno hanno mostrato cambiamenti significativi nella conta degli eritrociti, nei livelli di emoglobina (HGB) e nelle concentrazioni medie di HGB negli eritrociti, nonché un significativo prolungamento del sanguinamento e del tempo di protrombina, un marcato aumento dei livelli di proteina C (proteina anticoagulante) e di composti trombina-antitrombina e una riduzione dose-dipendente dell'aggregazione piastrinica e della concentrazione di fibrinogeno. Sulla base dei risultati dei test ematologici e di coagulazione, si può ipotizzare che il melograno possa avere effetti antianemici e cardioprotettivi22. Nella medicina tradizionale indiana, materiali vegetali come il succo di melograno sono usati come integratore alimentare per trattare l'anemia da carenza di ferro, possibilmente correlata alla promozione dell'assorbimento del ferro23.
Per chiarire ulteriormente il meccanismo di SLBXS nel trattamento dell'anemia, è stata eseguita un'analisi metabolomica completa. I metaboliti coinvolti nella rete di interazione erano alfa-tocoferolo, D-xilitolo, niacinamide, D-glucosio e lattosio, mentre i bersagli erano HIF1A, VEGFA, NOS3 e GLA. L'alfa-tocoferolo (vitamina E) ha proprietà antiossidanti che inibiscono la lisi prematura dei globuli rossi prevenendo l'ossidazione degli acidi grassi polinsaturi nella membrana dei globuli rossi24. Può, quindi, agire come un potenziale agente eritropoietico riducendo la lisi prematura degli eritrociti e diminuendo la fragilità dei globuli rossi25. Lo xilitolo, a dosi non tossiche, può alleviare l'emolisi indotta da APH. Il suo effetto antiemolitico può essere attribuito al suo ruolo nella produzione di NADPH, che protegge dal danno ossidativo dovuto all'assenza di mitocondri nei globuli rossi. Questo aiuta a mantenere i livelli di glutatione e protegge l'emoglobina, le proteine funzionali e altri componenti strutturali dal danno perossidativo26,27. La nicotinamide è un precursore della sintesi del coenzima I (NAD) e del coenzima II (NADP) nell'uomo28. Il NAD è un importante cofattore per molti enzimi coinvolti nel metabolismo energetico29. Il D-glucosio, il lattosio e il GLA sono componenti chiave del metabolismo del galattosio. Come importante fattore di trascrizione sensibile all'ossigeno, HIF-1α è fondamentale nella via di adattamento all'ipossia ed è considerato il regolatore primario delle risposte trascrizionali omeostatiche nelle cellule e nei tessuti 30,31. HIF-1α viene rapidamente degradato dalla prolil idrossilasi (PHD) in condizioni normossiche, ma in condizioni ipossiche, PHD viene inibito, portando all'accumulo di HIF-1α32. HIF-1α attiva i geni che controllano l'omeostasi cellulare dell'ossigeno, compresi quelli coinvolti nella produzione di globuli rossi, nel consumo di ossigeno, nella vasculogenesi e nel metabolismo mitocondriale33. VEGFA è una citochina che agisce principalmente sulle cellule endoteliali vascolari ed è espressa in molte cellule specializzate durante l'ischemia e l'ipossia34. NOS3 (eNOS) si trova principalmente nell'endotelio dei vasi coronarici e nella superficie luminale del cuore, partecipando al metabolismo dell'arginina e della prolina e catalizzando la produzione di ossido nitrico (NO). L'NO agisce come un potente vasodilatatore attivando la guanilato ciclasi solubile nelle cellule muscolari lisce35. Inoltre, l'NO interagisce con le specie reattive dell'ossigeno prodotte dagli eritrociti per generare specie reattive dell'ossido di azoto, riducendo così il danno ossidativo36.
Infine, i risultati della metabolomica sono stati convalidati utilizzando il Western blotting. I risultati hanno mostrato che i livelli di HIF-1α, VEGFA, GLA e NOS3 sono diminuiti dopo il trattamento con SLBXS rispetto a quelli del gruppo modello. HIF-1α, VEGFA e NOS3 sono bersagli importanti nella via di segnalazione di HIF-1, mentre GLA è un bersaglio chiave nel metabolismo del galattosio. Questi risultati suggeriscono che SLBXS può influenzare sia la via di segnalazione HIF-1 che la via del metabolismo del galattosio, dimostrando un effetto combinato nel trattamento dell'anemia. Numerosi studi hanno evidenziato il ruolo significativo delle vie metaboliche dell'HIF-1 e del galattosio nel trattamento dell'anemia e delle malattie correlate. L'anemia riduce la capacità di trasporto dell'ossigeno nel sangue, portando all'ipossia tissutale. HIF-1α si accumula nelle cellule in condizioni di ipossia e alti livelli di HIF-1α aumentano l'espressione di EPO e VEGF, contribuendo a un microambiente ematopoietico stabile, facilitando il trasporto di nutrienti e ossigeno e proteggendo le cellule dal danno ipossico 37,38. È stato dimostrato che l'attivazione della via HIF-1 stimola l'eritropoiesi, aumenta i livelli di emoglobina, corregge le condizioni anemiche e migliora l'omeostasi del ferro39. Il miglioramento dell'ipossia dopo il trattamento con SLBXS spiega la ridotta espressione proteica nella via HIF-1 osservata nel gruppo SLBXS. La GLA (α-galattosidasi A) è un'eso-glicosidasi che ha come bersaglio i galatto-oligosaccaridi come lo stachiosio, il raffinosio e il melibiosio, nonché i polisaccaridi ramificati come il galattomannano e il galattoglucomannano catalizzando l'idrolisi dei residui terminali di galattosio legati al α-1,640. Il galattosio è essenziale per il metabolismo cellulare in quanto facilita la produzione e l'immagazzinamento di energia in vari tessuti corporei e funge da precursore della glicosilazione41. L'integrazione con galatto-oligosaccaridi può migliorare l'assorbimento del ferro nell'intestino dei ratti e aumentare i livelli di emoglobina nel sangue42. In questo studio, abbiamo studiato i meccanismi alla base della SLBXS nel trattamento dell'anemia utilizzando una combinazione di metabolomica e farmacologia di rete. Abbiamo scoperto che la via di segnalazione HIF-1 e la via del metabolismo del galattosio sono significativamente importanti nel trattamento dell'anemia con SLBXS. Questo studio fornisce nuove informazioni sui meccanismi di SLBXS nel trattamento dell'anemia. La ricerca futura dovrebbe concentrarsi maggiormente sull'identificazione e la comprensione dei principi attivi coinvolti.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dal Piano di formazione speciale per i talenti delle minoranze scientifiche e tecnologiche, dalla Fondazione per le scienze naturali della regione autonoma uigura dello Xinjiang (2020D03021), dai fondi per il programma chiave per la medicina tradizionale cinese dell'Università di medicina cinese dell'Hubei (2022ZZXZ004) e dal programma Tianshan Innovation Team (2020D14030).
Materiali
| Name | Company | Catalog Number | Comments |
| Acetylphenylhydrazine | Shanghai Aladdin Biochemical Technology Co., Ltd. | C13979660 | |
| Automatic chemiluminescence imaging analysis system | Shanghai Tanon Life Science Co., Ltd. | Tanon-5200 | |
| Bicinchoninic acid assay kit | ThermoFisher Scientific | QPBCA-1KT | |
| Capillary column | Agilent J&W Scientific, Agilent Technologies, Inc. | DB-5MS | |
| Cell lysis buffer for Western and IP | Beyotime Biotechnology | P0013 | |
| Chlorotrimethylsilane | Shanghai Aladdin Biochemical Technology Co., Ltd. | C104814 | |
| Electronic balance | Mettler-Toledo International Inc. | ME203E | |
| Electronic scale | Mettler-Toledo International Inc. | LE104E | |
| Fu-Fang-E-Jiao Syrup | Dong E E Jiao Co., Ltd. | 214020031 | |
| Fully automatic hemocyte analyzer | Shenzhen Mindray Animal Care Technology Co., Ltd. | IDEXX ProCyte Dx | |
| GC-MS system | Agilent Technologies, Inc. | 7890B-5977B | |
| GLA primary antibody | Bioworld Technology | BS77041 | |
| Glass homogenizer | Shanghai Lei Gu Instruments Co., Ltd. | B-013001 | |
| Glass rod | Shanghai Lei Gu Instruments Co., Ltd. | B-003904 | |
| GraphPad Prism software | GraphPad, La Jolla | Version 9.0 | |
| Heparinized sample tubes | Changde BKMAM Biotechnology Co., Ltd. | B-ACT1P5 | |
| HIF-1α primary antibody | Bioworld Technology | BS3514 | |
| HMDB database | http://www.hmdb.ca/ | — | |
| Isoflurane | Hebei Jindafu Pharmaceutical Co., Ltd. | 20231202 | |
| Male C57BL/6 mice | Liaoning Changsheng Biotechnology Co., Ltd. | No. SCXK [Liao] 2015-0001 | |
| MassHunter | Agilent Technologies, Inc. | B.08.00 | |
| MetaboAnalyst 5.0 | https://www.metaboanalyst.ca/ | — | |
| Methoxyamine hydrochloride | Shanghai Aladdin Biochemical Technology Co., Ltd. | E1818113 | |
| n-hexane | Shanghai Aladdin Biochemical Technology Co., Ltd. | C14878803 | |
| NIST database | http://webbook.nist.gov/chemistry/ | — | |
| NOS3 primary antibody | Bioworld Technology | BS3625 | |
| Pyridine | Shanghai Aladdin Biochemical Technology Co., Ltd. | C13026996 | |
| Saline | BIOSHARP LIFE SCIENCES | 2308262009 | |
| Shi-Liu-Bu-Xue Syrup | Xinjiang Uygur Pharmaceutical Co., Ltd. | 211277 | |
| Surgical manipulation plate | DIXSG | ZK-JPB-A | |
| VEGFA primary antibody | Bioworld Technology | AP0742 | |
| β-actin | ABclonal (Shanghai) Trading Co., Ltd. | AC026 |
Riferimenti
- Munoz, M., Gomez-Ramirez, S., Bhandari, S. The safety of available treatment options for iron-deficiency anemia. Expert Opin Drug Saf. 17 (2), 149-159 (2018).
- Soliman, A. T., De Sanctis, V., Yassin, M., Wagdy, M., Soliman, N. Chronic anemia and thyroid function. Acta Biomed. 88 (1), 119-127 (2017).
- Pivina, L., Semenova, Y., Dosa, M. D., Dauletyarova, M., Bjorklund, G. Iron deficiency, cognitive functions, and neurobehavioral disorders in children. J Mol Neurosci. 68 (1), 1-10 (2019).
- Lumbiganon, P., et al. Indirect causes of severe adverse maternal outcomes: a secondary analysis of the WHO Multicountry Survey on Maternal and Newborn Health. BJOG. 121 (Suppl 1), 32-39 (2014).
- Shaddy, R. E., et al. Systematic literature review on the incidence and prevalence of heart failure in children and adolescents. Pediatr Cardiol. 39 (3), 415-436 (2018).
- China Medical Association of Minorities. Guidelines for clinical use of minority drugs. , Chinese Press of Traditional Chinese Medicine. Beijing. (2018).
- Yu, W. Q. Clinical efficiency of Pomegranate blood-enriching syrup in the treatment of iron deficiency anemia. J Med Pharm Chin Minor. 26 (11), 11-12 (2020).
- Zhang, D. N., et al. Mechanism of Shiliu Buxue Syrup for anemia using integrated metabolomics and network pharmacology. Anal Biochem. 653, 114774(2022).
- Nielsen, J. Systems biology of metabolism. Annu Rev Biochem. 86, 245-275 (2017).
- Wang, M., et al. Metabolomics highlights pharmacological bioactivity and biochemical mechanism of traditional Chinese medicine. Chem Biol Interact. 273, 133-141 (2017).
- Ben, C. N. Establishment and experimental research of "Blood Deficiency" animal model. Lab Animal Sci. (03), 5-10 (1994).
- Cao, S., et al. Integrative transcriptomics and metabolomics analyses provide hepatotoxicity mechanisms of asarum. Exp Ther Med. 20 (2), 1359-1370 (2020).
- Yang, H. Y., Liu, M. L., Luo, P., Yao, X. S., Zhou, H. Network pharmacology and metabolomics in the study of traditional Chinese medicine for cardiovascular diseases. Phytomedicine. 104, 154268(2022).
- Croci, S., Pedrazzi, G., Passeri, G., Piccolo, P., Ortalli, I. Acetylphenylhydrazine induced haemoglobin oxidation in erythrocytes studied by Mossbauer spectroscopy. Biochim Biophys Acta. 1568 (1), 99-104 (2001).
- Liebowitz, J., Cohen, G. Increased hydrogen peroxide levels in glucose 6-phosphate dehydrogenase deficient erythrocytes expose to acetylphenylhydrazine. Biochem Pharmacol. 17 (6), 983-988 (1968).
- Tarasenko, T. N., McGuire, P. J. The liver is a metabolic and immunologic organ: A reconsideration of metabolic decompensation due to infection in inborn errors of metabolism (IEM). Mol Genet Metab. 121 (4), 283-288 (2017).
- Topalovic, A., Knezevic, M., Gacnik, S., Mikulic-Petkovsek, M. Detailed chemical composition of juice from autochthonous pomegranate genotypes (Punica granatum L.) grown in different locations in Montenegro. Food Chem. 330, 127261(2020).
- Legua, P., et al. Total phenols and antioxidant capacity in 10 Moroccan pomegranate varieties. J Food Sci. 77 (1), C115-C120 (2012).
- Rodrigo, R., Miranda, A., Vergara, L. Modulation of endogenous antioxidant system by wine polyphenols in human disease. Clin Chim Acta. 412 (5-6), 410-424 (2011).
- Hussain, T., et al. Oxidative stress and inflammation: What polyphenols can do for us. Oxid Med Cell Longev. 2016, 7432797(2016).
- Sudheesh, S., Vijayalakshmi, N. R. Flavonoids from Punica granatum--potential antiperoxidative agents. Fitoterapia. 76 (2), 181-186 (2005).
- Riaz, A., Khan, R. A. Anticoagulant, antiplatelet and antianemic effects of Punica granatum (pomegranate) juice in rabbits. Blood Coagul Fibrinolysis. 27 (3), 287-293 (2016).
- Balasubramani, S. P., Varghese, R. K., Vishnuprasad, C. N., Venkatasubramanian, P. Pomegranate juice enhances iron dialysability and assimilation in in-vitro cell-free and cell-based models. Plant Foods Hum Nutr. 75 (2), 272-278 (2020).
- Jilani, T., Iqbal, M. P. Does vitamin E have a role in treatment and prevention of anemia. Pak J Pharm Sci. 24 (2), 237-242 (2011).
- Farrell, P. M., Bieri, J. G., Fratantoni, J. F., Wood, R. E., di Sant'Agnese, P. A. The occurrence and effects of human vitamin E deficiency. A study in patients with cystic fibrosis. J Clin Invest. 60 (1), 233-241 (1977).
- Ukab, W. A., Sato, J., Wang, Y. M., van Eys, J. Xylitol mediated amelioration of acetylphenylhydrazine-induced hemolysis in rabbits. Metabolism. 30 (11), 1053-1059 (1981).
- Ahuja, V., et al. Biological and pharmacological potential of xylitol: A molecular insight of unique metabolism. Foods. 9 (11), 1592(2020).
- Nikas, I. P., Paschou, S. A., Ryu, H. S. The role of nicotinamide in cancer chemoprevention and therapy. Biomolecules. 10 (3), 477(2020).
- Katayoshi, T., Yamaura, N., Nakajo, T., Kitajima, N., Tsuji-Naito, K. Porcine placental extract increases the cellular NAD levels in human epidermal keratinocytes. Sci Rep. 12 (1), 19040(2022).
- Bartoszewski, R., et al. Primary endothelial cell-specific regulation of hypoxia-inducible factor (HIF)-1 and HIF-2 and their target gene expression profiles during hypoxia. Faseb J. 33 (7), 7929-7941 (2019).
- Lee, S. H., Golinska, M., Griffiths, J. R. HIF-1-independent mechanisms regulating metabolic adaptation in hypoxic cancer cells. Cells. 10 (9), 2371(2021).
- Sato, T., Takeda, N. The roles of HIF-1α signaling in cardiovascular diseases. J Cardiol. 81 (2), 202-208 (2023).
- Ratcliffe, P. J. Oxygen sensing and hypoxia signalling pathways in animals: The implications of physiology for cancer. J Physiol. 591 (8), 2027-2042 (2013).
- Li, L. J., Huang, Q., Zhang, N., Wang, G. B., Liu, Y. H. miR-376b-5p regulates angiogenesis in cerebral ischemia. Mol Med Rep. 10 (1), 527-535 (2014).
- Tejero, J., Shiva, S., Gladwin, M. T. Sources of vascular nitric oxide and reactive oxygen species and their regulation. Physiol Rev. 99 (1), 311-379 (2019).
- Fujii, J., et al. Erythrocytes as a preferential target of oxidative stress in blood. Free Radic Res. 55 (5), 562-580 (2021).
- Huang, J. W., et al. High expression of HIF-1α alleviates benzene-induced hematopoietic toxicity and immunosuppression in mice. Environ Pollut. 311, 119928(2022).
- Zhang, Z., Yao, L., Yang, J., Wang, Z., Du, G. PI3K/Akt and HIF-1 signaling pathway in hypoxia-ischemia (Review). Mol Med Rep. 18 (4), 3547-3554 (2018).
- Del Balzo, U., et al. Nonclinical characterization of the hypoxia-inducible factor prolyl hydroxylase inhibitor roxadustat, a novel treatment of anemia of chronic kidney disease. J Pharmacol Exp Ther. 374 (2), 342-353 (2020).
- Bhatia, S., Singh, A., Batra, N., Singh, J. Microbial production and biotechnological applications of α-galactosidase. Int J Biol Macromol. 150, 1294-1313 (2020).
- Conte, F., van Buuringen, N., Voermans, N. C., Lefeber, D. J. Galactose in human metabolism, glycosylation and congenital metabolic diseases: Time for a closer look. Biochim Biophys Acta Gen Subj. 1865 (8), 129898(2021).
- Wang, Y. Y. Investigate the effect of galacto-oligosaccharide supplementation on intestinal absorption of iron in rats. [Master's Thesis]. , Southern Medical University. (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon