Method Article
Evaluación del mecanismo de un jarabe de hierbas tradicional para el tratamiento de la anemia mediante metabolómica hepática
En este artículo
Resumen
Este estudio presenta principalmente la aplicación de la metabolómica hepática en la investigación de la eficacia del jarabe Shi-Liu-Bu-Xue en el tratamiento de la anemia.
Resumen
Como medicina uigur muy conocida, el jarabe Shi-Liu-Bu-Xue (SLBXS) se ha utilizado ampliamente para tratar la anemia en China durante más de 20 años. Sin embargo, los mecanismos subyacentes de su eficacia en el tratamiento de la anemia siguen sin estar claros. En este estudio, la metabolómica hepática se empleó principalmente para determinar los posibles mecanismos reguladores de SLBXS en el tratamiento de la anemia. Se llevó a cabo un perfil metabolómico hepático para caracterizar el mecanismo de acción de SLBXS en un modelo murino de anemia inducida por acetilfenilhidracina. Se demostró que SLBXS disminuye el índice hepático, el recuento de glóbulos blancos y el recuento de plaquetas, al tiempo que aumenta el recuento de glóbulos rojos, la hemoglobina y los niveles de hematocrito. Se seleccionaron los objetivos principales para la verificación mediante Western blot. SLBXS demostró un efecto terapéutico significativo sobre la anemia principalmente mediante la regulación del metabolismo de la galactosa y la vía de señalización HIF-1, como lo indica la regulación negativa de las proteínas HIF-1α, NOS3, VEGFA y GLA en los tejidos hepáticos de ratones anémicos. Este estudio clarifica los posibles mecanismos reguladores del metabolismo hepático mediante la administración de SLBXS en el tratamiento de la anemia.
Introducción
La anemia es un problema de salud mundial apremiante y prevalente, que afecta al 25% de la población mundial y a personas de todas las edades, especialmente a adolescentes y mujeres embarazadas 1,2,3. Se asocia con un mayor riesgo de parto prematuro y mortalidad materna y puede provocar trastornos del desarrollo físico y deterioro del rendimiento cardiovascular4. Esta condición también puede afectar negativamente el estado de salud de los adolescentes, lo que resulta en infecciones e insuficiencia cardíaca5. Los tratamientos actuales incluyen principalmente transfusiones de sangre, suplementos de hierro y terapia con eritropoyetina. Sin embargo, estos tratamientos tienen desventajas y efectos secundarios adversos, como anafilaxia, malestar gastrointestinal, sobrecarga de hierro y urticaria1. Por lo tanto, es crucial identificar medicamentos efectivos con menos efectos secundarios para tratar la anemia.
La medicina tradicional china, incluida la medicina uigur, ofrece varias ventajas, como formulaciones de múltiples ingredientes, efectos de múltiples objetivos, interacciones de múltiples vínculos y menos efectos secundarios en la prevención y el tratamiento de enfermedades multifactoriales. El jarabe Shi-Liu-Bu-Xue (SLBXS) es un agente tradicional notable en la medicina uigur utilizado para los tónicos sanguíneos y la producción de sangre. Está reconocido como un fármaco regulador de la sangre que puede reducir el calor hepático y se ha incluido en las directrices para el uso clínico de medicamentos minoritarios para el tratamiento de la anemia. También está autorizado por la Administración Estatal de Alimentos y Medicamentos de China (Z20026094)6,7,8. En las últimas dos décadas, SLBXS se ha utilizado ampliamente en China para tratar afecciones relacionadas con la anemia. Sin embargo, sus posibles mecanismos para tratar la anemia siguen siendo desconocidos y requieren más investigación. La metabolómica, que examina las respuestas metabólicas dinámicas de los sistemas biológicos a las enfermedades, las intervenciones farmacológicas o las condiciones ambientales9, se utiliza cada vez más para dilucidar los mecanismos de acción de la medicina tradicional china mediante la evaluación de los cambios en los biomarcadores metabólicos en muestras biológicas después de estímulos externos 9,10.
En consecuencia, se adoptó un enfoque metabolómico hepático en este estudio para determinar los mecanismos terapéuticos subyacentes de SLBXS en el tratamiento de la anemia. En primer lugar, se estableció un modelo de ratón de anemia inducida por acetilfenilhidracina (APH). A continuación, se investigaron las vías metabólicas de los metabolitos endógenos utilizando metabolómica hepática con cromatografía de gases-espectrometría de masas (GC-MS) y métodos de datos multivariados tras la administración de SLBXS. Por último, se analizaron experimentalmente los objetivos clave para dilucidar los efectos antianémicos y los mecanismos moleculares de SLBXS.
Protocolo
Todos los procedimientos experimentales fueron aprobados por el Comité de Ética de Animales de Laboratorio de la Universidad de Medicina China de Hubei (HBUCMS201912015). Los ratones machos C57BL/6 (peso 20-22 g) se alojaron en una habitación específica libre de patógenos con una humedad relativa del 50%-60% y una temperatura de 22 °C ± 2 °C, se sometieron a un ciclo de 12 h de luz/12 h de oscuridad y se les proporcionó libre acceso a alimentos y agua. Antes de que comenzara el experimento, a todos los ratones se les permitió una semana para aclimatarse al medio ambiente. Los ratones fueron asignados aleatoriamente a uno de los siguientes cuatro grupos (n = 12): control, modelo, jarabe Fu-Fang-E-Jiao (FFEJS, un fármaco positivo, administrado por vía intragástrica a 7,8 mL/kg) y SLBXS (administrado por vía intragástrica a 11,7 mL/kg). Los ratones de los grupos de control y modelo recibieron volúmenes iguales de solución salina. Los ratones de todos los grupos recibieron administración intragástrica de los fármacos correspondientes una vez al día durante 2 semanas. Los detalles de los medicamentos, reactivos y equipos utilizados en este estudio se enumeran en la Tabla de materiales.
1. Establecimiento de un modelo de anemia en ratones
- Pese 2 g de acetilfenilhidracina (APH) con una balanza electrónica y transfiéralo a un vaso de precipitados de 150 ml. Agregue 100 mL de solución salina y revuelva con una varilla de vidrio hasta que el APH se disuelva por completo.
- Establecer el modelo murino de anemia inyectando por vía subcutánea un 2% de APH como se preparó en el paso 1.1 en el1º,4º y7º día a dosis de 200 mg/kg, 100 mg/kg y 100 mg/kg, respectivamente11.
NOTA: A partir del primer día, los ratones de los grupos FFEJS (7,8 mL/kg) y SLBXS (11,7 mL/kg) recibieron administración intragástrica una vez al día durante 2 semanas. Los ratones de los grupos de control y modelo recibieron volúmenes iguales de solución salina una vez al día durante 2 semanas.
2. Determinación del índice hepático
- Al final del experimento, pesa cada ratón con una báscula electrónica.
- Anestesiar a los ratones inhalando isoflurano al 2%. Aprieta el globo ocular de los ratones para hacerlo hiperémico y protuberante. Retire rápidamente el globo ocular con pinzas y recoja la sangre en tubos de muestra heparinizados.
- Asegure los ratones anestesiados del paso 2.2 a una placa de manipulación quirúrgica.
- Haz una incisión completa a lo largo de la línea media del abdomen con un bisturí. Diseccionar y aislar cuidadosamente el tejido hepático intacto12, luego medir su peso con una balanza electrónica.
NOTA: El índice hepático de cada ratón se calcula utilizando la siguiente fórmula: Índice hepático = peso hepático/peso corporal.
3. Análisis hematológico
- Agite suavemente el tubo que contiene la muestra de sangre heparinizada del paso 2.2 para prevenir la coagulación de la sangre.
- Coloque la muestra de sangre debajo de la aguja de inyección para asegurarse de que esté completamente sumergida en la aguja.
- Haga clic en el botón Detección automática para medir el recuento de glóbulos rojos (RBC), el hematocrito (HCT), el recuento de glóbulos blancos (WBC), los niveles de hemoglobina (HGB) y el recuento de plaquetas (PLT) utilizando un analizador de hemocitos totalmente automático.
4. Estudio de metabolómica hepática
- Preparación de la muestra de hígado
- Homogeneizar las muestras de tejido hepático (50 mg) del paso 2.4 con 1 mL de metanol preenfriado. Centrifugar a 18.759 x g durante 10 min a 4 °C para eliminar el precipitado.
- Transferir 200 μL del sobrenadante a un vial de muestra con una pipeta y secar al vacío en un liofilizador a 35 °C durante 2 h.
- Reaccionar las muestras secas con 40 μL de una solución de 40 mg/mL de clorhidrato de metoxiamina en piridina durante 90 min a 30 °C. A continuación, añadir 80 μL de N-metil-N-(trimetilsilil)trifluoroacetamida (MSTFA) con trimetilclorosilano (TMCS) al 1% e incubar durante 60 min a 37 °C.
- Añadir 10 μL de n-hexano al vial para finalizar la reacción de derivatización.
- Análisis metabólico hepático
- Analice las muestras derivatizadas (1 μL) utilizando un sistema GC-MS. Separe los derivados utilizando una columna capilar DB-5MS (30 m × 0,25 mm × 0,25 μm).
NOTA: Las condiciones del programa de temperatura del horno se establecieron de la siguiente manera: 60 °C durante 1 min; aumentar a 325 °C a una velocidad de 10 °C/min y mantener durante 10 min. Las temperaturas del inyector, la fuente de iones y la MS se ajustaron a 250 °C, 230 °C y 150 °C, respectivamente. Se utilizó helio (99,999%) como gas portador a un caudal de 1,1 mL/min, y la relación de división se estableció en 10:1. Se utilizó una energía de haz de electrones de 70 eV y un tiempo de retardo del disolvente de 5,9 min.
- Analice las muestras derivatizadas (1 μL) utilizando un sistema GC-MS. Separe los derivados utilizando una columna capilar DB-5MS (30 m × 0,25 mm × 0,25 μm).
- Procesamiento y análisis de datos
- Adquiera y convierta datos brutos de GC-MS utilizando el software MassHunter compatible.
- Realizar análisis espectrales utilizando la herramienta del Sistema Automatizado de Deconvolución e Identificación Espectral de Masas (AMDIS)12.
- Identifique todos los metabolitos utilizando las bases de datos NIST y HMDB (consulte la tabla de materiales).
- Importe los datos a la herramienta MetaboAnalyst para el análisis discriminante de mínimos cuadrados parciales (PLS-DA), pruebas t, análisis de rutas y análisis de redes12.
5. Análisis de Western blot
- Extraer el total de proteínas del tejido hepático de ratón
- Añadir 50 mg de tejido hepático del paso 2.4 y 250 μL de lisado celular a un homogeneizador de vidrio de 1 mL y triturar en hielo durante 5 min.
- Transfiera el homogeneizado de tejido hepático del paso 5.1.1 a un tubo de microcentrífuga de 1,5 ml utilizando una pipeta y centrifugar a 18.759 x g durante 10 min a 4 °C. A continuación, transfiera el sobrenadante a un nuevo tubo de 1,5 ml con una pipeta.
- Determinación de las concentraciones de proteínas y preprocesamiento de muestras de proteínas
- Agregue 2 μL de sobrenadante del paso 5.1.2, 18 μL de PBS y 180 μL de solución de trabajo de BCA a una placa de microtitulación de 96 pocillos8.
- Oscilar la placa en un oscilador durante 30 s, dejarla durante 30 min a 37 °C y determinar la absorbancia a 562 nm utilizando un lector de microplacas.
- Separe las proteínas totales con SDS-PAGE, transfiéralas a membranas de fluoruro de polivinilideno y bloquee con leche descremada al 5%8.
- Incubar las membranas del paso 5.3 con anticuerpos primarios contra HIF-1α (1:1000), VEGFA (1:1000), GLA (1:1000), NOS3 (1:1000) y β-actina (1:5000) durante la noche a 4 °C.
- Coloque las membranas del paso 5.4 en una caja de incubación de anticuerpos, agregue 10 ml de TBST y agite horizontalmente a 111 x g a temperatura ambiente para lavar los anticuerpos primarios no unidos tres veces durante 5 minutos cada una.
- Añadir 200 μL de IgG (H + L)-HRP (1:1000) anti-conejo de cabra a cada membrana a partir del paso 5.5 e incubar durante 2 h a temperatura ambiente. A continuación, repita el paso 5.5 para eliminar el anticuerpo secundario no unido (IgG (H + L)-HRP anti-conejo de cabra).
- Agregue 200 μL de solución quimioluminiscente ECL de ultra alta sensibilidad a la superficie de cada membrana a partir del paso 5.6 y visualice inmediatamente las bandas de proteínas utilizando un sistema automático de análisis de imágenes de quimioluminiscencia.
6. Análisis estadístico
- Analice los datos utilizando software estadístico y gráfico con ANOVA de un factor seguido de la prueba de Tukey.
- Presentar los resultados como media ± desviación estándar (DE) y considerar un valor de P < 0,05 como estadísticamente significativo.
Resultados
Para confirmar el establecimiento exitoso del modelo murino de anemia y analizar el efecto de SLBXS sobre la anemia, primero se investigaron el índice hepático y los parámetros hematológicos. La Figura 1 ilustra que el grupo modelo mostró una disminución significativa (P < 0,01) en el recuento de glóbulos rojos (RBC), hemoglobina (HGB) y hematocrito (HCT) en comparación con el grupo control. Por el contrario, el índice hepático, el recuento de glóbulos blancos (WBC) y el recuento de plaquetas (PLT) en el grupo modelo fueron notablemente más altos (P < 0,05 o P < 0,01). Estos resultados confirman que el modelo de anemia fue establecido con éxito. El índice hepático, los glóbulos blancos y el PLT fueron significativamente más bajos en el grupo de SLBXS en comparación con el grupo modelo (P < 0,05 o P < 0,01), mientras que la disminución de los glóbulos rojos, el HGB y el TCH en el grupo modelo se elevó marcadamente después del tratamiento con SLBXS (P < 0,05 o P < 0,01). No hubo diferencias significativas entre los parámetros en los grupos SLBXS y Fu-Fang-E-Jiao Syrup (FFEJS). Estos resultados indican que el SLBXS puede mejorar los síntomas de la anemia.
En la Figura 2 se presentan los cromatogramas iónicos totales (TIC) típicos de las muestras de hígado de los grupos control, modelo, SLBXS y FFEJS. Son evidentes diferencias marcadas en los perfiles de metabolitos entre los grupos control, modelo, SLBXS y FFEJS.
El análisis discriminante de mínimos cuadrados parciales (PLS-DA) es un método estadístico supervisado utilizado para el análisis discriminante, que modela la relación entre la expresión de metabolitos y la clase de muestra para predecir la clase de muestra. El gráfico de puntuaciones PLS-DA (Figura 3A) muestra una clara separación entre los grupos de control, modelo, SLBXS y FFEJS. La gráfica de puntuación entre los grupos de control y modelo se muestra en la Figura 3B, donde el grupo de modelo está significativamente separado del grupo de control. Esto indica que la anemia interrumpe el metabolismo normal en ratones, lo que confirma que el modelo de anemia se desarrolló con éxito. La figura 3C muestra el gráfico de puntuación PLS-DA basado en el modelo y los grupos SLBXS. Se calculó el valor de la variable importancia en la proyección (VIP) para evaluar la intensidad del patrón de expresión de cada metabolito en la clasificación de los grupos de muestras y para ayudar a identificar los metabolitos marcadores clave. Normalmente se utiliza un valor VIP >1,0 como criterio de cribado (Figura 3D). A continuación, se empleó la validación cruzada para validar el modelo PLS-DA establecido. Como se muestra en la Figura 3E, el modelo exhibió buenos valores de R² (0,95) y Q2 (0,86), lo que indica que el modelo PLS-DA era confiable con un riesgo mínimo de sobreajuste. Los metabolitos con VIP > 1 y un P < 0,05 se clasificaron como metabolitos diferenciales. Se identificaron un total de 29 metabolitos diferenciales (ver Tabla 1). Los resultados sugieren que SLBXS podría regular al alza metabolitos como la xilosa, el tetracosano, el alfa-tocoferol y la D-glucosa, mientras que regula a la baja metabolitos como la porfina. El análisis de enriquecimiento de estas 29 vías de estos 29 metabolitos diferenciales, realizado con MetaboAnalyst, reveló que estaban relacionados con 15 vías. Entre estas, el metabolismo de la galactosa y la degradación de la lactosa (P < 0,05) se identificaron como las vías metabólicas más pertinentes involucradas en el tratamiento de la anemia con SLBXS (Figura 3F y Figura 4).
La Figura 5 demuestra que los niveles de expresión de proteínas de HIF-1α, VEGFA, GLA y NOS3 se elevaron significativamente en el grupo modelo en comparación con el grupo control (P < 0,01). SLBXS revirtió significativamente la regulación positiva de la expresión de HIF-1α, VEGFA, GLA y NOS3 observada en el grupo modelo (P < 0,01).
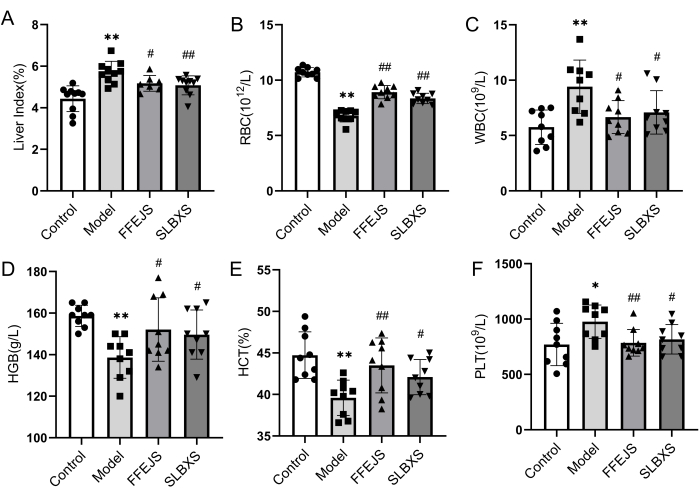
Figura 1: Efectos de SLBXS sobre el índice hepático y la rutina de sangre periférica de ratones con anemia después de 14 días de administración. (A) SLBXS disminuyó el índice hepático. (B) SLBXS aumentó los niveles de glóbulos rojos. (C) SLBXS disminuyó los niveles de leucocitos. (D) SLBXS aumentó los niveles de HGB. (E) SLBXS aumentó los niveles de HCT. (F) SLBXS disminuyó los niveles de PLT. Control vs Modelo, *P < 0.05, **P < 0.01; Modelo vs FFEJS o SLBXS, #P < 0.05, ##P < 0.01. SLBXS, jarabe Shi-Liu-Bu-Xue; RBC: glóbulos rojos; leucocitos: glóbulos blancos; HGB: hemoglobina; HCT: hematocrito; PLT: plaquetas. Haga clic aquí para ver una versión más grande de esta figura.
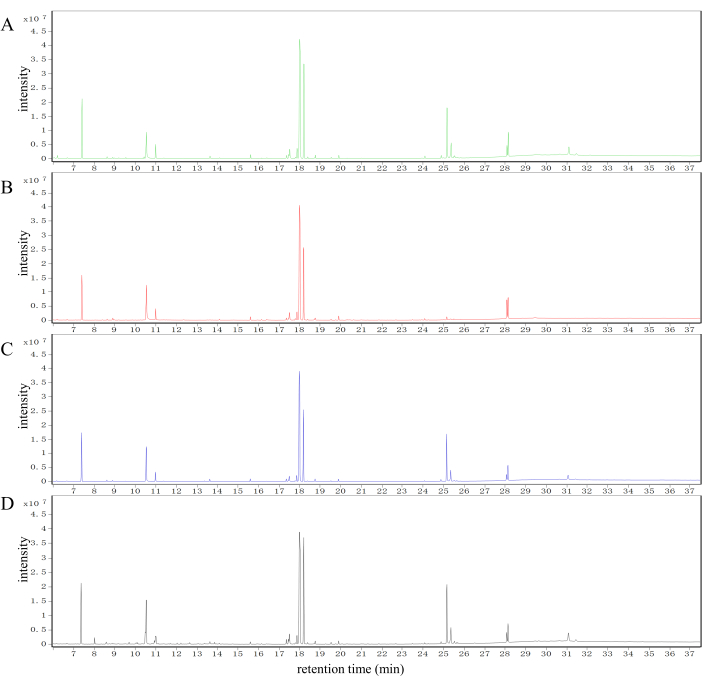
Figura 2: Análisis de las diferencias metabólicas de muestras de hígado de diferentes grupos de ratones en el sistema GC-MS. TIC de muestras hepáticas obtenidas de los grupos control (A), modelo (B), SLBXS (C) y FFEJS (D). TIC: cromatogramas iónicos totales; SLBXS, jarabe Shi-Liu-Bu-Xue; FFEJS, jarabe Fu-fang-e-Jiao. Haga clic aquí para ver una versión más grande de esta figura.
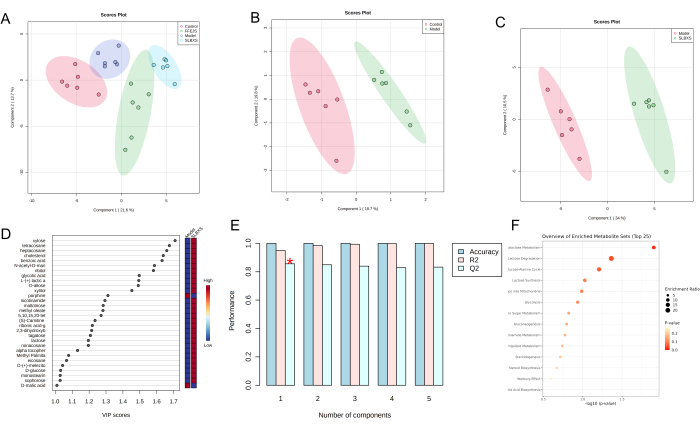
Figura 3: Análisis de datos de diferencias metabólicas en muestras de hígado de diferentes grupos de ratones. Gráficos de puntuación PLS-DA hepática de los grupos control, modelo, SLBXS y FFEJS (A); Gráficos de puntuación PLS-DA de los grupos de control y modelo (B); Gráficos de puntuación PLS-DA (C), gráficos de puntuación VIP (D) y validación cruzada (E) entre los grupos modelo y SLBXS mediante análisis metabolómico; análisis de enriquecimiento de metabolitos diferenciales (F). SLBXS, jarabe Shi-Liu-Bu-Xue; FFEJS, jarabe Fu-fang-e-Jiao. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: La red reguladora de SLBXS para el tratamiento de la anemia. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Determinación de los niveles de proteínas HIF-1α, VEGFA, GLA y NOS3 en el hígado de ratones mediante Western blot. (A) Diferentes bandas de proteínas representativas. (B) Análisis estadístico de los niveles de expresión de diferentes proteínas. Los datos se presentan como la media DE (n = 3), **P < 0,01 vs. el grupo de control; ##P < 0.01 vs. el grupo de modelos. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Resumen de los metabolitos diferenciales. Haga clic aquí para descargar esta tabla.
Discusión
La anemia es una afección común que afecta a muchas personas en todo el mundo, especialmente en los países en desarrollo1. En China, los pacientes utilizan con frecuencia la medicina tradicional china, incluida la medicina uigur, para aliviar los signos y síntomas de la anemia. SLBXS es un medicamento uigur que se ha utilizado en la práctica clínica durante muchos años; Sin embargo, su mecanismo exacto de acción contra la anemia sigue siendo poco conocido13. En este estudio, se estableció un modelo de ratón de anemia inducida por acetilfenilhidracina (APH) para dilucidar los mecanismos subyacentes de SLBXS en el tratamiento de la anemia mediante análisis metabolómicos.
La metabolómica es una herramienta valiosa para el diagnóstico de enfermedades, el descubrimiento de posibles biomarcadores y la exploración de la patogénesis de enfermedades a través del análisis cualitativo y cuantitativo de metabolitos de moléculas pequeñas en muestras biológicas. En este estudio, se utilizó acetilfenilhidracina (APH) para construir un modelo de anemia. La APH es un fuerte agente oxidante que causa un daño oxidativo lento y progresivo a los eritrocitos, particularmente al interferir con la glucosa-6-fosfato deshidrogenasa, promoviendo la desnaturalización de la hemoglobina (HGB) y la formación de cuerpos de Heinz. También destruye directamente las proteínas de la membrana y los lípidos de los eritrocitos, lo que conduce a la lisis de la membrana, ruptura y desintegración de los eritrocitos, lo que resulta en anemia hemolítica14,15. El hígado, al ser la glándula digestiva más grande del cuerpo humano, desempeña un papel crucial en el almacenamiento de energía y la regulación metabólica, manteniendo el equilibrio entre el metabolismo y el catabolismo16. En este estudio, los hígados agrandados de ratones modelo se aliviaron significativamente después de 14 días de administración de SLBXS. Se necesitan más estudios para determinar si el hígado es un órgano diana probable para el SLBXS y para dilucidar los mecanismos relacionados. En consecuencia, se utilizó cromatografía de gases-espectrometría de masas (GC-MS) para detectar metabolitos en el hígado de ratones con anemia. El análisis metabolómico identificó veintinueve biomarcadores y dos vías metabólicas clave: el metabolismo de la galactosa y la degradación de la lactosa.
Se han reportado muchos componentes activos, incluyendo taninos, flavonoides, alcaloides y ácidos orgánicos, en la granada17,18. Estos ingredientes ejercen varios efectos farmacológicos, que incluyen actividades antioxidantes, antiinflamatorias, antibacterianas y antitumorales. La evidencia sugiere que el jugo de granada es más potente que el vino tinto y el té verde en términos de actividad antioxidante debido a su mayor contenido de polifenoles19,20. Estos compuestos exhiben sus efectos antioxidantes a través de varios mecanismos, incluyendo la eliminación o neutralización de radicales libres, la quelación de metales, la afectación de las vías de señalización celular y la regulación de la expresión génica19,20. Además, el extracto de fruta de granada es rico en flavonoides, que mejoran los efectos antioxidantes al reducir los niveles de malondialdehído y peróxido de hidrógeno y aumentar las actividades de catalasa, superóxido dismutasa, glutatión peroxidasa y glutatión reductasa en el hígado21. Los conejos blancos sanos tratados con extracto de fruto de granada mostraron cambios significativos en el recuento de eritrocitos, los niveles de hemoglobina (HGB) y las concentraciones medias de HGB en los eritrocitos, así como una prolongación significativa en el tiempo de sangrado y protrombina, una marcada elevación en los niveles de proteína C (proteína anticoagulante) y compuestos de trombina-antitrombina, y una reducción dependiente de la dosis en la agregación plaquetaria y la concentración de fibrinógeno. Con base en los resultados de las pruebas hematológicas y de coagulación, se puede especular que la granada puede tener efectos antianémicos y cardioprotectores22. En la medicina tradicional de la India, los materiales vegetales como el jugo de granada se utilizan como complemento alimenticio para tratar la anemia ferropénica, posiblemente relacionada con la promoción de la absorción de hierro23.
Para dilucidar aún más el mecanismo de SLBXS en el tratamiento de la anemia, se realizó un análisis metabolómico completo. Los metabolitos implicados en la red de interacción fueron alfa-tocoferol, D-xilitol, niacinamida, D-glucosa y lactosa, mientras que las dianas fueron HIF1A, VEGFA, NOS3 y GLA. El alfa-tocoferol (vitamina E) tiene propiedades antioxidantes que inhiben la lisis prematura de los glóbulos rojos al prevenir la oxidación de los ácidos grasos poliinsaturados en la membrana de los glóbulos rojos24. Por lo tanto, puede actuar como un agente eritropoyético potencial al reducir la lisis eritrocitaria prematura y disminuir la fragilidad de los glóbulos rojos25. El xilitol, en dosis no tóxicas, puede aliviar la hemólisis inducida por APH. Su efecto antihemolítico puede atribuirse a su papel en la producción de NADPH, que protege contra el daño oxidativo debido a la ausencia de mitocondrias en los glóbulos rojos. Esto ayuda a mantener los niveles de glutatión y protege la hemoglobina, las proteínas funcionales y otros componentes estructurales del daño peroxidativo26,27. La nicotinamida es un precursor para la síntesis de coenzima I (NAD) y coenzima II (NADP) en humanos28. El NAD es un cofactor importante para muchas enzimas involucradas en el metabolismo energético29. La D-glucosa, la lactosa y el GLA son componentes clave del metabolismo de la galactosa. Como un importante factor de transcripción sensible al oxígeno, HIF-1α es crítico en la vía de adaptación a la hipoxia y se considera el principal regulador de las respuestas transcripcionales homeostáticas en células y tejidos30,31. La HIF-1α es degradada rápidamente por la prolil hidroxilasa (PHD) en condiciones normóxicas, pero en condiciones hipóxicas, la PHD se inhibe, lo que lleva a la acumulación de HIF-1α32. HIF-1α activa los genes que controlan la homeostasis del oxígeno celular, incluidos los involucrados en la producción de glóbulos rojos, el consumo de oxígeno, la vasculogénesis y el metabolismo mitocondrial33. VEGFA es una citocina que actúa principalmente sobre las células endoteliales vasculares y se expresa en muchas células especializadas durante la isquemia y la hipoxia34. NOS3 (eNOS) se encuentra principalmente en el endotelio de los vasos coronarios y en la superficie luminal del corazón, participando en el metabolismo de la arginina y la prolina y catalizando la producción de óxido nítrico (NO). El NO actúa como un potente vasodilatador mediante la activación de la guanilato ciclasa soluble en las células musculares lisas35. Además, el NO interactúa con las especies reactivas de oxígeno producidas por los eritrocitos para generar especies reactivas de óxido de nitrógeno, reduciendo así el daño oxidativo36.
Por último, los resultados de la metabolómica se validaron mediante Western blot. Los hallazgos mostraron que los niveles de HIF-1α, VEGFA, GLA y NOS3 disminuyeron después del tratamiento con SLBXS en comparación con los del grupo modelo. HIF-1α, VEGFA y NOS3 son objetivos importantes en la vía de señalización de HIF-1, mientras que GLA es un objetivo clave en el metabolismo de la galactosa. Estos resultados sugieren que SLBXS puede influir tanto en la vía de señalización de HIF-1 como en la vía del metabolismo de la galactosa, demostrando un efecto combinado en el tratamiento de la anemia. Numerosos estudios han puesto de manifiesto el importante papel de las vías del metabolismo del HIF-1 y la galactosa en el tratamiento de la anemia y enfermedades relacionadas. La anemia reduce la capacidad de transporte de oxígeno de la sangre, lo que conduce a la hipoxia tisular. El HIF-1α se acumula en las células en condiciones hipóxicas, y los altos niveles de HIF-1α mejoran la expresión de EPO y VEGF, contribuyendo a un microambiente hematopoyético estable, facilitando el transporte de nutrientes y oxígeno, y protegiendo a las células del daño hipóxico37,38. Se ha demostrado que la activación de la vía HIF-1 estimula la eritropoyesis, aumenta los niveles de hemoglobina, corrige las condiciones anémicas y mejora la homeostasis del hierro39. La mejoría de la hipoxia tras el tratamiento con SLBXS explica la reducción de la expresión proteica en la vía HIF-1 observada en el grupo SLBXS. La GLA (α-galactosidasa A) es una exo-glicosidasa que se dirige a los galactooligosacáridos como la estaquiosa, la rafinosa y la melibiosa, así como a los polisacáridos ramificados como el galactomanano y el galactoglucomanano catalizando la hidrólisis de los residuos terminales de galactosa ligados al α-1,640. La galactosa es esencial para el metabolismo celular, ya que facilita la producción y el almacenamiento de energía en varios tejidos corporales y sirve como precursor de la glicosilación41. La suplementación con galactooligosacáridos puede mejorar la absorción de hierro en el intestino de las ratas y aumentar los niveles de hemoglobina en sangre42. En este estudio, investigamos los mecanismos subyacentes de SLBXS en el tratamiento de la anemia utilizando una combinación de metabolómica y farmacología de red. Descubrimos que la vía de señalización HIF-1 y la vía del metabolismo de la galactosa son significativamente importantes en el tratamiento de la anemia con SLBXS. Este estudio proporciona nuevos conocimientos sobre los mecanismos de SLBXS en el tratamiento de la anemia. Las investigaciones futuras deberían centrarse más en la identificación y comprensión de los ingredientes activos involucrados.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo contó con el apoyo del Plan Especial de Capacitación para Talentos Minoritarios en Ciencia y Tecnología de la Fundación de Ciencias Naturales de la Región Autónoma Uigur de Xinjiang (2020D03021), los Fondos para el Programa Clave de Medicina Tradicional China de la Universidad de Medicina China de Hubei (2022ZZXZ004) y el Programa del Equipo de Innovación de Tianshan (2020D14030).
Materiales
| Name | Company | Catalog Number | Comments |
| Acetylphenylhydrazine | Shanghai Aladdin Biochemical Technology Co., Ltd. | C13979660 | |
| Automatic chemiluminescence imaging analysis system | Shanghai Tanon Life Science Co., Ltd. | Tanon-5200 | |
| Bicinchoninic acid assay kit | ThermoFisher Scientific | QPBCA-1KT | |
| Capillary column | Agilent J&W Scientific, Agilent Technologies, Inc. | DB-5MS | |
| Cell lysis buffer for Western and IP | Beyotime Biotechnology | P0013 | |
| Chlorotrimethylsilane | Shanghai Aladdin Biochemical Technology Co., Ltd. | C104814 | |
| Electronic balance | Mettler-Toledo International Inc. | ME203E | |
| Electronic scale | Mettler-Toledo International Inc. | LE104E | |
| Fu-Fang-E-Jiao Syrup | Dong E E Jiao Co., Ltd. | 214020031 | |
| Fully automatic hemocyte analyzer | Shenzhen Mindray Animal Care Technology Co., Ltd. | IDEXX ProCyte Dx | |
| GC-MS system | Agilent Technologies, Inc. | 7890B-5977B | |
| GLA primary antibody | Bioworld Technology | BS77041 | |
| Glass homogenizer | Shanghai Lei Gu Instruments Co., Ltd. | B-013001 | |
| Glass rod | Shanghai Lei Gu Instruments Co., Ltd. | B-003904 | |
| GraphPad Prism software | GraphPad, La Jolla | Version 9.0 | |
| Heparinized sample tubes | Changde BKMAM Biotechnology Co., Ltd. | B-ACT1P5 | |
| HIF-1α primary antibody | Bioworld Technology | BS3514 | |
| HMDB database | http://www.hmdb.ca/ | — | |
| Isoflurane | Hebei Jindafu Pharmaceutical Co., Ltd. | 20231202 | |
| Male C57BL/6 mice | Liaoning Changsheng Biotechnology Co., Ltd. | No. SCXK [Liao] 2015-0001 | |
| MassHunter | Agilent Technologies, Inc. | B.08.00 | |
| MetaboAnalyst 5.0 | https://www.metaboanalyst.ca/ | — | |
| Methoxyamine hydrochloride | Shanghai Aladdin Biochemical Technology Co., Ltd. | E1818113 | |
| n-hexane | Shanghai Aladdin Biochemical Technology Co., Ltd. | C14878803 | |
| NIST database | http://webbook.nist.gov/chemistry/ | — | |
| NOS3 primary antibody | Bioworld Technology | BS3625 | |
| Pyridine | Shanghai Aladdin Biochemical Technology Co., Ltd. | C13026996 | |
| Saline | BIOSHARP LIFE SCIENCES | 2308262009 | |
| Shi-Liu-Bu-Xue Syrup | Xinjiang Uygur Pharmaceutical Co., Ltd. | 211277 | |
| Surgical manipulation plate | DIXSG | ZK-JPB-A | |
| VEGFA primary antibody | Bioworld Technology | AP0742 | |
| β-actin | ABclonal (Shanghai) Trading Co., Ltd. | AC026 |
Referencias
- Munoz, M., Gomez-Ramirez, S., Bhandari, S. The safety of available treatment options for iron-deficiency anemia. Expert Opin Drug Saf. 17 (2), 149-159 (2018).
- Soliman, A. T., De Sanctis, V., Yassin, M., Wagdy, M., Soliman, N. Chronic anemia and thyroid function. Acta Biomed. 88 (1), 119-127 (2017).
- Pivina, L., Semenova, Y., Dosa, M. D., Dauletyarova, M., Bjorklund, G. Iron deficiency, cognitive functions, and neurobehavioral disorders in children. J Mol Neurosci. 68 (1), 1-10 (2019).
- Lumbiganon, P., et al. Indirect causes of severe adverse maternal outcomes: a secondary analysis of the WHO Multicountry Survey on Maternal and Newborn Health. BJOG. 121 (Suppl 1), 32-39 (2014).
- Shaddy, R. E., et al. Systematic literature review on the incidence and prevalence of heart failure in children and adolescents. Pediatr Cardiol. 39 (3), 415-436 (2018).
- China Medical Association of Minorities. . Guidelines for clinical use of minority drugs. , (2018).
- Yu, W. Q. Clinical efficiency of Pomegranate blood-enriching syrup in the treatment of iron deficiency anemia. J Med Pharm Chin Minor. 26 (11), 11-12 (2020).
- Zhang, D. N., et al. Mechanism of Shiliu Buxue Syrup for anemia using integrated metabolomics and network pharmacology. Anal Biochem. 653, 114774 (2022).
- Nielsen, J. Systems biology of metabolism. Annu Rev Biochem. 86, 245-275 (2017).
- Wang, M., et al. Metabolomics highlights pharmacological bioactivity and biochemical mechanism of traditional Chinese medicine. Chem Biol Interact. 273, 133-141 (2017).
- Ben, C. N. Establishment and experimental research of "Blood Deficiency" animal model. Lab Animal Sci. (03), 5-10 (1994).
- Cao, S., et al. Integrative transcriptomics and metabolomics analyses provide hepatotoxicity mechanisms of asarum. Exp Ther Med. 20 (2), 1359-1370 (2020).
- Yang, H. Y., Liu, M. L., Luo, P., Yao, X. S., Zhou, H. Network pharmacology and metabolomics in the study of traditional Chinese medicine for cardiovascular diseases. Phytomedicine. 104, 154268 (2022).
- Croci, S., Pedrazzi, G., Passeri, G., Piccolo, P., Ortalli, I. Acetylphenylhydrazine induced haemoglobin oxidation in erythrocytes studied by Mossbauer spectroscopy. Biochim Biophys Acta. 1568 (1), 99-104 (2001).
- Liebowitz, J., Cohen, G. Increased hydrogen peroxide levels in glucose 6-phosphate dehydrogenase deficient erythrocytes expose to acetylphenylhydrazine. Biochem Pharmacol. 17 (6), 983-988 (1968).
- Tarasenko, T. N., McGuire, P. J. The liver is a metabolic and immunologic organ: A reconsideration of metabolic decompensation due to infection in inborn errors of metabolism (IEM). Mol Genet Metab. 121 (4), 283-288 (2017).
- Topalovic, A., Knezevic, M., Gacnik, S., Mikulic-Petkovsek, M. Detailed chemical composition of juice from autochthonous pomegranate genotypes (Punica granatum L.) grown in different locations in Montenegro. Food Chem. 330, 127261 (2020).
- Legua, P., et al. Total phenols and antioxidant capacity in 10 Moroccan pomegranate varieties. J Food Sci. 77 (1), C115-C120 (2012).
- Rodrigo, R., Miranda, A., Vergara, L. Modulation of endogenous antioxidant system by wine polyphenols in human disease. Clin Chim Acta. 412 (5-6), 410-424 (2011).
- Hussain, T., et al. Oxidative stress and inflammation: What polyphenols can do for us. Oxid Med Cell Longev. 2016, 7432797 (2016).
- Sudheesh, S., Vijayalakshmi, N. R. Flavonoids from Punica granatum--potential antiperoxidative agents. Fitoterapia. 76 (2), 181-186 (2005).
- Riaz, A., Khan, R. A. Anticoagulant, antiplatelet and antianemic effects of Punica granatum (pomegranate) juice in rabbits. Blood Coagul Fibrinolysis. 27 (3), 287-293 (2016).
- Balasubramani, S. P., Varghese, R. K., Vishnuprasad, C. N., Venkatasubramanian, P. Pomegranate juice enhances iron dialysability and assimilation in in-vitro cell-free and cell-based models. Plant Foods Hum Nutr. 75 (2), 272-278 (2020).
- Jilani, T., Iqbal, M. P. Does vitamin E have a role in treatment and prevention of anemia. Pak J Pharm Sci. 24 (2), 237-242 (2011).
- Farrell, P. M., Bieri, J. G., Fratantoni, J. F., Wood, R. E., di Sant'Agnese, P. A. The occurrence and effects of human vitamin E deficiency. A study in patients with cystic fibrosis. J Clin Invest. 60 (1), 233-241 (1977).
- Ukab, W. A., Sato, J., Wang, Y. M., van Eys, J. Xylitol mediated amelioration of acetylphenylhydrazine-induced hemolysis in rabbits. Metabolism. 30 (11), 1053-1059 (1981).
- Ahuja, V., et al. Biological and pharmacological potential of xylitol: A molecular insight of unique metabolism. Foods. 9 (11), 1592 (2020).
- Nikas, I. P., Paschou, S. A., Ryu, H. S. The role of nicotinamide in cancer chemoprevention and therapy. Biomolecules. 10 (3), 477 (2020).
- Katayoshi, T., Yamaura, N., Nakajo, T., Kitajima, N., Tsuji-Naito, K. Porcine placental extract increases the cellular NAD levels in human epidermal keratinocytes. Sci Rep. 12 (1), 19040 (2022).
- Bartoszewski, R., et al. Primary endothelial cell-specific regulation of hypoxia-inducible factor (HIF)-1 and HIF-2 and their target gene expression profiles during hypoxia. Faseb J. 33 (7), 7929-7941 (2019).
- Lee, S. H., Golinska, M., Griffiths, J. R. HIF-1-independent mechanisms regulating metabolic adaptation in hypoxic cancer cells. Cells. 10 (9), 2371 (2021).
- Sato, T., Takeda, N. The roles of HIF-1α signaling in cardiovascular diseases. J Cardiol. 81 (2), 202-208 (2023).
- Ratcliffe, P. J. Oxygen sensing and hypoxia signalling pathways in animals: The implications of physiology for cancer. J Physiol. 591 (8), 2027-2042 (2013).
- Li, L. J., Huang, Q., Zhang, N., Wang, G. B., Liu, Y. H. miR-376b-5p regulates angiogenesis in cerebral ischemia. Mol Med Rep. 10 (1), 527-535 (2014).
- Tejero, J., Shiva, S., Gladwin, M. T. Sources of vascular nitric oxide and reactive oxygen species and their regulation. Physiol Rev. 99 (1), 311-379 (2019).
- Fujii, J., et al. Erythrocytes as a preferential target of oxidative stress in blood. Free Radic Res. 55 (5), 562-580 (2021).
- Huang, J. W., et al. High expression of HIF-1α alleviates benzene-induced hematopoietic toxicity and immunosuppression in mice. Environ Pollut. 311, 119928 (2022).
- Zhang, Z., Yao, L., Yang, J., Wang, Z., Du, G. PI3K/Akt and HIF-1 signaling pathway in hypoxia-ischemia (Review). Mol Med Rep. 18 (4), 3547-3554 (2018).
- Del Balzo, U., et al. Nonclinical characterization of the hypoxia-inducible factor prolyl hydroxylase inhibitor roxadustat, a novel treatment of anemia of chronic kidney disease. J Pharmacol Exp Ther. 374 (2), 342-353 (2020).
- Bhatia, S., Singh, A., Batra, N., Singh, J. Microbial production and biotechnological applications of α-galactosidase. Int J Biol Macromol. 150, 1294-1313 (2020).
- Conte, F., van Buuringen, N., Voermans, N. C., Lefeber, D. J. Galactose in human metabolism, glycosylation and congenital metabolic diseases: Time for a closer look. Biochim Biophys Acta Gen Subj. 1865 (8), 129898 (2021).
- Wang, Y. Y. . Investigate the effect of galacto-oligosaccharide supplementation on intestinal absorption of iron in rats. [Master's Thesis]. , (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados