Method Article
تقييم آلية الشراب العشبي التقليدي لعلاج فقر الدم باستخدام التمثيل الغذائي للكبد
In This Article
Summary
تقدم هذه الدراسة في المقام الأول تطبيق التمثيل الغذائي للكبد في التحقيق في فعالية شراب شي ليو بو شيويه في علاج فقر الدم.
Abstract
كدواء أويغوري معروف ، تم استخدام شراب Shi-Liu-Bu-Xue (SLBXS) على نطاق واسع لعلاج فقر الدم في الصين لأكثر من 20 عاما. ومع ذلك ، فإن الآليات الأساسية لفعاليته في علاج فقر الدم لا تزال غير واضحة. في هذه الدراسة ، تم استخدام أيضاب الكبد بشكل أساسي لتحديد الآليات التنظيمية المحتملة ل SLBXS في علاج فقر الدم. تم إجراء توصيف التمثيل الغذائي للكبد لتوصيف آلية عمل SLBXS في نموذج فأر يسببه أسيتيل فينيل هيدرازين لفقر الدم. تبين أن SLBXS يقلل من مؤشر الكبد وعدد خلايا الدم البيضاء وعدد الصفائح الدموية ، مع زيادة عدد خلايا الدم الحمراء والهيموجلوبين ومستويات الهيماتوكريت. تم اختيار الأهداف الأساسية للتحقق باستخدام البقع الغربية. أظهر SLBXS تأثيرا علاجيا كبيرا على فقر الدم بشكل أساسي عن طريق تنظيم استقلاب الجالاكتوز ومسار إشارات HIF-1 ، كما يتضح من تقليل تنظيم بروتينات HIF-1α و NOS3 و VEGFA و GLA في أنسجة الكبد للفئران المصابة بفقر الدم. توضح هذه الدراسة الآليات التنظيمية المحتملة لعملية التمثيل الغذائي الكبدي عن طريق إعطاء SLBXS في علاج فقر الدم.
Introduction
فقر الدم هو قضية صحية عالمية ملحة ومنتشرة ، وتؤثر على 25٪ من سكان العالم والناس من جميع الأعمار ، وخاصة المراهقين والنساء الحوامل1،2،3. يرتبط بزيادة خطر الولادة المبكرة ووفيات الأمهات ويمكن أن يؤدي إلى اضطرابات في النمو البدني وضعف أداء القلب والأوعيةالدموية 4. قد تؤثر هذه الحالة أيضا سلبا على الحالة الصحية للمراهقين ، مما يؤدي إلى الالتهابات وفشل القلب5. تشمل العلاجات الحالية في المقام الأول نقل الدم ومكملات الحديد والعلاج بالإريثروبويتين. ومع ذلك ، فإن هذه العلاجات لها عيوب وآثار جانبية ضارة ، مثل الحساسية المفرطة ، واضطراب الجهاز الهضمي ، والحمل الزائد للحديد ، وخلاياالنحل 1. لذلك ، فإن تحديد الأدوية الفعالة ذات الآثار الجانبية الأقل لعلاج فقر الدم أمر بالغ الأهمية.
يقدم الطب الصيني التقليدي ، بما في ذلك الطب الأويغوري ، العديد من المزايا ، مثل التركيبات متعددة المكونات ، والتأثيرات متعددة الأهداف ، والتفاعلات متعددة الروابط ، وآثار جانبية أقل في الوقاية من الأمراض متعددة العوامل وعلاجها. شراب شي ليو بو شيويه (SLBXS) هو عامل تقليدي بارز في الطب الأويغوري يستخدم في مقويات الدم وإنتاج الدم. وهو معترف به كدواء منظم للدم يمكن أن يقلل من حرارة الكبد وقد تم تضمينه في المبادئ التوجيهية للاستخدام السريري لأدوية الأقليات لعلاج فقر الدم. كما أنها مرخصة من قبل إدارة الغذاء والدواء الحكومية الصينية (Z20026094) 6،7،8. على مدى العقدين الماضيين ، تم استخدام SLBXS على نطاق واسع في الصين لعلاج الحالات المرتبطة بفقر الدم. ومع ذلك ، فإن آلياته المحتملة لعلاج فقر الدم لا تزال غير معروفة وتتطلب مزيدا من التحقيق. تستخدم الأيض ، التي تفحص الاستجابات الأيضية الديناميكية للأنظمة البيولوجية للأمراض أو التدخلات الدوائية أو الظروف البيئية9 ، بشكل متزايد لتوضيح آليات عمل الطب الصيني التقليدي من خلال تقييم التغيرات في المؤشرات الحيوية الأيضية في العينات البيولوجية بعد المحفزات الخارجية9،10.
وفقا لذلك ، تم اعتماد نهج استقلاب الكبد في هذه الدراسة لتحديد الآليات العلاجية الأساسية ل SLBXS في علاج فقر الدم. أولا ، تم إنشاء نموذج فأر ناتج عن أسيتيل فينيل هيدرازين (APH) لفقر الدم. بعد ذلك ، تم فحص المسارات الأيضية للمستقلبات الداخلية باستخدام التمثيل الغذائي للكبد مع قياس الطيف الكتلي الكروماتوغرافيا الغازية (GC-MS) وطرق البيانات متعددة المتغيرات بعد إدارة SLBXS. أخيرا ، تم تحليل الأهداف الرئيسية تجريبيا لتوضيح التأثيرات المضادة لفقر الدم والآليات الجزيئية ل SLBXS.
Protocol
تمت الموافقة على جميع الإجراءات التجريبية من قبل لجنة أخلاقيات المختبر التابعة لجامعة هوبى للطب الصيني (HBUCMS201912015). تم إيواء ذكور الفئران C57BL / 6 (الوزن 20-22 جم) في غرفة محددة خالية من مسببات الأمراض مع رطوبة نسبية تتراوح بين 50٪ -60٪ ودرجة حرارة 22 درجة مئوية ± 2 درجة مئوية ، وتعرضت لدورة ضوء 12 ساعة / 12 ساعة مظلمة ، وتم تزويدها بحرية الوصول إلى الطعام والماء. قبل بدء التجربة ، سمح لجميع الفئران لمدة أسبوع بالتأقلم مع البيئة. تم تعيين الفئران عشوائيا إلى واحدة من المجموعات الأربع التالية (ن = 12): التحكم ، النموذج ، شراب Fu-Fang-E-Jiao (FFEJS ، دواء إيجابي ، يعطى عن طريق المعدة عند 7.8 مل / كجم) ، و SLBXS (يعطى داخل المعدة عند 11.7 مل / كجم). تلقت الفئران في المجموعات الضابطة والنموذجية كميات متساوية من المحلول الملحي. أعطيت الفئران في جميع المجموعات إعطاء الأدوية المقابلة داخل المعدة مرة واحدة يوميا لمدة أسبوعين. تفاصيل الأدوية والكواشف والمعدات المستخدمة في هذه الدراسة مدرجة في جدول المواد.
1. إنشاء نموذج فقر الدم في الفئران
- قم بوزن 2 جم من أسيتيل فينيل هيدرازين (APH) باستخدام ميزان إلكتروني ونقله إلى دورق سعة 150 مل. أضف 100 مل من المحلول الملحي وحركه بقضيب زجاجي حتى يذوب APH تماما.
- إنشاء نموذج الفأر لفقر الدم عن طريق حقن تحت الجلد 2٪ APH كما تم إعداده في الخطوة 1.1 في 1شارع و4 و 7 أيام بجرعات 200 مجم / كجم و 100 مجم / كجم و 100 مجم / كجم ، على التوالي11.
ملاحظة: ابتداء من اليوم الأول ، تم إعطاء الفئران في مجموعات FFEJS (7.8 مل / كجم) و SLBXS (11.7 مل / كجم) إعطاء المعدة مرة واحدة يوميا لمدة أسبوعين. تلقت الفئران في المجموعات الضابطة والنموذجية كميات متساوية من المحلول الملحي مرة واحدة يوميا لمدة أسبوعين.
2. تحديد مؤشر الكبد
- في نهاية التجربة ، قم بوزن كل فأر باستخدام ميزان إلكتروني.
- تخدير الفئران عن طريق استنشاق 2٪ إيزوفلوران. اضغط على مقلة عين الفئران لجعلها مفرطة الدم وبارزة. قم بإزالة مقلة العين بسرعة باستخدام ملقط وجمع الدم في أنابيب عينة هيبارينية.
- قم بتأمين الفئران المخدرة من الخطوة 2.2 إلى لوحة التلاعب الجراحية.
- قم بعمل شق كامل على طول خط الوسط من البطن بمشرط. قم بتشريح وعزل أنسجة الكبد السليمةبعناية 12 ، ثم قم بقياس وزنه بميزان إلكتروني.
ملاحظة: يتم حساب مؤشر الكبد لكل فأر باستخدام الصيغة التالية: مؤشر الكبد = وزن الكبد / وزن الجسم.
3. تحليل الدم
- رج الأنبوب الذي يحتوي على عينة الدم الهبارينية برفق من الخطوة 2.2 لمنع تخثر الدم.
- ضع عينة الدم أسفل إبرة الحقن للتأكد من غمرها بالكامل في الإبرة.
- انقر فوق الزر "الكشف التلقائي" لقياس عدد خلايا الدم الحمراء (RBC) والهيماتوكريت (HCT) وعدد خلايا الدم البيضاء (WBC) ومستويات الهيموجلوبين (HGB) وعدد الصفائح الدموية (PLT) باستخدام محلل خلايا الدم الأوتوماتيكي بالكامل.
4. دراسة التمثيل الغذائي للكبد
- تحضير عينة الكبد
- تجانس عينات أنسجة الكبد (50 مجم) من الخطوة 2.4 مع 1 مل من الميثانول المبرد مسبقا. جهاز طرد مركزي عند 18,759 × جم لمدة 10 دقائق عند 4 درجات مئوية لإزالة الرواسب.
- انقل 200 ميكرولتر من المادة الطافية إلى قارورة عينة باستخدام ماصة وجففها بالفراغ في مجفف بالتجميد عند 35 درجة مئوية لمدة ساعتين.
- تفاعل العينات المجففة مع 40 ميكرولتر من محلول 40 مجم / مل من ميثوكسيأمين هيدروكلوريد في البيريدين لمدة 90 دقيقة عند 30 درجة مئوية. بعد ذلك ، أضف 80 ميكرولتر من N-Methyl-N- (trimethylsilyl) ثلاثي فلورو أسيتاميد (MSTFA) مع 1٪ Trimethylchlorosilane (TMCS) واحتضنه لمدة 60 دقيقة عند 37 درجة مئوية.
- أضف 10 ميكرولتر من n-hexane إلى القارورة لإنهاء تفاعل الاشتقاق.
- تحليل التمثيل الغذائي للكبد
- تحليل العينات المشتقة (1 ميكرولتر) باستخدام نظام GC-MS. افصل المشتقات باستخدام عمود شعري DB-5MS (30 م × 0.25 مم × 0.25 ميكرومتر).
ملاحظة: تم ضبط شروط برنامج درجة حرارة الفرن على النحو التالي: 60 درجة مئوية لمدة 1 دقيقة ؛ زيادة إلى 325 درجة مئوية بمعدل 10 درجات مئوية / دقيقة والحفاظ عليها لمدة 10 دقائق. تم ضبط درجات حرارة الحاقن ومصدر الأيونات ودرجة حرارة MS على 250 درجة مئوية و 230 درجة مئوية و 150 درجة مئوية على التوالي. تم استخدام الهيليوم (99.999٪) كغاز ناقل بمعدل تدفق 1.1 مل / دقيقة ، وتم ضبط نسبة الانقسام على 10: 1. تم استخدام طاقة شعاع إلكتروني تبلغ 70 فولت ووقت تأخير مذيب يبلغ 5.9 دقيقة.
- تحليل العينات المشتقة (1 ميكرولتر) باستخدام نظام GC-MS. افصل المشتقات باستخدام عمود شعري DB-5MS (30 م × 0.25 مم × 0.25 ميكرومتر).
- معالجة البيانات وتحليلها
- احصل على بيانات GC-MS الأولية وحولها باستخدام برنامج MassHunter المتوافق.
- إجراء تحليل طيفي باستخدام أداة نظام التفكيك وتحديد الهوية الطيفية الكتلية الآلي (AMDIS)12.
- تحديد جميع المستقلبات باستخدام قواعد بيانات NIST و HMDB (انظر جدول المواد).
- قم باستيراد البيانات إلى أداة MetaboAnalyst للتحليل الجزئي للمربعات الصغرى التمييزية (PLS-DA) ، واختبارات t ، وتحليل المسار ، وتحليل الشبكة12.
5. تحليل اللطخة الغربية
- استخراج البروتينات الكلية من أنسجة كبد الفأر
- أضف 50 مجم من أنسجة الكبد من الخطوة 2.4 و 250 ميكرولتر من محللات الخلية إلى الخالط الزجاجي سعة 1 مل وطحنها على الثلج لمدة 5 دقائق.
- انقل أنسجة الكبد المتجانسة من الخطوة 5.1.1 إلى أنبوب طرد مركزي دقيق سعة 1.5 مل باستخدام ماصة ، وجهاز طرد مركزي عند 18,759 × جم لمدة 10 دقائق عند 4 درجات مئوية. ثم انقل المادة الطافية إلى أنبوب جديد سعة 1.5 مل باستخدام ماصة.
- تحديد تركيزات البروتين وعينات البروتين قبل المعالجة
- أضف 2 ميكرولتر من المادة الطافية من الخطوة 5.1.2 ، و 18 ميكرولتر من PBS ، و 180 ميكرولتر من محلول عمل BCA إلى لوحة ميكروتيتر 96بئرا 8.
- قم بتذبذب اللوحة على مذبذب لمدة 30 ثانية ، واتركها لمدة 30 دقيقة عند 37 درجة مئوية ، وحدد الامتصاص عند 562 نانومتر باستخدام قارئ صفيحة دقيقة.
- افصل إجمالي البروتينات باستخدام SDS-PAGE ، وانقله إلى أغشية فلوريد البولي فينيلدين ، وقم بحظر 5٪ حليب خالي الدسم8.
- احتضان الأغشية من الخطوة 5.3 بالأجسام المضادة الأولية ضد HIF-1α (1: 1000) ، VEGFA (1: 1000) ، GLA (1: 1000) ، NOS3 (1: 1000) ، و β-أكتين (1: 5000) بين عشية وضحاها عند 4 درجات مئوية.
- ضع الأغشية من الخطوة 5.4 في صندوق حضانة الأجسام المضادة ، وأضف 10 مل من TBST ، ورج أفقيا عند 111 × جم في درجة حرارة الغرفة لغسل الأجسام المضادة الأولية غير المرتبطة ثلاث مرات لمدة 5 دقائق لكل منها.
- أضف 200 ميكرولتر من الماعز المضاد للأرانب IgG (H + L) -HRP (1: 1000) إلى كل غشاء من الخطوة 5.5 واحتضنه لمدة ساعتين في درجة حرارة الغرفة. بعد ذلك ، كرر الخطوة 5.5 لغسل الجسم المضاد الثانوي غير المرتبط (الماعز المضاد للأرانب IgG (H + L) -HRP).
- أضف 200 ميكرولتر من محلول التلألؤ الكيميائي ECL عالي الحساسية إلى سطح كل غشاء من الخطوة 5.6 وتصور نطاقات البروتين على الفور باستخدام نظام تحليل التصوير الكيميائي التلقائي.
6. التحليل الإحصائي
- تحليل البيانات باستخدام برنامج إحصائي ورسوم بيانية مع ANOVA أحادي الاتجاه متبوعا باختبار Tukey.
- اعرض النتائج كمتوسط ± الانحراف المعياري (SD) واعتبر قيمة P < 0.05 ذات دلالة إحصائية.
النتائج
لتأكيد التأسيس الناجح لنموذج الفأر لفقر الدم وتحليل تأثير SLBXS على فقر الدم ، تم أولا فحص مؤشر الكبد ومعايير الدم. يوضح الشكل 1 أن المجموعة النموذجية أظهرت انخفاضا كبيرا (P < 0.01) في عدد خلايا الدم الحمراء (RBC) والهيموجلوبين (HGB) والهيماتوكريت (HCT) مقارنة بالمجموعة الضابطة. على العكس من ذلك ، كان مؤشر الكبد وعدد خلايا الدم البيضاء (WBC) وعدد الصفائح الدموية (PLT) في المجموعة النموذجية أعلى بشكل ملحوظ (P < 0.05 أو P < 0.01). تؤكد هذه النتائج أن نموذج فقر الدم قد تم إنشاؤه بنجاح. كان مؤشر الكبد وكرات الدم البيضاء وPLT أقل بشكل ملحوظ في مجموعة SLBXS مقارنة بالمجموعة النموذجية (P < 0.05 أو P < 0.01) ، في حين أن انخفاض كرات الدم الحمراء و HGB و HCT في المجموعة النموذجية كان مرتفعا بشكل ملحوظ بعد المعالجة ب SLBXS (P < 0.05 أو P < 0.01). لم يكن هناك فرق كبير بين المعلمات في مجموعات SLBXS و Fu-Fang-E-Jiao Syrup (FFEJS). تشير هذه النتائج إلى أن SLBXS يمكن أن يحسن أعراض فقر الدم.
يتم عرض الكروماتوغرامات الأيونية النموذجية (TIC) لعينات الكبد من مجموعات التحكم والنموذج و SLBXS و FFEJS في الشكل 2. تظهر الاختلافات الملحوظة في ملامح المستقلب بين مجموعات التحكم والنموذج و SLBXS و FFEJS.
التحليل التمييزي للمربعات الصغرى الجزئية (PLS-DA) هو طريقة إحصائية خاضعة للإشراف تستخدم للتحليل التمييزي ، والتي تصمم العلاقة بين تعبير المستقلب وفئة العينة للتنبؤ بفئة العينة. يظهر مخطط درجات PLS-DA (الشكل 3 أ) فصلا واضحا بين مجموعات التحكم والنموذج و SLBXS و FFEJS. يظهر مخطط النتيجة بين مجموعات التحكم والنموذج في الشكل 3 ب ، حيث يتم فصل مجموعة النموذج بشكل كبير عن المجموعة الضابطة. يشير هذا إلى أن فقر الدم يعطل عملية التمثيل الغذائي الطبيعي في الفئران ، مما يؤكد أن نموذج فقر الدم قد تم تطويره بنجاح. يعرض الشكل 3C مخطط درجة PLS-DA استنادا إلى النموذج ومجموعات SLBXS. تم حساب الأهمية المتغيرة في قيمة الإسقاط (VIP) لتقييم مدى تأثير نمط تعبير كل مستقلب على تصنيف مجموعات العينات وللمساعدة في تحديد مستقلبات العلامات الرئيسية. عادة ما تستخدم قيمة VIP >1.0 كمعيار للفحص (الشكل 3D). ثم تم استخدام التحقق المتبادل للتحقق من صحة نموذج PLS-DA المعمول به. كما هو موضح في الشكل 3E ، أظهر النموذج قيم R² جيدة (0.95) و Q2 (0.86) ، مما يشير إلى أن نموذج PLS-DA كان موثوقا به مع الحد الأدنى من مخاطر الإفراط في التجهيز. تم تصنيف المستقلبات ذات > VIP 1 و P < 0.05 على أنها مستقلبات تفاضلية. تم تحديد ما مجموعه 29 مستقلبا تفاضليا (انظر الجدول 1). تشير النتائج إلى أن SLBXS يمكن أن ينظم مستقلبات مثل الزيلوز والتتراكوزان وألفا توكوفيرول و D-glucose مع تقليل تنظيم المستقلبات مثل البورفين. كشف تحليل إثراء المسار لهذه المستقلبات التفاضلية ال 29 ، التي أجريت باستخدام MetaboAnalyst ، أنها مرتبطة ب 15 مسارا. من بين هؤلاء ، تم تحديد استقلاب الجالاكتوز وتدهور اللاكتوز (P < 0.05) على أنها أكثر المسارات الأيضية صلة بمشاركة علاج SLBXS لفقر الدم (الشكل 3F والشكل 4).
يوضح الشكل 5 أن مستويات التعبير عن البروتين ل HIF-1α و VEGFA و GLA و NOS3 كانت مرتفعة بشكل ملحوظ في المجموعة النموذجية مقارنة بالمجموعة الضابطة (P < 0.01). عكس SLBXS بشكل كبير تنظيم تعبير HIF-1α و VEGFA و GLA و NOS3 الذي لوحظ في المجموعة النموذجية (P < 0.01).
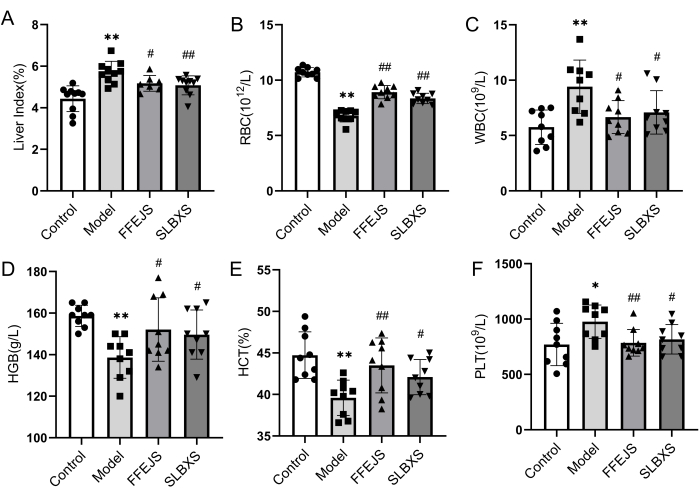
الشكل 1: تأثيرات SLBXS على مؤشر الكبد وروتين الدم المحيطي للفئران المصابة بفقر الدم بعد 14 يوما من الإعطاء. (أ) أدى SLBXS إلى انخفاض مؤشر الكبد. (ب) أدى SLBXS إلى زيادة مستويات كرات الدم الحمراء. (ج) خفضت SLBXS مستويات كرات الدم البيضاء. (د) زادت SLBXS من مستويات HGB. (ه) زادت SLBXS من مستويات كليات التقنية العليا. (و) خفضت SLBXS مستويات PLT. التحكم مقابل النموذج ، * P < 0.05 ، ** P < 0.01 ؛ النموذج مقابل FFEJS أو SLBXS ، # P < 0.05 ، # # P < 0.01. SLBXS ، شراب شي ليو بو شيو. كرات الدم الحمراء ، خلايا الدم الحمراء. WBC ، خلايا الدم البيضاء. HGB ، الهيموجلوبين. كليات التقنية العليا, الهيماتوكريت; PLT ، الصفائح الدموية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
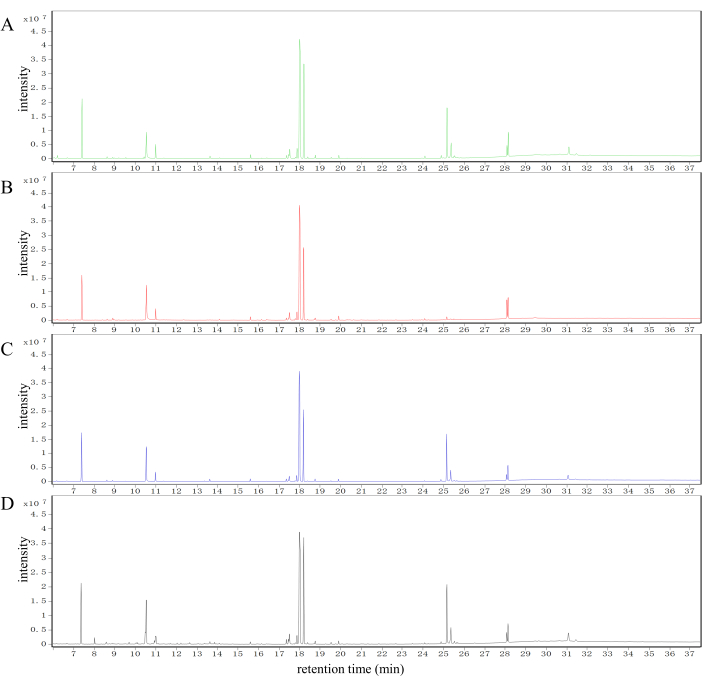
الشكل 2: تحليل الاختلافات الأيضية لعينات الكبد من مجموعات مختلفة من الفئران في نظام GC-MS. TIC لعينات الكبد التي تم الحصول عليها من مجموعات التحكم (A) والنموذج (B) و SLBXS (C) و FFEJS (D). TIC ، إجمالي الكروماتوغرامات الأيونية. SLBXS ، شراب شي ليو بو شيو. FFEJS ، شراب فو فانغ إي جياو. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
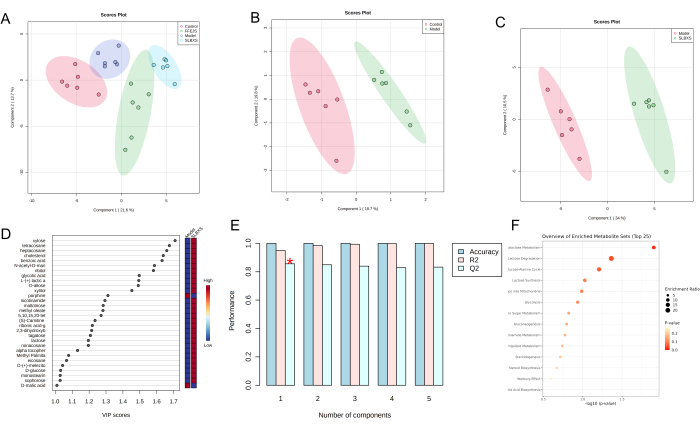
الشكل 3: تحليل بيانات الاختلافات الأيضية في عينات الكبد من مجموعات مختلفة من الفئران. مخططات درجات PLS-DA للكبد لمجموعات التحكم والنموذج و SLBXS و FFEJS (A) ؛ مخططات درجات PLS-DA لمجموعات التحكم والنموذج (B) ؛ مخططات درجات PLS-DA (C) ، ومخططات درجات VIP (D) ، والتحقق المتبادل (E) بين النموذج ومجموعات SLBXS باستخدام تحليل التمثيل الغذائي ؛ تحليل تخصيب المسار للمستقلبات التفاضلية (F). SLBXS ، شراب شي ليو بو شيو. FFEJS ، شراب فو فانغ إي جياو. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الشبكة التنظيمية ل SLBXS لعلاج فقر الدم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تحديد مستويات بروتين HIF-1α و VEGFA و GLA و NOS3 في كبد الفئران عن طريق النشاف الغربي. (أ) تمثيل نطاقات البروتين المختلفة. (ب) التحليل الإحصائي لمستويات التعبير عن البروتينات المختلفة. يتم تقديم البيانات كمتوسط SD (ن = 3) ، ** P < 0.01 مقابل المجموعة الضابطة. ##P < 0.01 مقابل المجموعة النموذجية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: ملخص المستقلبات التفاضلية. الرجاء النقر هنا لتنزيل هذا الجدول.
Discussion
فقر الدم هو حالة شائعة تصيب العديد من الأشخاص في جميع أنحاء العالم ، وخاصة في البلدانالنامية 1. في الصين ، يستخدم المرضى بشكل متكرر الطب الصيني التقليدي ، بما في ذلك طب الأويغور ، للتخفيف من علامات وأعراض فقر الدم. SLBXS هو دواء الأويغوري الذي تم استخدامه في الممارسة السريرية لسنوات عديدة. ومع ذلك ، فإن آلية عملها الدقيقة ضد فقر الدم لا تزال غير مفهومةجيدا 13. في هذه الدراسة ، تم إنشاء نموذج فأر لفقر الدم الناجم عن أسيتيل فينيل هيدرازين (APH) لتوضيح الآليات الأساسية ل SLBXS في علاج فقر الدم من خلال تحليل التمثيل الغذائي.
التمثيل الغذائي هو أداة قيمة لتشخيص الأمراض واكتشاف المؤشرات الحيوية المحتملة واستكشاف التسبب في الأمراض من خلال التحليل النوعي والكمي لمستقلبات الجزيئات الصغيرة في العينات البيولوجية. في هذه الدراسة ، تم استخدام أسيتيل فينيل هيدرازين (APH) لبناء نموذج لفقر الدم. APH هو عامل مؤكسد قوي يسبب أضرارا مؤكسدة بطيئة وتدريجية لكريات الدم الحمراء ، لا سيما عن طريق التدخل في نازعة هيدروجين الجلوكوز 6 فوسفات ، مما يعزز تمسخ الهيموجلوبين (HGB) وتكوين أجسام هاينز. كما أنه يدمر بشكل مباشر بروتينات الغشاء والدهون في كريات الدم الحمراء ، مما يؤدي إلى تحلل الغشاء وتمزق وتفكك كريات الدم الحمراء ، مما يؤدي إلى فقر الدم الانحلالي14،15. يلعب الكبد ، كونه أكبر غدة هضمية في جسم الإنسان ، دورا مهما في تخزين الطاقة وتنظيم التمثيل الغذائي ، والحفاظ على التوازن بين التمثيل الغذائي والتقويض16. في هذه الدراسة ، تم تخفيف الكبد المتضخم للفئران النموذجية بشكل كبير بعد 14 يوما من إعطاء SLBXS. هناك حاجة إلى مزيد من الدراسات لتحديد ما إذا كان الكبد هو العضو المستهدف المحتمل ل SLBXS ولتوضيح الآليات ذات الصلة. وبالتالي ، تم استخدام قياس الطيف الكتلي الكروماتوغرافيا الغازية (GC-MS) للكشف عن المستقلبات في كبد الفئران المصابة بفقر الدم. حدد تحليل الأيض تسعة وعشرين مؤشرا حيويا ومسارين رئيسيين لتمثيل الغذائي: استقلاب الجالاكتوز وتدهور اللاكتوز.
تم الإبلاغ عن العديد من المكونات النشطة ، بما في ذلك العفص والفلافونويد والقلويدات والأحماض العضوية ، في الرمان17،18. تمارس هذه المكونات تأثيرات دوائية مختلفة ، بما في ذلك مضادات الأكسدة والمضادة للالتهابات والمضادة للبكتيريا والأنشطة المضادة للأورام. تشير الدلائل إلى أن عصير الرمان أقوى من النبيذ الأحمر والشاي الأخضر من حيث النشاط المضاد للأكسدة بسبب محتواه العالي من مادة البوليفينول19،20. تظهر هذه المركبات آثارها المضادة للأكسدة من خلال عدة آليات ، بما في ذلك إزالة الجذور الحرة أو تحييدها ، واستخلاب المعادن ، والتأثير على مسارات الإشارات الخلوية ، وتنظيم التعبير الجيني19،20. بالإضافة إلى ذلك ، فإن مستخلص فاكهة الرمان غني بالفلافونويد ، مما يعزز التأثيرات المضادة للأكسدة عن طريق تقليل مستويات المالوند ديالديهايد وبيروكسيد الهيدروجين وزيادة أنشطة الكاتلاز وديسموتاز الفائق والجلوتاثيون بيروكسيداز واختزال الجلوتاثيون في الكبد21. أظهرت الأرانب البيضاء السليمة المعالجة بمستخلص فاكهة الرمان تغيرات كبيرة في عدد كريات الدم الحمراء ، ومستويات الهيموجلوبين (HGB) ، ومتوسط تركيزات كريات الدم الحمراء HGB ، بالإضافة إلى إطالة كبيرة في النزيف ووقت البروثرومبين ، وارتفاع ملحوظ في مستويات مركبات البروتين C (البروتين المضاد للتخثر) ومستويات مركب الثرومبين مضادات الثرومبين ، وانخفاض يعتمد على الجرعة في تراكم الصفائح الدموية وتركيز الفيبرينوجين. بناء على نتائج اختبارات الدم والتخثر ، يمكن التكهن بأن الرمان قد يكون له تأثيرات مضادة لفقر الدم وواقية للقلب22. في الطب التقليدي الهندي ، تستخدم المواد النباتية مثل عصير الرمان كمكمل غذائي لعلاج فقر الدم الناجم عن نقص الحديد ، وربما تكون مرتبطة بتعزيز امتصاص الحديد23.
لتوضيح آلية SLBXS في علاج فقر الدم ، تم إجراء تحليل شامل للأيض. كانت المستقلبات المشاركة في شبكة التفاعل هي ألفا توكوفيرول ، و D-xylitol ، والنياسيناميد ، و D-glucose ، واللاكتوز ، بينما كانت الأهداف هي HIF1A و VEGFA و NOS3 و GLA. يحتوي ألفا توكوفيرول (فيتامين ه) على خصائص مضادة للأكسدة تمنع تحلل خلايا الدم الحمراء المبكر عن طريق منع أكسدة الأحماض الدهنية المتعددة غير المشبعة في غشاء خلايا الدم الحمراء24. لذلك ، قد يكون بمثابة عامل محتمل للكريات الحمراء عن طريق تقليل تحلل كريات الدم الحمراء المبكر وتقليل هشاشة خلايا الدم الحمراء25. يمكن أن يخفف إكسيليتول ، بجرعات غير سامة ، من انحلال الدم الناجم عن APH. يمكن أن يعزى تأثيره المضاد لتحلل الدم إلى دوره في إنتاج NADPH ، الذي يحمي من التلف التأكسدي بسبب عدم وجود الميتوكوندريا في خلايا الدم الحمراء. هذا يساعد في الحفاظ على مستويات الجلوتاثيون ويحمي الهيموجلوبين والبروتينات الوظيفية والمكونات الهيكلية الأخرى من تلف المؤكسد26،27. النيكوتيناميد هو مقدمة لتخليق الإنزيم المساعد الأول (NAD) والإنزيم الثاني (NADP) في البشر28. NAD هو عامل مساعد مهم للعديد من الإنزيمات المشاركة في استقلاب الطاقة29. يعد D-glucose واللاكتوز و GLA من المكونات الرئيسية لعملية التمثيل الغذائي للجالاكتوز. كعامل نسخ مهم حساس للأكسجين ، يعد HIF-1α أمرا بالغ الأهمية في مسار التكيف مع نقص الأكسجة ويعتبر المنظم الأساسي لاستجابات النسخ الاستتبابية في الخلايا والأنسجة30،31. يتحلل HIF-1α بسرعة بواسطة بروليل هيدروكسيلاز (PHD) في ظل الظروف الطبيعية ، ولكن في ظل ظروف نقص الأكسجين ، يتم تثبيط PHD ، مما يؤدي إلى تراكم HIF-1α32. ينشط HIF-1α الجينات التي تتحكم في توازن الأكسجين الخلوي ، بما في ذلك تلك المشاركة في إنتاج خلايا الدم الحمراء ، واستهلاك الأكسجين ، وتكوين الأوعية الدموية ، واستقلاب الميتوكوندريا33. VEGFA هو سيتوكين يعمل بشكل أساسي على الخلايا البطانية الوعائية ويتم التعبير عنه في العديد من الخلايا المتخصصة أثناء نقص التروية ونقص الأكسجة34. يوجد NOS3 (eNOS) بشكل أساسي في بطانة الأوعية التاجية والسطح اللمعي للقلب ، ويشارك في استقلاب الأرجينين والبرولين ويحفز إنتاج أكسيد النيتريك (NO). يعمل NO كموسع قوي للأوعية الدموية عن طريق تنشيط سيكلاز غوانيلات القابل للذوبان في خلايا العضلات الملساء35. بالإضافة إلى ذلك ، يتفاعل NO مع أنواع الأكسجين التفاعلية التي تنتجها كريات الدم الحمراء لتوليد أنواع أكسيد النيتروجين التفاعلية ، وبالتالي تقليل الضرر التأكسدي36.
أخيرا ، تم التحقق من صحة نتائج التمثيل الغذائي باستخدام النشاف الغربي. أظهرت النتائج أن مستويات HIF-1α و VEGFA و GLA و NOS3 انخفضت بعد علاج SLBXS مقارنة بتلك الموجودة في المجموعة النموذجية. تعد HIF-1α و VEGFA و NOS3 أهدافا مهمة في مسار إشارات HIF-1 ، في حين أن GLA هو هدف رئيسي في استقلاب الجالاكتوز. تشير هذه النتائج إلى أن SLBXS قد يؤثر على كل من مسار إشارات HIF-1 ومسار استقلاب الجالاكتوز ، مما يدل على تأثير مشترك في علاج فقر الدم. سلطت العديد من الدراسات الضوء على الأدوار المهمة لمسارات التمثيل الغذائي HIF-1 والجالاكتوز في علاج فقر الدم والأمراض ذات الصلة. يقلل فقر الدم من قدرة الدم على حمل الأكسجين ، مما يؤدي إلى نقص الأكسجة في الأنسجة. يتراكم HIF-1α في الخلايا في ظل ظروف نقص الأكسجين ، وتعزز المستويات العالية من HIF-1α التعبير عن EPO و VEGF ، مما يساهم في بيئة مكروية مستقرة مكونة للدم ، ويسهل نقل المغذيات والأكسجين ، ويحمي الخلايا من تلف نقص التأكسج37،38. ثبت أن تنشيط مسار HIF-1 يحفز تكون الكريات الحمراء ، ويزيد من مستويات الهيموجلوبين ، ويصحح حالات فقر الدم ، ويحسن توازن الحديد39. يفسر التحسن في نقص الأكسجة بعد علاج SLBXS انخفاض تعبير البروتين في مسار HIF-1 الذي لوحظ في مجموعة SLBXS. GLA (α-galactosidase A) هو جليكوزيداز خارجي يستهدف السكريات الجالاكتو قليلة السكاريد مثل ستاكيوز ، رافينوز ، وميليبوز ، بالإضافة إلى السكريات المتفرعة مثل الجالاكتومانان والجالاكتوجلوكومانان عن طريق تحفيز التحلل المائي لبقايا الجالاكتوز الطرفية المرتبطة α-1،640. الجالاكتوز ضروري لعملية التمثيل الغذائي للخلايا لأنه يسهل إنتاج الطاقة وتخزينها في أنسجة الجسم المختلفة ويعمل كمقدمة للارتباط بالجليكوزيل41. يمكن أن تعزز مكملات السكاريد الجالاكتو قليلة السكاريد امتصاص الحديد في أمعاء الفئران وتزيد من مستويات الهيموجلوبين في الدم42. في هذه الدراسة ، قمنا بالتحقيق في الآليات الأساسية ل SLBXS في علاج فقر الدم باستخدام مزيج من التمثيل الغذائي وعلم الأدوية الشبكي. وجدنا أن مسار إشارات HIF-1 ومسار استقلاب الجالاكتوز مهمان بشكل كبير في علاج فقر الدم باستخدام SLBXS. تقدم هذه الدراسة رؤى جديدة حول آليات SLBXS في علاج فقر الدم. يجب أن تركز الأبحاث المستقبلية بشكل أكبر على تحديد وفهم المكونات النشطة المعنية.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل خطة التدريب الخاصة لمواهب الأقليات في العلوم والتكنولوجيا ، ومؤسسة العلوم الطبيعية لمنطقة شينجيانغ الويغورية ذاتية الحكم (2020D03021) ، وصناديق البرنامج الرئيسي للطب الصيني التقليدي بجامعة هوبى للطب الصيني (2022ZZXZ004) ، وبرنامج فريق الابتكار في تيانشان (2020D14030).
Materials
| Name | Company | Catalog Number | Comments |
| Acetylphenylhydrazine | Shanghai Aladdin Biochemical Technology Co., Ltd. | C13979660 | |
| Automatic chemiluminescence imaging analysis system | Shanghai Tanon Life Science Co., Ltd. | Tanon-5200 | |
| Bicinchoninic acid assay kit | ThermoFisher Scientific | QPBCA-1KT | |
| Capillary column | Agilent J&W Scientific, Agilent Technologies, Inc. | DB-5MS | |
| Cell lysis buffer for Western and IP | Beyotime Biotechnology | P0013 | |
| Chlorotrimethylsilane | Shanghai Aladdin Biochemical Technology Co., Ltd. | C104814 | |
| Electronic balance | Mettler-Toledo International Inc. | ME203E | |
| Electronic scale | Mettler-Toledo International Inc. | LE104E | |
| Fu-Fang-E-Jiao Syrup | Dong E E Jiao Co., Ltd. | 214020031 | |
| Fully automatic hemocyte analyzer | Shenzhen Mindray Animal Care Technology Co., Ltd. | IDEXX ProCyte Dx | |
| GC-MS system | Agilent Technologies, Inc. | 7890B-5977B | |
| GLA primary antibody | Bioworld Technology | BS77041 | |
| Glass homogenizer | Shanghai Lei Gu Instruments Co., Ltd. | B-013001 | |
| Glass rod | Shanghai Lei Gu Instruments Co., Ltd. | B-003904 | |
| GraphPad Prism software | GraphPad, La Jolla | Version 9.0 | |
| Heparinized sample tubes | Changde BKMAM Biotechnology Co., Ltd. | B-ACT1P5 | |
| HIF-1α primary antibody | Bioworld Technology | BS3514 | |
| HMDB database | http://www.hmdb.ca/ | — | |
| Isoflurane | Hebei Jindafu Pharmaceutical Co., Ltd. | 20231202 | |
| Male C57BL/6 mice | Liaoning Changsheng Biotechnology Co., Ltd. | No. SCXK [Liao] 2015-0001 | |
| MassHunter | Agilent Technologies, Inc. | B.08.00 | |
| MetaboAnalyst 5.0 | https://www.metaboanalyst.ca/ | — | |
| Methoxyamine hydrochloride | Shanghai Aladdin Biochemical Technology Co., Ltd. | E1818113 | |
| n-hexane | Shanghai Aladdin Biochemical Technology Co., Ltd. | C14878803 | |
| NIST database | http://webbook.nist.gov/chemistry/ | — | |
| NOS3 primary antibody | Bioworld Technology | BS3625 | |
| Pyridine | Shanghai Aladdin Biochemical Technology Co., Ltd. | C13026996 | |
| Saline | BIOSHARP LIFE SCIENCES | 2308262009 | |
| Shi-Liu-Bu-Xue Syrup | Xinjiang Uygur Pharmaceutical Co., Ltd. | 211277 | |
| Surgical manipulation plate | DIXSG | ZK-JPB-A | |
| VEGFA primary antibody | Bioworld Technology | AP0742 | |
| β-actin | ABclonal (Shanghai) Trading Co., Ltd. | AC026 |
References
- Munoz, M., Gomez-Ramirez, S., Bhandari, S. The safety of available treatment options for iron-deficiency anemia. Expert Opin Drug Saf. 17 (2), 149-159 (2018).
- Soliman, A. T., De Sanctis, V., Yassin, M., Wagdy, M., Soliman, N. Chronic anemia and thyroid function. Acta Biomed. 88 (1), 119-127 (2017).
- Pivina, L., Semenova, Y., Dosa, M. D., Dauletyarova, M., Bjorklund, G. Iron deficiency, cognitive functions, and neurobehavioral disorders in children. J Mol Neurosci. 68 (1), 1-10 (2019).
- Lumbiganon, P., et al. Indirect causes of severe adverse maternal outcomes: a secondary analysis of the WHO Multicountry Survey on Maternal and Newborn Health. BJOG. 121 (Suppl 1), 32-39 (2014).
- Shaddy, R. E., et al. Systematic literature review on the incidence and prevalence of heart failure in children and adolescents. Pediatr Cardiol. 39 (3), 415-436 (2018).
- China Medical Association of Minorities. Guidelines for clinical use of minority drugs. , Chinese Press of Traditional Chinese Medicine. Beijing. (2018).
- Yu, W. Q. Clinical efficiency of Pomegranate blood-enriching syrup in the treatment of iron deficiency anemia. J Med Pharm Chin Minor. 26 (11), 11-12 (2020).
- Zhang, D. N., et al. Mechanism of Shiliu Buxue Syrup for anemia using integrated metabolomics and network pharmacology. Anal Biochem. 653, 114774(2022).
- Nielsen, J. Systems biology of metabolism. Annu Rev Biochem. 86, 245-275 (2017).
- Wang, M., et al. Metabolomics highlights pharmacological bioactivity and biochemical mechanism of traditional Chinese medicine. Chem Biol Interact. 273, 133-141 (2017).
- Ben, C. N. Establishment and experimental research of "Blood Deficiency" animal model. Lab Animal Sci. (03), 5-10 (1994).
- Cao, S., et al. Integrative transcriptomics and metabolomics analyses provide hepatotoxicity mechanisms of asarum. Exp Ther Med. 20 (2), 1359-1370 (2020).
- Yang, H. Y., Liu, M. L., Luo, P., Yao, X. S., Zhou, H. Network pharmacology and metabolomics in the study of traditional Chinese medicine for cardiovascular diseases. Phytomedicine. 104, 154268(2022).
- Croci, S., Pedrazzi, G., Passeri, G., Piccolo, P., Ortalli, I. Acetylphenylhydrazine induced haemoglobin oxidation in erythrocytes studied by Mossbauer spectroscopy. Biochim Biophys Acta. 1568 (1), 99-104 (2001).
- Liebowitz, J., Cohen, G. Increased hydrogen peroxide levels in glucose 6-phosphate dehydrogenase deficient erythrocytes expose to acetylphenylhydrazine. Biochem Pharmacol. 17 (6), 983-988 (1968).
- Tarasenko, T. N., McGuire, P. J. The liver is a metabolic and immunologic organ: A reconsideration of metabolic decompensation due to infection in inborn errors of metabolism (IEM). Mol Genet Metab. 121 (4), 283-288 (2017).
- Topalovic, A., Knezevic, M., Gacnik, S., Mikulic-Petkovsek, M. Detailed chemical composition of juice from autochthonous pomegranate genotypes (Punica granatum L.) grown in different locations in Montenegro. Food Chem. 330, 127261(2020).
- Legua, P., et al. Total phenols and antioxidant capacity in 10 Moroccan pomegranate varieties. J Food Sci. 77 (1), C115-C120 (2012).
- Rodrigo, R., Miranda, A., Vergara, L. Modulation of endogenous antioxidant system by wine polyphenols in human disease. Clin Chim Acta. 412 (5-6), 410-424 (2011).
- Hussain, T., et al. Oxidative stress and inflammation: What polyphenols can do for us. Oxid Med Cell Longev. 2016, 7432797(2016).
- Sudheesh, S., Vijayalakshmi, N. R. Flavonoids from Punica granatum--potential antiperoxidative agents. Fitoterapia. 76 (2), 181-186 (2005).
- Riaz, A., Khan, R. A. Anticoagulant, antiplatelet and antianemic effects of Punica granatum (pomegranate) juice in rabbits. Blood Coagul Fibrinolysis. 27 (3), 287-293 (2016).
- Balasubramani, S. P., Varghese, R. K., Vishnuprasad, C. N., Venkatasubramanian, P. Pomegranate juice enhances iron dialysability and assimilation in in-vitro cell-free and cell-based models. Plant Foods Hum Nutr. 75 (2), 272-278 (2020).
- Jilani, T., Iqbal, M. P. Does vitamin E have a role in treatment and prevention of anemia. Pak J Pharm Sci. 24 (2), 237-242 (2011).
- Farrell, P. M., Bieri, J. G., Fratantoni, J. F., Wood, R. E., di Sant'Agnese, P. A. The occurrence and effects of human vitamin E deficiency. A study in patients with cystic fibrosis. J Clin Invest. 60 (1), 233-241 (1977).
- Ukab, W. A., Sato, J., Wang, Y. M., van Eys, J. Xylitol mediated amelioration of acetylphenylhydrazine-induced hemolysis in rabbits. Metabolism. 30 (11), 1053-1059 (1981).
- Ahuja, V., et al. Biological and pharmacological potential of xylitol: A molecular insight of unique metabolism. Foods. 9 (11), 1592(2020).
- Nikas, I. P., Paschou, S. A., Ryu, H. S. The role of nicotinamide in cancer chemoprevention and therapy. Biomolecules. 10 (3), 477(2020).
- Katayoshi, T., Yamaura, N., Nakajo, T., Kitajima, N., Tsuji-Naito, K. Porcine placental extract increases the cellular NAD levels in human epidermal keratinocytes. Sci Rep. 12 (1), 19040(2022).
- Bartoszewski, R., et al. Primary endothelial cell-specific regulation of hypoxia-inducible factor (HIF)-1 and HIF-2 and their target gene expression profiles during hypoxia. Faseb J. 33 (7), 7929-7941 (2019).
- Lee, S. H., Golinska, M., Griffiths, J. R. HIF-1-independent mechanisms regulating metabolic adaptation in hypoxic cancer cells. Cells. 10 (9), 2371(2021).
- Sato, T., Takeda, N. The roles of HIF-1α signaling in cardiovascular diseases. J Cardiol. 81 (2), 202-208 (2023).
- Ratcliffe, P. J. Oxygen sensing and hypoxia signalling pathways in animals: The implications of physiology for cancer. J Physiol. 591 (8), 2027-2042 (2013).
- Li, L. J., Huang, Q., Zhang, N., Wang, G. B., Liu, Y. H. miR-376b-5p regulates angiogenesis in cerebral ischemia. Mol Med Rep. 10 (1), 527-535 (2014).
- Tejero, J., Shiva, S., Gladwin, M. T. Sources of vascular nitric oxide and reactive oxygen species and their regulation. Physiol Rev. 99 (1), 311-379 (2019).
- Fujii, J., et al. Erythrocytes as a preferential target of oxidative stress in blood. Free Radic Res. 55 (5), 562-580 (2021).
- Huang, J. W., et al. High expression of HIF-1α alleviates benzene-induced hematopoietic toxicity and immunosuppression in mice. Environ Pollut. 311, 119928(2022).
- Zhang, Z., Yao, L., Yang, J., Wang, Z., Du, G. PI3K/Akt and HIF-1 signaling pathway in hypoxia-ischemia (Review). Mol Med Rep. 18 (4), 3547-3554 (2018).
- Del Balzo, U., et al. Nonclinical characterization of the hypoxia-inducible factor prolyl hydroxylase inhibitor roxadustat, a novel treatment of anemia of chronic kidney disease. J Pharmacol Exp Ther. 374 (2), 342-353 (2020).
- Bhatia, S., Singh, A., Batra, N., Singh, J. Microbial production and biotechnological applications of α-galactosidase. Int J Biol Macromol. 150, 1294-1313 (2020).
- Conte, F., van Buuringen, N., Voermans, N. C., Lefeber, D. J. Galactose in human metabolism, glycosylation and congenital metabolic diseases: Time for a closer look. Biochim Biophys Acta Gen Subj. 1865 (8), 129898(2021).
- Wang, Y. Y. Investigate the effect of galacto-oligosaccharide supplementation on intestinal absorption of iron in rats. [Master's Thesis]. , Southern Medical University. (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved