Method Article
יצירת תרביות ראשוניות להדמיית תאים חיים של קרטינוציטים
In This Article
Summary
פרוטוקול זה מתאר את התרבית של קרטינוציטים טריים שהושגו (מעבר 0) לשימוש בהדמיית תאים חיים.
Abstract
מעקב אחר תאי גזע והתנהגות אב מחויבת ברמת התא הבודד בעור האנושי היה מאתגר הן in vivo והן in vitro. הדמיית תאים חיים אפשרה התקדמות משמעותית ביכולת לזהות הבדלים בין תאי גזע של קרטינוציטים והתנהגות אב מחויבת. הדמיית תאים חיים היא שיטה מתפתחת ומאתגרת במקצת לחקר התנהגות קרטינוציטים במבחנה. פרוטוקול זה פותח לתרבית קרטינוציטים בצפיפות זריעה נמוכה, מה שמאפשר צילום ארוך טווח יחסית וניטור של התנהגות תאים בודדים. קרטינוציטים במעבר 0 גדלים בצפיפות משובטת, וצילום דולג זמן מאפשר תיעוד של חלוקות תאים בודדות וזמן התרחשותן. לקבלת רלוונטיות ביולוגית מקסימלית, קרטינוציטים אנושיים מבודדים טריים ממוקמים במבחנה. גישה זו מתמקדת בהפצה. עם זאת, ניתן להתאים פרוטוקול זה לשימוש ביישומי הדמיית תאים חיים אחרים המודדים התנהגות תאים בודדים, כגון מדידת נדידת תאים, ריפוי פצעים ותנועתיות.
Introduction
מטרת פרוטוקול זה היא לספק את היכולת לעקוב אחר קרטינוציטים בודדים בתרבית לאורך תקופה ארוכה יחסית (מספר שבועות) המתאפשרת על ידי צפיפות זריעה נמוכה וצילום דולג זמן. הדמיית תאים חיים בצפיפות נמוכה מעניקה לחוקרים את ההזדמנות לדמיין את התנהגות התא במבחנה ברמת תא בודד. אמנם לא אפשרי בתרבית תאים קונבנציונלית, אך הדמיית תאים חיים מאפשרת לפתח עצי שושלת בזמן אמת, ללא שימוש בתיוג, שממנו ניתן לברר מידע לגבי קינטיקה של חלוקה, כגון משך מחזור התא ושיעור חלוקות השגשוג וההתמיינות במושבה. זה גם מאפשר לחקור את נדידת התאים והתנועתיות. זה יכול להיות מאתגר מבחינה טכנית, עם היבטים הזקוקים לאופטימיזציה, בהתאם לסוג התא ולנתונים שיש ללכוד. מעבדות אחרות השתמשו בקרטינוציטים יילודים ו/או קרטינוציטים שקל יותר לגדל1.
עם זאת, קווי תאים שעוברים מעבר חוזר שונים באופן משמעותי בהתנהגות ובמורפולוגיה ממצבם in vivo 2. לקבלת הרלוונטיות הביולוגית הגדולה ביותר על מנת להשיג את ההתנהגות הקרובה ביותר ל-in vivo , נעשה שימוש בתאי מעבר 0. באוכלוסיות קרטינוציטים, ניתן להבחין בין תא הגזע לאב הקדמון המחויב ללא מיון או תוויות מכיוון שישנם הבדלים ברורים בהתנהגות החלוקה שניתן לראות באמצעות הדמיית תאים חיים3.
אנו משתמשים בהדמיית תאים חיים כדי לחקור קינטיקה של התפשטות קרטינוציטים. גישה דומה שימשה לחקר התנועתיות של תאי מלנומה עורית בתרבית משותפת עם קרטינוציטים4, נדידת תאים דבקים של מבחני שריטות5, וכיצד מעכבי ROCK משפיעים על התפשטות קרטינוציטים6. פרוטוקול זה תוכנן במיוחד לתרבית תאים כדי להקל על מעקב אחר שושלת על ידי הדמיית תאים חיים, אם כי הוא עשוי להיות מותאם למטרות אחרות.
פרוטוקול זה מתאר את הבידוד של קרטינוציטים ממעבר 0 למטרת הדמיית תאים חיים, דן בסיבוכים שעלולים להתעורר ומספק שיקולים שעשויים לדרוש שינויים בפרוטוקול (איור 1).
Protocol
נדרש אישור מהוועדה למחקר בבני אדם של המוסד לשימוש ברקמות אנושיות. דגימות אנושיות למחקר מתקבלות לרוב ממקורות מסחריים (לדוגמה, ATCC, טכנולוגיית תאי Lifeline ו-Zen-Bio). המחקרים שלנו משתמשים ברקמות שהושלכו בזמן ניתוחים או בדגימות ביופסיה של העור שנלקחו במיוחד למטרות המחקר. מצבים אלה דורשים אישורים שונים ונהלי הסכמה. כל הרקמות מתקבלות לאחר אישור הוועדה למחקר בבני אדם של UCSF, תוך שימוש בהסכמה מדעת בכתב ובהתאם לעקרונות הצהרת הלסינקי.
1. הפרדת האפידרמיס מהדרמיס
- ודא שהתקבלו אישורים מתאימים לשימוש ברקמה אנושית למחקר.
- השג דגימת עור והובל אותה במיכל מבודד עם שקית קרח. הנח את הדגימה באמצעי איסוף המכיל ריכוז פי 5 של פניצילין, סטרפטומיצין ואמפוטריצין.
הערה: הכמות הנדרשת תהיה תלויה ביישום. מניסיוננו, כ-1,000,000 קרטינוציטיםלסמ" ר מתקבלים מעור בוגר ומבוגר. עם זאת, זה יכול להשתנות באופן משמעותי עבור כל מדגם.- הנח עורלות יילודים במצע תרבית תאים והתחל בהליך בידוד הקרטינוציטים לא יותר מ-48 שעות לאחר ברית המילה כדי למזער את מוות התאים. אחסן את הרקמה בטמפרטורה של 4 מעלות צלזיוס עד לעיבוד. עיבוד דגימות בוגרות ומיושנות מתחיל בדרך כלל תוך מספר שעות מרגע האיסוף.
- קבל גישה לארון בטיחות ביולוגית עם ציוד ברמת BS2 המיועד לעבודה עם חומרים הגורמים למחלות על ידי בליעה, קרום רירי או חשיפה מלעורית7. ודא כי ארון הבטיחות הביולוגית מעוקר UV למשך 15 דקות לפחות וכי כל המשטחים מרוססים ב-70% אלכוהול לפני השימוש.
- לבש כפפות, רסס את מיכל האיסוף ב-70% אלכוהול והניח את המיכל במכסה האדים. הניחו כרית קירור מתחת לרקמה כדי למנוע ממנה להתחמם לטמפרטורת החדר וכדי לשמור על שלמותה. אם הרקמה גדולה במיוחד, חתכו חלק לעיבוד ושמרו את השאר לחים במיכל האיסוף.
הערה: מכיוון שרבות מהדגימות המבוגרות הן עור בטן או שד גדול מניתוחים, לוקח זמן לחתוך ולעבד את הרקמה. לעולם אין להניח רקמה ישירות על הכרית, מכיוון שהקור הקיצוני עלול לגרום לה להקפיא. במקום זאת, יש להניח אותו על משטח ביניים, כגון לוח שיש. - הניחו שתי צלחות פטרי בגודל 100 מ"מ על 15 מ"מ ואזמל כירורגי סטרילי #23 במכסה המנוע.
- פתחו את צלחות הפטרי והניחו אותן על פני הארון כך שהמשטחים הפנימיים של כל מנה פונים כלפי מעלה. הוסף 10 מ"ל של 10% כלורהקסידין גלוקונאט לאחת ממנות הפטרי. הוסף 10 מ"ל של 5x פניצילין/סטרפטומיצין/אמפוטריצין/גנטמיצין בתמיסת המלח המאוזנת של האנק (HBSS; 5x) ל-2 חצאי צלחת פטרי אחרים (ראה טבלת חומרים).
- הכן צלחת 6 בארות לשלב Dispase. עבור רקמות יילודים, השתמש ב-3 מ"ל של Dispase לכל באר. לדגימות רקמות מיושנות, השתמש ב-4 מ"ל. שימוש בכמויות לא מספקות של Dispase לנפח הרקמה עלול לגרום לקושי בהפרדת האפידרמיס מהדרמיס.
- השתמש באזמל כדי לחתוך את הרקמה לחתיכות קטנות יותר כך שהיא תחדור טוב יותר על ידי Dispase. Dispase חודר רק עד 5 מ"מ מקצוות הרקמה, לכן חותכים רצועות רקמה ארוכות ברוחב 0.5-1 ס"מ. אם לא נחתך מספיק קטן, לא תתרחש הפרדה של האפידרמיס מהדרמיס.
- חותכים רקמה עבה יותר לחתיכות קטנות יותר. חותכים עורלות יילודים ל -3 או 4 חלקים (~ 5 מ"מ x 7 מ"מ). יש להשתמש בשתי עורלות שלמות לכל היותר לכל באר של Dispase. דשי בטן שטחיים נוטים להיות דקים בהרבה, עם רקמה תת עורית מינימלית או ללא רקמה תת עורית, חותכים אותם לרצועות ארוכות יותר (~5 מ"מ על 15 מ"מ).
- יש להניח מקסימום ארבע רצועות לכל באר של Dispase. אם ברקמה המתקבלת מחובר הרבה שומן תת עורי, חתוך את הרקמה התת עורית כדי לעזור ל-Dispase לחדור באופן מלא לרקמה. אם הרקמה נחתכת קטנה מדי, ייתכן שיהיה צורך במיקרוסקופ מנתח כדי לקבוע איזה צד הוא אפידרמיס ואיזה צד הוא עורי תוך קילוף האפידרמיס. משיכת הצד הלא נכון של העור עלולה לגרום לטראומה נוספת לרקמות.
- מניחים את צד האפידרמיס של הרקמה כלפי מטה בצלחת הפטרי הראשונה שהוכנה בשלב 1.6, המכילה 10% כלורהקסידין גלוקונאט, למשך 10-20 שניות ואז מעבירים את צד האפידרמיס של הרקמה כלפי מטה לצלחת הפטרי השנייה, המכילה פי 5 פניצילין/סטרפטומיצין/אמפוטריצין (PSA) עם HBSS, ומערבבים במשך 10-20 שניות. העבירו את צד האפידרמיס של הרקמה כלפי מטה אל צלחת הפטרי השלישית, המכילה שוב 5x PSA עם HBSS, וערבבו עוד 10 שניות. עיבוד מספר דגימות עם אותו פתרון מקובל.
- העבירו את צד האפידרמיס של הרקמה כלפי מטה אל צלחת ה-Dispase בעלת 6 הבארות שהוכנה בשלב 1.7.
הערה: אנו ממליצים על צד האפידרמיס כלפי מטה על פי הכנס שלנו. פרוטוקולים אחרים ממליצים על דרמיס8. All Dispase אינו יעיל באותה מידה. קילוף האפידרמיס מעור מבוגר התגלה כמאתגר עם מוצרים מסוימים, אפילו בריכוזים של עד פי 4 מהרמה המומלצת על ידי היצרן. זה הביא לאובדן זמן ודגימות. חברות משתמשות ביחידות לא סטנדרטיות עבור Dispase, מה שמקשה על זיהוי ההבדלים בין ריכוזים בין מותגים. בשל אתגרים אלה, מומלץ מאוד להשתמש באחד ממותגי Dispase המפורטים בטבלת החומרים . - סמן את צלחת 6 הבארות המכילה את ה-Dispase והדגימות, והעביר ל-4 מעלות צלזיוס. דגירה של דגימות יילודים למשך 16-18 שעות בדגימות Dispase ודגימות בוגרים/מבוגרים למשך 24 שעות.
הערה: קיים פרוטוקול חלופי של שעתיים שניתן להשתמש בו עבור דגימות, כאשר הדגימה מונחת ב-Dispase ב-37 מעלות צלזיוס למשך שעתיים, ולאחר מכן מקלפים את האפידרמיס. למרבה הצער, זה לא תמיד עובד, ושלמות הרקמה עלולה להיפגע לאחר הדגירה, וכתוצאה מכך דגימה אבודה. דגירה של לילה עדיפה במידת האפשר.
2. בידוד של קרטינוציטים
- יש להניח 0.05% טריפסין-EDTA (או TrypLE), תמיסת נטרול טריפסין וחומר קרטינוציטים באמבט מים בטמפרטורה של 37 מעלות צלזיוס 20 דקות לפני תחילת סדרת השלבים הבאה
- הסר צלחת של 6 בארות מ-4 מעלות צלזיוס, רסס אותה ב-70% אתנול והנח אותה בארון בטיחות ביולוגית מוכן (ראה שלב 1.3).
- הנח מלקחיים סטריליים עם שיניים ומלקחיים ללא שיניים בצינור חרוטי של 50 מ"ל המכיל 20 מ"ל של 70% אתנול. אם מחוץ למכסה המנוע בתחילה, ריססו מלקחיים עם 70% אתנול לפני הכנסתו למכסה המנוע.
- בעזרת מלקחיים מעוקרים כימית, תפסו פיסת רקמה והניחו אותה על משטח סטרילי עם צד האפידרמיס כלפי מעלה (השתמשו בצלחת פטרי או בחלק הפנימי של החצי העליון של צלחת 6 הבארות). החזיקו את החלק העורי של הרקמה בעזרת מלקחיים משוננים באמצעות היד הלא דומיננטית ובמקביל אחזו בחוזקה באפידרמיס עם המלקחיים ללא שיניים ומשכו אותו מקצה לקצה. זה אמור לצאת בצורה חלקה כמקשה אחת.
- הנח את האפידרמיס בחלק הפנימי של השפה של צינור חרוטי של 15 מ"ל. לכל צינור חרוטי של 15 מ"ל צריך להיות אפידרמיס של שתי עורלות לכל היותר.
- עבוד ביעילות; אם הרקמה תתייבש, התשואה תיפגע. אם ה-Dispase לא חדר כראוי לרקמה, ייתכן שיהיה קושי לקלף את האפידרמיס. במקרה כזה, משוך/גרד את האפידרמיס מהדרמיס הבסיסי. זה גם מביא לתשואה נמוכה בהרבה ואינו מומלץ.
- הוסף 4 מ"ל של 0.05% טריפסין-EDTA בצינור החרוטי של 15 מ"ל, ולאחר מכן סגור והפוך את הצינור וודא שכל האפידרמיס תלוי בטריפסין ולא תקוע בצד הצינור/המכסה. מניחים באמבט מים של 37 מעלות צלזיוס למשך 10 דקות. מערבבים תאים כל 2 דקות ביד.
הערה: טריפסיניזציה במשך יותר מ-10 דקות עלולה לגרום לתפוקת תאים נמוכה יותר. כמו כן, אם שלמות חלבוני פני התא מדאיגה, השתמש ב-TrypLE מכיוון שהוא ספציפי יותר לאתר המחשוף שלו, וכתוצאה מכך פחות נזק לתאים והוכח כלא מפחית משמעותית את ביטוי האנטיגן על פני השטח בהשוואה ל-Trypsin-EDTA9. יתר על כן, אמבט המים הוא מקור זיהום נפוץ, לכן יש להקפיד לנקות אותו באופן קבוע. החלף את המים באופן קבוע במים נטולי יונים המכילים תמיסת aquaguard-2. - הנח צינור חרוטי של 50 מ"ל בארון הבטיחות הביולוגית. הברג את המכסה והנח מסננת תאים של 100 מיקרומטר על פתח הצינור החרוטי.
- הסר את הצינור החרוטי בנפח 15 מ"ל המכיל את הדגימה המעוכלת מאמבט המים, יבש היטב ורסס עם 70% אלכוהול לפני החזרתו לארון הבטיחות הביולוגית. הקש על הצינור החרוטי פי 3 על פני מכסה המנוע ואז הפוך פי 6. חזור על מחזור היפוך הקשה פי 3.
- הוסף 6 מ"ל של תמיסה מנטרלת טריפסין לתוך הצינור החרוטי. יוצקים דרך מסננת תאים לתוך הצינור החרוטי של 50 מ"ל משלב 2.7.
- שטפו את הצינור החרוטי בנפח 15 מ"ל המכיל את הדגימה עם 5 מ"ל של תמיסות מנטרלות טריפסין (TNS). יוצקים דרך מסננת תאים לתוך הצינור החרוטי של 50 מ"ל. צנטריפוגה ב -300 x גרם למשך 5 דקות.
- הסר מיד מהצנטריפוגה ופיפטה את הסופרנטנט כדי למנוע אובדן תאים לתוך המדיום. צריך להישאר רק את הגלולה עם אוסף קטן של נוזלים. זה יכול להיות קשה לראות את הגלולה מדגימות רקמה קטנות יותר.
הערה: יש טריפסין בסופרנטנט, ולכן עדיף להסיר כמה שיותר מבלי לאבד את הכדור. - השעו מחדש את גלולת הקרטינוציטים ב-2 מ"ל של מדיה קרטינוציטים.
הערה: יש כאן שני שיקולים. ראשית, באיזו מדיה להשתמש. למטרה זו, מומלץ להשתמש בחומר ללא סרום ללא קולגן. מבחינה היסטורית, התקן לתרבית תאי קרטינוציטים היה מדיום הנשר המותאם של Dulbecco (DMEM) +10% סרום בקר עוברי (FBS) + F-12 של Ham על שכבת הזנה פיברובלסטים (3t3-J2s)10. עם זאת, עם הופעת המדיה נטולת הסרום והזמינות של קולגן, אפשרויות רבות אחרות נותרו ברות קיימא (ראה דיון)11. השיקול השני הוא האם השימוש באנטיביוטיקה במדיום התרבית מתאים ליישום הדמיית תאים חיים. זה יהיה תלוי בזמן ההדמיה, משך הזמן והניסיון עם מערכת ההדמיה. מושבות מצולמות במשך מספר שבועות באמצעות מערכת הדמיה משותפת, מה שהופך את השימוש באנטיביוטיקה לגישה מועדפת למרות ההשפעה הפוטנציאלית על תרביות (ראה דיון). פניצילין, סטרפטומיצין, אמפוטריצין B ומדיום קרטינוציטים המכיל גנטמיצין משמשים במהלך ההשעיה, ולאחר מכן מעבר למדיה המכילה פניצילין/סטרפטומיצין לאחר שינוי המדיה הראשוני. שיטה זו מנעה ביעילות זיהום במהלך הדמיה ממושכת של תאים חיים. - ספור תאים וזרע את הצלחת (ראה דיון להערות על בחירת צפיפות הזריעה). כדי להבטיח פיזור זריעה אחיד, לפני הציפוי, השעו מחדש את תאי הקרטינוציטים בכמות הכוללת של המדיום שיש לצפות. לאחר תסיסה עדינה על ידי היפוך, מערבולת קלות למשך 1-2 שניות, וצלחת. לאחר מכן, הזיזו את המיקרו-צלחת בתבנית דמוית צלב (למעלה-למטה, שמאלה-ימינה) פי 3 בחממה.
- לאחר 24 שעות, הנח את הצלחת באינקובטור של מערכת הדמיית התאים החיים. בצע הדמיית תאים חיים במהירות של פי 10 עם תמונות שצולמו כל 20 דקות. הנח את הדגימות ב-37 מעלות צלזיוס ו-5% CO2 בחממה המחוברת למיקרוסקופ.
תוצאות
בהתחשב במשתנים המרובים שניתן לתמרן בשיטה זו שבסופו של דבר מביאים למגוון תוצאות, כאן אנו מתארים טעויות נפוצות ואת התוצאות הנובעות מהן, כמו גם מספקים תוצאות לדוגמה והנסיבות שמאחוריהן.
כמו בכל טכניקת תרבית תאים, זיהום הוא אפשרות (סרטון משלים 1). יחד עם טכניקות סטריליות זהירות, שקול להשתמש באנטיביוטיקה במדיה, במיוחד אם אתה מרבה לפרקי זמן ממושכים. זיהום תכוף נצפה כאשר תאים מתורבתים הועברו למערכת הדמיה במקום אחר ללא שימוש באנטיביוטיקה. אנא עיין בסעיף הדיון על החסרונות של שימוש באנטיביוטיקה.
כפי שצוין בפרוטוקול, בחירת המדיה היא קריטית. בתחילה נעשה שימוש ב-DMEM עם 10% FBS ו-F-12 של האם על שכבת הזנה פיברובלסטים. עם זאת, היו בעיות בבחירה זו (סרטון משלים 2). צפיפות הזריעה הראשונית של הפיברובלסטים ששימשו הייתה גבוהה מדי, וככל שחלף הזמן, נראה היה שהפיברובלסטים מתרחבים, ומסתירים את הראייה של הקרטינוציטים. הפחתת צפיפות הזריעה של פיברובלסטים פתרה את בעיית טשטוש הפיברובלסטים. עם זאת, בנוסף, נראה שהקרטינוציטים מתמיינים מהר יותר מאשר עם תווך נטול סרום, וזה הביא לאזורים לא אחידים של קרטינוציטים, שקשה היה לעקוב אחריהם למטרות מעקב אחר שושלת (סרטון משלים 3). סוגיות אחרות עם מדיה מבוססת DMEM מורחבות בדיון.
לאחר שנתקלו בבעיות עם ה-F-12 המסורתי של DMEM/FBS/Ham, מדיה נטולת סרום נבחרה כחלופה. עם אמצעי תרבית בתוספת HKGS וקרטינוציטים בצפיפות משובטת היו מושבות אחידות שניתן היה לעקוב אחריהן (סרטון משלים 4, סרטון משלים 5). עם מדיה חופשית בסרום, ההתמיינות מתרחשת לאט יותר (אולי בגלל סידן נמוך יותר), ותאים דבקים רבים לעולם אינם מתחלקים אך אינם מתנתקים (כפי שקורה במדיה אחרת; סרטון משלים 4, סרטון משלים 3).
צפיפות הזריעה יכולה להשפיע על היכולת לעקוב אחר תאים. יותר מדי תאים יכולים לגרום לחוסר יכולת לעקוב אחר תאים בצורה מדויקת, ומעט מדי תאים, לעומת זאת, לגרום לצמיחה לא מספקת. יצרנים רבים של מדיה נטולת סרום ממליצים לשייך את המדיום המוגדר שלהם לקולגן, מה שמאפשר צפיפות זריעה נמוכה יותר (איור 2). ראה את הדיון למידע נוסף בנושא זה.
התמיינות קרטינוציטים ניכרת מבחינה מורפולוגית על ידי תאים גדולים ושטוחים ומורפולוגיה מוערמת. ראה סרטון משלים 2. הערכת הבידול הסופי היא היעדר חלוקה על פני 48 שעות 3,12,13.
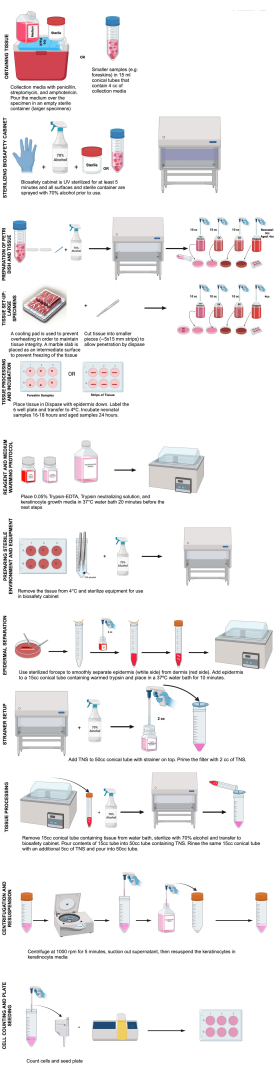
איור 1: שלבי בידוד קרטינוציטים. תרשים זה ממחיש את השלבים של בידוד קרטינוציטים כמתואר בפרוטוקול זה. נוצר בשנת BioRender.com אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: היצמדות תאים והיווצרות מושבה. ההבדל בהיצמדות התאים והיווצרות המושבה לאחר יומיים 23 שעות עם ובלי קולגן. קולגן משפר באופן משמעותי את ההיצמדות הראשונית לקרטינוציטים. נוצר בשנת BioRender.com אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרטון משלים 1: זיהום מושבת קרטינוציטים. תמונות שצולמו כל 20 דקות על ידי הדמיית תאים חיים שנאספו לווידאו. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים 2: צמיחה מהירה של קרטינוציטים באמצעות מזין מסורתי ומדיה מבוססת DMEM. תמונות שצולמו כל 20 דקות על ידי הדמיית תאים חיים שנאספו לווידאו. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים 3: התמיינות מוגברת של קרטינוציטים באמצעות מזין מסורתי ומדיה מבוססת DMEM. תמונות שצולמו כל 20 דקות על ידי הדמיית תאים חיים שנאספו לווידאו. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים 4: מושבת קרטינוציטים הניתנת למעקב. תמונות שצולמו כל 20 דקות על ידי הדמיית תאים חיים שנאספו לווידאו. אנא לחץ כאן להורדת קובץ זה.
סרטון משלים 5: מושבת קרטינוציטים הניתנת למעקב. תמונות שצולמו כל 20 דקות על ידי הדמיית תאים חיים שנאספו לווידאו. אנא לחץ כאן להורדת קובץ זה.
Discussion
כאן, פירטנו שיטה לתרבית ראשונית של קרטינוציטים אנושיים לצורך הדמיית תאים חיים. שיטה זו מתאימה טכניקות קיימות של תרבית תאים באמצעות ציפוי בצפיפות נמוכה ותרבית ארוכת טווח כדי לאפשר מחקרי הדמיה מוצלחים של תאים חיים. השיטה המועדפת לדיסוציאציה מסוג תאים זה כוללת עיכול אנזימטי דו-שלבי, שהוכח כגורם לקרטינוציטים, מתוכם 3%-4% מסוגלים להפוך ליחידות יוצרות מושבה14. גידול קרטינוציטים בוגרים ומבוגרים במבחנה הוא מאתגר, מכיוון שדגימות רבות פשוט לא מצליחות לגדול.
שלבים מרובים הם קריטיים למטרה של מקסום התשואות לשיפור הצמיחה. יש לבודד תאים אלה בהקדם האפשרי לאחר איסוף הרקמות. נשמר קו תקשורת ישיר עם המנתחים, והדגימות נאספות מיד לאחר קבלתן מהמטופל. מספר המלצות נוספות ניתנו על דרכים לשימור שלמות הרקמות בשיטה זו. שמור על רקמה קרירה, שמור על רקמה באמצעי איסוף ועבד רקמות ביעילות. שקול איגום דגימות, אם קטנות, כדי למקסם את הצמיחה במבחנה. יש לחמם תמיד ריאגנטים למשך 20 דקות לפחות. השתמש ביעילות מוכחת ושקול לחתוך רצועות רקמה קטנות יותר או להאריך את תקופת הדגירה אם יש בעיות בקילוף האפידרמיס. השתמש בפרק הזמן המינימלי האפשרי לעיכול עם טיפול אנזימטי לבחירה ונטרל מיד לאחר הדגירה. השעו מחדש את הגלולה בהקדם האפשרי לאחר הצנטריפוגה. גם לאחר ביצוע כל זה, צפו שיהיו מדי פעם דגימות אנושיות בוגרות ומבוגרות שאינן גדלות, אפילו בנסיבות שנראות כאידיאליות ביותר.
המטרה היא לפלוט קרטינוציטים בצפיפות שיבוט או קרוב אליה ולעקוב אחריהם באמצעות הדמיית תאים חיים; שיטה זו תואמת היטב את המטרות הללו. אם המטרה היא לבודד קרטינוציטים ולצפות בתנועתיות בתנאים שונים או לבדיקה פונקציונלית כמו בדיקת שריטות, שיטה חלופית שיש לקחת בחשבון היא טכניקת השתלת העור. גישה נטולת אנזימים זו לבידוד קרטינוציטים עשויה לגרום לתפוקת תאים גבוהה יותר 14,15,16.
שינויים במדיה המשמשת יכולים להיות חשובים להדמיית תאים חיים. המדיום שנבחר לקידום צמיחת הקרטינוציטים ישפיע על כל שלבי הניסוי. DMEM, 10% FBS וה-F-12 של האם עם תאי הזנה 3T3-J2 אפשרו צפיפות זריעה נמוכה יותר אך גרמו למספר בעיות. תאי הזנה, אלא אם כן נעשה בהם שימוש בצפיפות נמוכה, טשטשו את מישור הראייה שבו היו הקרטינוציטים, והקשו על המעקב. באמצעות DMEM, הפיברובלסטים נשארו למשך הדמיית תאים חיים (~2 שבועות). כמו כן, ישנן בעיות אחרות במדיה מבוססת סרום שהן חשובות, כולל קידום התמיינות (המונעת שימוש בתוכנת IncuCyte להדמיית תאים חיים עקב היעדר מראה אחיד של התאים) והסיכון לזיהום אפשרי מהסרום17. במדיה נטולת סרום, יש צורך בצפיפות זריעה גבוהה יותר מאשר ב-DMEM, מכיוון שפחות תאים נדבקים. השילובים של 154 CF + HKGS, Epilife + HKGS ו-Epilife + S7 היו יעילים כולם. כתזכורת, השתמש תמיד במדיום טרי בעת שימוש בתוספי גדילה מכיוון שהם מתכלים עם הזמן. בדוק תמיד את המדיום עם לפחות שלוש דגימות בעת התחלת פרוטוקול חדש כדי לוודא שהוא יכול לתמוך בתאים המתורבתים. יצרני מדיה ללא סרום ממליצים לעתים קרובות על שימוש בקולגן זנב חולדה (סוג 1)18. קולגן מסייע בהתקשרות ראשונית (מה שמאפשר צפיפות זריעה נמוכה יותר) והתפשטות19.
יחד עם סוג המדיום, גורם נוסף שעשוי להשפיע על התוצאות הוא צפיפות הזריעה והתפלגות התאים. תרבית קרטינוציטים נעזרת באינטראקציה בין תאים להתפשטות, וכך, צפיפות זריעה גבוהה יותר מביאה לצמיחה פורייה יותר20. מדיה וגילאי תאים שונים דורשים צפיפות זריעה משתנה כדי להשיג צמיחה משובטת. ניסויים נערכים בדרך כלל עם צפיפות זריעה מרובה כדי להשיג שיעורי גידול / גדלי מושבה מתאימים ליישום הדמיית התאים החיים הרצוי. הצפיפות לצמיחה משובטת ומעקב אחר שושלת עשויה להיות שונה מאלה הדרושות ליישומים אחרים. ודא שהתפלגות הזריעה אחידה לפני שתאפשר לתאים להידבק.
שימוש באנטיביוטיקה במהלך בידוד וגדילה שנוי במחלוקת. הוכח בעבר כי לאנטיביוטיקה נפוצה יכולה להיות השפעה מעכבת על התפשטות קרטינוציטים21. בהתחשב בכך, רבים בוחרים לא להשתמש באנטיביוטיקה לאחר ניקוי העור בהתחלה לפני העיבוד. יישום הדמיית תאים חיים זה כרוך במספר שבועות של צמיחת מושבה, מה שמגדיל את הסיכון לזיהום. יש לשקול את הסיכון לאובדן שבועות של זמן/דגימות יקרות ערך עקב זיהום עם הסיכון לירידה אפשרית בהתפשטות הקרטינוציטים. יישומים קצרים יותר עשויים שלא להזדקק לאנטיביוטיקה, בעוד שתקופות ממושכות של הדמיית תאים חיים כן.
מגבלה של תרבית תאים להדמיית תאים חיים, כמו לטכניקות אחרות במבחנה, היא הרלוונטיות הלא ידועה in vivo . בנוסף, השימוש בתאים טריים שהושגו לעומת תאים שעברו יכול להניב תוצאות שונות ככל שמאפייני התא מתפתחים ככל שמספר המעבר גדל20. יתר על כן, התוצאות עשויות להיות מושפעות מהסביבה החיצונית האחידה. סביבה אחידה זו עשויה לייצג חוזק או מגבלה, בהתאם למטרות המחקר, במיוחד כאשר מבחינים בין שינויים פנימיים וחיצוניים בהתנהגות התא.
יש שפע של גורמים שיש לקחת בחשבון בעת גידול קרטינוציטים לצורך הדמיית תאים חיים. השיטה המוצגת יכולה לעזור לפשט את התהליך. היכולת לבצע בהצלחה הדמיית תאים חיים של קרטינוציטים במחקרים עתידיים תאפשר הבנה מפורטת יותר של ההתנהגות המתפשטת והדיפרנציאטיבית של קרטינוציטים ומנגנוני התחזוקה של האפידרמיס.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
תודה מיוחדת ל-T. Richard Parenteau, MD/PhD, ולאלכסנדרה צ'ארוייר, PharmD/PhD, שלימדו אותי כיצד לתרבת קרטינוציטים. תודה למריסה פייפר MD שסיפקה לנו דגימות לבידוד קרטינוציטים. תודה אחרונה למייקל רוזנבלום, MD, על שאיפשר לנו גישה למערכת הדמיית התאים החיים שלו כדי להשלים את הניסויים.
Materials
| Name | Company | Catalog Number | Comments |
| .05% Trypsin-EDTA (1X), 100 mL | Gibco | 25300-054 | |
| 100 um cell filter | Corning | 352360 | |
| 15 cc Falcon | Corning | 352096 | |
| 50 cc conical Falcon | Corning | 352070 | |
| 6 well microplate | Corning | 3516 | |
| 70% reagent alcohol, 4 L | VWR Chemicals | BDH1164-4LP | Can alternatively dilute your own |
| Amphotericin B, 50 ml | Corning | 30-003-CF | Dilute to 5X (50 ug/mL) |
| Dipase, 100 ml | Corning | 354235 | Dilute 1:1 with HBSS, add 1x gentamycin, filter sterilize |
| Epilife, 50 mL | Gibco | MEP1500CA | Add HKGS, consider antibiotics |
| Fetal Bovine Serum Value Heat Inactivated FBS, 500 ml | Gibco | A52568-01 | FBS |
| Forceps | |||
| Gentamicin, 10 ml | Gibco | 15750-060 | Dilute to 50 ug/ml for 5X |
| Hank's Balanced Salt Solution (1X), 500 ml | Gibco | 14170-112 | (HBSS) |
| HBSS 5X PSAG | This is HBSS + 5X concentrations of Pen/Strep/Ampho/Gent | ||
| Hibiclens, Gallon | Molnlycke | 57591 | Dilute to 10% using deionized H20 |
| Human Keratinocyte Growth Serum, 5 mL | Gibco | S-001-5 | Added to epilife |
| Penicillin/Streptomycin, 100 ml | Corning | 30-002-Cl | Dilute to 5X (comes in 100x stock) for 5X PSA - 1X for media changes |
| Petri Dish 100 mm x 15 mm | Fisher Scientific | FB0875713 | |
| Scalpel Blade NO 23 | VWR | 76457-480 | |
| TrypLE | Gibco | 12604021 | A less caustic alternative to regular Trypsin |
| Trypsin Neutralizing Solution | (TNS), this is HBSS with 10% FBS (some use less serum, 5%) |
References
- Mateu, R., et al. Functional differences between neonatal and adult fibroblasts and keratinocytes: Donor age affects epithelial-mesenchymal crosstalk in vitro. Int J Mol Med. 38 (4), 1063-1074 (2016).
- Handl, J., Čapek, J., Majtnerová, P., Báčová, J., Roušar, T. The effect of repeated passaging on the susceptibility of human proximal tubular HK-2 cells to toxic compounds. Phy Res Aca Sci Boh. 69 (4), 731-738 (2020).
- Xiao, T., et al. Short cell cycle duration is a phenotype of human epidermal stem cells. Stem Cell Res The. 15 (1), 76 (2024).
- Noujarède, J., et al. Sphingolipid paracrine signaling impairs keratinocyte adhesion to promote melanoma invasion. Cell Rep. 42 (12), 113586 (2023).
- Sun, M., et al. An image-based dynamic high-throughput analysis of adherent cell migration. Bio-prol. 11 (6), e3957 (2021).
- Chapman, S., McDermott, D. H., Shen, K., Jang, M. K., McBride, A. A. The effect of Rho kinase inhibition on long-term keratinocyte proliferation is rapid and conditional. Stem Cell Res The. 5 (2), 60 (2014).
- U.S. Department of Health and Human Services. . Biosafety in microbiological and biomedical laboratories. , (2020).
- Poumay, Y., Roland, I. H., Leclercq-Smekens, M., Leloup, R. Basal detachment of the epidermis using dispase: tissue spatial organization and fate of integrin alpha 6 beta 4 and hemidesmosomes. J Inv Der. 102 (1), 111-117 (1994).
- Tsuji, K., et al. Effects of different cell-detaching methods on the viability and cell surface antigen expression of synovial mesenchymal stem cells. CellTra. 26 (6), 1089-1102 (2017).
- Rheinwald, J. G., Green, H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 6 (3), 331-343 (1975).
- Boisseau, A. M., et al. Production of epidermal sheets in a serum free culture system: a further appraisal of the role of extracellular calcium. J Der Sci. 3 (2), 111-120 (1992).
- Roshan, A., et al. Human keratinocytes have two interconvertible modes of proliferation. Nat Cell Bio. 18 (2), 145-156 (2016).
- Nanba, D., et al. EGFR-mediated epidermal stem cell motility drives skin regeneration through COL17A1 proteolysis. J Cell Bio. 220 (11), e202012073 (2021).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Der. 28 (2), 107-112 (2019).
- Guo, A., Jahoda, C. A. B. An improved method of human keratinocyte culture from skin explants: cell expansion is linked to markers of activated progenitor cells. Exp Derm. 18 (8), 720-726 (2009).
- Orazizadeh, M., Hashemitabar, M., Bahramzadeh, S., Dehbashi, F. N., Saremy, S. Comparison of the enzymatic and explant methods for the culture of keratinocytes isolated from human foreskin. Bio Rep. 3 (3), 304-308 (2015).
- Usta, S. N., Scharer, C. D., Xu, J., Frey, T. K., Nash, R. J. Chemically defined serum-free and xeno-free media for multiple cell lineages. Ann of tra med. 2 (10), 97 (2014).
- Lenihan, C., Rogers, C., Metcalfe, A. D., Martin, Y. H. The effect of isolation and culture methods on epithelial stem cell populations and their progeny-toward an improved cell expansion protocol for clinical application. Cyt. 16 (12), 1750-1759 (2014).
- Bernstam, L. I., Vaughan, F. L., Bernstein, I. A. Keratinocytes grown at the air-liquid interface. In Vitro Cell Dev Biol. 22 (12), 695-705 (1986).
- Ponce, L., et al. Isolation and cultivation of primary keratinocytes from piglet skin for compartmentalized co-culture with dorsal root ganglion neurons. J Cell Bio. 2 (2), 93-115 (2017).
- Nygaard, U. H., et al. Antibiotics in cell culture: friend or foe? Suppression of keratinocyte growth and differentiation in monolayer cultures and 3D skin models. Exp Der. 24 (12), 964-965 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved