Method Article
Generación de cultivos primarios para la obtención de imágenes de células vivas de queratinocitos
En este artículo
Resumen
Este protocolo describe el cultivo de queratinocitos recién obtenidos (pasaje 0) para su uso en la obtención de imágenes de células vivas.
Resumen
El seguimiento de las células madre y el comportamiento comprometido de los progenitores a nivel de una sola célula en la piel humana ha sido un desafío tanto in vivo como in vitro. Las imágenes de células vivas han permitido avances significativos en la capacidad de identificar diferencias entre las células madre de queratinocitos y el comportamiento de los progenitores comprometidos. La obtención de imágenes de células vivas es un método en evolución y algo desafiante para estudiar el comportamiento de los queratinocitos in vitro. Este protocolo se ha desarrollado para cultivar queratinocitos a baja densidad de siembra, lo que permite la fotografía de lapso de tiempo a largo plazo y el seguimiento del comportamiento de las células individuales. Los queratinocitos del pasaje 0 se cultivan a densidad clonal, y la fotografía de lapso de tiempo permite documentar las divisiones celulares individuales y el momento de su aparición. Para obtener la máxima relevancia biológica, los queratinocitos humanos recién aislados se colocan in vitro. Este enfoque se centra en la proliferación. Sin embargo, este protocolo se puede adaptar para su uso en otras aplicaciones de adquisición de imágenes de células vivas que miden el comportamiento de células individuales, como la medición de la migración celular, la cicatrización de heridas y la motilidad.
Introducción
El objetivo de este protocolo es proporcionar la capacidad de rastrear queratinocitos individuales en cultivo durante un período relativamente largo (varias semanas) gracias a bajas densidades de siembra y fotografía de lapso de tiempo. La obtención de imágenes de células vivas a baja densidad ofrece a los investigadores la oportunidad de visualizar el comportamiento de las células in vitro a nivel de una sola célula. Si bien no es posible en el cultivo celular convencional, la obtención de imágenes de células vivas permite desarrollar árboles de linaje en tiempo real, sin el uso de etiquetado, a partir del cual se puede obtener información sobre la cinética de división, como la duración del ciclo celular y la proporción de divisiones de proliferación y diferenciación en una colonia. También permite el estudio de la migración y motilidad celular. Puede ser un desafío técnico, con aspectos que deben optimizarse, dependiendo del tipo de celda y de los datos que se van a capturar. Otros laboratorios han utilizado queratinocitos neonatales y/o queratinocitos pasados que son más fáciles de cultivar1.
Sin embargo, las líneas celulares que se someten a un paso repetido son significativamente diferentes en comportamiento y morfología de su estado in vivo 2. Para obtener la mayor relevancia biológica con el fin de obtener el comportamiento más cercano al in vivo , se utilizan células de paso 0. En las poblaciones de queratinocitos, es posible distinguir entre la célula madre y el progenitor comprometido sin clasificación ni etiquetas, ya que existen claras diferencias en el comportamiento de la división que se pueden observar a través de imágenes de células vivas3.
Utilizamos imágenes de células vivas para estudiar la cinética de proliferación de queratinocitos. Un enfoque similar se ha utilizado para estudiar la motilidad de las células de melanoma cutáneo cocultivadas con queratinocitos4, la migración celular adherente de los ensayos de rasguño5 y cómo los inhibidores de ROCK afectan la proliferación de queratinocitos6. Este protocolo está diseñado específicamente para el cultivo de células con el fin de facilitar el rastreo del linaje mediante imágenes de células vivas, aunque puede adaptarse para otros fines.
Este protocolo describe el aislamiento de los queratinocitos del paso 0 con el fin de obtener imágenes de células vivas, analiza las complicaciones que pueden surgir y proporciona consideraciones que pueden requerir alteraciones en el protocolo (Figura 1).
Protocolo
Se requiere la aprobación del Comité de Investigación en Seres Humanos de la institución para el uso de tejido humano. Las muestras humanas para la investigación a menudo se obtienen de fuentes comerciales (por ejemplo, ATCC, tecnología de celdas Lifeline y Zen-Bio). Nuestros estudios utilizan tejido desechado en el momento de las cirugías o muestras de biopsia de piel tomadas específicamente con fines de estudio. Estas situaciones requieren diferentes aprobaciones y procedimientos de consentimiento. Todos los tejidos se obtienen después de la aprobación del Comité de Investigación Humana de la UCSF, utilizando el consentimiento informado por escrito y siguiendo los principios de la Declaración de Helsinki.
1. Separación de la epidermis de la dermis
- Asegurarse de que se obtengan las aprobaciones adecuadas para utilizar tejido humano para el estudio.
- Obtenga una muestra de piel y transpórtela en un recipiente aislado con una bolsa de hielo. Coloque la muestra en un medio de recolección que contenga una concentración 5 veces mayor de penicilina, estreptomicina y anfotericina.
NOTA: La cantidad requerida dependerá de la aplicación. En nuestra experiencia, aproximadamente 1.000.000 de queratinocitos porcm2 se obtienen de pieles adultas y envejecidas. Sin embargo, esto puede variar significativamente para cada muestra.- Coloque los prepucios neonatales en medios de cultivo celular e inicie el procedimiento de aislamiento de queratinocitos no más de 48 horas después de la circuncisión para minimizar la muerte celular. Guarde el tejido a 4 °C hasta su procesamiento. El procesamiento de muestras adultas y envejecidas generalmente comienza a las pocas horas de la recolección.
- Obtener acceso a una cabina de bioseguridad con equipo de nivel BS2 diseñado para trabajar con agentes causantes de enfermedades por ingestión, membrana mucosa o exposición percutánea7. Asegúrese de que la cabina de bioseguridad esté esterilizada con rayos UV durante al menos 15 minutos y que todas las superficies se rocíen con alcohol al 70% antes de su uso.
- Póngase los guantes, rocíe el recipiente de recolección con alcohol al 70% y coloque el recipiente en la campana extractora. Coloque una almohadilla de enfriamiento debajo del pañuelo para evitar que se caliente a temperatura ambiente y para mantener su integridad. Si el tejido es extremadamente grande, corte una porción para procesarla y mantenga el resto húmedo en el recipiente de recolección.
NOTA: Como muchos de los especímenes envejecidos son grandes de piel abdominal o mamaria debido a cirugías, se necesita tiempo para cortar y procesar el tejido. El pañuelo nunca debe colocarse directamente sobre la almohadilla, ya que el frío extremo puede hacer que se congele. En su lugar, debe colocarse sobre una superficie intermedia, como una losa de mármol. - Coloque dos placas de Petri de 100 mm x 15 mm y un bisturí quirúrgico estéril #23 en la capucha.
- Abra las placas de Petri y colóquelas en la superficie del gabinete de manera que las superficies internas de cada placa miren hacia arriba. Agregue 10 mL de gluconato de clorhexidina al 10% a una de las placas de Petri. Agregue 10 mL de 5x penicilina/estreptomicina/anfotericina/gentamicina en la Solución Salina Balanceada de Hank (HBSS; 5x) a otras 2 mitades de la placa de Petri (Ver Tabla de Materiales).
- Prepare una placa de 6 pocillos para el paso de Dispasa. Para el tejido neonatal, use 3 mL de Dispasa por pocillo. Para muestras de tejido envejecido, use 4 mL. El uso de cantidades inadecuadas de dispasa para el volumen de tejido puede resultar en dificultad para separar la epidermis de la dermis.
- Use un bisturí para cortar el tejido en pedazos más pequeños para que la dispasa penetre mejor. La dispasa solo penetra hasta 5 mm desde los bordes del tejido, por lo que debe cortar tiras largas de tejido de 0,5 a 1 cm de ancho. Si no se corta lo suficientemente pequeño, no se producirá la separación de la epidermis de la dermis.
- Corta el tejido más grueso en pedazos más pequeños. Corta los prepucios neonatales en 3 o 4 pedazos (~5 mm x 7 mm). Utilice un máximo de dos prepucios enteros por pocillo de Dispasa. Los colgajos abdominales superficiales tienden a ser mucho más delgados, con un mínimo o ningún tejido subcutáneo, córtelos en tiras más largas (~ 5 mm x 15 mm).
- Coloque un máximo de cuatro tiras por pocillo de Dispasa. Si el tejido obtenido tiene una gran cantidad de grasa subcutánea adherida, recorte el tejido subcutáneo para ayudar a que la dispasa penetre completamente en el tejido. Si el tejido se corta demasiado pequeño, es posible que se requiera un microscopio de disección para determinar qué lado es epidérmico y qué lado es dérmico mientras se despega la epidermis. Tirar del lado equivocado de la piel puede provocar un traumatismo tisular adicional.
- Coloque el tejido con el lado epidérmico hacia abajo en la primera placa de Petri preparada en el paso 1.6, que contiene gluconato de clorhexidina al 10%, durante 10-20 s Luego transfiera el tejido con el lado epidérmico hacia abajo a la segunda placa de Petri, que contiene 5x penicilina/estreptomicina/anfotericina (PSA) con HBSS, y agite durante 10-20 s. Transfiera el tejido con el lado epidérmico hacia abajo a la tercera placa de Petri, que nuevamente contenga 5x PSA con HBSS, y agite durante otros 10 s. Es aceptable procesar varias muestras con la misma solución.
- Transfiera el tejido con el lado epidérmico hacia abajo a la placa de dispasa de 6 pocillos preparada en el paso 1.7.
NOTA: Recomendamos el lado epidérmico hacia abajo según nuestra convención. Otros protocolos recomiendan la dermis hacia abajo8. No todas las dispasas son igualmente eficaces. Pelar la epidermis de la piel envejecida resultó un desafío con ciertos productos, incluso en concentraciones de hasta 4 veces el nivel recomendado por el fabricante. Esto resultó en la pérdida de tiempo y especímenes. Las empresas utilizan unidades no estandarizadas para Dispasa, lo que dificulta la identificación de cómo difieren las concentraciones entre las marcas. Debido a estos desafíos, se recomienda encarecidamente el uso de una de las marcas de Dispasa enumeradas en la Tabla de Materiales . - Etiquete la placa de 6 pocillos que contiene la dispasa y las muestras, y transfiérala a 4 °C. Incubar muestras neonatales durante 16-18 h en Dispasa y muestras adultas/envejecidas durante 24 h.
NOTA: Existe un protocolo alternativo de 2 h que se puede utilizar para las muestras, en el que la muestra se coloca en Dispasa a 37 °C durante 2 h, y luego se pela la epidermis. Desafortunadamente, esto no siempre funciona, y la integridad del tejido puede verse comprometida después de la incubación, lo que resulta en la pérdida de una muestra. Se prefiere la incubación nocturna siempre que sea posible.
2. Aislamiento de queratinocitos
- Coloque tripsina-EDTA al 0,05 % (o TrypLE), la solución neutralizante de tripsina y los medios de queratinocitos en un baño de agua a 37 °C 20 minutos antes de comenzar el siguiente conjunto de pasos
- Retire una placa de 6 pocillos a 4 °C, rocíela con etanol al 70% y colóquela en una cabina de bioseguridad preparada (consulte el paso 1.3).
- Coloque pinzas dentadas estériles y pinzas no dentadas en un tubo cónico de 50 mL que contenga 20 mL de etanol al 70%. Si está fuera de la campana inicialmente, rocíe las pinzas con etanol al 70% antes de colocarlas en la campana.
- Con pinzas esterilizadas químicamente, agarre un trozo de tejido y colóquelo sobre una superficie estéril con el lado epidérmico hacia arriba (use una placa de Petri o el interior de la mitad superior de la placa de 6 pocillos). Sostenga la porción dérmica del tejido con pinzas dentadas con la mano no dominante y, al mismo tiempo, agarre firmemente la epidermis con las pinzas no dentadas y tire de ella de borde a borde. Debe desprenderse suavemente como una sola pieza.
- Coloque la epidermis en el interior del labio de un tubo cónico de 15 mL. Cada tubo cónico de 15 mL debe tener una epidermis de dos prepucios como máximo.
- Trabajar de manera eficiente; Si el tejido se seca, el rendimiento se verá comprometido. Si la dispasa no penetró adecuadamente en el tejido, puede haber dificultad para despegar la epidermis. En tal caso, tire/raspe la epidermis de la dermis subyacente. Esto también da como resultado un rendimiento mucho menor y no se recomienda.
- Agregue 4 mL de Tripsina-EDTA al 0,05% en el tubo cónico de 15 mL, luego cierre e invierta el tubo asegurándose de que toda la epidermis quede suspendida en la Tripsina y no se pegue en el costado del tubo/tapa. Colocar en un baño de agua a 37 °C durante 10 min. Agite las células cada 2 minutos con la mano.
NOTA: La tripsinización durante más de 10 minutos puede resultar en un menor rendimiento de celdas. Además, si la integridad de las proteínas de la superficie celular es una preocupación, use TrypLE, ya que es más específico para su sitio de escisión, lo que resulta en menos daño a las células y se ha demostrado que no disminuye significativamente la expresión de antígeno de superficie en comparación con Trypsin-EDTA9. Además, el baño de agua es una fuente común de contaminación, así que asegúrese de limpiarlo regularmente. Cambie el agua regularmente con agua desionizada que contenga la solución aquaguard-2. - Coloque un tubo cónico de 50 mL en la cabina de bioseguridad. Desenrosque la tapa y coloque un colador de células de 100 μm en la abertura del tubo cónico.
- Retire el tubo cónico de 15 mL que contiene la muestra digerida del baño de agua, séquelo completamente y rocíe con alcohol al 70% antes de volver a colocarlo en la cabina de bioseguridad. Golpee el tubo cónico 3 veces contra la superficie de la campana extractora y luego invierta 6 veces. Repita el ciclo de inversión de roscado 3 veces.
- Agregue 6 mL de solución neutralizante de tripsina en el tubo cónico. Vierta a través del filtro de células en el tubo cónico de 50 ml del paso 2.7.
- Enjuague el tubo cónico de 15 mL que contiene la muestra con 5 mL de soluciones neutralizantes de tripsina (TNS). Vierta a través de un colador de células en el tubo cónico de 50 mL. Centrifugar a 300 x g durante 5 min.
- Retire inmediatamente de la centrífuga y pipetee el sobrenadante para evitar la pérdida de células en el medio. Solo debe quedar el pellet con una pequeña acumulación de líquido. Puede ser difícil ver el gránulo a partir de muestras de tejido más pequeñas.
NOTA: Hay tripsina presente en el sobrenadante, por lo que es mejor eliminar la mayor cantidad posible sin perder el pellet. - Vuelva a suspender el pellet de queratinocitos en 2 mL de medio de queratinocitos.
NOTA: Aquí hay dos consideraciones. En primer lugar, qué medios utilizar. Para ello, se recomiendan medios sin suero y sin colágeno. Históricamente, el estándar para el cultivo de células de queratinocitos ha sido el medio de águila modificado de Dulbecco (DMEM) +10% de suero fetal bovino (FBS) + F-12 de Ham en una capa alimentadora de fibroblastos (3t3-J2s)10. Sin embargo, con el advenimiento de los medios sin suero y la disponibilidad de colágeno, muchas otras posibilidades siguen siendo viables (ver discusión)11. La segunda consideración es si el uso de antibióticos en el medio de cultivo es apropiado para la aplicación de imágenes de células vivas. Esto dependerá del tiempo de obtención de imágenes, la duración y la experiencia con el sistema de imágenes. Las colonias se toman imágenes durante varias semanas utilizando un sistema de imágenes compartido, lo que hace que el uso de antibióticos sea un enfoque preferido a pesar del impacto potencial en los cultivos (ver discusión). La penicilina, la estreptomicina, la anfotericina B y el medio de queratinocitos que contienen gentamicina se utilizan durante la resuspensión, seguido de un cambio a un medio que contiene penicilina/estreptomicina después del cambio de medio inicial. Este método ha evitado eficazmente la contaminación durante la obtención de imágenes de células vivas prolongadas. - Cuente las celdas y siembre la placa (consulte la discusión para obtener comentarios sobre la selección de la densidad de siembra). Para asegurar una distribución uniforme de la siembra, antes de la siembra, vuelva a suspender las células de queratinocitos en la cantidad total de medio a sembrar. Después de una agitación suave por inversión, vórtice ligeramente durante 1-2 s y plaque. Luego, mueva la microplaca en un patrón en forma de cruz (arriba-abajo, izquierda-derecha) 3 veces en la incubadora.
- Después de 24 h, coloque la placa en la incubadora del sistema de imágenes de células vivas. Realice imágenes de células vivas a 10x con imágenes tomadas cada 20 minutos. Coloque las muestras a 37 °C y 5% de CO2 en la incubadora adjunta al microscopio.
Resultados
Dadas las múltiples variables que pueden ser manipuladas en este método y que, en última instancia, dan lugar a una variedad de resultados, aquí describimos los errores comunes y sus resultados resultantes, así como proporcionamos resultados ejemplares y las circunstancias detrás de ellos.
Al igual que con cualquier técnica de cultivo celular, la contaminación es una posibilidad (Video complementario 1). Junto con las técnicas estériles cuidadosas, considere el uso de antibióticos en los medios, especialmente si se cultiva durante períodos prolongados de tiempo. Se observó una contaminación frecuente cuando las células cultivadas se transportaron a un sistema de imágenes en otro lugar sin el uso de antibióticos. Consulte la sección de discusión para conocer los aspectos negativos del uso de antibióticos.
Como se indica en el protocolo, la selección de medios es fundamental. Inicialmente se utilizó DMEM con 10% de FBS y F-12 de Ham en una capa alimentadora de fibroblastos. Sin embargo, hubo problemas con esta selección (Video Suplementario 2). La densidad inicial de siembra de los fibroblastos utilizados era demasiado alta y, a medida que pasaba el tiempo, los fibroblastos parecían expandirse, oscureciendo la vista de los queratinocitos. La reducción de la densidad de siembra de fibroblastos resolvió el problema de oscurecer los fibroblastos. Sin embargo, además, los queratinocitos parecieron diferenciarse más rápidamente que con el medio sin suero, y esto dio lugar a áreas no uniformes de queratinocitos, que eran difíciles de rastrear para fines de rastreo de linaje (Video complementario 3). Otros problemas con los medios basados en DMEM se amplían en la discusión.
Después de encontrar problemas con el F-12 tradicional de DMEM/FBS/Ham, se eligieron los medios sin suero como alternativa. Con los medios de cultivo suplementados con HKGS y queratinocitos a densidad clonal, hubo colonias uniformes que fueron rastreables (Video Suplementario 4, Video Suplementario 5). Con los medios libres de suero, la diferenciación ocurre más lentamente (posiblemente debido a la disminución del calcio) y muchas células adherentes nunca se dividen, pero no se desprenden (como lo hacen en otros medios; Video complementario 4, video complementario 3).
La densidad de siembra puede afectar la capacidad de seguimiento de las células. Demasiadas células pueden resultar en una incapacidad para rastrear las células con precisión, y muy pocas células, por el contrario, resultan en un crecimiento insuficiente. Muchos fabricantes de medios sin suero recomiendan emparejar su medio definido con colágeno, lo que permite densidades de siembra más bajas (Figura 2). Consulte la discusión para obtener más información sobre este tema.
La diferenciación de los queratinocitos es evidente morfológicamente por células grandes y aplanadas y morfología apilada. Ver video complementario 2. La evaluación de la diferenciación terminal es la falta de división a lo largo de 48 h 3,12,13.
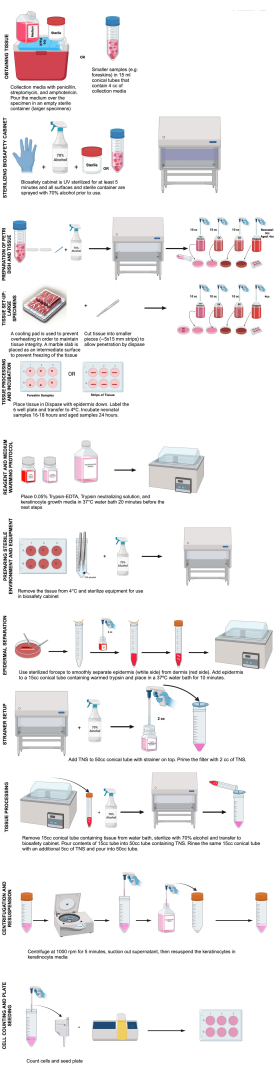
Figura 1: Pasos de aislamiento de queratinocitos. Este diagrama ilustra los pasos del aislamiento de queratinocitos tal y como se describe en este protocolo. Creado en BioRender.com Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Adherencia celular y formación de colonias. La diferencia en la adherencia celular y la formación de colonias a los 2 días 23 h con y sin colágeno. El colágeno mejora significativamente la adherencia inicial de los queratinocitos. Creado en BioRender.com Haga clic aquí para ver una versión más grande de esta figura.
Video complementario 1: Contaminación de una colonia de queratinocitos. Imágenes tomadas cada 20 minutos por imágenes de células vivas cotejadas en video. Haga clic aquí para descargar este archivo.
Video complementario 2: Crecimiento rápido de queratinocitos utilizando alimentadores tradicionales y medios basados en DMEM. Imágenes tomadas cada 20 minutos por imágenes de células vivas cotejadas en video. Haga clic aquí para descargar este archivo.
Video complementario 3: Aumento de la diferenciación de queratinocitos utilizando alimentador tradicional y medios basados en DMEM. Imágenes tomadas cada 20 minutos por imágenes de células vivas cotejadas en video. Haga clic aquí para descargar este archivo.
Video complementario 4: Colonia de queratinocitos rastreable. Imágenes tomadas cada 20 minutos por imágenes de células vivas cotejadas en video. Haga clic aquí para descargar este archivo.
Video complementario 5: Colonia de queratinocitos rastreable. Imágenes tomadas cada 20 minutos por imágenes de células vivas cotejadas en video. Haga clic aquí para descargar este archivo.
Discusión
Aquí, hemos detallado un método para el cultivo primario de queratinocitos humanos con el propósito de obtener imágenes de células vivas. Este método adapta las técnicas de cultivo celular existentes mediante siembra de baja densidad y cultivo a largo plazo para permitir estudios exitosos de imágenes de células vivas. El método preferido para la disociación de este tipo de células implica una digestión enzimática de dos pasos, que se ha demostrado que da lugar a queratinocitos, de los cuales el 3%-4% son capaces de convertirse en unidades formadoras de colonias14. El crecimiento in vitro de queratinocitos adultos y ancianos es un desafío, ya que muchas muestras simplemente no crecen.
Múltiples pasos son críticos para el objetivo de maximizar los rendimientos para mejorar el crecimiento. Se deben aislar estas células tan pronto como sea posible después de la recolección de tejido. Se mantiene una línea directa de comunicación con los cirujanos, y las muestras se recogen inmediatamente después de ser obtenidas del paciente. Se han hecho varias otras recomendaciones sobre las formas de preservar la integridad de los tejidos utilizando este método. Mantenga el tejido frío, manténgalo en los medios de recolección y procese el tejido de manera eficiente. Considere la posibilidad de agrupar muestras, si son pequeñas, para maximizar el crecimiento in vitro. Siempre caliente los reactivos durante al menos 20 min. Utilice Dispasa de eficacia demostrada y considere cortar tiras más pequeñas de tejido o extender el período de incubación si hay problemas para despegar la epidermis. Utilice el mínimo tiempo posible para la digestión con un tratamiento enzimático de elección y neutralice inmediatamente después de la incubación. Vuelva a suspender el pellet lo antes posible después de la centrifugación. Incluso después de hacer todo esto, espere que ocasionalmente haya muestras humanas adultas y ancianas que no crezcan, incluso en lo que parece ser la más ideal de las circunstancias.
El objetivo es colocar placas de queratinocitos en o cerca de la densidad clonal y rastrearlos mediante imágenes de células vivas; Este método se alinea bien con esos objetivos. Si el objetivo es aislar queratinocitos y observar la motilidad en diferentes condiciones o para un ensayo funcional como un ensayo de arañazo, un método alternativo a considerar es la técnica de explante de piel. Este enfoque libre de enzimas para aislar queratinocitos puede resultar en un mayor rendimiento celular 14,15,16.
Las modificaciones en los medios utilizados pueden ser importantes para la obtención de imágenes de células vivas. El medio seleccionado para promover el crecimiento de los queratinocitos tendrá un impacto en todas las fases del experimento. DMEM, 10% FBS y F-12 de Ham con celdas alimentadoras 3T3-J2 permitieron densidades de siembra más bajas, pero resultaron en varios problemas. Las células alimentadoras, a menos que se usen a baja densidad, oscurecieron el plano visual en el que se encontraban los queratinocitos, lo que dificultó el seguimiento. Usando DMEM, los fibroblastos permanecieron durante la duración de la obtención de imágenes de células vivas (~ 2 semanas). Además, existen otros problemas con los medios basados en suero que son importantes, incluyendo la promoción de la diferenciación (que impide el uso del software IncuCyte para la obtención de imágenes de células vivas debido a la falta de apariencia uniforme de las células) y el riesgo de posible contaminación del suero17. En medios sin suero, se necesita una mayor densidad de siembra que con DMEM, ya que se adhieren menos células. Las combinaciones de 154 CF + HKGS, Epilife + HKGS y Epilife + S7 han sido efectivas. Como recordatorio, siempre use medios frescos cuando use suplementos de crecimiento, ya que se degradan con el tiempo. Siempre pruebe el medio con al menos tres muestras al comenzar un nuevo protocolo para verificar que pueda soportar las células que se están cultivando. Los fabricantes de medios sin suero a menudo recomiendan el uso de colágeno de cola de rata (tipo 1)18. El colágeno ayuda con la unión inicial (lo que permite densidades de siembra más bajas) y la proliferación19.
Junto con el tipo de medio, otro factor que puede afectar los resultados es la densidad de siembra y la distribución de las células. El cultivo de queratinocitos se ve favorecido por la interacción célula-célula para la proliferación y, por lo tanto, las densidades de siembra más altas dan como resultado un crecimiento más prolífico20. Los diferentes medios y edades celulares requieren diferentes densidades de siembra para lograr el crecimiento clonal. Los experimentos generalmente se llevan a cabo con múltiples densidades de siembra para obtener tasas de crecimiento/tamaños de colonia apropiados para la aplicación de imágenes de células vivas deseada. Las densidades para el crecimiento clonal y el rastreo del linaje pueden ser diferentes de las necesarias para otras aplicaciones. Asegúrese de que la distribución de la siembra sea uniforme antes de permitir que las células se adhieran.
El uso de antibióticos durante el aislamiento y el crecimiento es controvertido. Se ha demostrado previamente que los antibióticos de uso común pueden tener un efecto inhibidor sobre la proliferación de queratinocitos21. Ante esto, muchos optan por no usar antibióticos después de limpiar la piel inicialmente antes del procesamiento. Esta aplicación de imágenes de células vivas implica varias semanas de crecimiento de la colonia, lo que aumenta el riesgo de contaminación. Es necesario sopesar el riesgo de perder semanas de muestras valiosas debido a la contaminación con el riesgo de una posible disminución de la proliferación de queratinocitos. Es posible que las aplicaciones más cortas no necesiten antibióticos, mientras que los períodos prolongados de imágenes de células vivas sí lo hacen.
Una limitación del cultivo de células para la obtención de imágenes de células vivas, al igual que para otras técnicas in vitro, es la relevancia indirecta desconocida. Además, el uso de células recién obtenidas frente a las pasadas puede producir resultados diferentes a medida que las características de la célula evolucionan a medida que el número de células aumenta20. Además, los resultados pueden verse influenciados por el entorno extrínseco uniforme. Este entorno uniforme puede representar una fortaleza o una limitación, dependiendo de los objetivos del estudio, particularmente cuando se distingue entre cambios intrínsecos y extrínsecos en el comportamiento celular.
Hay una gran cantidad de factores que deben tenerse en cuenta al cultivar queratinocitos con el fin de obtener imágenes de células vivas. El método presentado puede ayudar a simplificar el proceso. Ser capaz de realizar con éxito imágenes de células vivas de queratinocitos en estudios futuros permitirá una comprensión más granular del comportamiento proliferativo y diferenciador de los queratinocitos y los mecanismos de mantenimiento epidérmico.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Un agradecimiento especial a T. Richard Parenteau, MD/PhD, y Alexandra Charruyer, PharmD/PhD, por enseñarme a cultivar queratinocitos. Gracias a la Dra. Merisa Piper por proporcionarnos muestras para aislar los queratinocitos. Agradecimientos finales al Dr. Michael Rosenblum por permitirnos acceder a su sistema de imágenes de células vivas para completar los experimentos.
Materiales
| Name | Company | Catalog Number | Comments |
| .05% Trypsin-EDTA (1X), 100 mL | Gibco | 25300-054 | |
| 100 um cell filter | Corning | 352360 | |
| 15 cc Falcon | Corning | 352096 | |
| 50 cc conical Falcon | Corning | 352070 | |
| 6 well microplate | Corning | 3516 | |
| 70% reagent alcohol, 4 L | VWR Chemicals | BDH1164-4LP | Can alternatively dilute your own |
| Amphotericin B, 50 ml | Corning | 30-003-CF | Dilute to 5X (50 ug/mL) |
| Dipase, 100 ml | Corning | 354235 | Dilute 1:1 with HBSS, add 1x gentamycin, filter sterilize |
| Epilife, 50 mL | Gibco | MEP1500CA | Add HKGS, consider antibiotics |
| Fetal Bovine Serum Value Heat Inactivated FBS, 500 ml | Gibco | A52568-01 | FBS |
| Forceps | |||
| Gentamicin, 10 ml | Gibco | 15750-060 | Dilute to 50 ug/ml for 5X |
| Hank's Balanced Salt Solution (1X), 500 ml | Gibco | 14170-112 | (HBSS) |
| HBSS 5X PSAG | This is HBSS + 5X concentrations of Pen/Strep/Ampho/Gent | ||
| Hibiclens, Gallon | Molnlycke | 57591 | Dilute to 10% using deionized H20 |
| Human Keratinocyte Growth Serum, 5 mL | Gibco | S-001-5 | Added to epilife |
| Penicillin/Streptomycin, 100 ml | Corning | 30-002-Cl | Dilute to 5X (comes in 100x stock) for 5X PSA - 1X for media changes |
| Petri Dish 100 mm x 15 mm | Fisher Scientific | FB0875713 | |
| Scalpel Blade NO 23 | VWR | 76457-480 | |
| TrypLE | Gibco | 12604021 | A less caustic alternative to regular Trypsin |
| Trypsin Neutralizing Solution | (TNS), this is HBSS with 10% FBS (some use less serum, 5%) |
Referencias
- Mateu, R., et al. Functional differences between neonatal and adult fibroblasts and keratinocytes: Donor age affects epithelial-mesenchymal crosstalk in vitro. Int J Mol Med. 38 (4), 1063-1074 (2016).
- Handl, J., Čapek, J., Majtnerová, P., Báčová, J., Roušar, T. The effect of repeated passaging on the susceptibility of human proximal tubular HK-2 cells to toxic compounds. Phy Res Aca Sci Boh. 69 (4), 731-738 (2020).
- Xiao, T., et al. Short cell cycle duration is a phenotype of human epidermal stem cells. Stem Cell Res The. 15 (1), 76 (2024).
- Noujarède, J., et al. Sphingolipid paracrine signaling impairs keratinocyte adhesion to promote melanoma invasion. Cell Rep. 42 (12), 113586 (2023).
- Sun, M., et al. An image-based dynamic high-throughput analysis of adherent cell migration. Bio-prol. 11 (6), e3957 (2021).
- Chapman, S., McDermott, D. H., Shen, K., Jang, M. K., McBride, A. A. The effect of Rho kinase inhibition on long-term keratinocyte proliferation is rapid and conditional. Stem Cell Res The. 5 (2), 60 (2014).
- U.S. Department of Health and Human Services. . Biosafety in microbiological and biomedical laboratories. , (2020).
- Poumay, Y., Roland, I. H., Leclercq-Smekens, M., Leloup, R. Basal detachment of the epidermis using dispase: tissue spatial organization and fate of integrin alpha 6 beta 4 and hemidesmosomes. J Inv Der. 102 (1), 111-117 (1994).
- Tsuji, K., et al. Effects of different cell-detaching methods on the viability and cell surface antigen expression of synovial mesenchymal stem cells. CellTra. 26 (6), 1089-1102 (2017).
- Rheinwald, J. G., Green, H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 6 (3), 331-343 (1975).
- Boisseau, A. M., et al. Production of epidermal sheets in a serum free culture system: a further appraisal of the role of extracellular calcium. J Der Sci. 3 (2), 111-120 (1992).
- Roshan, A., et al. Human keratinocytes have two interconvertible modes of proliferation. Nat Cell Bio. 18 (2), 145-156 (2016).
- Nanba, D., et al. EGFR-mediated epidermal stem cell motility drives skin regeneration through COL17A1 proteolysis. J Cell Bio. 220 (11), e202012073 (2021).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Der. 28 (2), 107-112 (2019).
- Guo, A., Jahoda, C. A. B. An improved method of human keratinocyte culture from skin explants: cell expansion is linked to markers of activated progenitor cells. Exp Derm. 18 (8), 720-726 (2009).
- Orazizadeh, M., Hashemitabar, M., Bahramzadeh, S., Dehbashi, F. N., Saremy, S. Comparison of the enzymatic and explant methods for the culture of keratinocytes isolated from human foreskin. Bio Rep. 3 (3), 304-308 (2015).
- Usta, S. N., Scharer, C. D., Xu, J., Frey, T. K., Nash, R. J. Chemically defined serum-free and xeno-free media for multiple cell lineages. Ann of tra med. 2 (10), 97 (2014).
- Lenihan, C., Rogers, C., Metcalfe, A. D., Martin, Y. H. The effect of isolation and culture methods on epithelial stem cell populations and their progeny-toward an improved cell expansion protocol for clinical application. Cyt. 16 (12), 1750-1759 (2014).
- Bernstam, L. I., Vaughan, F. L., Bernstein, I. A. Keratinocytes grown at the air-liquid interface. In Vitro Cell Dev Biol. 22 (12), 695-705 (1986).
- Ponce, L., et al. Isolation and cultivation of primary keratinocytes from piglet skin for compartmentalized co-culture with dorsal root ganglion neurons. J Cell Bio. 2 (2), 93-115 (2017).
- Nygaard, U. H., et al. Antibiotics in cell culture: friend or foe? Suppression of keratinocyte growth and differentiation in monolayer cultures and 3D skin models. Exp Der. 24 (12), 964-965 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados