Method Article
Génération de cultures primaires pour l’imagerie de cellules vivantes kératinocytes
Dans cet article
Résumé
Ce protocole décrit la culture de kératinocytes fraîchement obtenus (passage 0) pour une utilisation en imagerie de cellules vivantes.
Résumé
Le suivi des cellules souches et du comportement des progéniteurs engagés au niveau de la cellule unique dans la peau humaine a été difficile à la fois in vivo et in vitro. L’imagerie des cellules vivantes a permis des progrès significatifs dans la capacité d’identifier les différences entre les cellules souches kératinocytaires et le comportement des progéniteurs engagés. L’imagerie de cellules vivantes est une méthode évolutive et quelque peu difficile pour étudier le comportement des kératinocytes in vitro. Ce protocole a été développé pour cultiver des kératinocytes à faible densité d’ensemencement, permettant une photographie en accéléré à relativement long terme et un suivi du comportement cellulaire individuel. Les kératinocytes de passage 0 sont cultivés à une densité clonale, et la photographie en accéléré permet de documenter les divisions cellulaires individuelles et le moment de leur apparition. Pour une pertinence biologique maximale, des kératinocytes humains fraîchement isolés sont placés in vitro. Cette approche est axée sur la prolifération. Cependant, ce protocole peut être adapté pour être utilisé dans d’autres applications d’imagerie de cellules vivantes mesurant le comportement des cellules individuelles, telles que la mesure de la migration cellulaire, de la cicatrisation des plaies et de la motilité.
Introduction
L’objectif de ce protocole est de fournir la possibilité de suivre des kératinocytes individuels en culture sur une période relativement longue (plusieurs semaines) grâce à de faibles densités d’ensemencement et à la photographie en accéléré. L’imagerie de cellules vivantes à faible densité offre aux chercheurs la possibilité de visualiser le comportement cellulaire in vitro à un seul niveau cellulaire. Bien qu’elle ne soit pas possible dans la culture cellulaire conventionnelle, l’imagerie des cellules vivantes permet de développer des arbres de lignage en temps réel, sans utiliser de marquage, à partir desquels on peut obtenir des informations sur la cinétique de division, telles que la durée du cycle cellulaire et la proportion de divisions de prolifération et de différenciation dans une colonie. Il permet également d’étudier la migration et la motilité cellulaires. Cela peut être techniquement difficile, avec des aspects qui doivent être optimisés, en fonction du type de cellule et des données à capturer. D’autres laboratoires ont utilisé des kératinocytes néonatals et/ou des kératinocytes passés qui sont plus faciles à cultiver1.
Cependant, les lignées cellulaires qui subissent des passages répétés ont un comportement et une morphologie significativement différents de leur état in vivo 2. Pour la plus grande pertinence biologique afin d’obtenir le comportement le plus proche in vivo , des cellules de passage 0 sont utilisées. Dans les populations de kératinocytes, il est possible de faire la distinction entre la cellule souche et le progéniteur engagé sans tri ni étiquetage, car il existe des différences distinctes dans le comportement de division qui peuvent être observées via l’imagerie de cellules vivantes3.
Nous utilisons l’imagerie de cellules vivantes pour étudier la cinétique de prolifération des kératinocytes. Une approche similaire a été utilisée pour étudier la motilité des cellules de mélanome cutané co-cultivées avec les kératinocytes4, la migration cellulaire adhérente des tests de grattage5 et la façon dont les inhibiteurs de ROCK affectent la prolifération des kératinocytes6. Ce protocole est spécialement conçu pour la culture de cellules afin de faciliter le traçage de la lignée par imagerie de cellules vivantes, bien qu’il puisse être adapté à d’autres fins.
Ce protocole décrit l’isolement des kératinocytes de passage 0 à des fins d’imagerie de cellules vivantes, traite des complications qui peuvent survenir et fournit des considérations qui peuvent nécessiter des modifications au protocole (Figure 1).
Protocole
L’approbation du Comité de la recherche humaine de l’établissement est requise pour l’utilisation de tissus humains. Les échantillons humains pour la recherche proviennent souvent de sources commerciales (par exemple, ATCC, Lifeline cell technology et Zen-Bio). Nos études utilisent des tissus jetés au moment des interventions chirurgicales ou des échantillons de biopsie cutanée prélevés spécifiquement à des fins d’étude. Ces situations nécessitent des approbations et des procédures de consentement différentes. Tous les tissus sont obtenus après l’approbation du Comité de recherche humaine de l’UCSF, en utilisant un consentement éclairé écrit et conformément aux principes de la Déclaration d’Helsinki.
1. Séparation de l’épiderme du derme
- S’assurer que les approbations appropriées sont obtenues pour utiliser des tissus humains pour l’étude.
- Prélevez un échantillon de peau et transportez-le dans un contenant isotherme avec un sac de glace. Placez l’échantillon dans un milieu de prélèvement contenant une concentration 5x de pénicilline, de streptomycine et d’amphotéricine.
REMARQUE : La quantité requise dépendra de l’application. D’après notre expérience, environ 1 000 000 de kératinocytes parcm2 sont obtenus à partir de peaux adultes et âgées. Cependant, cela peut varier considérablement pour chaque échantillon.- Placez les prépuces néonatals dans un milieu de culture cellulaire et commencez la procédure d’isolement des kératinocytes au plus tard 48 heures après la circoncision pour minimiser la mort cellulaire. Conservez le mouchoir à 4 °C jusqu’au traitement. Le traitement des échantillons adultes et âgés commence généralement quelques heures après la collecte.
- Obtenir l’accès à une enceinte de biosécurité avec un équipement de niveau BS2 conçu pour travailler avec des agents qui causent des maladies par ingestion, muqueuse ou exposition percutanée7. Assurez-vous que l’enceinte de biosécurité est stérilisée aux UV pendant au moins 15 minutes et que toutes les surfaces sont pulvérisées avec de l’alcool à 70 % avant utilisation.
- Mettez des gants, vaporisez le récipient de collecte avec de l’alcool à 70 % et placez le récipient dans la hotte. Placez un coussin de refroidissement sous le tissu pour l’empêcher de se réchauffer à température ambiante et pour maintenir son intégrité. Si le tissu est extrêmement gros, coupez une partie pour le traitement et gardez le reste humide dans le récipient de collecte.
REMARQUE : Comme de nombreux spécimens âgés ont une grosse peau abdominale ou mammaire provenant de chirurgies, il faut du temps pour couper et traiter le tissu. Le mouchoir ne doit jamais être placé directement sur le coussinet, car le froid extrême peut le faire geler. Au lieu de cela, il doit être placé sur une surface intermédiaire, telle qu’une dalle de marbre. - Placez deux boîtes de Pétri de 100 mm x 15 mm et un scalpel chirurgical stérile #23 dans la capuche.
- Ouvrez les boîtes de Pétri et placez-les sur la surface de l’armoire de manière à ce que les surfaces intérieures de chaque boîte soient orientées vers le haut. Ajouter 10 ml de gluconate de chlorhexidine à 10 % dans l’une des boîtes de Pétri. Ajouter 10 ml de 5x pénicilline/streptomycine/amphotéricine/gentamycine dans la solution saline équilibrée de Hank (HBSS ; 5x) à 2 autres moitiés de boîte de Pétri (voir le tableau des matériaux).
- Préparez une plaque à 6 puits pour l’étape de dispase. Pour les tissus néonatals, utilisez 3 mL de Dispase par puits. Pour les échantillons de tissus âgés, utilisez 4 ml. L’utilisation de quantités insuffisantes de Dispase pour le volume de tissu peut entraîner des difficultés à séparer l’épiderme du derme.
- À l’aide d’un scalpel, coupez le tissu en petits morceaux afin qu’il soit mieux pénétré par la dispase. La dispase ne pénètre que jusqu’à 5 mm des bords du tissu, alors coupez de longues bandes de tissu de 0,5 à 1 cm de large. S’il n’est pas coupé assez petit, la séparation de l’épiderme du derme ne se produira pas.
- Coupez les tissus plus épais en petits morceaux. Coupez le prépuce néonatal en 3 ou 4 morceaux (~5 mm x 7 mm). Utilisez un maximum de deux prépuces entiers par puits de Dispase. Les lambeaux abdominaux superficiels ont tendance à être beaucoup plus minces, avec peu ou pas de tissu sous-cutané, coupez-les en bandes plus longues (bandes de ~5 mm x 15 mm).
- Placez un maximum de quatre bandes par puits de Dispase. Si le tissu obtenu a beaucoup de graisse sous-cutanée attachée, coupez le tissu sous-cutané pour aider Dispase à pénétrer complètement dans le tissu. Si le tissu est coupé trop petit, un microscope de dissection peut être nécessaire pour déterminer quel côté est épidermique et quel côté est dermique lors du décollement de l’épiderme. Tirer du mauvais côté de la peau peut entraîner un traumatisme tissulaire supplémentaire.
- Placez le côté épidermique tissulaire vers le bas dans la première boîte de Pétri préparée à l’étape 1.6, contenant 10 % de gluconate de chlorhexidine, pendant 10 à 20 s, puis transférez le côté épidermique tissulaire vers le bas dans la deuxième boîte de Pétri, contenant 5 fois la pénicilline/streptomycine ou l’amphotéricine (PSA) avec HBSS, et agitez pendant 10 à 20 s. Transférez le tissu du côté épidermique vers le bas dans la troisième boîte de Pétri, contenant à nouveau 5 fois PSA avec HBSS, et agitez pendant 10 secondes supplémentaires. Le traitement de plusieurs échantillons avec la même solution est acceptable.
- Transférez le tissu, côté épidermique vers le bas, dans la plaque de dispase à 6 puits préparée à l’étape 1.7.
REMARQUE : Nous recommandons le côté épidermique vers le bas selon notre convention. D’autres protocoles recommandent le derme versle bas 8. All Dispase n’est pas aussi efficace. Le peeling de l’épiderme d’une peau âgée s’est avéré difficile avec certains produits, même à des concentrations jusqu’à 4 fois le niveau recommandé par le fabricant. Cela a entraîné une perte de temps et d’échantillons. Les entreprises utilisent des unités non normalisées pour Dispase, ce qui rend difficile l’identification des différences de concentration entre les marques. En raison de ces défis, l’utilisation de l’une des marques Dispase répertoriées dans la table des matériaux est fortement recommandée. - Étiquetez la plaque à 6 puits contenant la dispase et les échantillons, puis transférez-les à 4 °C. Incuber des échantillons néonatals pendant 16 à 18 h dans Dispase et des échantillons adultes/âgés pendant 24 h.
REMARQUE : Il existe un protocole alternatif de 2 h qui peut être utilisé pour les échantillons, où l’échantillon est placé dans Dispase à 37 °C pendant 2 h, puis l’épiderme est pelé. Malheureusement, cela ne fonctionne pas toujours et l’intégrité du tissu peut être compromise après l’incubation, ce qui entraîne la perte d’un échantillon. L’incubation d’une nuit est préférable dans la mesure du possible.
2. Isolement des kératinocytes
- Placez la trypsine-EDTA à 0,05 % (ou TrypLE), la solution neutralisante de trypsine et le milieu kératinocytaire dans un bain-marie à 37 °C 20 minutes avant de commencer la prochaine série d’étapes.
- Retirez une plaque à 6 puits à 4 °C, vaporisez-la d’éthanol à 70 % et placez-la dans une enceinte de biosécurité préparée (voir étape 1.3).
- Placez les pinces dentées stériles et les pinces non dentées dans un tube conique de 50 ml contenant 20 ml d’éthanol à 70 %. Si vous êtes à l’extérieur de la hotte au départ, vaporisez une pince avec de l’éthanol à 70 % avant de la mettre dans la hotte.
- À l’aide d’une pince stérilisée chimiquement, saisissez un morceau de tissu et placez-le sur une surface stérile, côté épidermique vers le haut (à l’aide d’une boîte de Pétri ou de l’intérieur de la moitié supérieure de la plaque à 6 puits). Tenez la partie dermique du tissu à l’aide d’une pince dentée à l’aide de la main non dominante et saisissez fermement l’épiderme avec la pince non dentée et retirez-le d’un bord à l’autre. Il doit se détacher en douceur en un seul morceau.
- Placez l’épiderme à l’intérieur de la lèvre d’un tube conique de 15 ml. Chaque tube conique de 15 mL doit avoir un épiderme de deux prépuces maximum.
- Travailler efficacement ; Si le tissu se dessèche, le rendement sera compromis. Si la dispase n’a pas pénétré correctement dans le tissu, il peut être difficile de décoller l’épiderme. Dans un tel cas, retirez/grattez l’épiderme du derme sous-jacent. Cela entraîne également un rendement beaucoup plus faible et n’est pas recommandé.
- Ajoutez 4 ml de trypsine-EDTA à 0,05 % dans le tube conique de 15 ml, puis fermez et retournez le tube en vous assurant que tout l’épiderme est suspendu dans la trypsine et non collé sur le côté du tube/du couvercle. Placer dans un bain-marie à 37 °C pendant 10 min. Agitez les cellules toutes les 2 minutes à la main.
REMARQUE : La trypsinisation pendant plus de 10 minutes peut entraîner un rendement cellulaire plus faible. De plus, si l’intégrité des protéines de surface cellulaire est une préoccupation, utilisez TrypLE car il est plus spécifique à son site de clivage, ce qui entraîne moins de dommages aux cellules et il a été démontré qu’il ne diminue pas de manière significative l’expression de l’antigène de surface par rapport à la trypsine-EDTA9. De plus, le bain-marie est une source fréquente de contamination, alors assurez-vous qu’il est nettoyé régulièrement. Changez l’eau régulièrement avec de l’eau déminéralisée contenant la solution aquaguard-2. - Placez un tube conique de 50 mL dans l’enceinte de sécurité biologique. Dévissez le couvercle et placez une passoire à cellules de 100 μm sur l’ouverture du tube conique.
- Retirer du bain-marie le tube conique de 15 mL contenant l’échantillon digéré, le sécher à fond et l’asperger d’alcool à 70 % avant de le remettre dans l’enceinte de sécurité biologique. Tapotez le tube conique 3x contre la surface de la hotte puis retournez-le 6x. Répétez le cycle de taraudage-inversion 3x.
- Ajouter 6 ml de solution neutralisante de trypsine dans le tube conique. Verser à travers la passoire cellulaire dans le tube conique de 50 ml à partir de l’étape 2.7.
- Rincez le tube conique de 15 mL contenant l’échantillon avec 5 mL de solutions neutralisantes de trypsine (TNS). Verser à travers une passoire à cellule dans le tube conique de 50 ml. Centrifugeuse à 300 x g pendant 5 min.
- Retirer immédiatement de la centrifugeuse et pipeter le surnageant pour éviter la perte de cellules dans le milieu. Il ne devrait rester que le granulé avec une petite collection de liquide. Il peut être difficile de voir la pastille à partir d’échantillons de tissus plus petits.
REMARQUE : Il y a de la trypsine présente dans le surnageant, il est donc préférable d’en éliminer autant que possible sans perdre la pastille. - Remettre la pastille de kératinocytes en suspension dans 2 mL de milieu kératinocytaire.
REMARQUE : Il y a deux considérations ici. Tout d’abord, quels médias utiliser. À cette fin, il est recommandé d’utiliser des milieux sans sérum et sans collagène. Historiquement, la norme pour la culture de cellules kératinocytes a été le milieu d’aigle modifié (DMEM) de Dulbecco + 10 % de sérum de veau fœtal (FBS) + le F-12 de Ham sur une couche nourricière de fibroblastes (3t3-J2s)10. Cependant, avec l’avènement des milieux sans sérum et la disponibilité du collagène, de multiples autres possibilités restent viables (voir discussion)11. La deuxième considération est de savoir si l’utilisation d’antibiotiques dans le milieu de culture est appropriée pour l’application d’imagerie de cellules vivantes. Cela dépendra de la durée de l’imagerie et de l’expérience avec le système d’imagerie. Les colonies sont imagées sur plusieurs semaines à l’aide d’un système d’imagerie partagé, ce qui fait de l’utilisation d’antibiotiques une approche privilégiée malgré l’impact potentiel sur les cultures (voir la discussion). La pénicilline, la streptomycine, l’amphotéricine B et le milieu kératinocytaire contenant de la gentamicine sont utilisés pendant la remise en suspension, suivie d’un passage à un milieu contenant de la pénicilline/streptomycine après le changement initial de milieu. Cette méthode a permis d’empêcher efficacement la contamination lors de l’imagerie prolongée de cellules vivantes. - Comptez les cellules et ensemencez la plaque (voir la discussion pour les commentaires sur le choix de la densité d’ensemencement). Pour assurer une distribution uniforme de l’ensemencement, avant l’ensemencement, remettre en suspension les cellules kératinocytes dans la quantité totale de milieu à plaquer. Après une légère agitation par inversion, agiter légèrement pendant 1 à 2 s, et plaquer. Ensuite, déplacez la microplaque en croix (haut-bas, gauche-droite) 3 fois dans l’incubateur.
- Après 24 h, placez la plaque dans l’incubateur du système d’imagerie de cellules vivantes. Effectuez une imagerie de cellules vivantes à 10x avec des images prises toutes les 20 min. Placez les échantillons à 37 °C et 5 % de CO2 dans l’incubateur fixé au microscope.
Résultats
Étant donné les multiples variables qui peuvent être manipulées dans cette méthode et qui aboutissent finalement à une variété de résultats, nous décrivons ici les erreurs courantes et les résultats qui en résultent, ainsi que des résultats exemplaires et les circonstances qui les sous-tendent.
Comme pour toute technique de culture cellulaire, la contamination est une possibilité (Vidéo supplémentaire 1). En plus des techniques de stérilisation prudentes, envisagez d’utiliser des antibiotiques dans les milieux, surtout si vous cultivez pendant de longues périodes. Une contamination fréquente a été observée lorsque les cellules cultivées ont été transportées vers un système d’imagerie situé à un autre endroit sans utiliser d’antibiotiques. Veuillez consulter la section de discussion pour les inconvénients de l’utilisation des antibiotiques.
Comme indiqué dans le protocole, la sélection des supports est essentielle. Le DMEM avec 10 % de FBS et le F-12 de Ham sur une couche nourricière de fibroblastes a d’abord été utilisé. Cependant, il y a eu des problèmes avec cette sélection (Vidéo supplémentaire 2). La densité d’ensemencement initiale des fibroblastes utilisés était trop élevée et, au fil du temps, les fibroblastes semblaient se dilater, obscurcissant la vue des kératinocytes. La réduction de la densité d’ensemencement des fibroblastes a résolu le problème de l’obscurcissement des fibroblastes. Cependant, de plus, les kératinocytes semblaient se différencier plus rapidement qu’avec un milieu sans sérum, ce qui entraînait des zones non uniformes de kératinocytes, qui étaient difficiles à suivre à des fins de traçage de la lignée (vidéo supplémentaire 3). D’autres problèmes avec les médias basés sur DMEM sont développés dans la discussion.
Après avoir rencontré des problèmes avec le F-12 traditionnel de DMEM/FBS/Ham, les milieux sans sérum ont été choisis comme alternative. Avec des milieux de culture complétés par des HKGS et des kératinocytes à la densité clonale, il y avait des colonies uniformes qui pouvaient être suivies (vidéo supplémentaire 4, vidéo supplémentaire 5). Avec les milieux libres sériques, la différenciation se produit plus lentement (peut-être en raison d’un calcium plus faible), et de nombreuses cellules adhérentes ne se divisent jamais mais ne se détachent pas (comme elles le font dans d’autres milieux ; Vidéo supplémentaire 4, Vidéo supplémentaire 3).
La densité d’ensemencement peut affecter la capacité de suivre les cellules. Trop de cellules peut entraîner une incapacité à suivre les cellules avec précision, et trop peu de cellules, à l’inverse, entraînent une croissance insuffisante. De nombreux fabricants de milieux sans sérum recommandent d’associer leur milieu défini avec du collagène, ce qui permet d’obtenir des densités de semis plus faibles (Figure 2). Voir la discussion pour plus d’informations sur ce sujet.
La différenciation des kératinocytes est évidente morphologiquement par de grandes cellules aplaties et une morphologie empilée. Voir la vidéo supplémentaire 2. L’évaluation de la différenciation terminale est un manque de division sur 48 h 3,12,13.
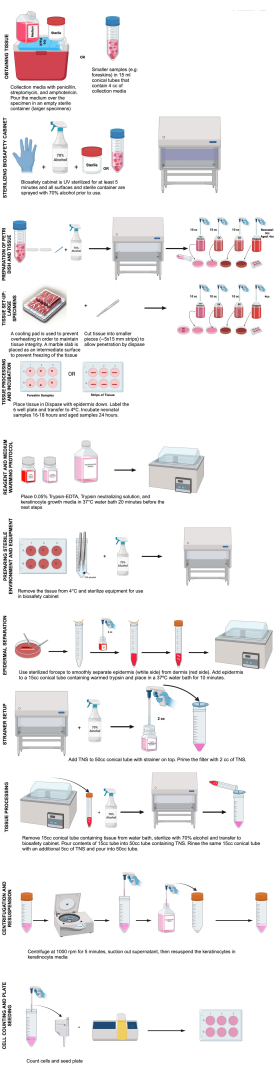
Figure 1 : Étapes d’isolement des kératinocytes. Ce schéma illustre les étapes de l’isolement des kératinocytes telles que décrites dans ce protocole. Créé en BioRender.com Cliquez ici pour voir une version agrandie de cette figure.

Figure 2 : Adhérence cellulaire et formation des colonies. La différence dans l’adhérence cellulaire et la formation de colonies à 2 jours 23 h avec et sans collagène. Le collagène améliore considérablement l’adhérence initiale des kératinocytes. Créé en BioRender.com Cliquez ici pour voir une version agrandie de cette figure.
Vidéo supplémentaire 1 : Contamination d’une colonie de kératinocytes. Images prises toutes les 20 minutes par imagerie de cellules vivantes rassemblées en vidéo. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 2 : Croissance rapide des kératinocytes à l’aide d’un feeder traditionnel et de milieux à base de DMEM. Images prises toutes les 20 minutes par imagerie de cellules vivantes rassemblées en vidéo. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 3 : Différenciation accrue des kératinocytes à l’aide de milieux traditionnels basés sur un feeder et un DMEM. Images prises toutes les 20 minutes par imagerie de cellules vivantes rassemblées en vidéo. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 4 : Colonie de kératinocytes traçable. Images prises toutes les 20 minutes par imagerie de cellules vivantes rassemblées en vidéo. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire 5 : Colonie de kératinocytes traçable. Images prises toutes les 20 minutes par imagerie de cellules vivantes rassemblées en vidéo. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ici, nous avons détaillé une méthode de culture primaire de kératinocytes humains à des fins d’imagerie de cellules vivantes. Cette méthode adapte les techniques de culture cellulaire existantes en utilisant un placage à faible densité et une culture à long terme pour permettre des études d’imagerie de cellules vivantes réussies. La méthode privilégiée pour la dissociation de ce type de cellule implique une digestion enzymatique en deux étapes, dont il a été démontré qu’elle aboutit à des kératinocytes, dont 3 à 4 % sont capables de devenir des unités formant des colonies14. La croissance in vitro de kératinocytes adultes et âgés est difficile, car de nombreux échantillons ne parviennent tout simplement pas à se développer.
Plusieurs étapes sont essentielles pour maximiser les rendements afin d’améliorer la croissance. Il faut isoler ces cellules dès que possible après le prélèvement de tissus. Une ligne de communication directe avec les chirurgiens est maintenue et les échantillons sont prélevés immédiatement après avoir été obtenus du patient. Plusieurs autres recommandations ont été formulées sur les moyens de préserver l’intégrité des tissus à l’aide de cette méthode. Gardez les tissus au frais, conservez les tissus dans les milieux de collecte et traitez les tissus efficacement. Envisagez de regrouper les échantillons, s’ils sont petits, pour maximiser la croissance in vitro. Réchauffez toujours les réactifs pendant au moins 20 min. Utilisez Dispase dont l’efficacité a été démontrée et envisagez de couper de plus petites bandes de tissu ou de prolonger la période d’incubation s’il y a des problèmes pour décoller l’épiderme. Utilisez le minimum de temps possible pour la digestion avec un traitement enzymatique de votre choix et neutralisez immédiatement après l’incubation. Remettez le granulé en suspension dès que possible après la centrifugation. Même après avoir fait tout cela, attendez-vous à ce qu’il y ait occasionnellement des échantillons d’adultes et d’humains âgés qui ne grandissent pas, même dans ce qui semble être les circonstances les plus idéales.
L’objectif est de plaquer les kératinocytes à une densité clonale ou proche de celle-ci et de les suivre à l’aide de l’imagerie de cellules vivantes ; Cette méthode s’aligne bien avec ces objectifs. Si l’objectif est d’isoler les kératinocytes et d’observer la motilité dans différentes conditions ou pour un test fonctionnel comme un test de grattage, une autre méthode à envisager est la technique de l’explant de peau. Cette approche sans enzyme pour isoler les kératinocytes peut entraîner des rendements cellulaires plus élevés 14,15,16.
Les modifications apportées aux milieux utilisés peuvent être importantes pour l’imagerie de cellules vivantes. Le milieu choisi pour favoriser la croissance des kératinocytes aura un impact sur toutes les phases de l’expérience. Le DMEM, 10 % FBS et le F-12 de Ham avec des cellules d’alimentation 3T3-J2 ont permis des densités de semis plus faibles, mais ont entraîné plusieurs problèmes. Les cellules nourricières, à moins d’être utilisées à faible densité, obscurcissaient le plan visuel sur lequel se trouvaient les kératinocytes, ce qui rendait le suivi plus difficile. En utilisant le DMEM, les fibroblastes sont restés pendant toute la durée de l’imagerie de cellules vivantes (~2 semaines). En outre, il existe d’autres problèmes importants avec les milieux sériques, notamment la promotion de la différenciation (qui empêche l’utilisation du logiciel IncuCyte pour l’imagerie des cellules vivantes en raison du manque d’uniformité de l’apparence des cellules) et le risque de contamination possible par le sérum17. Dans les milieux sans sérum, une densité de semis plus élevée est nécessaire qu’avec le DMEM, car moins de cellules adhèrent. Les combinaisons de 154 CF + HKGS, Epilife + HKGS et Epilife + S7 ont toutes été efficaces. Pour rappel, utilisez toujours du milieu frais lorsque vous utilisez des suppléments de croissance car ils se dégradent avec le temps. Testez toujours le milieu avec au moins trois échantillons lorsque vous commencez un nouveau protocole pour vérifier qu’il peut supporter les cellules en culture. Les fabricants de milieux sans sérum recommandent souvent l’utilisation de collagène de queue de rat (type 1)18. Le collagène aide à l’attachement initial (permettant des densités de semis plus faibles) et à la prolifération19.
Outre le type de milieu, un autre facteur qui peut affecter les résultats est la densité d’ensemencement et la distribution des cellules. La culture de kératinocytes est facilitée par l’interaction cellule-cellule pour la prolifération, et donc, des densités d’ensemencement plus élevées entraînent une croissance plus prolifique20. Des milieux et des âges cellulaires différents nécessitent des densités d’ensemencement variables pour obtenir une croissance clonale. Les expériences sont généralement menées avec plusieurs densités d’ensemencement afin d’obtenir des taux de croissance et des tailles de colonie appropriés pour l’application d’imagerie de cellules vivantes souhaitée. Les densités pour la croissance clonale et le traçage de la lignée peuvent être différentes de celles nécessaires pour d’autres applications. Assurez-vous que la distribution de l’ensemencement est uniforme avant de permettre aux cellules d’adhérer.
L’utilisation d’antibiotiques pendant l’isolement et la croissance est controversée. Il a déjà été démontré que les antibiotiques couramment utilisés peuvent avoir un effet inhibiteur sur la prolifération des kératinocytes21. Compte tenu de cela, beaucoup choisissent de ne pas utiliser d’antibiotiques après avoir nettoyé la peau avant le traitement. Cette application d’imagerie de cellules vivantes implique plusieurs semaines de croissance de colonies, ce qui augmente le risque de contamination. Le risque de perdre des semaines de temps/d’échantillons précieux en raison de la contamination doit être mis en balance avec le risque d’une éventuelle diminution de la prolifération des kératinocytes. Les applications plus courtes peuvent ne pas nécessiter d’antibiotiques, contrairement aux longues périodes d’imagerie de cellules vivantes.
Une limitation de la culture de cellules pour l’imagerie de cellules vivantes, comme pour d’autres techniques in vitro, est la pertinence in vivo inconnue. De plus, l’utilisation de cellules fraîchement obtenues par rapport à des cellules passées peut produire des résultats différents à mesure que les caractéristiques des cellules évoluent à mesure que le nombre de passages augmente de20. De plus, les résultats peuvent être influencés par l’environnement extrinsèque uniforme. Cet environnement uniforme peut représenter soit une force, soit une limitation, selon les objectifs de l’étude, en particulier lorsqu’il s’agit de distinguer les changements intrinsèques et extrinsèques dans le comportement cellulaire.
Il y a une pléthore de facteurs à prendre en compte lors de la culture de kératinocytes à des fins d’imagerie de cellules vivantes. La méthode présentée peut aider à simplifier le processus. Être en mesure d’effectuer avec succès l’imagerie de cellules vivantes de kératinocytes dans de futures études permettra une compréhension plus granulaire du comportement prolifératif et différenciatif des kératinocytes et des mécanismes de maintenance de l’épiderme.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Un merci spécial à T. Richard Parenteau, MD/PhD, et Alexandra Charruyer, PharmD/PhD, pour m’avoir appris à cultiver des kératinocytes. Merci à Merisa Piper MD de nous avoir fourni des échantillons pour isoler les kératinocytes. Enfin, merci à Michael Rosenblum MD de nous avoir permis d’accéder à son système d’imagerie de cellules vivantes pour réaliser les expériences.
matériels
| Name | Company | Catalog Number | Comments |
| .05% Trypsin-EDTA (1X), 100 mL | Gibco | 25300-054 | |
| 100 um cell filter | Corning | 352360 | |
| 15 cc Falcon | Corning | 352096 | |
| 50 cc conical Falcon | Corning | 352070 | |
| 6 well microplate | Corning | 3516 | |
| 70% reagent alcohol, 4 L | VWR Chemicals | BDH1164-4LP | Can alternatively dilute your own |
| Amphotericin B, 50 ml | Corning | 30-003-CF | Dilute to 5X (50 ug/mL) |
| Dipase, 100 ml | Corning | 354235 | Dilute 1:1 with HBSS, add 1x gentamycin, filter sterilize |
| Epilife, 50 mL | Gibco | MEP1500CA | Add HKGS, consider antibiotics |
| Fetal Bovine Serum Value Heat Inactivated FBS, 500 ml | Gibco | A52568-01 | FBS |
| Forceps | |||
| Gentamicin, 10 ml | Gibco | 15750-060 | Dilute to 50 ug/ml for 5X |
| Hank's Balanced Salt Solution (1X), 500 ml | Gibco | 14170-112 | (HBSS) |
| HBSS 5X PSAG | This is HBSS + 5X concentrations of Pen/Strep/Ampho/Gent | ||
| Hibiclens, Gallon | Molnlycke | 57591 | Dilute to 10% using deionized H20 |
| Human Keratinocyte Growth Serum, 5 mL | Gibco | S-001-5 | Added to epilife |
| Penicillin/Streptomycin, 100 ml | Corning | 30-002-Cl | Dilute to 5X (comes in 100x stock) for 5X PSA - 1X for media changes |
| Petri Dish 100 mm x 15 mm | Fisher Scientific | FB0875713 | |
| Scalpel Blade NO 23 | VWR | 76457-480 | |
| TrypLE | Gibco | 12604021 | A less caustic alternative to regular Trypsin |
| Trypsin Neutralizing Solution | (TNS), this is HBSS with 10% FBS (some use less serum, 5%) |
Références
- Mateu, R., et al. Functional differences between neonatal and adult fibroblasts and keratinocytes: Donor age affects epithelial-mesenchymal crosstalk in vitro. Int J Mol Med. 38 (4), 1063-1074 (2016).
- Handl, J., Čapek, J., Majtnerová, P., Báčová, J., Roušar, T. The effect of repeated passaging on the susceptibility of human proximal tubular HK-2 cells to toxic compounds. Phy Res Aca Sci Boh. 69 (4), 731-738 (2020).
- Xiao, T., et al. Short cell cycle duration is a phenotype of human epidermal stem cells. Stem Cell Res The. 15 (1), 76 (2024).
- Noujarède, J., et al. Sphingolipid paracrine signaling impairs keratinocyte adhesion to promote melanoma invasion. Cell Rep. 42 (12), 113586 (2023).
- Sun, M., et al. An image-based dynamic high-throughput analysis of adherent cell migration. Bio-prol. 11 (6), e3957 (2021).
- Chapman, S., McDermott, D. H., Shen, K., Jang, M. K., McBride, A. A. The effect of Rho kinase inhibition on long-term keratinocyte proliferation is rapid and conditional. Stem Cell Res The. 5 (2), 60 (2014).
- U.S. Department of Health and Human Services. . Biosafety in microbiological and biomedical laboratories. , (2020).
- Poumay, Y., Roland, I. H., Leclercq-Smekens, M., Leloup, R. Basal detachment of the epidermis using dispase: tissue spatial organization and fate of integrin alpha 6 beta 4 and hemidesmosomes. J Inv Der. 102 (1), 111-117 (1994).
- Tsuji, K., et al. Effects of different cell-detaching methods on the viability and cell surface antigen expression of synovial mesenchymal stem cells. CellTra. 26 (6), 1089-1102 (2017).
- Rheinwald, J. G., Green, H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell. 6 (3), 331-343 (1975).
- Boisseau, A. M., et al. Production of epidermal sheets in a serum free culture system: a further appraisal of the role of extracellular calcium. J Der Sci. 3 (2), 111-120 (1992).
- Roshan, A., et al. Human keratinocytes have two interconvertible modes of proliferation. Nat Cell Bio. 18 (2), 145-156 (2016).
- Nanba, D., et al. EGFR-mediated epidermal stem cell motility drives skin regeneration through COL17A1 proteolysis. J Cell Bio. 220 (11), e202012073 (2021).
- Ścieżyńska, A., et al. Isolation and culture of human primary keratinocytes-a methods review. Exp Der. 28 (2), 107-112 (2019).
- Guo, A., Jahoda, C. A. B. An improved method of human keratinocyte culture from skin explants: cell expansion is linked to markers of activated progenitor cells. Exp Derm. 18 (8), 720-726 (2009).
- Orazizadeh, M., Hashemitabar, M., Bahramzadeh, S., Dehbashi, F. N., Saremy, S. Comparison of the enzymatic and explant methods for the culture of keratinocytes isolated from human foreskin. Bio Rep. 3 (3), 304-308 (2015).
- Usta, S. N., Scharer, C. D., Xu, J., Frey, T. K., Nash, R. J. Chemically defined serum-free and xeno-free media for multiple cell lineages. Ann of tra med. 2 (10), 97 (2014).
- Lenihan, C., Rogers, C., Metcalfe, A. D., Martin, Y. H. The effect of isolation and culture methods on epithelial stem cell populations and their progeny-toward an improved cell expansion protocol for clinical application. Cyt. 16 (12), 1750-1759 (2014).
- Bernstam, L. I., Vaughan, F. L., Bernstein, I. A. Keratinocytes grown at the air-liquid interface. In Vitro Cell Dev Biol. 22 (12), 695-705 (1986).
- Ponce, L., et al. Isolation and cultivation of primary keratinocytes from piglet skin for compartmentalized co-culture with dorsal root ganglion neurons. J Cell Bio. 2 (2), 93-115 (2017).
- Nygaard, U. H., et al. Antibiotics in cell culture: friend or foe? Suppression of keratinocyte growth and differentiation in monolayer cultures and 3D skin models. Exp Der. 24 (12), 964-965 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon