Method Article
רישום זרמי K+ מיישרים פנימה בתאי שריר חלק של העורקים הבסיסיים המבודדים הטריים בטכניקת Patch Clamp
In This Article
Summary
פרוטוקול זה מתאר שיטה מהירה ויעילה לבידוד תאי שריר חלק מהעורק הבסיסי של החולדה ורישום זרמי תעלת אשלגן מיישרים פנימה בתאים אלה באמצעות טכניקת מהדק תיקון של תא שלם. הוא מציע גישה חדשה לחוקרים החוקרים את העורק הבסיסי ותעלות היונים.
Abstract
מחלת כלי דם במוח היא מצב שכיח בקרב קשישים, כאשר שכיחותה עולה בהתמדה. העורק הבסיסי הוא כלי מוחי קריטי המספק את הפונס, המוח הקטן, אזורי המוח האחוריים והאוזן הפנימית. פעילות תעלת אשלגן (K+) ממלאת תפקיד משמעותי בקביעת טונוס כלי הדם על ידי ויסות פוטנציאל קרום התא. הפעלה של תעלות K+ (Kir) מיישרות פנימה, כמו תעלות K+ אחרות, מובילה להיפרפולריזציה והרחבת כלי דם של קרום התא. במחקר זה, תאי שריר חלק מבודדים טריים מהעורק הבסיסי שימשו לרישום זרמי קיר באמצעות טכניקת מהדק תיקון של תא שלם. נחקרו ההשפעות של 100 מיקרומול/ליטר BaCl2, מעכב תעלות קיר, ו-10 מיקרומול/ליטר נתרן ניטרופרוסיד (SNP), מרחיב כלי דם ניטרו, על זרמי ערוץ קיר. התוצאות הראו כי BaCl2 עיכב זרמי תעלות קיר בתאי שריר חלק בעורק הבסיסי, בעוד ש-SNP שיפר את הזרמים הללו. פרוטוקול זה מספק מדריך מקיף להכנת תאי שריר חלק עורקי מבודדים טריים ורישום זרמי ערוץ קיר באמצעות טכניקת מהדק התיקון, ומציע משאב רב ערך לחוקרים המבקשים לשלוט בשיטה זו.
Introduction
מחלות כלי דם במוח הן מצב שכיח בקרב האוכלוסייה המבוגרת. עם שיפורים ברמת החיים, עלייה בתוחלת החיים והזדקנות האוכלוסייה, שכיחות מחלות כלי דם במוח עולה בהתמדה1. העורק הבסיסי, כלי לא מזווג שנוצר על ידי איחוי עורקי החוליות הדו-צדדיים, עובר מתחת לפונים בתוך הגולגולת ומתחלק לשני עורקי מוח אחוריים. הוא מספק את הפונים, המוח הקטן, האזורים האחוריים של המוח והאוזן הפנימית. אספקת דם לא מספקת לעורק הבסיסי עלולה להוביל לסחרחורת אפיזודית, המלווה לעתים קרובות בבחילות והקאות. חולים עשויים לחוות גם תסמינים כגון טינטון, אובדן שמיעה ובעיות קשורות אחרות. תסמינים אלו קשורים לעתים קרובות למצבים כמו ספונדילוזיס צוואר הרחם, טרשת עורקים מוחית ולחץ דם לא תקין. מחלות כלי דם במוח, שכיחות במיוחד בקרב אנשים בגיל העמידה וקשישים, קשורות לעתים קרובות למצבים בסיסיים אלה 2,3,4.
עורקי התנגדות ממלאים תפקיד חיוני בתפקוד הלב וכלי הדם ובשמירה על הומאוסטזיס בגוף. כאתר העיקרי של עמידות כלי הדם, הם מווסתים את לחץ הדם ותפוקת הלב, ומבטיחים זרימת דם מספקת כדי לעמוד בדרישות המטבוליות והפיזיולוגיות של רקמות ואיברים5. העורק הבסיסי, המסווג כעורק התנגדות, מווסת בעיקר את זרימת הדם לגזע המוח6. תאי שריר חלק, היוצרים את דפנות עורקי ההתנגדות, הם מתווכים מרכזיים של התנגדות כלי הדם באמצעות ויסות התכווצות במצב יציב או מתח כלי דם. תאים אלה מכילים תעלות יונים רבות, כולל תעלות K+, תעלות Ca2+ ותעלות Cl, שהן קריטיות לאפנון טונוס כלי הדם 5,7.
תעלות K+ הן קריטיות לביסוס פוטנציאל הממברנה ולוויסות טונוס ההתכווצות של תאי שריר חלק עורקי8. ישנם ארבעה סוגים של תעלות K+ בשריר החלק העורקי: K+ תלוי מתח (Kᴠ), K+ תלוי Ca2+ (KCa), K+ תלוי ATP (KATP) ומיישר פנימה K+ (Kir) ערוצי 9,10,11. ערוצי קיר מסווגים לשבעה תת-סוגים, כאשר Kir2.x הם ערוצי קיר קלאסיים. מבין אלה, תת-המשפחות Kir2.x הן הרלוונטיות ביותר בכלי הדם. זרמי קיר מציגים יישור פנימה במתחים שליליים, מה שמעיד על זרימה נטו של K+ לתוך התא, ואילו במתחים חיוביים, יש זרימת זרם K+ נטומינימלית עד ללא 5. במערכת הלב וכלי הדם, תעלות קיר חיוניות לייצוב פוטנציאל הממברנה. הפעלתם גורמת להיפרפולריזציה של קרום התא והרחבת כלי דם 12,13,14.
ניסויי Patch-clamp על תאי שריר חלק מבודדים טריים נערכו בעורקים שונים, כולל עורקים כליליים, מוחיים, כליות ומזנטרי15,16. בעוד ששיטות מסוימות משתמשות באותו סוג של קולגנאז לבידוד תאים, ההליכים המדויקים משתנים. מעט מחקרים סיכמו באופן מקיף את השיטות לבידוד תאי שריר חלק בכלי הדם. לכן, מחקר זה מתמקד בבידוד טרי של תאי שריר חלק בכלי הדם הראשוניים מהעורק הבסיסי של החולדה וברישום זרמי תעלת קיר בתאים אלה באמצעות טכניקת מהדק תיקון של תא שלם, המספק פרוטוקול מפורט ומלא לחוקרים בתחומים קשורים.
Protocol
פרוטוקול בעלי החיים אושר על ידי ועדת האתיקה לרווחת בעלי חיים במעבדה לרפואה סינית מסורתית של אוניברסיטת צ'נגדו (רשומה מס' 2024035). במחקר זה נעשה שימוש בחולדות Sprague-Dawley (SD), במשקל 260-300 גרם ובגילאי 8-10 שבועות. החיות סופקו עם מים ומזון (מזון לבעלי חיים ניסיוניים עם SPF) אד ליביטום. פרטים על הריאגנטים והציוד המשמשים במחקר זה מפורטים בטבלת החומרים.
1. דיסקציה של עורק בסיסי של חולדה
- הכנת פתרון
- הכן פתרונות כמתואר בטבלה 1.
- להרדים את החולדה בשאיפה של 2% איזופלורן. אשר הרדמה עמוקה באמצעות צביטה בבוהן. במידת הצורך, יש לתת חומרי הרדמה נוספים. המשך מיד לפתוח את הגולגולת ולחשוף את המוח על שולחן הניתוחים הנייד.
- העבירו במהירות את המוח לצלחת פטרי המכילה PSS רווי ב-95% O2 ו-5% CO2 ב-4 מעלות צלזיוס. ודא שלתמיסה יש pH של 7.40.
- מקם את המוח עם הגחון כלפי מעלה בצלחת פטרי ואבטח אותו עם מחטים. תחת מיקרוסקופ אור, אתרו את העורק הבסיסי והסירו בזהירות את הרקמה שמסביב באמצעות פינצטה ומספריים שעברו חיטוי (ראו איור 1A).
- הכנס חוט באורך 2 ס"מ בקוטר 25 מיקרומטר לעורק הבסיסי המבודד. שפשפו בעדינות את הקיר הפנימי עם החוט כדי להסיר ביעילות את האנדותל של כלי הדם.
הערה: העורק הבסיסי בחולדות ממוקם בתוך החריץ הבסיסי של גזע המוח בבסיס המוח ונוצר על ידי מפגש עורקי החוליה השמאלית והימנית2. במהלך תהליך הבידוד, טפל בעורק בזהירות כדי למנוע מתיחה או דחיסה מוגזמת שעלולה לגרום לנזק.
2. בידוד תאי שריר חלק
- מחממים מראש 1 מ"ל של תמיסת הפרדת תאים, 1 מ"ל של הידרוליזט אנזימטי I ו-1 מ"ל של הידרוליזט אנזימטי II עד 37 מעלות צלזיוס במבחנות 1, 2 ו-3, בהתאמה (ראה איור 1B).
- העבר את העורק הבסיסי המבודד למבחנה 2. הזרקה רציפה של תערובת של 95% O2 ו-5% CO2 לתוך הצינורית, ושמירה על טיפול אנזימטי למשך 30 דקות (ראה איור 1C).
- העבירו את העורק הבסיסי ממבחנה 2 למבחנה 3. המשיכו להזריק 95% O2 ו-5%CO2 לתוך הצינורית, והמשיכו בטיפול אנזימטי למשך 5 דקות (ראו איור 1D).
- הוסף 1 מ"ל של תמיסת הפרדת תאים של 37 מעלות צלזיוס ממבחנה 1 לתוך מבחנה 3. יש להמשיך להזריק 95% O2 ו-5% CO2 תוך שמירה על טיפול אנזימטי למשך 3 דקות. שלש את הכנת העורק הבסיסי כדי לשחרר תאים (ראה איור 1E).
- הוסף תמיסת הפרדה של 4 °C למבחנה 3 כדי לסיים את התהליך האנזימטי (ראה איור 1F). צנטריפוגה את התערובת בחום של 59 × גרם למשך 6 דקות. השליכו את הסופרנטנט באמצעות פיפטה, הוסיפו שוב תמיסת הפרדה של 4 מעלות צלזיוס (ראו איור 1G), וחזרו על הצנטריפוגה פעמיים כדי להסיר שאריות אנזימים.
- הסר את חומר העל באמצעות פיפטה, ואחסן 1 מ"ל מתלה התא בטמפרטורה של 4 מעלות צלזיוס למשך עד 6-8 שעות.
- קח 100 מיקרוליטר מתרחיף התא והנח אותו באמבטיה (ראה איור 1H). הוסיפו 1 מ"ל של נוזל חוץ-תאי לאמבטיה ואפשרו לתאים להתיישב במשך 40 דקות כדי להיצמד לתחתית (ראו איור 2).
הערה: עבור תאים בקבוצת הטיפול (למשל, BaCl2 או נתרן ניטרופרוסיד), יש לדגור מראש עם החומרים המתאימים בטמפרטורת החדר (22-26 מעלות צלזיוס) למשך 40 דקות במהלך תקופת ההצמדה.
3. הקלטת זרם קיר באמצעות מהדק תיקון תא שלם
- ייצור מיקרופיפטות
- הפעל את חולץ המיקרופיפטה (עיין בטבלת החומרים).
- הנח צינור זכוכית (קוטר חיצוני: 1.5 מ"מ, קוטר פנימי: 1.10 מ"מ, אורך: 10 ס"מ) במושך. בחר תוכנית 1, לחץ על Enter וגש לתוכנית 1. בצע בדיקת רמפה על ידי לחיצה על רמפה בלוח הבקרה כדי למדוד את ערך החום של צינור הזכוכית.
הערה: ערוך את תוכנית 1 עם הפרמטרים הבאים: חום: רמפה, משיכה: 0, מהירות: 25, השהיה: 1, לחץ: 500, מצב: השהיה, חום בטוח מופעל. יש לבצע את בדיקת הרמפה בעת החלפת חוטים או סוגי פיפטות זכוכית. מיקרופיפטות צריכות להיות בקוטר קצה של ~1-2 מיקרומטר ואורך חרוט של כ-5 מ"מ. קוטר קצה קטן יותר וחרוטים ארוכים יותר מביאים להתנגדות גבוהה יותר לפיפטה. - הכנס צינור זכוכית חדש ובחר תוכנית 1. לחץ על Enter כדי לייצר את המיקרופיפטה.
- הקלטת זרם קיר
- הפעל את התקני החומרה ברצף: ממיר דיגיטלי לאנלוגי, מגבר אותות, מיקרומניפולטור, מיקרוסקופ, מצלמה ומחשב.
- הפעל את התוכנה בסדר הבא: מצלמה, אות ampחיים ותוכנת רכישת נתונים.
הערה: אם מיקרוסקופ אינו מצויד במצלמה, רק תוכנת המכשיר זקוקה להפעלה. ודא שהתוכנה נפתחת לאחר אתחול החומרה כדי לאפשר פונקציונליות נאותה. - בתוכנה לרכישת נתונים, בחר File > Set Data File Names כדי ליצור נתיב אחסון נתונים.
- ערוך את הפרוטוקול להקלטת זרמי קיר באופן הבא:
- ממשק צורת גל: תקופה A ו-D: סוג = שלב; רמה ראשונה = -60 mV; רמת דלתא = 0 mV; משך ראשון = 100 אלפיות השנייה; משך דלתא = 0 אלפיות השנייה. תקופה ב': סוג = צעד; רמה ראשונה = -160 mV; רמת דלתא = 0 mV; משך ראשון = 1 אלפיות השנייה; משך דלתא = 0 אלפיות השנייה. תקופה C: סוג = רמפה; רמה ראשונה = 40 mV; רמת דלתא = 20 mV; משך ראשון = 500 אלפיות השנייה; משך דלתא = 0 אלפיות השנייה.
- ממשק מצב/קצב: עיכוב ניסיון = 0 שניות; ריצות = 1; סוויפ = 1; משך הסריקה = 0.8 שניות.
- ממשק יציאות: ערוץ #0; רמת החזקה = −60 mV. שמור ותן לפרוטוקול את השם "פרוטוקול קיר".
הערה: הגדרת הפרוטוקול מותאמת להקלטות נוכחיות ספציפיות וניתן לעשות בה שימוש חוזר לאחר השמירה. ודא שממשק הפלט תואם את החיווט של המכשיר (למשל, ערוץ #0).
- הפעל את פונקציית בדיקת הממברנה בתפריט כלים של תוכנת רכישת הנתונים.
- מקם את התא למדידה במרכז תצוגת המצלמה של המיקרוסקופ.
- טבלו את קצה חוט הייחוס בתמיסת האמבטיה. מלאו 20% מהמיקרופיפטה (המיוצרת בשלב 3.1) בתמיסה התוך תאית ואבטחו אותה על מחזיק אלקטרודות ההקלטה.
- הפעל לחץ חיובי באמצעות מזרק, העבר את קצה הפיפטה לתוך תמיסת האמבטיה, והתאם את היסט הפיפטה באות ampתוכנת liifier כדי להגדיר את קו הבסיס הנוכחי ל-0 pA (ראה איור 3A).
הערה: השתמש בחוטי ייחוס Ag/AgCl. התנגדות הפיפטה צריכה להיות 4-6 MΩ.
- הפעל לחץ חיובי באמצעות מזרק, העבר את קצה הפיפטה לתוך תמיסת האמבטיה, והתאם את היסט הפיפטה באות ampתוכנת liifier כדי להגדיר את קו הבסיס הנוכחי ל-0 pA (ראה איור 3A).
- לחץ בעדינות את הפיפטה על קרום התא. שימו לב לעלייה בהתנגדות האיטום (Rt) ל-MΩ 1 לפחות (איור 3B). הסר לחץ חיובי והפעל לחץ שלילי כדי ליצור התנגדות גבוהה עם Rt ≥ 1 GΩ (איור 3C).
- הגדר את מתח ההחזקה ל- mV 60- ופצה על קיבוליות האלקטרודה באמצעות Cp Fast ו- Cp Slow (איור 3D).
הערה: אם Rt נשאר מעל 1 GΩ, המשך לשלב הבא; אחרת, החלף את התא או הפיפטה וחזור על שלבים 3.2.6-3.2.8.
- הגדר את מתח ההחזקה ל- mV 60- ופצה על קיבוליות האלקטרודה באמצעות Cp Fast ו- Cp Slow (איור 3D).
- הפעילו לחץ שלילי קצר כדי לקרוע את קרום התא, וליצור תצורה של תא שלם (איור 3E). בחר תא שלם בתוכנת מגבר האות, לחץ על אוטומטי עבור קיזוז קיבוליות הממברנה (איור 3F), טען את פרוטוקול Kir והתחל בהקלטת נתונים. חזור על שלבים 3.2.6-3.2.9 עבור תאים מטופלים.
הערה: אם התנגדות הסדרה (Ra) היא >30 MΩ, בחר תא חדש. אם 30 MΩ > Ra > 10 MΩ, החל פיצוי התנגדות סדרתי לפני ההקלטה. פרוטוקול זה דורש Ra < 10 MΩ.
- ניתוח נתונים
- פתח את תוכנת ניתוח הנתונים וטען את הנתונים המוקלטים. השתמש בסמנים כדי לנתח עקבות זרם ולייצא נתונים עבור התוויית עקומת IV.
- צור אות צורת גל גירוי על ידי בחירה באפשרות ערוך > צור אות צורת גל גירוי ואשר.
- ייצא את המעקב אחר פרוטוקול Kir על-ידי בחירה באפשרות ערוך > מעקבי העברה, ציון אזור המעקב והאות המלאים (A0 #0) והעתקת נתונים להמשך ניתוח.
- ייצא מעקבי זרם של Kir מייצג על-ידי בחירה באפשרות ערוך > מעקבי העברה, ציון אזור המעקב והאות המלאים (IN 0) והעתקת נתונים כדי ליצור עלילות מעקב נוכחיות.
הערה: נרמל את הנתונים הנוכחיים באמצעות צפיפות זרם (pA/pF) להשוואה מדויקת בין תאים בגדלים שונים. ודא שקיבול הממברנה (ס"מ) נרשם במהלך הניסוי17.
תוצאות
בידוד תאי שריר חלק עורקי
החלק הראשון של ההליך מפרט את תהליך בידוד תאי השריר החלק מהעורק הבסיסי המוחי של החולדה. תהליך זה מתואר באיור 1. ההליך כולל שלבי עיכול אנזימטיים והפרדת תאים לשחרור תאי שריר חלק מהעורק.
תמונות מייצגות של תאי שריר חלק מבודדים
החלק השני מציג תרשים מייצג של תאי השריר החלק המבודדים. איור 2 כולל תמונות שדה בהיר של תאי שריר חלק בצורת ציר, המאשרות את זהותם כתאי שריר חלק בהתבסס על צורתם האופיינית.
טכניקת מהדק תיקון תא שלם
החלק השלישי מתאר את תרשים הזרימה של טכניקת מהדק התיקון של התא השלם המשמשת לרישום זרמי קיר בתאי שריר חלק מבודדים טריים. איור 3 מספק המחשה מפורטת של הגדרת מהדק התיקון ונהלים לקביעת תצורת תא שלם.
הקלטת זרם קיר
החלק הרביעי מציג את זרם הקיר המייצג שנרשם מתאי שריר חלק מבודדים טריים באמצעות טכניקת מהדק תיקון של תא שלם. איור 4 מציג את הזרמים המתועדים ואת ההשפעות של התערבויות שונות על פעילות ערוץ קיר. איור 4A מציג את זרם ה-Kir הטיפוסי, המדגים יישור פנימה במתחים שליליים, המציין את הזרימה נטו של K+ לתוך התא. במתחים חיוביים, יש זרימת זרם K+ נטו מינימלית עד אפסית. איור 4B ממחיש את העיכוב של זרמי Kir על ידי המעכב הספציפי BaCl2. התוצאות מראות כי Ba2+ בריכוזים של 100-300 מיקרומול/ליטר חוסם ביעילות את תעלות קיר, ומאשר את הזרם כקיר. איור 4C מדגים את ההשפעה של נתרן ניטרופרוסיד (SNP), מרחיב ניטרובאזוד, על זרמי קיר. הנתונים מראים כי SNP מגביר את זרם קיר, מה שמרמז על מעורבות של ערוצי קיר בהרחבת כלי הדם הנגרמת על ידי SNP. איור 4F מציג את ערכי הקיבוליות (Cm) בקבוצות הבקרה, BaCl2 ו-SNP. התוצאות מצביעות על כך שאין מובהקות סטטיסטית בערכי Cm בקבוצות אלה.

איור 1: בידוד של תאי שריר חלק עורקי. (A) הצד הגחוני של מוח החולדה והעורק הבסיסי. (B) חימום מוקדם של 1 מ"ל של תמיסת הפרדת תאים, 1 מ"ל של הידרוליזט אנזימטי של תאים I, ו-1 מ"ל של הידרוליזט אנזימטי של תאים II עד 37 מעלות צלזיוס במבחנות 1, 2 ו-3, בהתאמה. (ג-ה) שלושת השלבים של הפרדת תאים מרקמת כלי הדם על ידי טיפול אנזימטי. (ו,ז) הפסקת הטיפול האנזימטי על ידי הוספת תמיסת הפרדה של 4 מעלות צלזיוס. (H) נוזל תאים שמכיל תאי שריר חלק עורקי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: תאי שריר חלק עורקי. (A) תצוגת שדה בהיר של תאי שריר חלק וסקולרי מבודדים טריים, המציגה מורפולוגיה של ציר. סרגל קנה מידה: 10 מיקרומטר. (B) תאים בריאים המתאימים לניסויי טלאי-מהדק. סרגל קנה מידה: 30 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
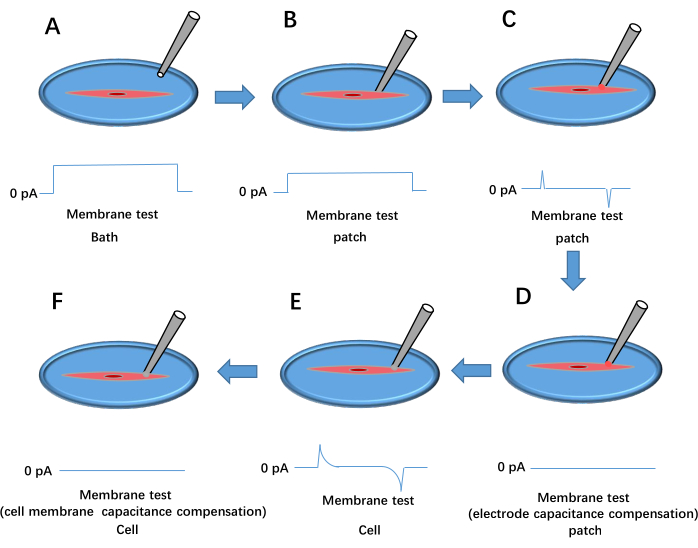
איור 3: תהליך היווצרות מהדק תיקון תא שלם. זה מראה את התוצאה של בדיקת קרום דופק המתח. (א) הפיפטה מוטלת לאמבטיה. (B) אלקטרודת ההקלטה מועברת כדי ליצור קשר עם התא ונלחצת על הממברנה. (ג) היווצרות אטם בעל התנגדות גבוהה בין הפיפטה לתא. (ד) פיצוי קיבוליות אלקטרודה. (E) קרע בקרום התא. (F) פיצוי קיבול קרום התא. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4. זרם קיר מייצג בתאי שריר חלק עורקי. (א) זרם קיר רגיל. (B) עיכוב על ידי המעכב הספציפי BaCl2. (C) השפעת נתרן ניטרופרוסיד (SNP) על זרם קיר. (D) עקומת I-V של זרמי קיר. (ה) תוצאות סטטיסטיות. p < 0.05, BaCl2 (n = 6) ו- SNP (n = 6) לעומת קבוצת הביקורת (n = 6); ההבדלים נותחו על ידי ANOVA דו-כיווני דו-זנבי. (F) ס"מ (pF), p > 0.05, BaCl2 (n = 6) ו- SNP (n = 6) לעומת קבוצת הביקורת (n = 6); ההבדלים נותחו על ידי מבחן T. פרוטוקול גירוי: החזקה ב-60 mV עם גירוי רמפה מ-160 mV ל-+40 mV למשך 500 אלפיות השנייה. Control, BaCl2 ו-SNP נערכו בנפרד בקבוצות שונות של תאים. תרכובות נוספו 40 דקות לפני ההקלטות ויכלו להישאר באמבטיה עד 20 דקות במהלך ההקלטה. SNP: נתרן ניטרופרוסיד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| סוג פתרון | הרכב הפתרון | נקודות עיקריות | ||
| תמיסת מלח פיזיולוגית (PSS, mmol/L) | 118 NaCl, 4.7 KCl, 2.5 CaCl2, 1.2 KH2PO4, 1.2 MgCl2, 25 NaHCO3, 11 D-גלוקוז, 5 HEPES | יש להרוות את התמיסה ולבעבע אותה בגז מעורב המורכב מ-95% O2 ו-5% CO2 לפני השימוש. לאחר מכן, התאם את ה-pH של התמיסה ל-7.4 באמצעות NaOH. טמפרטורה להכנתו ואחסונו בטמפרטורת החדר וב -4 מעלות צלזיוס, בהתאמה | ||
| תמיסת הפרדת תאים (mmol/L) | 118 NaCl, 4.7 KCl, 2.5 CaCl2, 1.2 KH2PO4, 1.2 MgCl2, 25 NaHCO3, 11 D-גלוקוז, 5 HEPES | זהה לתמיסת המלח הפיזיולוגית | ||
| הידרוליזט אנזימטי של תאים I | אלבומין בסרום בקר (BSA): 1 מ"ג/מ"ל, דיתיותרייטול (DTT): 1 מ"ג/מ"ל ופפאין: 0.5 מ"ג/מ"ל נוספו לתמיסת הפרדת התאים | הכן את התמיסה מיד לשימוש. טמפרטורה להכנתו בטמפרטורת החדר | ||
| הידרוליזט אנזימטי של תאים II | BSA: 1 מ"ג/מ"ל, קולגנאז H: 0.3 מ"ג/מ"ל וקולגנאז F: 0.7 מ"ג/מ"ל נוספו לתמיסת הפרדת התאים | זהה להידרוליזה האנזימטית של התא I | ||
| תמיסת אמבטיה נוכחית של קיר (מילימול/ליטר) | 12 NaCl, 130 KCl, 0.4 KH2PO4 , 0.3 NaH2PO4, 2 NaHCO3 , 1 MgCl2 , 1.8 CaCl2 , 10 HEPES, 5.5 גלוקוז | מותאם ל-pH של 7.4 באמצעות NaOH ואוסמולריות של 310 mOsm. טמפרטורה להכנתו ואחסונו בטמפרטורת החדר וב -4 מעלות צלזיוס, בהתאמה | ||
| תמיסת מילוי פיפטות זרם קיר (mmol/L) | 100 אשלגן-D-גלוקונאט, 30 ק"ל, 1 מ"ג Cl2, 1 EGTA, 15 HEPES, 1 ו-2-ATP | מותאם ל-pH של 7.2 באמצעות KOH ואוסמולריות של 300 mOsm. טמפרטורה להכנתו ואחסונו בטמפרטורת החדר ו-20 מעלות צלזיוס, בהתאמה | ||
טבלה 1: אמצעי זהירות להרכב והכנה לפתרונות שונים.
Discussion
רישום תאים שלמים באמצעות תאים מבודדים טריים מתוארך לתחילת שנות ה-80 של המאהה-20 18, והרישום של זרמי תעלה מתאי שריר חלק בסיסי של מכרסמים הפך לנהוג באופן נרחב בשנות ה-9019. עם ההתקדמות הטכנולוגית, החוקרים מתמקדים יותר ויותר בתוצאות שהושגו באמצעות טכנולוגיות אלה. עם זאת, תשומת הלב שניתנה לעדכון וסיכום שיטות טכניות פחתה בהדרגה. מאמר זה מציג שיטה מפורטת להפרדה טרייה של תאי שריר חלק בכלי הדם והשימוש הבא בתאים אלה לתיעוד זרמי קיר, במטרה לסייע לחוקרים בהבנת התהליך המתודולוגי הסטנדרטי.
שריר חלק בכלי הדם ממלא תפקיד מכריע בוויסות מתח העורקים. דווח על שיטות רבות להפרדת תאי שריר חלק בכלי הדם 20,21,22,23,24,25, רובן כרוכות בהידרוליזה אנזימטית. עם זאת, הסוגים והשלבים של אנזימים משתנים בין מחקרים, ותנאי ניסוי שונים יכולים להשפיע על היעילות האנזימטית. מאמר זה מציג שיטת הידרוליזה אנזימטית, עם שינויים קלים בסוגי האנזימים ובנהלים בהשוואה למחקרים קודמים. הוא מספק פרוטוקול מפורט להפרדה חריפה של תאי שריר חלק ראשוניים בכלי הדם.
השלבים העיקריים של פרוטוקול זה הם שלבים 2.2 עד 2.4, שכן השלמה מוצלחת של שלבים אלה משפיעה ישירות על איכות התאים המבודדים. תאי השריר החלק בכלי הדם המבודדים מתאימים ליישומים שונים, כולל ניסויי טלאי-מהדק לחקר תעלות יונים, מיצוי RNA וחלבון למחקרים מולקולריים ואימונופלואורסצנציה לחקירת ביטוי חלבון בתאים. כתוצאה מכך, שיטה זו מציעה גישה רב-תכליתית לחוקרים רלוונטיים, ומספקת אפשרויות ניסיוניות יותר.
מוליכות אשלגן (K+) על הממברנה של תאי שריר חלק עורקי ממלאת תפקיד מכריע בוויסות פוטנציאל הממברנה, מתח כלי הדם, ובסופו של דבר, זרימת דם מקומית26,27. תעלת קיר, סוג של תעלת K+ המצויה בתאי שריר חלק עורקי, מסייעת בייצוב פוטנציאל הממברנה ופועלת כמגבר חשמלי לתעלות K+ אחרות. כאשר היא מופעלת, תעלת קיר גורמת להיפרפולריזציה של הממברנה ומעודדת התרחבות כלי דם28. טכנולוגיית מהדק תיקון נחשבת זה מכבר לתקן הזהב לחקר תעלות יונים29,30, כאשר מהדק תיקון תא שלם הוא השיטה הנפוצה ביותר31. בעוד שטכניקה זו דורשת רמה גבוהה של מיומנות מפעיל, המיומנות תלויה בסופו של דבר בשמירה על פרוטוקולים סטנדרטיים.
מחקר זה מציג נוהל מפורט וסטנדרטי לרישום זרמי קיר מתאי שריר חלק בכלי הדם שבודדו לאחרונה באמצעות מהדק תיקון של תא שלם, המספק התייחסות רבת ערך לחוקרים. שלבים קריטיים בפרוטוקול הם שלבים 3.2.7 עד 3.2.9, שכן השלמה מוצלחת של שלבים אלה קובעת אם ההקלטות הנוכחיות הבאות של קיר יהיו מוצלחות. בנוסף, בחירת הנוזלים התוך-תאיים והאמבטיה משפיעה באופן משמעותי על הזרם הנרשם. לדוגמה, השימוש באשלגן גבוה חוץ-תאי במחקר זה נועד להפעיל באופן מלא את תעלת האשלגן המיישר פנימה. לכן, הצלחת הניסוי תלויה בתשומת לב קפדנית לכל פרט תפעולי.
בעוד שתאים מבודדים טריים מציעים רלוונטיות פיזיולוגית רבה יותר מאשר קווי תאים, ישנן מגבלות מובנות. אלה כוללים את השפעת טמפרטורת הסביבה על ההפרדה האנזימטית, זמני עיכול משתנים של כלי דם בקטרים שונים וחוסר יציבות הסביבה הטבעית של התאים. כתוצאה מכך, לעתים קרובות יש להתאים את זמני העיכול האנזימטיים. טכנולוגיית מהדק תיקון מציבה גם אתגרים טכניים, במיוחד בשלבי האיטום וקרע הממברנה, הדורשים מיומנות גבוהה של המפעיל. מצב התא משפיע ישירות על הצלחת הליך התיקון-מהדק כולו. כתוצאה מכך, תשומת לב קפדנית למגבלות אלה חיונית להבטחת הצלחת הניסוי.
Ba2+ נמצא בשימוש נרחב כחוסם ספציפי לחקר תפקידן של תעלות קיר בתאים וברקמות. בריכוזים מתחת ל-100 מיקרומול/ליטר, Ba2+ חוסם באופן סלקטיבי תעלות קיר, בעוד שריכוזים גבוהים עד 300 מיקרומול/ליטר יכולים לחסום אותם לחלוטין32. במחקר זה, נעשה שימוש ב-BaCl2 כדי לאמת את זרם ערוץ קיר.
תעלות קיר מוסדרות הן על ידי מכווצי כלי דם והן על ידי מרחיבי כלי דם. SNP (נתרן ניטרופרוסיד), מרחיב ניטרובאזו, שימש במחקר זה כדי לחקור זאת. SNP עובר חילוף חומרים בשריר חלק בכלי הדם כדי לייצר תחמוצת חנקן, מה שמפחית את ההתנגדות המערכתית של כלי הדם על ידי פעולה על שריר חלק ורידי ועורקי כאחד, מה שעלול לשפר את תפוקת הלב. בשל הופעתו המהירה ומחצית החיים הקצרה, SNP משמש בדרך כלל כסוכן קו ראשון למניעה וטיפול ביתר לחץ דם33. המחקר הבחין כי SNP הגדיל את זרם הקיר בתאי שריר חלק בעורק הבסיסי, מה שמרמז על הפעלת תעלות קיר במהלך הרחבת כלי הדם המושרה על ידי SNP.
מגבלה של ההקלטות הנוכחיות היא שהן התקבלו מקבוצות תאים שונות, והשוואות נעשו על ידי ניתוח צפיפות הזרם בין הקבוצות. גישה מעודנת יותר תכלול רישום התגובות של אותם תאים לפני ואחרי יישום התרכובות, מה שימזער את ההשפעה של שונות תא לתא על פירוש הנתונים.
לסיכום, מאמר זה מספק פרוטוקול מפורט לבידוד חריף של תאי שריר חלק בעורק בסיסי של חולדות ושימוש במהדק תיקון תאים שלמים לחקר זרמי קיר. פרוטוקול זה הוא רב תכליתי וניתן ליישם אותו על תאי שריר חלק מעורקים אחרים, כגון העורקים הכליליים, המזנטרי והכליה. עם זאת, ייתכן שיהיה צורך להתאים את זמן ההפרדה האנזימטי בהתאם לסוג העורק. בנוסף, ניתן להשתמש בתאי שריר חלק עורקי מבודדים במגוון טכניקות ניסיוניות אחרות.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי תוכנית הכישרונות המיוחדים של אוניברסיטת צ'נגדו לרפואה סינית מסורתית עבור "תוכנית קידום מחקר של חוקרי שינגלין וכישרונות דיסציפלינה" (33002324) ופרויקט מחקר ופיתוח מרכזי להצגת כישרונות מדעיים וטכנולוגיים ברמה גבוהה בעיר לוליאנג (2022RC28).
Materials
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma, USA | B2064 | |
| Barium chloride | Macklin Biochemical Co.,Ltd.,Shanghai, China | B861682 | |
| CaCl2 | Sangon Biotech Co., Ltd., Shanghai, China | A501330 | |
| Camera | Hamamatsu, Japan | C11440 | |
| Camera software | Image J, USA | Micro-manager 2.0.0-gammal | |
| Collagenase F | Sigma, USA | C7926 | |
| Collagenase H | Sigma, USA | C8051 | |
| Computer | Lenovo, China | ~ | |
| Data acquisition software | Molecular Devices, USA | Clampex 10.4 | |
| Data analysis software | Axon, USA | clampfit 10.4 | |
| D-glucose | Sangon Biotech Co., Ltd., Shanghai, China | A610219 | |
| Digital-analog converter | Molecular Devices, USA | Axon digidata 1550B | |
| Dithiothreitol | Sigma, USA | D0632 | |
| Drawing software | San Diego, California, USA | GraphPad | |
| EGTA | Sangon Biotech Co., Ltd., Shanghai, China | A600077 | |
| Glass tube | DL Naturegene Life Sciences.USA | B150-86-10 | |
| HEPES | Xiya Reagent Co., Ltd., Shandong, China | S3872 | |
| KCl | Sangon Biotech Co., Ltd., Shanghai, China | A100395 | |
| KH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A100781 | |
| MgCl2·6H2O | Sangon Biotech Co., Ltd., Shanghai, China | A100288 | |
| Micromanipulator | sutter, USA | MP285A | |
| Micropipette puller | sutter, USA | P1000 | |
| Microscope | Olympus, Japan | IX73 | |
| Na2-ATP | Sigma, USA | A26209 | |
| Na2HPO4 | Sangon Biotech Co., Ltd., Shanghai, China | A610404 | |
| NaCl | Sangon Biotech Co., Ltd., Shanghai, China | A100241 | |
| NaH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A600878 | |
| NaHCO3 | Sangon Biotech Co., Ltd., Shanghai, China | A100865 | |
| NaOH | Sangon Biotech Co., Ltd., Shanghai, China | A100173 | |
| Papain | Sigma, USA | P4762 | |
| Potassium-D-gluconate | Sangon Biotech Co., Ltd., Shanghai, China | A507810 | |
| Signal amplifier | Molecular Devices, USA | Axon MutiClamp 700B | |
| Signal amplifier software | Molecular Devices, USA | MultiClamp Commander software | |
| Sodium nitroprusside | Sangon Biotech Co., Ltd., Shanghai, China | A600867 | |
| Statistical analysis software | San Diego, California, USA | GraphPad |
References
- Goins, R. T., et al. Lower body functioning and correlates among older american indians: The cerebrovascular disease and its consequences in american indians study. BMC Geriatrics. 18 (1), 1-9 (2018).
- Mattle, H. P., Arnold, M., Lindsberg, P. J., Schonewille, W. J., Schroth, G. Basilar artery occlusion. Lancet Neurol. 10 (11), 1002-1014 (2011).
- Morales, A., Parry, P. V., Jadhav, A., Jovin, T. A novel route of revascularization in basilar artery occlusion and review of the literature. BMJ Case Reports. , 1-6 (2015).
- Ghantous, C. M., Azrak, Z., Rahman, F. A., Itani, H. A., Zeidan, A. Assessment of basilar artery reactivity in stroke and subarachnoid hemorrhage using wire myograph. Methods Mol Biol. 34, 625-643 (2016).
- Tykocki, N. R., Boerman, E. M., Jackson, W. F. Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr Physiol. 7 (2), 485-581 (2017).
- Wu, B. -. N., et al. Hyposmotic challenge inhibits inward rectifying K+ channels in cerebral arterial smooth muscle cells. Am J Physiol Heart Circ Physiol. 292 (2), H1085-H1094 (2007).
- Jackson, W. F. Ion channels and vascular. Hypertension. 35 (2), 173-178 (2000).
- Jackson, W. F. Potassium channels in the peripheral microcirculation. Microcirculation. 12 (1), 113-127 (2005).
- Dogan, M. F., Yildiz, O., Arslan, S. O., Ulusoy, K. G. Potassium channels in vascular smooth muscle: A pathophysiological and pharmacological perspective. Fundam Clin Pharmacol. 33 (5), 504-523 (2019).
- Daghbouche-Rubio, N., López-López, J. R., Pérez-García, M. T., Cidad, P. Vascular smooth muscle ion channels in essential hypertension. Front Physiol. 13, 1-9 (2022).
- Sahranavard, T., et al. The role of potassium in atherosclerosis. Eur J Clin Invest. 51 (3), 1-19 (2020).
- Crecelius, A. R., Dinenno, F. A. Vascular regulation via kir channels and Na+/K+-ATPase. Channels. 9 (4), 171-172 (2015).
- Liu, Y., et al. Prostanoids contribute to regulation of inwardly rectifying K+ channels in intrarenal arterial smooth muscle cells. Life Sci. 250, 1-9 (2020).
- Li, W., et al. Luteolin-induced coronary arterial relaxation involves activation of the myocyte voltage-gated K+ channels and inward rectifier K+ channels. Life Sci. 221, 233-240 (2019).
- Guo, P., et al. Coronary hypercontractility to acidosis owes to the greater activity of tmem16a/ano1 in the arterial smooth muscle cells. Biomed Pharmacother. 139, 1-14 (2021).
- Jing, Y., et al. Apigenin relaxes rat intrarenal arteries, depresses Ca2+-activated Cl− currents and augments voltage-dependent K+ currents of the arterial smooth muscle cells. Biomed Pharmacother. 115, 1-9 (2019).
- Manz, K. M., Siemann, J. K., Mcmahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 1-30 (2021).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Langton, P. D., Standen, N. B. Calcium currents elicited by voltage steps and steady voltages in myocytes isolated from the rat basilar artery. J Physiol. 469, 535-548 (1993).
- Kittiwoot, T. -. O., et al. Isolation of intrapulmonary artery and smooth muscle cells to investigate vascular responses. J Vis Exp. (184), e63686 (2022).
- Trask, A. J., Lucchesi, P. A., Mccallinhart, P. E., Zhang, X., Husarek, K. E. Isolation of murine coronary vascular smooth muscle cells. J Vis Exp. 111, e53983 (2016).
- Ribeiro, M. P., Relvas, R., Chiquita, S., Correia, I. J. Isolation of human umbilical arterial smooth muscle cells (HUASMC). J Vis Exp. (41), e1940 (2010).
- Kim, H. J., et al. Increased inward rectifier K+ current of coronary artery smooth muscle cells in spontaneously hypertensive rats; partial compensation of the attenuated endothelium-dependent relaxation via Ca2+-activated K+ channels. Clin Exp Pharmacol Physiol. 47 (1), 38-48 (2019).
- Qiao, Y., et al. Kir2.1 regulates rat smooth muscle cell proliferation, migration, and post-injury carotid neointimal formation. Biochem Biophys Res Commun. 477 (4), 774-780 (2016).
- Tykocki, N. R., Bonev, A. D., Longden, T. A., Heppner, T. J., Nelson, M. T. Inhibition of vascular smooth muscle inward-rectifier K+channels restores myogenic tone in mouse urinary bladder arterioles. Am J Physiol Renal Physiol. 312 (5), F836-F847 (2017).
- Ko, E. A., Han, J., Jung, I. D., Park, W. S. Physiological roles of K+ channels in vascular smooth muscle cells. Smooth Muscle Res. 44 (2), 65-81 (2008).
- Standen, N. B., Quayle, J. M. K+ channel modulation in arterial smooth muscle. Acta Physiol Scand. 164, 549-557 (1998).
- Smith, P. D., et al. Kir channels function as electrical amplifiers in rat vascular smooth muscle. J Physiol. 586 (4), 1147-1160 (2008).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 1-12 (2021).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for qt interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. J Pharmacol Toxicol Methods. 48 (2), 65-80 (2002).
- Kodandaramaiah, S. B., Franzesi, G. T., Chow, B. Y., Boyden, E. S., Forest, C. R. Automated whole-cell patch-clamp electrophysiology of neurons in vivo. Nat Methods. 9 (6), 585-587 (2012).
- Park, W. S., Han, J., Earm, Y. E. Physiological role of inward rectifier K+ channels in vascular smooth muscle cells. Pflugers Arch. 457 (1), 137-147 (2008).
- Thomas, C., Svehla, L., Moffett, B. S. Sodium nitroprusside induced cyanide toxicity in pediatric patients. Expert Opin Drug Saf. 8 (5), 599-602 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved