Method Article
Enregistrement des courants K+ rectificatifs vers l’intérieur dans des cellules musculaires lisses de l’artère basilaire fraîchement isolées par la technique du patch clamp
Dans cet article
Résumé
Ce protocole décrit une méthode rapide et efficace pour isoler les cellules musculaires lisses de l’artère basilaire du rat et enregistrer les courants des canaux potassiques rectificatifs vers l’intérieur dans ces cellules à l’aide de la technique du patch clamp de cellules entières. Il offre une nouvelle approche aux chercheurs qui étudient l’artère basilaire et les canaux ioniques.
Résumé
Les maladies cérébrovasculaires sont une affection répandue chez les personnes âgées, dont l’incidence ne cesse d’augmenter. L’artère basilaire est un vaisseau cérébral essentiel qui alimente le pont, le cervelet, les régions postérieures du cerveau et l’oreille interne. L’activité des canaux potassiques (K+) joue un rôle important dans la détermination du tonus vasculaire en régulant le potentiel de la membrane cellulaire. L’activation des canaux K+ rectificatifs vers l’intérieur (Kir), comme les autres canaux K+ , entraîne une hyperpolarisation et une vasodilatation de la membrane cellulaire. Dans cette étude, des cellules musculaires lisses fraîchement isolées de l’artère basilaire ont été utilisées pour enregistrer les courants de Kir via la technique du patch clamp à cellules entières. Les effets de 100 μmol/L de BaCl2, un inhibiteur du canal Kir, et de 10 μmol/L de nitroprussiate sodilatateur de sodium (SNP), un nitrovasodilatateur, sur les courants du canal Kir ont été étudiés. Les résultats ont démontré que BaCl2 inhibait les courants du canal Kir dans les cellules musculaires lisses de l’artère basilaire, tandis que le SNP augmentait ces courants. Ce protocole fournit un guide complet pour la préparation de cellules musculaires lisses artérielles fraîchement isolées et l’enregistrement des courants du canal Kir à l’aide de la technique du patch clamp, offrant une ressource précieuse pour les chercheurs cherchant à maîtriser cette méthode.
Introduction
Les maladies cérébrovasculaires sont une affection répandue chez les personnes âgées. Avec l’amélioration du niveau de vie, l’augmentation de l’espérance de vie et le vieillissement de la population, l’incidence des maladies cérébrovasculaires ne cesse d’augmenter1. L’artère basilaire, un vaisseau non apparié formé par la fusion des artères vertébrales bilatérales, passe sous les boutons à l’intérieur du crâne et se divise en deux artères cérébrales postérieures. Il alimente le pont, le cervelet, les régions postérieures du cerveau et l’oreille interne. Un apport sanguin insuffisant à l’artère basilaire peut entraîner des vertiges épisodiques, souvent accompagnés de nausées et de vomissements. Les patients peuvent également présenter des symptômes tels que des acouphènes, une perte auditive et d’autres problèmes connexes. Ces symptômes sont fréquemment associés à des affections telles que la spondylose cervicale, l’athérosclérose cérébrale et une pression artérielle anormale. Les maladies cérébrovasculaires, particulièrement répandues chez les personnes d’âge moyen et les personnes âgées, sont souvent liées à ces affections sous-jacentes 2,3,4.
Les artères de résistance jouent un rôle essentiel dans la fonction cardiovasculaire et le maintien de l’homéostasie corporelle. En tant que principal site de résistance vasculaire, ils régulent la pression artérielle et le débit cardiaque, assurant un flux sanguin suffisant pour répondre aux exigences métaboliques et physiologiques des tissus et des organes5. L’artère basilaire, classée comme artère de résistance, régule principalement le flux sanguin vers le tronc cérébral6. Les cellules musculaires lisses, qui forment les parois des artères de résistance, sont des médiateurs clés de la résistance vasculaire par la régulation de la contraction à l’état d’équilibre ou de la tension vasculaire. Ces cellules hébergent de nombreux canaux ioniques, notamment les canaux K+, les canaux Ca2+ et les canaux Cl-, qui sont essentiels à la modulation du tonus vasculaire 5,7.
Les canaux K+ sont essentiels à l’établissement du potentiel membranaire et à la régulation du tonus contractile des cellules musculaires lisses artérielles8. Il existe quatre types de canaux K+ dans le muscle lisse artériel : K+ dépendant du voltage (Kᴠ), K+ dépendant de Ca2+ (KCa), K+ dépendant de l’ATP (KATP) et les canaux9, 10, 11 du redresseur vers l’intérieur K+ (Kir). Les chaînes Kir sont classées en sept sous-types, Kir2.x étant des chaînes Kir classiques. Parmi celles-ci, les sous-familles Kir2.x sont les plus pertinentes dans le système vasculaire. Les courants Kir présentent une rectification vers l’intérieur aux tensions négatives, indiquant un afflux net de K+ dans la cellule, tandis qu’aux tensions positives, il y a peu ou pas de flux de courant net K+ 5. Dans le système cardiovasculaire, les canaux Kir sont essentiels pour stabiliser le potentiel membranaire. Leur activation induit une hyperpolarisation et une vasodilatation de la membrane cellulaire 12,13,14.
Des expériences de patch-clamp sur des cellules musculaires lisses fraîchement isolées ont été menées dans diverses artères, notamment les artères coronaires, cérébrales, rénales et mésentériques15,16. Bien que certaines méthodes utilisent le même type de collagénase pour l’isolement cellulaire, les procédures précises varient. Peu d’études ont résumé de manière exhaustive les méthodes d’isolement des cellules musculaires lisses vasculaires. Par conséquent, cette étude se concentre sur l’isolement frais de cellules musculaires lisses vasculaires primaires de l’artère basilaire du rat et l’enregistrement des courants du canal Kir dans ces cellules à l’aide de la technique de patch clamp de cellules entières, fournissant un protocole détaillé et complet pour les chercheurs dans des domaines connexes.
Protocole
Le protocole animal a été approuvé par le Comité d’éthique du bien-être animal de laboratoire de l’Université de médecine traditionnelle chinoise de Chengdu (enregistrement n° 2024035). Des rats Sprague-Dawley mâles, pesant de 260 à 300 g et âgés de 8 à 10 semaines, ont été utilisés dans cette étude. Les animaux ont reçu de l’eau et de la nourriture (SPF, alimentation expérimentale pour animaux) ad libitum. Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Dissection de l’artère basilaire chez le rat
- Préparation de la solution
- Préparez les solutions comme décrit dans le tableau 1.
- Anesthésier le rat par inhalation de 2 % d’isoflurane. Confirmez l’anesthésie profonde à l’aide d’un pincement des orteils. Si nécessaire, administrez des anesthésiques supplémentaires. Procédez immédiatement à l’ouverture du crâne et exposez le cerveau sur la table d’opération portable.
- Transférez rapidement le cerveau dans une boîte de Pétri contenant du PSS saturé de 95 % d’O2 et de 5 % de CO2 à 4 °C. Assurez-vous que la solution a un pH de 7,40.
- Positionnez le cerveau ventralement vers le haut dans une boîte de Pétri et fixez-le avec des aiguilles. Au microscope optique, localisez l’artère basilaire et retirez soigneusement le tissu environnant à l’aide d’une pince à épiler et de ciseaux autoclavés (voir Figure 1A).
- Insérez un fil de 2 cm de long et d’un diamètre de 25 μm dans l’artère basilaire isolée. Frottez doucement la paroi interne avec le fil pour éliminer efficacement l’endothélium vasculaire.
REMARQUE : L’artère basilaire chez le rat est située dans les sillons basaux du tronc cérébral à la base du cerveau et est formée par la confluence des artères vertébrales gauche et droite2. Pendant le processus d’isolement, manipulez l’artère avec soin pour éviter un étirement ou une compression excessifs qui pourraient entraîner des dommages.
2. Isolement des cellules musculaires lisses
- Préchauffer 1 mL de solution de séparation cellulaire, 1 mL d’hydrolysat enzymatique I et 1 mL d’hydrolysat enzymatique II à 37 °C dans des tubes à essai 1, 2 et 3, respectivement (voir la figure 1B).
- Transférez l’artère basilaire isolée dans le tube à essai 2. Injecter en continu un mélange de 95 % d’O2 et de 5 % de CO2 dans le tube et maintenir le traitement enzymatique pendant 30 min (voir Figure 1C).
- Transférez l’artère basilaire du tube à essai 2 vers le tube à essai 3. Continuer à injecter 95 % d’O2 et 5 % de CO2 dans le tube et maintenir le traitement enzymatique pendant 5 min (voir Figure 1D).
- Ajouter 1 mL de solution de séparation cellulaire à 37 °C du tube à essai 1 dans le tube à essai 3. Poursuivre l’injection de 95 % d’O2 et 5 % de CO2 tout en maintenant le traitement enzymatique pendant 3 min. Triturez la préparation de l’artère basilaire pour libérer les cellules (voir Figure 1E).
- Ajouter une solution de séparation à 4 °C dans le tube à essai 3 pour terminer le processus enzymatique (voir Figure 1F). Centrifuger le mélange à 59 × g pendant 6 min. Jeter le surnageant à l’aide d’une pipette, ajouter à nouveau une solution de séparation à 4 °C (voir figure 1G) et répéter la centrifugation deux fois pour éliminer les enzymes résiduelles.
- Prélever le surnageant à l’aide d’une pipette et conserver 1 mL de suspension cellulaire à 4 °C pendant 6 à 8 h au maximum.
- Prélever 100 μL de suspension cellulaire et les placer dans le bain (voir Figure 1H). Ajoutez 1 ml de liquide extracellulaire dans le bain et laissez les cellules se stabiliser pendant 40 minutes pour se fixer au fond (voir la figure 2).
REMARQUE : Pour les cellules du groupe de traitement (par exemple, BaCl2 ou nitroprussiate de sodium), pré-incuber avec les substances respectives à température ambiante (22-26 °C) pendant 40 min pendant la période de fixation.
3. Enregistrement du courant Kir à l’aide d’une pince patch à cellules entières
- Fabrication de micropipettes
- Allumez l’extracteur de micropipette (reportez-vous à la table des matériaux).
- Placez un tube en verre (diamètre extérieur : 1,5 mm, diamètre intérieur : 1,10 mm, longueur : 10 cm) dans l’extracteur. Sélectionnez Programme 1, cliquez sur Entrer et accédez au Programme 1. Effectuez un test de rampe en cliquant sur Rampe sur le panneau de commande pour mesurer la valeur thermique du tube de verre.
REMARQUE : Modifiez le programme 1 avec les paramètres suivants : Chaleur : Rampe, Traction : 0, Vitesse : 25, Retard : 1, Pression : 500, Mode : Retard, Chauffage de sécurité activé. Le test de rampe doit être effectué lors du changement de filaments ou de types de pipettes en verre. Les micropipettes doivent avoir un diamètre de pointe de ~1-2 μm et une longueur de cône d’environ 5 mm. Des diamètres de pointe plus petits et des cônes plus longs permettent d’augmenter la résistance des pipettes. - Insérez un nouveau tube en verre et sélectionnez Programme 1. Cliquez sur Entrer pour fabriquer la micropipette.
- Enregistrement de Kir Current
- Allumez les périphériques matériels de manière séquentielle : convertisseur numérique-analogique, amplificateur de signal, micromanipulateur, microscope, appareil photo et ordinateur.
- Lancez le logiciel dans l’ordre suivant : caméra, amplificateur de signal et logiciel d’acquisition de données.
REMARQUE : Si un microscope n’est pas équipé d’une caméra, seul le logiciel de l’instrument doit être activé. Assurez-vous que le logiciel est ouvert après l’initialisation du matériel pour permettre une fonctionnalité correcte. - Dans le logiciel d’acquisition de données, sélectionnez Fichier > Définir les noms de fichiers de données pour établir un chemin de stockage de données.
- Modifiez le protocole d’enregistrement des courants Kir comme suit :
- Interface de forme d’onde : Epoch A & D : Type = pas ; Premier niveau = −60 mV ; Niveau delta = 0 mV ; Première durée = 100 ms ; Durée du delta = 0 ms. Époque B : Type = pas ; Premier niveau = −160 mV ; Niveau delta = 0 mV ; Première durée = 1 ms ; Durée du delta = 0 ms. Époque C : Type = rampe ; Premier niveau = 40 mV ; Niveau delta = 20 mV ; Première durée = 500 ms ; Durée delta = 0 ms.
- Interface mode/débit : Délai d’essai = 0 s ; Runs = 1 ; Balayages = 1 ; Durée du balayage = 0,8 s.
- Interface de sortie : Canal #0 ; Niveau de maintien = −60 mV. Enregistrez et nommez le protocole « Protocole Kir ».
REMARQUE : La configuration du protocole est adaptée à des enregistrements en cours spécifiques et peut être réutilisée après la sauvegarde. Assurez-vous que l’interface de sortie correspond au câblage de l’instrument (par exemple, le canal #0).
- Activez la fonction Test de membrane dans le menu Outils du logiciel d’acquisition de données.
- Positionnez la cellule de mesure au centre de la vue de la caméra du microscope.
- Plongez l’embout du fil de référence dans la solution du bain. Remplissez 20 % de la micropipette (fabriquée à l’étape 3.1) avec la solution intracellulaire et fixez-la sur le porte-électrode d’enregistrement.
- Appliquez une pression positive à l’aide d’une seringue, déplacez la pointe de la pipette dans la solution du bain et ajustez le décalage de la pipette sur le logiciel de l’amplificateur de signal pour régler la ligne de base actuelle à 0 pA (voir Figure 3A).
REMARQUE : Utilisez des fils de référence Ag/AgCl. La résistance de la pipette doit être de 4 à 6 MΩ.
- Appliquez une pression positive à l’aide d’une seringue, déplacez la pointe de la pipette dans la solution du bain et ajustez le décalage de la pipette sur le logiciel de l’amplificateur de signal pour régler la ligne de base actuelle à 0 pA (voir Figure 3A).
- Appuyez doucement la pipette contre la membrane cellulaire. Observez une augmentation de la résistance d’étanchéité (Rt) à au moins 1 MΩ (Figure 3B). Supprimez la pression positive et appliquez une pression négative pour établir une résistance élevée avec Rt ≥ 1 GΩ (Figure 3C).
- Réglez la tension de maintien à −60 mV et compensez la capacité de l’électrode à l’aide de Cp Fast et Cp Slow (Figure 3D).
REMARQUE : Si Rt reste supérieur à 1 GΩ, passez à l’étape suivante ; Sinon, remplacez la pile ou la pipette et répétez les étapes 3.2.6 à 3.2.8.
- Réglez la tension de maintien à −60 mV et compensez la capacité de l’électrode à l’aide de Cp Fast et Cp Slow (Figure 3D).
- Appliquez une brève pression négative pour rompre la membrane cellulaire, formant une configuration de cellules entières (Figure 3E). Sélectionnez Whole Cell dans le logiciel de l’amplificateur de signal, cliquez sur Auto pour la compensation de capacité membranaire (Figure 3F), chargez le protocole Kir et lancez l’enregistrement des données. Répéter les étapes 3.2.6 à 3.2.9 pour les cellules traitées.
REMARQUE : Si la résistance série (Ra) est de >30 MΩ, sélectionnez une nouvelle cellule. Si 30 MΩ > Ra > 10 MΩ, appliquez une compensation de résistance série avant l’enregistrement. Ce protocole nécessite une < Ra de 10 MΩ.
- Analyse des données
- Ouvrez le logiciel d’analyse de données et chargez les données enregistrées. Utilisez les curseurs pour analyser les traces actuelles et exporter les données pour le traçage des courbes I-V.
- Créez un signal de forme d’onde de stimulus en sélectionnant Modifier > Créer un signal de forme d’onde de stimulus et confirmez.
- Exportez la trace du protocole Kir en sélectionnant Modifier > Transférer les traces, en spécifiant la région de trace et le signal complets (A0 #0) et en copiant les données pour une analyse plus approfondie.
- Exportez des traces de courant Kir représentatives en sélectionnant Modifier > Transférer les traces, en spécifiant la région de trace et le signal complets (IN 0) et en copiant les données pour générer les tracés de trace actuels.
REMARQUE : Normalisez les données de courant à l’aide de la densité de courant (pA/pF) pour une comparaison précise entre des cellules de tailles différentes. Assurez-vous que la capacité de la membrane (Cm) est enregistrée pendant l’expérience17.
Résultats
Isolement des cellules musculaires lisses artérielles
La première section de la procédure détaille le processus d’isolement des cellules musculaires lisses de l’artère basilaire cérébrale du rat. Ce processus est illustré à la figure 1. La procédure implique une digestion enzymatique et des étapes de séparation cellulaire pour libérer les cellules musculaires lisses de l’artère.
Images représentatives de cellules musculaires lisses isolées
La deuxième section présente un schéma représentatif des cellules musculaires lisses isolées. La figure 2 comprend des images en fond clair de cellules musculaires lisses en forme de fuseau, confirmant leur identité en tant que cellules musculaires lisses en fonction de leur forme caractéristique.
Technique de patch clamp à cellules entières
La troisième section présente l’organigramme de la technique de patch-clamp de cellules entières utilisée pour enregistrer les courants Kir dans des cellules musculaires lisses fraîchement isolées. La figure 3 fournit une illustration détaillée de la configuration de la pince de brassage et des procédures d’établissement d’une configuration de cellule entière.
Enregistrement du courant Kir
La quatrième partie présente le courant Kir représentatif enregistré à partir de cellules musculaires lisses fraîchement isolées à l’aide de la technique du patch-clamp sur cellules entières. La figure 4 montre les courants enregistrés et les effets de différentes interventions sur l’activité du canal Kir. La figure 4A montre le courant Kir typique, démontrant le redressement vers l’intérieur à des tensions négatives, indiquant l’afflux net de K+ dans la cellule. À des tensions positives, le flux de courant net K+ est minime ou nul. La figure 4B illustre l’inhibition des courants Kir par l’inhibiteur spécifique BaCl2. Les résultats montrent que Ba2+ à des concentrations de 100-300 μmol/L bloque efficacement les canaux Kir, confirmant que le courant est Kir. La figure 4C montre l’effet du nitroprussiate de sodium (SNP), un nitrovasodilatateur, sur les courants Kir. Les données montrent que le SNP augmente le courant Kir, suggérant l’implication des canaux Kir dans la vasodilatation induite par le SNP. La figure 4F présente les valeurs de capacité (Cm) dans les groupes de contrôle, BaCl2 et SNP. Les résultats n’indiquent aucune signification statistique des valeurs de Cm dans ces groupes.

Figure 1 : Isolement des cellules musculaires lisses artérielles. (A) La face ventrale du cerveau du rat et l’artère basilaire. (B) Préchauffage de 1 mL de solution de séparation cellulaire, 1 mL d’hydrolysat enzymatique cellulaire I et 1 mL d’hydrolysat enzymatique cellulaire II à 37 °C dans des tubes à essai 1, 2 et 3, respectivement. (C-E) Les trois étapes de séparation des cellules du tissu vasculaire par traitement enzymatique. (F,G) Fin du traitement enzymatique par l’ajout d’une solution de séparation à 4 °C. (H) Liquide cellulaire contenant des cellules musculaires lisses artérielles. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Cellules musculaires lisses artérielles. (A) Vue en fond clair de cellules musculaires lisses vasculaires fraîchement isolées, présentant une morphologie du fuseau. Barre d’échelle : 10 μm. (B) Cellules saines adaptées aux expériences de patch-clamp. Barre d’échelle : 30 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
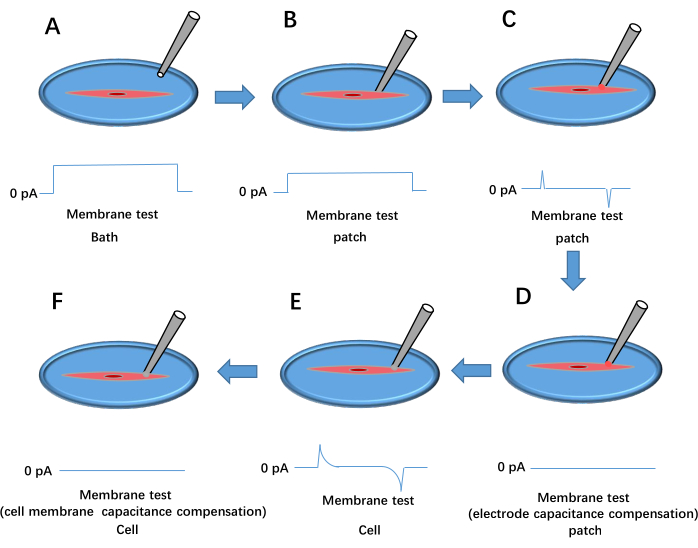
Figure 3 : Processus de formation d’un patch-clamp à cellules entières. Cela montre le résultat de l’essai de membrane d’impulsion de tension. (A) La pipette est laissée tomber dans le bain. (B) L’électrode d’enregistrement est déplacée pour entrer en contact avec la cellule et pressée contre la membrane. (C) Formation d’un joint à haute résistance entre la pipette et la cellule. (D) Compensation de la capacité de l’électrode. (E) Rupture de la membrane cellulaire. (F) Compensation de la capacité de la membrane cellulaire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 4. Courant Kir représentatif dans les cellules musculaires lisses artérielles. (A) Courant Kir normal. (B) Inhibition par l’inhibiteur spécifique BaCl2. (C) Effet du nitroprussiate de sodium (SNP) sur le courant Kir. (D) Courbe I-V des courants Kir. (E) Résultats statistiques. p < 0,05, BaCl2 (n = 6) et SNP (n = 6) par rapport au groupe témoin (n = 6) ; les différences ont été analysées par ANOVA bilatérale à deux facteurs. (F) Cm (pF), p > 0,05, BaCl2 (n = 6) et SNP (n = 6) par rapport au groupe témoin (n = 6) ; Les différences ont été analysées par test T. Protocole de stimulation : Maintien à -60 mV avec stimulation sur rampe de -160 mV à +40 mV pendant 500 ms. Contrôle, BaCl2 et SNP ont été réalisés séparément dans différents groupes de cellules. Les composés ont été ajoutés 40 minutes avant l’enregistrement et pouvaient rester dans le bain jusqu’à 20 minutes pendant l’enregistrement. SNP : nitroprussiate de sodium. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Type de solution | Composition de la solution | Points clés | ||
| Solution saline physiologique (PSS, mmol/L) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-glucose, 5 HEPES | Saturez la solution et faites-la bouillonner avec un gaz mixte composé de 95 % d’O2 et de 5 % de CO2 avant utilisation. Ensuite, ajustez le pH de la solution à 7,4 à l’aide de NaOH. Température de fabrication et de conservation à température ambiante et 4°C, respectivement | ||
| Solution de séparation cellulaire (mmol/L) | 118 NaCl, 4,7 KCl, 2,5 CaCl2, 1,2 KH2PO4, 1,2 MgCl2, 25 NaHCO3, 11 D-glucose, 5 HEPES | Identique à la solution saline physiologique | ||
| Hydrolysat enzymatique cellulaire I | De l’albumine sérique bovine (BSA) : 1 mg/mL, du dithiothréitol (DTT) : 1 mg/mL et de la papaïne : 0,5 mg/mL ont été ajoutés à la solution de séparation cellulaire | Préparez immédiatement la solution pour l’utilisation. Température pour le faire à température ambiante | ||
| Hydrolysat enzymatique cellulaire II | BSA : 1 mg/mL, la collagénase H : 0,3 mg/mL et la collagénase F : 0,7 mg/mL ont été ajoutées à la solution de séparation cellulaire | Identique à l’hydrolysat enzymatique Cell I | ||
| Solution de bain de courant Kir (mmol/L) | 12 NaCl, 130 KCl, 0,4 KH2PO4 , 0,3 NaH2PO4, 2 NaHCO3 , 1 MgCl2 , 1,8 CaCl2 , 10 HEPES, 5,5 glucose | Ajusté à un pH de 7,4 à l’aide de NaOH et à une osmolarité de 310 mOsm. Température de fabrication et de conservation à température ambiante et 4°C, respectivement | ||
| Solution de remplissage de pipette à courant Kir (mmol/L) | 100 D-gluconate de potassium, 30 KCl, 1 MgCl2, 1 EGTA, 15 HEPES, 1 Na2-ATP | Ajusté à un pH de 7,2 à l’aide de KOH et d’une osmolarité de 300 mOsm. Température de fabrication et de conservation à température ambiante et -20°C, respectivement | ||
Tableau 1 : Précautions de composition et de préparation pour diverses solutions.
Discussion
L’enregistrement de cellules entières à l’aide de cellules fraîchement isolées remonte au début des années 198018, et l’enregistrement des courants de canal à partir de cellules musculaires lisses basilaires de rongeurs est devenu largement pratiqué dans les années 199019. Avec les progrès technologiques, les chercheurs se concentrent de plus en plus sur les résultats obtenus grâce à ces technologies. Cependant, l’attention accordée à la mise à jour et à la synthèse des méthodes techniques a progressivement diminué. Cet article présente une méthode détaillée pour la séparation récente des cellules musculaires lisses vasculaires et l’utilisation ultérieure de ces cellules pour enregistrer les courants Kir, dans le but d’aider les chercheurs à comprendre le processus méthodologique standard.
Le muscle lisse vasculaire joue un rôle crucial dans la régulation de la tension artérielle. De nombreuses méthodes de séparation des cellules musculaires lisses vasculaires ont été rapportées 20,21,22,23,24,25, dont la plupart impliquent l’hydrolyse enzymatique. Cependant, les types et les étapes des enzymes varient d’une étude à l’autre, et différentes conditions expérimentales peuvent influencer l’efficacité enzymatique. Cet article présente une méthode d’hydrolyse enzymatique, avec de légères modifications des types d’enzymes et des procédures par rapport aux études précédentes. Il fournit un protocole détaillé pour la séparation aiguë des cellules musculaires lisses vasculaires primaires.
Les étapes clés de ce protocole sont les étapes 2.2 à 2.4, car la réussite de ces étapes a un impact direct sur la qualité des cellules isolées. Les cellules musculaires lisses vasculaires isolées conviennent à diverses applications, notamment les expériences de patch-clamp pour étudier les canaux ioniques, l’extraction d’ARN et de protéines pour les études moléculaires et l’immunofluorescence pour étudier l’expression des protéines sur les cellules. Par conséquent, cette méthode offre une approche polyvalente pour les chercheurs concernés, offrant davantage d’options expérimentales.
La conductance potassique (K+) sur la membrane des cellules musculaires lisses artérielles joue un rôle crucial dans la régulation du potentiel membranaire, de la tension vasculaire et, en fin de compte, du flux sanguin local26,27. Le canal Kir, un type de canal K+ présent dans les cellules musculaires lisses artérielles, aide à stabiliser le potentiel membranaire et agit comme un amplificateur électrique pour les autres canaux K+. Lorsqu’il est activé, le canal Kir induit une hyperpolarisation membranaire et favorise la dilatation vasculaire28. La technologie du patch clamp a longtemps été considérée comme l’étalon-or pour la recherche sur les canaux ioniques29,30, le patch clamp à cellules entières étant la méthode la plus couramment utilisée31. Bien que cette technique exige un haut niveau de compétence de l’opérateur, la compétence dépend en fin de compte du respect de protocoles standardisés.
Cette étude présente une procédure détaillée et standardisée pour l’enregistrement des courants Kir à partir de cellules musculaires lisses vasculaires fraîchement isolées à l’aide d’un patch clamp de cellules entières, fournissant une référence précieuse pour les chercheurs. Les étapes critiques du protocole sont les étapes 3.2.7 à 3.2.9, car la réussite de ces étapes détermine si les enregistrements ultérieurs du courant Kir seront réussis. De plus, la sélection des fluides intracellulaires et de bain a un impact significatif sur le courant enregistré. Par exemple, l’utilisation d’un potassium extracellulaire élevé dans cette étude visait à activer complètement le canal potassique redresseur vers l’intérieur. Par conséquent, le succès de l’expérience dépend d’une attention particulière portée à chaque détail opérationnel.
Bien que les cellules fraîchement isolées offrent plus de pertinence physiologique que les lignées cellulaires, il existe des limites inhérentes. Il s’agit notamment de l’influence de la température ambiante sur la séparation enzymatique, des temps de digestion variables pour des vaisseaux sanguins de différents diamètres et de l’instabilité de l’environnement natif des cellules. Par conséquent, les temps de digestion enzymatique doivent souvent être ajustés. La technologie des patchs pose également des défis techniques, en particulier dans les étapes d’étanchéité et de rupture de la membrane, qui nécessitent une grande compétence de l’opérateur. L’état de la cellule a un impact direct sur le succès de l’ensemble de la procédure de patch-clamp. Par conséquent, il est essentiel d’accorder une attention particulière à ces limites pour assurer le succès de l’expérience.
Ba2+ a été largement utilisé comme bloqueur spécifique pour étudier le rôle des canaux Kir dans les cellules et les tissus. À des concentrations inférieures à 100 μmol/L, Ba2+ bloque sélectivement les canaux Kir, tandis que des concentrations aussi élevées que 300 μmol/L peuvent les bloquer complètement32. Dans cette étude, BaCl2 a été utilisé pour vérifier le courant du canal Kir.
Les canaux Kir sont régulés à la fois par les vasoconstricteurs et les vasodilatateurs. Le SNP (nitroprussiate de sodium), un nitrovasodilatateur, a été utilisé dans cette étude pour explorer cela. Le SNP est métabolisé dans les muscles lisses vasculaires pour produire de l’oxyde nitrique, ce qui réduit la résistance vasculaire systémique en agissant à la fois sur les muscles lisses veineux et artériels, ce qui peut améliorer le débit cardiaque. En raison de son apparition rapide et de sa courte demi-vie, le SNP est couramment utilisé comme agent de première intention pour la prévention et le traitement de l’hypertension33. L’étude a observé que le SNP augmentait le courant Kir dans les cellules musculaires lisses de l’artère basilaire, suggérant l’activation des canaux Kir pendant la vasodilatation induite par le SNP.
Une limite des enregistrements actuels est qu’ils ont été obtenus à partir de différents groupes de cellules, et les comparaisons ont été faites en analysant les densités de courant entre les groupes. Une approche plus raffinée consisterait à enregistrer les réponses des mêmes cellules avant et après l’application des composés, ce qui minimiserait l’impact de la variabilité d’une cellule à l’autre sur l’interprétation des données.
En conclusion, cet article fournit un protocole détaillé pour l’isolement aigu des cellules musculaires lisses de l’artère basilaire du rat et l’utilisation d’une pince patch à cellules entières pour étudier les courants de Kir. Ce protocole est polyvalent et peut être appliqué aux cellules musculaires lisses d’autres artères, telles que les artères coronaires, mésentériques et rénales. Cependant, le temps de séparation enzymatique peut devoir être ajusté en fonction du type d’artère. De plus, des cellules musculaires lisses artérielles isolées peuvent être utilisées dans une variété d’autres techniques expérimentales.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par le programme de talents spéciaux de l’Université de médecine traditionnelle chinoise de Chengdu pour le « Plan de promotion de la recherche sur les chercheurs et les talents disciplinaires de Xinglin » (33002324) et le projet clé de recherche et de développement pour l’introduction de talents scientifiques et technologiques de haut niveau dans la ville de Luliang (2022RC28).
matériels
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma, USA | B2064 | |
| Barium chloride | Macklin Biochemical Co.,Ltd.,Shanghai, China | B861682 | |
| CaCl2 | Sangon Biotech Co., Ltd., Shanghai, China | A501330 | |
| Camera | Hamamatsu, Japan | C11440 | |
| Camera software | Image J, USA | Micro-manager 2.0.0-gammal | |
| Collagenase F | Sigma, USA | C7926 | |
| Collagenase H | Sigma, USA | C8051 | |
| Computer | Lenovo, China | ~ | |
| Data acquisition software | Molecular Devices, USA | Clampex 10.4 | |
| Data analysis software | Axon, USA | clampfit 10.4 | |
| D-glucose | Sangon Biotech Co., Ltd., Shanghai, China | A610219 | |
| Digital-analog converter | Molecular Devices, USA | Axon digidata 1550B | |
| Dithiothreitol | Sigma, USA | D0632 | |
| Drawing software | San Diego, California, USA | GraphPad | |
| EGTA | Sangon Biotech Co., Ltd., Shanghai, China | A600077 | |
| Glass tube | DL Naturegene Life Sciences.USA | B150-86-10 | |
| HEPES | Xiya Reagent Co., Ltd., Shandong, China | S3872 | |
| KCl | Sangon Biotech Co., Ltd., Shanghai, China | A100395 | |
| KH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A100781 | |
| MgCl2·6H2O | Sangon Biotech Co., Ltd., Shanghai, China | A100288 | |
| Micromanipulator | sutter, USA | MP285A | |
| Micropipette puller | sutter, USA | P1000 | |
| Microscope | Olympus, Japan | IX73 | |
| Na2-ATP | Sigma, USA | A26209 | |
| Na2HPO4 | Sangon Biotech Co., Ltd., Shanghai, China | A610404 | |
| NaCl | Sangon Biotech Co., Ltd., Shanghai, China | A100241 | |
| NaH2PO4 | Sangon Biotech Co., Ltd., Shanghai, China | A600878 | |
| NaHCO3 | Sangon Biotech Co., Ltd., Shanghai, China | A100865 | |
| NaOH | Sangon Biotech Co., Ltd., Shanghai, China | A100173 | |
| Papain | Sigma, USA | P4762 | |
| Potassium-D-gluconate | Sangon Biotech Co., Ltd., Shanghai, China | A507810 | |
| Signal amplifier | Molecular Devices, USA | Axon MutiClamp 700B | |
| Signal amplifier software | Molecular Devices, USA | MultiClamp Commander software | |
| Sodium nitroprusside | Sangon Biotech Co., Ltd., Shanghai, China | A600867 | |
| Statistical analysis software | San Diego, California, USA | GraphPad |
Références
- Goins, R. T., et al. Lower body functioning and correlates among older american indians: The cerebrovascular disease and its consequences in american indians study. BMC Geriatrics. 18 (1), 1-9 (2018).
- Mattle, H. P., Arnold, M., Lindsberg, P. J., Schonewille, W. J., Schroth, G. Basilar artery occlusion. Lancet Neurol. 10 (11), 1002-1014 (2011).
- Morales, A., Parry, P. V., Jadhav, A., Jovin, T. A novel route of revascularization in basilar artery occlusion and review of the literature. BMJ Case Reports. , 1-6 (2015).
- Ghantous, C. M., Azrak, Z., Rahman, F. A., Itani, H. A., Zeidan, A. Assessment of basilar artery reactivity in stroke and subarachnoid hemorrhage using wire myograph. Methods Mol Biol. 34, 625-643 (2016).
- Tykocki, N. R., Boerman, E. M., Jackson, W. F. Smooth muscle ion channels and regulation of vascular tone in resistance arteries and arterioles. Compr Physiol. 7 (2), 485-581 (2017).
- Wu, B. -. N., et al. Hyposmotic challenge inhibits inward rectifying K+ channels in cerebral arterial smooth muscle cells. Am J Physiol Heart Circ Physiol. 292 (2), H1085-H1094 (2007).
- Jackson, W. F. Ion channels and vascular. Hypertension. 35 (2), 173-178 (2000).
- Jackson, W. F. Potassium channels in the peripheral microcirculation. Microcirculation. 12 (1), 113-127 (2005).
- Dogan, M. F., Yildiz, O., Arslan, S. O., Ulusoy, K. G. Potassium channels in vascular smooth muscle: A pathophysiological and pharmacological perspective. Fundam Clin Pharmacol. 33 (5), 504-523 (2019).
- Daghbouche-Rubio, N., López-López, J. R., Pérez-García, M. T., Cidad, P. Vascular smooth muscle ion channels in essential hypertension. Front Physiol. 13, 1-9 (2022).
- Sahranavard, T., et al. The role of potassium in atherosclerosis. Eur J Clin Invest. 51 (3), 1-19 (2020).
- Crecelius, A. R., Dinenno, F. A. Vascular regulation via kir channels and Na+/K+-ATPase. Channels. 9 (4), 171-172 (2015).
- Liu, Y., et al. Prostanoids contribute to regulation of inwardly rectifying K+ channels in intrarenal arterial smooth muscle cells. Life Sci. 250, 1-9 (2020).
- Li, W., et al. Luteolin-induced coronary arterial relaxation involves activation of the myocyte voltage-gated K+ channels and inward rectifier K+ channels. Life Sci. 221, 233-240 (2019).
- Guo, P., et al. Coronary hypercontractility to acidosis owes to the greater activity of tmem16a/ano1 in the arterial smooth muscle cells. Biomed Pharmacother. 139, 1-14 (2021).
- Jing, Y., et al. Apigenin relaxes rat intrarenal arteries, depresses Ca2+-activated Cl− currents and augments voltage-dependent K+ currents of the arterial smooth muscle cells. Biomed Pharmacother. 115, 1-9 (2019).
- Manz, K. M., Siemann, J. K., Mcmahon, D. G., Grueter, B. A. Patch-clamp and multi-electrode array electrophysiological analysis in acute mouse brain slices. STAR Protocols. 2 (2), 1-30 (2021).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Langton, P. D., Standen, N. B. Calcium currents elicited by voltage steps and steady voltages in myocytes isolated from the rat basilar artery. J Physiol. 469, 535-548 (1993).
- Kittiwoot, T. -. O., et al. Isolation of intrapulmonary artery and smooth muscle cells to investigate vascular responses. J Vis Exp. (184), e63686 (2022).
- Trask, A. J., Lucchesi, P. A., Mccallinhart, P. E., Zhang, X., Husarek, K. E. Isolation of murine coronary vascular smooth muscle cells. J Vis Exp. 111, e53983 (2016).
- Ribeiro, M. P., Relvas, R., Chiquita, S., Correia, I. J. Isolation of human umbilical arterial smooth muscle cells (HUASMC). J Vis Exp. (41), e1940 (2010).
- Kim, H. J., et al. Increased inward rectifier K+ current of coronary artery smooth muscle cells in spontaneously hypertensive rats; partial compensation of the attenuated endothelium-dependent relaxation via Ca2+-activated K+ channels. Clin Exp Pharmacol Physiol. 47 (1), 38-48 (2019).
- Qiao, Y., et al. Kir2.1 regulates rat smooth muscle cell proliferation, migration, and post-injury carotid neointimal formation. Biochem Biophys Res Commun. 477 (4), 774-780 (2016).
- Tykocki, N. R., Bonev, A. D., Longden, T. A., Heppner, T. J., Nelson, M. T. Inhibition of vascular smooth muscle inward-rectifier K+channels restores myogenic tone in mouse urinary bladder arterioles. Am J Physiol Renal Physiol. 312 (5), F836-F847 (2017).
- Ko, E. A., Han, J., Jung, I. D., Park, W. S. Physiological roles of K+ channels in vascular smooth muscle cells. Smooth Muscle Res. 44 (2), 65-81 (2008).
- Standen, N. B., Quayle, J. M. K+ channel modulation in arterial smooth muscle. Acta Physiol Scand. 164, 549-557 (1998).
- Smith, P. D., et al. Kir channels function as electrical amplifiers in rat vascular smooth muscle. J Physiol. 586 (4), 1147-1160 (2008).
- Kanda, H., Tonomura, S., Dai, Y., Gu, J. G. Protocol for pressure-clamped patch-clamp recording at the node of Ranvier of rat myelinated nerves. STAR Protocols. 2 (1), 1-12 (2021).
- Witchel, H. J., Milnes, J. T., Mitcheson, J. S., Hancox, J. C. Troubleshooting problems with in vitro screening of drugs for qt interval prolongation using HERG K+ channels expressed in mammalian cell lines and Xenopus oocytes. J Pharmacol Toxicol Methods. 48 (2), 65-80 (2002).
- Kodandaramaiah, S. B., Franzesi, G. T., Chow, B. Y., Boyden, E. S., Forest, C. R. Automated whole-cell patch-clamp electrophysiology of neurons in vivo. Nat Methods. 9 (6), 585-587 (2012).
- Park, W. S., Han, J., Earm, Y. E. Physiological role of inward rectifier K+ channels in vascular smooth muscle cells. Pflugers Arch. 457 (1), 137-147 (2008).
- Thomas, C., Svehla, L., Moffett, B. S. Sodium nitroprusside induced cyanide toxicity in pediatric patients. Expert Opin Drug Saf. 8 (5), 599-602 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon